UJI ANGKA KAPANG/KHAMIR (AKK), ANGKA LEMPENG TOTAL (ALT), DAN IDENTIFIKASI Escherichia coli DALAM JAMU
UYUP-UYUP DARI PENJUAL JAMU RACIK“X” DI YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Theresia Nurida Ambarwulan
NIM : 108114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI ANGKA KAPANG/KHAMIR (AKK), ANGKA LEMPENG TOTAL (ALT), DAN IDENTIFIKASIEscherichia coli DALAM JAMU
UYUP-UYUP DARI PENJUAL JAMU RACIK“X” DI YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Theresia Nurida Ambarwulan NIM : 108114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
iii
iv
HALAMAN PERSEMBAHAN
J a dila h k ua t be t a pa pun pa ra hnya k e sa la ha n,
be t a pa pun sulit nya pe pe ra nga n,
be t a pa pun la m a nya pe na nt ia n,
ja nga n pa t a h se m a nga t , t e rusla h be rjua ng!
Esok pa st i t e rde nga r sora k nya nyia n...
-Babcock
Kupersembahkan karyaku ini kepada:
Tuhan Yesus Kristus dan Bunda Maria
Ayahku tercinta Matius Tukiran Mangku Sutrisno
Ibuku tercinta Yasinta Daryati
Suamiku tercinta Eko Ari Wibowo
Malaikat kecilku Viola Natasya Wibowo
Kakak Q tercinta Christina Febriana Mayasari
Adikku tercinta Filipus Rosarianto Pamungkas
Terima kasih atas segala doa, dukungan, kepercayaan serta waktu
v
vi
vii
PRAKATA
Rasa syukur kami panjatkan kepada Tuhan Yang Maha Kuasa atas seluruh
berkat dan anugrah serta kehendakNya penulis dapat menyelesaikan penulisan
skripsi yang berjudul “Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total
(ALT), dan Identifikasi Escherichia coli dalam Jamu Uyup-uyup dari Penjual
Jamu Racik “X” Di Yogyakarta” dengan baik dan tepat waktu. Penulisan skripsi
ini dimaksudkan untuk memenuhi salah satu syarat memperoleh gelar Sarjana
Farmasi di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa penulisan skripsi ini bukanlah suatu hal yang
mudah tentunya banyak kendala yang dihadapi. Berkat segala bantuan dan
dukungan yang diberikan dari berbagai pihak, skripsi ini dapat diselesaikan.
Penulis ingin menyampaikan ucapan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Yohanes Dwiatmaka, S. Si., selaku dosen pembimbing yang telah
berkenan membimbing, mengarahkan serta memberikan saran kepada
penulis dalam menyelesaikan skripsi ini.
3. Maria Dwi Budi Jumpowati, S. Si., atas bantuannya yang telah berkenan
membimbing, mengarahkan serta memberikan saran kepada penulis dalam
menyelesaikan skripsi ini.
4. Dr. Erna Tri Wulandari, M.Si.,Apt selaku dosen penguji atas kritik dan
viii
5. Damiana Sapta Candrasari, M.Sc. selaku dosen penguji atas kritik dan
saran yang telah diberikan sehingga skripsi ini menjadi lebih baik.
6. Keluargaku tercinta atas kasih sayang, doa serta dukungannya baik moril
maupun materil.
7. Sahabat-sahabatku angkatan 2010, khusunya: Anas, Oric, Tika, Ribka atas
segala saran, kebersamaan, keceriaan dan dukungannya selama ini.
8. Seluruh staf serta karyawan dari Balai Laboratorium Kesehatan Daerah
Istimewa Yogyakarta atas bantuan serta kerjasamanya dalam
menyelesaikan skripsi ini.
9. Pihak-pihak lain yang turut membantu penulis namun tidak dapat
disebutkan satu persatu.
Dengan segala kerendahan hati penulis menyadari bahwa tidak skripsi ini
jauh dari sempurna karena keterbatasan pikiran, waktu dan tenaga. Oleh karena
itu, penulis sangat mengharapkan kritik dan saran yang membangun agar skripsi
ini lebih mendekati sempurna.
Penulis berharap bahwa skripsi ini dapat bermanfaat bagi semua pihak,
baik mahasiswa, lingkungan akademisi, masyarakat, serta dapat memberikan
sumbangan kecil bagi perkembangan ilmu pengetahuan khususnya di bidang
kefarmasian.
ix
INTISARI
Jamu uyup-uyup merupakan jamu yang berkhasiat untuk melancarkan produksi Air Susu Ibu (ASI) yang dikonsumsi oleh ibu-ibu menyusui. Adanya Angka Kapang/Khamir (AKK) dan Angka Lempeng Total (ALT) yang melebihi batas yang ditentukan oleh KEPMENKES nomor 661 tahun 1994 akan membahayakan kesehatan ibu serta bayinya. Escherichia coli merupakan bakteri yang hidup di tanah dan air. Keberadaannya dapat mengkontaminasi jamu uyup-uyup karena bahan baku yang digunakan berupa rimpang yang berasal dari tanah.
Penelitian ini bertujuan untuk mengetahui AKK, ALT dan mengidentifikasi
E.coli dalam jamu uyup-uyup yang diproduksi penjual jamu racik “X” di
Yogyakarta.
Penelitian ini merupakan penelitian non-eksperimental dengan rancangan deskriptif exploratif. Penelitian yang dilakukan meliputi penentuan dan pemilihan tempat pengambilan sampel, pangambilan sampel jamu uyup-uyup, pengujian AKK, pengujian ALT, identifikasi bakteriE.coliserta analisis hasil.
Hasil pengujian yang dilakukan pada jamu uyup-uyup dari penjual jamu
racik “X” di Yogyakarta diperoleh nilai AKK sebesar 7,5 x 104CFU/ml sampai dengan 4 x 105CFU/ml. Nilai ALT sebesar 8 x 104CFU/ml sampai dengan 2,4 x 107 CFU/ml. Hasil uji identifikasi menunjukkan bahwa pada jamu uyup-uyup telah tercemar oleh bakteriE.coli.
x
ABSTRACT
Jamu uyup-uyup is believed to expedite the production of breast milk (ASI) consumed by breastfeeding mothers. The existence of the Number of Mold/ Yeast (AKK), Total Plate Count (ALT) exceeding the limit specified by KEPMENKES no 661 of 1994 would endanger the health of the mother and her baby. Escherichia coli is a bacteria that lives in soil and water. Its presence can contaminate jamu uyup-uyup because that raw materials used in the form or rhizomes from the soil.
The purpose of research were to determine the AKK, ALT and identify the
E.coliinjamu uyup-uyupthat produced byjamu racikseller “X” in Yogyakarta.
This research was non-experimental research with the framework of descriptive explorative. Research was conducted on the determination and selection of the sampling, sampling ofjamu uyup-uyup, testing of AKK, testing of ALT,E.colibacteria identification and analysis of result.
Results of tests performed on jamu uyup-uyup that produced by jamu racikseller “X” in Yogyakarta AKK values as 7,5 x 104 CFU / mL up to 4 x 105. ALT values as 1 x 106CFU / mL up to 2,4 x 107CFU / mL. The test results show that the identification of jamu uyup-uyup been contaminated by the E.coli
bacteria.
xii
BAB II. TINJAUAN PUSTAKA... 7
A. Obat Tradisional... 7
B. Jamu Uyup-uyup... 8
C. Angka Kapang/Khamir (AKK)... 11
D. Angka Lempeng Total (ALT)... 13
E. Media... 17
F. Escherichia coli... 19
G. IdentifikasiEscherichia coli... 23
H. Landasan Teori... 26
I. Hipotesis... 27
BAB III. METODE PENELITIAN... 28
A. Jenis dan Rancangan Penelitian... 28
B. Variabel Penelitian dan Definisi Operasional... 28
1. Variabel Utama... 28
1. Pemilihan Sampel dan Pengambilan Sampel... 30
2. Penangan Wadah/Kemasan Penyiapan Sampel... 31
3. Tahap Pra-Pengkayaan... 31
xiii
5. Uji ALT... 33
6. Uji IdentifikasiEscherichia coli... 34
F. Analisis Hasil... 38
1. Uji AKK... 38
2. Uji ALT... 39
3. IdentifikasiEscherichia coli... 42
BAB VI. HASIL DAN PEMBAHASAN... 43
A. Penentuan dan Pemilihan Sampel... 43
B. Pengambilan Sampel... 43
C. Homogenisasi dan Pengenceran Sampel... 44
D. Uji AKK... 45
E. Uji ALT... 48
F. IdentifikasiEscherichia coli... 50
1. Tahap Pengkayaan... 50
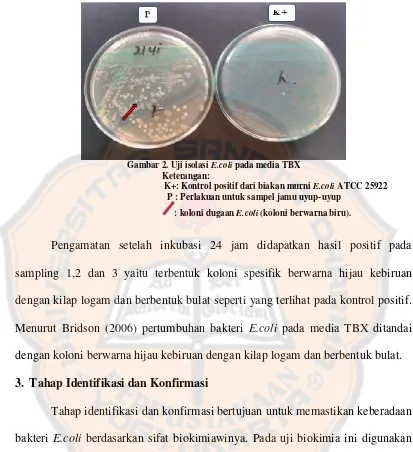
2. Tahap Isolasi... 53
3. Tahap Identifikasi dan Konfirmasi... 54
4. Pengecatan Gram... 63
BAB V. KESIMPULAN DAN SARAN... 67
A. Kesimpulan... 67
B. Saran... 67
DAFTAR PUSTAKA... 68
LAMPIRAN... 72
xiv
DAFTAR TABEL
Tabel I. Uji fermentasi karbohidrat dan uji IMViC pada identifikasi
E.coli(Holtet all., 2000)... 42
Tabel II. Nilai AKK sampel jamu uyup-uyup pada inkubasi hari
ke-5... 46
Tabel III. Nilai ALT sampel jamu uyup-uyup pada inkubasi 48 jam... 49
Tabel IV. Hasil uji biokimia dan pengecatan gram dalam sampel jamu
xv
DAFTAR GAMBAR
Gambar 1. Uji pengkayaanE.colipada media ECB... 52
Gambar 2. Uji isolasiE.colipada media TBX... 54
Gambar 3. Uji fermentasi karbohidrat pada sampel jamu uyup-uyup... 56
Gambar 4. Uji motilitas bakteri terlihat adanya pertumbuhan di sekitar tusukan dan permukaan media sebelum penambahan reagen Kovac’s... Gambar 5. Uji Indol pada sampel jamu uyup-uyup... 60
Gambar 6. Uji metil merah pada sampel jamu uyup-uyup... 61
Gambar 7. Uji Voges-Voskauer pada sampel jamu uyup-uyup... 62
Gambar 8. Uji sitrat pada sampel jamu uyup-uyup... 63
Gambar 9. Hasil pengecatan gram berwarna merah muda (gram negatif) dan berbentuk batang... 65
xvi
DAFTAR LAMPIRAN
Lampiran 1. Surat ijin penelitian di Balai Laboratorium Kesehatan
Yogyakarta... 73
Lampiran 2. Hasil uji MPN E.coli dari Balai Laboratorium Kesehatan
Yogyakarta... 74
Lampiran 3. Uji AKK sampel jamu uyup-uyup pada inkubasi hari ke-5... 75
Lampiran 4. Perhitungan AKK sampel jamu uyup-uyup pada inkubasi
hari ke-5... 76
Lampiran 5. Uji ALT sampel jamu uyup-uyup pada inkubasi 48 jam... 79
Lampiran 6. Perhitungan ALT sampel jamu uyup-uyup pada inkubasi
48 jam... 80
Lampiran 7. Pengambilan sampel jamu uyup-uyup... 83
Lampiran 8. Uji AKK sampel jamu uyup-uyup sampling I pada inkubasi
hari ke-5... 84
Lampiran 9. Uji AKK sampel jamu uyup-uyup sampling II pada inkubasi
hari ke-5... 85
Lampiran 10. Uji AKK sampel jamu uyup-uyup sampling III pada inkubasi
xvii
Lampiran 11. Uji ALT sampel jamu uyup-uyup sampling I pada inkubasi
48 jam... 87
Lampiran 12. Uji ALT sampel jamu uyup-uyup sampling II pada inkubasi 48 jam... 88
Lampiran 13. Uji ALT sampel jamu uyup-uyup sampling III pada inkubasi 48 jam... 89
Lampiran 14. Uji tahap pengkayaan sampel jamu uyup-uyup inkubasi 24 jam... 90
Lampiran 15. Uji tahap isolasi sampel jamu uyup-uyup pada inkubasi 24 jam... 91
Lampiran 16. Uji fermentasi karbohidrat pada sampel jamu uyup-uyup... 92
Lampiran 17. Uji indol pada sampel jamu uyup-uyup... 93
Lampiran 18. Uji metil merah pada sampel jamu uyup-uyup... 94
Lampiran 19. Uji Voges-Proskauer pada sampel jamu uyup-uyup... 95
Lampiran 20. Uji sitrat pada sampel jamu uyup-uyup... 96
1
BAB 1 PENGANTAR A. Latar Belakang
Obat Bahan Alam Indonesia dikelompokkan menjadi tiga jenis yaitu jamu,
obat herbal terstandar dan fitofarmaka (BPOM RI, 2004). Jamu merupakan obat
asli Indonesia yang harus tetap dilestarikan dengan fokus utama pada aspek
keamanan (safety), mutu, dan khasiat jamu sebagai obat tradisional (Wasito,
2011). Menurut PERMENKES RI No. 003/MENKES/PER/I/2010 Jamu adalah
obat tradisional Indonesia. Jamu harus memenuhi kriteria aman sesuai dengan
persyaratan yang khusus untuk itu, klaim khasiat dibuktikan berdasarkan data
empiris yang ada, dan memenuhi persyaratan mutu khusus untuk itu. Jamu sudah
menjadi budaya masyarakat Indonesia dibuktikan berdasarkan data hasil Riset
Kesehatan Dasar 2010, hampir setengah (49, 53%) penduduk Indonesia berusia 15
tahun ke atas, mengkonsumsi jamu. Sekitar lima persen (4,36%) mengkonsumsi
jamu setiap hari, sedangkan sisanya (45,17%) mengkonsumsi jamu sesekali
(Departemen Kesehatan Republik Indonesia, 2011).
Salah satu jamu yang banyak digemari masyarakat adalah jamu racikan.
Alasan utama masyarakat lebih memilih jamu daripada obat sintetik adalah karena
jamu mempunyai efek samping yang jauh lebih kecil, harganya yang terjangkau,
bahan baku jamu lebih mudah ditemukan, serta dari beberapa hasil penelitian
yang sudah dilakukan ternyata jamu memang memiliki khasiat pengobatan secara
Asi sangat bermanfaat bagi pertumbuhan bayi diantaranya adalah sebagai
nutrisi bagi bayi, meningkatkan daya tahan tubuh bayi dari berbagai penyakit,
meningkatkan kecerdasan, serta menyusui dapat meningkatkan jalinan kasih
sayang antara ibu dan anak (Roesli, 2000). Produksi ASI yang cukup mempunyai
peranan penting dalam tumbuh kembang bagi bayi. Jamu uyup-uyup atau jamu
gepyokan adalah jamu yang dipilih mereka karena dipercaya berkhasiat sebagai
pelancar ASI bagi ibu yang sedang menyusui dan tersedia banyak di pasar-pasar
tradisional. Bahan baku yang digunakan dalam pembuatan jamu uyup-uyup
bervariasi, namun secara umum terdiri dari empon-empon yaitu kencur, jahe,
bangle, laos, kunyit, temulawak, puyang, dan temu giring (Suharmiati, 2003).
Salah satu Grand Strategi Pengembangan Jamu yang dikeluarkan oleh
Kementrian Kesehatan Republik Indonesia adalah meningkatkan keamanan, mutu
dan efikasi jamu. Usaha jamu racikan merupakan usaha yang tidak wajib memiliki
ijin edar, oleh karena itu keamanan serta jaminan mutu kualitas jamu racikan
masih cukup rendah. Salah satu parameter jaminan keamanan dan mutu dari jamu
yang diatur dalam KEPMENKES no 661 tahun 1994 adalah tidak boleh
mengandung mikroba patogen, Angka Kapang/Khamir (AKK) tidak lebih dari 103
dan Angka Lempeng Total (ALT) tidak lebih dari 104.
Penelitian ini bertujuan untuk mengetahui nilai AKK, ALT, dan
mengidentifikasi adanya bakteri patogen E.coli dalam jamu uyup-uyup dari
penjual jamu racik “X” di kota Yogyakarta. Adanya AKK yang melebihi batas
pada jamu uyup-uyup ini dapat membahayakan bagi ibu yang sedang menyusui
uyup-uyup adalah Aspergilus flavus, Candida albicans dan Cryptococcus
neoformans. Ketiga mikroba patogen ini ditemukan di tanah dan air. Aspergilus
flavusmemproduksi mikotoksin yaitu aflatoksin. Salah satu aflatoksin yang paling
berbahaya yaitu aflatoksin B1 yang dapat disekresikan melalui ASI dan bersifat
karsinogenik karena dapat menyebabkan hepatotoksik dan kanker hati
(Abdulrazaq et al., 2003). Bahan baku yang digunakan disimpan di bawah
kandang burung yang kemungkinan besar terkontaminasi khamir Cryptococcus
neoformans yang dapat menyebabkan infeksi paru-paru karena Cryptococcus
neoformans juga ditemukan pada kotoran burung. Sementara itu, Candida
albicansdapat menyebabkan kandidiasis pada mulut yaitu sariawan terutama pada
bayi serta dapat menyebabkan vulvovaginitis atau keputihan pada wanita
mengingat jamu uyup-uyup dikonsumsi oleh ibu-ibu (Jawetz, 1996).
Adanya ALT yang melebihi batas juga dapat membahayakan ibu dan bayi,
karena dalam ALT yang tinggi kemungkinan terdapat bakteri patogen diantaranya
adalahSalmonella, E.coli, dan Shigelladan Pseudomonas aeruginosa yang dapat
menyebabkan demam dan diare berat pada ibu terutama bayinya karena sistem
imun bayi yang belum sempurna dan rentan terkena penyakit (Radji, 2011;
Jawetz, 1996).
Identifikasi E.coli dipilih karena bakteri ini merupakan indikator dari
sanitasi yang buruk pada saat pembuatan jamu. Selain itu, menurut Radji (2011)
bakteri E.coli Uropatogenik dapat menyebabkan Infeksi Saluran Kemih (ISK)
pada 90% wanita serta diare sehingga ibu yang mengkonsumsi jamu uyup-uyup
menjaga kebersihannya maka bayinya akan tertular diare melalui fekel oral rute
karena bayi sangat rentan terkena penyakit. Penyebab utama diare pada bayi yaitu
E.colienteropatogenik danE.colienterotoksigenik (Radji, 2011).
Jamu uyup-uyup dipilih karena merupakan jamu pilihan utama untuk
membantu memperlancar produksi ASI. Konsumsi jamu pelancar ASI didasari
berbagai alasan, diantaranya adalah karena harga dari susu khusus ibu menyusui
yang cukup mahal dan sebagian dari mereka tidak menyukai susu (Rengga, 2013).
Jamu uyup-uyup dari penjual jamu racik “X” juga banyak dikonsumsi oleh
banyak warga bukan hanya warga Jogja tetapi juga warga di luar kota Jogja.
Penjual jamu racik “X” menjual jamu uyup-uyup dari jam 06.00 pagi hingga jam
19.30 WIB dengan sekali pembuatan dengan cara manual yaitu memakai tangan
dan ditumbuk menggunakan peralatan sederhana seperti lumpang dan alu. Hal ini
akan memicu adanya pertumbuhan jamur dan bakteri patogen. Selain itu, bahan
yang digunakan adalah rimpang yang berasal dari tanah yang merupakan habitat
dari jamur serta bakteri termasuk bakteriE.coli.
1. Rumusan masalah
a. Berapa AKK dalam jamu uyup-uyup dari penjual jamu racik “X” di
Yogyakarta?
b. Berapa ALT dalam jamu uyup-uyup dari penjual jamu racik “X” di
Yogyakarta?
c. Adakah cemaran bakteri patogen Escherichia coli dalam jamu uyup-uyup
2. Keaslian penelitian
Sejauh penelusuran pustaka penulis, publikasi penelitian tentang “Uji
AKK, Uji ALT dan identifikasi Escherichia coli dalam jamu uyup-uyup dari
penjual jamu racik “X” di Yogyakarta” belum pernah dilakukan. Penelitian
yang pernah dilakukan berkaitan dengan penelitian ini adalah:
a. Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT) dan
IdentifikasiEscherichia colidalam jamu cekok dari penjual jamu racik
“X” di Yogyakarta oleh Susetyo (2014).
b. Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT) dan
IdentifikasiSalmonelladalam jamu uyup-uyup dari penjual jamu racik
“X” di Yogyakarta oleh Purwaningsih (2014).
c. Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT) dan
IdentifikasiSalmonelladalam jamu cekok dari penjual jamu racik “X”
di Yogyakarta Oleh Kartika (2014).
d. Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT) dan
Identifikasi Staphylococcus aureus dalam jamu cekok dari penjual
jamu racik “X” di Yogyakarta oleh Oktavori (2014).
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi mengenai AKK,
ALT dan ada tidaknya bakteri Escherichia coli dalam jamu uyup-uyup
b. Manfaat praktis
Penelitian ini diharapkan dapat bermanfaat bagi penjual jamu serta
masyarakat dalam memberikan informasi mengenai salah satu parameter
kualitas dan keamanan terkait AKK, ALT dan ada tidaknya bakteri
Escherichia coli pada jamu uyup-uyup dari penjual jamu racik “X” di
Yogyakarta.
B. Tujuan penelitian
Penelitian ini bertujuan untuk mengetahui nilai AKK, ALT dan ada
tidaknya cemaran bakteri Escherichia coli dalam jamu uyup-uyup dari penjual
7
BAB II
TINJAUAN PUSTAKA A. Obat Tradisional
Obat tradisional sebagaimana tercantum dalam PERMENKES Nomor 007
tahun 2012 adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan
hewan, bahan mineral, sediaan sarian (galenik), atau campuran dari bahan tersebut
yang secara turun-temurun telah digunakan untuk pengobatan, dan dapat
diterapkan sesuai dengan norma yang berlaku di masyarakat.
Menurut Keputusan Kepala Badan Pengawas Obat dan makanan Republik
Indonesia, Obat Bahan Alam Indonesia dikelompokkan menjadi tiga yaitu jamu,
obat herbal terstandar dan fitofarmaka (BPOM RI, 2004). Jamu adalah obat
tradisional Indonesia. Obat herbal terstandar adalah sediaan obat bahan alam yang
telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan
bahan bakunya telah distandardisasi. Fitofarmaka adalah sediaan obat bahan alam
yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik
dan klinik, bahan baku dan produk jadinya telah distandardisasi (BPOM, 2005).
KEPMENKES nomor 661 tahun 1994 menyebutkan bahwa cairan obat
dalam adalah sediaan obat tradisional berupa larutan emulsi atau suspensi dalam
air; bahan bakunya berasal dalam dari serbuk simplisia atau sediaan galenik dan
digunakan sebagai obat dalam.
Jamu merupakan cairan obat dalam, sesuai dengan KEPMENKES Nomor
661 tahun 1994 bahwa untuk cairan obat dalam nilai AKK tidak boleh lebih dari
B. Jamu Uyup-uyup
Sesuai dengan Peraturan Menteri Kesehatan Republik Indonesia Nomor
007 Tahun 2012, usaha jamu racikan adalah usaha yang dilakukan oleh depot
jamu atau sejenisnya yang dimiliki perorangan dengan melakukan pencampuran
sediaan jadi dan/atau sediaan segar obat tradisional untuk dijajakan langsung
kepada konsumen.
Cara pembuatan jamu uyup-uyup yang diproduksi oleh penjual jamu racik
“X” di Yogyakarta adalah dengan mencuci semua bahan yang digunakan dengan
air dan disikat, kemudian menumbuknya sampai halus menggunakan lumpang dan
alu. Hasil tumbukan dimasukkan dalam kantong plastik bening, esok paginya
direbus dan disaring, kemudian jamu dijual ke konsumen dari pagi hingga malam
hari.
Menurut Suharmiati (2003), jamu uyup-uyup atau jamu gepyokan adalah
jamu yang digunakan bagi ibu-ibu pasca melahirkan untuk membantu
memproduksi banyak asi bagi bayinya. Bahan baku dari jamu uyup-uyup
berbeda-beda antar penjual jamu, namun pada umumnya yang digunakan berupa
empon-empon meliputi:
1. Kunyit (Curcuma domesticaVal. )
Rimpang kunyit mengandung senyawa kurkuminoid. Selain itu, dalam
rimpang kunyit juga mengandung minyak atsiri berupa sesquiterpen, tumeron,
tumeon, zingiberen, dan garam-garam mineral. Khasiat dari rimpang kunyit yaitu
untuk memperlancar ASI, mengobati diabetes melitus, disentri, sakit keputihan,
2. Kencur (Kaempferia galangaL.)
Senyawa yang terkandung dalam rimpang kencur adalah amilum (4,14%)
mineral (13,73%) dan minyak atsiri (0,02%) terdiri dari sineol, asam
metilfumarat, dan pentadekana, ester etil sinamat, borneol, kamfena, asam anisik,
alkaloid, dan gom. Khasiat dari rimpang kencur ini adalah untuk mengobati
masuk angin, diare, sakit kepala, influenza pada bayi, batuk memperlancar haid,
menghilangkan lelah, muntah-muntah, dan lain-lain (Agoes, 2010)
3. Temulawak (Curcuma xanthorrhizaRoxb.)
Rimpang temulawak mengandung kurkuminoid berupa kurkumin,
demetoksikurkumin serta minyak atsiri terdiri dari alfakurkumin dan xantorizol
yang berkhasiat sebagai antibakteri, koleretik (menstimulasi produksi empedu dari
hati) dan sebagai antipiretik (menurunkan panas). Temulawak mempunyai banyak
khasiat di antaranya yaitu memperlancar ASI, mengobati asma, sakit maag,
menambah nafsu makan, meredakan nyeri haid dan lain-lain (Latief, 2012).
4. Lempuyang wangi (Zingiber aromaticumVal.)
Jenis temulawak ini juga sering disebut sebagai lempuyang emprit.
Kandungan zat aktifnya meliputi zerumbon, suatu senyawa yang berkhasiat
sebagai antikejang. Selain itu, juga terdapat limonen yang berkhasiat sebagai
karminatif (mengeluarkan gas) dari saluran cerna. Khasiat lain dari lempuyang
yaitu mengobati kaki bengkak setelah melahirkan, wasir, gatal-gatal, anemia,
cacingan, kolik karena kedinginan, serta untuk menambah nafsu makan (Latief,
5. Temu ireng (Curcuma aeruginosaRoxb.)
Rimpang temu ireng mengandung senyawa tanin, kurkumol,
isokurkumenol, kurzerenon, kurdion, kurkumalakton, germakron, β-g-elemene,
linderazulene, kurkumin, dan bisdemethyoxykurkumin. Ciri khas dari rimpang ini
yaitu mempunyai rasa pahit, tajam dan sifatnya mendinginkan. Rimpang ini
berkhasiat sebagai pengencer dahak, karminatif (memicu flatus), stomakik
(meningkatkan nafsu makan), antihelmintik, dan pembersih darah setelah
melahirkan atau setelah haid ( Agoes, 2010).
6. Temu giring (Curcuma heyneana)
Temu giring mengandung zat pati, minyak atsiri, dan piperazin sitrat yang
dapat membunuh cacing gelang. Khasiat lain dari temu giring adalah mengatasi
bau badan, gelisah atau cemas, menguruskan badan, disentri, sembelit, jantung
berdebar-debar serta dapat digunakan sebagai lulur pengantin (Agoes, 2010).
7. Pepaya (Carica papayaL.)
Bagian yang digunakan dalam jamu uyup-uyup ini adalah bagian daun
yang mempunyai ciri khas rasanya yang pahit. Kandungan dari daun pepaya ini
meliputi enzim papain, alkaloid karparin dan pseudokarpain, glikosida, karposida,
dan saponin. Khasiat dari daun pepaya yaitu untuk melancarkan ASI, mengobati
malaria, flu, mencegah demam nifas, menambah nafsu makan, mengatasi
C. Angka Kapang/Khamir (AKK)
Tujuan dilakukannya uji AKK adalah memberikan jaminan bahwa sediaan
obat tradisional tidak mengandung cemaran fungi melebihi batas yang ditetapkan
karena mempengaruhi stabilitas dan aflatoksin yang berbahaya bagi kesehatan.
Prinsip dari uji AKK ini adalah penentuan adanya kapang/khamir secara
mikrobiologis dinyatakan dalam koloni/ml ( Depkes RI, 2000).
Khamir atau yeast adalah kelompok fungi uniseluler yang bersifat
mikroskopik. Ada beberapa genus khamir yang dapat membentuk miselium
dengan percabangan. Khamir dapat bersifat patogen pada manusia dan binatang
bersel satu. Khamir tersebar di alam, tetapi tidak seluas daerah penyebaran
bakteri. Pada umumnya khamir mempunyai ukuran sel-sel yang lebih besar
dibandingkan bakteri. Ukuran khamir sekitar 1-5 mikron lebar dan panjangnya
sekitar 5-30 mikron (Tarigan, 1988). Khamir tidak mempunyai flagel dan
organel lain untuk melakukan pergerakan. Beberapa bentuk khamir yaitu bulat
(spheroid), elips atau bulat telur dan batang atau silindris. Bentuk sel khamir tetap
sehingga dapat membantu dalam melakukan identifikasi (Jutono, 1972).
Beberapa kelompok khamir yang dominan ditemukan dalam air dan
ekosistem tanah adalah genus Cryptococcus, Candida dan Debaryomyces (Kanti
2005). Candida albicans adalah flora normal selaput mukosa saluran pernafasan,
saluran pencernaan dan genitalia wanita. Kadang-kadang Candida menyebabkan
penyakit sistemik progresif pada penderita yang lemah atau sistem imunnya
tertekan.Candida albicansdapat menyebabkan infeksi mulut (sariawan), terutama
bercak-bercak putih yang sebagian besar terdiri atas pseudomiselium dan epitel yang
terkelupas dan hanya terdapat erosi minimal pada selaput. Candida albicansjuga
dapat menyebabkan vulvovaginitis atau keputihan pada wanita. Penyakit ini
menyerupai sariawan tetapi menimbulkan iritasi, gatal yang hebat dan
pengeluaran sekret. Dalam keadaan pH normal yang asam bakteri vagina tidak
menimbulkan penyakit, namun karena hilangnya pH asam merupakan predisposisi
timbulnya vulvovaginitis kandida. Cryptococcus neoformans juga ditemukan
pada kotoran burung. Cryptococcus neoformans menyebabkan infeksi yang
disebut kriptokokosis yang bersifat opportunistik. Infeksi pada manusia terjadi
malalui saluran pernafasan dan dapat bersifat asimtomatik, infeksi paru-paru dapat
menyebar secara sistemik dan menetap dalam susunan saraf pusat dan
organ-organ lainnya (Jawetz, 1996).
Kapang atau mold merupakan jamur yang berbentuk menyerupai benang,
multiseluler, tidak berklorofil dan belum mempunyai diferensiasi jaringan.
Spesies kapang yang non-patogen meliputi spesies-spesies yang melakukan
perombakan bahan-bahan organik di tanah, dan perusakan pada serat-serat kayu
dan bahan-bahan lain. Kapang hidup di dalam tanah, buah-buahan, dalam air, dan
pada bahan-bahan makanan. Kapang dapat bersifat saprofit dan parasit pada
tanaman, manusia, dan hewan (Jutono, 1972). Tubuh kapang terdiri dari
kumpulan benang-benang halus berwarna putih yang disebut hifa. Hifa-hifa ini
dapat terus tumbuh dan bercabang membentuk miselium. Setiap hifa mempunyai
Adanya kapang dalam makanan atau minuman sangat berbahaya karena
kapang menghasikan mikotoksin. Mikotoksin adalah metabolit sekunder dari
kapang yang bersifat sitotoksik, merusak struktur sel, seperti membran dan
merusak proses pembentukan sel yang penting bagi tubuh. Penyakit yang
disebabkan oleh mikotoksin disebut dengan mikotoksis. Ada 5 jenis mikotoksin
yang berbahaya bagi kesehatan yaitu, aflatoksin, fumonisin, okratoksin,
trikotesena, dan zearalenon. Aflatoksin terutama dihasilkan olehAspergilus flavus
dan Aspergilus parasiticus. Terdapat enam jenis aflatoksin yang sering dijumpai
dan bersifat toksik, yaitu aflatoksin B1, B2, G1, G2, M1 dan M2 (Ahmad, 2009).
Aspergilus flavusditemukan di air, udara dan tanah (Davidet all., 2001)
Salah satu jenis aflatoksin yang paling toksik adalah aflatoksin B1 yang
banyak ditemukan pada makanan dan minuman. Apabila aflatoksin ini masuk ke
dalam tubuh manusia terutama pada wanita yang sedang menyusui, maka akan
disekresikan melalui ASI dalam bentuk hidroksilasinya yaitu aflatoksin M1.
Aflatoksin M1 ini dapat terkonsumsi oleh bayi melalui ASI dan dapat
menyebabkan hepatotoksik dan kanker hati (Abdulrazzaq, 2003).
D. Angka Lempeng Total (ALT)
Metode kuantitatif digunakan untuk mengetahui jumlah mikroba yang
ada pada suatu sampel, umumnya dikenal dengan Angka Lempeng Total
(ALT). Uji ALT dan lebih tepatnya ALT bakteri aerob mesofil atau anaerob
mesofil menggunakan media padat dengan hasil akhir berupa koloni bakteri
ml/g atau koloni/100ml. Cara yang digunakan antara lain dengan cara tuang,
cara tetes dan cara sebar (BPOM RI, 2008).
Bakteri merupakan organisme yang tidak memiliki membran inti sel,
prokariota dan mikroskopik (berukuran kecil). Bakteri adalah salah satu penyebab
infeksi pada manusia. Banyak infeksi yang disebabkan oleh bakteri bersifat
patogen dan asimtomatik. Penyakit terjadi jika bakteri atau reaksi imunologik
terhadap keberadaannya menyebabkan cukup kerusakan pada seseorang (Jawetz,
1996).
Habitat bakteri merupakan tempat tinggal yang spesifik bagi bakteri untuk
tumbuh. Habitat alam mikroorganisme berupa tanah, air dan udara. Bakteri
patogen yang berada di tanah meliputi Clostridium tetani, Clostridium
perfringens,Clostridium botulinum, danBacillus antracis. Bakteri yang berasal di
air meliputi Salmonella, shigella, Vibrio cholerae, Legionella, dan Escherichia
coli. Bakteri E.coliini biasanya digunakan sebagai indikator dari pencemaran air
oleh tinja. Udara sangat jarang menjadi habitat bakteri karena adanya efek
pengeringan, ozonisasi, dan radiasi sinar UV. Namun, udara dalam ruangan
kemungkinan mengandung mikroba patogen yang berasal dari tangan, kulit,
pakaian, dan saluran napas atas manusia (Radji, 2011).
Patogenesis merupakan kemampuan dari suatu mikroorganisme untuk
menyebabkan penyakit mulai dari mikroorganisme masuk dalam sel hospes dan
berkembang biak. Kemampuan mikroorganisme dalam menimbulkan penyakit ini
dipengaruhi dari sistem imun hospes yang sedang terganggu serta faktor virulensi
Faktor virulensi mikroorganisme patogen ditentukan oleh toksin yang
diproduksi yaitu berupa endotoksin (toksin lipopolisakarida) dan eksotoksin
(toksin protein). Eksotoksin merupakan protein toksin yang termolabil dan
dikelompokkan menjadi 3 tipe yaitu: sitotoksin (membunuh sel inang atau
mempengaruhi fungsi sel), neurotoksin (terlibat dalam transmisi normal impuls
saraf), enterotoksin (mempengaruhi sel-sel pada saluran pencernaan). Endotoksin
merupakan toksin yang tahan panas dan dihasilkan oleh bakteri gram negatif
selama masa pertumbuhan terutama pada saat sel mengalami lisis. Pada saat sel
lisis, disintegrasi dinding selnya mengakibatkan pelepasan toksin LPS.
Endotoksin yang dilepaskan pada peredaran darah dapat menyebabkan syok
kerena terjadi penurunan tekanan darah dan kegagalan fungsi banyak organ
(Pratiwi, 2008).
Clostridium tetani merupakan bakteri tanah patogen yang menghasilkan
neurotoksin berupa tetanospamin. Tetanospamin dapat mencapai sistem saraf
pusat dan terikat pada sel saraf menyebabkan kontraksi otot yang tidak terkendali,
menghasilkan kontraksi otot spasmodik tetanus. Bakteri Clostridium botulinum
juga menghasilkan neurotoksin berupa toksin botulinum. Neurotoksin ini akan
menghambat transmisi impuls saraf ke sel otot. Toksin ini terikat kuat pada sel
saraf dan menghambat pelepasan neurotransmiter yaitu asetilkolin (berperan
dalam menginduksi kontraksi otot). Akibatnya terjadi penghambatan kontraksi
otot (Pratiwi, 2008). Clostridium perfringens menularkan penyakit dari makanan
atau minumam yang terkontaminasi tanah dan tinja. Bakteri ini menghasilkan
menyebabkan hipersekresi air dan klorida dan menghambat reabsorpsi natrium.
Akibatnya terjadi diare, kram perut, dan kadang-kadang terasa mual disertai
muntah (Radji, 2011).
Bakteri air seperti E.coli dapat menyebabkan diare dan infeksi saluran
kemih. Penyebab utama diare pada bayi yaitu E.colienterohemoragik dan E.coli
enterotoksigenik (Dupont, 1971). Bakteri Salmonellamenyebabkan salmonellosis
pada manusia melalui makanan atau minuman yang terkontaminasi. Salmonella
menghasilkan endotoksin yang dapat merangsang pelepasan zat pirogen dari
sel-sel makrofag dan sel-sel polimorfonuklear sehingga mengakibatkan demam.
Salmonella juga menghasilkan enterotoksin dan sitotoksin yang menyebabkan
diare. Shigella menghasilkan endotoksin yang dapat menyebabkan demam dan
eksotoksin berupa enterotoksin, neurotoksin serta sitotoksin. Enterotoksin yang
dihasilkan olehShigellaini dapat menyerang kolon sehingga mengakibatkan diare
berair atau disentri, sedangkan neurotoksin dan sitotoksin belum diketahui pasti
peranannya pada shigellosis, tetapi diduga menyebabkan kejang pada anak-anak.
Bakteri Legionella tidak hanya berasal dari air tetapi juga infeksi diperoleh
melalui inhalasi udara atau melalui debu. Gejala klinik dari infeksi Legionella
yaitu berupa demam tinggi, menggigil, diare, dan batuk (Radji, 2011). Toksin
kolera merupakan enterotoksin yang dihasilkan oleh bakteri Vibrio cholerae yang
dapat menginduksi pembentukan cyclic cAMP dari ATP pada sitoplasma.
Akibatnya, sel epitel mengeluarkan sejumlah besar cairan dan elektrolit serta
mengganggu kontraksi otot normal sehingga berakhir dengan diare disertai
air. P. aeruginosajuga dapat dijumpai pada daerah lembab (Levinson & Jawetz,
2003). P.aeruginosa melekat dan membentuk koloni pada selaput mukosa atau
kulit, menginvasi secara lokal dan menimbulkan penyakit sistemik.
Lipopolisakarida pada P.aerugenosa berperan langsung dalam menyebakan
demam, syok oligouria, leukositosis, dan leukopenia.
Pengenceran dari sampel sangat penting untuk menghindari koloni bakteri
atau kapang/khamir yang saling menumpuk karena konsentrasi sangat pekat
sehingga didapatkan koloni yang terpisah dan dapat dihitung dengan mudah.
Pengenceran ini sangat membantu terutama untuk sampel dengan cemaran sangat
tinggi (BPOM RI, 2008).
E. Media
Media pertumbuhan mikroorganisme adalah bahan yang tersusun dari
bermacam-macam zat makanan atau nutrisi yang diperlukan untuk pertumbuhan
mikroorganisme dalam menyusun komponen sel-selnya (Aulia, 2012). Mikroba
membutuhkan banyak nutrisi untuk dapat melakukan sintesa protoplasma dan
bagian-bagian sel lainnya. Setiap nutrisi yang dibutuhkan mikroorganisme dapat
berbeda karena sifat fisiologi setiap mikroorganisme juga berbeda (Sumarsih,
2007). Media dapat berupa cairan seperti kaldu dan dapat pula berupa padatan
seperti agar dan gelatin. Media harus mengandung sumber karbon, nitrogen,
sulfur, fosfor, dan faktor pertumbuhan organik (Radji, 2011). Proses pembuatan
media harus dilakukan proses sterilisasi dan selalu menerapkan perilaku aseptis
Medium pertumbuhan dapat digunakan untuk hal-hal berikut :
1. isolat mikroorganisme menjadi kultur murni,
2. memanipulasi komposisi media pertumbuhannya,
3. menumbuhkan mikroorganisme,
4. memperbanyak jumlah,
5. menguji sifat-sifat fisiologisnya
6. menghitung jumlah mikroba (Aulia, 2012).
Media yang digunakan untuk pengujian AKK adalah Potato Dextrose
Agar (PDA). Media ini menyediakan nutrisi untuk menstimulasi pertumbuhan
konidium pada jamur (Murray, 1996). Media yang digunakan untuk pengujian
ALT adalah Plate Count Agar (PCA) yang mengandung tripton, glukosa dan
yeast extractuntuk nutrisi pertumbuhan bakteri (Bridson, 2006).
Identifikasi bakteri patogen misalnya E. coli menggunakan media selektif
yaitu media yang hanya dapat ditumbuhi oleh satu atau lebih mikroorganisme
tertentu, tetapi akan menghambat/mematikan jenis lainnya. Salah satu media
selektif untuk identifikasi bakteri E.coli adalah E.coli Broth (ECB) merupakan
media yang memfasilitasi bakteri Coliform yaitu E.coli, Enterobacter aerogenes
dan Citrobacter fruendii untuk memfermentasikan laktosa. Hasil positif
ditunjukkan dengan adanya pembentukan gas (Cappucino, 2008).
Media differensial adalah media yang digunakan untuk menumbuhkan
mikroba tertentu serta untuk menentukan sifat-sifatnya. Media Tryptone Bile
X-Glucuronide (TBX) adalah media yang mengandung agen kromogenik x-β
pada E.coli. Bakteri E.coli akan menyerap agen kromogenik x-β-D-glukoronide
dan akan terjadi interaksi dengan enzim glukoronidase. Setelah terjadi proses
fermentasi maka agen kromogenik akan disekresikan ke luar sel yang akan
menimbulkan warna hijau-kebiruan sehingga memudahkan dalam proses
identifikasiE.coli(Bridson, 2006).
F. Escherichia coli
Escherichia coli termasuk dalam golongan gram negatif yang berbentuk
batang, berbentuk rantai membentuk koloni, dan bergerak mengunakan flagel.
Sebagian besar dari bakteri E.coli menghasilkan toksin berupa eksotoksin yang
tidak tahan pada panas, eksotoksin ini dapat menyebabkan hipermotilitas karena
peningkatan sekresi air dan klorida ke dalam lumen usus dan menyebabkan diare
pada anak-anak ( Jawetz, 1996). Pada saluran pencernaan, E. coli mampu
memfermentasikan laktosa pada suhu tubuh normal 35-37ºC (Chandra, 2007).
E.coli dapat tumbuh baik pada temperatur 8º-46ºC. Bakteri yang berada sedikit di
atas temperatur minimum atau sedikit di atas temperatur maksimum, tidak akan
mati melainkan berada dalam keadaan tidur atau dormancy ( Melliawati, 2009).
BakteriE.colidapat tetap bertahan pada suhu 70oC (Anonim, 2014).
Bakteri E.coli merupakan flora normal yang berada pada saluran
pencernaan manusia. Namun apabila keberadaannya berlebih tentu justru akan
membahayakan kondisi tubuh. Selain itu, ada beberapa dari galur bakteri E.coli
meningitis, diare yang disertai darah, kejang perut, demam, dan terkadang dapat
menyebabkan gangguan pada ginjal (Radji, 2011).
Escherichia coli adalah golongan Enterobacteriaceae yang sebenarnya
tidak banyak dijadikan sebagai indikator dari kontaminasi fekal, tetapi lebih
menunjukkan sebagai indikator dari sanitasi yang buruk pada saat proses produksi
jamu dikarenakan bakteri ini tahan pada suhu tinggi maupun suhu rendah,
kekeringan, serta tahan terhadap detergen atau disinfektan (BPOM, 2008).
Berdasarkan sifat virulensi,E.colidikelompokkan menjadi 2 yaitu:
1. E.coliyang menyebabkan infeksi intestin
a. E.coliEnteropatogenik (EPEC)
EPEC ini menyebabkan diare berat pada bayi bisa bertahan
lebih dari 2 minggu dalam tubuh inang dan mengakibatkan
kematian jika terjadi dehidrasi berat. Pada orang dewasa,
penyakit ini ditandai dengan diare berat, mual, muntah, kram
perut, sakit kepala, demam, dan menggigil. Waktu timbulnya
penyakit diare adalah 17 sampai 72 jam dengan durasi 6 jam
sampai 3 hari. Strain ini menyebabkan penyakit diare pada
orang-orang di negara berkembang ketika ditransmisikan dalam
air yang terkontaminasi oleh tinja (Dupont, 1971).
b. E.coliEnteroinvasif (EIEC)
EIEC mirip dengan shigellosis dan disebabkan oleh penetrasi
bakteri yang mengakibatkan kerusakan mukosa usus. Gejala
perut, dan diare cair. Penyakit ini terjadi 8 sampai 24 jam
setelah konsumsi makanan atau air yang terkontaminasi bakteri
ini (Dupont, 1971)
c. E.coliEnterotoksigenik (ETEC)
Penyebab utama pada “diare wisatawan” serta penting
menyebabkan diare pada bayi di negara berkembang. ETEC
termasuk strain yang menghasilkan enterotoksin yaitu toksin
LT (tidak tahan panas) dan toksin ST (tahan panas) ketika
berkembang biak di usus menyebabkan diare dan gangguan
absorpsi klorida dan natrium serta menurunkan motilitas usus
halus. Penyakit ini ditandai dengan diare berat, yang
menyebabkan dehidrasi. Diare dapat bertahan hingga 19 hari.
Biasanya tidak ada demam. Onset penyakit dapat terjadi 8-44
jam setelah konsumsi (Dupont, 1971)
d. E.coliEnterohemoragic (EHEC)
Gejala ditandai dengan kram perut parah (namun tidak selalu)
diikuti dengan diare berdarah (kolitis hemoragik). Beberapa
individu hanya menunjukkan diare dan muntah tidak disertai
demam. Masa inkubasi biasanya sekitar sekitar 3 sampai 9 hari.
Mikroorganisme ini menghasilkan verotoksin yang
menyebabkan sindrom uremik hemolitik dan gagal ginjal pada
anak-anak yang sering membutuhkan dialisis dan akhirnya
e. E.coliEnteroagregatif (EAEC)
Penyebab utama diare akut dan kronis pada masyarakat
berkembang. EAEC menyebabkan diare tidak berdarah, tidak
menginvasi, dan tidak menyebabkan inflamasi pada mukosa
intestin. EAEC juga menghasilkan hemolisin yang dapat
menyebabkab infeksi saluran kemih (Radji, 2011).
2. E.coliyang dapat menyebabkan infeksi extraintestin
a. E.coliUropatogenik (UPEC)
UPEC menyebabkan infeksi saluran kandung kemih pada 90%
wanita. Kemungkinan wanita mengalami infeksi UPEC ini
dikarenakan wanita mempunyai saluran uretra yang lebih
pendek dibandingkan pria. Bakteri yang berkolonisasi berasal
dari tinja atau daerah perineum saluran urin yang masuk ke
dalam kandung kemih (Radji, 2011).
b. E.colimeningitis neonatus (NMEC)
NMEC merupakan penyebab utama meningitis pada bayi yang
baru dilahirkan. Infeksi terjadi setelah E.coli masuk ke dalam
pembuluh darah melaui nasofaring atau saluran gastrointestinal
dan kemudian masuk ke dalam sel-sel otak. Faktor utama
G. Identifikasi Escherichia coli
Prinsip pengujian deteksi Eschericia coli menurut Metode Analisis
Mikrobiologi (MA PPOM 73/MIK/06) yaitu pertumbuhan koloniEschericia
coli pada media lempeng selektif dan dilanjutkan dengan konfirmasi melalui
uji biokimia. Pada pengujan deteksi Eschericia coli digunakan Tryptic Soy
Broth (TSB) sebagai media cair atau pengencer, dan Eosyn Methylen Blue
(EMB) sebagai media lempeng selektif.
Uji yang digunakan untuk mengetahui keberadaan bakteri E.coli
didalam contoh adalah uji fermentasi karbohidrat dan uji IMViC (uji Indol,
Methyl Red, Voges-Proskauer, dan Citrate) yang menjadi ciri keberadaan
bakteriE.coli(Holtet all., 2000). Berikut uji identifikasi keberadaanE.coli:
1. Uji fermentasi karbohidrat
Sebagian besar mikroorganisme memperoleh energi dari serangkaian
reaksi enzimatik dari substrat seperti karbohidrat. Organisme yang menggunakan
karbohidrat berbeda-beda tergantung dari enzim yang dimilikinya. Beberapa
organisme dapat memfermentasikan gula salah satunya adalah glukosa secara
anaerob. Bakteri fakultatif anaerob seperti E.coli dapat memfermentasikan
glukosa dalam keadaan aerob maupun anaerob. Fermentasi karbohidrat secara
anaerob menghasilkan asam organik seperti asam format, asam laktat, asam asetat
disertai gas hidrogen dan karbon dioksida (Cappuccino, 2008).
Karbohidrat yang sering digunakan yaitu glukosa, laktosa, manitol,
maltosa dan sukrosa. Media yang digunakan mengandung glukosa dan
warna media dari merah menjadi kuning. Gas yang terbentuk terjebak dalam
tabung Durham (Lay, 1994).
2. Uji indol
Bakteri E.coli mampu menggunakan triptofan sebagai sumber karbon.
E.coli memiliki enzim triptofanase yang mengkatalisasikan penguraian gugus
indol dari triptofan. Pembentukan Indol diketahui dengan adanya cincin warna
merah muda di permukaan media karena penambahan reagen Kovac’s (Lay, 1994).
3. Uji metil merah
Pada umumnya glukosa merupakan sumber energi bagi mikroorganisme.
Sebagian besar mikroorganisme enterik seperti E.coli memfermentasikan glukosa
dengan memproduksi asam organik. Adanya penambahan indikator pH metil
merah dapat mendeteksi adanya asam yang dihasilkan oleh mikroorganisme
ditandai dengan penurunan pH dari 6 menjadi 4 dan perubahan warna media dari
kuning menjadi merah (Cappuccino, 2008).
4. Uji Voges-Proskauer
Uji Voges-Proskauer dapat mengetahui beberapa mikroorganisme yang
menghasilkan produk non asam atau bersifat netral, seperti asetilmetilkarbinol
dari asam organik yang dihasilkan pada metabolisme glukosa. Reagen yang
digunakan yaitu reagen Barritt’s yang berisi alkohol α-naftol dan KOH 40%. Hasil positif ditandai dengan terbentuknya kompleks warna merah seperti bunga
menit, terbentuknya warna merah mengindikasikan adanya asetilmetilkarbinol
(Cappuccino, 2008).
5. Uji sitrat
Uji sitrat bertujuan untuk mengetahui kemampuan suatu mikroorganisme
dalam menggunakan sitrat sebagai satu-satunya sumber karbon dan energi. Warna
media akan berubah dari hijau menjadi biru karena asam dihilangkan dan terjadi
peningkatan pH, karena mikroorganisme menggunakan sitrat sebagai sumber
karbon dan energi. Perubahan warna media dikarenakan adanya indikator pH
brom timol biru pada media (Lay, 1994).
6. Pengecatan gram
Pengecatan gram merupakan metode yang paling banyak digunakan dalam
klasifikasi bakteri. Metode ini dapat memisahkan menjadi 2 kelompok besar yaitu
bakteri gram positif dan gram negatif (Hadioetomo, 1985).
Zat warna yang digunakan yaitu kristal violet (biru) dan safranin (merah).
Prosedur laboratorium dimulai dengan melapisi spesimen dengan zat warna kristal
violet. Mikroorganisme kemudian dicuci dan diberi zat warna safranin.
Berdasarkan karakteristik dinding selnya, mikroorganisme gram positif akan
menyerap zat warna kristal violet ke dalam dinding sel dan mempertahankannya
selama pencucian sehingga akhirnya akan berwarna biru. Mikroorganisme gram
negatif tidak dapat mempertahankan zat warna kristal violet pada saat pencucian
H. Landasan Teori
Obat Bahan Alam Indonesia dibagi menjadi 3 yaitu jamu, obat herbal
terstandar serta fitofarmaka. Jamu termasuk dalam cairan obat dalam yang harus
memenuhi persyaratan sesuai KEPMENKES RI No. 661 Tahun 1994 yaitu tidak
boleh mengandung bakteri patogen, AKK tidak lebih dari 103dan ALT tidak lebih
dari 104.
Jamu uyup-uyup merupakan jamu yang dikonsumsi oleh ibu yang sedang
menyusui dan berkhasiat untuk meningkatkan produksi ASI. Jamu uyup-uyup ini
terbuat dari empon-empon berupa kunyit, kencur, temulawak, lempuyang, temu
ireng, temu giring, dan daun pepaya.
Pada penelitian ini dilakukan uji AKK, ALT serta Identifikasi bakteri
Escherichia colipada jamu uyup-uyup dari penjual jamu racik “X” di Yogyakarta.
Uji AKK dan uji ALT bertujuan untuk menghitung jumlah mikroba patogen yang
berada pada sampel jamu uyup-uyup dan dinyatakan dalam koloni/mL sesuai
dengan PPOMN tahun 2006.
Tanah dan air merupakan habitat bagi mikroba patogen diantaranya adalah
Clostridium tetani, Clostridium botulinum, Clostridium perfringens, Bacillus
antracis, Salmonella, shigella, Vibrio cholerae, Legionella, dan E. coli. Apabila
mikroba patogen tersebut masuk ke dalam tubuh manusia maka akan
menimbulkan penyakit diantaranya adalah demam, diare, muntah bahkan dapat
menyerang sistem saraf terutama bagi ibu-ibu yang sedang menyusui yang dapat
Faktor-faktor yang dapat menyebakan tingginya jumlah AKK, ALT dan
keberadaan bakteri E.coli adalah bahan baku yang digunakan oleh penjual jamu
racik “X” di Yogyakarta adalah berupa rimpang yang berasal dari tanah yang
kemungkinan mengandung banyak mikroba patogen. Pencucian bahan baku yang
kurang bersih karena bahan baku hanya dicuci menggunakan sikat yang
memungkinkan bakteri patogen masih tertinggal di rimpang tersebut. Selain itu,
bahan baku disimpan di dekat kamar mandi yang kondisinya lembab, serta
ditempatkan di bawah kandang burung yang kemungkinan dapat terkontaminasi
oleh mikroba patogen Cryptococcus neoformans. Mikroba patogen ini ditemukan
pada kotoran burung dan dapat menyebabkan infeksi paru-paru pada manusia.
Peralatan yang digunakan untuk pembuatan jamu uyup-uyup adalah
menggunakan lumpang dan alu yang tidak dicuci menggunakan sabun, dan dalam
keadaan yang lembab dapat memicu adanya pertumbuhan mikroba patogen.
Penjual jamu racik “X” buka dari pukul 06.00 WIB hingga 19.30 WIB, akibat
jamu yang didiamkan terlalu lama akan memicu pertumbuhan mikroba yang
semakin banyak karena air merupakan media yang sesuai untuk pertumbuhan
bakteri dan jamur. Apabila air yang digunakan oleh penjual jamu racik “X”
tercemar bakteri E.coli maka akan mengkontaminasi pada saat pembuatan jamu
uyup-uyup.
I. Hipotesis
Pada sampel jamu uyup-uyup dari penjual jamu racik “X” di Yogyakarta
mengandung AKK lebih dari 103, ALT lebih dari 104serta terdapat bakteri
28
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non-eksperimental dengan rancangan
deskriptif exploratif. Penelitian ini akan mendeskripsikan nilai AKK dan ALT
serta mengidentifikasi keberadaan bakteri Escherichia coli dalam sampel jamu
uyup-uyupdari penjual jamu racik “X” di Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional
Variabel-variabel yang digunakan pada penelitian ini adalah:
1. Variabel utama
a. Variabel bebas: waktu produksi jamu uyup-uyup dari penjual jamu racik
“X” di Yogakarta.
b. Variabel tergantung: AKK, ALT, dan keberadaan bakteriE. coli.
2. Variabel Pengacau
a. Variabel pengacau terkendali: media pertumbuhan yaitu Potato Dextrose
Agar (PDA) dan Plate Count Agar (PCA), suhu inkubasi 35ºC untuk uji
ALT dan 25ºC untuk uji AKK, waktu inkubasi 24-48 jam untuk uji ALT
dan 3-5 hari untuk uji AKK. Media selektif yaitu media E.Coli Broth
(ECB), TBX (Tryptone Bile X-Glucoronide), media glukosa, laktosa,
manitol, maltosa dan sakarosa (uji fermentasi karbohidrat), media Simmon
Citrate Agar, media MR-VP, suhu inkubasi (37-44ºC), waktu inkubasi
b. Variabel pengacau tak terkendali: kualitas bahan yang digunakan.
3. Definisi operasional
a. Jamu uyup-uyup adalah jamu yang terbuat dari kencur, kunyit, lempuyang,
temulawak, temu giring, temu ireng dan daun pepaya yang dipercaya
berkhasiat untuk memperlancar ASI. Jamu uyup-uyup yang digunakan
berasal dari penjual jamuracik “X”di Yogyakarta.
b. AKK adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung
jumlah kapang dan atau khamir yang terdapat dalam jamu uyup-uyup
dengan metode dan analisis hasil berdasarkan PPOMN tahun 2006.
c. ALT adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung
jumlah bakteri aerob mesofil yang terdapat dalam jamu uyup-uyup dengan
metode menurut PPOMN TAHUN 2006.
d. Uji identifikasi E.coliadalah uji fermentasi karbohidrat, uji IMViC dan
pengecatan gram untuk mengidentifikasi keberadaan bakteriE.coli dalam
jamu uyup-uyup menurut PPOMN tahun 2006.
C. Bahan Penelitian
1. Cairan jamu uyup-uyup yang diperoleh dari penjual jamu racik “X” di
Yogyakarta.
2. Media yang digunakan untuk pengujian AKK adalah media Potato Dextrose
Agar (Oxoid). Media yang digunakan dalam pengujian ALT adalah plate count agar(Oxoid). Media selektifE.coli yaitu mediaE.Coli Broth(Oxoid),
Tryptone Bile X-Glucoronide (Oxoid). Media untuk uji identifikasi E.coli
sakarosa (Oxoid) (IMVIC) menggunakan media Sulfur Indol Motility
(Oxoid), Methyl-Red Voges Proskauer (Oxoid), Simon’s Citrate agar
(Oxoid).
3. Kloramfenikol (Brataco Chemika), Pepton Dilution Fluid (Oxoid) aquadest
steril, etanol 70%, reagenKovac’s (Merck), larutan metil merah, larutan α -naftol, larutan KOH 40%.
D. Alat Penelitian
Laminar Air Flow, autoklaf (model: KT-40 No.108049 Midorigaoka
Japan), inkubator (WTC binder), oven (Memmert model 400), stomacher 400
circulator (Seward), mikropipet (Iwaki), mikroskop, pipet tetes, tabung reaksi,
tabung Durham, gelas sediaan, cawan petri, pipet volume, Beaker glass (Pyrex),
gelas ukur (Pyrex), Bunsen, neraca analitik (Precition Balance Model AB-204,
Metter Taledo) , Erlenmeyer, penangas air dan jarum ose.
E. Tata Cara Penelitian 1. Pemilihan dan Pengambilan Sampel
Sampel jamu yang dipilih adalah jamu uyup-uyup diambil dari penjual
jamu racik “X” di Yogyakarta. Sampel jamu selanjutnya diuji AKK, ALT dan
identifikasiEscherichia coli. Pengambilan sampel dilakukan setiap hari senin jam
06.00-07.30 karena pada jam tersebut paling banyak pembeli jamu uyup-uyup.
Sampel jamu uyup-uyup diambil tiga kali dengan jarak pengambilan satu
2. Penanganan Wadah/Kemasan Penyiapan Sampel
Sumbat atau tutup botol dibersihkan dengan kapas beralkohol 70%, lalu
dipanaskan di api bunsen sebentar. Sumbat dibuka secara aseptis.
3. Tahap Pra-Pengkayaan
a. Homogenisasi sampel untuk uji AKK
Sampel jamu uyup-uyup dipipet sebanyak 25 mL secara aseptis,
dimasukan ke dalam plastik steril yang telah berisi sebanyak 225 mL
larutan pengencer PDF kemudian dihomogenkan dengan bantuan
stomacher, sehingga diperoleh pengenceran 10-1.
b. Homogenisasi sampel untuk uji ALT
Sampel jamu uyup-uyup dipipet sebanyak 25 mL secara aseptis,
dimasukan ke dalam plastik steril yang telah berisi sebanyak 225 mL
larutan pengencer PDF kemudian dihomogenkan dengan bantuan
stomacher, sehingga diperoleh pengenceran 10-1.
c. Pengenceran sampel untuk uji AKK
Labu ukur 10 mL disiapkan sebanyak 4 buah yang masing-masing
telah diisi sebanyak 9 mL PDF. Sampel dipipet sebanyak 1 mL
pengenceran 10-1 dan dimasukkan ke dalam tabung pertama yang telah
berisi PDF secara aseptis hingga diperoleh pengenceran 10-2lalu dikocok
homogen dengan vortex. Pengenceran dibuat sampai 10-5.
d. Pengenceran sampel untuk uji ALT
Labu ukur 10 mL disiapkan sebanyak 4 buah yang masing-masing
homogenisasi pada penyiapan sampel dipipet sebanyak 1 mL dengan cara
aseptis dan dimasukkan ke dalam tabung pertama yang telah diisi
sebanyak 9 mL PDF hingga diperoleh pengenceran 10-2, kemudian
dihomogenkan dengan menggunakan vortex. Pengenceran selanjutnya
dibuat hingga 10-5(PPOMN, 2006).
4. Uji AKK
a. Pembuatan larutan kloramfenikol 1%
Kloramfenikol sebanyak 1 gram dilarutkan ke dalam 100 mL
aquadest steril.
b. Pembuatan mediaPotato Dextrose Agar(PDA)
Serbuk PDA sebanyak 39 gram disuspensikan dalam 1000 mL
aquadest, kemudian dilarutkan dengan pemanasan dan diaduk hingga
merata, dimasukkan dalam wadah yang sesuai. Kloramfenikol 100
gram/L ditambahkan dalam media dan dicampur hingga merata. Sterilisasi
dengan autoklaf selama 15 menit pada suhu 121°C, setelah itu dituang ke
dalam cawan petri atau tabung reaksi steril dan dibiarkan memadat.
c. Uji AKK
Suspensi bakteri dari masing-masing pengenceran dipipet sebanyak
1 mL dengan cara aseptis ke dalam cawan petri steril dan dibuat duplo.
Media PDA yang telah dicairkan (suhu 45±1oC) sebanyak 20 mL
dituangkan ke dalam cawan petri dan digoyangkan sehingga campuran
tersebut merata. Cawan petri dibalik setelah agar membeku dan
Pengamatan dilakukan setiap hari sampai hari ke-5. Koloni kapang dan
khamir dihitung setelah 5 hari.
Uji sterilitas media dilakukan dengan menuangkan media PDA
dalam cawan petri dan dibiarkan memadat. Uji sterilitas pengencer
dilakukan dengan cara menuangkan media PDA yang ditambahkan
sebanyak 1 mL pengencer (PDF) lalu dibiarkan memadat (PPOMN, 2006).
5. Uji ALT
a. Pembuatan mediaPlate Count Agar(PCA)
Sebanyak 7,05 g PCA ditimbang dan dicampurkan dengan 300 mL
aquadest steril, pH diatur 7,0 dan dipanaskan hingga larutan jernih.
Selanjutnya disterilkan dengan autoclaf selama 15 menit pada suhu
121oC.
b. Uji ALT
Masing-masing dari pengenceran dipipet sebanyak 1 mL secara
aseptis ke dalam cawan petri steril dan dibuat duplo. Media PCA sebanyak
15 mL yang telah dicairkan yang bersuhu 45±1oC dalam waktu 15 menit
dari pengenceran pertama dituangkan pada setiap cawan petri . Cawan
petri digoyangkan dengan hati-hati agar sampel tersebar merata dengan
media dan biarkan hingga memadat. Uji kontrol dilakukan untuk
mengetahui sterilitas media dan pengencer. Uji sterilitas media dilakukan
dengan cara menuangkan media PCA dalam suatu cawan petri dan
menuangkan media PCA yang ditambahkan sebanyak 1 mL pengencer
PDF lalu dibiarkan memadat.
Seluruh cawan petri diinkubasi terbalik pada suhu 35oC selama 24
jam hingga 48 jam. Jumlah koloni yang tumbuh diamati dan dihitung.
Dihitung Angka Lempeng total dalam 1 mL contoh dengan mengkalikan
jumlah rata-rata koloni pada cawan dengan faktor pengenceran yang
digunakan (PPOMN, 2006).
6. Uji IdentifikasiEscherichia coli
a. Uji Pengkayaan
Suspensi hasil homogenisasi contoh dipipet sebanyak 1 mL dan
diinokulasikan pada 9 mL ECB. Kemudian diinkubasi pada suhu 44oC
selama 24 jam. Timbulnya gas pada tabung Durham dan kekeruhan pada
media yang menunjukkan karakteristikE.coli(PPOMN, 2006)).
b. Isolasi
Hasil dari biakan pengkayaan diinokulasikan pada permukaan
TBX dengan cara streak plate dan diinkubasi dengan posisi lempeng
terbalik pada suhu 35-37oC selama 24 jam. Koloni spesifik E.coli yang
tumbuh dengan ciri-ciri bentuk bulat, diameter 2-3 mm, berwarna hijau
dengan kilap logam dan bintik biru kehijauan ditengahnya (PPOMN,
2006).
c. IdentifikasiE.colidengan uji biokimia
Satu koloni spesifik dipilih pada media TBX dan ditanam pada
Simmon’s citrate agar kemudian diinkubasi pada suhu 35-37oC selama 24 jam sebagai berikut :
1. Uji fermentasi glukosa
Satu sengkelit biakan TBX diinokulasikan pada media
glukosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil
positif ditandai dengan adanya perubahan warna media dari orange
kemerahan menjadi kuning (PPOMN, 2006).
2. Uji fermentasi laktosa
Satu sengkelit biakan TBX diinokulasikan pada media
laktosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil
positif ditandai dengan adanya perubahan warna media dari orange
menjadi kuning (PPOMN, 2006).
3. Uji fermentasi manitol
Satu sengkelit biakan TBX diinokulasikan pada media
manitol dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil
positif ditandai dengan adanya perubahan warna media dari orange
kemerahan menjadi kuning (PPOMN, 2006).
4. Uji fermentasi maltosa
Satu sengkelit biakan TBX diinokulasikan pada media
maltosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil
positif ditandai dengan adanya perubahan warna media dari orange
5. Uji fermentasi sukrosa
Satu sengkelit biakan TBX diinokulasikan pada media
maltosa dan diinkubasi pada suhu 35-37oC selama 24 jam
diinokulasikan pada media sukrosa dan diinkubasi pada suhu
35-37oC selama 24 jam. Hasil positif ditandai dengan adanya
perubahan warna media dari orange menjadi kuning (PPOMN,
2006).
6. Uji indol
Satu sengkelit biakan TBX diinokulasikan pada media SIM
dan diinkubasikan pada suhu 35-37oC selama 24 jam. Setelah
diinkubasi, ditambahkan 1 mL pereaksi indol (Reagen Kovac’s) ke
dalam masing-masing tabung dan dikocok beberapa menit. Warna
merah muda yang membentuk cincin pada permukaan biakan
menunjukkan reaksi indol positif (PPOMN, 2006).
7. Uji metil merah
Satu sengkelit biakan TBX diinokulasikan dalam media
MR-VP dan diinkubasikan pada suhu 35-37oC selama 48 jam.
Setelah diinkubasi tambahkan 5 tetes larutan metil merah dan
dikocok homogen selama beberapa menit. Warna kuning
menunjukkan reaksi negatif dan warna merah menunjukkan reaksi
8. Uji Voges-Proskauer
Satu sengkelit biakan TBX diinokulasikan pada media
MR-VP dan diinkubasi pada suhu 35-37°C selama 48 jam.
Ditambahkan 12 tetes larutan alfa naftol dan 4 tetes larutan KOH
40%, dikocok kemudian didiamkan selama 2-4 jam. Perubahan
warna biakan menjadi merah muda hingga merah menyala
menunjukkan reaksi positif (PPOMN, 2006).
9. Uji Sitrat
Satu sengkelit biakan TBX diinokulasikan pada media
Simmon’s citrate agar lalu diinkubasikan pada suhu 35-37oC selama 24-48 jam. Perubahan warna media dari hijau menjadi biru
menunjukkan reaksi positif (PPOMN, 2006).
d. Uji konfirmasi keberadaanE.colidengan pengecatan gram
Sediaan dibuat di atas kaca alas. Kemudian dikeringkan di udara
dan difiksasikan dengan panas. Sediaan diwarnai dengan larutan crystal
violet-ammonium oksalat selama 1 menit. Selanjutnya sediaan dicuci
dengan air dan ditiriskan. Larutan larutan lugol (gram iodine) dibubuhkan
selama 1 menit. Selanjutnya sediaan dicuci dengan air dan ditiriskan.
Warna dihilangkan dengan dicuci menggunakan alkohol 95% selama 30
detik. Sediaan dicuci dengan air dan ditiriskan kemudian dibubuhkan
larutan safranin selama 10-30 detik. Sediaan dicuci dengan air dan
dilakukan pengamatan dengan menggunakan mikroskop pada perbesaran
1000 kali (PPOMN, 2006).
F. Analisis Hasil 1. Uji AKK
Perhitungan Angka Kapang/Khamir sesuai dengan MA PPOMN No.
96/MIK/00 sebagai berikut:
Cawan petri yang dipilih yaitu cawan petri dari suatu pengenceran yang
menunjukkan jumlah koloni antara 10-150 koloni. Jumlah koloni dari kedua
cawan dihitung lalu dikalikan dengan faktor pengencerannya. Bila pada cawan
petri dari 2 tingkat pengenceran yang berurutan menunjukkan jumlah antara
10-150 koloni, maka dihitung jumlah koloni dan dikalikan faktor pengenceran,
kemudian diambil angka rata-rata. Hasil dinyatakan sebagai angka kapang/khamir
dalam tiap gram atau ml sampel (PPOMN, 2006).
Untuk beberapa kemungkinan lain yang berbeda dari pernyataan di atas,
maka diikuti petunjuk sebagai berikut:
i. Bila hanya salah satu di antara kedua cawan petri dari
pengenceran yang sama menunjukkan jumlah antara 10-150
koloni, jumlah koloni dari kedua cawan dihitung dan dikalikan
dengan faktor pengenceran (PPOMN, 2006).
ii. Bila ada tingkat pengenceran yang lebih tinggi di dapat jumlah
koloni lebih besar dari dua kali jumlah koloni pada
pengenceran di bawahnya, maka dipilih tingkat pengenceran
pada pengenceran 10-3 diperoleh 30 koloni, maka dipilih
jumlah koloni pada pengenceran 10-2yaitu 60 koloni).
Bila pada pengenceran yang lebih tinggi didapat jumlah koloni
kurang dari dua kali jumlah koloni pengenceran di bawahnya,
maka diambil angka rata-rata dari jumlah koloni dari kedua
pengenceran tersebut. Hasil dinyatakan sebagai Angka
Kapang/Khamir dalam tiap gram sampel (Misal: pada
pengenceran 10-2 diperoleh 60 koloni dan pengenceran 10-3
diperoleh 10 koloni, maka Angka Kapang/Khamir adalah :
6 + 10 x 103= 8 x 103
(PPOMN, 2006).
iii. Bila dari seluruh cawan petri tidak ada satupun yang
menunjukkan jumlah antara 10-150 koloni, maka dicatat angka
sebenarnya dari tingkat pengenceran terendah dan dihitung
sebagai Angka Kapang dan Khamir Perkiraan (PPOMN, 2006).
iv. Bila tidak ada pertumbuhan pada semua cawan dan bukan
disebabkan karena faktor inhibitor, maka Angka Kapang dan
Khamir dilaporkan sebagai kurang dari satu dikalikan faktor
pengenceran terendah (<1 x faktor pengenceran terendah)