6 BAB 2
TINJAUAN KEPUSTAKAAN
2.1. Baja Nirkarat Austenitik
Kandungan unsur dalam logam mempengaruhi ketahanan logam terhadap korosi, dimana paduan dengan unsur tertentu lebih tahan korosi dibanding logam murni, contoh baja nirkarat atau baja paduan Fe-18Cr-8Ni lebih tahan korosi dibandingkan Fe murni.
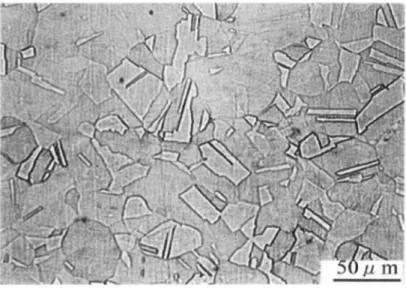
Berdasarkan persentase paduan unsur kimia, baja nirkarat di bagi menjadi lima jenis, yaitu: baja nirkarat martensitik, feritik, austenitik, duplek dan percipitation hardening. AISI 304 adalah jenis baja nirkarat austenitik, unsur pembentuk utamanya besi, karbon sangat rendah 0,08%, khromium (18 - 20)% dan nikel (8 - 10,5)%. Gambar 2.1, memperlihatkan mikrostruktur baja nirkarat austenitik AISI 304. Logam
Gambar 2.1. Mikrostruktur Baja Nirkarat Austenitik AISI 304
7
paduan ini merupakan paduan berbasis ferrous dan struktur kristal face centered cubic (FCC). Umumnya tetap dapat menjaga sifat austenitik pada temperatur ruang, lebih bersifat ulet dan memiliki ketahanan korosi lebih baik dibandingkan baja nirkarat feritik dan martensitik.
Komposisi unsur - unsur pemadu ini akan menentukan sifat ketahanan korosi dan sifat mekaniknya. Kadar khromium tinggi sebagai suatu ferrite stabilizer, membentuk lapisan film khromium oksida (Cr2O3) yang protektif jika beroksidasi
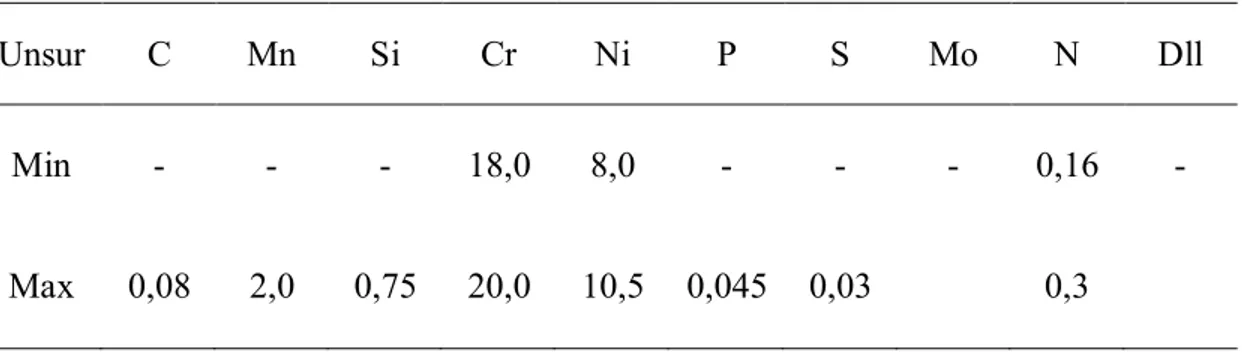
dengan oksigen, sehingga meningkatkan ketahanan korosi. Komposisi karbon rendah untuk meminimalisir sensitasi akibat proses pengelasan. Sifat fisika baja nirkarat austenitik AISI 304, seperti Tabel 2.1 dan komposisi kimia baja tersebut seperti Tabel 2.2.
Tabel 2.1. Sifat Fisika Baja Nirkarat AISI 304 Modulus Elastisitas E (GPa) Angka Poisson(n) Densitas (D) (Kg/m3) Panas Spesifik (J/Kg.K) Konduktivitas (W/mK) 197 0,3 40 500 16,2
Tabel 2.2. Komposisi Kimia Baja Nirkarat AISI 304
Unsur C Mn Si Cr Ni P S Mo N Dll
Min - - - 18,0 8,0 - - - 0,16 -
Max 0,08 2,0 0,75 20,0 10,5 0,045 0,03 0,3
8
2.2. Perhitungan Tegangan Dengan Metode Elemen Hingga
Komponen kontruksi tiga dimensi C-ring spesimen diberi beban tegangan dengan cara mengencangkan baut dan mur sampai diameter luar mengalami pergeseran, diperlihatkan Gambar 2.2.
Gambar 2.2. Komponen Tiga Dimensi C-ring Spesimen
Efek tegangan tarik terhadap ikatan antara atom-atom sebuah logam pada struktur kristal yang mengalami pelengkungan, distribusi tegangan yang terjadi di serap secara tidak merata oleh semua ikatan yang bersangkutan. Sebagian ikatan akan mengalami tekanan lebih besar di banding yang lain sehingga mempunyai potensi terjadinya pemusatan tegangan.
Secara garis besar hubungan tegangan dan pergeseran diameter luar C-ring spesimen (∆) adalah selisih diameter sebelum pergeseran (OD) dan sesudah
9
pergeseran (ODf) akibat pengencangan mur dan baut, didasarkan perhitungan kekuatan dalam konstruksi mekanik untuk daerah elastik (ASTM G 38), persamaan (2.1).
= 4E ∆
D2 …….……….(2.1) Dimana:
Δ
= OD - OD
f = Selisih diameter luar setelah mengalami tegangan (mm).σ
app = Tegangan aplikasi (MPa).D = Diameter rata-rata (mm). t = Tebal dinding (mm). E = Modulus Elastisitas (MPa).
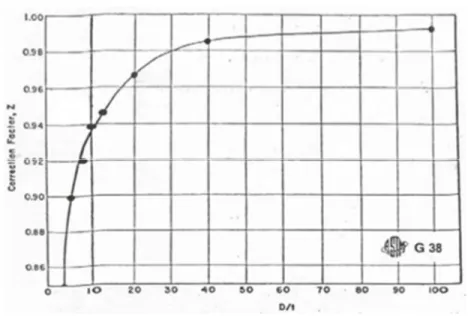
Z = Faktor koreksi berdasarkan kurva Gambar 2.3.
Gambar 2.3. Faktor Koreksi Z.
10
Untuk menganalisa distribusi tegangan yang terjadi digunakan metode elemen hingga. Dasar dari metode elemen hingga adalah membagi benda kerja menjadi elemen-elemen kecil yang jumlahnya berhingga sehingga dapat menghitung reaksi akibat beban pada kondisi batas yang diberikan. Dari elemen - elemen tersebut dapat disusun persamaan - persamaan matrik yang bisa diselesaikan secara numerik dan hasilnya menjadi jawaban dari kondisi beban yang diberikan pada benda kerja tersebut. Dari penyelesaian matematis dengan menghitung inverse matrik akan diperoleh persamaan dalam bentuk matrik untuk satu elemen dan bentuk matrik total yang merupakan penggabungan matrik elemen.
Dari rumus dasar perhitungan kekuatan mekanik menunjukan hubungan antara beban, sifat bahan, geometri dan pergeseran yang ditimbulkan dapat di susun bentuk umum persamaan dalam elemen dengan persamaan matrik (2.2), dengan memberikan syarat batas dan pembebanan sebagai berikut:
[ ][ ] = [ ] ………..(2.2) Dimana:
[K] = matrik kekakuan [U] = matrik pergeseran [F] = matrik beban
Berdasarkan bentuk persamaan matrik untuk tiap elemen dapat disusun bentuk persamaan yang kemudian memberikan hasil tegangan pada setiap titik dan elemen. Penyelesaian akibat beban dapat juga diselesaikan dengan memberikan syarat batas dan menyelesaikan persamaan matriknya. Penyelesaian metode elemen hingga untuk
11
memperoleh hasil akhir berupa nilai dan distribusi tegangan pada seluruh titik elemen pada komponen. Penyelesaian persamaan dari berbagai macam pembebanan disusun dari penyelesaian dengan menghitung inverse matrik menggunakan teknik iterasi.
2.3. Korosi Peristiwa Elektrokimia di Alam
Korosi adalah suatu proses kerusakan logam atau material karena berinteraksi dengan lingkungan yang berlangsung secara kimia atau elektrokimia. Korosi mengembalikan logam kebentuk asalnya dan berlangsung dengan sendirinya, sehingga proses korosi tidak dapat dicegah hanya ada usaha untuk mengendalikannya.
2.3.1. Energi Bebas dan Potensial Listrik.
Bentuk energi sebagai penggerak yang menimbulkan korosi berasal dari energi kimia, yaitu energi yang tersimpan dalam ikatan-ikatan kimia zat yang disebut dengan energi dalam sistem. Hanya sebagian saja energi dalam ini yang siap menjadi energi berguna, misalnya untuk menggerakan motor atau untuk menjadi agen penghancur yang menimbulkan reaksi korosi. Energi yang tersedia ini disebut energi bebas.
Suatu reaksi dapat berlangsung dengan sendirinya, harus ada energi bebas yang di lepas, dalam hal ini energi bebas setiap unsur sebagai G dan perubahan energi netto dalam suatu reaksi dinyatakan dengan ΔG, maka perubahan G harus negatif persamaan (2.3), berikut ini:
+ → + ∆ °= − / ………(2.3)
12
Reaksi pada parameter baku ΔGo, temperatur 298 K dan tekanan 1 atm, untuk menghitung harga ΔG pada setiap temperatur (tidak dalam kesetimbangan) dapat dilakukan menggunakan persamaan berikut:
∆ = ∆ °+ [ ][ ]
[ ][ ] ………..(2.4)
Dimana:
∆ °= Perubahan energi netto baku (- X kJ/mol)
=[ ][ ]
[ ][ ] = Tetapan kesetimbangan
R = Konstanta gas universal, (8,3143 J mol-1K-1) T = Temperatur
Ekspresi yang mendefinisikan hubungan potensial listrik dengan energi bebas, dirumuskan oleh Michael Faraday menyatakan kerja yang dilakukan (perubahan energi bebas pada proses korosi) fungsi beda potensial dan muatan yang dipindahkan:
∆ = ………(2.5)
Dimana:
F = 96,494 coulomb/mol (muatan yang pindah oleh satu mol elektron) E = Potensial pengukuran (Volt)
z = Jumlah elektron yang dipindahkan dalam reaksi korosi.
Jika sistem mencapai suatu titik dimana perubahan energi bebas netto tidak ada maka sistem dalam keadaan setimbang, ΔG = 0. Pada keadaan baku hubungan ini menjadi:
∆ ° = − ………. (2.6)
13
2.3.2. Mekanisme Korosi - Tegangan
Korosi memainkan satu bagian penting dalam mekanisme pemicu terbentuknya pit permukaan baja nirkarat. Proses korosi pada dasarnya adalah proses elektrokimia, terjadi apabila terdapat perbedaan potensial listrik dan terbentuk aliran listrik dengan adanya bagian anodik, katodik dan lingkungan elektrolit pada permukaan logam.
Bagian anodik dapat berupa kehadiran konsentrasi tegangan bervariasi pada permukaan baja tersebut, metal yang berada di bawah film lapis oksida yang terkelupas atau terletak pada batas butir di mana terjadinya ketidak tepatan yang cukup lebar dari kristal metal grain lattice, atau komposisi metal pada permukaan yang kurang homogen. Pada bagian ini logam akan ter korosi dengan lingkungan, atom logam akan kehilangan elektron atau terjadi reaksi oksidasi.
Bagian katodik dapat berupa selapis tipis oksida metal akibat bereaksinya metal dengan zat asam, atau berupa kotoran - kotoran yang berada pada material. Pada bagian ini logam yang tidak ter korosi dengan lingkungan, pada atom logam terjadi penangkapan elektron oleh ion hidrogen (proses reduksi).
Lingkungan elektrolit merupakan larutan pengantar listrik yang menghubungkan anoda dengan katoda, dapat berupa larutan asam basa yang kontak dengan logam, air laut atau fluida yang mengandung garam-garaman. Air sebagai elektrolit konduktivitasnya ditentukan oleh temperatur air, kecepatan alir, komposisi air (air murni konduktivitas listriknya rendah) dan dengan penambahan kelarutan garam - garaman di dalam air dapat menaikkan konduktivitas.
14
Ketika tegangan yang bekerja pada struktur logam dalam suatu lingkungan korosif menjadi daerah anodik yang dominan. Maka bentuk korosi yang akan teramati adalah korosi jenis SCC, yaitu suatu kegagalan rapuh yang terjadi akibat kombinasi secara simultan antara beban tegangan statik dan lingkungan korosif.
Beberapa kombinasi paduan logam dan lingkungan yang menyebabkan resiko kegagalan, seperti baja lunak diketahui retak di lingkungan nitrat serta kaustik, sementara paduan-paduan alumunium ternyata retak hanya karena berada di udara yang lembab dan air laut. Paduan - paduan magnesium juga diketahui rentan terhadap keretakan di udara lembab.
Meskipun demikian tidak semua kombinasi lingkungan dan material akan berpengaruh terhadap SCC, seperti baja nirkarat akan retak di lingkungan yang mengandung ion klorida, tetapi tidak dalam lingkungan ammonia. Sedangkan logam bras akan retak di lingkungan ammonia, tetapi tidak akan terjadi SCC di lingkungan yang mengandung ion klorida (M.G. Fontana, 1979).
Lingkungan air laut, di kenal sangat korosif karena mengandung 3,5% garam, di dalamnya terdiri dari, 55% senyawa klorida, 7,7% senyawa sulfat, 30,6% sodium, dan lain-lain, dari komposisi tersebut dapat dipastikan bahwa komposisi air laut tersebut umumnya mengandung ion klorida.
Kasus SCC, terjadi pada penyambung tali temali di perahu, yang terbuat dari baja nirkarat AISI 304 dalam aplikasinya mengalami tegangan akibat proses penyambungan tali pada socket dan menahan beban dari tiang perahu. Kontaminasi garam yang mengandung ion klorida dan pengotor air merembes sepanjang kawat,
15
memasuki celah sempit sehingga garam berakumulasi, kombinasi tersebut menyebabkan SCC tak dapat dihindari. Gambar 2.4, memperlihatkan penyambung tali atau socket mengalami kerusakan akibat SCC.
Gambar 2.4. Kasus SCC Penyambung Tali Temali Pada Perahu.
Kegiatan tegangan tarik terhadap bahan akan menyerang kisi kristal menyebabkan ketidakteraturan dalam struktur kristal, yang semestinya dalam kesetimbangan, dan berakibat bangkitnya energi thermodinamika ikatan-ikatan atom, sehingga potensial anodik pada daerah ini meningkat. Karena tegangan pada metal yang peka, film oksida di permukaan pecah. Akibatnya terjadilah perbedaan potensial antar bagian terbuka yang menjadi anodik terhadap bagian yang terlindungi film oksida. Karena area anodik lebih kecil dibandingkan katodik, sehingga konsentrasi tegangan mencegah pembentukan film oksida (Cr2O3) di tempat tersebut, dengan
adanya elektrolit ini mempercepat reaksi selanjutnya.
Reaksi korosi pada daerah anoda yaitu reaksi oksidasi atau bagian logam yang ter korosi (daerah aktif) dengan persamaan reaksi:
16
Fe Fe 2+ + 2e- (oksidasi)………... (2.7) Zat hydrogen masuk larutan pengantar menjadi daerah katoda yaitu reaksi reduksi, bagian logam yang tidak ter korosi (daerah pasif) dengan persamaan reaksi:
O2 + 2H2O + 4e- 4OH - (reduksi) ………(2.8)
Ion-ion klorida dan ion hidroksil ini bereaksi dengan ion-ion besi menjadi: Fe2+ + 2Cl FeCl2 (tidak stabil) ……….(2.9)
FeCl2 + 2H2O Fe(OH)2 + 2HCl ………(2.10)
Apabila terdapat oksigen dalam air akan terjadi reaksi:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 ………(2.11)
2Fe(OH)3 Fe2 O3 + 3H2O ………..(2.12)
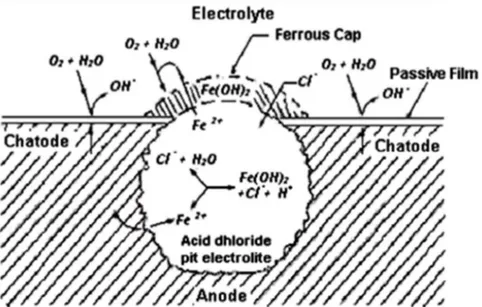
Elektroda besi yang anodik akan kehilangan massa karena melarutnya ion - ion Fe yang tidak stabil, karenanya elektroda besi berkarat dengan ditandai terjadinya kerusakan pada permukaannya dalam hal ini terbentuknya lubang, Gambar 2.5.
Gambar 2.5. Mekanisme Inisiasi Pit Korosi
17
Sekali terjadinya pit, konsentrasi tegangan pada lubang menjadi penyebab pecahnya film oksida di tempat tersebut dan sekaligus mencegah terjadinya film oksida lebih lanjut, karena itu proses sel korosi berjalan terus. Tegangan mempercepat pembentukan lubang yang akan berakumulasi
menjadi lebih cepat dan ini bertindak sebagai takik dan menyebabkan terjadinya pemusatan tegangan yang mendukung terjadinya SCC.
2.3.3. Polarisasi Elektrokimia
Suatu logam atau elektroda tidak berada dalam keseimbangan larutan elektrolit yang mengandung ionnya atau terjadi perubahan potensial selama proses elektrolisis, dimana potensial anoda menjadi lebih nobel dan katoda menjadi lebih aktif ini disebut polarisasi.
Terdapat dua jenis proses polarisasi, yaitu polarisasi aktivasi dan polarisasi konsentrasi. Polarisasi aktivasi adalah polarisasi yang dikendalikan oleh energi bebas atau tenaga penggerak potensial ada dipermukaan elektroda itu sendiri. Polarisasi konsentrasi adalah polarisasi yang dikendalikan sebagai akibat dari perubahan konsentrasi di dalam larutan di dekat permukaan metal. Polarisasi merupakan parameter penting untuk membuat pernyataan - pernyataan tentang laju proses korosi.
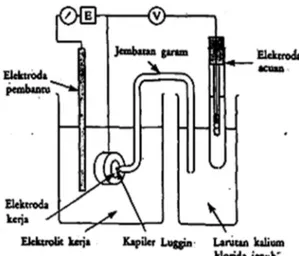
Kelakuan korosi bahan pada suatu sampel logam, ditentukan dengan mengaplikasikan potensial elektrokimia melalui pengukuran polarisasi dari kaitan antara arus dengan potensial di bawah kondisi terkontrol. Perangkat laboratorium untuk penelitian kuantitatif terhadap sifat-sifat korosi bahan digunakan sel tiga elektroda, yaitu suatu perangkat sel korosi basah yang telah baku.
18
Komponen ini terdiri dari beberapa peralatan seperti, elektroda kerja atau elektroda yang sedang di teliti, adalah medium penghantar dapat menjadi antar muka antar arus elektron dalam kawat rangkaian listrik dan arus ionik dalam larutan. Penggunaan istilah elektroda sebagai ganti dari anoda, karena tidak terbatas pada perilaku yang bersangkutan dengan anoda, juga akan menyelidiki perilaku katoda, skematik peralatan seperti Gambar 2.6.
Gambar 2.6. Komponen Sel Elektrokimia Tiga Elektroda
Elektroda acuan, dimaksudkan sebagai titik dasar yang tepat mengacu pada pengukuran-pengukuran potensial elektroda kerja. Arus yang mengalir dalam elektroda ini harus sekecil-kecilnya sehingga dapat diabaikan. Bila tidak demikian elektroda ini akan ikut dalam reaksi sel dan potensialnya tidak lagi konstan.
Pipa berisi elektrolit yang menghubungkan antara elektroda acuan dan elektroda uji disebut jembatan garam, gunanya untuk menyediakan lintasan ber kehantaran tinggi dari permukaan elektroda kerja ke elektroda acuan, sebuah kaca pipa kapiler dengan ujung sangat lancip yang harus ditempatkan pada permukaan
19
logam. Pipa kapiler ini menghubungkan bejana reaksi dengan sebuah bejana lain tempat elektroda kalomel jenuh (SCE) yang terpasang dan terisi dengan larutan kalium klorida jenuh bentuk gel.
Elektroda pembantu dimaksudkan khusus untuk mengangkut arus dalam rangkaian yang terbentuk dalam penelitian, elektroda ini tidak diperlukan untuk pengukuran potensial. Bahan yang digunakan tidak menimbulkan kontaminasi ion-ion ke dalam elektrolit seperti Platina.
Untuk mengoperasikan peralatan, mengalirkan respon arus sebagai fungsi dari potensial terapan. Data hasil pengukuran ini disusun dalam suatu tabel yang memuat harga -harga potensial yang diberikan (volt) dan kerapatan arus (amper per centimeter persegi), kemudian di plot dalam bentuk grafik yang menghasilkan konfigurasi kurva polarisasi Tafel, Gambar 2.7.
Gambar 2.7. Skema Empat Kurva Polarisasi Ekstrapolasi Tafel
20
Persamaan khusus untuk mencari laju korosi atau densitas arus disebut dengan persamaan Tafel, pada reaksi anoda dan katoda adalah sebagai berikut:
a = a log ia
/
io ………..(2.13) c = clogic/
io………(2.14) Dimana :io = Densitas arus pertukaran (A/cm2)
ia
,
ic = Densitas arus anodik, katodik (A/cm2) a,c = Konstanta anodik, katodik TafelMetode ini dapat dianggap lebih menguntungkan dari pada metode kehilangan berat karena dapat dilaksanakan lebih cepat, sehingga tidak memerlukan faktor akselerasi untuk pengukuran di laboratorium, dengan demikian hasilnya lebih akurat.
Laju korosi CR, adalah kehilangan berat per luas penampang per waktu periode (mpy). Hubungan densitas arus korosi dan laju korosi seperti persamaan 2.15 berikut ini:
= 1,248 × 10 (2.15) Dimana :
icor = Densitas arus korosi (A/m2).
M = Berat molekul (gr/mol).
F = Konstanta Faraday ( 96.490 coulomb/ekivalen).
Z = Valensi oksidasi (ekivalen/mol). D = Densitas metal (gr/cm2).
21
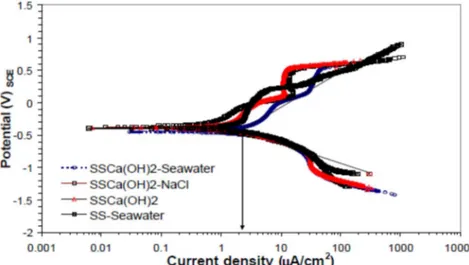
2.4. Kurva Polarisasi Baja Nirkarat AISI 304 di Lingkungan Air Laut
Pengukuran kurva polarisasi baja nirkarat austenitik AISI 304 di beberapa lingkungan air laut peniruan beton (J. Teran dkk, 2005).
Kurva hasil pengukuran, seperti Gambar 2.8, suatu zona korosi terjadi pada daerah ujung sempit, merupakan titik potong aktivitas korosi pada potensial korosi sekitar -380 mV. Penambahan Ca(OH)2 sebagai senyawa peniruan beton menurunkan
aktivitas korosi sebesar 33%. Densitas korosi dibebera lingkungan uji, Tabel 2.3.
Gambar 2.8. Kurva Polarisasi Baja AISI 304 Lingkungan Laut Peniruan Beton Tabel 2.3. Densitas korosi baja nirkarat lingkungan laut peniruan beton
Lingkungan Uji icor (A/cm2) CR (m/year)
SS + Ca(OH)2 0,375 4,32
SS + Ca(OH)2 + NaCl 0,625 7,2
SS + Ca(OH)2 + Seawater 14,186 16,34
SS + Seawater 4,275 49,25
22
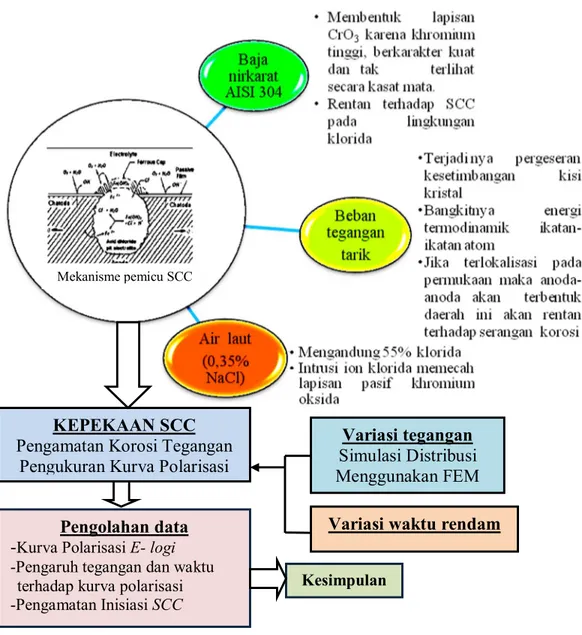
2.5. Kerangka Konsep
Kegagalan SCC struktur komponen baja nirkarat AISI 304 dalam lingkungan air laut diawali fase pemicuan pembentukan pit korosi. Kepekaan SCC berguna dipelajari untuk mengetahui dimana batas tegangan belum terjadi pembentukan lubang atau pit korosi, maka di susun kerangka konsep penelitian seperti Gambar 2.9.
Gambar 2.9. Kerangka Konsep Penelitian
Mekanisme pemicu SCC
Variasi tegangan Simulasi Distribusi Menggunakan FEM Variasi waktu rendam Pengolahan data
-Kurva Polarisasi E- logi
-Pengaruh tegangan dan waktu terhadap kurva polarisasi
-Pengamatan Inisiasi SCC
Kesimpulan
KEPEKAAN SCC Pengamatan Korosi Tegangan
Pengukuran Kurva Polarisasi