MORFOLOGI DAN MORFOMETRI SPERMATOZOA
KUCING DOMESTIK (Felis catus)
RADITYA NANDIASA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
RADITYA NANDIASA. Sperm Morphology and Morphometry of Domestic Cat (Felis catus). Under direction of R. IIS ARIFIANTINI and R. TAUFIQ PURNA NUGRAHA
The objective of the research was to study the sperm morphology and morphometry of domestic cat (Felis catus). Semen were obtained from five sexually mature cats using electroejaculator and evaluated macro- and microscopically. Semen samples were stained with carbofuchsin (William’s stains). Sperm morphology was assested from 200 cells for each sample in three times repetition. Sperm morphometry such as the length, width and head area and the length of midpiece and principal tail were counted in three times repetition using sperm morphology analyzed software (ImageJ) from 50 cells for each sample. Result of the research indicated that the primary and secondary abnormalities were 15.00 ± 3.11% and 7.97 ± 1.97% respectively. Headless and dag defect abnormalities were the most common primary and secondary abnormality that were found on all examined samples. The length, width and area of sperm head were 5.13 ± 0.20 µm, 3.01 ± 0.31 µm and 11.96 ± 1.68 µm. The length of midpiece and principal tail were 7.62 ± 0.22 µm and 38.72 ± 0.29 µm. The total sperm length was 51.47 ± 0.56 µm.
ABSTRAK
RADITYA NANDIASA. Morfologi dan Morfometri Spermatozoa Kucing Domestik (Felis catus). Dibimbing oleh R. IIS ARIFIANTINI dan R. TAUFIQ PURNA NUGRAHA
Penelitian ini bertujuan untuk menentukan nilai morfologi dan morfometri spermatozoa kucing domestik (Felis catus). Lima ekor kucing yang telah dewasa kelamin dikoleksi semennya menggunakan elektroejakulator. Semen dievaluasi secara makroskopis dan mikroskopis. Sampel semen diwarnai menggunakan pewarnaan carbofuchsin (William’s stain). Morfologi dievaluasi dari 200 sel untuk setiap sampel dengan tiga kali pengulangan. Morfometri spermatozoa dihitung menggunakan perangkat lunak ImageJ. Variabel yang diukur pada bagian kepala spermatozoa adalah panjang, lebar dan luas sedangkan untuk bagian ekor adalah panjang midpiece dan ekor bagian utama dari 50 sel untuk setiap sampel dengan tiga kali pengulangan. Hasil dari penelitian menunjukkan bahwa abnormalitas primer dan sekunder pada kucing domestik masing-masing adalah 15.00 ± 3.11% dan 7.97 ± 1.97%. Headless dan dag defect adalah abnormalitas yang paling banyak ditemukan pada semua sampel. Panjang, lebar dan luas daerah kepala spermatozoa berturut-turut adalah 5.13 ± 0.20 µm, 3.01 ± 0.31 µm dan 11.96 ± 1.68 µm. Panjang midpiece dan ekor bagian utama adalah 7.62 ± 0.22 µm dan 38.72 ± 0.29 µm. Panjang total spermatozoa adalah 51.47 ± 0.56 µm.
RADITYA NANDIASA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Morfologi dan Morfometri Spermatozoa Kucing Domestik (Felis catus) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2011
Raditya Nandiasa
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
LEMBAR PENGESAHAN
Judul Skripsi : Morfologi dan Morfometri Spermatozoa Kucing Domestik (Felis catus)
Nama : Raditya Nandiasa
NIM : B04070111
Disetujui,
Dr. R. Iis Arifiantini, M.Si Pembimbing I
drh. R. Taufiq Purna Nugraha, M.Si Pembimbing II
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala hikmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul Morfologi dan Morfometri Spermatozoa Kucing Domestik (Felis catus).
Terima kasih penulis ucapkan kepada:
1. Keluarga atas dukungannya secara moril dan materil.
2. Dr. R. Iis Arifiantini, M.Si dan drh. R. Taufiq Purna Nugraha selaku dosen pembimbing atas arahan, nasehat dan pengalaman yang diberikan.
3. Bondan Achmadi, SE dan staf Depertemen Klinik, Reproduksi dan Patologi atas setiap bantuannya.
4. Angeline Budiawan dan Fajriati Rafelia Hapsari sebagai teman sepenelitian atas jerih payahnya dalam menyelesaikan rangkaian penelitian, penulisan skripsi dan seminar bersama-sama.
5. Yanotama Tirta Laksana yang selalu mendampingi sepanjang suka dan duka pengerjaan tugas akhir serta telah memberikan bantuan dalam segala hal, motivasi dan kasih sayang yang berlimpah.
6. Keluarga besar UKM PMK IPB atas setiap doa, dukungan, penguatan, persaudaraan, dan persekutuan yang indah yang selalu hadir.
7. Keluarga besar Gianuzzi 44 atas dorongan semangat dan persahabatan yang spesial.
Penulis mengharapkan agar skripsi ini dapat bermanfaat bagi berbagai pihak yang membutuhkan dan memperkaya informasi di bidang reproduksi hewan.
Bogor, September 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 30 Juni 1989 dari ayah Wishnu Santoso dan ibu Yani Wijaya. Penulis merupakan putri pertama dari dua bersaudara. Penulis memulai jenjang sekolah pada tahun 1995 di SD PSKD kwt. VIII di Depok, kemudian melanjutkan sekolah ke SMP 6 PSKD di Depok. Setelah lulus SMP, penulis melanjutkan pendidikan ke SMA Negeri 1 Depok.
Tahun 2007 penulis lulus dari SMAN 1 Depok dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan mayor Kedokteran Hewan.
Selama menjalani program S1, penulis tergabung dalam Unit Kegiatan Mahasiswa (UKM) Agria Swara pada tahun ajaran 2007/2008 dan UKM Persekutuan Mahasiswa Kristen Institut Pertanian Bogor (PMK IPB) selama tahun ajaran 2007/2008 hingga 2010/2011. Dalam UKM PMK IPB penulis menjabat sebagai Wakil Koordinator I Bidang Pembinaan Komisi Pelayanan Anak (2009/2010) dan Koordinator Kelompok Pra-alumni (2010/2011).
DAFTAR ISI
Halaman
DAFTAR ISI ………..…………. i
DAFTAR TABEL .. …….………...……….. ii
DAFTAR GAMBAR ……… iii
PENDAHULUAN ……… 1
Latar Belakang ………..………...… 1
Tujuan ……… 2
TINJAUAN PUSTAKA ………. 3
Tinjauan Umum Kucing Domestik ……….... 3
Organ Reproduksi Kucing ………. 4
Spermatogenesis ……… 5
Morfologi Spermatozoa …….……….... 7
Morfometri Spermatozoa ….………... 8
Pewarnaan Spermatozoa….………... 9
BAHAN DAN METODE……… 10
Waktu dan Tempat Penelitian ………... 10
Metode Penelitian …..……….... 10
Persiapan Kucing ……….. 10
Koleksi Semen dengan Elektroejakulator ………. 10
Karakteristik Semen ………... 11
Morfologi dan Morfometri Spermatozoa ……….. 11
Analisis Data ………. 12
HASIL DAN PEMBAHASAN ………... 13
Karakteristik Semen Segar Kucing Domestik ……….... 13
Morfologi dan Morfometri Spermatozoa Kucing Domestik ………... 14
SIMPULAN ………. 23
DAFTAR PUSTAKA ……….. 24
ii
DAFTAR TABEL
Halaman 1 Karakteristik semen kucing domestik yang dikoleksi
menggunakan elektroejakulator ………. 14 2 Morfologi kepala dan ekor spermatozoa kucing domestik
yang dikoleksi menggunakan elektroejakulator ………. 15 3 Persentase abnormalitas primer spermatozoa kucing domestik
yang dikoleksi menggunakan elektroejakulator ………. 18 4 Persentase abnormalitas sekunder spermatozoa kucing domestik
yang dikoleksi menggunakan elektroejakulator ………. 20 5 Hasil pengukuran morfometri spermatozoa kucing domestik
yang dikoleksi menggunakan elektroejakulator ………. 21 6 Morfometri spermatozoa dari beberapa mamalia ……….. 21
DAFTAR GAMBAR
Halaman
1 Kucing domestik ………... 4
2 Testis kucing dari sisi lateral ……….. 4
3 Penis kucing ……….. 5
4 Morfologi spermatozoa dari beberapa mamalia ……… 8
5 Variabel morfometri sel spermatozoa ……… 12
PENDAHULUAN
Latar BelakangKucing merupakan salah satu hewan karnivora yang banyak dipelihara sebagai hewan kesayangan. Kucing terutama kucing keturunan murni (pure breed) sering dikembangbiakan oleh karena itu dibutuhkan penelitian-penelitan mengenai reproduksi hewan tersebut. Selain itu, penelitian terhadap aspek reproduksi kucing penting untuk melestarikan jenis-jenis kucing yang terancam punah. Penelitian reproduktif ini akan lebih menguntungkan jika menggunakan hewan model, yaitu kucing domestik (Felis catus).
Fertilitas kucing jantan dan betina menentukan keberhasilan proses reproduksi. Penelitian-penelitian sebelumnya melaporkan bahwa abnormalitas spermatozoa yang tinggi pada kucing dapat menurunkan kemampuannya untuk penetrasi oosit in vitro, dibandingkan dengan spermatozoa dari pejantan dengan tingkat abnormalitas yang rendah (Howard et al. 1993). Salah satu cara mengetahui fertilitas kucing jantan adalah menguji kualitas semennya. Pengujian kualitas semen dapat dilakukan secara makroskopis ataupun mikroskopis. Pengujian makroskopis terdiri dari penilaian terhadap volume, konsistensi, warna, dan pH semen. Pengujian mikroskopis meliputi gerakan individu, gerakan massa, motilitas, konsentrasi, viabilitas, serta morfologi spermatozoa.
Morfologi spermatozoa menggambarkan bentuk spermatozoa. Morfologi spermatozoa telah banyak dilaporkan pada berbagai hewan diantaranya pada kancil (Najamudin 2010), kerbau (Arifiantini & Ferdian 2006), sapi bali (Arifiantini et al. 2006a), sapi potong (Arifiantini et al. 2010), sapi perah (Purwantara et al. 2010), dan kuda (Morrell et al. 2008).
Spermatozoa terdiri atas bagian kepala dan ekor dan mempunyai ukuran yang berbeda untuk masing-masing spesies (Gage & Freckleton 2003). Ukuran-ukuran spermatozoa tersebut dikenal dengan istilah morfometri spermatozoa. Informasi mengenai morfometri spermatozoa semen segar penting untuk diketahui agar perubahan morfometri pada saat proses preservasi dapat diketahui. Morfometri spermatozoa telah dilaporkan diantaranya pada sapi bali (Arifiantini et al. 2006b), kelelawar (Nugraha 2010) dan kuda (Hidalgo et al. 2005).
Tujuan
Mengingat informasi mengenai morfologi dan morfometri spermatozoa kucing belum banyak dilaporkan, penelitian ini bertujuan untuk menentukan nilai morfologi dan morfometri spermatozoa kucing domestik (Felis catus) yang dikoleksi menggunakan elektroejakulator.
TINJAUAN PUSTAKA
Tinjauan Umum Kucing DomestikKucing domestik (Felis catus, Linneaus 1758) (Gambar 1) menempati sebagian besar penjuru dunia. Bukti arkeologi menunjukkan domestikasi kucing terjadi di Near East sekitar 9000 hingga 10 000 tahun yang lalu namun inisiasi domestikasi mungkin dimulai ribuan tahun yang lalu saat manusia dan nenek moyang kucing menjadi semakin saling tergantung. Proses domestikasi mungkin dimulai selama periode ketika manusia berhenti berburu kawanan hewan liar dan mengadopsi lebih banyak gaya hidup pertanian. Perubahan ini terjadi 10 000 sampai dengan 11 000 tahun yang lalu dan dimungkinkan oleh domestikasi serealia liar tertentu dan rumput-rumputan yang menyebabkan manusia membutuhkan kucing untuk mengontrol tikus yang merusak tanaman (Lipinski et al. 2007). Menurut Wastlhuber (1991) kucing domestik yang ada sekarang ini kemungkinan merupakan evolusi dari kucing liar Afrika (F. silvestris lybica) di zaman Mesir kuno sekitar 3000 hingga 4000 tahun lampau.
Meskipun banyak kucing telah dipelihara, kucing tidak sepenuhnya kehilangan kemampuannya untuk berburu sehingga sifat kucing pada saat ini bervariasi, yaitu dari tidak dapat dijinakkan hingga sangat lembut (Lipinski et al. 2007). Adapun klasifikasi kucing menurut Linneaus (1758) adalah :
Kingdom : Animalia Filum : Chordata Kelas : Mammalia Ordo : Carnivora Famili : Felidae Genus : Felis Spesies : Felis catus
Gambar 1 Kucing domestik. Organ Reproduksi Kucing
Alat kelamin jantan pada kucing terbagi dalam empat subbagian seperti karnivora pada umumnya. Subbagian pertama meliputi testis, epididimis, duktus deferens, korda spermatikus, dan tunika. Subbagian kedua terdiri dari kelenjar-kelenjar asesoris, subbagian ketiga penis, dan yang terakhir uretra.
Testis kucing (Gambar 2) turun dan menempati skrotum antara minggu kedua dan ketiga setelah kelahiran. Epididimis melekat pada perbatasan dorsolateral dari testis. Kaput epididimis dimulai dari medial permukaan testis, namun saat mencapai posisi dorsolateral dilanjutkan menjadi korpus dan kauda. Duktus deferens merupakan saluran berdinding otot tebal dan berfungsi menyalurkan sperma dari kauda epididimis ke dalam uretra (Schatten & Constantinescu 2007).
Gambar 2 Testis kucing dari sisi lateral (Schatten & Constantinescu 2007).
korda spermatikus duktus deferens
korpus epididimis
testis arteri testikuler
5
Kelenjar asesoris yang berkembang pada kucing adalah kelenjar prostat dan bulbouretralis sedangkan kelenjar vesikular tidak berkembang. Kelenjar prostat memiliki dua bagian yaitu bagian badan dan diseminasi. Kelenjar bulbouretralis bentuknya sangat kecil (memiliki diameter lebih dari 5 mm) (Schatten & Constantinescu 2007).
Penis pada kucing (Gambar 3) berada di ventral skrotum. Penis disusun oleh dua buah korpora cavernosa, satu pada tiap sisi dan sebuah korpus spongiosum yang berada di tengah. Pejantan dewasa memiliki glans penis pada bagian ujung penis dengan panjang 5 sampai dengan 10 mm, berbentuk kerucut yang mengarah ke kaudal dan memiliki 120 hingga 150 buah duri penis (penile spines). Peran duri pada proses kopulasi belum diketahui secara pasti namun diperkirakan duri ini berfungsi memberikan stimulasi seksual pada jantan atau betina, menghalangi penarikan penis dari vagina atau meningkatkan stimulasi betina untuk induksi ovulasi. Os penis pada kucing berukuran panjang 3 sampai dengan 5 mm dan berada di ujung glans penis pada kucing jantan dewasa (Johnston et al. 2001).
Gambar 3 Penis kucing (Schatten & Constantinescu 2007). Spermatogenesis
Spermatozoa dihasilkan dari stem sel (sel induk) melalui suatu siklik dan proses yang terorganisir serta kompleks. Proses ini disebut spermatogenesis dan terjadi di dalam tubulus seminiferus dari hewan yang dewasa seksual. Pembentukan spermatozoa adalah salah satu sistem pembaharuan paling produktif yang terjadi dalam tubuh hewan. Setiap hari jutaan spermatozoa diproduksi dari induk spermatogonium (Costa et al. 2006).
papila kerucut
Proses perkembangan sel germinal jantan dari spermatogonia menjadi spermatozoa disebut spermatogenesis. Perkembangan ini terjadi di dalam tubuli seminiferi. Spermatogenesis terbagi menjadi tiga fase, yaitu spermatositogenesis (tahap proliferasi; Costa et al. 2006), meiosis dan spermiogenesis (tahap diferensiasi; Costa et al. 2006). Proses spermatositogenesis diawali dengan perkembangan sel-sel germinal primordial menjadi spermatogonia tipe A yang diploid. Sel-sel ini tetap berada dekat membran basal dan selanjutnya akan membelah. Spermatogonia tipe A secara ekstrim tahan terhadap paparan toksik dan apabila diperlukan dapat membentuk kembali sel germinal di dalam tubuli seminiferi. Beberapa spermatogonia tipe A berdiferensiasi menjadi spermatogonia tipe B diploid yang selanjutnya akan berdiferensiasi menjadi spermatosit primer (spermatosit I) diploid. Sel spermatosit primer adalah produk akhir dari proses spermatositogenesis (Schatten & Constantinescu 2007).
Selama fase meiosis, materi genetik spermatosit diduplikasi, direkombinasi dan dipisahkan (Costa et al. 2006). Proses ini terdiri dari dua tahap, yaitu meiosis I yang mengubah spermatosit primer menjadi spermatosit sekunder (spermatosit II) dan meiosis II yang mengubah spermatosit sekunder menjadi spermatid haploid. Spermatosit sekunder sulit ditemukan pada preparat histologi karena keberadaannya langsung menginisiasi terjadinya meiosis II (Schatten & Constantinescu 2007).
Tahap akhir spermatogenesis disebut spermiogenesis yang mencakup pengembangan dari spermatid dengan bentuk membulat menjadi spermatozoa yang berbentuk memanjang dan siap untuk keluar dari tubulus seminiferus (Schatten & Constantinescu 2007). Empat peristiwa utama terjadi sebagai bagian dari tahap ini, yaitu fase golgi, fase tudung, fase akrosom, dan fase pematangan. Di akhir tahap spermiogenesis, spermatozoa yang telah matang disimpan dalam epididimis dan menunggu hingga dapat keluar dari tubuh jantan untuk melaksanakan fungsi reproduktifnya, yaitu membuahi oosit (Theunissen 2011).
Meskipun proses spermatogenesis mirip dalam semua mamalia, terdapat karakteristik khusus antar spesies dalam hubungannya dengan kronologi peristiwa, proporsi volumetrik yang dihasilkan oleh komponen parenkim testis, jumlah generasi spermatogonium, populasi sel di tubulus seminiferus, produksi
7
sperma harian, tingkat sel sertoli, dan hasil spermatogenesis secara umum (Costa et al. 2006).
Morfologi Spermatozoa
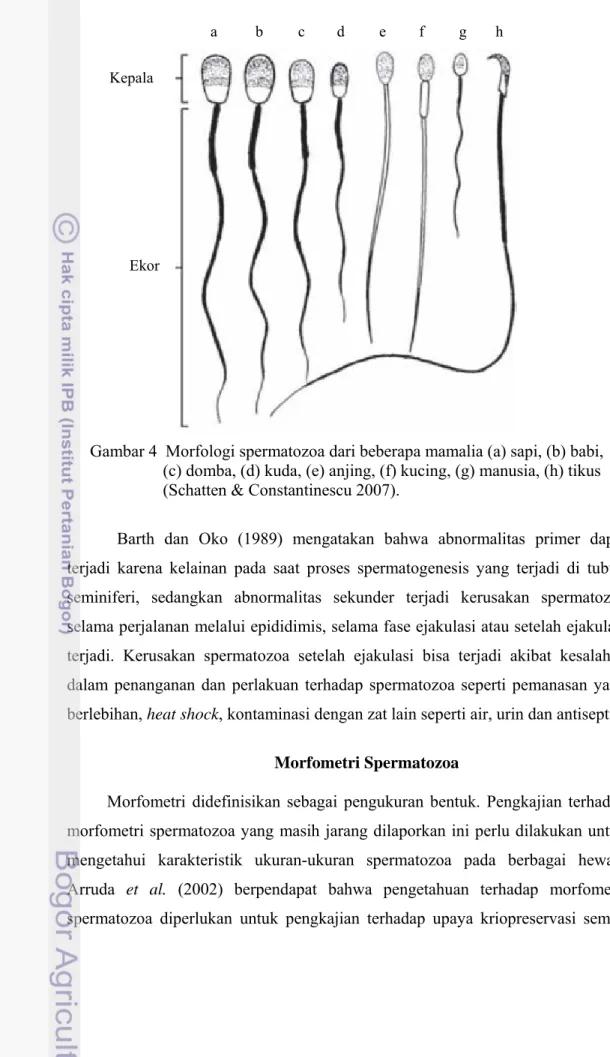
Spermatozoa pada hewan mamalia merupakan sel panjang yang motil. Sebuah sel sperma memiliki kepala dan ekor (Gambar 4). Kepala terdiri dari sebuah nukleus dengan kepadatan tinggi, kromatin kental yang diselimuti teka perinuklear, sebuah akrosom dan membran plasma. Fungsi utama dari bagian kepala adalah untuk penetrasi pada oosit, membawa genom haploid jantan, dan inisiasi perkembangan embrionik setelah fertilisasi.
Ekor dapat terbagi menjadi bagian penghubung (connecting piece), bagian tengah (midpiece), bagian utama (principle piece), dan bagian ujung (end-piece). Bagian penghubung merupakan bagian rangkaian penghubung yang pendek antar kepala dengan ekor yang terdiri dari segmen-segmen, jaringan fibrosa dan kapitulum. Bagian tengah berfungsi sebagai membran pelindung mitokondria yang merupakan pengatur energi untuk motilitas sperma. Bagian ini dimulai dari distal bagian penghubung sampai annulus (struktur yang membatasi bagian tengah dengan bagaian utama). Bagian utama ekor merupakan daerah yang dimulai dari annulus sampai ujung ekor. Secara keseluruhan, ekor berguna untuk mendorong spermatozoa bergerak melalui uterus dan tuba falopii hingga bertemu dan berpenetrasi pada oosit (Schatten & Constantinescu 2007).
Berdasarkan kejadiannya, abnormalitas morfologi spermatozoa dapat dibedakan menjadi abnormalitas primer dan sekunder. Abnormalitas morfologi juga dapat dibagi berdasarkan dampaknya, yaitu abnormalitas mayor dan minor. Abnormalitas primer terjadi pada bagian kepala, bersifat genetik dan berdampak mayor terhadap fertilitas sedangkan abnormalitas sekunder umumnya terjadi pada bagian ekor dan mudah terseleksi pada pengujian motilitas (Arifiantini et al. 2010).
Gambar 4 Morfologi spermatozoa dari beberapa mamalia (a) sapi, (b) babi, (c) domba, (d) kuda, (e) anjing, (f) kucing, (g) manusia, (h) tikus (Schatten & Constantinescu 2007).
Barth dan Oko (1989) mengatakan bahwa abnormalitas primer dapat terjadi karena kelainan pada saat proses spermatogenesis yang terjadi di tubuli seminiferi, sedangkan abnormalitas sekunder terjadi kerusakan spermatozoa selama perjalanan melalui epididimis, selama fase ejakulasi atau setelah ejakulasi terjadi. Kerusakan spermatozoa setelah ejakulasi bisa terjadi akibat kesalahan dalam penanganan dan perlakuan terhadap spermatozoa seperti pemanasan yang berlebihan, heat shock, kontaminasi dengan zat lain seperti air, urin dan antiseptik.
Morfometri Spermatozoa
Morfometri didefinisikan sebagai pengukuran bentuk. Pengkajian terhadap morfometri spermatozoa yang masih jarang dilaporkan ini perlu dilakukan untuk mengetahui karakteristik ukuran-ukuran spermatozoa pada berbagai hewan. Arruda et al. (2002) berpendapat bahwa pengetahuan terhadap morfometri spermatozoa diperlukan untuk pengkajian terhadap upaya kriopreservasi semen
Kepala
Ekor
9
mengingat terdapat perbedaan yang signifikan terhadap ukuran spermatozoa semen segar dengan semen yang telah mengalami kriopreservasi.
Panjang spermatozoa manusia dan hewan domestik secara umum adalah sekitar 50 µm sedangkan spermatozoa rodensia dapat mencapai panjang 100 hingga 250 µm. Hewan mamalia yang memiliki spermatozoa terpanjang adalah Homey opossum (Tarsipens rostratus), yaitu sepanjang 350 µm (Schatten & Constantinescu 2007).
Pewarnaan Spermatozoa
Pewarnaan yang umum digunakan untuk spermatozoa adalah eosin, eosin-nigrosin (EN) dan William’s. Eosin merupakan zat warna dengan sifat asam dan termasuk ke dalam kelompok molekul yang memiliki cincin kuinoid yang ditautkan pada cincin non-kuinoid melalui atom-atom C dan O. Pewarnaan EN merupakan pewarnaan ganda untuk memberikan efek kontras sehingga memberi batas yang jelas pada sel. Zat warna dasar yang digunakan dalam pewarnaan William’s adalah basic fuchsin dan eosin. Baik basic fuchsin, yang merupakan zat warna yang termasuk dalam golongan trifenil metan, maupun eosin dapat mewarnai sitoplasma (Gunarso 1989).
Salah satu pewarnaan yang sering digunakan untuk spermatozoa adalah pewarnaan William’s. Pewarnaan ini mempunyai kelebihan dalam hal kejernihan hasil yang didapatkan sehingga pengamatan morfologi dan morfometri spermatozoa dapat dilakukan dengan mudah. Selain itu pewarnaan ini tidak perlu dilakukan bersamaan dengan evaluasi semen. Preparat ulas yang dikeringudarakan dari sampel yang ada dapat langsung diwarnai atau didiamkan dalam waktu yang cukup lama. Kekurangan pewarnaan William’s adalah tidak dapat digunakan untuk membedakan dan menghitung jumlah spermatozoa yang hidup dan mati seperti pada pewarnaan eosin-nigrosin (Arifiantini 2006a).
Penelitian ini dilaksanakan pada bulan Oktober 2010 hingga Juni 2011 di Unit Rehabilitasi Reproduksi, Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Laboratorium Reproduksi, Bagian Zoologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor. Kucing dipelihara dalam kandang individual di Rumah Sakit Hewan Institut Pertanian Bogor selama penelitian berlangsung.
Metode Penelitian Persiapan kucing
Lima ekor kucing domestik yang digunakan dalam penelitian ini memiliki bobot 3 sampai dengan 4 kg dan diperoleh di daerah Bogor. Sebelum dikoleksi semennya, kucing diadaptasikan selama satu bulan, diperiksa kesehatannya secara klinis dan dari gambaran darah, diberi obat cacing, campuran kuning telur dan madu, serta vitamin. Selama proses penelitian, kucing diberikan pakan kering (My Dear Cat®) dua kali sehari masing-masing sebanyak 50 g dan minum ad libitum.
Koleksi semen dengan elektroejakulator
Kucing dipuasakan selama 12 jam sebelum dilakukan pembiusan menggunakan kombinasi ketamine HCl dan diazepam secara intravena pada vena cephalica antibrachii dorsalis kanan atau kiri. Setelah kucing terbius, bagian preputium dibersihkan dengan kapas yang telah dibasahi dengan NaCl fisiologis untuk mencegah semen terkontaminasi kotoran. Koleksi semen dilakukan dengan elektroejakulator (Fujihira Industry, Jepang) dan mengadopsi teknik Howard et al. (1990). Probe elektroejakulator diberi pelumas berupa gel dan dimasukkan secara perlahan ke dalam anus dan diarahkan ke bagian ventral tubuh (sekitar 7 sampai dengan 9 cm). Setiap kucing dikoleksi semennya sebanyak tiga kali dengan waktu antar koleksi satu minggu.
11
Karakteristik semen
Karakteristik semen dievaluasi secara makroskopis dan mikroskopis. Pengujian makroskopis terdiri atas penilaian terhadap volume, konsistensi, warna, dan pH semen (pH special indicator paper). Pengujian mikroskopis meliputi gerakan individu (scoring 0 sampai dengan 5), motilitas spermatozoa (0 hingga 100%), konsentrasi spermatozoa/mL (Neubauer chamber), dan viabilitas (persentase spermatozoa hidup dan mati).
Morfologi dan morfometri spermatozoa
Morfologi spermatozoa dinilai dengan pewarnaan carbofuchsin atau William’s stain (Arifiantini et al. 2006a). Satu tetes semen segar dibuat preparat ulas dan dikeringudarakan. Pewarnaan dilakukan sekaligus pada seluruh sampel dengan cara difiksasi di atas bunsen, direndam dalam alkohol absolut selama 4 menit dan dikeringudarakan. Selanjutnya preparat dicelupkan berulang kali dalam larutan chloramin 0.5% selama 1 sampai 2 menit atau hingga mukus hilang dan ulasan terlihat jernih, dicuci dalam air destilasi, dicelupkan dalam alkohol 95% dan diwarnai dengan carbofuchsin selama 8 hingga 10 menit. Preparat yang telah diwarnai dicuci dengan air mengalir hingga ulasan terlihat jernih dan dikeringkan.
Morfologi spermatozoa dihitung dari 200 spermatozoa menggunakan mikroskop (Olympus CH 20) dengan pembesaran 1000 X. Kelainan morfologi kepala diantaranya adalah pearshape (kepala berbentuk buah pir), narrow (kepala menyempit), narrow at the base (kepala menyempit di bagian post akrosom), headless (tanpa kepala), abaxial (posisi ekor tidak di tengah), undeveloped (kepala tidak berkembang), microcephalus (kepala kecil), macrocephalus (kepala besar), diadem (kepala berlubang di bagian nukleus), knobbed acrosome (KA) defect (bagian akrosom melekuk ke arah dalam atau luar), round head (kepala membulat), double head (kepala ganda), detached head (kepala patah atau terlepas), dan abnormal contour (kelainan pada kontur kepala). Kelainan morfologi ekor termasuk tailless (tanpa ekor), bent tail (ekor melipat), coiled tail (ekor menggulung), dan dag defect (ekor menggulung di bawah kepala). Persentase spermatozoa yang abnormal adalah jumlah spermatozoa abnormal
(kepala dan ekor) dibagi total spermatozoa (jumlah spermatozoa normal dan abnormal) dikali 100%.
Pengukuran morfometri spermatozoa dapat dilakukan dengan bantuan perangkat lunak imageJ ver 1.43h (http://rsb.info.nih.gov.ij/). Preparat ulas yang sudah diwarnai, diamati dan difoto mengunakan mikroskop (Nikon Optihot-2, Jepang) yang dilengkapi dengan kamera digital (Canon PS S5IS, Jepang) dengan pembesaran lensa objektif 100 X (Nugraha 2010). Sebanyak 50 spermatozoa per sampel dilakukan analisis yang meliputi panjang kepala, lebar kepala, area kepala, panjang ekor bagian tengah (midpiece), panjang ekor (utama dan akhir) dan panjang total sperma (Gambar 1). Semua pengukuran dilakukan dalam satuan mikrometer (µm).
Gambar 5 Variabel morfometri sel spermatozoa. panjang kepala (a), lebar kepala (b), area kepala (c), panjang ekor bagian tengah (midpiece) (d), panjang ekor (utama dan akhir) (e) dan panjang total sperma (a, d dan e) (Arifiantini et al. 2006b).
Analisis Data
Data disampaikan dalam bentuk rataan dan simpangan baku dari tiga kali pengulangan untuk setiap sampel.
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar Kucing DomestikPengujian kualitas semen segar diawali dengan pengujian secara makroskopis. Semen kucing yang dikoleksi dengan elektroejakulator memiliki konsistensi encer-sedang dan warna putih keruh. Semen dengan konsentrasi spermatozoa yang tinggi akan mempunyai warna yang lebih putih dibandingkan dengan semen yang memiliki konsentrasi spermatozoa lebih rendah. Warna kekuningan tampak pada semen yang terkontaminasi urin dan terkadang warna kekuningan tersebut dapat muncul pada semen yang dikoleksi dengan elektroejakultor terutama dengan voltase tinggi (Axnér & Linde-Forsberg 2002). Semen kucing domestik memiliki volume senilai 59.00 ± 12.45 µL. Derajat keasaman (pH) semen yang diperoleh dalam penelitian ini (7.26 ± 0.43) termasuk dalam kisaran normal, yaitu 6.60 hingga 8.80 (Axnér & Linde-Forsberg 2002).
Pengamatan terhadap karakteristik semen segar secara mikroskopis pada penelitian ini menghasilkan nilai motilitas, gerakan individu, viabilitas, dan konsentrasi spermatozoa. Persentase spermatozoa yang motil (bergerak secara progresif) diperoleh sebesar 72.00 ± 13.04%. Menurut Axnér dan Linde-Forsberg (2002), motilitas spermatozoa pada kucing sangat bervariasi. Axnér dan Linde-Forsberg (2002) menyatakan kisaran persentase motilitas spermatozoa kucing senilai 56 hingga 84% sedangkan Howard et al. (1990) menilai lebih tinggi, yaitu 84.40 ± 5.90%. Gerakan spermatozoa juga dapat dinilai secara individu dengan skala 0 sampai 5. Skala 0 menyatakan tidak ada pergerakan sama sekali dan skala 5 menyatakan adanya gerakan yang sangat cepat ke arah depan (Axnér & Linde-Forsberg 2002). Dalam penelitian ini diperoleh nilai gerakan individu sebesar 4.60 ± 0.55. Howard et al. (1990) mendapatkan nilai gerakan individu sebesar 4.20 ± 0.30 dalam penelitiannya.
Nilai viabilitas dan konsentrasi spermatozoa yang diperoleh dalam penelitian ini secara berurutan adalah 85.46 ± 8.51% dan 608.00 ± 598.74 x 106/mL (Tabel 1). Seperti motilitas, konsentrasi spermatozoa juga sangat bervariasi. Axnér dan Linde-Forsberg (2002) menyatakan kisaran konsentrasi spermatozoa kucing yang dikoleksi dengan elektroejakulator adalah sebesar 168
hingga 361 x 106/mL sedangkan konsentrasi spermatozoa yang dikoleksi dengan vagina buatan ada dalam kisaran 96 hingga 5101 x 106/mL.
Tabel 1 Karakteristik semen kucing domestik yang dikoleksi menggunakan elektroejakulator
Parameter Rata-rata
Makroskopis
Konsistensi Encer-sedang Warna Putih keruh Volume (µL) 59.00 ± 12.45
pH 7.26 ± 0.43
Mikroskopis Motilitas (%) 72.00 ± 13.04
Gerakan individu (scoring 0-5) 4.60 ± 0.55 Viabilitas (%) 85.46 ± 8.51 Konsentrasi (juta/mL) 608.00 ± 598.74
Morfologi dan Morfometri Spermatozoa Kucing Domestik
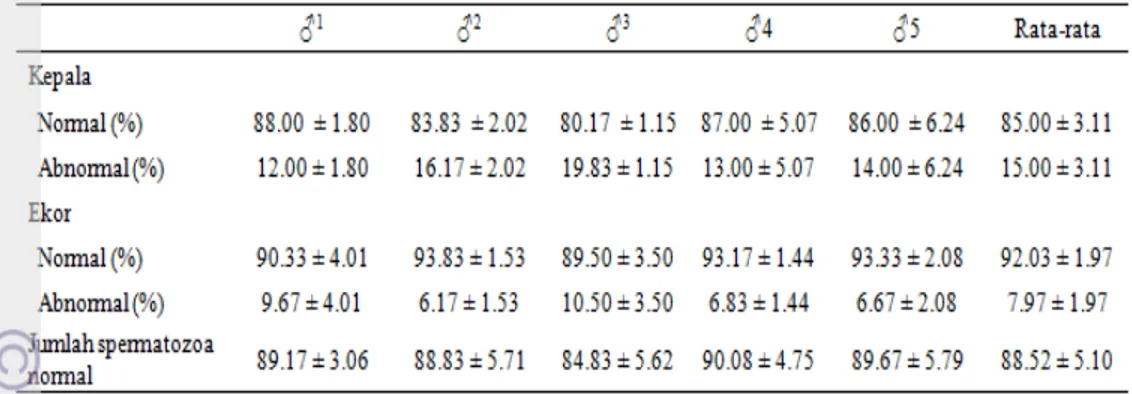
Abnormalitas morfologi dapat digolongkan menjadi abnormalitas primer (pada bagian kepala) dan abnormalitas sekunder (pada bagian ekor). Hasil penelitian ini menunjukkan morfologi kepala spermatozoa yang normal adalah 85.00 ± 3.11%, berkisar antara 79.00 hingga 92.50% sedangkan morfologi ekor spermatozoa yang normal adalah 92.03 ± 1.97% dengan kisaran 85.50 sampai dengan 95.50% (Tabel 2). Axnér dan Linde-Forsberg (2002) mengkaji laporan dari beberapa peneliti dan menyimpulkan bahwa jumlah abnormalitas spermatozoa pada kucing berkisar antara 38.20 sampai dengan 90.00%. Howard et al. (1993) mendefinisikan istilah normospermik bagi kucing jantan dewasa yang menghasilkan spermatozoa dengan morfologi normal lebih dari 60% per ejakulat dan teratospermik bagi pejantan dewasa yang memproduksi spermatozoa dengan morfologi normal kurang dari 40% per ejakulat. Axnér et al. (1997) dalam penelitiannya memperoleh tingkat abnormalitas kepala, kerusakan akrosom, abnormalitas akrosom, dan abnormalitas midpiece spermatozoa kucing masing-masing sebesar 14.70 ± 7.00%, 2.40 ± 4.60%, 1.80 ± 1.30%, dan 5.10 ± 5.70%.
15
Tabel 2 Morfologi kepala dan ekor spermatozoa kucing domestik yang dikoleksi menggunakan elektroejakulator
♂1: jantan 1, ♂2: jantan 2, ♂3: jantan 3, ♂4: jantan 4, ♂5: jantan 5
Axnér dan Linde-Forsberg (2002) menyatakan bahwa morfologi spermatozoa kucing sangat dipengaruhi oleh variasi individu dan cara fiksasi. Pengelompokan jenis abnormalitas pun berbeda-beda antar peneliti. Selain itu, teknik pembuatan preparat, seperti jenis pewarnaan yang digunakan dapat mempengaruhi identifikasi morfologi. Kelainan bentuk kepala seperti pear shaped, narrow, narrow at the base, abnormal contour, undeveloped, dan kepala dengan ukuran abnormal (microcephalus atau macrocephalus) lebih mudah terlihat dengan preparat yang diwarnai sedangkan kelainan seperti knobbed acrosome (KA) defect, detached head, abaxial, dan kelainan-kelainan pada ekor lebih mudah dinilai dengan preparat basah (Axnér & Linde-Forsberg 2002).
Morfologi spermatozoa juga dipengaruhi oleh teknik koleksi semen (Axnér et al. 1998). Semen yang dikoleksi menggunakan elektroejakulator memiliki jumlah abnormalitas sekunder lebih tinggi dibandingkan dengan semen yang dikoleksi langsung dari kauda epididimis. Tingkat abnormalitas juga berbeda antara ejakulat satu dan kedua meskipun dilakukan dalam waktu pembiusan yang sama (Axnér et al. 1997).
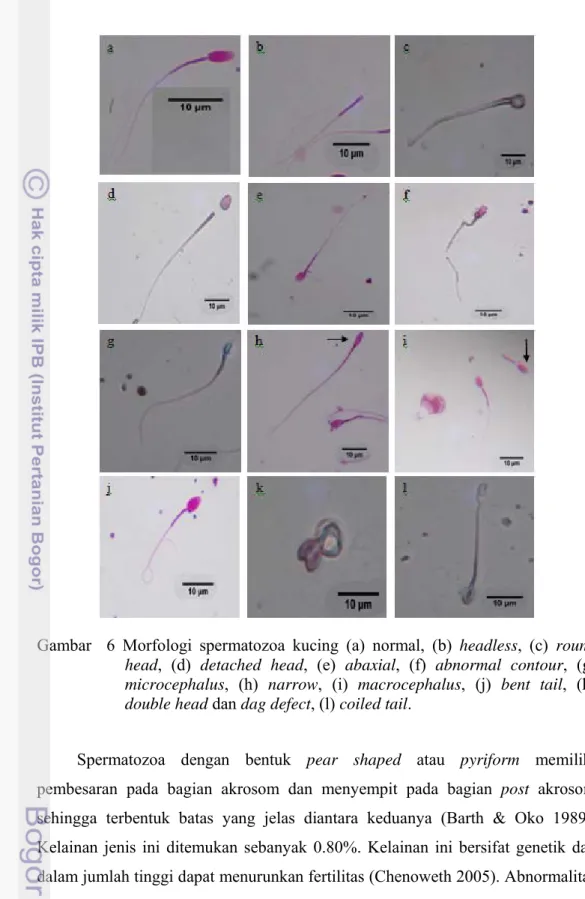
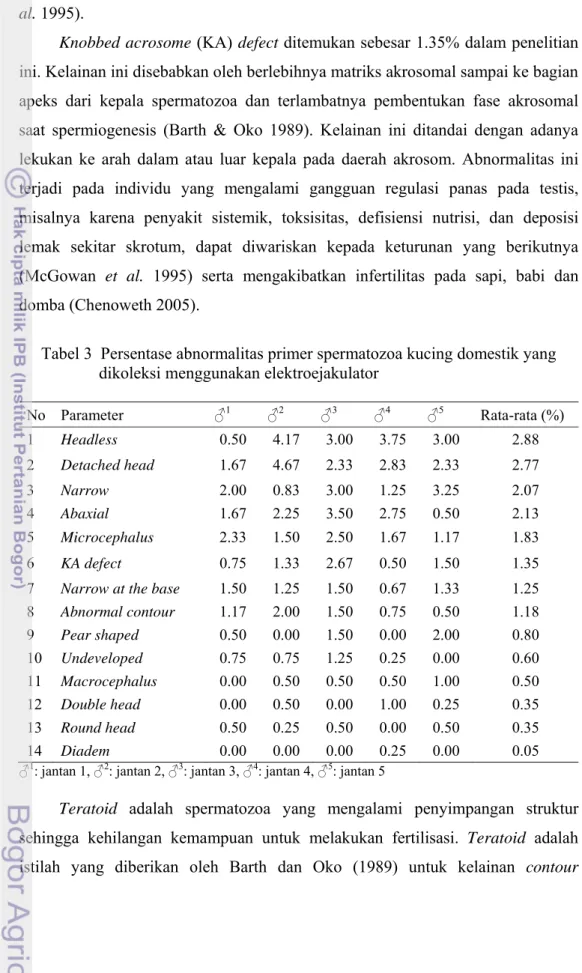
Berbagai jenis abnormalitas primer ditemukan dalam penelitian ini (Tabel 3) dengan abnormalitas yang paling banyak ditemukan berupa spermatozoa yang tidak memiliki kepala (headless) sebesar 2.88%. Spermatozoa tanpa kepala juga ditemukan dalam urin tikus pada umur 8 sampai 11 minggu dan merupakan kejadian fisiologis terkait dengan pematangan sel sertoli (Shimomura et al. 2008). Detached head (kelainan berupa patah atau terlepasnya kepala dari bagian leher
dan ekor) sebesar 2.77% dan nilai ini hampir sama dengan laporan Axnér et al. (1997), yaitu 2.50 ± 2.20%. Kelainan ini biasanya diakibatkan oleh hipoplasia testikular, degenerasi testis atau peradangan pada ampula dan epididimis. Selain itu, faktor genetik merupakan predisposisi terjadinya kelainan ini (McGowan et al. 1995).
Spermatozoa narrow atau tapered head (Barth & Oko 1989) yang ditemukan sebanyak 2.07% dalam penelitian ini dan merupakan kelainan bentuk pada kepala berupa terjadinya penyempitan pada daerah akrosom serta post akrosom. Kelainan ini diakibatkan oleh perkembangan yang tidak sempurna pada fase spermatosit primer sehingga substansi spermatozoa pada daerah kepala tidak tersebar secara merata dan kepala mengalami penekanan sehingga bentuknya menyempit. Narrow at the base merupakan abnormalitas primer yang ditandai dengan penyempitan post akrosom spermatozoa yang pada penelitian ini ditemukan sebanyak 1.25%.
Abaxial dapat diklasifikasikan sebagai abnormalitas primer maupun sekunder. Kelainan ini ditandai dengan bergesernya tempat bertaut ekor pada kepala. Abnormalitas ini dipengaruhi oleh faktor genetik yang bersifat herediter dan pada penelitian ini ditemukan sebesar 2.13%. Pada ternak kuda dan babi kelainan ini tidak mempengaruhi fertilitas, tetapi pada sapi jika ditemukan dalam jumlah yang tinggi akan mengganggu fertilitas (Barth & Oko 1989).
Variable size merupakan kelainan ukuran kepala spermatozoa yang lebih kecil (microcephalus) atau lebih besar (macrocephalus) dari ukuran normal spermatozoa pada spesies tersebut. Ukuran kepala spermatozoa akan mempengaruhi jumlah kromosom yang terkandung di dalamnya. Kelainan ini akibat faktor genetik tetapi microcephalus dapat juga disebabkan oleh perubahan lingkungan, luka, demam, atau radang testis (orchitis) yang kronis (Barth & Oko 1989). Dalam penelitian ini microcephalus ditemukan 1.83%, lebih banyak dibandingkan dengan macrocephalus yang hanya 0.5%. Kejadian microcephalus dan macrocephalus sebesar 0.10 ± 0.02% dan 0.10 ± 0.03% pada kucing domestik di wilayah Amerika (Howard et al. 1990). Stachecki et al. (1993) tidak menemukan kelainan microcephalus tetapi menemukan 0.30 ± 0.10%
17
macrocephalus pada spermatozoa kucing domestik yang dikoleksi melalui epididimis.
Gambar 6 Morfologi spermatozoa kucing (a) normal, (b) headless, (c) round head, (d) detached head, (e) abaxial, (f) abnormal contour, (g) microcephalus, (h) narrow, (i) macrocephalus, (j) bent tail, (k) double head dan dag defect, (l) coiled tail.
Spermatozoa dengan bentuk pear shaped atau pyriform memiliki pembesaran pada bagian akrosom dan menyempit pada bagian post akrosom sehingga terbentuk batas yang jelas diantara keduanya (Barth & Oko 1989). Kelainan jenis ini ditemukan sebanyak 0.80%. Kelainan ini bersifat genetik dan dalam jumlah tinggi dapat menurunkan fertilitas (Chenoweth 2005). Abnormalitas
ini terjadi akibat proses spermiogenesis yang tidak sempurna yang disebabkan oleh gangguan regulasi panas dan gangguan hormonal pada testis (McGowan et al. 1995).
Knobbed acrosome (KA) defect ditemukan sebesar 1.35% dalam penelitian ini. Kelainan ini disebabkan oleh berlebihnya matriks akrosomal sampai ke bagian apeks dari kepala spermatozoa dan terlambatnya pembentukan fase akrosomal saat spermiogenesis (Barth & Oko 1989). Kelainan ini ditandai dengan adanya lekukan ke arah dalam atau luar kepala pada daerah akrosom. Abnormalitas ini terjadi pada individu yang mengalami gangguan regulasi panas pada testis, misalnya karena penyakit sistemik, toksisitas, defisiensi nutrisi, dan deposisi lemak sekitar skrotum, dapat diwariskan kepada keturunan yang berikutnya (McGowan et al. 1995) serta mengakibatkan infertilitas pada sapi, babi dan domba (Chenoweth 2005).
Tabel 3 Persentase abnormalitas primer spermatozoa kucing domestik yang dikoleksi menggunakan elektroejakulator
No Parameter ♂1 ♂2 ♂3 ♂4 ♂5 Rata-rata (%) 1 Headless 0.50 4.17 3.00 3.75 3.00 2.88 2 Detached head 1.67 4.67 2.33 2.83 2.33 2.77 3 Narrow 2.00 0.83 3.00 1.25 3.25 2.07 4 Abaxial 1.67 2.25 3.50 2.75 0.50 2.13 5 Microcephalus 2.33 1.50 2.50 1.67 1.17 1.83 6 KA defect 0.75 1.33 2.67 0.50 1.50 1.35
7 Narrow at the base 1.50 1.25 1.50 0.67 1.33 1.25
8 Abnormal contour 1.17 2.00 1.50 0.75 0.50 1.18 9 Pear shaped 0.50 0.00 1.50 0.00 2.00 0.80 10 Undeveloped 0.75 0.75 1.25 0.25 0.00 0.60 11 Macrocephalus 0.00 0.50 0.50 0.50 1.00 0.50 12 Double head 0.00 0.50 0.00 1.00 0.25 0.35 13 Round head 0.50 0.25 0.50 0.00 0.50 0.35 14 Diadem 0.00 0.00 0.00 0.25 0.00 0.05 ♂1: jantan 1, ♂2: jantan 2, ♂3: jantan 3, ♂4: jantan 4, ♂5: jantan 5
Teratoid adalah spermatozoa yang mengalami penyimpangan struktur sehingga kehilangan kemampuan untuk melakukan fertilisasi. Teratoid adalah istilah yang diberikan oleh Barth dan Oko (1989) untuk kelainan contour
19
(permukaan kepala tidak rata dan konformitas tidak teratur) dan undeveloped (tidak berkembang, terlihat kepala kecil dan ekor pendek serta tidak disusun oleh materi genetik yang lengkap). Undeveloped disebabkan akibat gangguan yang parah pada spermatogenesis terutama pada saat spermiogenesis atau degenerasi pada tubulus dan fibriosis (McGowan et al. 1995). Dalam penelitian ini ditemukan abnormal contour dan undeveloped masing-masing 1.18% dan 0.60%.
Double head (bicephalic) adalah kelainan spermatozoa berupa kepala ganda dengan ukuran yang sama atau berbeda dan terjadi akibat kerusakan genetik. Round head adalah bentuk kepala spermatozoa yang membulat tanpa batas akrosom yang jelas. Kedua jenis kelainan ini ditemukan dalam jumlah yang sama dalam penelitian ini, yaitu 0.35%. Howard et al. (1990) melaporkan hasil yang hampir sama untuk jenis kelainan ini yaitu 0.20 ± 0.20% dan Stachecki et al. (1993) sebesar 0.30 ± 0.10% tetapi pada semen dikoleksi dari epididimis.
Diadem adalah kelainan pada kepala spermatozoa berupa adanya lubang-lubang pada bagian apeks nukleus yang disebabkan oleh invaginasi membran nuklear ke dalam nukleoplasma. Diadem disebut juga pouches, craters atau nuclear vacuoles karena bentuk lubang terlihat seperti kantung. Abnormalitas jenis ini dapat meningkat seiring kondisi stres karena cedera, kekurangan pakan, kondisi iklim yang ekstrim, serta kondisi lain yang tidak mendukung (Barth & Oko 1989; McGowan et al. 1995). Abnormalitas ini pada spermatozoa kucing ditemukan 0.05%, hanya pada jantan 4. Axnér et al. (1997) melaporkan nilai yang hampir sama yaitu 0.03 ± 0.10% pada kucing-kucing di wilayah Swedia.
Jenis abnormalitas sekunder yang paling banyak ditemukan dalam penelitian ini adalah dag defect sebanyak 2.73%. Abnormalitas ini ditandai dengan ekor melipat, melingkar, dan fraktur bagian distal dari midpiece spermatozoa dengan atau tanpa adanya sitoplasmik droplet dibagian distal. Dag defect pertama kali ditemukan pada sapi perah jenis Jersey dan diduga bersifat herediter dan dapat disebabkan oleh gangguan testis atau epididimis (McGowan et al. 1995). Semen sapi normal dapat memiliki kelainan ini maksimal 4%. Jumlah dag defect lebih dari 50% akan berimplikasi terhadap gangguan fertilitas (Chenoweth 2005).
Bent tail terjadi akibat disfungsi testis dan epididimis. Kelainan ini dapat juga terjadi sebagai artefak yang diakibatkan oleh cold shock atau pada lingkungan dengan tekanan osmotik yang tidak sesuai, misalnya kontaminasi air akibat vagina buatan yang bocor (McGowan et al. 1995). Dalam penelitian ini diperoleh persentase abnormalitas bent tail sebesar 2.20%, nilai ini cukup kecil jika dibandingkan dengan Axnér et al. (1997) yang dapat mencapai 6.70 ± 4.80%.
Tabel 4 Persentase abnormalitas sekunder spermatozoa kucing domestik yang dikoleksi menggunakan elektroejakulator
No Parameter ♂1 ♂2 ♂3 ♂4 ♂5 Rata-rata (%)
1 Dag defect 3.00 1.17 2.00 3.83 3.67 2.73
2 Bent tail 3.83 1.33 3.33 1.33 1.17 2.20
3 Tailless 2.00 3.33 3.00 1.00 0.67 2.00
4 Coiled tail 0.83 0.50 2.17 1.00 1.17 1.13
♂1: jantan 1, ♂2: jantan 2, ♂3: jantan 3, ♂4: jantan 4, ♂5: jantan 5
Coiled tail merupakan bentuk ekor spermatozoa yang menggulung dibagian ujungnya dan disebabkan oleh faktor-faktor yang mirip dengan bent tail (McGowan et al. 1995). Dalam penelitian ini ditemukan abnormalitas coiled tail hanya 1.13% sedangkan Axnér et al. (1997) menemukan jumlah yang sangat tinggi yaitu 15.80 ± 17.50%. Tailless (kepala tanpa ekor) merupakan kelainan spermatozoa yang akan terjadi pada individu yang mengalami degenerasi testis, hipoplasia testis dan gangguan sistem saluran reproduksi seperti epididimitis atau ampulitis (McGowan et al. 1995). Jenis abnormalitas ini ditemukan sebanyak 2.00% (Tabel 4).
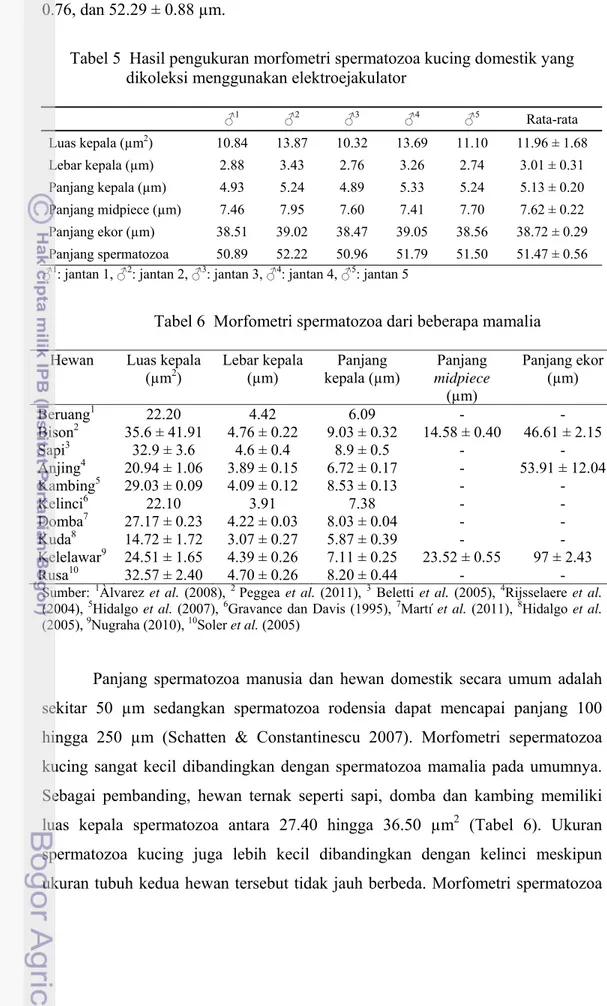
Informasi mengenai morfometri spermatozoa kucing masih terbatas. Hasil pengukuran morfometri spermatozoa pada penelitian ini adalah panjang, lebar dan luas kepala masing-masing 5.13 ± 0.20 µm, 3.01 ± 0.31 µm dan 11.96 ± 1.68 µm2, panjang midpiece 7.62 ± 0.22 µm, panjang ekor (utama dan akhir) 38.72 ± 0.29 µm, serta panjang total spermatozoa 51.47 ± 0.56 µm (Tabel 5). Ukuran ini tidak jauh berbeda dengan morfometri spermatozoa kucing domestik di wilayah Amerika (Terrell 2011). Peneliti tersebut melaporkan panjang dan lebar kepala, panjang midpiece, panjang ekor bagian utama serta panjang spermatozoa kucing
21
domestik masing-masing adalah 4.54 ± 0.15, 2.22 ± 0.10, 7.68 ± 0.13, 40.06 ± 0.76, dan 52.29 ± 0.88 µm.
Tabel 5 Hasil pengukuran morfometri spermatozoa kucing domestik yang dikoleksi menggunakan elektroejakulator
♂1 ♂2 ♂3 ♂4 ♂5 Rata-rata Luas kepala (µm2) 10.84 13.87 10.32 13.69 11.10 11.96 ± 1.68 Lebar kepala (µm) 2.88 3.43 2.76 3.26 2.74 3.01 ± 0.31 Panjang kepala (µm) 4.93 5.24 4.89 5.33 5.24 5.13 ± 0.20 Panjang midpiece (µm) 7.46 7.95 7.60 7.41 7.70 7.62 ± 0.22 Panjang ekor (µm) 38.51 39.02 38.47 39.05 38.56 38.72 ± 0.29 Panjang spermatozoa 50.89 52.22 50.96 51.79 51.50 51.47 ± 0.56
♂1: jantan 1, ♂2: jantan 2, ♂3: jantan 3, ♂4: jantan 4, ♂5: jantan 5
Tabel 6 Morfometri spermatozoa dari beberapa mamalia
Hewan Luas kepala
(µm2) Lebar kepala (µm) kepala (µm) Panjang Panjang
midpiece (µm) Panjang ekor (µm) Beruang1 22.20 4.42 6.09 - - Bison2 35.6 ± 41.91 4.76 ± 0.22 9.03 ± 0.32 14.58 ± 0.40 46.61 ± 2.15 Sapi3 32.9 ± 3.6 4.6 ± 0.4 8.9 ± 0.5 - - Anjing4 20.94 ± 1.06 3.89 ± 0.15 6.72 ± 0.17 - 53.91 ± 12.04 Kambing5 29.03 ± 0.09 4.09 ± 0.12 8.53 ± 0.13 - - Kelinci6 22.10 3.91 7.38 - - Domba7 27.17 ± 0.23 4.22 ± 0.03 8.03 ± 0.04 - - Kuda8 14.72 ± 1.72 3.07 ± 0.27 5.87 ± 0.39 - - Kelelawar9 24.51 ± 1.65 4.39 ± 0.26 7.11 ± 0.25 23.52 ± 0.55 97 ± 2.43 Rusa10 32.57 ± 2.40 4.70 ± 0.26 8.20 ± 0.44 - -
Sumber: 1Àlvarez et al. (2008), 2 Peggea et al. (2011), 3 Beletti et al. (2005), 4Rijsselaere et al.
(2004), 5Hidalgo et al. (2007), 6Gravance dan Davis (1995), 7Martí et al. (2011), 8Hidalgo et al.
(2005), 9Nugraha (2010), 10Soler et al. (2005)
Panjang spermatozoa manusia dan hewan domestik secara umum adalah sekitar 50 µm sedangkan spermatozoa rodensia dapat mencapai panjang 100 hingga 250 µm (Schatten & Constantinescu 2007). Morfometri sepermatozoa kucing sangat kecil dibandingkan dengan spermatozoa mamalia pada umumnya. Sebagai pembanding, hewan ternak seperti sapi, domba dan kambing memiliki luas kepala spermatozoa antara 27.40 hingga 36.50 µm2 (Tabel 6). Ukuran spermatozoa kucing juga lebih kecil dibandingkan dengan kelinci meskipun ukuran tubuh kedua hewan tersebut tidak jauh berbeda. Morfometri spermatozoa
kucing lebih mendekati ukuran spermatozoa kuda apabila dilihat dari luas, lebar dan panjang kepala.
Teknik pewarnaan dan umur hewan diketahui dapat mempengaruhi nilai morfometri spermatozoa. Pengaruh nyata terhadap teknik pewarnaan ditemukan pada pengukuran panjang kepala dan ekor bagian utama spermatozoa sapi bali tetapi tidak ditemukan pada lebar dan panjang midpiece (Arifiantini et al. 2006b) dan panjang total spermatozoa anoa yang diwarnai dengan teknik William’s lebih panjang dibandingkan dengan pewarnaan dengan eosin-nigrosin (Yudi et al. 2008). Perbedaan yang nyata terjadi pada panjang kepala, midpiece dan ekor utama antara anoa dewasa dan anoa muda tetapi tidak berbeda nyata pada lebar kepala dan panjang total telah dilaporkan oleh Yudi et al. (2008).
SIMPULAN
Abnormalitas morfologi spermatozoa kucing domestik yang diperoleh dalam penelitian ini sebesar 15.00 ± 3.11% untuk abnormalitas primer dan 7.97 ± 1.97% untuk abnormalitas sekunder. Headless dan dag defect merupakan jenis abnormalitas yang paling banyak ditemukan. Panjang, lebar dan luas daerah kepala spermatozoa adalah 5.13 ± 0.20 µm, 3.01 ± 0.31 µm dan 11.96 ± 1.68 µm2. Panjang midpiece dan ekor (utama dan akhir) adalah 7.62 ± 0.22 µm dan 38.72 ± 0.29 µm serta panjang total spermatozoa adalah 51.47 ± 0.56 µm.
M, Garde J, Anel L, De Paz P. 2008. Effects of cryopreservation on head morphometry and its relation with chromatin status in brown bear (Ursus arctos) spermatozoa. Theriogenology 70:1498-1506.
Arifiantini RI, Ferdian F. 2006. Tinjauan aspek morfologi dan morfometri spermatozoa kerbau rawa (Bubalus bubalis) yang dikoleksi dengan teknik masase. J Vet 7:83-91.
Arifiantini RI, Wresdiyanti T, Retnani EF. 2006a. Pengujian morfologi spermatozoa sapi bali (Bos sondaicus) menggunakan pewarnaan William’s. Jurnal Pengembangan Peternakan Tropis Fapet Undip 31:105-110.
Arifiantini RI, Wresdiyanti T, Retnani EF. 2006b. Kaji banding morfometri spermatozoa sapi bali (Bos sondaicus) menggunakan pewarnaan William’s, eosin, eosin nigrosin dan formol saline. Jurnal Sains 24:65-70.
Arifiantini RI, Purwantara B, Riyadhi M. 2010. Occurrence of sperm abnormality of beef cattle at several artificial insemination centers in Indonesia. Animal Production 12:44-49.
Arruda RP, Ball BA, Gravance CG, Garcia AR. 2002. Effect of extender and cryoprotectants on stalion sperm head morphometry. Theriogenology 58:253-256.
Axnér E, Strom B, Linde-Forsberg C. 1997. Sperm morphology is better in the second ejaculate than in the first in domestic cats electoejaculated twice during the same period of anesthesia. Theriogenology 47:929-934.
Axnér E, Strom B, Linde-Forsberg C. 1998. Morphology of spermatozoa in the cauda epididymidis before and after electroejaculation and a comparison with ejaculated spermatozoa in the domestic cat. Theriogenology 50:973-979.
Axnér E, Linde-Forsberg C. 2002. Semen collection and assessment, and artificial insemination in the cat. International Veterinary Information Service.
Barth AD, Oko RJ. 1989. Abnormal Morfology of Bovine Spermatozoa. Iowa : Iowa State University Press.
Beletti ME, Costa LF, Viana MP. 2005. A comparison of morphometric characteristics of sperm from fertile Bos taurus and Bos indicus bulls in Brazil. Animal Reproduction Science 85:105-116.
Chenoweth PJ. 2005. Genetic sperm defect. Theriogenology 64:457-468.
Costa DS, Paula TAR, Matta SLP da. 2006. Cat, Cougar, and Jaguar Spermatogenesis: a Comparative Analysis. Brazilian Archives of Biology and Technology 49:725-731.
Gage MJG, Freckleton RP. 2003. Relative testis size and sperm morphometry across mammals: no evidence for an association between sperm competition and sperm length. Proc R Soc Lond B 270:625-632.
25
Gravance CG, Davis RO. 1995. Automated sperm morphometry analysis (ASMA) in the rabbit. J Androl 16:88-93.
Gunarso W. 1989. Mikroteknik. Bogor: Pusat Antar Universitas Ilmu Hayat Institut Pertanian Bogor.
Hidalgo M, Rodríguez I, Dorado J, Sanz J, Soler C. 2005. Effect of sample size and staining methods on stallion sperm morphometry by the Sperm Class Analyzer. Vet Med 50:24-32.
Hidalgo M, Rodríguez I, Dorado J. 2007. The effect of cryopreservation on sperm head morphometry in Florida male goat related to sperm freezability. Animal Reproduction Science 100:61-72.
Howard JG, Brown JL, Bush M, Wildt DE. 1990. Teratospermic and normospermic domestic cats: ejaculate traits, pituitary-gonadal hormones, and improvement of spermatozoa motility and morphology after swim-up processing. J Androl 11:204-215.
Howard JG, Donoghue AM, Johnston LA, Wildt DE. 1993. Zona pellucida filtration of structurally abnormal spermatozoa and reduced fertilization in teratospermic cats. Biol Reprod 49:131-139.
Johnston SD, Kustritz MVR, Olson PNS. 2001. Canine and Feline Theriogenology. Philadelphia: W. B. Saunders Company.
Lipinski MJ, Froenicke L, Baysac KC, Billings NC, Leutenegger CM, Levy AM, Longeri M, Niini T, Ozpinar H, Slater MR, Pedersen NC, Lyons LA. 2007. The ascent of cat breeds: genetic evaluations of breeds and worldwide random bred populations. Genomics 91:12-21.
Martí JI, Aparicio IM, García-Herreros M. 2011. Sperm morphometric subpopulations are differentially distributed in rams with different maturity age in cryopreserved ejaculates. Theriogenology 76:97-109.
McGowan M, Galloway D, Taylor E, Entwistle K, Johnston P. 1995. Veterinarians Examination of Bulls. Queensland : Australia Association of Cattle Veterinarians.
Morrell JM, Johannisson A, Dalin A, Hammar L, Sandebert T, Rodriguez-Martinez H. 2008. Sperm morphology and chromatin integrity in Swedish warmblood stallions and their relationship to pregnancy rate. Acta Veterinaria Scandinavica 50:2.
Najamudin. 2010. Kajian pola reproduksi pada kancil (Tragulus javanicus) dalam mendukung pelestariannya [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Nugraha. 2010. Anatomi komparatif organ reproduksi jantan pada genus Cynopterus dengan tinjauan khusus pada bakulum, penile spine dan spermatozoa [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Peggea RBG, Krishnakumar S, Whiteside D, Elkin B, Parlevlieta JM, Thundathilb
JC. 2011. Sperm characteristics in plains (Bison bison bison) versus wood (Bison bison athabascae) bison. Theriogenology 75:1360-1370.
Purwantara B, Arifiantini RI and Riyadhi M. 2010. Sperm morphological assessments of Friesian holstein bull semen collected from three artificial insemination centers in Indonesia. J Indonesian Trop Anim Agric 35(2). Rijsselaere T, Soom A van, Hoflack G, Maes D, Kruif A de. 2004. Automated
sperm morphometry and morphology analysis of canine semen by the Hamilton-Thorne analyser. Theriogenology 62:1292-1306.
Schatten H, Constantinescu GM. 2007. Comparative Reproductive Biology. Iowa: Blackwell Publishing.
Shimomura K, Sakurai K, Shimada M, Hagiwara M, Kato M, Furuhama K. 2008. Occurrence of headless sperms in adolescent rat urine. Lab Anim
2008;42:204-212.
Soler C, Gadea B, Soler AJ, Fernández-Santos MR, Esteso MC, Núñez J, Moreira PN, Núñez M, Gutiérrez R, Sancho M, Garde JJ. 2005. Comparison of three different staining methods for the assessment of epididymal red deer sperm morphometry by computerized analysis with ISAS. Theriogenology 64:1236-1243.
Stachecki JJ, Ginsburg KA, Leach RE, Armant DR. 1993. Computer-assisted semen analysis (CASA) of epididymal sperm from the domestic cat. J Androl 14:60-65.
Terrell K. 2011. Metabolism and cryo-sensitivity of domestic cat (Felis catus) and cheetah (Acinonyx jubatus) spermatozoa [disertasi]. New Orleans: University of New Orleans.
Theunissen MHA. 2011. Acrosome deficiency and male infertility; causes and treatment [tesis]. Utrecht: Universiteit Utrecht.
Wastlhuber J. 1991. History of domestic cats and cat breeds in feline husbandry: diseases and management in the multiple cat environment. Am Vet Publ Inc 1-59.
Yudi, Yusuf TL, Purwantara B, Agil M, Wresdiyati T, Sajuthi D, Aditya, Manangsang J, Sudarwati R, Hastuti YT. 2008. Morfologi dan biometri spermatozoa anoa (Bubalus sp.) yang diwarnai dengan pewarna william’s dan eosin-nigrosin. Media Peternakan 33:88-94.