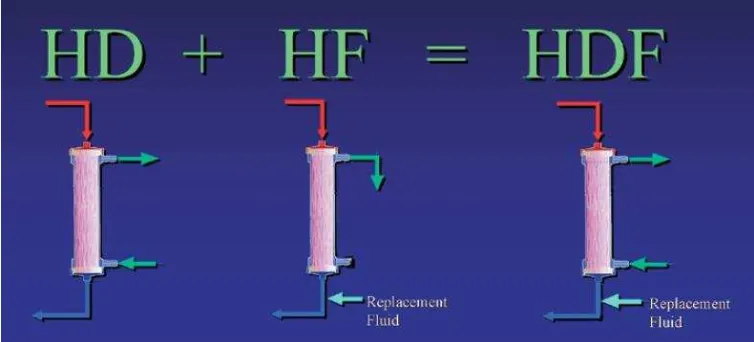
HEMODIAFILTRASI
Abdurrahim R Lubis, Harun R Lubis, Ricky Rivalino Sitepu
Divisi Nefrologi-Hipertensi Departemen Ilmu Penyakit Dalam
Fakultas Kedokteran Universitas Sumatera Utara
Pendahuluan
Sejak terapi dialisis mulai dikenal, para ahli telah mencoba untuk menggabungkan teknik
difusi dan konveksi dalam upaya untuk menggantikan fungsi ginjal. Teknik difusi sendiri
telah dikenal industri kimia sejak lama yang sebagai teknik pertukaran zat-zat kimia yang
efisien [1]. Pada perkembangan selanjutnya, teknik konveksi mulai diperkenalkan setelah
menunjukkan keuntungan yang potensial dalam mengobati pasien dengan penyakit ginjal
[2]. Pada awalnya, teknik konveksi pada ultrafiltrasi (UF) hanya digunakan untuk
mengobati pasien yang overhidrasi. Pada perkembangan selanjutnya, ultrafiltrasi
kemudian juga digunakan dalam pembersihan zat-zat terlarut pada dialisis. Hal ini terjadi oleh karena fenomena “solvent drag” yang dihasilkan pada teknik konveksi [3]. Kombinasi difusi dan konveksi dalam mencapai pemurnian darah yang efisien dan
memadai menghasilkan penemuan teknik gabungan yang disebut hemodiafiltration
(HDF) [4]. Reading assignment ini akan meringkas sejarah dan perkembangan teknologi,
evolusi HDF dari seluruh berbagai modalitas, dan akhirnya studi klinis terbaru yang
menunjukkan bahwa HDF dapat menjadi standar emas baru sebagai terapi pengganti
ginjal.
Definisi
HDF adalah teknik penggantian ginjal extrakorporal menggunakan membran yang sangat
permeabel dimana hemodialisis (difusi) dan hemofiltration (konveksi) dikombinasikan
untuk meningkatkan pembersihan zat terlarut pada spektrum berat molekul yang luas.
Modalitas yang berbeda dari HDF saat ini telah diterapkan dalam praktek klinis, namun
pada dasarnya terapi tersebut adalah kombinasi dari difusi dan konveksi untuk mencapai
Gambar 1. Secara definisi, hemodiafiltrasi merupakan terapi pengganti ginjal yang menggabungkan hemodialysis (difusi) dan hemofiltrasi (konveksi)
Sejarah
Pada masa awal dialisis diperkenalkan, beberapa pelopor mulai menganalisis potensi
penggunaan beberapa proses pemisahan masa untuk mencapai pemurnian darah. Pada
tahun 1967, Henderson [3] menerbitkan artikel pertama tentang penggunaan ultrafiltrasi
dan penggantian cairan (diafiltrasi) sebagai metode pembersihan darah. Pada tahun 1969,
Miller et AL [5] menunjukkan kelayakan diafiltration sebagai terapi penggamti ginjal.
Pada tahun 1977 untuk pertama kalinya, istilah HDF digunakan oleh Leber et al [6].
Metode dialisis yang tergolong baru ini terdiri dari kombinasi hemofiltration (HF) dan
hemodialisis konvensional (HD) menggunakan membran high-flux dengan tekanan
transmembran dari 300 hingga 500 mmHg dan laju aliran dialisat pada 900 mL/menit.
Oleh karena kombinasi perpindahan masa secara konvektif dan difusi, nilai clearance dari
molekul kecil dan besar secara signifikan lebih tinggi daripada HF atau HD saja dengan
menggunakan membran yang sama. Pengurangan air pada pasien overhydrated pun lebih
dapat ditoleransi. Setidaknya terdapat 2 keuntungan dari HDF, diantaranya: (1) dapat
dengan mudah mengurangi kelebihan cairan dari pasien dan (2) pembersihan zat terlarut
dalam spektrum berat molekul yang lebih luas. Pada tahun 1977, Kunitomo et al [7]
menunjukkan kelayakan HDF dengan inovasi teknologi yang lebih lanjut, termasuk
diantaranya sistem laju UF yang dapat dikontrol, hollow fiber dialyzer yang sangat
teknik yang mendapatkan popularitas di Eropa dan membuka jalan untuk teknologi
modern HDF dan aplikasinya sebagai terapi rutin pengganti ginjal [8].
Mekanisme Pembersihan Zat Terlarut pada Hemodiafiltrasi
Sesuai dengan definisi yang telah dijabarkan, HDF menggunakan kombinasi difusi dan
konveksi dalam membersihkan zat-zat terlarut di dalam darah. Pembuangan zat terlarut
pada proses difusi memerlukan adanya cairan dialisate yang mengalir berlawanan dengan
aliran darah. Sedangkan pada proses konveksi, cairan pengganti diperlukan untuk
menggantikan cairan tubuh yang hilang. Besarnya cairan pengganti tubuh yang
diperlukan bergantung oleh ada tidaknya overload cairan pada pasien. Cairan pengganti
dapat dialirkan ke dalam darah sebelum masuk ke filter (predilution), setelah darah
keluar dari filter (postdilution), atau dapat diberikan ke dalam filter. Cairan pengganti
tubuh tersebut nantinya akan bercampur dengan darah, oleh karenanya cairan tersebut
haruslah steril dan mempunyai komposisi yang sesuai dengan plasma darah. Cairan
pengganti tubuh dapat berupa cairan infus seperti NaCl 0.9%, Ringer-Laktat (RL),
Dextrose, dan lain-lain [9].
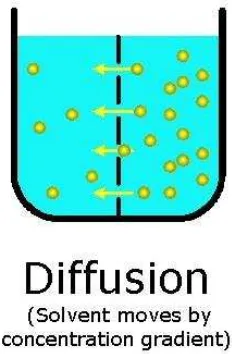
a. Difusi [10]
Pada HDF maupun HD, terdorongnya zat terlarut melawati membran permeable
pada proses difusi disebabkan oleh adanya perbedaan konsentrasi zat-zat terlarut
di dalam darah dengan cairan dialisis. Tingginya laju difusi tergantung pada
ukuran molekul dan adanya resistansi. Resistansi aliran zat terlarut disebabkan
oleh membran permeable itu sendiri. Jarak yang ditempuh oleh darah dan
diameter rongga serat pada filter juga memainkan peranan dalam resistansi
(gambar 2). Oleh karenanya molekul-molekul kecil mempunyai laju difusi yang
tinggi dibandingkan dengan molekul-molekul yang lebih besar. Karakteristik
dialiser dalam proses difusi dapat dinyatakan dalam K0A, disebut dengan
koefisen luas area perpindahan masa, dimana proses pembersihan zat pada laju
Gambar 2. Proses difusi terjadi dimana perpindahan zat terlarut melewati membran permeable dari area dengan konsentrasi tinggi ke area dengan konsentrasi rendah.
Untuk memaksimalkan transportasi zat terlarut pada proses difusi secara klinis,
diperlukan laju aliran darah dan cairan dialisis yang tinggi untuk mempertahankan
konsentrasi gradien yang besar. Tingginya aliran darah hendaknya dengan sesuai
dengan kondisi vena akses pada pasien. Secara praktis terdapat aturan yang bahwa
aliran darah sebaiknya berbanding 1:2 dengan aliran dialisat. Namun hasil yang
optimal masih dapat diperoleh pada laju aliran yang rendah dengan menggunakan
dialiser modern [11]. Di antara tiga parameter—laju aliran darah, laju aliran dialisat, dan luas permukaan dialiser—parameter yang berhubungan dengan
pasien sebaiknya dapat diatur oleh pengendali mesin.
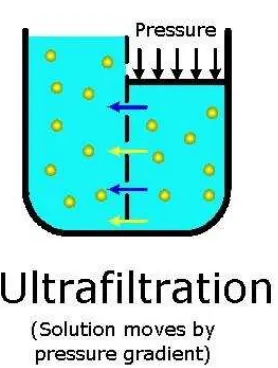
b. Konveksi [10]
Proses konvektif pada dialisis ialah pergerakan pasif zat terlarut mengikuti aliran
fluida melintasi membran permeabel yang disebabkan oleh adanya perbedaan
tekanan gradient dari dalam darah (gambar 3). Aliran fluida melintasi membran
permeabel disebut juga dengan ultrafiltrasi. Tingkat ultrafiltrasi dipengaruhi oleh
2 faktor yaitu permeabilitas membran dan tekanan hidrostatik darah, yang
tergantung pada aliran darah. Permeabilitas membran terhadap zat terlarut, atau
sieving properties, ditentukan oleh ukuran pori-pori pada membran yang
menetapkan batas zat terlarut yang dapat diseret (solvent drag) melintasi
Gambar 3. Pada proses konveksi/ultrafiltrasi, zat terlarut berpindah dari area yang betekanan tinggi ke area yang bertekanan rendah melalui membran permeabel.
Proses konveksi persis dengan apa yang sebenarnya terjadi dalam ginjal normal
manusia. Konveksi sangat efektif dalam menurunkan jumlah cairan dalam tubuh
dan molekul berukuran kecil-menengah yang diduga menyebabkan uremia. Selain
itu, proses ini juga dapat memperbaiki kondisi pasien dengan sepsis oleh karena
sebagian besar sitokin yang terlibat dalam sepsis merupakan "molekul berukuran
menengah".
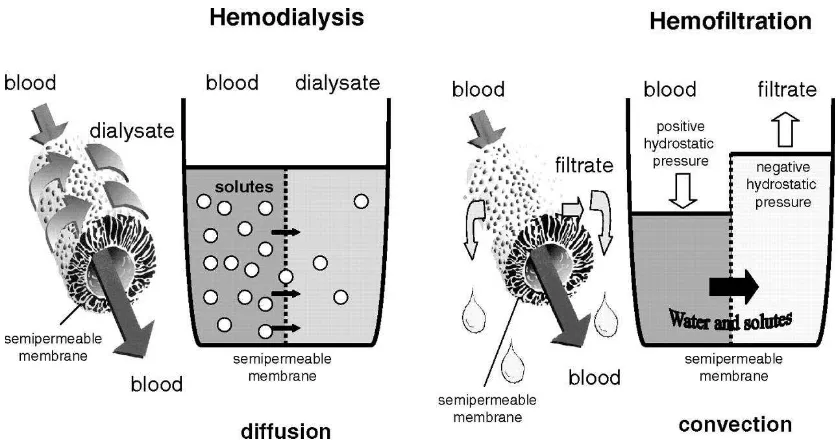
Hemodialisis merupakan contoh yang baik dari terapi difusi. Pada HD, membran
low-flux digunakan karena memiliki permeabilitas difusi yang tinggi. Hal ini memungkinkan
zat terlarut bermolekul kecil bergerak bolak-balik melintasi membran dengan mudah
sesuai dengan gradien konsentrasi mereka masing-masing. Namun, transportasi zat
terlarut bermolekul sedang dan besar, dan aliran air yang tinggi tidak dapat dicapai
dengan membran low-flux. Oleh karena itu, jumlah transportasi zat terlarut dan pelarut
yang dicapai oleh transportasi konvektif sangat kecil sehingga dapat diabaikan. Hasil
yang optimal dapat dicapai dengan meningkatkan laju aliran darah dan laju aliran dialisat
dan juga luas permukaan dialiser. Hal ini dapat dilihat dari peningkatan penghapusan zat
terlarut kecil seperti urea dan kreatinin, sementara itu memiliki sedikit efek pada zat
Hemofiltrasi adalah terapi di mana pembersihan zat terlarut bergantung sepenuhnya pada
konveksi. Bila diterapkan dengan menggunakan laju aliran darah yang tinggi dan volume
ultrafiltrasi yang besar, terapi ini dapat membersihkan molekul berukuran sedang dan
besar secara signifikan [13]. Konveksi pada hemofiltrasi juga menurunkan jumlah cairan
pada pasien dengan overload cairan. Meskipun demikian sering kali jumlah cairan yang
disaring oleh ultrafiltrasi melebihi batas yang diinginkan, oleh karenanya aliran infus
harus selalu diberikan secara predilution atau postdilution untuk mencegah terjadinya
syok. Untuk meningkatkan efisiensi HF, laju aliran ultrafiltrasi yang lebih tinggi harus
dihasilkan dan ini memerlukan kecepatan aliran darah yang lebih tinggi dan
kadang-kadang juga luas permukaan membran yang lebih besar. Hasilnya akan terlihat pada
peningkatan clearance berbagai zat terlarut [14].
Gambar 4. Perbedaan mekanism penyaringan pada hemodialisis dan hemofiltrasi. Pada hemodialisis terjadi perpindahan molekul secara difusi. Sedangkan hemofiltrasi menggunakan proses konveksi untuk
menyeret zat terlarut (solvent drag) ke arah filtrasi.
Pada Hemodiafiltrasi, proses difusi dan konveksi terjadi secara bersamaan, tetapi efek
dari kedua proses tidak hanya bersifat aditif melainkan juga bersifat saling
mengintervensi satu sama lain. Difusi mengurangi konsentrasi molekul-molekul kecil,
menyisakan sedikit yang selanjutnya dibersihkan oleh proses konvektif. Konveksi juga
memiliki nilai terbatas dalam pembersihan molekul-molekul kecil, meskipun demikian,
proses ini penting dalam pembersihan molekul-molekul besar (Gambar 5) [13].
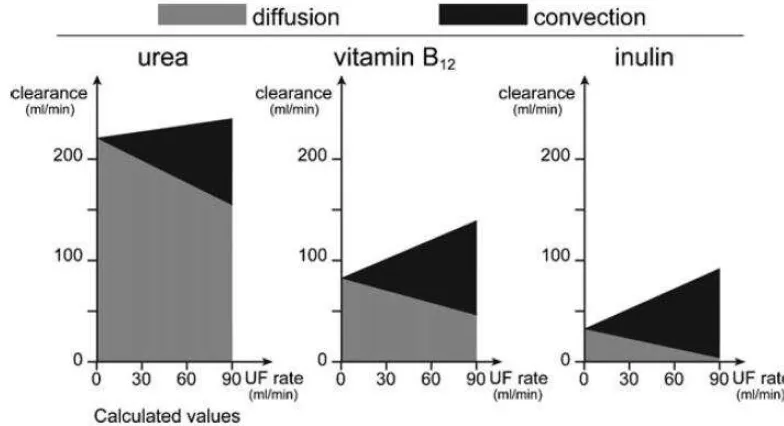
Gambar 5. Clearance pada urea (MW = 60), vitamin B12 (MW = 1 355) dan inulin (MW = 5 000) mengilustrasikan dampak dari meningkatnya proses konveksi (hitam) pada difusi (abu-abu). Proses terjadi
pada HDF dengan tingkat aliran darah 300 ml/min. Terlihat bahwa semakin tinggi tingkat ultrafiltrasi, semakin tinggi pula proses konveksi dan semakin rendah proses difusi [13].
Statistik menunjukkan bahwa 40-50 % dari tingkat ultrafiltrasi merupakan clearance
konvektif yang dapat digabungkan oleh difusi [15] . Keseimbangan antara difusi dan
konveksi dapat diatur melalui parameter yang dapat dikendalikan. Konveksi biasanya
diprioritaskan, dan ini dicapai dengan mengatur parameter ultrafiltrasi secara maksimal.
Menemukan tingkat UF yang optimal membutuhkan perawat yang berpengalaman, dan
pada kenyataannya, banyak perawatan HDF dioperasikan di bawah kondisi suboptimal
untuk menghindari berbunyinya alarm transmembrane pressure gradient (TMP) dan
menghemat waktu keperawatan. Salah satu cara yang efisien ialah dengan membiarkan
mesin mengendalikan tingkat UF memilih dan menyesuaikan secara TMP otomatis [16].
Membran
Membran permeable pada dializer berfungsi menyaring zat-zat terlarut pada darah dan
membran permeable menjadi faktor terpenting dalam terapi pengganti ginjal
ektrakorporal. Terdapat 2 ukuran pori yang berbeda pada membran dialyzer. Membran
dengan ukuran pori yang lebih kecil disebut dengan "low-flux" dan membran dengan
ukuran pori yang lebih besar disebut dengan "high-flux”. Kedua membran tersebut memiliki struktur dan penggunaannya yang berbeda dalam modalitas pengganti ginjal
extrakorporal.
Istilah 'flux' mengacu pada permeabilitas membran dialyser yang dapat dilewati oleh
toxin dan cairan. Pada awalnya, membran permeable terbuat dari selulosa alami yang
memiliki pori-pori yang relatif kecil. Membrane selulosa dengan ukuran pori-pori yang
relative kecil atau sering disebut 'low-flux' dapat dengan mudah menghilangkan toxin
yang lebih kecil seperti urea dan kreatinin, tetapi toxin dengan ukuran molekul yang lebih
besar tidak dapat melewati melalui membran tersebut. Saat ini, membran dialyser modern
terbuat dari polimer sintetis atau selulosa yang dimodifikasi secara kimia. Produsen
membran dializer sintetik dapat membentuk ukuran pori-pori sesuai dengan ukuran yang
dibutuhkan.
Pada hemodialisis, membran yang digunakan biasanya bersifat low-flux. Selain itu
dengan ketebalan 10-20 µm, membran low-flux lebih tipis dibandingkan dengan
membran yang digunakan pada HF dan HDF. Hal ini memungkinkan zat terlarut
bermolekul kecil bergerak bolak-balik melintasi membran dengan mudah [17]. Namun,
membran low-flux memiliki sieving coefficient yang lebih rendah untuk molekul
berukuran sedang-besar dibandingkan dengan membran high-flux (gambar 6). Hal ini
menyebabkan clearance molekul berukuran sedang dan besar tidak bisa dicapai sesuai
dengan keinginan. Saat ini, banyak terapi HD yang menggunakan membran high-flux
oleh karena studi yang menunjukkan hasil yang lebih baik dengan menggunakan
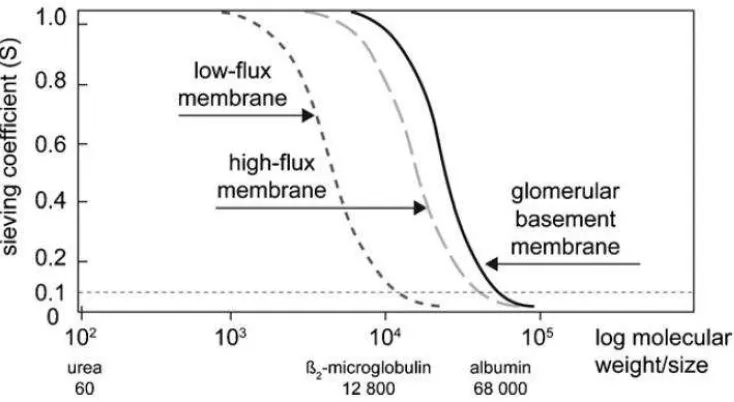
Gambar 6. Sieving coefficient (S)merupakan rasio antara konsentrasi zat terlarut dalam filtrat dan konsentrasi zat terlarut dalam darah dengan nilai 0 hingga 1. Semakin tinggi “S”, semakin tinggi
pula permeabilitas suatu solute. Kurva diatas menunjukkan bahwa membran high-flux memiliki permeabilitas lebih tinggi pada molekul yang lebih besar dibandingkan dengan membran low-flux.
Membran glomerulus dipakai sebagai perbandingan.
Pada hemofiltrasi maupun hemodiafiltrasi, membran yang digunakan memiliki pori-pori
yang lebih besar atau bersifat high-flux. Hal ini memungkinkan molekul berukuran
sedang-besar dapat melewati membran dengan mudah sedangkan jumlah molekul kecil
yang tersaring tergolong cukup. Meskipun sama, membran pada hemodiafiltrasi memiliki
ketebalan yang lebih tipis (hampir sama dengan membran low-flux pada HD)
dibandingkan dengan membran hemofiltrasi yang memiliki ketebalan hingga 100 µm.
Ketebalan dinding yang lebih tipis mampu meningkatkan penyaringan molekul kecil
lebih efisien [8, 19, 20]. Ilustrasi perbedaan membran pada HD, HF, dan HDF dapat
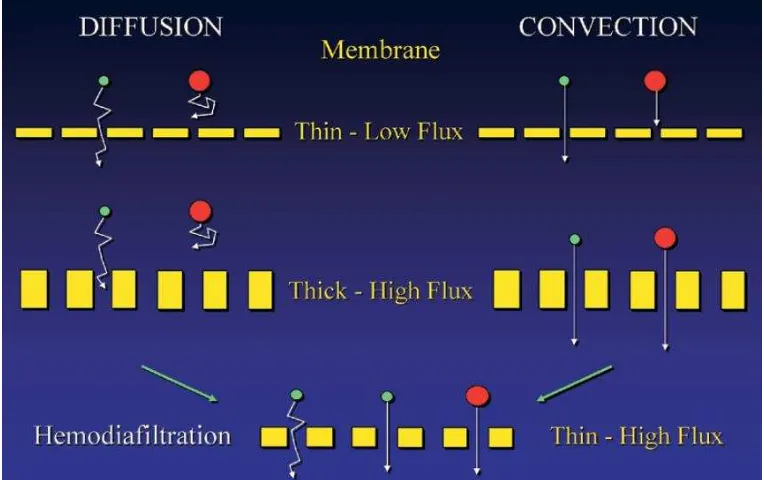
Gambar 7. Hemodialisis menggunakan membran low-flux dengan ketebalan 10-20 µm. Hemofiltrasi menggunakan membran high-flux dengan ketebalan 100 µm. Sedangkan hemodiafiltrasi menggunakan
membran high-flux dengan ketebalan dinding yang tipis.
Cairan Dialysis
Pada terapi pengganti ginjal, cairan memiliki fungsi sebagai cairan dialisate dan juga
sebagai cairan substitusi. Jumlah volume cairan yang diperlukan sangatlah besar untuk
terapi yang efisien, khuksusnya pada HDF. Cairan pengganti serta cairan dialisis secara
fisiologis dan komposisi harus serupa dengan cairan plasma. Pasien HD yang akan
menjalani HDF, dianjurkan untuk memulai dengan komposisi yang sama dari cairan
pengganti seperti yang telah digunakan untuk cairan dialisis. Kualitas cairan yang tinggi
juga dinilai dari segi mikrobiologis.
Penyusunan cairan berkualitas tinggi untuk dialisis, dimulai dengan air keran dan
finishing dengan cairan dialisis ultra murni atau larutan substitusi steril, harus dipandang
sebagai suatu proses yang terintegrasi dimana setiap langkah dalam rantai memenuhi
didefinisikan obyektif dan divalidasi untuk tujuan tersebut (Gambar 8). Berdasarkan
kualitas mikrobiologis, cairan yang digunakan dalam dialisis dapat dibagi menjadi tiga
tingkatan—standar, ultrapure, dan steril—ketiganya memiliki relevansi dengan HDF (Gambar 8) [21]. Tingkat kontaminan mikrobiologi diukur berdasarkan unit pembentuk
mengacu berdasarkan rekomendasi dan standar ISO baru [22]. Dibawah ini dijabarkan
beberapa perbedaan dari tingkatan cairan dialisis.
a) Cairan standar dialisis
Cairan dialisis dengan kualitas standar mempunyai nilai hitung bakteri <100
CFU/ml dan level endotoxin <0.50 EU/ml. Cairan standar untuk dialisis dibuat
dari air keran melalui serangkaian filter untuk menghilangkan mikropartikel,
bahan organik, dan anorganik. Kemudian proses reverse osmosis digunakan untuk
menghasilkan air yang memenuhi tuntutan kualitas yang direkomendasikan, baik
dari segi komposisi maupun mikrobiologis (gambar). Kualitas air standar untuk
dialisis dapat berfungsi sebagai dasar persiapan cairan lainnya (Gambar 4).
Apabila air yang diolah tidak memenuhi target cairan standar maka tidak dapat
digunakan dalam segala bentuk dialisis [21].
b) Cairan Ultrapure
Cairan dialisis ultrapure memiliki nilai hitung bakteri <0.1 CFU/ml dan level
endotoxin <0.03 EU/ml. Cairan ultrapure didapat dengan mengkonversi cairan
standar dialisis melalui proses ultrafiltrasi [23]. Hingga saat ini, belum ada
penelitian terkontrol secara acak yang membandingkan efek cairan ultrapure
dengan standar mutu cairan dialisis cairan. Namun, banyak penelitian klinis
menunjukkan perbaikan yang signifikan dari parameter inflamasi ketika pasien
beralih dari cairan standar ke cairan ultrapure [24]. Berdasarkan temuan ini,
European Best Practice Guidelines dan pedoman Japanese Society for Dialysis
Therapy merekomendasikan penggunaan cairan dialisis ultra murni untuk semua
bentuk dialisis [25].
c) Cairan steril
Cairan kualitas steril tidak dapat didefinisikan oleh kandungan bakteri tertentu,
karena tidak dapat diuji. Cairan yang digunakan untuk setiap terapi harus bebas
dari bakteri hidup dengan yang dapat dilihat melalui mikroskop dengan
pembesaran 1000 000 kali. Cairan juga harus bersifat non-pirogenik, yang
didefinisikan sebagai tingkat endotoksin <0,03 EU / ml. Cairan dialisis steril
Cairan dialisis steril dapat digunakan sebagai subsitusi cairan tubuh melalui cairan
yang telah disiapkan dalam kantong ataupun pada on-line HDF [26].
Gambar 8. Proses pemurnian air keran menjadi air yang memenuhi standar untuk digunakan sebagai cairan dialisat hingga cairan subsitusi. Proses dimulai dengan penyaringan (pretreatment) dan reverse osmosis (RO) yang kemudian dimixasi agar sesuai konsentrasi cairan plasma. Proses ultrafiltrasi cairan
dilakukan untuk mendapatkan air yang lebih murni.
Air keran yang telah diolah menjadi cairan standar dialisis kemudian akan dicampur cairan
dialisat pekat dengan perbandingan 1:34 hingga 120L dimasukan dalam tangki air kemudian
mengalirkannya ke ginjal buatan dengan kecepatan 500 – 600 cc/menit. Pencampuran dilakukan untuk mencapai kadar konsentrasi yang sama dengan cairan plasma darah. Table
di bawah ini membandingkan cairan plasma dengan dialisat.
Table 1. perbandingan darah dan dialisat :
Tipe-Tipe Hemodiafiltrasi
Seperti yang telah disebutkan sebelumnya, HDF adalah kombinasi dari HD dan HF
(Gambar 1). Kombinasi konveksi dengan membran tipis high-flux memungkinkan
pembuangan zat terlarut kecil dan besar (Gambar 7). Kontribusi relatif dari konveksi
pada pembuangan zat terlarut secara keseluruhan meningkat secara progresif dengan
meningkatnya berat molekul (Gambar 5). Kedua konsep ini telah diterapkan dalam
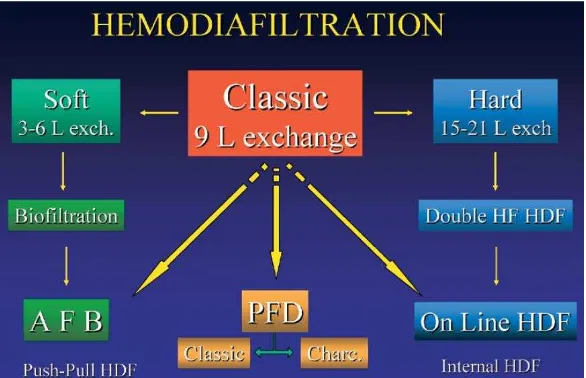
Gambar 10. Evolusis dari hemodiafiltrasi. Classic HDF menggunakan sekitar 9 liter cairan subsitusi. Apabila cairan subsitusi kurang dari 9 liter (3-6 liter) maka teknik tersebut tergolong dalam soft HDF.
Begitu pula sebaliknya pada hard HDF (15-21 liter).
Bab ini meringkas aplikasi praktis dari HDF selama bertahun-tahun, diantaranya sebagai
berikut.
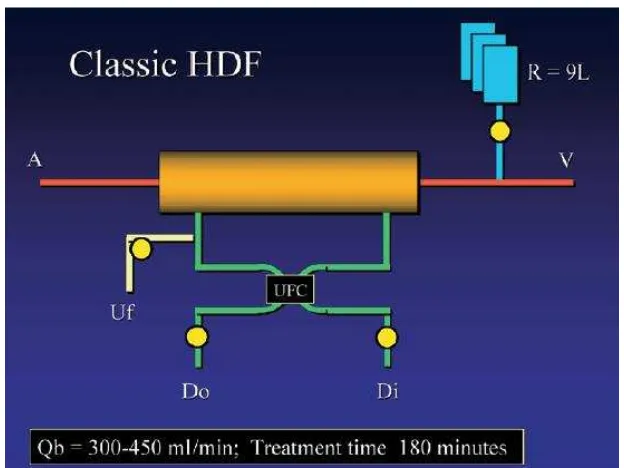
a) Classic HDF
Teknik ini didasarkan pada tingkat pemberian cairan subsitusi tubuh (reinfusion)
sekitar 9 liter per sesi. Biasanya cairan subsitusi diberikan pada darah yang telah
melewati tabung dialiser atau postdilution (Gambar 11). Cairan yang digunakan
biasanya merupakan cairan infus komersial. Aliran darah yang tinggi, >300
mL/menit, diperlukan untuk menghasilkan tingkat ultrafiltrasi yang cukup pada
tekanan gradien transmembran yang dapat diterima. Peralatan yang dibutuhkan
mencakup sistem kontrol ultrafiltrasi, pompa reinfusion, dan skala yang
mengukur berat kantong infus secara terus menerus. Teknik ini digunakan selama
bertahun-tahun sebelum modalitas on-line tersedia (Gambar 12). Dalam beberapa
kasus, jumlah reinfusion dapat serendah 3 L per sesi ("soft" HDF) seperti dalam
kasus biofiltrasi atau mencapai 15 L per sesi seperti pada "hard" HDF yang akan
Gambar 11. Classic HDF
b) Acetate-free biofiltration
Acetate-free biofiltration adalah bentuk khusus dari HDF di mana cairan dialisat
dan cairan subsitusi benar-benar terbebas dari asetat. Jumlah rata-rata cairan
pengganti dititrasi berdasarkan tingkat bikarbonat darah dan bervariasi antara 6
hingga 9 L per sesi [8].
c) High-volume HDF (“hard” HDF)
Pada beberapa jenis tipe klasik HDF, jumlah pertukaran cairan dapat mencapai 15
L per sesi atau bahkan lebih. Karena tingkat ultrafiltrasi yang tinggi, arus darah
yang tinggi juga diperlukan, dan cairan subsitusi terkadang diberikan pada mode
predilution (sebelum darah masuk ke dalam tabung dialisat). Meskipun teknik ini
dapat menurunkan efisiensi terapi, tetapi memungkinkan distribusi aliran darah
secara optimal dalam hemodialyzer dan menurunkan konsentrasi polarisasi
protein polarisasi lebih rendah pada membran dialiser [18].
d) On-line HDF
Tingginya biaya cairan subsitusi komersial dan perkembangan dalam teknologi
persiapan cairan dialisat on-line telah mendorong pengembangan teknik baru
yang disebut HDF secara on-line (OLHDF) (Gambar 12). Cairan ultrapure dialisat
diambil dari baris inlet dialisat, diolah dengan beberapa langkah ultrafiltrasi, dan
kemudian diinfusikan kembali sebagai cairan pengganti. Dengan cara ini,
sejumlah besar cairan subsitusi dengan harga yang terjangkau dapat dihasilkan,
dan HDF dapat dilakukan dengan volume cairan yang sangat tinggi (hingga 30-40
L per sesi). Reinfusion cairan dapat diberikan secara pre-atau postdilution atau
Gambar 12. On-line HDF
e) Internal Filtration HDF
Teknik ini merupakan perkembangan dari teknik on-line HDF dimana
backfiltered dialisat digunakan sebagai solusi pengganti dan keseimbangan cairan
dikelola oleh fungsi kontrol volume mesin HD. Jumlah ultrafiltrasi biasanya tidak
dapat dikendalikan dapat menjadi konsekuensi dari pengobatan [28].
f) Paired Filtration Dialysis
Teknik hemodiafiltration ini dikembangkan di Italia. Teknik ini didasarkan pada 2
filter yang ditempatkan secara berurutan. Pertama, hemofilter yang membersihkan
cairan dan zat terlarut dengan proses konveksi, dan yang kedua hemodialyzer
yang membersihkan zat terlarut dengan proses difusi (Gambar 13). Penggantian
cairan infus diberikan di antara 2 unit. Terapi ini meminimalkan interaksi antara
konveksi dan difusi, mencegah backfiltration pada hemodialyzer, dan ultrafiltrasi
dapat diukur sewaktu-waktu untuk sehingga dapat mengontrol pemberian cairan
Gambar 13. Paired Filtration Dialysis
g) Middilution HDF
Saat ini, filter khusus dengan 2 kompartemen membujur telah dikembangkan
untuk menciptakan teknik yang disebut middilution HDF (Gambar 14). Pada
teknik ini, darah mengalir di kompartemen pertama dan memproduksi sejumlah
ultrafiltrasi, pada akhir kompartemen, darah diarahkan berlawanan pada
kompartemen darah kedua. Di ujung vena dari dialyzer, di tempat pelabuhan
vena, terdapat ruang khusus yang dirancang untuk menerima penggantian infus
cairan dan untuk menyusun kembali komposisi darah. Darah kemudian
meninggalkan dialyzer dan masuk ke dalam tubuh. Dialisat dalam sistem ini
mengalir 50% berlawanan darah, sedangkan 50% mengalir bersamaan dengan
Gambar 14. Middilution HDF
h) Double High-Flux HDF
Teknik ini juga digunakan 2 dialyzers high-flux secara berurutan. Filtrasi terjadi
di filter proksimal, sedangkan backfiltration terjadi di unit distal (Gambar 15).
Arus darah yang tinggi digunakan dalam teknik ini, dan efisiensi yang tinggi telah
memungkinkan terapi dilakukan di bawah 2 jam tiap sesinya [5].
i) Push-Pull HDF
Teknik ini menggunakan mekanisme yang mendaorong dan menarik darah secara
bergantian. Hal dapat dilakukan dengan 2 pompa yang terdapat pada pre- dan
postfilter. Ketika pompa postfilter dihentikan, filtrasi terjadi, dan ketika pompa
prefilter dihentikan, tekanan negatif diinduksi dalam kompartemen darah
menghasilkan backfiltration. Terapi ini dapat meningkatkan proses konveksi
sehingga pembersihan darah dapat lebih optimal (Gambar 16) [31].
Gambar 16. Push-pull HDF
Dari modalitas HDF yang telah disebutkan di atas, teknik on-line hemodiafiltrasi menjadi
teknik yang paling efisien dibandingkan dengan teknik lainnya seperti high-flux HDF dan
classic HDF. Teknik on-line HDF, menghasilkan proses konveksi yang lebih tinggi
dibandingkan teknik lainnya sehingga hasil clearance yang diperoleh singnifikan. Selain
itu, terapi ini juga tergolong murah karena tidak membutuhkan cairan infus melainkan
menggunakan cairan dialisat sebagai cairan subsitusi. Meskipun demikian, on-line HDF
membutuhkan sistem penyaringan yang dapat mengubah air keran menjadi cairan steril
Studi Klinis Pada Hemodiafiltrasi
Terapi dialisis yang efisien merupakan faktor utama yang dapat mempengaruhi kualitas
hidup pasien dengan gagal ginjal. Keberhasilan dari dialisis dapat dinilai dari berbagai
aspek termasuk angka kematian, anemia, gizi, dan penyakit kardiovaskular. Beberapa
studi klinis menunjukkan HDF memiliki keunggulan dalam berbagai aspek yang dapat
meningkatkan kualitas hidup pasien. Beberapa keunggulan HDF pada pembuangan zat
toxin dan perbandingannya dengan HD dapat dilihat di bawah ini.
a) Urea
Studi seperti Kerr et al dan Canaud et al, menunjukkan clearance urea dan
kreatinin meningkat pada terapi OLHDF sebesar 10% sampai 15% dari waktu ke
waktu dibandingkan dengan HD [32, 33].
b) Fosfat
Kalsium-fosfat, vitamin D, dan hormon paratiroid telah menjadi faktor penting
yang terkait dengan penyakit kardiovaskular pada patients gagal ginjal [33, 34].
Dengan adanya proses konveksi, clearance fosfat dapat ditingkatkan dengan
metode HDF hingga mencapai 30-35 mmol/L per sesi. Pasien yang mendapat
terapi HDF memiliki kadar fosfat serum lebig rendah dibandingkan dengan
mereka yang mendapat terapi HD [33],
c) β2-mikroglobulin dan Zat terlarut bermolekul besar lainnya
Studi terkontrol dan prospektif telah menunjukkan pengurangan 20% sampai 30% lebih besar dari β2-mikroglobulin per sesi dengan OLHDF dibandingkan dengan HD high-flux [35, 36]. Hal ini dapat membantu dalam mengurangi terjadinya
amyloidosis. Selain itu, molekul ini telah sering digunakan sebagai marker untuk
clearance dari berbagai zat dengan berat molekul sedang. Hal ini menunjukkan
bahwa HDF juga akan lebih efektif dalam menghilangkan racun uremik lebih
besar dibandingkan dengan modalitas difusi. Selain itu, HDF juga telah
menunjukkan dapat membersihkan zat terlarut yang lebih besar seperti mioglobin
dan retina-binding protein [37] serta beberapa protein yang mengikat zat terlarut
glycosylation endproducts) yang berkontribusi dalam terjadinya atherosclerosis
pada pasien gagal ginjal [39]. Selain itu kadar homocysteine, asam amino yang
juga dapat menyebabkan atherosclerosis, berkurang secara signifikan pada terapi
HDF [40]. Kadar leptin juga berkurang secara signifikan pada HDF, dan tingkat
leptin darah yang rendah dapat terlihat pada pasien dengan terapi HDF jangka
panjang. Hal ini berpotensi mendukung perbaikan status gizi pasien dan status
kardiovaskular, meskipun ini titik akhir klinis belum dievaluasi secara mendalam
[41].
Aspek Klinis Pada Hemodiafiltrasi
Sebuah inovasi teknologi dalam terapi, seperti hemodialysis, akan dianggap layak jika
menunjukkan hasil, setidaknya 1 dari berikut: meningkatkan kelangsungan hidup,
meningkatkan kualitas hidup, atau pengurangan komplikasi. Berbagai manfaat klinis
HDF dapat dilihat di bawah ini.
a) Hipotensi pada dialisis
Penghapusan zat terlarut dan cairan secara cepat dapat menyebabkan gejala
hipotensi yang merupakan komplikasi akut yang paling umum dari HD. Dua
puluh persen hingga 30% dari sesi dialisis berkomplikasi terjadi hipotensi dan
gejala yang mengikutinnya seperti kram otot, mual, muntah, dan nyeri kepala
[42]. Hal ini dapat berpengaruh terutama pada pasien lansia, pasien dengan
diabetes, serta pasien dengan penyakit jantung struktural.
Berkurangnya komplikasi tersebut dapat memberikan kontribusi yang signifikan
untuk meningkatkan kualitas hidup pasien gagal ginjal. Pengurangann hipotensi
intradialytic juga memungkinkan penghapusan cairan yang cukup, membantu
memulihkan euvolemia dan kontrol tekanan darah yang lebih baik. Beberapa studi
observasional menunjukkan stabilitas hemodinamik intradialytic lebih baik ketika
pasien dirawat oleh terapi konvektif, termasuk HDF [42]. Studi meta-analisis
terkontrol acak menegaskan bahwa tekanan darah sistolik selama sesi dialisis
secara signifikan lebih tinggi, dan penurunan tekanan sistolik dapat terjadi secara
Mekanisme yang tepat dimana HDF dapat mempertahankan tekanan arteri selama
sesi dialisis tidak sepenuhnya dipahami. Beberapa faktor yang mungkin
berkontribusi pada adaptasi hemodinamik selama HDF, meskipun spekulatif,
diantaranya termasuk konsentrasi natrium yang tinggi dari cairan dialisis dan
cairan substitusi, pelepasan mediator vasokonstriktor, clearance mediator
vasodilator, dan peningkatan aktivitas simpatis memfasilitasi denyut jantung dan
resistensi vaskular.
b) Amyloidosis
Dialysis-related amyloidosis (DRA) adalah gangguan yang disebabkan oleh deposisi β2-mikroglobulin sebagai amiloid fibril pada jaringan. Pengendapan amiloid pada jaringan secara histologis terjadi jauh lebih awal daripada
manifestasi klinis atau radiografi penyakit. Sebuah studi postmortem prospektif
pada pasien yang mendapatkan terapi HD menemukan deposisi amiloid sekitar
21% dari pasien yang menerima HD kurang dari 2 tahun, 50% pada 4 sampai 7
tahun, 90% pada 7 sampai 13 tahun, dan 100% pada lebih dari 13 tahun. Hingga
sampai saat ini, belum ada penelitian yang menunjukkan adanya perbedaan
persentase DRA pada pasien gagal ginjal yang menerima terapi HDF. Hal ini
dikarenakan manifestasi dari DRA timbul setelah deposisi β2-mikroglobulin selama bertahun tahun [43].
c) Anemia
Anemia merupakan faktor risiko independen pada hipertrofi ventrikel kiri dan
kardiovaskular dan kematian pada pasien gagal ginjal dan juga berdampak pada
kualitas hidup. Meski masih kontroversial, beberapa studi menunjukkan bahwa
anemia dapat ditingkatkan pada pasien yang dengan HDF sehingga dapat
mengurangi dosis penggunaan erythropoietin rekombinan (rHuEpo).
Pengkoreksian anemia juga terkait dengan penurunan faktor inflammation. Studi
menunjukkan bahwa HDF meningkatkan pembuangan racun uremik yang lebih
besar dan dengan mengurangi keadaan inflamasi pasien [44].
d) Kualitas hidup
Kualitas hidup telah dinilai secara khusus dalam 2 penelitian secara acak. Lin et al
mereka yang menjalani HD berdasarkan ukuran kesejahteraan pasien [45].
Meskipun demikian, penelitian tersebut masih menggunakan alat scoring yang
belum tervalidasi. Di sisi lain, penelitian lainnya menemukan tidak ada perbedaan
yang signifikan dalam kualitas hidup berdasarkan Kidney Disease Questionnaire
[46].
e) Mortalitas
Sebuah tinjauan sistematis dari 20 studi tentang HDF, HF, dan HD pada penderita
gagal ginjal memeriksa berbagai titik akhir, termasuk mortalitas.30 Meta-analisis
untuk kematian dalam 6 studi (ukuran sampel dikumpulkan = 388) dengan tindak
lanjut mulai dari 12 sampai 48 bulan dan menunjukkan bahwa angka kematian
tidak berbeda nyata untuk modalitas konvektif (HF, HDF, dan acetat-free
biofiltration) dibandingkan dengan HD (risiko relatif, 1,68; 95% confidence
interval, 0,23-12,13). Namun, penilitian tersebut mengingatkan bahwa tidak ada
kematian dalam 4 studi yang dianalisis, dan terdapat adanya heterogenitas
inter-trial yang signifikan [33].
Kesimpulan
Meskipun dengan kemajuan teknologi saat ini, pengobatan HD dan penghapusan zat
terlarut secara difusi memiliki tingkat kematian dan komplikasi yang tinggi. Oleh
karenanya, dibutuhkan modalitas terapi yang lebih baik bagi pasien dengan gagal ginjal.
Modalitas pengobatan yang melibatkan konveksi, seperti HDF, memungkinkan
penghapusan spektrum yang lebih luas dari toxin-toxin uremik, dengan clearance yang
lebih efisien pada molekul berukuran sedang-besar. Teknologi dalam pemurnian cairan
online ultrapure dialisat dan cairan reinfusate telah mengurangi biaya dan kompleksitas
HDF sambil memastikan keamanan dan efisiensi. HDF online memiliki banyak
keuntungan klinis yang potensial dibandingkan dengan HD high-flux seperti dapat
membantu meningkatkan kualitas hidup secara keseluruhan dan juga meningkatkan
kelangsungan hidup pasien gagal ginjal. Meskipun demikian, masih diperlukan adanya
penelitian yang dapat mengkonfirmasi lebih lanjut dari temuan modalitas pengganti ginjal
tersebut dengan uji coba terkontrol menggunakann ukuran sampel dan follow up yang
masing-masing teknik HDF dapat memungkinkan dokter untuk mendapatkan hasil
Daftar Pustaka
1. Kolff, W.J., First Clinical Experience with the Artificial Kidney. Ann Intern Med, 1965. 62: p. 608-19.
2. Henderson, L.W., et al., Blood purification by ultrafiltration and fluid replacement (diafiltration). Hemodial Int, 2004. 8(1): p. 10-8.
3. Henderson, L.W., The beginning of hemofiltration. Contrib Nephrol, 1982. 32: p. 1-19. 4. Henderson, L.W., et al., Hemodiafiltration. J Dial, 1977. 1(3): p. 211-38.
5. Miller, J.H., et al., Technical aspects of high-flux hemodiafiltration for adequate short (under 2 hours) treatment. Trans Am Soc Artif Intern Organs, 1984. 30: p. 377-81.
6. Leber, H.W., et al., Simultaneous hemofiltration/hemodialysis: an effective alternative to hemofiltration and conventional hemodialysis in the treatment of uremic patients. Clin Nephrol, 1978. 9(3): p. 115-21.
7. Kunitomo, T., et al., Clinical evaluation of postdilution dialysis with a combined ultrafiltration (UF)--hemodialysis (HD) system. Trans Am Soc Artif Intern Organs, 1978. 24: p. 169-77.
8. Ronco, C. and D. Cruz, Hemodiafiltration history, technology, and clinical results. Adv Chronic Kidney Dis, 2007. 14(3): p. 231-43.
9. Ledebo, I., On-line hemodiafiltration: technique and therapy. Adv Ren Replace Ther, 1999. 6(2): p. 195-208.
10. Sargent, J.A. and F.A. Gotch, Replacement of Renal Function by Dialysis, in Principles and biophysics of dialysis1996: Dordrecht, The Netherlands: Kluwer. p. 35–96.
11. Maduell, F., Hemodiafiltration. Hemodial Int, 2005. 9(1): p. 47-55.
12. Eknoyan, G., et al., Effect of dialysis dose and membrane flux in maintenance hemodialysis. N Engl J Med, 2002. 347(25): p. 2010-9.
13. Ledebo, I., Principles and practice of hemofiltration and hemodiafiltration. Artif Organs, 1998.
22(1): p. 20-5.
14. Beerenhout, C.H., et al., Pre-dilution on-line haemofiltration vs low-flux haemodialysis: a randomized prospective study. Nephrol Dial Transplant, 2005. 20(6): p. 1155-63.
15. Jaffrin, M.Y., Convective mass transfer in hemodialysis. Artif Organs, 1995. 19(11): p. 1162-71. 16. Joyeux, V., et al., Optimized convective transport with automated pressure control in on-line
postdilution hemodiafiltration. Int J Artif Organs, 2008. 31(11): p. 928-36.
17. Leber, H.W., et al., Hemodiafiltration: a new alternative to hemofiltration and conventional hemodialysis. Artif Organs, 1978. 2(2): p. 150-3.
18. Pedrini, L.A., et al., Transmembrane pressure modulation in high-volume mixed
21. Schiffl, H., High-flux dialyzers, backfiltration, and dialysis fluid quality. Semin Dial, 2011. 24(1): p. 1-4.
23. Ledebo, I., Ultrapure dialysis fluid--direct and indirect benefits in dialysis therapy. Blood Purif, 2004. 22 Suppl 2: p. 20-5.
24. Ledebo, I., Ultrapure dialysis fluid--how pure is it and do we need it? Nephrol Dial Transplant, 2007. 22(1): p. 20-3.
25. Ledebo, I., Ultrapure dialysis fluid: improving conventional and daily dialysis. Hemodial Int, 2004.
8(2): p. 159-66.
26. Ledebo, I., On-line preparation of solutions for dialysis: practical aspects versus safety and regulations. J Am Soc Nephrol, 2002. 13 Suppl 1: p. S78-83.
27. Canaud, B., et al., On-line hemodiafiltration as routine treatment of end-stage renal failure: why pre- or mixed dilution mode is necessary in on-line hemodiafiltration today? Blood Purif, 2004.
22 Suppl 2: p. 40-8.
28. Fiore, G.B., et al., A new semiempirical mathematical model for prediction of internal filtration in hollow fiber hemodialyzers. Blood Purif, 2006. 24(5-6): p. 555-68.
29. Mandolfo, S., et al., Evaluation of hygiene and safety controls for on-line paired hemodiafiltration (PHF). Int J Artif Organs, 2006. 29(2): p. 160-5.
30. Santoro, A., et al., Mid-dilution: the perfect balance between convection and diffusion. Contrib Nephrol, 2005. 149: p. 107-14.
31. Miwa, M. and T. Shinzato, Push/pull hemodiafiltration: technical aspects and clinical effectiveness. Artif Organs, 1999. 23(12): p. 1123-6.
32. Kerr, P.B., et al., Comparison of hemodialysis and hemodiafiltration: a long-term longitudinal study. Kidney Int, 1992. 41(4): p. 1035-40.
33. Canaud, B., et al., Mortality risk for patients receiving hemodiafiltration versus hemodialysis: European results from the DOPPS. Kidney Int, 2006. 69(11): p. 2087-93.
34. Lornoy, W., et al., Impact of convective flow on phosphorus removal in maintenance hemodialysis patients. J Ren Nutr, 2006. 16(1): p. 47-53.
35. Lin, C.L., et al., Long-term on-line hemodiafiltration reduces predialysis beta-2-microglobulin levels in chronic hemodialysis patients. Blood Purif, 2001. 19(3): p. 301-7.
36. Rabindranath, K.S., et al., Comparison of hemodialysis, hemofiltration, and acetate-free biofiltration for ESRD: systematic review. Am J Kidney Dis, 2005. 45(3): p. 437-47.
37. Maduell, F., et al., Osteocalcin and myoglobin removal in on-line hemodiafiltration versus low- and high-flux hemodialysis. Am J Kidney Dis, 2002. 40(3): p. 582-9.
38. Bammens, B., et al., Removal of the protein-bound solute p-cresol by convective transport: a randomized crossover study. Am J Kidney Dis, 2004. 44(2): p. 278-85.
39. Lin, C.L., et al., Reduction of advanced glycation end product levels by on-line hemodiafiltration in long-term hemodialysis patients. Am J Kidney Dis, 2003. 42(3): p. 524-31.
40. Gonella, M., et al., The achievement of normal homocysteinemia in regular extracorporeal dialysis patients. J Nephrol, 2004. 17(3): p. 411-3.
41. Wiesholzer, M., et al., Inappropriately high plasma leptin levels in obese haemodialysis patients can be reduced by high flux haemodialysis and haemodiafiltration. Clin Sci (Lond), 1998. 94(4): p. 431-5.
42. Donauer, J., et al., Reduction of hypotensive side effects during online-haemodiafiltration and low temperature haemodialysis. Nephrol Dial Transplant, 2003. 18(8): p. 1616-22.
43. Locatelli, F., et al., Comparison of mortality in ESRD patients on convective and diffusive extracorporeal treatments. The Registro Lombardo Dialisi E Trapianto. Kidney Int, 1999. 55(1): p. 286-93.
44. Sitter, T., A. Bergner, and H. Schiffl, Dialysate related cytokine induction and response to recombinant human erythropoietin in haemodialysis patients. Nephrol Dial Transplant, 2000.
45. Lin, C.L., et al., Clinical improvement by increased frequency of on-line hemodialfiltration. Ren Fail, 2001. 23(2): p. 193-206.
46. Ward, R.A., et al., A comparison of on-line hemodiafiltration and high-flux hemodialysis: a prospective clinical study. J Am Soc Nephrol, 2000. 11(12): p. 2344-50.
47. Ursino, M., et al., A mathematical model for the prediction of solute kinetics, osmolarity and fluid volume changes during hemodiafiltration with on-line regeneration of ultrafiltrate (HFR). Int J Artif Organs, 2006. 29(11): p. 1031-41.