PEMBUATAN MEMBRAN KALSIUM ALGINAT KITOSAN SERTA PENGUJIAN PERMEABILITASNYA
SKRIPSI
DEWI REGINA SILITONGA NIM : 050802020
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
2009
PEMBUATAN MEMBRAN KALSIUM ALGINAT-KITOSAN SERTA PENGUJIAN PERMEABILITASNYA
SKRIPSI
Diajukan untuk melengkapai tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEWI REGINA SILITONGA NIM : 050802020
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PEMBUATAN MEMBRAN KALSIUM
ALGINAT-KITOSAN SERTA PENGUJIAN PERMEABILITASNYA
Kategori : SKRIPSI
Nama : DEWI REGINA SILITONGA
Nomor Induk Mahasiswa : 050802020 Program Studi : SARJANA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA ) UNIVERSITAS
SUMATERA UTARA
Disetujui di :
Medan, November 2009
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Herlince Sihotang. M.Si Prof.Dr. Jamaran Kaban.M.Sc NIP. 195503251986012002 NIP. 19510630198002001 Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU
PERNYATAAN
PEMBUATAN MEMBRAN KALSIUM ALGINAT-KITOSAN SERTA PENGUJIAN PERMEABILITASNYA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing masing disebutkan sumbernya.
Medan, November 2009
PENGHARGAAN
Segala Puji dan Syukur penulis panjatkan kepada Tuhan Yesus Krisus atas segala kasih karunia dan berkatNya sehingga penulis dapat meyelesaikan penelitian dan penyusunan skripsi ini. Dalam pelaksanaan penelitian hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, motivasi adn dukungan dari berbagai pihak.Untuk itu pada kesempatan ini penulis menyampaikan terimakasih kepada :
1. Prof.Dr.Jamaran Kaban.M.Sc sebagai pembimbing 1 dan Dra.Herlince Sihotang.M.Si sebagai pembimbing 2 yang dengan sabar telah memberikan dorongan , bimbingan dan saran sehingga skripsi ini dapat diselesaikan
2. Dr.Rumondang Bulan Nst.MS dan Drs.Firman Sebayang,MS sebagai ketua dan sekretaris Departemen Kimia FMIPA USU
3. Drs.Adil Ginting MSc, sebagai Kepala Laboratorium Kimia Organik FMIPA USU dan kepada bapak/ibu dosen Organik Bapak Drs.Darwis Surbakti MS , Bapak Drs.Mimpin Ginting MS, dan Ibu Juliati Tarigan S.Si,M.Si atas segala dorongan dan waktu diskusinya
4. Seluruh dosen Departemen Kimia FMIPA USU terkhusus ibu Dra.Nurhaida Pasaribu.M.Si selaku dosen wali yang telah memberikan waktunya untuk memberikan bimbingan selama penulis mengikuti kuliah di Departemen Kimia. 5. Prof.Dr. Hakim Bangun, Apt, teman-teman asisten Laboratorium Teknologi
formulasi dan teman-teman asisten Laboratorium Farmasi Kuantitatif atas fasilitas, sarana dan kerjasama nya selama ini.
6. Bapak AKBP.Drs.Tarsim Tarigan,M.Si yang telah menyediakan waktu dan membimbing penulis dalam menyelesaikan penelitian.
7. Kelompok ”Helios” (Jubel,Julianto,Vera,Raffles,Donald dan K’Sani) beserta adik-adik kelompokku ( Mutiara,Mompo,Fiona,Christin,Defi dan Sondang ) buat seluruh kasih sayang, dukungan doa dan perhatiannya.
melakukan penelitian ini, juga kepada teman terkasih Dolihar Damanik yang telah mendukung dalam penyelesaian penelitian ini.
9. Teman-teman Asisten Laboratoium Kimia Organik (Bg daus, Yemima, Robi, Aspriadi, Maria dan Meri ) serta Bg Abdi Suranta S.Si yang telah banyak membantu dalam meyelesaikan penelitian ini.
10.Teman-teman kostku (Desi, Ina, Berni, Becka, K’Cory, K’juni, Bg Eydu, David,dkk) buat kebersamaan dan semangat nya.
11.Pihak-pihak yang tidak disebutkan namun tulus membantu penulis dalam penyelesaian skripsi ini.
Akhirnya saya mengucapkan terimakasih yang setinggi tingginya untuk kedua orangtua saya Bapak (H.Silitonga) dan Mama (E.Simanjuntak) dan kepada saudara-saudaraku tersayang (K’Anita Silitonga,Spd , K’Iin Silitonga SP, Ivan Silitonga, Bg Boy Nainggolan S.ST), Nenek ku terkasih serta seluruh keluarga besar yang telah meberikan kasih sayang, motivasi dan dukungan yang sangat besar untuk keberhasilan penulis.
Semoga Tuhan selalu memberikan rahmat dan kasih karuniaNya kepada kita semua.
ABSTRAK
Telah dilakukan pembuatan membran kalsium alginat-kitosan serta pengujian karakteristiknya. Pembuatan membran tersebut dilakukan dengan menginteraksikan polikationik kitosan dengan polianionik alginat. Selanjutnya polielektrolit yang terbentuk direaksikan dengan CaCl2 membentuk khelat. Dalam karakteristisasi
ABSTRACT
The prepared of membrane calcium alginate-chitosan with examined the
characteristic has been studied. This study can be prepared by mixing of polycationic
of chitosan with polyanionic of alginate. Then polyelectrolyte of alginate chitosan was
reacted with calcium chloride to form chelate. The tensile strength have load and
stroke 0.16 and 2.81, scanning electron microscope (SEM) showed the surface
morphology and diffusion of urea, sodium salycilate and albumin were examined the
characteristic in this study. This study showed that membrane calcium
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiii
DAFTAR LAMPIRAN... xiv
BAB 1. PENDAHULUAN 1.1.Latar Belakang ... 1
1.2.Permasalahan ... 2
1.3.Pembatasan Masalah... 2
1.4.Tujuan Penelitian ... 3
1.5.Manfaat Penelitian... 3
1.6.Metodologi Penelitian ... 3
1.7.Lokasi Penelitian ...3
BAB 2. TINJAUAN PUSTAKA 2.1. Kitin ... 4
2.1.1. Sumber ... 4
2.1.2. Struktur ... 4
2.1.3. Sifat-Sifat Fisika dan Kimia ... 5
2.1.3.2. Sifat Kimia ...5 BAB 3. BAHAN DAN METODE PENELITIAN 3.1. Alat-Alat ... 16
3.2. Bahan-Bahan ... 16
3.3. Prosedur Penelitian ... 17
3.3.1. Pembuatan Membran Kalsium Alginat-Kitosan ... 17
3.3.2. Uji Kekuatan Tarik Membran Kalsium Alginat-Kitosan ... 17
3.3.3. Uji Difusi Urea, Na-Salisilat dan Albumin melalui membran Kalsium Alginat Kitosan ...17
3.3.3.1. Pembuatan Larutan Induk Baku (LIB) ...17
3.3.3.1.1. Pembuatan LIB Urea ...17
3.3.3.1.2. Pembuatan LIB Na-Salisilat...18
3.3.3.1.3. Pembuatan LIB Albumin... 18
3.3.3.2. Penentuan maksimum Urea, Na-salisilat dan Albumin ...18
3.3.3.2.1. Penentuan maksimum urea ...18
3.3.3.2.2. Penentuan maksimum Na-Salisilat ...18
3.3.3.2.3. Penentuan maksimum Albumin...18
3.3.3.3.3. Pembuatan Kurva Kalibrasi Albumin ... 19
3.3.3.4. Uji Difusi ... 19
3.3.3.4.1. Uji Difusi Urea ...19
3.3.3.4.2. Uji Difusi Na-Salisilat... 20
3.3.3.4.3. Uji Difusi Albumin... 20
3.4. Bagan Penelitian... 21
BAB 4. HASIL DAN PEMBAHASAN 4.1. Membran Kalsium Alginat-Kitosan... 29
4.2. Scanning Electron microscope(SEM)... 31
4.3. Uji Kekuatan Tarik... 33
4.4. Uji difusi dan fluks membran kalsium alginat kitosan... 36
DAFTAR GAMBAR
Gambar 1. Struktur Kitin Gambar 2. Strukutur Kitosan
Gambar 3. Struktur α-L Guluronat dan β-D-Mannuronat Gambar 4. Kalsium berada pada blok G(egg in egg box) Gambar 5. Hemodialisis
Gambar 6. Proses difusi pada penampang melintang membran. Gambar 7. Interaksi ionik antara alginat dan kitosan pada pH 5.4 Gambar 8. Pembentukan khelat kalsium alginat-kitosan
Gambar 9. Foto Permukaan kalsium alginat kitosan menggunakan SEM (400x perbesaran)
Gambar 10. Foto Permukaan kalsium alginat-kitosan sebelum difusi menggunakan
SEM (200x perbesaran)
Gambar 11. Foto Permukaan kalsium alginat-kitosan (dawolo, 2005)
DAFTAR TABEL
Tabel 1. Komposisi dari Asam alginat berdasarkan anatomi tumbuhan Tabel2. Ketebalan membran kalsium alginat-kitosan
Tabel 3. Data kekuatan tarik (Load) kekuatan regangan pada membran Kalsium-Alginat-Kitosan
Tabel 4. Perbandingan nilai stroke dan load pada berbagai jenis membran Tabel 5. Data Kemuluran dan Kekuatan tarik membran kalsium alginat-Kitosan Tabel 6. Data Konsentrasi zat yang terdifusi melalui membran kalsium kitosan.
DAFTAR LAMPIRAN
Lampiran 1. Data dan Kurva kalibrasi Urea Lampiran 2. Data dan Kurva kalibrasi Na-Salisilat Lampiran 3. Data dan Kurva kalibrasi Albumin
Lampiran 4. Penetrasi rata-rata Urea melalui membran Kalsium Alginat-Kitosan Lampiran 5. Penetrasi rata-rata Na-Salisilat melalui membran Kalsium
Alginat-Kitosan
Lampiran 6. Penetrasi rata-rata Albumin melalui membran Kalsium Alginat-Kitosan Lampiran 7. Tabel data Fluks urea melalui membran kalsium alginat-kitosan.
ABSTRAK
Telah dilakukan pembuatan membran kalsium alginat-kitosan serta pengujian karakteristiknya. Pembuatan membran tersebut dilakukan dengan menginteraksikan polikationik kitosan dengan polianionik alginat. Selanjutnya polielektrolit yang terbentuk direaksikan dengan CaCl2 membentuk khelat. Dalam karakteristisasi
ABSTRACT
The prepared of membrane calcium alginate-chitosan with examined the
characteristic has been studied. This study can be prepared by mixing of polycationic
of chitosan with polyanionic of alginate. Then polyelectrolyte of alginate chitosan was
reacted with calcium chloride to form chelate. The tensile strength have load and
stroke 0.16 and 2.81, scanning electron microscope (SEM) showed the surface
morphology and diffusion of urea, sodium salycilate and albumin were examined the
characteristic in this study. This study showed that membrane calcium
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Alginat merupakan polisakarida linear yang disusun oleh residu asam β -D-manuronat dan α-L-guluronat dan dihubungkan melalui ikatan 1, 4. Alginat berasal dari alga cokelat sejenis tumbuhan laut. Alginat telah diketahui merupakan polisakarida yang tidak bersifat toksis, tidak menyebabkan alergi bersifat biodegradabel dan juga biokompatibel (Robinson, 1987)
Asam alginat tidak larut dalam air sehingga yang biasa digunakan dalam air adalah natrium alginate. Salah satu sifat dari larutan natrium alginat adalah jika dilarutkan dengan larutan kalsium klorida segera terbentuk gel kalsium alginat yang tidak larut dalam air. Ikatan antara kalsium dengan alginat adalah ikatan khelat yaitu antara kalsium dengan rantai L-guluronat dari alginat (Morris et al, 1978)
Kitosan merupakan polisakarida yang terdapat dalam jumlah yang melimpah di alam. Kitosan adalah poli[β-(1,4)-2 amino-2deoxy-D-glukopiranosa] dan merupakan produk deasetilasi kitin. Material ini telah banyak digunakan dalam bidang biomedis dan farmasetika karena sifatnya yang biodegradabel, biokompatibel dan tidak beracun (Adriana et al, 2003)
Alginat yang merupakan polianionik dan kitosan yang polikationik bila dilarutkan pada kondisi yang tepat dapat berinteraksi satu sama lain melalui gugus karbonil dari alginat dan gugus amino dari kitosan . Kompleks polielektrolit yang terbentuk diharapkan dapat memberikan aplikasi yang lebih baik karena keunikan struktur dan sifatnya. Sejauh ini kompleks polielektrolit alginat kitosan banyak dimanfaatkan sebagai serat, kapsul dan butiran. Sementara publikasi mengenai pemanfaatannya sebagai membran masih terbatas. Di sisi lain, kitosan yang bersifat basa dan mudah larut dalam media asam banyak digunakan dalam pembuatan gel dan beberapa variasi konfigurasi seperti butiran, membran pelapis, kapsul, serat dan spon.
tujuan dialisis. Kitosan yang merupakan derivat kitin juga berpotensi untuk digunakan sebagai membran (Meriaty,2005 : Krajang S, 2000).
Peneliti terdahulu telah berhasil membuat membran kitin dalam sistem pelarut asam trikloro asetat-diklorometan dan selanjutnya diuji sifat difusinya terhadap beberapa senyawa dengan berat molekul yang berbeda untuk melihat terdifusinya senyawa-senyawa tersebut (Tarigan T, 2006).
Demikian juga pembuatan kompleks polielektrolit alginat kitosan yang digunakan untuk membran hemodialisa (Adriana,2006 : Dawolo,2006). Pada membran alginat kitosan diperoleh kekuatan tarik yang lemah sehingga peneliti ingin membuat membran kalsium alginat kitosan yang lebih kuat karena adanya ikatan silang didalam membran kalsium alginat-kitosan dibandingkan dengan membran alginat kitosan. Membran Kalsium Alginat-Kitosan dilakukan pengujian permeabilitasnya yang diharapkan dapat dimanfaatkan sebagai membran hemodialisis.
1.2. Permasalahan
Bagaimanakah sifat permeabilitas dari membran kalsium alginat-kitosan dan apakah membran tersebut dapat berpotensi sebagai membran hemodialisa.
1.3.Pembatasan Masalah
Penentuan permeabilitas dari membran kalsium alginat kitosan didasarkan pada perbedaan berat molekul dari urea, natrium-salisilat dan albumin sehingga dapat diuji apakah berpotensi digunakan sebagai membran hemodialisa.
1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui sifat permeabilitas dari Urea,Na-Salisilat dan Albumin dan hubungannya pada membran kalsium alginat -kitosan.
1.5.Manfaat Penelitian
1.6.Metodologi penelitian
Metodologi penelitian yang digunakan adalah :
Pembuatan membran kalsium alginat-kitosan dilakukan dengan menginteraksikan natrium alginat dengan kitosan, selanjutnya diberikan larutan CaCl2. Pengujian difusi
membran kalsium alginat-kitosan yang dilakukan dengan menggunakan 3 jenis penetran yaitu urea, natrium salisilat dan albumin dengan variasi waktu tertentu. Kemudian dilakukan uji kekuatan tarik dari membran tersebut dan uji scanning elektron mikroskop (SEM) untuk melihat morfologi dari membran tersebut.
1.7.Lokasi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. Kitin
Kitin berasal dari bahasa Yunani ”Kiton” yang berarti baju rantai dari besi. Hal ini sesuai dengan fungsinya sebagai jaket pelindung untukm hewan-hewan golongan invetebrata. Kitin tersebar luas di alam dan merupakan senyawa organik kedua yang sangat melimpah di bumi setelah sellulosa (Rudall K.M.,1973). Setiap tahun dari perairan (laut) dihasilkan sekitar 1011 ton kitin namun kurang dari 0,1% yang dimanfaatkan kembali (Skjak-Braek& Sanford,1989).
2.1.1. Sumber
2.1.2. Stuktur
Kitin adalah suatu polisakarida linear yang terdiri dari senyawa poli [β-(1,4)-2 asetamido deoksi-D-glukopiranose. Struktur kristal kitin serupa dengan selulosa didalam ikatan hidrogen didalam rantai dan antara satu rantai dengan rantai yang lainnnya. Strukutur kitin dapat dilihat dari gambar dibawah ini.
O
Gambar 1. Struktur Kitin
Unit penggunaan struktur kitin mengandung dua residu heksosa dan ketobiosa. Kitin mempunyai rumus molekul (C8H13NO5)n yang mengandung jumlah atom C =
47,29%,H = 6,45%,N = 6,89% dan O = 39,37% (Austin , 1981).
Dalam struktur kitin (N-asetil D-glukosianin) bahwa β-piranosa merupakan komponen utama dari kitin ( substansi yang dibentuk dari skleton dan arthropoda) (Carey,1987). Kitin merupakan komponen yang tidak larut dalam air dan sangat tahan pada hidrolisa yang terjadi dan salah satu bagian dari sakarida (Willbraham,1989). Kitin adalah polimer kedua terbanyak di alam setelah selulosa.
2.1.3. Sifat-Sifat Fisika dan Kimia 2.1.3.1. Sifat Fisika
Kitin merupakan bahan yang mirip dengan sellulosa yang sama-sama memiliki sifat-sifat dalam hal kelarutannya dan reaktifitasnya yang rendah. Kitin yang berwarna putih, keras, tidak elastis, polisakarida yang mengandung nitrogen. Kitin dapat larut dalam HCl, H2SO4, H3PO4, dikoloroasetat, trikloroasetat dan asam formiat. Kitin juga
larut dalam larutan pekat garam netral yang panas (Synowiecki,2003). 2.1.3.2. Sifat Kimia
kitin bereaksi dengan α-asam amino (terutama tirosin ) dan protein kutikular akan membentuk kompleks stabil namun mudah terdisosiasi setelah pH berubah. Kitin dapat dianggap sebagai basa lemah, oleh karena itu dapat mengalami reaksi netralisasi sebagai senyawa yang bersifat alkali (Taranathan & Kittur,2003).
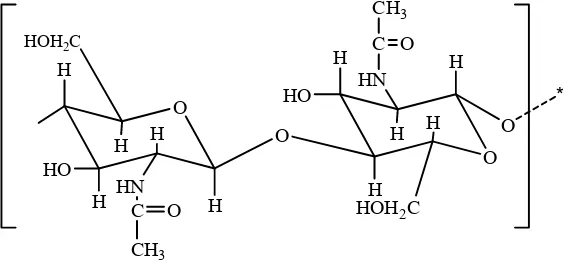
2.2. Kitosan 2.2.1. Struktur.
Kitosan adalah suatu rantai linear dari Glukosamin dan N-Asetil D-Glukosamin yang terangkai pada posisi β(1-4).Kitosan dihasilkan dari deasetilasi kitin. Karena dalam bentuk kationik, bentuk kitosan yang tidak larut dalam air akan membentuk polielektronik dengan anion polielektrolit. Kitosan telah digunakan dalam bidang biomedikal dan farmasi karena kitosan bersifat biokompatibel,biodegradasi dan tidak beracun (Adriana et al,2003).
Kitosan juga terdapat secara alami dalam beberapa jamur namun tidak sebanyak kitin. Struktur idealnya dapat dilihat dari gambar 2:
O
Gambar 2. Struktur Kitosan
Karena adanya gugus amino,kitosan merupakan polielektrolit kationik( pKa ≈ 6,5) hal yang sangat jarang terjadi secara alami. Sifat yang basa ini menjadikan kitosan :
c.Dapat digunakan sebagai pengkhelat ion logam berat dimana gelnya menyediakan sistem produksi terhadap efek dekstruksi dari ion (Meryati,2005).
2.2.2 Sifat- Sifat Fisika dan Kimia 2.2.2.1. Sifat Fisika
Kitosan adalah padatan amorf putih yang tidak larut dalam alkali dan asam mineral kecuali pada keadaan tertentu. Kitosan merupakan molekul polimer yang mempunyai berat molekul tinggi. Kitosan dengan berat molekul yang tinggi didapati dengan mempunyai vikositas yang baik dalam suasana asam. Kitosan hasil destilasi kitin, larut dalam asam encer seperti asam asetat, asam formiat, dll. Kitosan dapat membentuk gel dalam n-metilmorpin n-oksida yang dapat digunakan dalam formulasi pelepasan obat terkendali. Kandungan nitrogen dalam kitin berkisar 5-8% tergantung pada tingkat deasetilasi sedangkan nitrogen pada kitosan kebanyakan dalam bentuk gugus amino. Maka kitosan bereaksi melalui gugus amino dalam pembentukan N-asilasi dan reaksi Schiff yang merupakan reaksi yang penting (Kumar, 2000).
2.2.2.2 Sifat Kimia
Adanya gugus amino dan hidroksil dari kitosan juga menyebabkan kitosan mudah dimodifikasi secara kimia antara lain dalam reaksi pembentukan:
a. N-Asil
Metode yang paling sederhana adalah dengan mereaksikan asam karboksilat dengan kitosan. Pemanasan larutan kitosan dalam asam formiat 100% pada suhu 90oC dengan penambahan piridin sedikit demi sedikit untuk menghasilkan N-formilatosan serta Asetil dalam asetat 20%. Pereaksi yang paling banyak digunakan untuk N-Asilasi kitosan adalah asil anhidrida,baik dalam kondisi homogen dan heterogen. b. O-Asilasi
Gugus Amino kitosan lebih reaktif daripada gugus hidroksilnya. Gugus amino perlu diproteksi selama proses asilasi untuk menghasilkan O-Asil Kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan untuk mencegah hidrolisis asam dan basa Schiff.
Pembuatan O-Asetil kitosan dapat juga dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan HClO4 dengan asumsi protonasi akan mencegah terjadinya N-Asetilasi.
klorida berlebih-piridin-kloroform dan ditambah asam klorida sesudah direfluks 5 jam. Produk yang diperoleh sesudah 9 jam larut dalam kloroform, benzene, dietil eter dan piridin.
c. Eter Kitosan
Pembuatan derivate alkil kitosan dapat dilakukan dengan 2 cara yaitu O-Alkilasi kitin disusul pengurangan N-Asetilasi dan O-O-Alkilasi derivat kitosan dimana gugus amino diproteksi selama reaksi selama reaksi alkilasi.
Karboksilmetil kitosan yang diperoleh melalui prosedur pertama menghasilkan garam natrium dengan gugus amin bebas dalam bentuk busa ataupun garam hidroklorida dari asam amino dengan gugus karboksimetil dalam bentuk asam. Sensitifitas terhadap penambahan elektrolit meningkat dengan bertambahnya karboksimetilasi. Perlakuan alkali kitin dengan epiloklorohidrin pada 0-15oC disusul deasetilasi menghasilkan O-hidroksialkil kitosan (Kaban, 2007).
Karena kitin dan kitosan merupakan bahan alam maka keduanya lebih bersifat biokompatibel dan biodegradabel dibanding dengan polimer sintetik. Kitin dan kitosan serta senyawa turunannya telah banyak diaplikasikan dalam berbagai industri. Nilai total perdagangan bahan-bahan tersebut pada tahun 2002 mencapai 112 trilyun rupiah (Toharisman, 2007).
2.3. Alginat
Alginat merupakan kopolimer linear yang terdiri atas β-D-Mannuronat dan α -L-Guluronat yang dihubungkan dengan ikatan (1-4) membentuk homopolimer yang disebut dengan M atau G dan heteropilmer yang disebut dengan MG. Karena adanya kapasitas gel pada kation divalen sehingga dapat digunakan dalam berbagai aplikasi seperti makanan, kosmetik,dan industri farmasi (Adriana et al,2003).
2.3.1. Struktur dan Komposisi
OH-M(Alg)2 + 2Na+ 2NaAlg + M2+
Proses pertukaran ion alginat dilakukan dengan mineral asam sebelum diekstraksi dengan alkali.
Ca(Alg) + 2H+ 2Halg + Ca2+ Halg + Na+ OH- NaAlg + H+
Larutan natrium alginat kasar yang diperoleh di filtrasi dan diendapkan dengan Ca2+ untuk membentuk garam kalsium yang tidak larut. Selanjutnya pemisahan dilakukan dengan proses acidfikasi untuk memisahkan asam alginat dan ion-ion kalsium.
2NaAlg + Ca2+ Ca(Alg)2 + 2Na+
Ca(Alg)2 + 2H+ 2HAlg + Ca2+
Kemudian gel asam alginat, setelah didehidrasi dicampurkan dengan alkali ( Na2CO3)
untuk membuat kembali garam natrium yang larut. Halg + Na+ OH- NaAlg
Akhirnya diperoleh pasta natrium alginat lalu dikeringkan dan digiling untuk memperoleh bubuk natrium alginat (Zhanjiang, 1990).
Setiap produksi dari tanaman ini menghasilkan jenis-jenis alginat yang berbeda-beda dimana jumlahnya tergantung pada masa panennya dan bagian anatomi dari tumbuhan itu sendiri, dan dapat dilihat dari tabel dibawah ini:
Tabel 1. Perbandingan asam uronat dalam berbagai spesies alga
Nama Spesies Perbandingan asam uronat (%)
Asam Guluronat (G) Asam Mannuronat (M) Ascophyllum nodosum
yang besar, sedangkan yang mengandung asam mannuronat yang tinggi mempunyai struktur yang tidak kaku (Prakash,S.,dkk, 2004).
Gambar 3. α-L-Guluronat dan β-D-Mannuronat 2.3.2. Sifat dan Kegunaan.
Asamalginat tidak dapat larut dalam air dan secara umum pada industri untuk melarutkannya dilakukan dengan penambahan natrium ataupun kalsium. Salah satu sifat dari larutan natrium alginat adalah jika dicampurkan dengan larutan kalsium klorida akan membentuk gel kalsium alginat, yang tidak larut dalam air. Ikatan antara kalsium dengan alginat adalah ikatan khelat yaitu antara kalsium dengan rantai L-Guluronat dari alginat (Morris et al,1978).
Ikatan ionik dapat dibentuk diantara gugus karboksilat dan Ca2+ dengan ikatan hidrogen diantara gugus hidroksi. Ketika blok G tersusun paralel berbentuk pola rantai seperti dengan lubang-lubang yang sangat ideal sebagai tempat pengikatan kalsium ini menyerupai telur dalam kotaknya (egg in an egg box) dan dapat dilihat sebagai berikut:
Gel terbentuk melalui reaksi kimia dimana kalsium menggantikan natrium dengan alginat mengikat molekul molekul alginat yang panjang sehingga membentuk gel. Tergantung dari jumlah kalsium yang memberikan assosiasi sementara dan meningkatkan viskositas larutan, sementara kandungan kalsium yang tinggi menghasilkan assosiasi permanen yang menyebabkan pengendapan atau gelatin. Gel yang lebih homogen dan stabil dapat diperoleh melalui pendinginan yang lambat larutan alginat dengan adanya ion kalsium. Gel yang dibentuk selama pendinginan secara kimia lebih mudah dikontrol dan tidak mudah meleleh bila dipanaskan walaupun terdegradasi pada pH yang ekstrim (Robinson,1987).
Kegunaan dari alginat didasarkan pada 3 sifat utamanya adalah :
a. Kemampuan untuk larut dalam air serta meningkatkan viskositas larutan. b. Kemampuannya untuk membentuk gel.
c.Kemampuannya untuk membuat film (natrium alginat) dan serat (kalsium alginat).
Dalam industri tekstil, alginat digunakan sebagai pengental pasta yang mengandung zat pewarna. Bahan pengental lain seperti pati sering digunakan tetapi bereaksi dengan bahan pengaktif pewarna, sehingga menghasilkan warna yang lebih rendah dan kadang-kadang limbahnya sulit untuk dicuci. Alginat tidak bereaksi dengan zat pewarna dan dengan mudah dicuci dari tekstil sehingga alginat menjadi pengental yang terbaik untuk zat pewarna (Mchugh, 2003). Alginat digunakan dalam pembuatan membran sebagai sistem penyampaian obat tipikal baru, povidon iodium sebagai obat dimana membran alginat dapat berfungsi sebagai reservoir obat, membran dapat menyerap air dan melepaskan obat (Bangun.H.,1990).
2.4. Membran
Kata membran berasal dari bahasa latin yaitu ’membrane’ yang berarti potongan kain. Saat ini istilah membran didefenisikan sebagai lapisan tipis ( film ) yang fleksibel, pembatas antara fasa yang bersifat semipermiabel ( Jones, 1987). Membran dapat berupa padatan ataupun cairan dan berfungsi sebagai media pemisahan yang selektif berdasarkan perbedaan koefisien difusivitas, muatan listrik atau kelarutan.
penyusun tubuh kita dibungkus dengan membran. Membran sel sangat bersifat selektif sehingga hanya zat-zat tertentu saja yang dapat melaluinya. Pada tahun 1855 membran baru dikembangkan secara kecil-kecilan dalam skala laboratoriumnya oleh Fick. Saat ini pemakaian membran telah meluas pada berbagai bidang meliputi industri logam (kontrol polusi, recorveri bahan-bahan kimia), industri pulp dan kertas (pengganti evaporasi, kontrol polusi, recorveri serta bahan-bahan kimia), kesehatan dan medis (organ artifisial, control release untuk obat, fraksionasi darah, sterilisasi, pemurnian air) dan pengelolahan limbah( pemisahan garam, deionisasi).
Pengelompokan membran dapat dilakukan atas dasar berbagai hal. Atas dasar material yang digunakan membran dapat dikelompokkan menjadi membran polimer, liquid membran, padatan (keramik) dan membran penukar ion. Berdasarkan konfigurasinya membran dapat dikelompokkan memnjadi lembaran, lilitan spiral (spiral warna), tubular dan emulsi (Mulder,1996)
2.4.1. Membran Filtrasi
Berdasarkan besar kecilnya ukuran material yang dapat melewatinya membran dapat dibagi menjadi 4 kelompok yaitu mikrofiltrasi, ultrafiltrasi, nanofiltrasi dan reverse osmosis.
a.Mikrofiltrasi
Membran mikrofiltrasi(MF) dapat dibedakan dari reverse osmosis(RO) dan ultrafiltrasi(UF) berdasarkan ukuran partikel yang dapat dipisahkan. Pada membran mikroultrafiltrasi, garam-garam tidak dapat direjeksi oleh membran. Proses foltrasi dapat dilaksanakan pada tekanan yang cukup rendah yaitu dibawah 2 bar. Membran mikrofiltrasi dapat dibuat dari berbagai macam material anorganik ataupun organik. Membran anorganik banyak digunakan karena ketahanannya pada suhu tinggi dan zat kimia.Membran mikrofiltrasi memiliki ukuran pori antara 0.05 sampai 10 m dan tebal 10-15 m.
0.0001 m 0.001 m 0.1 m
b.Ultrafiltrasi
Proses ultrafiltarsi(UF) berada diantara proses nanofiltasi dan makrofiltrasi. Ukuran pori membran berkisar antara 0.05 m sampai 1nm. Ultrafiltrasi digunakan untuk memisahkan makromolekul dan koloid dari larutannya. Ketebalan lapisan atas ultrafiltrasi umumnya kurang 1 m.
c. Membran Reserve Osmosis.
Membrane reverse osmosis (RO) digunakan untuk memisahkan zat terlarut yang memilki berat molekul yang rendah seperti garam anorganik atau molekul organic kecil seperti glukosa dan sukrosa larutannya. Aplikasi reverse osmosis terutama adalah untuk pemurnian air, khususnya desalinasi air laut dan air payau menjadi air minum (Mulder, 1996)
2.4.2.Membran Dialisis
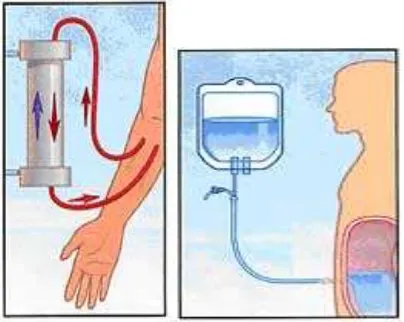
Bila ginjal gagal melakukan fungsinya, sehingga bermacam macam produk sisa termasuk garam dan air menumpuk dalam tubuh, perlu dilakukan dialisis untuk mengeluarkan produk sisa tersebut. Proses dialisis sesungguhnya menggunakan sifat sifat dari membran semi-permiabel, dimana membran tersebut hanya dapat dilalui oleh oleh zat-zat dengan berat molekul yang kecil dan tidak dapat ditembus oleh berat molekul yang besar. Melalui membran semi-permeabel tersebut kelebihan air,macam macam produk sisa yang menumpuk dalam tubuh ataupun zat-zat toksit lainnnya dapat dikeluarkan dari tubuh penderita gagal ginjal ataupun untuk meningkatkan kerja ginjal pada terapi keracunan (Haven, 1995).
Ada dua macam pengobatan dengan dialisis yaitu Hemodialisis dan Dialisis Intraperitoneal.
a.Dialisis Intraperitoneal
Pada proses dialisis intraperitoneal cairan dialysis dimasukkan kedalam kateter kedalam peritoneum,sehingga pertukaran ion terjadi sepanjang membrane peritoneal. Pada interval waktu tertentu cairan dialysis tersebut harus diganti atau dapat disirkulkasi kembali melalui suatu adsorben chamber.
b.Hemodialisis
kedalam mesin dan dialirkan melalui sisi lain dari permukaan semi-permiabel, sehingga terjadi pertukaran ion antara darah pasien dengan cairan hemodialisis.
(Haven.L,2005)
Gambar 5.Hemodialisis
Proses pemisahan suatu komponen dari campuran yang disebabkan oleh adanya perbedaan konsentrasi yang lebih dominan dibandingkan dengan beda pengaruh tekanan atau beda potensial listrik pada membran, dikenal dengan dialisis. Sedangkan proses perpindahan ion melalui membran penukar ion melalui membran penukar ion sebagai akibat oleh adanya pengaruh beda konsentrasi yang lebih dominan dibandingkan dengan beda tekanan atau beda potensial pada membran dikenal dengan dialisis difusi. Pada dialisis fasa cair yang mengandung pelarut yang sama berada pada kedua sisi membran dan tidak ada beda tekanan. Pada dialisis fluks zat terlarut sebanding dengan konsentrasi. Pemisahan terjadi karena perbedaan koefisien permeabilitas. Makromolekul memiliki koefisien difusi jauh lebih rendah dibandingkan dengan berat molekul yang rendah ( Mulder,1996).
2.4.3. Difusi membran.
banyak molekul yang bergerak kesebelah kanan dibandingkan dengan yang kiri. Apabila ada 2 bidang x dan x + σx (misalnya lapisan tipis membran dan jumlah penetran yang meninggalkan bidang ) adalah (j + (σj + σx)σx)dt.
X x + σx
jσx (j + (σj + σx)σx)dt.
Gambar 6. Proses difusi pada penampang melintang membran
Besarnya koefisien difusi molekul yang berpenetrasi melalui membran tidak berpori tergantung pada ukuran partikel yang berdifusi dan sifat material membran. Secara umum koefisien difusi menurun seiring dengan besarnya ukuran partikel (Mulder,1996). Proses difusi dipengaruhi oleh struktur, ukuran pori, komposisi polimer, sifat dan ukuran zat serta konsentrasi larutan.Difusi zat melalui membran dapat dinyatakan dalam hukum Fick:
J =
M= berat zat yang terdifusi persatuan waktu (gr) A = area yang tersedia untuk difusi (cm2)
t = waktu (s-1)
Fluks zat menyatakan jumlah mol,massa atau volume suatu komponen yang melewati luas permukaan tertentu suatu membran. Untuk menguji sifat membran yang dibuat digunakan 3 zat dengan berat molekul yang berbeda yaitu : urea (BM = 60,06), natrium salisilat ( BM =160,11), dan albumin (BM= 60.000). Pemilihan urea dan albumin didasarkan pada prinsip pencucian darah dalam proses dialisis. Sementara natrium salisilat digunakan sebagai pembanding (Martin, 1993).
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. ALAT-ALAT
10.Spektrofotometer UV-Visible Shimadjzu
11.Magnetik bar
12.Universal testing Machine SC-2DE
13.Neraca analitis
14.Scanning Electron Machine (SEM)
3.2. BAHAN-BAHAN
1. Natrium Alginat Wako Pure Chemical
3.3. PROSEDUR PENELITIAN
3.3.1. Pembuatan membran Kalsium Alginat-kitosan
Sebanyak 0.5 g kitosan didispersikan kedalam 12.5 ml akuades dan ditambahkan 2.5 ml asam asetat glasial sambil diaduk dengan magnetik bar untuk mendapatkan campuran yang homogen. Ditimbang 0.5 g Na-Alginat dan dilarutkan dengan 12.5 ml akuades. Kedua larutan tersebut dibiarkan terpisah selama 1 malam. Kedua larutan polimer tersebut dicampurkan dan ditambahkan larutan NaOH 2M sampai pH 5-6 dan dicetak di atas plat kaca, lalu didiamkan selama 1 malam, lapisan tipis yang diperoleh kemudian direndam dengan CaCl2 0,1M. Dicuci dengan akuades
dan dibiarkan hingga kering.
3.3.2. Uji Kekuatan Tarik Membran Kalsium Alginat-Kitosan
Membran Kalsium Alginat-kitosan yang diperoleh diuji keteguhan tariknya dengan menggunakan alat ” Universal Testing Machine ” typr SC-2DE,Cap : 2000 kg, Meg No : 6079 Made in Tokyo Jepang dengan pengujian :
a. Sampel yang akan diuji dibentuk sesuai dengan kriteria bahan dan alat b. Alat dihidupkan ( warm up) selama 1 jam
c. Alat dikalibrasi dan diaatur tombol beban yang ada di dalam alat d. Diatur kecepatan alat untuk pengujian sampel dengan satuan mm/menit e. Dipasang alat penjepit sampel uji atas dan bawah
f. Dicatat nilai dari hasil pengujian pada saat beban maksimum dan pada saat stroke g. Print elastisitas pengujian sampel pada kertas grafik.
3.3.3. Uji Difusi Urea,Na-Salisilat dan Albumin Melalui membran Kalsium Alginat-kitosan
3.3.3.1.Pembuatan Larutan Induk Baku (LIB) Urea, Na-Salisilat dan Albumin 3.3.3.1.1.Pembuatan LIB urea
3.3.3.1.2..Pembuatan LIB Na-Salisilat
Ditimbang 10 mg Na-Salisilat lalu dimasukkan kedalam labu ukur 100 ml. Ditambahkan akuades hingga garis tanda, lalu dihomogenkan. Diperoleh larutan induk baku Na-Salisilat dengan konsentrasi 100 mcg/ml
3.3.3.1.3.Pembuatan LIB albumin.
Ditimbang 10 mg albumin dan dimasukkan kedalam labu ukur 100 ml.Ditambahkan akuades hingga garis tanda lalu dihomogenkan. Diperoleh larutan induk baku albumin dengan konsentrasi 100 mcg/ml
3.3.3.2. Penentuan λ maksimum urea, Na-Salisilat dan Albumin. 3.3.3.2.1. Penentuan λ maksimum urea.
Dari LIB dipipet sebanyak 50 ml dan dimasukkan kedalam labu ukur 100 ml. Lalu dipanaskan pada suhu 60oC selama 30 menit. Diteteskan regen Nessler sebanyak 0,5 ml dan dibiarkan selama 20 menit.Ditambahkan aquadest hingga garis tanda. Diperoleh larutan urea dengan konsentrasi 50 mcg/ml.
3.3.3.2.2. Penentuan λ maksimum Na-Salisilat
Dari LIB dipipet 10 ml dan dimasukkan kedalam labu ukur 100 ml. DitambahkanH2SO4 0,1N hingga mencapai garis tanda. Diperoleh larutan Na-Salisilat
dengan konsentrasi 10 mcg/ml dan diukur panjang gelombang serapannya.
3.3.3.2.3. Penentuan λ maks Albumin
Dari LIB dipipet 50 ml dimasukkan kedalam labu ukur 100 ml.Ditambahkan akuades hingga garis tanda dan diperoleh larutan albumin dengan konsentrasi 500 mcg/ml dan diukur panjang serapannya.
3.3.3.3. Pembuatan kurva kalibrasi urea, Na-Salisilat dan Albumin. 3.3.3.3.1. Pembuatan kurva kalibrasi urea
Ditambahkan akuades hingga mencapai garis tanda. Diperoleh dengan konsentrasi 0,5: 1 ; 5; 10; 20; 30; 40; 50; 60; 70; 80; 90; 100 dan masing masing diukur panjang serapannya.
3.3.3.3.2. Pembuatan kurva kalibrasi Na-Salisilat
Dari LIB dipipet masing masing 1 ml, 2ml, 4ml, 6ml, 8ml, 10ml, 12ml, 14ml, 16ml, 18ml, 20ml dan 22 ml. Dimasukkan dalam labu ukur 100 ml. Lalu ditambahkan H2SO4 0,1 N sampai batas atas sehingga diperoleh larutan Na-Salisilat
dengan konsentrasi 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 dan 22 mcg/ml.Diukur serapan masing masing larutan tersebut.
3.3.3.3.3. Pembuatan kurva kalibrasi albumin
Dari LIB dipipet masing masing 0,1 ml ; 0,5ml; 1ml, 2ml, 5ml, 10ml, 20ml, 30ml, 40ml, 50ml, 60ml, 70ml , 80ml, 90ml dan 100ml lalu dimasukkan kedalam labu ukur 100ml. Kemudian ditambahkan akuades hingga garis tanda sehingga diperoleh larutan albumin dengan konsentrasi 1, 5, 10, 20, 50, 100 , 200, 300, 400, 500, 600, 700, 800, 900 dan 1000 mcg/ml dan diukur panjang gelombangnya.
3.3.3.4.Uji Difusi
3.3.3.4.1.Uji difusi Urea
Ditempatkan membran kalsium alginat-kitosan diantara kedua bejana difusi. Dimasukkan 10 ml larutan urea 100 mcg/ml kedalam bejana difusi sebelah kiri (A) dan disebelah kanan (B) dimasukkan akuades dengan volume yang sama. Sel difusi ditempatkan pada thermostat dengan suhu 37oC. Dengan selang waktu tertentu (1, 3, 5, 10, 15, 30, 45, 60, 90, 120, 150 dan 180 menit) urea yang terdifusi kedalam bejana B diambil sebanyak 1 ml. Setelah diambil pada bejana yang sama (bejana B) ditambahkan akuades dengan volume yang sama. Kemudian dipanaskan pada suhu 60oC selama 30 menit ( masing-masing larutan urea yang terdifusi). Ditambahkan 0,5 ml reagen nessler. Dibiarkan 20 menit dan diencerkan dalam labu takar 10 ml dengan akuades. Kemudian diukur absorbansi larutan yang terdifusi.
3.3.3.4.2. Uji difusi Na-Salisilat.
(1, 3, 5, 10, 15, 30, 45, 60, 90, 120, 150 dan 180 menit) larutan Na-Salisilat yang terdifusi kedalam bejana B diambil sebanyak 1 ml. Setelah diambil pada bejana yang sama (bejana B) ditambahkan akuades dengan volume yang sama. Diencerkan dalam labu ukur 10 ml dengan menggunakan H2SO4 0.1N. Kemudian diukur absorbansi
larutan yang terdifusi.
3.3.3.4.3. Uji difusi Albumin
3.4. BAGAN PENELITIAN.
3.4.1.Pembuatan Membran Kalsium Alginat-Kitosan.
0.5 g kitosan 0.5 g Na-Alginat
Akuades (12.5 ml) Asetat glasial (2.5 ml) diaduk
Dibiarkan 12 jam
Akuades (12.5 ml)
Distirer (2jam) Dibiarkan 12 jam
Larutan NaOH 2M hingga pH 5-6 Dicetak diatas plat kaca
Didiamkan (12 jam) Membran alginat
kitosan
Direndam CaCl2 0.1M
Dicuci dengan akuades Dikeringkan
3.4.2. Uji Kekuatan Tarik.
Membran kalsium Alginat Kitosan
Dipotong sesuai dengan ukuran pada alat
Dimasukkan kedalam universal testing machine
Uji Kekuatan Tarik
Dihidupkan alat Dikalibrasi
Diatur kecepatan alat
Dipasang alat penguji sampel atas dan bawah
Dicatat nilai hasil pengujian
3.4.3. Uji difusi urea, natrium salisilat dan albumin.
3.4.3.1. Pembuatan larutan induk baku (LIB) dan penentuan λ maksimum urea, natrium salisilat dan albumin.
3.4.3.1.1. Pembuatan LIB, penentuan λ maksimum dan kurva kalibrasi urea.
100 mg Urea
Dimasukkan dalam labu ukur 1000 ml Akuades hingga garis tanda
Dihomogenkan
LIB Urea
Diambil 50 ml
Dimasukkan dalam labu ukur 100 ml Dipanaskan pada suhu 60oC (30 menit) Regen nessler ( 0.5ml )
Akuades hingga garis tanda
Uji maksimum
Dipipet masing masing ( 1, 5, 10, 20, 30, 40, 50, 60, 70, 80,90 dan 100 ml)
Didiamkan selama 20 menit Dimasukkan dalam labu ukur 100 ml
3.4.3.1.2. Pembuatan LIB, penentuan λ maksimum dan kurva kalibrasi natrium salisilat.
10 mg Na-Salisilat
Dimasukkan dalam labu ukur 100 ml Akuades hingga garis tanda
Dihomogenkan
LIB Na-Salisilat
Diambil 10 ml Dipipet masing masing ( 1, 2, 4, 6, 8, 10, 12, 14, 20 dan 22 ml)
H2SO4 0.1 N hingga garis
tanda Dimasukkan dalam labu
ukur 100 ml
Uji maksimum
Dimasukkan dalam labu ukur 100 ml
Diukur serapan dengan maksimum 278 nm
Kurva Kalibrasi H2SO4 0.1 N hingga garis
3.4.3.1.3. Pembuatan LIB, penentuan λ maksimum dan kurva kalibrasi albumin.
10 mg Albumin
Dimasukkan dalam labu ukur 100 ml Akuades hingga garis tanda
Dihomogenkan
LIB Albumin
Diambil 50ml
Dimasukkan dalam labu takar 100 ml
Akuades hingga garis tanda
Uji maksimum
Dipipet masing-masing( 0,1:0,5: 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 ml)
Akuades hingga garis tanda Dimasukkan dalam labu ukur 100 ml
Diukur serapan dengan maksimum 237 nm
3.4.3.2 . Uji difusi urea
Membran Kalsium Alginat-Kitosan
ditempatkan diantara 2 bejana difusi
Bejana Difusi A Bejana Difusi B
dimasukkan 10 ml larutan urea 1000 ppm
dimasukkan 10 ml akuades
ditempatkan pada thermostat dengan suhu 37oC distirer
diambil 1arutan urea sebanyak 1 ml dengan selang waktu tertentu (1, 3, 5, 10, 15, 30, 45, 60, 90, 120, 150 menit) yang terdifusi dari bejana B ditambahkan 1 ml akuades pada bejana B dipanaskan pada suhu 60oC selama 30 menit ditambahkan 0,5 ml reagen nessler
diencerkan dalam labu takar 10 ml diukur absorbansi larutan yang terdifusi
didiamkan selama 20 menit
Hasil
3.4.3.3. Uji difusi natrium salisilat
Membran Kalsium alginat-Kitosan
Bejana Difusi A Bejana Difusi B ditempatkan diantara 2 bejana difusi
dimasukkan 10 ml larutan Na-Salisilat 100 ppm
dimasukkan 10 ml akuades
ditempatkan pada thermostat pada suhu 37oC distirer
diambil larutan Na-salisilat sebanyak 1 ml dengan selang waktu tertentu (1, 3, 5, 10, 15, 30, 45, 60, 90, 120, 180 menit) yang terdifusi dari bejana B
ditambahkan 1 ml akuades pada bejana B diencerkan dengan H2SO4 0,1 N pada labu takar 10 ml
3.4.3.4. Uji difusi albumin.
Membran Kalsium Alginat-Kitosan
Bejana Difusi A Bejana Difusi B
ditempatkan diantara kedua bejana difusi
dimasukkan 10 ml larutan
albumin 100 ppm dimasukkan 10 ml akuades
ditempatkan pada thermostat dengan suhu 37oC distirer
diambil larutan albumin sebanyak 1 ml dengan selang waktu tertentu ( 3, 5, 10, 15, 30, 45, 60, 90, 120, 150, 180 menit) yang terdifusi dari bejana B
ditambahkan 1 ml akuades pada bejana B
diencerkan dengan akuades dalam labu takar 10 ml diukur absorbansi larutan yang terdifusi
BAB IV
HASIL DAN PEMBAHASAN
4.1. MEMBRAN KALSIUM ALGINAT-KITOSAN.
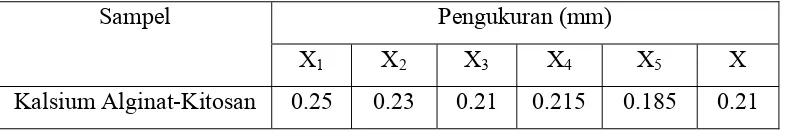
Membran kalsium alginat yang diperoleh adalah membran transparan yang memiliki ketebalan 210 m. Berikut adalah hasil pengukuran ketebalan membran kalsium alginat kitosan dengan menggunakan mikrometer pada 5 posisi acak.
Tabel 2. Ketebalan membran kalsium alginat-kitosan.
Sampel Pengukuran (mm)
X1 X2 X3 X4 X5 X
Kalsium Alginat-Kitosan 0.25 0.23 0.21 0.215 0.185 0.21
Membran kalsium alginat-kitosan yang dihasilkan mempunyai ketebalan sesuai dengan penggunaan membran hemodialisa dimana ukuran ketebalan membran untuk difusi adalah 100-500 m.
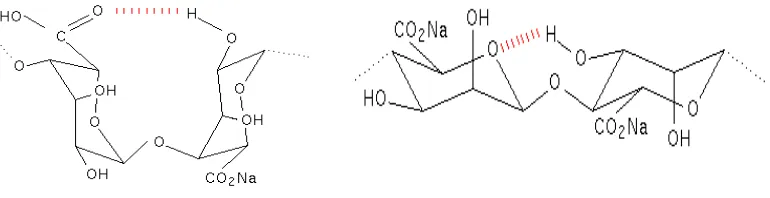
Rantai Alginat
(Knill et al,2004, Kumar 2000)
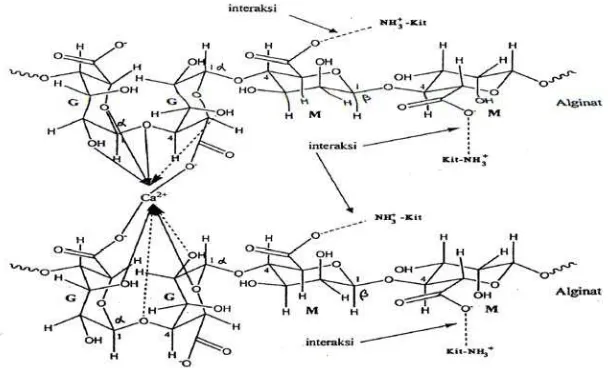
Gambar 7. Interaksi Ionik antara alginat dengan kitosan pada pH 5.4
Cadenak dkk berhasil membuat membran kompleks polielektrolit alginat kitosan dengan cara mencampurkan larutan kitosan asetat dengan natrium alginat sebelum diperoleh kompleks polielektrolit pada pH 5.28 melalui penambahan NaOH, campuran larutan ditambahkan HCl 32% terlebih dahulu.
Interaksi kitosan dengan natrium alginat dan penambahan kalsium klorida akan membentuk kompleks polielektrolit. Sebagai hasil pencampuran dua polielektrolit akan dihasilkan kompleks membran tidak larut yang mampu melewatkan zat dengan berat molekul tertentu melalui pengembangan dalam air.
Dalam interaksi antara kalsium alginat dengan kitosan membentuk ikatan silang. Dimana ikatan silang tersebut memperkokoh ikatan kalsium alginat-kitosan sehingga membran yang dihasilkan tidak mudah koyak.Berikut merupakan interaksi antara kalsium alginat-kitosan :
-OOC
NH3+ COOH
COO-Na+
-OOC
AcNH
NH3Cl
-H2N
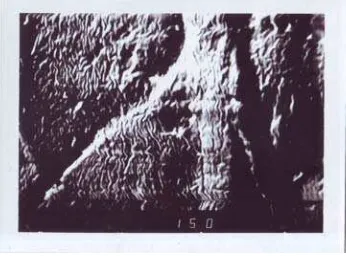
4.2. SCANNING ELECTRON MICROSCOPE (SEM)
Analisis SEM menunjukkan bahwa bentuk dan perubahan (morfologi) permukaan dari sampel yang dianalisis. Pada prinsipnya bila terjadi perubahan suatu bahan misalnya patahan, lekukan dan perubahan struktur dari permukaan maka bahan tersebut cenderung mengalami perubahan energi. Energi yang telah berubah tersebut dapat dipancarkan, dipantulkan dan diserap serta diubah bentuknya menjadi fungsi bergelombang elektron yang dapat ditangkap dan dibaca hasilnya.
Foto SEM dengan perbesaran 150, 200 dan 400 kali perbesaran :
Gambar 9. Foto permukaan kalsium alginat-kitosan dengan menggunakan SEM (400 x perbesaran).
Gambar 10. Foto permukaan kalsium Gambar 11.Foto permukaan kalsium algi Alginat kitosan setelah difusi menggunakan nat-kitosan (Dawolo,2005)
SEM ( 200 x perbesaran).
Perubahan morfologi permukaan membran sesudah difusi juga dapat dilihat dari gambar berikut ini.
Gambar 12. Foto permukaan kalsium alginat-kitosan setelah difusi dengan menggunakan SEM ( 150 dan 200 x perbesaran ).
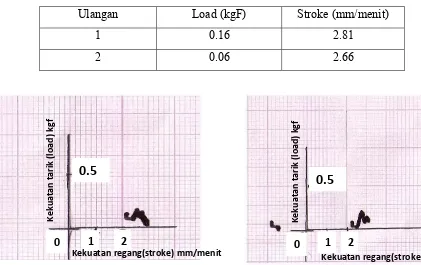
4.3. UJI KEKUATAN TARIK.
Pengujian kekuatan tarik membran kalsium alginat kitosan dilakukan pada suhu kamar dengan berat beban 100kgf dan kecepatan 20mm/menit. Kekuatan tarik membran dapat dilihat dari nilai load dan stroke yang dimilikinya. Nilai stroke menyatakan kekuatan tarik pada saat putus, sedangkan stroke (mm/menit) menunjukkan kekuatan regangan pada saat putus. Nilai load dan stroke berbanding terbalik.
Tabel 3. Data kekuatan tarik (load), kekuatan regangan pada membran kalsium alginat-kitosan.
Ulangan Load (kgF) Stroke (mm/menit)
1 0.16 2.81 2 0.06 2.66
Kurva 3. Load Vs stroke membran kalsium alginat kitosan
Bila dibandingkan dengan peneliti terlebih dahulu (Dawolo dan Meriaty) membran kalsium alginat-kitosan memiliki nilai stroke dan load yang lebih besar dibandingkan dengan membran alginat kitosan dan kalsium alginat.
Berikut merupakan perbandingan nilai stroke antara membran kalsium alginat kitosan, alginat kitosan dan kalsium alginat.
K
Kekuatan regang(stroke) mm/menit Kekuatan regang(stroke) mm/menit
Tabel 4.Perbandingan nilai stroke dan Load pada berbagai jenis membran Jenis Membran Load (kgF) Stroke(mm/menit)
Kalsium alginat-kitosan 0.16 2.81
Alginat-kitosan 0.080 12.510
Kalsium Alginat 1% 0.05 3.27
Pada uji kekuatan tarik dalam membran kalsium alginat-kitosan dapat diketahui kemuluran dari membran tersebut yaitu :
Kemuluran (ε1) = x100%
dimana Ao = luas penampang permukaan membran.
=
Dari perhitungan diatas dapat dibuat tabel sebagai berikut :
4.4. UJI DIFUSI DAN FLUKS MEMBRAN KALSIUM ALGINAT KITOSAN Berikut adalah data konsentrasi zat yang terdifusi pada membran kalsium alginat-kitosan yang diperoleh dari lampiran 1 :
Tabel 6. Data konsentrasi zat yang terdifusi melalui membran kalsium alginat-kitosan persatuan waktu.
Waktu (menit)
Konsentrasi(mcg/ml)
Kurva 1 : Perbandingan penetrasi beberapa penetran melalui membran kalsium alginat-kitosan persatuan waktu.
Pengujian difusi terhadap urea (BM = 60,06), natrium salisilat (BM = 160) dan albumin (BM berkisar 60.000) yang merupakan penetran dengan BM kecil, sedang dan besar pada membran kalsium alginat-kitosan menghasilkan bahwa molekul urea terdifusi lebih mudah dibandingkan dengan natrium salisilat sedangkan molekul albumin tidak terdifusi sama sekali.
Hal ini disebabkan karena perbedaan berat molekul urea, natrium salisilat dan albumin dimana pori-pori dari membran kalsium alginat-kitosan masih bisa dilewati molekul yang kecil dan sedang seperti urea dan natrium salisilat namun albumin yang merupakan polimer dengan BM besar tidak dapat melewati porositas dari membran tersebut.
jauh lebih besar dibandingkan dengan natrium salisilat dan albumin tidak terdifusi. Bila diperhatikan konsentrasi dari urea dan natrium salisilat yang terdifusi pada selang waktu tertentu ternyata pada membran kalsium alginat kitosan jumlahnya lebih sedikit dibandingkan dengan membran alginat kitosan. Dalam hal ini pada membran kalsium alginat-kitosan terdapat ikatan silang sedangkan membran alginat-kitosan tanpa ikatan silang sehingga mempengaruhi porositas membran (hanya interaksi).
Berdasarkan hitungan dari lampiran 7 dan 8 maka diperoleh data sebagai berikut. Waktu
(menit)
Fluks zat (mcg/cm2/s)
urea Na-salisilat Albumin 0 0.000 0.000 0.000 1 75.588 15.309 0.000
3 28.379 5.490 0.000
5 40.539 2.717 0.000
10 43.930 1.452 0.000
15 14.480 1.348 0.000
30 8.924 2.385 0.000
45 7.615 3.298 0.000
60 5.863 2.933 0.000
90 4.103 2.721 0.000
120 3.337 2.614 0.000
150 3.142 2.021 0.000
180 2.710 1.841 0.000
Kurva 2. Perbandingan fluks beberapa penetran melalui membran kalsium alginat-kitosan.
BAB V
KESIMPULAN DAN SARAN
5.1. KESIMPULAN.
1. Dari data SEM diperoleh bahwa permukaan membran kalsium alginat-kitosan sebelum dan sesudah difusi tidak terlalu berbeda.
2. Keteguhan tarik dan kemuluran dari membran kalsium alginat-kitosan adalah 7.52 Mpa dan 85.15%
3. Urea, Natrium salisilat dapat terdifusi melalui membran kalsium alginat-kitosan sedangkan albumin tidak dapat, sehingga membran ini berpotensi sebagai membran Hemodialisa.
4. Sifat difusi molekul urea dan natrium salisilat berbeda pada membran kalsium alginat-kitosan dibandingkan dengan membran alginat kitosan.
5.2. SARAN
DAFTAR PUSTAKA
Adriana,C ;W. Arguelles. Mound,FM. Goycoolea, Carlos Peniche. 2003. Diffusion Through Membrane of polyelectrolyte Complex of Chitosan and Alginate. Macromol. Biosci, 3 : 535-539
Austin,P.R: C.J.Brime : J.E.Castle and J.P Zikalis, 1981. Chitin : New Facets of Research. Science 212,749
Bangun,H; Arianto A. 2002. Pembuatan membrane alginate sebagai system tempat penyimpanan obat topical baru: Povidon iodium sebagai model obat.
Media Farmasi , 10(2): 174-182
Carey, Franchisa. 1992. Organic Chemistry. Mc Graw Hill-Departemen Chemistry of Virginia. New York
Dawolo, Asteria, K. 2005. Pembuatan Membran Polielektrolit Alginat Kitosan dan Membran Kitosan serta Karakterisainya. Tesis. Medan
Haven, L. 2005. Hemodialisis. Yahoo!Health.Diakses tanggal 14 November 2008
Hudson, M, Samuel ; Jenkis; David, W .2005. Chitin and Chitosan. John-Willey and Sons, North Carolina State University
Jones,A.J. 1987. Membrane and Seperation Technology : The Australian Perspective. Australian Government Publishing Service. Canberra
Kaban, Jamaran.2007. Karakteristik dan Aplikasi Film Pelapis komposit khelat logam alkali tanah Alginat-Kitosan. Disertasi. Medan.
Knill.C.J. : J.F. Kennedy.J.Mistry : M.Miraftab : G.Smart : Mr.Groocock and H.J.Williams. 2004. Alginate Fibres Modified with unhydrolysed and
Kumar,M.N.V. 2000. Nano and Microparticles as controlled drug Delivery Devices. J.Pharm Pharmaceutic. Scie 3(2) : 234-258
Loudon, Marc. 1984. Organic Chemistry. Addison-Wesley Publishing Company. London
Marthin, Alfred. 1993. Farmasi fisik. Edisi ketiga. Penerbit Universitas UI-Press. Jakarta.
Meriaty.2002.Pembuatan dan Karakterisasi Membran Kalsium Alginat.Tesis.Medan.
Mulder, M. 1996. Basic Principles of Membran Technology. 2nd ed. Kluwer Academic Publisher. Dordrecht.
Mc Hugh, D.J. 2003. A Guide to Seaweed Industry. Food and Agric. Org of the UN, Rome
Prakash,S and Hahn Soe-Lin. 2004. Strategy for Cell therapy : Polymers for Live Cell Encapsulation and Delivery. Trends Biomate. Artif. Organs, vol 18(1), pp 35
Robinson, S, David.1987. Food Biochemistry and Nutritional Value.Longman Scientific and Technical Longman Group, Jhon Willey and Sons. New York
Rudall, K. M. And W. Kenchington. 1973. The Chitin System Biology. Review 49:
497
Synoweicki, J and N.A. Al-Kateeb. 2003. Production, Properties and Some New Aplication of Chitin and its derivates. Critical Review in Food Science andNutrition, 43 (2) : 145-171
Tarigan.T.2005. Pembuatan Membran Kitin dan Pengujian sifat Permeabilitasnya terhadap Ureum, Aspirin dan Albumin. Tesis. Medan.
Tharanathan, R.N and F.S Kittur. 2003. Chitin- The Undisputed Biomolecule of Great Potential. Critical Reviews in Food Science and Nutrition, 43, 1 : ProQuest
Medical Library.
Toharisman. A. 2007. Peluang Pemanfaatan Enzim Kitinase di Industri Gula. P3GI.
Willbraham.C, Anthony. 1984. Introduction to Organic and Biological Chemistry. The Benjamin Leumming Publishing Company Inc. Menlo Park.California.
Zhanjiang Fisheries. 1990. Training Manual of Gracilaria Culture and Seaweed Processing in China. Regional Seafarming Development and Demontration
Lampiran 1.
Data dan kurva kalibrasi Urea
No Konsentrasi Abs
1 0 0.000
2 1 0.011
3 5 0.039
4 10 0.073
5 20 0.149
6 30 0.234
7 40 0.335
8 50 0.412
9 60 0449
10 70 0.567
11 80 0.676
12 90 0.736
Lampiran 2.
Data dan kurva kalibrasi Na-salisilat :
No Konsentrasi Abs
1 0 0.000
2 1 0.042
3 2 0.078
4 3 0.116
5 4 0.153
6 6 0.224
7 8 0.288
8 10 0.356
9 12 0.418
10 14 0.488
11 16 0.510
12 18 0.654
13 20 0.721
Lampiran 3.
Data dan kurva kalibrasi Albumin
No Konsentrasi Abs
1 0 0.000
2 1 0.001
3 5 0.004
4 10 0.007
5 20 0.014
6 50 0.033
7 100 0.061
8 200 0.115
9 300 0.170
10 400 0.236
11 500 0.277
12 600 0.310
13 700 0.375
14 800 0.423
15 900 0.470
Lampiran 4.
Tabel penetrasi rata-rata urea melalui membran kalsium alginat kitosan Waktu
Lampiran 6.
Tabel penetrasi rata-rata albumin melalui membran kalsium alginat kitosan. Waktu
Tabel data Fluks Urea melalui membran kalsium alginat-kitosan Waktu
3 180 9022.2 1.7662 28.379
5 300 21480 1.7662 40.539
10 600 23280 1.7662 43.930
15 900 23025 1.7662 14.480
30 1800 28372.2 1.7662 8.924
45 2700 36315 1.7662 7.615
60 3600 37282.2 1.7662 5.863
90 5400 39135 1.7662 4.103
120 7200 42945 1.7662 3.337
150 9000 49957.2 1.7662 3.142
Lampiran 8.
Tabel data Fluks Natrium Salisilat melalui membran kalsium alginat-kitosan. Waktu