PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN GEL KITOSAN-CMC
FEBY FERDIANSYAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN GEL KITOSAN-CMC
FEBY FERDIANSYAH
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul : Perilaku Difusi Ketoprofen Melalui Membran Gel Kitosan-CMC Nama : Feby Ferdiansyah
NIM : G44204035
Menyetujui,
Pembimbing I, Pembimbing II,
Prof. Dr. Purwantiningsih Sugita, MS Budi Arifin, SSi
NIP 131 779 513 NIP 132 321 568
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor,
Dr. drh. Hasim, DEA NIP 131 578 806
PRAKATA
Puji syukur ke hadirat Allah SWT atas segala rahmat dan hidayah-Nya sehingga penulis dapat menyusun dan menyelesaikan karya ilmiah ini. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Maret sampai November 2008 di Laboratorium Kimia Organik dan Laboratorium Bersama, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis selama penelitian dan juga penyusunan karya ilmiah ini, terutama kepada Prof. Dr. Purwantiningsih Sugita, MS dan Budi Arifin, SSi selaku pembimbing yang telah banyak memberi arahan, motivasi, saran, dan solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian, serta kepada orang tua dan keluarga yang telah memberikan kasih sayang, dorongan, dan doa. Penghargaan juga penulis sampaikan kepada Drs. Muhammad Farid dan Tuti Wukirsari, SSi atas segala diskusi dan saran berkaitan dengan penelitian.
Penulis juga mengucapkan terima kasih kepada Bapak Sabur, Ibu Yenni Karmila, dan Ibu Siti Robiah atas fasilitas, bantuan, serta masukan yang diberikan. Tak lupa, ungkapan terima kasih penulis sampaikan kepada semua rekan peneliti di Laboratorium Kimia Organik Departemen Kimia FMIPA IPB (Anggi, Dedi, Noviadi, Andre, Bekti, Miqdad, Panji, Rini, Erika, dan Yuyun) serta teman-teman kimia 41 atas diskusi dan kebersamaan selama penulis menempuh studi dan menjalankan penelitian.
Pada kesempatan ini, penulis juga mengucapkan terima kasih kepada Hibah Kompetensi Dikti Tahun 2008 sebagai sumber dana bagi penelitian ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 3 Februari 1987 dari pasangan Endang Budi Hartono dan Etty Hindrayati. Penulis merupakan anak pertama dari tiga bersaudara. Penulis menyelesaikan studi di SMU Negeri 1 Cibadak pada tahun 2004. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) pada Program Studi Kimia FMIPA melalui jalur Undangan Seleksi Masuk IPB (USMI).
Semasa perkuliahan penulis pernah menjadi staf pengajar bimbingan belajar Excelent pada tahun 2005/2006 dan 2006/2007 serta menjadi asisten praktikum mata kuliah Kimia Organik layanan Biokimia dan ITP pada tahun 2006/2007 dan 2007/2008. Penulis juga aktif di beberapa organisasi kemahasiswaan, di antaranya menjadi staf DPM TPB pada tahun 2004–2005, ketua IKAMASI (Ikatan Mahasiswa dan Keluarga Sukabumi) pada tahun 2004–2006, ketua IMASIKA (Ikatan Mahasiswa Kimia IPB) pada tahun 2006–2007, Dewan Pengawas IMASIKA pada tahun 2007–2008, dan staf BPP IKAHIMKI (Ikatan Himpunan Kimia Indonesia) pada tahun 2006–2008. Pada bulan Juli– Agustus 2007, penulis berkesempatan melaksanakan kegiatan praktik lapangan di Laboratorium Kontrol Mutu PT Indoeskrim Dairy Food dengan judul Analisis Sifat Kimia Berbagai Jenis Frozen Dessert pada Proses Produksi.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1 TINJAUAN PUSTAKA ... 1 Ketoprofen ... 1 Kitosan ... 2 CMC ... 2 Gel Kitosan-CMC ... 2 Difusi Membran ... 3
BAHAN DAN METODE ... 4
Bahan dan Alat ... 4
Langkah Kerja ... 4
Pembuatan Membran Kitosan-CMC ... 4
Uji Difusi Membran ... 5
Pemodelan Cs, D, J ... 5
Pencirian Membran (SEM) ... 5
HASIL DAN PEMBAHASAN ... 5
Pencirian Kitosan ... 5
Pembuatan Membran ... 5
Porositas Membran ... 5
Pemodelan Konsentrasi Kesetimbangan (Cs) ... 7
Pemodelan Koefisien Difusi (D) dan Fluks Ketoprofen (J) ... 7
SIMPULAN DAN SARAN ... 8
Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
DAFTAR GAMBAR
Halaman
1 Struktur ketoprofen. ... 1
2 Struktur unit berulang selulosa, kitin, dan kitosan ... 2
3 Struktur CMC. ... 2
4 Skema difusi obat melalui matrik padat (Martin 1993) . ... 3
5 Alat uji difusi ... 4
6 Foto SEM permukaan membran ... 6
7 Foto SEM tampak samping membran ... 6
8 Pengaruh h, A terhadap J ... 7
DAFTAR LAMPIRAN
Halaman 1Prosedur pencirian kitosan ...
122
Diagram alir penelitian utama ...
143 Hasil pencirian kitosan ... 15
4 Hasil uji difusi ... 17
ABSTRAK
FEBY FERDIANSYAH. Perilaku Difusi Ketoprofen Melalui Membran Gel Kitosan-CMC. Dibimbing oleh PURWANTININGSIH SUGITA dan BUDI ARIFIN.
Gel kitosan-karboksimetilselulosa (CMC) berpotensi sebagai penyalut sediaan-lepas-lambat ketoprofen, gel ini telah dilaporkan memiliki sifat reologi yang baik dalam sistem pengantaran obat dan baik terhadap kondisi pH lambung. Dalam penelitian ini, perilaku difusi membran kitosan-CMC terhadap ketoprofen dipelajari. Membran dibuat dengan mencampurkan kitosan 3% (b/v) dalam asam asetat 1% (v/v), CMC 1% (b/v), dan glutaraldehida 6% (v/v) dengan nisbah 30:5:1 lalu dituang ke dalam cetakan. Ketebalan membran (h) diragamkan dengan meragamkan volume yang digunakan. Setelah itu, membran digunakan dalam uji difusi pada suhu (T) 37 dan 42 °C. Uji difusi ini menggunakan tiga konsentrasi ketoprofen dalam sel donor (A): 25, 50, dan 75 µg/ml, sedangkan sel resipien diisi pelarut etanol-air (1:1). Alikuot diambil dari sel resipien setiap 30 menit sampai didapat konsentrasi kesetimbangan (Cs). Alikuot diukur
serapannya pada panjang gelombang 258 nm.
Rentang Cs yang didapat, yaitu 3.1–17.3 mg/l, telah mendekati konsentrasi terapi
ketoprofen (15 mg/l), maka membran ini lebih berpotensi sebagai penyalut dibandingkan membran kitosan alginat yang sebelumnya telah dilaporkan. Analisis dengan metode permukaan respons lebih jauh menunjukkan pengaruh positif dari A, h, dan T terhadap fluks (J) ketoprofen melewati membran tersebut. Model yang diperoleh berturut-turut Cs
= 19.9277 – 0.01h – 0.3542A – 0.4069T + 0.0001h2 + 0.0013A2 + 0.0002hA – 0.0002hT + 0.00088 AT dengan nilai R2 = 90.8%, dan J = 6.42999 + 0.04251h +0.02198A – 0.1839T – 1.012Cs – 0.00009h2 + 0.00113A2 + 0.06862Cs2 + 0.00078hA – 0.00040hT –
0.00040hCs + 0.00079AT – 0.01882ACs + 0.02169TCs dengan nilai R2 = 98.9%. Namun,
diperlukan analisis morfologi lebih lanjut terhadap membran yang nilai fluksnya besar.
ABSTRACT
FEBY FERDIANSYAH. Diffusion Behavior of Ketoprofen Through Chitosan-CMC Membranes Gels. Supervised by PURWANTININGSIH SUGITA and BUDI ARIFIN.
Chitosan-carboxymethyl cellulose (CMC) gel is potential as a coating agent for ketoprofen sustained-drug-release. In the previous research, this gel has been reported to have good rheological properties as a drug delivery system, and persistent to gastric pH condition. This membrane was made by mixing 3% (w/v) chitosan, 1% (w/v) CMC, and 6% (v/v) glutaraldehyde in 30:5:1 ratio, and then poured into a mold. The membrane thickness (h) was varied by varying the volume used. Afterwards, the membrane was used for diffusion test at 37 and 42 °C temperatures (T). Three concentrations of ketoprofen in donor cell (A) were used: 25, 50, and 75 µg/ml, whereas the recipient cell was filled with ethanol-water (1:1) solvent. Aliquot was taken from recipient cell every 30 minutes until the equilibrium concentration (Cs) was reached. The absorbance of each
aliquot was measured at wavelength of 258 nm.
The Cs range obtained, namely 3.1-17,3 mg/l, had approached the ketoprofen therapy concentration (15 mg/l), so this membrane has better properties as a coating agent as compared with chitosan-alginate membrane previously reported. Further analysis using response surface method showed positive effects of A, h, and T towards flux (J) of ketoprofen through the membrane. The models obtained were Cs = 19.9277 – 0.01h –
0.3542A – 0.4069T + 0.0001h2 + 0.0013A2 + 0.0002hA – 0.0002hT + 0.00088 AT with R2 = 90.8%, and J = 6.42999 + 0.04251h +0.02198A – 0.1839T – 1.012Cs – 0.00009h2 +
0.00113A2 + 0.06862Cs2 + 0.00078hA – 0.00040hT – 0.00040hCs + 0.00079AT –
0.01882ACs + 0.02169TCs with R2 = 98.9%. However, further morphological analysis is
1
PENDAHULUAN
Ketoprofen merupakan komponen aktif yang sering dijumpai dalam obat rematik komersial. Komponen ini berfungsi sebagai analgesik, antiradang, dan antipiretik yang menghambat sintesis prostaglandin. Penggunaan ketoprofen pada dosis tinggi dapat mengiritasi lambung dan usus. Selain itu, karena waktu paruh eliminasinya yang cepat dalam tubuh, yaitu sekitar 1–3 jam, obat ini harus sering dikonsumsi (3–4 kali sehari). Kelemahan-kelemahan tersebut diharapkan dapat teratasi dengan menyalut ketoprofen dalam mikrokapsul yang mampu mengatur pelepasan obat dalam tubuh (Yamada et al. 2001, Tiyaboonchai & Ritthidej 2003).
Kitosan merupakan aminopolisakarida hasil deasetilasi kitin, yaitu polisakarida alami terbanyak kedua setelah selulosa. Karena kemampuannya membentuk gel dalam suasana asam, kitosan berpotensi sebagai matriks dalam sistem pengantaran obat ke dalam tubuh (Sutriyo et al. 2005). Yamada et al. (2001) telah menggunakan membran kitosan ini sebagai penyalut obat antiradang ketoprofen.
Modifikasi kimia kitosan menjadi gel kitosan telah dilaporkan dapat meningkatkan kemampuan dan kapasitas serapnya. Di antaranya adalah dengan menambahkan hidrokoloid alami seperti gom guar (Sugita et
al. 2006a), karboksimetilselulosa (CMC)
(Sugita et al. 2006b), alginat (Sugita et al. 2006c), dan gom xantan (Sugita et al. 2007b).
Mikrokapsul kitosan-gom guar telah diuji sebagai penyalut ketoprofen. Namun, hasilnya masih kurang baik karena mikrokapsul terurai lebih cepat di dalam lambung dan pelepasan obat menjadi tidak terkendali (Sugita et al. 2007a), walaupun Setyowati (2008) memperlihatkan bahwa usia guna mikrokapsul bisa mencapai 10.17 minggu pada komposisi kitosan 1.75%, gom guar 0.75%, dan glutaraldehida 3%. Pemodelan difusi ketoprofen melalui membran tersebut juga belum bisa menjelaskan secara keseluruhan mekanisme pengantaran obat yang terjadi, karena parameter jumlah dan ukuran pori membran belum terukur (Nata et al. 2007).
Belum lama ini, Yundhana (2008) melaporkan bahwa matriks gel kitosan-CMC memiliki kemampuan yang lebih baik dibandingkan dengan matriks kitosan-gom guar sebagai sediaan lepas lambat. Ketoprofen masih tersalut dengan cukup baik ketika di dalam lambung, dan baru terlepas secara
terkendali di dalam usus. Karena itu, penyerapan obat maksimum dan bahaya pendarahan lambung dapat diminimumkan.
Untuk mempelajari lebih lanjut potensi gel kitosan-CMC sebagai penyalut dalam sediaan lepas lambat ketoprofen, perilaku difusi ketoprofen melalui membran tersebut dipelajari dalam penelitian ini. Parameter yang dikaji meliputi pengaruh konsentrasi ketoprofen dalam sel donor (A), suhu difusi (T), ketebalan membran (h), dan konsentrasi kesetimbangan
ketoprofen (Cs) yang diperoleh dari metode
permukaan respons (RSM) terhadap fluks (J) ketoprofen. Fluks ketoprofen dihitung dengan persamaan Higuchi.
TINJAUAN PUSTAKA
Ketoprofen
Ketoprofen [asam 2-(3-benzoilfenil) propanoat] merupakan obat antiradang nonsteroid dengan rumus molekul C16H14O3 (bobot molekul 254.3). Zat ini berbentuk serbuk hablur, putih atau hampir putih, dan tidak berbau, mudah larut dalam etanol, kloroform, dan eter, tetapi tidak larut dalam air, serta memiliki laju pelepasan yang cepat dalam tubuh. Suhu leburnya berkisar 93–96 ºC (USP 2003). Struktur ketoprofen dapat dilihat pada Gambar 1.
Gambar 1 Struktur ketoprofen.
Ketoprofen dieliminasi melalui ginjal. Dosis oral ketoprofen bagi penderita artritis reumatoid dan osteoartritis adalah 75 mg jika diminum 3 kali sehari, atau 50 mg untuk 4 kali sehari. Penggunaan ketoprofen dalam dosis yang tinggi (>300 mg) dapat menyebabkan pendarahan pada lambung (AMA 1991). Kelemahan-kelemahan tersebut dapat diatasi dengan teknik mikroenkapsulasi. Obat disalut dalam mikrokapsul gel yang mampu mengatur laju pelepasan obat dalam tubuh tanpa mengurangi aktivitasnya (Tiyaboonchai & Ritthidej 2003 & Yamada et al. 2001).
2
Kitosan
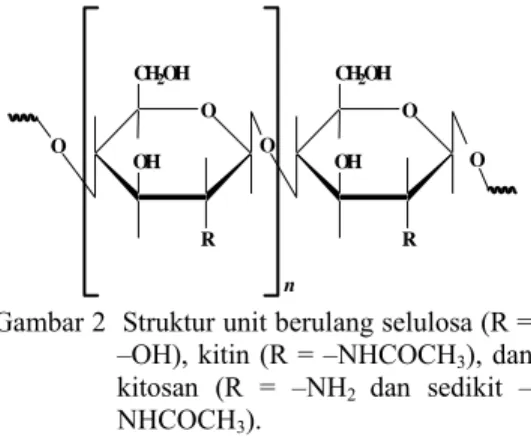
Kitosan merupakan kopolimer dari 2-amino-2-deoksi-D-glukopiranosa dan sejumlah kecil 2-asetamido-2-deoksi-D-glukopiranosa melalui taut β-(1→4). Biopolimer ini didapat dari deasetilasi kitin. Kitin dihasilkan dari kulit udang atau kepiting yang dideproteinasi dengan NaOH dan didemineralisasi dengan HCl. Deasetilasi kitin menjadi kitosan dilakukan dengan pemanasan dalam NaOH (Tarirai 2005). Struktur unit berulang selulosa, kitin, dan kitosan disajikan pada Gambar 2.
O R OH CH2OH O R OH CH2OH O O O n
Gambar 2 Struktur unit berulang selulosa (R = –OH), kitin (R = –NHCOCH3), dan
kitosan (R = –NH2 dan sedikit –
NHCOCH3).
Parameter penting dalam pencirian kitosan adalah bobot molekul dan derajat deasetilasi (DD). Bobot molekul kitosan beragam, yang antara lain bergantung pada degradasi yang terjadi selama proses deasetilasi. Derajat deasetilasi dipengaruhi oleh sumber dan metode isolasi kitin (Purwantiningsih 1992). Kitosan farmasi mengalami deasetilasi antara 90 dan 95% dan kitosan pangan 70–75%. Kitosan tidak larut dalam air atau pelarut organik, tetapi larut dalam HCl dan asam organik seperti asam format, asetat, oksalat, dan laktat (Rosca et al. 2005).
Kitosan sekarang ini banyak dimanfaatkan dalam dunia pangan, medis, farmasi, dan bioteknologi (Khan et al. 2002). Banyaknya aplikasi kitosan dalam dunia medis dan farmasi dikarenakan sifatnya yang biokompatibel dan biodegradabel. Aplikasi kitosan dalam dunia medis di antaranya ialah untuk pengantaran obat (Berger et al. 2003).
CMC
CMC adalah polisakarida anionik linear yang larut dalam air dan merupakan gom alami yang dimodifikasi secara kimia. CMC secara umum memiliki derajat substitusi berkisar 0.4
sampai 1.4 per unit monomer (Nussinovitch 1997). CMC digunakan dalam modifikasi gel kitosan karena dapat digunakan dalam kisaran beragam dalam aplikasinya dibandingkan dengan polimer larut air lainnya. Struktur CMC dapat dilihat pada Gambar 3.
Gambar 3 Struktur CMC
CMC diproduksi dengan cara menggabungkan selulosa dari pulp kayu atau kapas dengan larutan NaOH. Selulosa alkali ini kemudian direaksikan dengan Na-monokloroasetat atau asam Na-monokloroasetat menghasilkan Na-CMC dan NaCl. Berbeda dengan turunan selulosa lainnya, CMC mengandung garam karboksil yang membuatnya lebih mudah larut dalam air. Secara umum larutan CMC dalam air bersifat pseudoplastik, tetapi larutan CMC dengan derajat polimerisasi tinggi dan derajat substitusi rendah menunjukkan sifat tiksotropik. Hong et al. (2007) memaparkan kopolimer kitosan-CMC dapat disintesis dengan polimerisasi termal dan potensial digunakan sebagai penukar ion yang biokompatibel.
Gel Kitosan-CMC
Gel merupakan jejaring tiga dimensi yang terhubung antarmolekul atau partikel dan memerangkap sejumlah pelarut seperti spons. Gel berupa serat-serat yang terbentuk dari molekul-molekul polimer yang ditautkan oleh ikatan hidrogen, interaksi hidrofobik, ikatan ionik, atau ikatan kovalen (Whistler & James 1976). Gel merupakan sistem semipadat dari suspensi partikel anorganik yang kecil atau molekul organik yang besar, yang terpenetrasi oleh suatu cairan. Sementara hidrogel merupakan gel yang dapat menahan air dalam strukturnya (Wang et al. 2004). Air yang terdapat dalam gel ini merupakan jenis air imbibisi, yaitu air yang masuk ke dalam suatu bahan dan menyebabkan pengembangan volume, tetapi bukan komponen penyusun bahan tersebut (Winarno 1997).
Kunci utama dalam pembentukan gel adalah pembentukan taut silang (cross-link) di antara molekul-molekul polimer yang
3
memperkuat jejaring gel (Fardiaz 1989). Taut-silang kovalen dalam hidrogel kitosan dapat dibedakan menjadi 4, yaitu taut silang kitosan-kitosan, jejaring polimer hibrida atau HPN (hybrid polymer network), jejaring semi- atau
full-IPN (interpenetrating polymer network),
dan kitosan bertaut-silang ionik.
Sifat gel kitosan yang rapuh telah banyak diperbaiki dengan melakukan modifikasi. Wang et al. (2004) melaporkan pembentukan gel kitosan-poli(vinil alkohol) (PVA). PVA ditambahkan karena sifat mekaniknya yang lebih baik daripada kitosan dan dapat terurai secara alami. Hasil yang diperoleh menunjukkan bahwa penambahan PVA dapat memperbaiki sifat gel kitosan, yaitu menurunkan waktu gelasi dan meningkatkan kekuatan mekanis gel. Modifikasi gel kitosan-PVA pun dilanjutkan dengan menambahkan poli(etilena glikol) (PEG) sebagai porogen (Ariwanda 2006). Penambahan PEG pada gel kitosan-PVA menghasilkan membran yang lebih mudah dilewati zat terlarut.
Modifikasi gel kitosan juga dilakukan dengan menambahkan hidrokoloid alami seperti gom guar (Sugita et al. 2006a), karboksimetilselulosa (CMC) (Sugita et al. 2006b), alginat (Sugita et al. 2006c), dan gom xantan (Sugita et al. 2007b). Sugita et al. (2007a) dan Nata et al. (2007) berturut-turut telah melakukan uji disolusi dan difusi terhadap gel kitosan-gom guar. Diperoleh bahwa pelepasan ketoprofen dari matriks telah berlangsung di dalam lambung sehingga berpotensi menyebabkan pendarahan pada lambung. Mekanisme pelepasannya diawali dengan pembengkakan matriks yang pada akhirnya menyebabkan pembukaan pori membran.
Di sisi lain, Yundhana (2008) baru-baru ini melaporkan bahwa dengan menggunakan gel kitosan-CMC, disolusi ketoprofen lebih terkendali sehingga baru terjadi dalam medium usus. Karena itu, gel ini lebih berpotensi sebagai penyalut untuk sediaan lepas-lambat ketoprofen. Sifat reologi gel ini juga tergolong baik. Penambahan CMC telah ditunjukkan membuat gel semakin elastis serta memiliki daya bengkak dan daya kerut yang lebih besar (Sugita et al. 2006b).
Difusi Membran
Aplikasi membran, termasuk membran kitosan-CMC, ditentukan oleh sifat difusinya (Krajewska 2001), yang meliputi mekanisme difusi, laju difusi, dan faktor-faktor lain yang
memengaruhi difusi. Jika tidak terdapat interaksi kimia antara partikel terlarut dan membran, difusi partikel terlarut melalui membran tersebut dapat digambarkan oleh persamaan Fick (Martin 1993):
J = dt S dM
. (1)
dengan J adalah fluks partikel terlarut (g cm-2 det-1), M adalah massa partikel terlarut yang berdifusi (g), S adalah luas permukaan
membran (cm2), dan t adalah waktu difusi
(det).
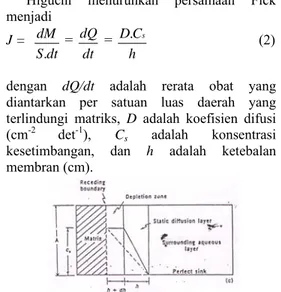
Pengetahuan tentang difusi membran tersebut kemudian dikembangkan untuk menjelaskan sistem pengantaran obat. Di antaranya ialah Higuchi yang mengembangkan persamaan Fick untuk pengantaran obat melalui matriks polimer.
Higuchi menurunkan persamaan Fick menjadi J = dt S dM . = dQ = dt h C D. s (2) dengan dQ/dt adalah rerata obat yang diantarkan per satuan luas daerah yang terlindungi matriks, D adalah koefisien difusi
(cm-2 det-1), C
s adalah konsentrasi
kesetimbangan, dan h adalah ketebalan membran (cm).
Gambar 4 Skema difusi obat melalui matriks padat (Martin 1993)
Batas antara matriks obat dan yang tidak mengandung obat semakin mundur seiring bertambahnya waktu (Gambar 4). Jumlah yang sangat kecil (dQ) dari obat yang berdifusi untuk pelebaran batas yang sangat kecil (dh) digambarkan dengan persamaan linear
dQ = A dh – ½ Cs dh (3)
dengan A adalah konsentrasi awal (massa ketoprofen per satuan volume). Dengan mensubstitusikan Persamaan 3 ke Persamaan 2 akan didapatkan nilai h sebagai berikut:
4
(A – ½ Cs) dh = h C D. s dt (4)∫
hdh DC C A s s 2 -2 =∫
dt (5) t= h C ADCs Cs A + − ) 2 2 ( (6)Tetapan C dievaluasi pada t = 0, yang memberikan h = 0, sehingga persamaan menjadi t = s s ADC h C A ) 2 2 ( − (7) h = 1/2 2 ⎟⎠ ⎞ ⎜ ⎝ ⎛ − s s C A t ADC (8)
Jumlah obat per satuan luas matriks (Q) pada waktu t didapat dengan mengintegralkan Persamaan 3 menjadi
Q = h – ½ h Cs (9)
Substitusi Persamaan (8) ke Persamaan (9) menghasilkan Persamaan 10 yang dikenal sebagai persamaan Higuchi:
Q = [D (2A-Cs) Cs t]1/2 (10)
Nilai J (dQ/dt) didapat dengan menurunkan Persamaan 10 terhadap t: J = dt dQ =
(
2)
1/2 2 1 ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ − t Cs s C A D (11)Biasanya A jauh lebih besar dibanding Cs,
maka Persamaan (10) direduksi menjadi
Q = (2A D Cst)
1/2 (12)
Dan persamaan (11) menjadi
J = dt dQ = 2 / 1 2 ⎥⎦ ⎤ ⎢⎣ ⎡ t ADCs (13)
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah kitosan dari Bratachem, NaOH teknis, HCl
teknis, indikator pH universal, asam asetat teknis, CMC, glutaraldehida, etanol teknis, etanol absolut, air suling, dan ketoprofen yang diperoleh dari PT Kalbe Farma.
Alat-alat yang digunakan, antara lain lempeng pemanas, pengaduk magnet, oven, spektrofotometer inframerah transformasi Fourier (FTIR) Bruker jenis Tentor 37 di Pusat Studi Biofarmaka, viskometer Ostwald-Cannon-Fenske, alat uji difusi (Gambar 5), penangas air, spektrofotometer ultraviolet/sinar tampak (UV/Vis) Shimadzu Pharmaspec 1700 di Laboratorium Bersama, mikroskop elektron susuran (SEM) JOEL-JSM-5310LV di Laboratorium SEM Zoologi LIPI, dan peranti lunak Minitab Release 14.
Gambar 5 Alat uji difusi.
Langkah Kerja
Penelitian ini melalui dua tahapan, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan berupa pencirian kitosan yang meliputi kadar air, kadar abu , DD, dan bobot molekul, sedangkan dalam penelitian utama dilakukan pembuatan dan uji difusi membran gel kitosan-CMC. Penelitian sebagian besar dilaksanakan di Laboratorium Kimia Organik dan Laboratorium Bersama, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Prosedur pencirian kitosan dan diagram alir penelitian utama dapat dilihat pada Lampiran 1 dan 2.
Pembuatan Membran Kitosan-CMC (modifikasi dari Sugita et al. 2006b)
Sebanyak 30 ml larutan kitosan 3% (b/v) dalam asam asetat 1% (v/v) ditambahkan 5 ml larutan CMC 1% (b/v) kemudian ditetesi HCl pekat sambil diaduk sampai homogen. Kemudian ditambahkan glutaraldehida 6% (v/v) sebanyak 1 ml secara perlahan-lahan
5
sambil terus diaduk. Larutan yang terbentuk dituang ke atas lempeng kaca berukuran 21 ×
28 cm2 pada suhu kamar. Pelarut dibiarkan
menguap sampai diperoleh membran kering. Membran lalu dilepaskan dari cetaan dengan menambahkan larutan NaOH 1 M. Pekerjaan ini diulangi dengan meragamkan volume kitosan (30, 60, dan 90 ml) untuk memperoleh membran dengan ketebalan berbeda.
Uji Difusi Membran (Nata et al. 2007)
Sel donor diisi larutan ketoprofen dengan konsentrasi 25, 50 dan 75 µg/ml dalam etanol-air (1:1), sementara pada sel resipien diisikan pelarut. Alat difusi kemudian diletakkan dalam penangas air bersuhu 37 dan 42 °C yang dijaga konstan. Cairan pada kedua sel difusi terus diaduk dengan bantuan aerator.
Setiap 30 menit alikuot diambil dari sel resipien dan konsentrasi ketoprofen yang berdifusi diukur dengan spektrofotometer UV/Vis pada 258 nm. Pengambilan alikuot terus dilakukan sampai diperoleh konsentrasi
kesetimbangan (Cs). Setiap pengambilan
alikuot, ditambahkan pelarut dengan jumlah yang sama ke dalam sel resipien.
Pemodelan Cs, D, dan J
Model matematis untuk Cs, D, dan J
diturunkan dengan menggunakan RSM dalam peranti lunak Minitab Release 14 dengan faktor-faktor konsentrasi ketoprofen dalam sel donor (A), suhu difusi (T), dan ketebalan membran (h). Luaran yang didapat berupa persamaan dan peta kontur respons dua dimensi.
Pencirian Membran (SEM)
Morfologi membran sebelum dan sesudah difusi diamati dengan SEM pada permukaan dan penampang lintangnya. Pencirian ini bertujuan mengamati porositas membran dalam upaya mempelajari mekanisme difusi.
HASIL DAN PEMBAHASAN
Pencirian Kitosan
Kitosan yang digunakan memiliki kadar air, kadar abu, DD, dan bobot molekul
berturut-turut 7.5%, 0.11%, 74.41%, 24.3894 × 105 –
63.1553 × 105 g mol-1 (Lampiran 3). Spesifikasi
ini dapat dibandingkan dengan kitosan hasil isolasi Asnel (2009) (Tabel 1 ).
Tabel 1 Spesifikasi kitosan*
Parameter Ciri
Ukuran partikel Serpihan sampai bubuk
Kadar air 8.49%
Kadar abu 0.15%
Derajat deastilasi 74.15%
Warna larutan tidak berwarna
Bobot molekul: 6.63× 105 g mol-1
* Sumber: Asnel (2009)
Pembuatan Membran
Kondisi optimum gel kitosan-CMC yang diperoleh Sugita et al. (2006b), yaitu 30 ml larutan kitosan 2.5% (b/v) dalam asam asetat 1% dicampur dengan 2 ml CMC 1% (b/v) dan 1 ml glutaraldehida 6% (v/v), tidak menghasilkan membran gel. Hal ini diduga karena bobot molekul kitosan yang digunakan pada penelitian ini lebih besar daripada yang digunakan Sugita et al. (2006b). Karena itu, dilakukan percobaan pendahuluan dengan berbagai konsentrasi kitosan (1.5, 2, 2.5, dan 3%). Konsentrasi kitosan 3% dipilih karena membran yang dihasilkan lebih mudah dilepas dari cetakan dan lebih cepat kering dibandingkan dengan yang lain.
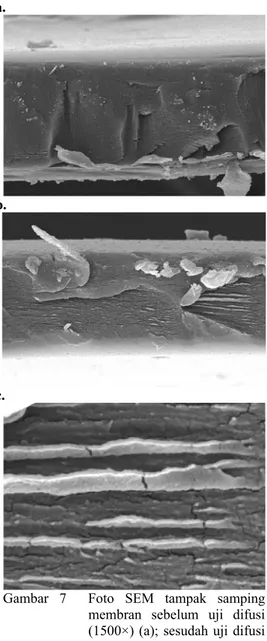
Porositas Membran
Membran yang dihasilkan memiliki tekstur pori yang rapat dan tertutup (Gambar 6a). Hal ini diduga terjadi karena ruang kosong di sela-sela taut silang kitosan-glutaraldehida diisi sempurna oleh CMC sehingga menutup pori.
Pemilihan membran hasil uji difusi ke-2 dan ke-31 untuk pengamatan dengan SEM dikarenakan keduanya memiliki nilai A dan h yang sama, dan diharapkan hanya berbeda dalam nilai T. Dengan kesamaan tersebut pengaruh T terhadap morfologi membran dapat terlihat. Namun, Gambar 6b dan c tidak memperlihatkan adanya pembukaan pori pada suhu 37 maupun 42 °C. Walaupun demikian, dengan didapatnya nilai fluks, terlihat adanya proses difusi yang mengindikasikan terbentuknya pori. Nilai fluks kedua membran
uji juga tidak jauh berbeda, yaitu 4.75×10-9
g/cm2det pada uji difusi ke-2 (37 °C) dan
4.22×10-9 g/cm2det pada uji ke-31 (42 °C)
(Lampiran 4).
Catatan yang bisa diambil dari Gambar 6c yaitu terjadinya retakan yang diharapkan berasal dari pembengkakan membran.
6
Pembengkakan membran sangat mungkin terjadi karena CMC mempunyai kemampuan menyerap air. Namun pembengkakan ini tidak terlihat karena membran diamati pada keadaan kering. Retakan inilah yang menguatkan terbentuknya pori pada membran sehingga terjadinya proses difusi. Namun, ukuran pori sangat berpengaruh terhadap difusi yang terjadi. Ukuran pori yang diharapkan haruslah lebih besar dari ukuran partikel ketoprofen.
a.
b.
c.
Gambar 6 Foto SEM permukaan membran sebelum uji difusi (a); sesudah uji difusi ke-31 (b); dan sesudah uji difusi ke-2 (c) (perbesaran 10000×).
Foto SEM tampak samping membran hasil uji difusi ke-2 (Gambar 7b) juga tidak memperlihatkan adanya pori. Dengan
membandingkan Gambar 7a dan b juga tidak teramati pembengkakan membran sebagaimana yang dilaporkan sebagai awal terjadinya difusi oleh Nata et al. (2007). Dengan perbesaran yang sama (1500×), ketebalan membran relatif tetap dan permukaan membran terlihat tetap mulus (tidak bergelombang). Kedua pengamatan ini menunjukkan bahwa tidak terjadi pembengkakan pada membran yang dipilih untuk uji SEM. Rapatnya membran ini menjelaskan rendahnya nilai Cs yang melintasi
membran itu (Lampiran 4).
a.
b.
c.
Gambar 7 Foto SEM tampak samping membran sebelum uji difusi (1500×) (a); sesudah uji difusi ke-2 (1500×) (b); sesudah uji difusi ke-2 (10000×) (c). .
Dalam penelitian sebelumnya, sifat reologi pembengkakan gel kitosan-CMC telah
7
dilaporkan lebih baik daripada gel kitosan-gom guar, yakni berturut-turut 5.3 g (Sugita et al. 2006b) dan 4.1 g (Sugita et al. 2006a). Potensi difusi yang lebih besar dari gel kitosan-CMC ini tidak terlihat dari foto SEM pada Gambar 6 maupun 6. Analisis SEM pada membran kitosan-CMC yang mampu melewatkan lebih banyak ketoprofen diperlukan untuk menunjukkan pembengkakan dan pembukaan pori yang serupa dengan hasil Nata et al. (2007).
Pemodelan Konsentrasi Kesetimbangan Ketoprofen (Cs)
Model Cs yang diperoleh dengan RSM
adalah Cs = 19.9277 – 0.01h – 0.3542A –
0.4069T + 0.0001h2 + 0.0013A2 + 0.0002hA –
0.0002hT + 0.00088 AT dengan nilai R2 =
90.8%. Dengan nilai R2 = 90.8%, persamaan ini
dapat menjelaskan nilai-nilai Cs yang diperoleh
dalam percobaan.
Pada kedua suhu yang diujikan, terlihat
kenaikan nilai Cs dengan meningkatnya A
(Lampiran 4). Rentang nilai Cs yang
didapatkan 3.1–17.3 mg/l. Membran pada uji difusi ke-8, dengan h = 150.6 µm pada T = 37
°C dan A = 50 mg/l, memiliki Cs lebih besar
daripada batas minimum konsentrasi terapi ketoprofen, yaitu 15 mg/l. Sebelumnya, Sumirtapura et al. (2002) melaporkan bahwa kadar puncak terapi ketoprofen pada sediaan tablet hanya mencapai 4.6 µg/ml. Hasil ini menunjukkan potensi membran kitosan-CMC sebagai penyalut ketoprofen untuk sediaan lepas-lambat.
Pemodelan Koefisien Difusi (D) dan Fluks (J)
Nilai Cs merupakan hasil interaksi tiga
faktor, yaitu A, h, dan T, yang dijadikan faktor keempat dalam penentuan nilai J. Berdasarkan
Persamaan 2, semakin besar nilai Cs, nilai D
akan menurun untuk nilai J tertentu dan sebaliknya nilai J akan meningkat untuk nilai
D tertentu. Dengan menggunakan RSM
diperoleh model untuk D = 16.0925 – 0.0074h
– 0.5753A – 0.4302T + 2.3474Cs + 0.0003h 2 – 0.0007A2 + 0.0795C s 2 + 0.0017hA + 0.0026hT – 0.0162hCs + 0.0163AT – 0.0016ACs – 0.082TCs dengan nilai R2 = 99.7% dan untuk J = 6.42999 + 0.04251h + 0.02198A – 0.1839T - 1.012Cs – 0.00009h 2 + 0.00113A2 + 0.06862C s 2 + 0.00078hA – 0.00040hT – 0.00040hCs + 0.00079AT – 0.01882ACs + 0.02169TCs dengan nilai R2 = 98.9%.
Nilai R2 yang sangat tinggi untuk kedua
model tersebut menunjukkan bahwa persamaan ini cukup baik untuk menjelaskan nilai-nilai J dan D dalam percobaan. Namun, analisis statistik (Lampiran 5) terhadap persamaan D memiliki nilai P>0.01yang menunjukkan bahwa pengaruh D tidak nyata. Sebaliknya, J memiliki P<0.01 yang berarti terminologi-terminologi tersebut memberikan pengaruh nyata pada taraf kepercayaan 99%. Berdasarkan hasil ini, nilai J dipilih untuk menjelaskan perilaku difusi.
Pengaruh Konsentrasi Ketoprofen dalam Sel Donor, Ketebalan Membran, dan Suhu
terhadap Fluks Ketoprofen
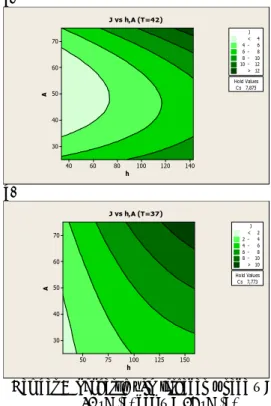
Gambar 8 memperlihatkan peta kontur 2-dimensi pengaruh konsentrasi ketoprofen dalam sel donor (A) dan ketebalan membran (h) terhadap fluks ketoprofen (J) pada 2 suhu
uji (T), yaitu 42 oC (Gambar 8a) dan 37 oC
(Gambar 8b). Peta kontur tersebut dibuat dengan mengambil nilai Cs konstan pada nilai
mediannya, yaitu 7.875 mg/l pada suhu 42 oC
dan 7.773 mg/l pada suhu 37 oC. Nilai median
yang dipilih, dan bukan nilai minimum atau
maksimum Cs, karena sebaran nilai yang
cenderung merata. a. h A 140 120 100 80 60 40 70 60 50 40 30 Hold Values Cs 7,875 J 6 - 8 8 - 10 10 - 12 > 12 < 4 4 - 6 J vs h,A (T=42) b. h A 150 125 100 75 50 70 60 50 40 30 Hold Values Cs 7,773 J 4 - 6 6 - 8 8 - 10 > 10 < 2 2 - 4 J vs h,A (T=37)
Gambar 8 Pengaruh h, A terhadap J pada T = 42 °C (a) dan T = 37 °C (b)
8
Terlihat bahwa nilai J cenderung meningkat dengan meningkatnya A, h, maupun T. Dari persamaan (2) dan (13), J seharusnya berbanding lurus dengan A dan berbanding terbalik dengan h. Semakin besar konsentrasi ketoprofen dalam sel donor, gradien konsentrasi dengan sel resipien semakin besar sehingga memperbesar gaya dorong yang mendesak ketoprofen dari sel donor untuk melewati membran; dengan kata lain, fluks akan meningkat (Nata et al. 2007). Sebaliknya, semakin tebal membran yang dipakai, lintasan tempuh difusi menjadi semakin panjang dan semakin sulit terbentuk pori yang permeabel di sepanjang ketebalan membran itu. Karena itu, fluks akan menurun.
Menurunnya fluks pada membran yang semakin tebal telah dilaporkan oleh Wu et al. (2008) untuk transport metanol. Dalam penelitian ini, fluks justru meningkat dengan bertambahnya ketebalan membran. Hal ini mungkin dikarenakan tersumbatnya pori membran akibat banyaknya ketoprofen yang menempel di permukaan dalam pori membran. Dengan membandingkan Gambar 8a dan b,
terlihat bahwa fluks pada suhu 42 oC lebih
tinggi daripada pada suhu 37 oC. Kenaikan
suhu akan meningkatkan laju gerak ketoprofen sehingga memperbesar peluang ketoprofen melintasi membran. Santos et al. (2008) telah melaporkan meningkatnya perpindahan massa melewati membran, dan karena itu, nilai J meningkat dengan bertambahnya suhu.
Lebih jauh, terlihat perbedaan pola kontur di antara kedua suhu tersebut. Pada suhu 42 oC, fluks maksimum diperoleh pada konsentrasi 72–75 µg/ml dan ketebalan 127–145 µm, sedangkan fluks minimum berturut-turut pada 34–67 µg/ml dan 35–68 µm. Sementara fluks
maksimum dan minimum pada suhu 37 oC
berturut-turut diperoleh pada konsentrasi 67–75 µg/ml dan 25–47 µg/ml serta ketebalan 127– 157 µm dan 25–40 µm.
SIMPULAN DAN SARAN
Simpulan
Membran kitosan-CMC berpotensi sebagai penyalut dalam sediaan lepas-lambat untuk ketoprofen dengan nilai Cs = 17.3 mg/l, lebih
besar daripada nilai yang dihasilkan oleh membran kitosan-alginat dalam penelitian sebelumnya. Namun, foto SEM dari membran hasil uji difusi ke-2 dan 31 belum menunjukkan pembengkakan dan pembentukan
pori yang mengawali proses difusi ketoprofen. Diperlukan analisis SEM terhadap membran lain yang nilai fluks ketoprofennya lebih besar. Analisis RSM lebih jauh menunjukkan pengaruh positif dari konsentrasi ketoprofen dalam sel donor, ketebalan membran, dan suhu uji difusi terhadap nilai fluks.
Saran
Penelitian lebih lanjut diharapkan dapat menggunakan pemodelan tiga dimensi untuk menjelaskan pengaruh A, h, dan T terhadap J. Membran yang dianalisis dengan SEM
sebaiknya yang nilai Cs-nya besar agar
perubahan morfologi membran dapat terlihat jelas dan dapat menjelaskan mekanisme difusi. Selain itu juga diperlukan modifikasi alat yang lebih tahan perubahan suhu dan interaksi dengan pelarut agar hasil pengamatan maksimal.
DAFTAR PUSTAKA
[AMA] American Medical Association. 1991.
Drug Evaluations. Ed ke-8. United States
of America: American Medical Association.
Asnel RS. 2009. Perilaku difusi ketoprofen melalui membran kitosan-alginat [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[AOAC] Association of Official Analytical Chemists. 1999. Official Methods of
Analysis of AOAC International. 5th Revision. Volume 2. Cunnif P, editor.
Maryland: AOAC International.
Ariwanda R. 2006. Dialisis larutan garam menggunakan membran kitosan termodifikasi poli(vinil alkohol) dengan poli(etilena glikol) sebagai porogen [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Berger J et al. 2004. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. Eur J Pharm Biopharm 57:193-194.
9
Fardiaz D. 1989. Hidrokoloid. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Hong et al. 2007. Synthesis of Biocompatible CS-g-CMC Ion Exchangers for Heavy Metal Ions. J Ind Eng Chem 13: 1009-1016.
Khan TA, Peh KK, Ch’ng HS. 2002. Reporting degree of deacetylation values of chitosan: The influence of analytical methods. J
Pharm Pharmaceut Sci 5:205-212.
Krajewska B. 2001. Diffusional properties of chitosan hydrogel membranes. J Chem
Technol Biotechnol 76:636-642.
Martin, A. 1993. Physical Pharmacy. Ed ke-4. Philadelphia and London: Lea & Febiger. Nussinovitch A. 1997. Hydrocolloid
applications. Israel: Chapman and London.
Nata F, Sugita P, Sjachriza A, Arifin B. 2007. Diffusion behavior of ketoprofen through chitosan-guar gum membranes.
Proceedings of The International Conference and Workshop on Basic and Applied Sciences: Improving Link of Basic Sciences and Applied Sciences: Surabaya
6-7 Agu 2007. Surabaya: Unair-RuG-KNAW-UTM.
Purwantiningsih. 1992. Isolasi kitin dan komposisi senyawa kimia dari limbah udang windu (Penaeus monodon) [tesis]. Bandung: Program Pascasarjana, Institut Teknologi Bandung.
Rosca et al. 2005. Interaction of chitosan with natural or synthetic anionic polyelectrolytes: 1. The
chitosan-carboxymethylcellulose complex.
Carbohydr Polym 62:35-41.
Santos DES, Neto CGT, Fonseca JIC, Pereira MR. 2008. Chitosan macroporous asymmetric membranes – Preparation, characterization and transport of drugs. J
Membr Sci 325:362-370.
Setyowati EV. 2008. Uji stabilitas obat anti peradangan ketoprofen yang tersalut gel kitosan-gom guar [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sugita P, Sjachriza A, Lestari SI. 2006a. Sintesis dan optimalisasi gel kitosan-guar gum. J Natur 9:32-36.
Sugita P, Sjachriza A, Rachmanita. 2006b. Sintesis dan optimalisasi gel kitosan-karboksimetilselulosa.J Alchemy 6:57-62. Sugita P, Sjachriza A, Wahyono D. 2006c.
Sintesis dan optimalisasi gel kitosan-alginat. J Sains Teknol 8:133-137.
Sugita P, Amelia F, Srijanto B, Arifin B, Wukirsari T. 2007a. Perilaku disolusi ketoprofen tersalut gel kitosan-gom guar. J
S Chem.
Sugita P, Sjachriza A, Utomo DW. 2007b. Optimization synthesis chitosan-xanthan gum gel for metal adsorption. Di dalam:
Proceeding of 1st International Conference on Chemical Sciences.
Yogyakarta-Indonesia, 24-26 Mei 2007.
Sumirtapura YC, Badruzaman S, Mamat R. 2002. Farmakokinetik dan ketersediaan hayati relatif sediaan kapsul, tablet salut enterik dan suposituria ketoprofen. J Mat
Sains 7:15-19.
Sutriyo, Joshita D, Indah R. 2005. Perbandingan pelepasan propranolol hidroklorida dari matriks kitosan, etil selulosa, dan hidroksipropil metil selulosa.
Maj Ilmu Kefarmasian 2:145-153.
Tarbojevich M, Cosani A. 1996. Molecular weight determination of chitin and chitosan. Di dalam: Muzarelli RAA, Peter MG, editor. Chitin Handbook. Grottammare: European Chitin Society. hlm 85-108. Tarirai C. 2005. Cross-linked chitosan matrix
systems for sustained drug release [thesis]. Tshwane: Faculty of Health Sciences, Tshwane University of Technology.
Tiyaboonchai W, Ritthidej GC. 2003. Development of indomethacin sustained release microcapsules using
chitosan-carboxymethylcellulose complex coacervation. Songklanakarin J Sci Technol
25:245-254.
[USP] United States Pharmacopeia. 2003. US
Pharmacopeia 2003. Maryland: The United
10
Wang T, Turhan M, Gunasekaram S. 2004. Selected properties of pH-sensitive, biodegradable chitosan-poly(vinyl alkohol) hydrogel. Polym Int 53:911-918.
Whistler RL, James RD. 1976. Carbohydrates. Di dalam: Fennema OR, editor. Food
Chemistry. Ed ke-2. New York: Marcel
Dekker. hlm 69-138.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
Wu Z, Sun G, Jin W, Hou H, Wang S. 2008. A model for methanol transport through Nafion membrane in diffusion cell. J
Membr Sci 325: 376-382.
Yamada T, Onishi H, Machida Y. 2001. In
vitro and in vivo evaluation of sustained
release chitosan-coated ketoprofen microparticle. Yakugaku Zasshi 121:239-245.
Yundhana Y. 2008. Mikroenkapsulasi obat anti-peradangan ketoprofen yang tersalut gel kitosan-karboksimetil selulosa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
12
Lampiran 1 Prosedur pencirian kitosan
Penelitian Pendahuluan
1) Penentuan kadar air (AOAC 1999)
Kadar air kitosan ditentukan dengan metode gravimetri. Sebanyak kira-kira 1.0000 g kitosan dimasukkan ke dalam cawan porselen yang telah diketahui bobotnya, kemudian cawan beserta isinya dimasukkan ke dalam oven pada suhu 105 °C selama 3 jam. Setelah itu, dimasukkan ke dalam desikator dan ditimbang. Pengeringan dan penimbangan diulangi setiap jam sampai diperoleh bobot konstan. Kadar air kitosan dihitung dengan persamaan
% 100 awal sampel Bobot kering sampel bobot -awal sampel Bobot air Kadar = ×
2) Penentuan kadar abu (AOAC 1999)
Kadar abu kitosan juga ditentukan secara gravimetri. Cawan porselen dibersihkan dan dipanaskan dalam tanur untuk menghilangkan sisa kotoran yang menempel pada cawan, kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak kira-kira 0.5000 g kitosan dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap, kemudian dibakar dalam tanur pengabuan dengan suhu 600ºC sampai diperoleh abu berwarna putih. Setelah itu, cawan beserta isinya didinginkan dalam eksikator dan ditimbang. Kadar abu kitosan dihitung dengan persamaan
% 100 sampel bobot abu bobot abu Kadar = ×
3) Penentuan DD (Domszy & Robert 1985 dalam Khan et al. 2002)
Derajat deasetilasi kitosan ditentukan dengan metode garis dasar menggunakan FTIR. Kitosan dibuat pelet dengan KBr 1%, kemudian dilakukan penyusuran pada daerah frekuensi 4000 – 400 cm-1. Derajat deasetilasi ditentukan dengan rumus
P
P
A
=
log
0dengan A = absorbans
P0 = % transmitans pada garis dasar, dan
P = % transmitans pada puncak minimum
% DD = 1 – 100% 1.33 1 3450 1655 × ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ × A A
dengan A1655 = absorbans pada bilangan gelombang 1655 cm -1 (serapan pita
amida)
A3450 = absorbans pada bilangan gelombang 3450 cm -1 (serapan gugus
hidroksil), dan
1.33 = A1655 untuk kitin yang terdeasetilasi sempurna (100%) 4) Penentuan bobot molekul kitosan (Tarbojevich & Cosani 1996)
Bobot molekul kitosan ditentukan dengan menggunakan metode viskometri. Sebanyak kira-kira 0.1000 g kitosan dilarutkan dalam 100 mL asam asetat 0.5 M, kemudian diambil sebanyak 5 ml dan dimasukkan ke dalam viskometer Ostwald-Cannon-Fenske untuk ditentukan waktu alirnya. Pengukuran
13
juga dilakukan untuk beberapa konsentrasi kitosan lainnya dan waktu alir dibaca sebanyak tiga kali ulangan.
Bobot molekul kitosan dihitung dengan menggunakan persamaan Mark-Houwink: Viskositas relatif
η
r =η
/η
o ≅ t/to Viskositas spesifikη
sp =η
r -1 Viskositas intrinsik [η
] = (η
sp/c)cη
= KMα dengan K = 3.5 x 10-4 mL/g α = 0.76T = waktu alir zat t0 = waktu alir pelarut
η
= viskositas zatη
0 = viskositas pelarutM = bobot molekul zat
Seluruh pencirian di atas dilakukan dengan mengambil sampel secara acak pada 3 titik dengan 3 kali ulangan.
14
Lampiran 2 Diagram alir penelitian utama
Penelitian Utama: Pembuatan dan Uji Difusi Membran Gel Kitosan-CMC
Pembuatan gel kitosan-CMC:
kitosan 3% (b/v) dalam asam asetat 1% (v/v)
+ CMC 1% (b/v) + glutaraldehida 6% (v/v)
Uji difusi:
Sel 1: ketoprofen 25, 50, atau 75 mg/l
dalam etanol-air (1:1)
Sel 2: pelarut
dalam penangas air suhu 37 atau 42 °C;
alikuot diambil setiap 30 menit sampai
tercapai konsentrasi kesetimbangan (C
s);
[ketoprofen] diukur dengan
spektrofotometer UV/Vis pada λ 258 nm
Pencirian membran (SEM)
Pemodelan C
s, D dan J dengan metode RSM
15
Lampiran 3 Hasil pencirian kitosan
1)
Kadar air dan abuUlangan ke- Sampel Kadar air (%) Kadar abu (%)
1 Kitosan 1 7.76 0.08 2 Kitosan 2 7.31 0.14 3 Kitosan 3 7.43 0.12 Rerata 7.50 0.11
2)
Derajat deasetilasi A1655 = log 8105 . 1 5615 . 7 = 0.6208 A3450 = log 1597 . 0 65 . 10 = 1.8239 % DD = 100% 33 . 1 1 8239 . 1 6208 . 0 1− ×⎥
×⎦
⎤
⎢
⎣
⎡
⎟
⎠
⎞
⎜
⎝
⎛
= 74.41 %16
3)
Bobot molekulWaktu alir larutan kitosan
Konsentrasi Sampel 1 Sampel 2 Sampel 3
t (det) Rerata t (det) Rerata t (det) Rerata
0 62.93 63.01 62.93 63.01 62.93 63.01 62.9 62.9 62.9 63.19 63.19 63.19 0.02 66.75 66.61 67.51 67.45 67.96 67.81 66.54 67.55 67.85 66.55 67.3 67.62 0.04 71.46 71.52 72.61 72.73 73.25 73.35 71.56 72.88 73.46 71.55 72.71 73.34 0.06 76.92 77.09 78.85 78.61 79.37 79.4 77.24 78.93 79.45 77.1 78.04 79.38 0.08 82.39 82.53 84.9 85.13 86.52 86.38 82.68 85.19 86.57 82.52 85.31 86.06 0.1 87.96 87.93 91.13 91.63 91.97 91.77 88.07 91.78 91.68 87.77 91.99 91.65
Contoh perhitungan untuk sampel 1:
Dibuat kurva hubungan antara ln
η
sp/c dan c, sesuai dengan persamaan:ln
η
sp/c =ln [η
] + k’ [η
] 2c
y a b x
Kurva pe ne ntuan bobot m ole k ul s am pe l 1
y = 3.9429x + 1.0255 R2 = 0.8712 0 0.5 1 1.5 0 0.02 0.04 0.06 0.08 0.1 0.12 k ons e ntras i ln ( n s p /c )
Diperoleh [
η
] = 3.9429 yang jika dimasukkan dalam persamaan [η
] = KMα menghasilkan M = 63.1553 × 105 g/mol17
Lampiran 4 Hasil uji difusi
No h (µm) A (mg/l) T (°C) Cs (mg/l) t (jam) D (cm2/det)×10-8 J(g/cm2det)×10-9
12 30.4 50 37 7.3711 9 0.0830 2.1728 11 30.6 50 37 5.5582 10 0.1043 2.0069 17 33.2 75 37 10.8214 10.5 0.0869 3.0560 18 33.8 75 37 10.0173 9.5 0.1089 3.4586 5 36 25 37 3.8185 7 0.1436 1.6493 6 36 25 37 6.2454 8 0.0689 1.3673 15 95 75 37 10.7629 11 0.6842 8.3507 16 95 75 37 8.7454 12 0.7944 7.7657 10 96 50 37 6.3916 11 0.7976 5.6732 9 96.6 50 37 5.4266 9.5 1.1243 6.6782 4 97.4 25 37 3.4091 8.5 0.9870 3.7075 3 97.8 25 37 3.8477 8.5 0.8652 3.6876 13 144 75 37 12.1371 14 1.0738 9.8473 14 144 75 37 10.5436 14.5 1.2212 9.6177 8 150.6 50 37 17.3272 14 0.4438 6.1758 7 150.8 50 37 7.0202 11 1.7679 8.8519 2 154.8 25 37 3.6138 10.5 1.8873 4.7491 1 159.4 25 37 5.0173 9.5 1.4981 5.2414 36 34 25 42 3.6576 9 0.1047 1.2158 35 35.4 25 42 3.1167 9 0.1364 1.2806 30 35.8 50 42 6.0406 8.5 0.1530 2.7482 29 36.2 50 42 5.9384 9 0.1506 2.6273 23 37.2 75 42 9.8126 10 0.1283 3.6215 24 37.2 75 42 12.4295 10 0.0976 3.5539 27 83.4 50 42 8.4091 11 0.4380 4.8224 21 87 75 42 10.2219 9.5 0.7050 8.8894 28 89.4 50 42 8.4384 11.5 0.4795 4.9430 33 93.2 25 42 2.6050 10.5 0.9907 2.9214 22 94.2 75 42 13.1459 11 0.5321 8.1387 34 94.2 25 42 3.2921 11 0.7425 2.7777 26 131.6 50 42 5.7482 12 1.5488 7.1779 25 135.4 50 42 5.5144 11.5 1.7923 7.7254 20 136.8 75 42 12.6781 11.5 1.1206 11.3439 32 142 25 42 3.0875 11.5 1.7358 4.0227 31 142.6 25 42 3.0875 11 1.8302 4.2233 19 147.4 75 42 10.7044 14 1.3023 10.1846
18
Lampiran 5 Analisis keragaman Cs, D, dan J
Analysis of Variance for Cs
Source DF Seq SS Adj SS Adj MS F P Regression 8 331.111 331.111 41.389 31.97 0.000 Linear 3 317.144 6.089 2.030 1.57 0.221 Square 2 5.377 5.425 2.712 2.09 0.143 Interaction 3 8.589 8.589 2.863 2.21 0.111 Residual Error 26 33.662 33.662 1.295 Lack-of-Fit 22 23.988 23.988 1.090 0.45 0.900 Pure Error 4 9.674 9.674 2.419 Total 34 364.773
Analysis of Variance for D
Source DF Seq SS Adj SS Adj MS F P Regression 9 643,757 643,75658 71,52851 294,21 0,000 Linear 3 626,174 2,76402 0,92134 3,79 0,093 Square 3 14,407 3,59869 1,19956 4,93 0,059 Interaction 3 3,176 3,17576 1,05859 4,35 0,074 Residual Error 5 1,216 1,21560 0,24312 Total 14 644,972
Analysis of Variance for J
Source DF Seq SS Adj SS Adj MS F P Regression 8 0.000000 0.000000 0.000000 261.51 0.000 Linear 3 0.000000 0.000000 0.000000 7.75 0.001 Square 2 0.000000 0.000000 0.000000 6.19 0.008 Interaction 3 0.000000 0.000000 0.000000 41.64 0.000 Residual Error 21 0.000000 0.000000 0.000000 Lack-of-Fit 18 0.000000 0.000000 0.000000 4.68 0.115 Pure Error 3 0.000000 0.000000 0.000000 Total 29 0.000000