PENGARUH PENAMBAHAN LAKTOSA DI DALAM PENGENCER TRIS
TERHADAP KUALITAS SEMEN CAIR DOMBA GARUT
[The Effect of Lactose Addition in Tris Extender on Chilled-semen Quality of Garut Ram]
M. Rizal
Jurusan Peternakan Fakultas Pertanian Universitas Pattimura, Ambon
ABSTRAK
Tujuan penelitian ini adalah untuk mengevaluasi kualitas semen cair domba Garut yang diencerkan dengan pengencer Tris dan ditambahkan berbagai konsentrasi laktosa. Semen dikoleksi dengan vagina buatan satu kali dalam satu minggu dari tiga pejantan domba Garut dewasa kelamin. Segera setelah dievaluasi, semen segar dibagi ke dalam empat buah tabung reaksi dan masing-masing diencerkan dengan 80% pengencer Tris + 20% kuning telur ayam ras (kontrol), 80% pengencer Tris + 20% kuning telur ayam ras + 0,05% laktosa (L0,05), 80% pengencer Tris + 20% kuning telur ayam ras + 0,1% laktosa (L0,10), dan 80% pengencer Tris + 20% kuning telur ayam ras + 0,2% laktosa (L0,20). Semen yang telah diencerkan disimpan di dalam lemari es pada suhu 5 oC. Kualitas semen cair yang telah didinginkan meliptui persentase spermatozoa motil, persentase spermatozoa hidup, dan persentase membran plasma utuh (MPU) dievaluasi setiap hari selama lima hari. Hasil yang diperoleh menunjukkan bahwa penambahan laktosa di dalam pengencer Tris mampu meningkatkan kualitas semen cair pada hari keempat dan kelima penyimpanan. Pada hari kelima penyimpanan, persentase spermatozoa motil, spermatozoa hidup, dan MPU perlakuan L0,10 (49% 57% dan 58%) nyata (P<0,05) lebih tinggi dibandingkan dengan perlakuan L0,20 (44%, 54%, dan 53,8%), perlakuan L0,05 (41%, 52,4%, dan 53,4%), dan perlakuan kontrol (38,75%, 48,25%, dan 49,75%). Dapat disimpulkan bahwa penambahan laktosa di dalam pengencer Tris mampu mempertahankan kualitas semen cair domba Garut hingga hari kelima penyimpanan pada suhu 5 oC. Penambahan 0,1% laktosa di dalam pengencer Tris merupakan dosis optimum dalam mempertahankan kualitas semen cair domba Garut yang disimpan pada suhu 5 oC.
Kata kunci: laktosa, pengencer Tris, kualitas semen cair, domba Garut
ABSTRACT
The purpose of this research was to evaluate the quality of chilled-semen of garut ram which diluted with Tris extender and addition the various lactose concentrations. Semen was collected using artificial vagina once a week from three mature Garut rams. After initial evaluation, semen was divided into four parts and diluted with 80% Tris extender + 20% egg yolk (control), 80% Tris extender + 20% egg yolk + 0.05% lactose (L0.05), 80% Tris extender + 20% egg yolk + 0.1% lactose (L0.10), and 80% Tris ex-tender + 20% egg yolk + 0.2% lactose (L0.20), respectively. The extended-semen were stored in refrig-erator at 5 oC. The quality of chilled-semen including : percentages of motile spermatozoa, live sperma-tozoa, and intact plasma membrane (IPM) were evaluated everyday for five days. The results indicated that the addition of lactose in Tris extender could increase the chilled-semen quality at day-4 and day-5 of storage. At day-5 of storage, the percentages of motile spermatozoa, live spermatozoa, and IPM for L0.10 (49%, 57%, and 58%) was significantly (P<0.05) higher than L0.20 (44%, 54%, and 53.8%), L0.05 (41%, 52.4%, and 53.4%), and control (38.75%, 48.35%, and 49.75%). In conclusion, the addi-tion of lactose in Tris extender could maintain the quality of chilled-semen of Garut ram until day-5 of storage at 5 oC. The addition of 0.1% lactose in Tris extender was an optimum dose for maintaining the quality of Garut ram chilled-semen stored at 5 oC.
Keywords : lactose, Tris extender, chilled-semen quality, Garut ram
PENDAHULUAN
Permasalahan utama penyimpanan semen pada suhu rendah (umumnya pada suhu 3 – 5 oC dan –196 oC) adalah terjadinya suatu proses yang disebut kejutan dingin (cold shock) yang dapat merusak membran plasma sel dan berakibat kematian spermatozoa. Untuk meminimalkan kerusakan sel spermatozoa akibat pengaruh buruk suhu rendah tersebut di atas, maka upaya yang dapat dilakukan adalah dengan menambahkan berbagai zat ke dalam pengencer semen. Zat tersebut dikenal dengan nama krioprotektan seperti gliserol (krioprotektan intraseluler) yang umum digunakan dalam kriopreservasi (pembekuan) se-men dan beberapa jenis gula (krioprotektan ekstraseluler) yang juga digunakan dalam proses kriopreservasi dan preservasi semen pada suhu 5 oC dan sekaligus berfungsi sebagai substrat sumber energi.
Upaya memperbaiki kualitas semen hasil olahan dengan cara menambahkan beberapa jenis gula di dalam pengencer telah dilaporkan oleh beberapa peneliti. Penambahan 210 mM glukosa di dalam pengencer Tris pada semen beku domba menghasilkan persentase spermatozoa motil setelah thawing sebesar 46,2% (Molinia et al., 1993) dan 184,96 mM glukosa di dalam pengencer Tr is pada semen beku babi men gh asilkan persentase spermatozoa motil setelah thawing sebesar 58% (de los Reyes et al., 2000). Kualitas semen beku kambing peranakan Etawah meningkat dengan menambahkan 9% w/v rafinosa (Suwarso, 1999), sedangkan pada semen beku domba Pampinta (Friesian x Corriedale) diperoleh persentase spermatozoa motil sebesar 64% dan 52,1% masin g-masin g un tuk semen yan g diencerkan dengan penambahan trehalosa dan EDTA (Aisen et al., 2000; 2002). Hal yang sama dilaporkan bahwa penambahan gula berupa sukrosa atau trehalosa di dalam pengencer nyata meningkatkan persentase spermatozoa motil semen beku sapi (Woelders et al., 1997), laktosa pada semen beku kambing (Singh et al., 1995), rafinosa atau trehalosa pada semen beku mencit (Storey et
al., 1998), dan trehalosa pada semen beku anjing
(Yildiz et al., 2000). Dilaporkan bahwa gula yang
ditambahkan di dalam pengencer Tris tersebut mampu meningkatkan persentase spermatozoa motil setelah thawing karena berfungsi sebagai krioprotektan ekstraseluler. Dengan demikian mampu mengurangi kerusakan membran plasma sel selama proses pengolahan semen, terutama saat proses pendinginan, pembekuan, dan thawing. Hal ini karena gula-gula tersebut dapat meningkatkan fluiditas membran plasma sel spermatozoa sebelum pembekuan.
Khusus pada domba Garut dilaporkan bahwa penambahan gula berupa laktosa (Rizal et
al., 2003a), maltosa (Herdis, 2005), trehalosa
(Herdis et al., 2005), serta dextrosa, trehalosa, rafinosa, dan sukrosa (Rizal et al., 2006) di dalam pengencer Tris mampu meningkatkan kualitas spermatozoa yang disimpan pada suhu –196 oC. Pada penelitian ini dicoba menambahkan berbagai konsentrasi laktosa di dalam pengencer Tris untuk meningkatkan kualitas semen cair domba Garut yang belum pernah dilaporkan. Hal ini dilakukan untuk mengetahui berapa lama daya hidup sper-matozoa yang disimpan pada suhu 5 oC dan masih memenuhi syarat kualitas digunakan dalam pro-gram IB.
MATERI DAN METODE Ternak Percobaan
Ternak percobaan yang digunakan adalah tiga ekor pejantan domba Garut berumur sekitar tiga tahun dan berat badan rata-rata 83 kg dengan kondisi tubuh dan kesehatan baik, sebagai sumber semen yang diuji kualitasnya. Setiap domba dikandangkan secara individu dan diberikan pakan berupa rumput dan leguminosa segar sebanyak sekitar 9 kg dan ampas tahu sekitar 0,2 kg per ekor per hari. Untuk menjaga kesehatan, pejantan dimandikan setiap minggu.
Metode Percobaan
Semen ditampung menggunakan vagina buatan satu kali dalam satu minggu. Segera setelah ditampung, semen dinilai secara makroskopik dan mikroskopik. Penilaian makroskopik meliputi: volume, warna, konsistensi (kekentalan), dan
derajat keasaman (pH). Penilaian mikroskopik meliputi: gerakan massa, persentase spermatozoa motil, persentase spermatozoa hidup, konsentrasi spermatozoa, persentase spermatozoa abnormal, dan persentase membran plasma utuh (MPU). Semen segar yang memenuhi syarat (persentase spermatozoa motil 70%, konsentrasi spermato-zoa 2000 juta sel per ml, gerakan massa ++ atau +++, dan persentase spermatozoa abnormal <15%) diencerkan sesuai dengan perlakuan.
Semen diencerkan dengan pengencer Tris yang terdiri atas: 3,32 g Tris(hidroksimetil) aminometan, 1,86 g asam sitrat, 1,37 g fruktosa yang dilarutkan dengan akuabidestilata hingga mencapai volume 100 ml, kemudian ditambahkan antibiotik berupa penisilin dan streptomisin masing-masing 1.000 g/ml (Rizal et al., 2002). Jumlah pengencer yang digunakan ditentukan berdasarkan persamaan yang dikemukakan oleh Toelihere (1993) yaitu : Jumlah pengencer (ml) = [(volume semen x motilitas x konsentrasi)/100 x 106) x 0,2] – volume semen.
Semen segar yang memenuh i syarat ditambahkan ke dalam empat buah tabung reaksi yang telah diisi dengan pengencer sebagai perlakuan, yakni: 80% pengencer Tris + 20% kuning telur ayam ras (kontrol), 80% pengencer Tris + 20% kuning telur ayam ras + 0,05% laktosa (L0,05), 80% pengencer Tris + 20% kuning telur ayam ras + 0,1% laktosa (L0,10), dan 80% pengencer Tris + 20% kuning telur ayam ras + 0,2% laktosa (L0,20).
Tabung reaksi yang berisi semen yang telah diencerkan dimasukkan ke dalam gelas piala berisi air dan disimpan di dalam lemari es pada suhu 5 oC. Sampel semen masing-masing perlakuan dievaluasi kualitasnya meliputi persentase sperma-tozoa motil, spermasperma-tozoa hidup, dan membran plasma utuh (MPU) setiap hari selama lima hari.
Persentase spermatozoa motil: persentase spermatozoa yang bergerak progresif (bergerak ke depan). Ditentukan secara subjektif pada delapan lapang pandang yang berbeda dengan mikroskop cahaya pembesaran 400x. Angka yang diberikan berkisar antara 0% dan 100% dengan skala 5% (Toelihere, 1993).
Per sentase sper matozoa h idup: persentase spermatozoa yang hidup. Ditentukan dengan teknik pewarnaan eosin B (Toelihere, 1993). Spermatozoa yang hidup ditandai oleh
kepala berwarna putih, sedangkan yang mati ditandai oleh kepala berwarna merah. Sebanyak minimum 200 spermatozoa diamati dengan mikroskop cahaya pembesaran 400x.
Persentase MPU: persentase spermatozoa yang memiliki membran plasma utuh. Ditentukan dengan metode osmotic resistance test (ORT) atau
hypoosmotic swelling (HOS) test (Revell dan
Mrode, 1994). Spermatozoa yang memiliki membran plasma utuh ditandai oleh ekor yang melingkar atau menggelembung, sedangkan yang rusak ditandai oleh ekor yang lurus apabila semen dipaparkan di dalam larutan hipoosmotik dan diinkubasi pada suhu 37 oC selama 60 menit. Sebanyak minimum 200 spermatozoa diamati dengan mikroskop cahaya pembesaran 400x. Analisis Data
Data dianalisis dengan analisis ragam dalam bentuk rancangan acak lengkap (RAL) dengan empat perlakuan dan jumlah penampungan semen sebanyak lima kali sebagai ulangan. Perbedaan antarperlakuan diuji dengan uji beda nyata terkecil (Steel dan Torrie, 1993).
HASIL DAN PEMBAHASAN Karakteristik Semen Segar
Evaluasi terhadap kuantitas dan kualitas se-men segar dimaksudkan untuk se-menentukan apakah semen tersebut layak atau tidak diproses lebih lanjut dan untuk mengetahui kadar pengenceran yang dibutuhkan. Kuantitas dan kualitas semen yang diperoleh menunjukkan karakteristik semen segar domba Garut dan memenuhi syarat untuk diolah menjadi semen cair atau semen beku (Tabel 1).
Volume semen. Hasil penelitian diperoleh volume semen rata-rata 1,1 ml. Volume semen segar domba Garut rata-rata 0,76 ml (Inounu, 2001), 0,99 ml (Rizal et al., 2003b), dan 0,82 ml (Herdis et al., 2005). Pada jenis domba yang lain dilaporkan volume semen segar rata-rata 1,66 ml pada domba St Croix (Feradis, 1999), 1,05 ml pada domba Suffolk, 1,09 ml pada domba Dorset Horn, dan 1,14 ml pada domba Texel (Boland et al., 1985), 0,9 – 1,2 ml pada domba (Langford et al., 1989), dan 1,1 ml pada domba Konya Merino (Kaya et al., 2002).
Derajat keasaman (pH) semen. Derajat keasaman semen yang diperoleh rata-rata 7 yang
berarti normal dan netral. Derajat keasaman se-men domba Garut rata-rata 7,07 (Rizal et al., 2003b) dan 6,89 (Herdis et al., 2005). Pada domba yang lain dilaporkan bahwa pH semen segar rata-rata 6,8 (6,2 – 7) pada domba lokal Bogor (Toelihere, 1993), 6,8 pada domba St Croix (Feradis, 1999), dan 5,9 – 7,3 (Hafez dan Hafez, 2000).
Warna, konsistensi, gerakan massa, dan konsentrasi spermatozoa. Keempat peubah ini saling berkaitan, karena warna semen ditentukan oleh kepadatan (konsentrasi) spermatozoa dan juga akan termanifestasikan pada konsistensi semen dan gerakan massa spermatozoa. Hasil yang diperoleh warna rata krem, konsistensi rata-rata kental, gerakan massa rata-rata-rata-rata +++, dan konsentrasi spermatozoa rata-rata 3.652 juta/ml. Beberapa hasil penelitian dilaporkan bahwa warna semen domba Garut rata krem, konsistensi rata-rata kental, gerakan massa rata-rata-rata-rata +++, dan konsentrasi spermatozoa sebanyak 950 – 4.368 juta/ml (Inounu et al., 2001; Rizal et al., 2003b; Herdis et al., 2005). Hasil penelitian Feradis (1999) pada domba St Croix didapatkan warna semen rata-rata krem, konsistensi kental, dan konsentrasi sper-matozoa 3.785 juta/ml. Sedangkan menurut Langford et al. (1989) konsentrasi spermatozoa domba antara 4.600 dan 5.100 juta/ml, dan 3.800 juta/ml pada domba Konya Merino (Kaya et al., 2002).
Persentase spermatozoa motil dan sper-matozoa hidup. Hasil penelitian didapatkan persentase spermatozoa motil dan spermatozoa hidup masing-masing rata-rata 75% dan 87,5%. Persentase spermatozoa motil dan spermatozoa
hidup domba Garut masing-masing rata-rata 58,08% (10 – 80%) dan 64,32% (19 – 95%) (Inounu et al., 2001), 76,67% dan 87,33% (Rizal et al., 2003b), serta 74,17% dan 86,6% (Herdis et al., 2005). Sedangkan semen domba St Croix memiliki persentase sper-matozoa motil dan spersper-matozoa hidup masing-masing rata-rata 81,67% dan 89% (Feradis, 1999), 89,8% dan 94,2% pada domba Konya Merino (Kaya et al., 2002). Persentase spermatozoa motil semen domba rata-rata 75% (Toelihere, 1993) dan 60 – 80% (Hafez dan Hafez, 2000).
Persentase spermatozoa abnormal. Persentase spermatozoa abnormal yang diperoleh rata-rata 6,2%. Ini menunjukkan semen tersebut layak digunakan dalam program IB, karena menurut Toelihere (1993) semen domba yang baik memiliki spermatozoa abnormal tidak lebih dari 14%. Persentase spermatozoa abnormal domba Garut rata-rata 5,47% (Rizal et al., 2003b) dan 2,67% (Herdis et al., 2005). Persentase spermatozoa ab-normal domba rata-rata 10% (Toelihere, 1993), 5 – 20% (Hafez dan Hafez, 2000), 8,33% pada domba St Croix (Feradis, 1999), dan 4,8% pada domba Konya Merino (Kaya et al., 2002).
Persentase MPU spermatozoa. Hasil penelitian didapatkan persentase MPU rata-rata 87,83%. Persentase MPU spermatozoa domba Garut rata-rata 87,73% (Rizal et al., 2003b) dan 85% (Herdis et al., 2005). Feradis (1999) melaporkan persentase MPU spermatozoa domba St Croix rata-rata 86,33%. Menurut Revell dan Mrode (1994) persentase MPU semen segar yang kurang dari 60% dikategorikan sebagai semen yang infertil.
Berdasarkan nilai karakteristik semen
Tabel 1. Karakteristik Semen Segar Domba Garut
Peubah Ukuran
Volume (ml) 1,10 0,38
Warna Krem
Derajat keasaman (pH) 7,00 0,11
Konsistensi (kekentalan) Kental
Gerakan massa +++
Konsentrasi spermatozoa (juta/ml) 3.652 503,80
Spermatozoa motil (%) 75,00 0,00
Spermatozoa hidup (%) 87,50 3,45
Spermatozoa abnormal (%) 6,20 1,17
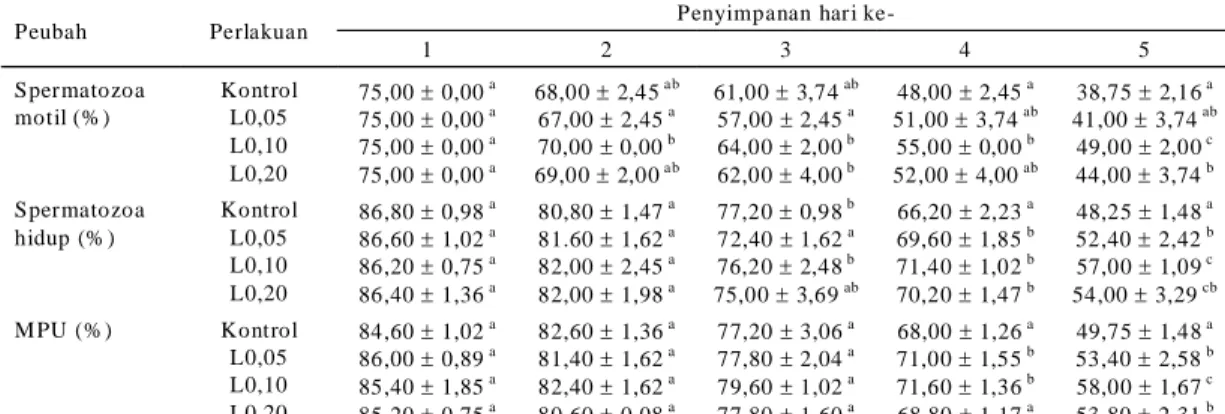
segar yang diperoleh, dapat dikatakan bahwa se-men segar domba percobaan memiliki kualitas yang baik sehingga layak diproses lebih lanjut, baik dalam bentuk semen cair maupun semen beku. Kualitas Spermatozoa Setelah Pengenceran Hasil penelitian menunjukkan bahwa penambahan laktosa di dalam pengencer dapat meningkatkan persentase spermatozoa motil, sper-matozoa hidup, dan MPU selama lima hari penyimpanan di dalam lemari es pada suhu 5 oC (Tabel 2).
Laktosa mampu memperbaiki kualitas spermatozoa domba Garut yang disimpan pada suhu 5 oC dapat dipahami karena laktosa berfungsi ganda dalam menunjang kehidupan spermatozoa. Sebagai karbohidrat dari golongan disakarida, laktosa terdiri atas satu unit glukosa dan satu unit galaktosa yang keduanya dapat dimanfaatkan oleh spermatozoa dalam proses glikolisis dan siklus Krebs untuk menghasilkan energi berupa adenosin trifosfat (ATP). Adenosin trifosfat dimanfaatkan oleh spermatozoa sebagai energi dalam proses pergerakan sehingga dapat tetap motil dan mempertahankan daya hidupnya. Laktosa juga diman faatkan oleh spermatozoa sebagai krioprotektan ekstraseluler yang berfungsi melindungi membran plasma sel dari kerusakan akibat pengaruh kejutan dingin (cold shock) selama penyimpanan pada suhu rendah (5 oC). Dengan tetap utuhnya membran plasma sel spermatozoa selama penyimpanan akan memberikan efek yang baik pula terhadap motilitas dan daya hidup
sper-matozoa. Motilitas (daya gerak) spermatozoa sangat bergantung pada suplai energi berupa ATP hasil metabolisme. Metabolisme sendiri akan berlangsung dengan baik apabila membran plasma sel berada dalam keadaan utuh, sehingga mampu dengan baik mengatur lalu lintas masuk dan keluar sel seluruh substrat dan elektrolit yang dibutuhkan dalam proses metabolisme.
Laktosa dapat melindungi membran plasma sel spermatozoa karena pada bagian luar membran plasma terdapat karbohidrat yang
berikatan dengan lipid (glikolipid) atau protein (glikoprotein) yang disebut selubung sel atau glikokaliks (Subowo, 1995). Diasumsikan bahwa laktosa yang ditambahkan di dalam pengencer akan berasosiasi dengan karbohidrat tersebut sehingga terlindungi dari kerusakan secara mekanik selama proses pengolahan semen berlangsung, terutama saat penyimpanan pada suhu rendah. Kalaupun karbohidrat yang ada pada membran plasma sel ter sebut rusak selama pr oses pr eser vasi, diharapkan laktosa yang ditambahkan dapat menjadi pengganti sehingga struktur selubung sel tetap utuh.
Menurut Viswanath dan Shannon (2000) krioprotektan dari golongan karbohidrat seperti laktosa, memiliki kemampuan menggantikan molekul air secara normal dalam kelompok polar
hydrated. Sifat-sifat laktosa ini akan membantu
menstabilkan membran plasma sel spermatozoa selama masa transisi melewati zona suhu yang kritis, serta mengubah sifat mekanik pengencer
Tabel 2. Persentase Spermatozoa Motil, Spermatozoa Hidup, dan M PU Semen Cair-dingin Domba Garut selama Lima Hari Penyimpanan pada Suhu Rendah (5 oC)
Penyimpanan hari ke-
Peubah Perlakuan 1 2 3 4 5 Spermatozoa Kontrol 75,00 0,00 a 68,00 2,45 ab 61,00 3,74 ab 48,00 2,45 a 38,75 2,16 a motil (% ) L0,05 75,00 0,00 a 67,00 2,45 a 57,00 2,45 a 51,00 3,74 ab 41,00 3,74 ab L0,10 75,00 0,00 a 70,00 0,00 b 64,00 2,00 b 55,00 0,00 b 49,00 2,00 c L0,20 75,00 0,00 a 69,00 2,00 ab 62,00 4,00 b 52,00 4,00 ab 44,00 3,74 b Spermatozoa Kontrol 86,80 0,98 a 80,80 1,47 a 77,20 0,98 b 66,20 2,23 a 48,25 1,48 a hidup (% ) L0,05 86,60 1,02 a 81.60 1,62 a 72,40 1,62 a 69,60 1,85 b 52,40 2,42 b L0,10 86,20 0,75 a 82,00 2,45 a 76,20 2,48 b 71,40 1,02 b 57,00 1,09 c L0,20 86,40 1,36 a 82,00 1,98 a 75,00 3,69 ab 70,20 1,47 b 54,00 3,29 cb M PU (% ) Kontrol 84,60 1,02 a 82,60 1,36 a 77,20 3,06 a 68,00 1,26 a 49,75 1,48 a L0,05 86,00 0,89 a 81,40 1,62 a 77,80 2,04 a 71,00 1,55 b 53,40 2,58 b L0,10 85,40 1,85 a 82,40 1,62 a 79,60 1,02 a 71,60 1,36 b 58,00 1,67 c L0,20 85,20 0,75 a 80,60 0,08 a 77,80 1,60 a 68,80 1,17 a 53,80 2,31 b a,b,c
Superskrip dalam ko lo m yang sama setiap peubah, menunjukkan berbeda nyata (P<0,05)
melalui peningkatan viskositas. Aisen et al. (2002) menyatakan golongan karbohidrat disakarida seperti laktosa berperan menggantikan posisi air pada permukaan membran plasma sel yang langsung ber hubungan dengan pengencer. Selanjutnya dinyatakan bahwa laktosa dapat berinteraksi langsun g dengan gugus pusat fosfolipid polar selama pembekuan , dan menurunkan interaksi ikatan van der Waals di antara rantai karbon. Menurut Lehninger (1994) laktosa merupakan salah satu senyawa pereduksi dan memiliki struktur yang stabil. Sebagai senyawa pereduksi, laktosa memiliki fungsi yang mirip dengan senyawa antioksidan karena mampu mer edam sen yawa-sen yawa pen goksidasi, sehingga juga berperan dalam meminimalkan terjadinya reaksi oksidasi. Reaksi oksidasi yang berlebihan sangat membahayakan kehidupan sper-matozoa karena menghasilkan produk yang dapat merusak integritas sel. Sebagai senyawa yang stabil, laktosa tidak mudah mengalami perubahan struktur menjadi bentuk ion yang dapat merubah tekanan osmotik larutan pengencer.
Pengaruh positif penambahan laktosa terhadap kualitas spermatozoa semakin jelas terlihat dengan bertambahnya waktu penyimpanan semen, yakni pada hari keempat dan kelima (Tabel 2). Hal ini semakin nyata menunjukkan peranan laktosa sebagai substrat sumber energi dan sebagai krioprotektan ekstraseluler. Seiring dengan bertambahnya waktu penyimpanan semen, berarti spermatozoa membutuhkan persediaan substrat sumber energi dalam jumlah cukup untuk dapat tetap mempertahankan daya hidupnya. Sperma-tozoa juga membutuhkan zat yang berfungsi melindungi membran plasmanya dari kerusakan akibat terlalu lama terpapar pada suhu rendah. Kebutuhan spermatozoa tersebut dapat dipenuhi oleh laktosa yang ditambahkan di dalam pengencer. Penambahan laktosa sebanyak 0,2% menghasilkan semen cair dengan kualitas yang lebih rendah daripada 0,1%, tetapi relatif lebih tinggi daripada 0,05% (Tabel 2). Hal ini menunjukkan bahwa penambahan 0,1% laktosa di dalam pengencer Tris merupakan dosis optimum dalam mempertahankan kualitas semen cair domba Garut yang disimpan pada suhu 5 oC. Fenomena ini dapat dijelaskan sebagai berikut: penambahan laktosa dengan konsentrasi tinggi akan mengakibatkan meningkatnya tekanan osmotik larutan pengencer,
yang mungkin tidak dapat diadaptasi dengan baik oleh spermatozoa. Hal ini akan mengganggu berlangsungnya proses-proses biokemik secara normal di dalam sel, yang pada akhirnya akan menurunkan daya hidup spermatozoa itu sendiri selama penyimpanan. Fenomena ini mendukung hasil penelitian Rizal et al. (2003a) yang melaporkan bahwa penambahan 120 mM laktosa di dalam pengencer Tris menghasilkan semen beku dengan kualitas yang nyata lebih rendah dibandingkan dengan penambahan 60 mM.
Herdis (2005) melapor kan bah wa penambahan 0,6% dan 1,2% maltosa di dalam pengencer Tris mampu meningkatkan kualitas se-men domba Garut yang disimpan pada suhu 5 oC dan –196 oC. Semen yang disimpan pada suhu 5 oC kualitasnya masih dapat dipertahankan di atas batas minimum yang dipersyaratkan untuk IB hingga hari kelima penyimpanan. Selanjutnya dilaporkan bahwa ini disebabkan oleh maltosa berfungsi sebagai substrat sumber energi dan sekaligus sebagai pelindung membran plasma sel spermatozoa dari kerusakan selama penyimpanan pada suhu 5 oC dan –196 oC. Hal sama dilaporkan Rizal et al. (2003a) bahwa penambahan 60 mM laktosa di dalam pen gen cer Tr is n yata meningkatkan persentase spermatozoa motil, sper-matozoa hidup, dan MPU spersper-matozoa domba Gar ut setelah pr oses kr iopr eser vasi. Hasil penelitian menunjukkan bahwa penambahan laktosa sebanyak 0,05%, 0,1%, dan 0,2% di dalam pen gen cer Tr is dapat mempertahankan persentase spermatozoa motil di atas 40% pada hari kelima penyimpanan, sehingga masih memenuhi syarat digunakan dalam program IB. Sedangkan pada perlakuan kontrol (tanpa penambahan laktosa) persentase spermatozoa motil pada hari kelima penyimpanan hanya sebesar rata-rata 38,75%, sehingga tidak lagi memenuhi syarat digunakan dalam program IB. Menurut Toelihere (1993) semen yang memenuhi syarat digunakan dalam program IB harus memiliki persentase spermatozoa motil paling sedikit 40%.
KESIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa kuantitas dan kualitas semen segar yang dihasilkan oleh domba-domba percobaan adalah baik, dan memenuhi syarat
untuk diproses menjadi semen cair atau semen beku. Penambahan laktosa di dalam pengencer Tris mampu mempertahankan kualitas semen cair domba Garut hingga hari kelima penyimpanan pada suhu 5 oC. Penambahan 0,1% laktosa di dalam pengencer Tris merupakan dosis optimum dalam mempertahankan kualitas semen cair domba Garut yang disimpan pada suhu 5 oC.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih pada Badan Pengkajian dan Penerapan Teknologi, Jakarta dan peternakan domba laga “Lesan Putra” PT. Sarbi Moerhani Lestari, Ciomas, Bogor atas dukungan dana, hewan percobaan, dan fasilitas pendukung lainnya sehingga penelitian ini dapat berlangsung dengan baik.
DAFTAR PUSTAKA
Aisen, E.G., H.L. Alvarez, A. Venturino, and J.J. Garde. 2000. Effect of trehalose and EDTA on cryoprotective action of ram semen diluents. Theriogenology 53:1053-1061. Aisen, E.G., V.H. Medina, and A. Venturino. 2002.
Cryopreservation and post-thawed fertil-ity of ram frozen semen in different treha-lose concentrations. Theriogenology 57:1801-1808.
Boland, M.P., A.A. Al-Kamali, T.F. Crosby, N.B. Haynes, C.M. Howles, D.L. Kelleher, and I. Gordon. 1985. The influence of breed, sea-son and photoperiod on semen character-istics, testicular size, libido and plasma hor-mone concentrations in rams. Anim. Reprod. Sci. 9:241-252.
de los Reyes, M., L. Saenz, L. Lapiere, J. Crosby, and C. Barros. 2000. In vitro evaluation of boar spermatozoa frozen with permeable and non permeable cryoprotectant. Pro-ceeding 14th International Congress on Ani-mal Reproduction. Stockholm 2-6 July 2000. 17:33, P.161. Abstract Vol.2.
Feradis. 1999. Penggunaan Antioksidan dalam Pen gencer Semen Beku dan Metode
Sin kr on isasi Estr us pada Pr ogram Inseminasi Buatan Domba St Croix. Disertasi. Program Pascasarjana, Institut Pertanian Bogor, Bogor.
Hafez, E.S.E. and B. Hafez. 2000. Reproduction in Farm Animals, 7th Edition. Lippincott Williams & Wilkins, Baltimore.
Herdis. 2005. Optimalisasi inseminasi buatan melalui teknologi laserpunktur pada domba Garut (Ovis aries). Disertasi. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor.
Herdis, M. Rizal, A. Boediono, R.I. Arifiantini, T. Saili, A.S. Aku, dan Yulnawati. 2005. Optimasi kualitas semen beku domba Garut melalui penambahan trehalosa ke dalam pengencer kuning telur. J. Pengembangan Peternakan Tropis 30:229-236.
Inounu, I., N. Hidajati, S.N. Jarmani, D. Priyanto, Hastono, B. Setiadi, dan Subandriyo. 2001. Pengaruh interaksi genetik dan lingkungan terhadap produksi domba persilangan dan domba lokal pada beberapa lokasi pengamatan: evaluasi kualitas semen domba hasil persilangan. Prosiding Semi-nar Hasil Penelitian Bagian “Proyek Rekayasa Teknologi Peternakan/ARMP II”. Puslitbang Peternakan. Hlm 64-73. Kaya, A., M. Aksoy, and T. Tekeli. 2002.
Influ-ence of ejaculation frequency on sperm characteristics, ionic composition and en-zymatic activity of seminal plasma in rams. Small Rum. Res. 44:153-158.
Langford, G.A., J.N.B. Shrestha, and G.J. Marcus. 1989. Repeatability of scrotal size and se-men quality measurese-ments in rams in a short-day light regime. Anim. Reprod. Sci. 19-27.
Lehninger, A.L. 1994. Dasar-dasar Biokimia Jilid 2. Alih Bahasa M. Thenawijaya. Erlangga, Jakarta.
W.M.C. Maxwell. 1993. Effect of monosac-charides and disacmonosac-charides in Tris-based diluents on motility, acrosome integrity and fertility of pellet frozen ram spermatozoa. Anim. Reprod. Sci. 36:113-122.
Revell, S.G. and R.A. Mrode. 1994. An osmotic resistance test for bovine semen. Anim. Reprod. Sci. 36:77-86.
Rizal, M., M.R. Toelihere, T.L. Yusuf, B. Purwantara, dan P. Situmorang. 2002. Kualitas semen beku domba Gar ut dalam ber bagai konsentrasi gliserol. J. Ilmu Ternak dan Veteriner 7:193-198.
Rizal, M., M.R. Toelihere, T.L. Yusuf, B. Purwantara, dan P. Situmorang. 2003a. Kriopreservasi semen domba Garut dalam pengencer Tris dengan konsentrasi laktosa yang berbeda. Media Kedokteran Hewan 19:79-83. Rizal, M., M.R. Toelihere, T.L. Yusuf, B. Purwantara,
dan P. Situmorang. 2003b. Karakteristik penampilan reproduksi pejantan domba Garut. J. Ilmu Ternak dan Veteriner 8:134-140.
Rizal, M., Herdis, A. Boediono, A.S. Aku, dan Yulnawati. 2006. Peranan beberapa gula dalam meningkatkan kualitas semen beku domba Garut. J. Ilmu Ternak dan Veteriner.
In Press.
Singh, M.P., A.K. Sinha, and B.K. Singh. 1995. Effect of cryoprotectants on certain semi-nal attributes and on the fertility of buck spermatozoa. Theriogenology 43:1047-1053.
Steel, R.G.D. and J.H. Torrie. 1993. Prinsip dan Prosedur Statistika. Gramedia Pustaka Utama, Jakarta.
Storey, B.T., E.E. Noiles, and K.A. Thompson. 1998. Comparison of glycerol, other polyols, tre-halose, and raffinose to provide a defined cryoprotectant medium for mouse sperm cryopreservation. Cryobiology 37:46-58.
Subowo. 1995. Biologi Sel. Angkasa, Bandung. Suwarso. 1999. Peranan rafinosa dalam pengencer
Tris-sitrat-kuning telur terhadap kualitas semen beku kambing peranakan Etawah. Tesis. Program Pascasarjana, Institut Pertanian Bogor, Bogor.
Toelihere, M.R. 1993. Inseminasi Buatan pada Ternak. Angkasa, Bandung.
Viswanath, R. and P. Shannon. 2000. Storage of bovine semen in liquid frozen state. Anim. Reprod. Sci. 62:23-53.