BAB II
TINJAUAN PUSTAKA
2.1 PRINSIP DASAR KERAMIK
Keramik mempunyai sifat rapuh, tahan korosi, keras dan kaku. Sifat bahan keramik ini bergantung pada ikatan kimianya. Ikatan kovalen memberi sifat dapat mengarahkan kepada kualitas kristal dan strukturnya lebih rumit dari ikatan logam atau ion, dimana struktur kristalnya digambarkan seprti bola – bola yang tersusun rapat, ikatan kovalennya sangat kuat sehingga kristalnya bersifat kuat dan mempunyai titik leleh yang tinggi serta sifat isolator yang baik (David:2007)
Keramik secara umum mempunyai kualitas tekan lebih baik dibandingkan kualitas tariknya. Pada prinsipnya keramik terbagi atas keramik tradisional, keramik halus dan biokeramik. Keramik tradisional yaitu keramik yang terbuat dari bahan alam seperti kaolin, feldsfar, clay, kuarsa. Yang termasuk keramik ini adalah barang pecah belah (dinner ware), keperluan rumah tangga (tile bricks) dan untuk industri (refractory). Keramik halus (fine ceramic) atau keramik modern biasanya disebut keramik teknik, avanced ceramic, engineering ceramic, technical ceramic adalah keramik yang dibuat dengan menggunakan oksida-oksida logam atau logam, seperti: oksida logam (SiO2, Al2O3, ZrO2
Bio–Keramik adalah produk yang terbuat dari berbagai jenis keramik yang dicampur dengan oksida mineral seperti silika, aluminium oksida, dan sebagainya. Campuran material ini akan memancarkan FIR (far infrared rays). Bio-Keramik dibuat dari 26 jenis keramik dengan beberapa mineral oksida dan dipanaskan bersama pada suhu 1600
, MgO, dll). Pengunaannya sebagai elemen pemanas semikonduktor, komponen turbin dan pada bidang medis (Refractron:2001)
OC, kemudian dibiarkan dingin perlahan-lahan selama penyatuan. Setelah dingin, material ini akan memancarkan FIR. Far Infrared Rays (Sinar Inframerah Gelombang Panjang) adalah salah satu bagian dari spektrum sinar matahari yang tidak kelihatan oleh mata telanjang. Sinar ini disebut juga sinar Bio-Genetik (panjang gelombang 6-14 μm). Sinar Bio–Genetik telah terbukti oleh para ilmuwan membantu pertumbuhan dan perkembangan sel sehat terutama pada manusia, hewan dan tumbuhan. FIR memiliki panjang gelombang yang merupakan frekuensi resonansi molekul air dan molekul– molekul pembentuk tubuh makhluk hidup. Oleh karena itu paparan FIR menyebabkan pengionisasian molekul air. FIR mengaktifkan dan mengionisasi molekul air di dalam sel dan darah tubuh kita (70% berat badan manusia adalah air) yang menyebabkan peningkatan kinerja kesehatan, metabolisme dan sirkulasi darah (Meyli:2011)
lingkungan geologi dimana bahan diperoleh. Secara umum strukturnya sangat rumit dengan sedikit elektron – elektron bebas. Kurangnya beberapa elektron bebas keramik membuat sebagian besar bahan keramik secara kelistrikan bukan merupakan konduktor dan juga menjadi konduktor panas yang jelek (David;2007).
2.2 SILIKON DIOKSIDA(SiO2)
Silikon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Si dan nomor atom 14. Unsur kimia ini ditemukan oleh Jons Jakob Berzelius pada tahun 1824. Silikon membentuk 25,7% kerak bumi dalam jumlah berat, dan merupakan unsur terbanyak kedua setelah oksigen. Silikon dioksida (silika, SiO2
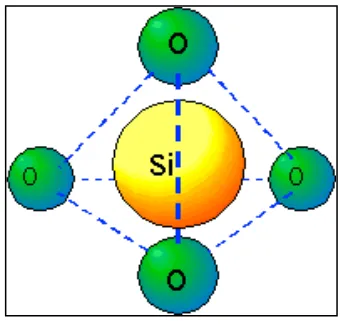
Silikon dioksida terbentuk melalui ikatan kovalen yang kuat, serta memiliki struktur lokal yang jelas: empat atom oksigen terikat pada posisi sudut tetrahedral di sekitar atom pusat yaitu atom silikon. Berikut ini struktur lokal dari silikon dioksida yang ditunjukkan pada Gambar 2.1
) merupakan senyawa yang umum ditemui dalam kehidupan sehari-hari dan banyak digunakan sebagai bahan baku industri elektronik. Silikon dioksida kristalin dapat ditemukan dalam berbagai bentuk yaitu sebagai quarsa, kristobalit dan tridimit. Pasir di pantai juga banyak mengandung silika.
Gambar 2.1 Struktur Lokal Silikon Dioksida
Atom oksigen bersifat elektronegatif dan kerapatan elektron pada atom silikon sebagian ditransfer pada atom oksigen, tetapi tidaklah tepat jika silika dikatakan sebagai garam yang terdiri dari ion Si4+ dan ion O
2-Silikon dioksida memiliki ikatan yang disebut “jembatan” oksigen yang terdapat diantara atom silikon, hal inilah yang memberikan sifat unik pada silikon dioksida. Sudut ikatan pada Si-O-Si sekitar 145
. Untuk memahami hal ini maka dapat dilihat melalui arah ikatan (momen dipol) pada struktur silika. Sudut ikatan di sekitar O-Si-O merupakan sudut tetrahedral yaitu sebesar 109⁰; jarak antara atom Si-O sebesar 1,61 Å (0,16 nm).
Gambar 2.2 Sudut Ikatan Si-O-Si
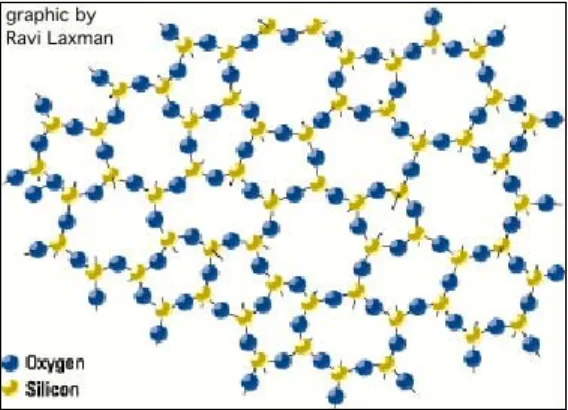
Cara yang cukup mudah untuk mengamati struktur SiO2 adalah dengan menggunakan model Zachariesen-Warren. Struktur SiO2 terbentuk melalui kelompok-kelompok SiO4 yang saling berikatan melalui atom oksigen pada sudut-sudut tetrahedralnya, ikatan ini dapat terbentuk dalam berbagai variasi sudut. Berikut struktur padatan silikon dioksida yang ditunjukkan pada gambar 2.3 di bawah ini
Gambar 2.3 Struktur Padatan Silikon Dioksida
2.2.1 SILICA GEL
Silica gel merupakan benda berpori yang terbuat dari SiO2
Silica gel memiliki beberapa jenis, yaitu:
yang mempunyai daya absorbsi sangat aktif. Silica gel tidak larut dalam air dan pelarut lainnya, non toksik, tidak berbau dan stabil secara kimiawi. Absorbsi pada silika gel terjadi karena adanya ikatan Van Der Waals dan kondensasi secara kapiler pada kelembaban tinggi. Beberapa silica gel dapat menyerap air sampai dengan 1,2 kali berat tubuhnya. Daya absorbsinya yang rendah memungkinkan silica gel kembali melalui proses pemanasan.
1. Silica gel white
Bentuk : butiran
Ukuran : 3-5 mm atau 2-4 mm
Warna : Transparan, seperti butiran kaca bening. Tidak ada indikator warna jika silica gel jenuh
2. Silica gel blue
Bentuk : butiran Ukuran : 3-5 mm
Warna : biru atau biru terang menggunakan indikator gel biru yaitu cobalt chloride, akan berubah dari biru menjadi merah setelah penuh.
Keunggulannya silica gel ini tidak menggunakan pewarna berbahaya, silica gel memiliki daya serap yang lebih tinggi sehingga pemakaiannya lebih irit. Sebelum digunakan sebagai bahan pembuat filter katalis pada penelitian ini, Silica gel harus di haluskan terlebih dahulu, supaya mendapatkan ukuran butir yang homogen dengan bahan pembuat filter katalis lainnya yaitu kalsium karbonat dan clay.
2.3 KALSIUM KARBONAT(CaCO3
2.3.1 CIRI-CIRI DAN SIFAT KALSIUM KARBONAT )
Kalsium karbonat bila dipanaskan pada suhu > 840 OC akan pecah dan menjadi serbuk remah yang lunak yang dinamakan kalsium oksida (CaO). Hal ini terjadi karena pada reaksi tersebut setiap molekul dari kalsium akan bergabung dengan 1 atom oksigen dan molekul lainnya akan berikatan dengan oksigen menghasilkan CO2
CaCO
yang akan terlepas ke udara sebagai gas karbon dioksida. dengan reaksi sebagai berikut:
3 --> CaO + CO Reaksi ini akan berlanjut pada reaksi filter (200 – 300
2
OC) apabila ditambahkan air, reaksinya akan berjalan dengan sangat kuat dan cepat apabila dalam bentuk serbuk, serbuk kalsium karbonat akan melepaskan kalor. Molekul dari CaCO3 akan segera mengikat molekul air (H2O) yang akan membentuk kalsium hidroksida, zat yang lunak seperti pasta. Sebagaimana ditunjukkan pada reaksi sebagai berikut:
CaCO3 + H2O --> Ca(OH)2 + CO2
2.3.2 PEMBUATAN KALSIUM KARBONAT
Pembuatan kalsium karbonat dapat dilakukan dengan cara mengeringkan Ca(OH)2 hingga molekul H2O dilepaskan ke udara sedangkan molekul CO2 diserap dari udara sekitar sehingga Ca(OH)2 dapat berubah kembali menjadi CaCO3
Reaksinya dapat ditunjukkan sebagai berikut: .
Ca(OH)2 + CO2 --> CaCO3 + H2
secara kimia, sama saja dengan bahan mentahnya, namun kalsium karbonat yang terbentuk kembali tampak berbeda dari CaCO
O
3 yang semula sebelum bereaksi, karena kalsium karbonat yang terbentuk kembali tidak terbentuk dalam tekanan yang tinggi di dalam bumi. Manfaat Kalsium Karbonat dalam industri adalah sebagai pembuat pasta gigi dan obat anti asam lambung (Ratnawati:2011)
2.4 CLAY
Clay dikenal sebagai tanah liat (Argiles), merupakan sejenis mineral halus berbentuk kepingan, gentian atau hablur yang terbentuk dari batuan sedimen (sedimensary rock) dengan ukuran butir <1/256 mm. Pada umumnya ada dua jenis clay yaitu ball clay dan fire clay.
2.5 EMISI GAS BUANG KENDARAAN
Emisi gas buang adalah sisa hasil pembakaran yang dihasilkan oleh pembakaran di dalam mesin kendaraan bermotor. Sebenarnya pengertian pembakaran kendaraan bermotor itu tidak hanya terbatas pada mobil, sepeda motor, angkutan umum tetapi termasuk aktivitas industri, kapal terbang, turbin, kereta api dan kapal laut. Intinya semua armada yang menggunakan bahan bakar sebagai sumber utamanya.
Gas sisa pembakaran mesin ini beracun dan akan merusak lapisan ozon dan menjadi penyebab utama adanya pemanasan global. Beberapa gas yang ditimbulkan oleh sisa pembakaran mesin adalah:
1. Karbon monoksida (CO) mempunyai sifat beracun, sifat lain gas ini adalah tidak berwarna, CO dapat menyebabkan pengurangan kadar oksigen dalam darah sehingga mengakibatkan pusing dan gangguan berpikir, penurunan reflek, gangguan jantung, bahkan juga kematian 2. Karbon dioksida (CO2) mempunyai daya rusak terhadap ozon (O3
3. H
), Gas inilah yang saat ini menjadi perhatian dunia karena mengakibatkan pemanasan global dan efek pemanasan global. Hal ini telah melahirkan banyak bencana di dunia. Salah satu praduga adalah pada tahun 2010 ada beberapa kejadian yang misterius tentang jatuhnya benda dilangit di Bone, Duren Sawit Jaktim, Bima NTB. Teorinya, setiap benda langit atau meteor yang tidak akan sampai ke bumi jika lapisan ozon masih sempurna, karena gesekan meteor dengan udara akan membuat meteor terbakar dahulu sebelum sampai ke bumi.
2
4. Pb (Timbal) dapat mengakibatkan penurunan tingkat kecerdasan dan perkembangan mental anak, mengakibatkan tekanan darah tinggi, terganggunya fungsi reproduksi laki-laki dan terganggunya fungsi ginjal.
O atau air
5. NOx (Oksida Nitrogen) dapat menimbulkan iritasi mata, batuk, gangguan jantung dan paru-paru, asma, dan infeksi saluran pernapasan.
6. HC (Hidrokarbon) tercipta sebagai akibat dari tidak sempurnanya proses pembakaran, kekurangan oksigen, busi yang kotor, bensin yang tercampur dengan air, bocornya paking adalah penyebab pembakaran yang tidak sempurna. HC (Hidrokarbon) menyebabkan iritasi mata, pusing, batuk, mengantuk, bercak kulit, perubahan kode genetic, memicu asma dan kanker paru-paru (Anneahira:2012)
sensor dimasukkan ke dalam knalpot kendaraan dan secara otomatis, alat bekerja serta hasil langsung tertera pada monitor alat yang di gunakan
2.6 DESAIN DAN STRUKTUR KATALIS
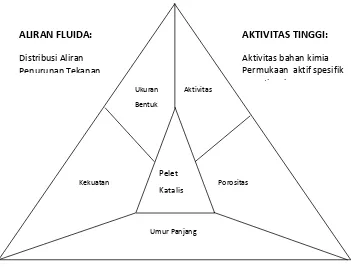
Karakteristik tekstur katalis dapat dijelaskan melalui parameter, seperti: luas permukaan, volume pori, densitas pellet, porositas, radius pori rata-rata tekstur dan distribusi ukuran pori.
Gambar 2.4 Karakteristik teknis dari katalis (Istadi:2011)
Aktivitas dan selektivitas katalis yang tinggi di desain dengan memilih komponen kimia yang benar menggunakan cara–cara pembuatan tertentu sehingga menghasilkan katalis dengan luas permukaan yang diinginkan serta memformulasikan pelet katalis agar situs aktif dapat mudah diakses pada umumnya.
2.7 KOMPONEN-KOMPONEN KATALIS
Pada umumnya katalis tersusun dari beberapa komponen antara lain: 2.7.1 KOMPONEN AKTIF
Pelet
Katalis
Ukuran Bentuk
Aktivitas
Porositas Kekuatan
Umur Panjang
ALIRAN FLUIDA:
Distribusi Aliran Penurunan Tekanan
STABILITAS
AKTIVITAS TINGGI:
Aktivitas bahan kimia Permukaan aktif spesifik yang tinggi
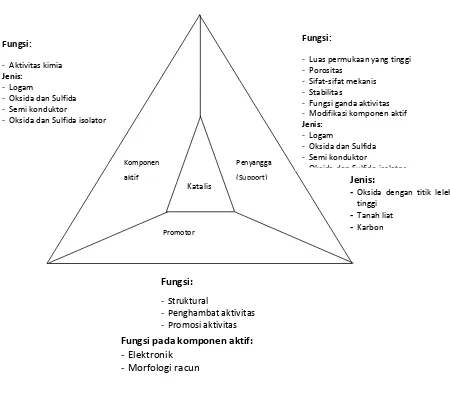
Komponen aktif merupakan komponen katalis yang bertanggung jawab terhadap reaksi kimia yang utama. Pemilihan komponen aktif adalah tahap pertama dalam mendesain katalis. Hubungan antara komponen aktif, promotor dan penyangga (Support) dapat dilihat pada gambar 2.5 di bawah ini
Gambar 2.5 Hubungan antara komponen aktif, pendukung dan promotor dalam sistem katalis (Istadi:2011)
2.7.2 PENYANGGA (SUPPORT)
Penyangga (Support) atau dinamakan juga sebagai pembawa (carrier) mempunyai banyak fungsi. Fungsi yang paling penting adalah menjaga agar luas permukaan komponen aktif tetap besar. Sebagai contoh katalis platinum (Pt) sebagai logam aktif untuk proses reformasi
Katalis
- Oksida dan Sulfida
- Semi konduktor
- Oksida dan Sulfida isolator
Fungsi:
-Struktural
-Penghambat aktivitas -Promosi aktivitas
Jenis:
- Oksida dengan titik leleh tinggi
- Tanah liat
- Karbon
Fungsi:
- Luas permukaan yang tinggi
- Porositas
- Sifat-sifat mekanis
- Stabilitas
- Fungsi ganda aktivitas
- Modifikasi komponen aktif
Jenis:
- Logam
- Oksida dan Sulfida
- Semi konduktor
Oksida dan Sulfida isolator
Fungsi pada komponen aktif:
-Elektronik
katalis dan pembersihan knalpot kendaraan secara analitik. Kristal platinum mempunyai titik leleh pada suhu 1774 OC. Jika platinum tersebut dibuat dalam bentuk platinum hitam, maka pemakaian dalam reaksi selama satu jam pada suhu 400 O
Besarnya konsentrasi komponen aktif atau biasa disebut loading juga mempunyai efek yang signifikan agar penyangga bisa memberikan tingkat dispersi komponen aktif yang besar, misalnya 70% NiAl
C menghasilkan ukuran kristal 50 nm, namun jika digunakan dalam waktu enam bulan maka ukuran kristal menjadi 2000 nm. Dalam hal ini ketidakstabilan terjadi. Selain itu, logam platinum juga termasuk logam yang sangat mahal.
2O3, walaupun besarnya loading maka alumina masih tetap sebagai penyangga dan nikel sebagai komponen aktif.
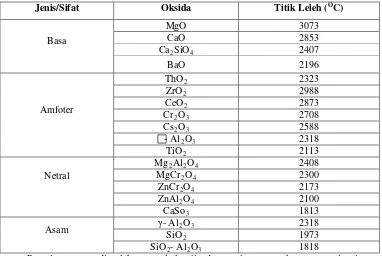
Tabel 2.1 Oksida logam dengan titik leleh tinggi sebagai penyangga katalis
Porositas sangat diperlukan untuk katalis dengan luas permukaan yang tinggi, tetapi bentuk pori dan distribusi ukuran pori adalah faktor penting jika proses difusi internal mengendalikan laju reaksi. Penyangga yang baik adalah penyangga yang dapat dimanipulasi sehingga menghasilkan sifat tekstur yang diinginkan. Dalam hal ini alumina dan silika adalah penyangga yang baik. Kedua jenis penyangga ini digunakan karena mudah untuk pengendalian ukuran dan bentuk pori. Faktor yang penting lainnya adalah kekuatan mekanik dan stabilitas termal.
2.7.3 PROMOTOR
Promotor merupakan senyawa ketiga yang ditambahkan ke dalam sistem katalis, biasanya dalam jumlah kecil saja. Tujuan pemberian promotor ini adalah untuk menghasilkan aktivitas,
selektivitas dan efek stabilitas yang diinginkan. Promotor dapat diandaikan sebagai bumbu dalam masakan.
Promotor di desain untuk membantu penyangga atau komponen aktif. Salah satu peran penting dari promotor adalah dalam pengendalian stabilitas katalis. Beberapa kasus lain, promotor ditambahkan ke dalam struktur katalis atau penyangga untuk menghambat mekanisme reaksi tertentu yang tidak diinginkan, seperti pembentukan karbon (coke). Coking ini berasal dari perengkahan di situs asam Bronsted yang diikuti polimerisasi dengan katalis asam untuk menghasilkan (CHx)n. Coking ini memenuhi pori dan memblokade lubang pori.
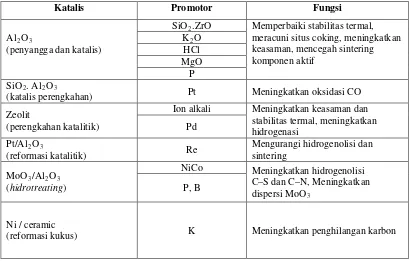
Tabel 2.2 Contoh promotor katalis dalam beberapa proses
Katalis Promotor Fungsi
Al2O
(penyangga dan katalis) 3
SiO2 Memperbaiki stabilitas termal, meracuni situs coking, meningkatkan keasaman, mencegah sintering
(katalis perengkahan) 3 Pt Meningkatkan oksidasi CO Zeolit
(perengkahan katalitik)
Ion alkali Meningkatkan keasaman dan stabilitas termal, meningkatkan hidrogenasi
Pd Pt/Al2O
(reformasi katalitik) 3 Re
Mengurangi hidrogenolisi dan sintering
MoO3/Al2O (hidrotreating) 3
NiCo Meningkatkan hidrogenolisi C–S dan C–N, Meningkatkan dispersi MoO3
P, B
Ni / ceramic
(reformasi kukus) K Meningkatkan penghilangan karbon
Tabel 2.3 Jenis-jenis bahan katalis
Jenis Bahan Keadaan Contoh
Logam Terdispersi Rendah: Pt/Al2O3, Ru/SiO2
Asam Crystalline Dual SiO2-AlZeolit 2O3 Natural Clays Montmorillonite Asam terpromosi Super asam SbF5, HF
Basa Terdispersi CaO, MgO, K2O, Na2O
2.7.4 DESAIN KATALIS
Desain katalis yang akan sukses memerlukan kombinasi pengalaman-pengalaman unik dengan pengetahuan yang berhubungan dengan pengalaman tersebut. Diskusi tentang pengembangan proses adalah dasar penting di dalam mendesain katalis, penekanannya pada apa yang dibutuhkan oleh proses itu. Target reaksi adalah sangat penting. Faktor-faktor penting yang perlu diperhatikan adalah ukuran partikel, ukuran pori, kekuatan dan selektivitas, aktivitas, stabilitas dan formulasi. Berikut ini ada beberapa langkah untuk mendesain katalis :
1. Analisis stoikiometrik 2. Analisis termodinamika 3. Mekanisme molecular 4. Mekanisme reaksi permukaan 5. Identifikasi jalur reaksi
6. Sifat-sifat katalis yang diperlukan 7. Pencarian bahan-bahan katalis 8. Desain katalis
Deposisi komponen aktif ke dalam penyangga dapat melalui beberapa cara, antara lain: 1. Presipitasi
2. Absorbsi 3. Ion Exchange
4. Impregnasi
2.8 CATALIC CONVERTER
Katalis adalah suatu zat yang mempercepat tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri (lihat pul berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk.
Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau lemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan antara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC (1)
B + AC → AB + C (2)
Meskipun katalis (C) termakan oleh reaksi satu, namun selanjutnya dihasilkan kembali oleh reaksi dua, sehingga untuk reaksi keseluruhannya menjadi,
A + B + C → AB + C
katalis tidak termakan atau pun tercipta.biokatalis. Penggunaan istilah "katalis" dalam konteks budaya yang lebih luas, secara biasa dianalogikan dengan konteks ini.
Beberapa katalis ternama yang pernah dikembangkan di antaranya yang digunakan untuk produksi massal dikenal ialah dari
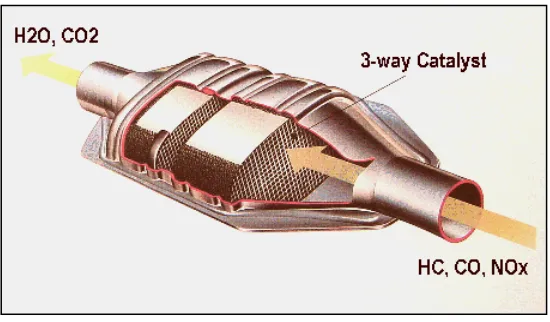
Catalic converter, pertama kali ditemukan tahun1975 di Amerika Serikat. Alat ini dibuat demi memenuhi standar emisi gas buang yang sangat ketat di negara tersebut. Singkatnya Catalytic Converter ini adalah alat yang akan mereaksikan gas-gas buang yang berbahaya melalui reaksi kimia sehingga nantinya gas-gas tersebut akan berubah menjadi gas yang tidak berbahaya bagi lingkungan. Atau minimal menjadi gas yang tidak terlalu berbahaya. Saat ini Catalytic Converter telah digunakan di banyak mesin-mesin mobil dan motor, bahkan beberapa motor bebek yang notabene motor murah sudah memasang teknologi ini. Ada dua tipe dari Catalytic Converter, yaitu three-way Catalist dan two-way Catalyst. three-way Catalist digunakan pada mesin mobil dan motor yang menggunakan bahan bakar bensin (premium, solar dsb).
Ada tiga tahap dalam proses ini yaitu :
1. Reduksi Nitrogen Oksida menjadi nitrogen dan Oksigen : 2NOx→ xO2+N 2. Oksidasi Karbon Monoksida menjadi Karbon Dioksida : 2CO + O
2
2→ 2CO
3. Oksidasi senyawa Hidrokarbon yang tak terbakar (HC) menjadi Karbon Dioksida dan air : 2C
2
Reaksi-reaksi di atas akan berjalan efisien bila mesin bekerja dengan perbandingan 14,7 bagian udara dengan 1 bagian bahan bakar. Berikut adalah gambar tipe three-way Catalist ditunjukkan pada gambar 2.6
Gambar 2.6 Tipe dari Catalytic Converterthree-way Catalist
Sedangkan two-way Catalist digunakan pada mesin diesel. Karena pada daur mesin diesel tidak dihasilkan Nitrogen Oksida (NOx
Catalytic Converter sangat peka terhadap logam-logam lain yang biasanya terkandung dalam bensin ataupun solar misalnya timbal pada premium, belerang pada solar, lalu seng, mangan, fosfor, silikon, dsb. Logam-logam tersebut bisa merusak komponen dari Catalytic Converter. Oleh karena itu teknologi ini tidak bisa digunakan di semua daerah terutama daerah yang premiumnya belum diganti oleh Premium TT (Tanpa Timbal). Bagaimanapun teknologi Catalytic Converter yang telah diciptakan oleh para engineer ini telah memberikan kontribusi nyata terhadap usaha menekan polusi udara yang juga akan berdampak pada isu pemanasan global (Triatmono:2011)
), maka daur yang terjadi hanyalah daur nomor dua dan tiga saja.
2.8.1 CARA KERJA CATALIC CONVERTER
Seiring dengan berlakunya standar emisi gas buang Euro dua untuk produk mobil dan sepeda motor di Indonesia mulai 2007, catalytic converter menjadi peranti yang wajib dipasang pada kendaraan produksi terbaru. Alat ini dirancang untuk mengurangi gas polutan sisa
pembakaran mesin kendaraaan bermotor.
converters telah membantu mengurangi bahan polutan sebanyak 1,5 miliar ton di AS dan tiga miliar ton di seluruh dunia.
Bentuk catalytic converter seperti tabung bentuknya mirip sarang tawon. Bahannya terbuat dari keramik dengan ukuran lubang penyaring antara satu hingga dua mm. Secara umum ada dua tipe catalytic converter yang dipakai, yaitu jenis pellet dan monolithic. Jenis monolithic merupakan catalytic converter yang banyak dipakai saat ini. Alasannya, jenis tersebut memiliki tahanan gas buang yang kecil, lebih ringan, dan cepat panas dibandingkan jenis pellet.
Untuk mengurangi gas polutan, catalytic converter menggunakan beberapa bahan baku. Berdasarkan bahan baku yang dipakai, catalytic converter bisa dibagi menjadi dua model, yaitu oxidation catalyst (OC) dan three way catalyst (TWC). Jenis OC menggunakan material platinum dan paladium, yang dapat mengurangi CO dan HC. Sedangkan TWC mengandung platinum dan rhodium yang mampu mengurangi CO, HC, dan NOx.
Catalytic converter ditempatkan di belakang exhaust manifold atau diantara muffler dengan header. Alasannya, catalytic converter cepat panas ketika mesin dinyalakan. Selain itu, sensor bisa segera bekerja untuk menginformasikan kebutuhan campuran bahan bakar udara yang tepat ke Engine Control Machine (ECM). Peranti catalytic converter baru bekerja efektif ketika kondisinya panas.
Khusus untuk jenis TWC, prosedur kerjanya dibagi menjadi tiga bagian:
1. Tahap pertama disebut dengan reduction catalyst. Molekul NOx disaring dan direaksikan menjadi atom nitrogen dan oksigen. Atom nitrogen yang terperangkap dalam katalis tersebut diikat dengan atom nitrogen lainnya, sehingga berubah menjadi N2. Sementara oksigen yang ada diubah menjadi O2
2. Proses kerja kedua disebut oxidization catalyst. Tujuannya mengurangi kadar hidrokarbon juga mengubah CO menjadi gas CO
.
2
3. Adapun mekanisme kerja ketiga adalah pengendalian yang memonitor arus gas buang. "informasi" yang diperoleh dipakai untuk mengatur campuran bahan bakar dengan udara agar selalu berada dalam komposisi yang ideal.
yang tidak berbahaya.
Setiap mobil memiliki jumlah alat sensor yang berbeda, bergantung pada kebutuhan dan teknologi mesinnya. Umumnya mobil injeksi menggunakan dua sensor oksigen yang berbeda tempat. Ketika sensor, misalnya, mendeteksi temperatur gas buang terlalu tinggi akibat jumlah bahan bakar yang sedikit dibandingkan udara, maka air-fuel ratio (AFR) menjadi "miskin". Informasi inilah yang akan diteruskan ke ECM. Peranti ECM pun segera bekerja melakukan penyetelan ulang komposisi bahan bakar dan udara sehingga proses pembakaran menjadi ideal.
Pipa buang adalah pipa baja yang mengalirkan gas sisa pembakaran dari exhaust manifold ke udara bebas. Konstruksinya dibagi menjadi beberapa bagian, yaitu pipa bagian depan, tengah, dan belakang. Susunannya sengaja dibuat demikian untuk mempermudah saat penggantian catalytic converter atau muffler, tanpa perlu melepas keseluruhan konstruksi sistem pembuangan.
hingga 5 kg/cm2. Sedangkan suhunya bisa mencapai 600 hingga 800 OC. Besaran panas ini kira-kira 34% dari energi panas yang dihasilkan mesin. Kalau gas ini langsung disalurkan ke udara luar tanpa muffler, gas akan mengembang dengan cepat diiringi dengan suara ledakan yang cukup keras (Geomorphosis; 2011)
2.9 FILTER GAS BUANG
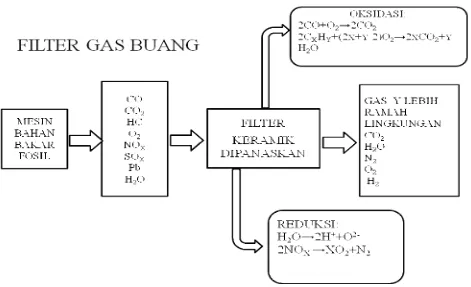
Keramik berpori sangat banyak digunakan untuk filtrasi ion-ion logam berat dan absorbsi gas pada temperatur tinggi. Di bawah ini adalah skema proses oxidation catalic yang terjadi pada catalic converter untuk tipe three way catalist yang ditunjukkan pada gambar 2.7
Gambar 2.7 Skema Proses Filtrasi Gas Buang
2.10 KARAKTERISTIK BAHAN 2.10.1 SIFAT FISIS
2.10.1.1 PENYUSUTAN (SHRINKAGE)
Penyusutan terjadi akibat menurunnya porositas dimana keporian terisi oleh bahan-bahan yang mudah melebur. Penyusutan suatu produk sangat erat kaitannya dengan proses pembuatan (fabrication) bahan tersebut.
Temperatur pembakaran sangat berpengaruh terhadap penyusutan. Semakin tinggi temperatur pembakaran yang diberikan terhadap bahan keporian akan semakin tertutupi oleh bahan yang mudah melebur sehingga terjadi penyusutan yang semakin besar. Faktor-faktor lain yang mempengaruhi penyusutan antara lain:
a. Pembentukan b. Lama pembakaran c. Ukuran butir d. Komposisi, dll
Penyusutan massa adalah persentasi penyusutan massa sebelum dan sesudah dibakar.
... (2.1)
Keterangan : Msbl
M
= massa sebelum dibakar (Kilogram) sdh
Pengukuran susut volum dilakukan pada benda uji dengan menggunakan persamaan: = massa sesudah dibakar (Kilogram)
... (2.2)
m = Massa (Kilogram) V = Volum
Dalam prakteknya kadang-kadang sampel yang akan diukur mempunyai ukuran dari bentuk yang tidak teratur, sehingga persatuan volum mengalami kesulitan serta kerapatannya diragukan. Pengukuran kerapatan massa memberikan hasil yang lebih akurat dapat dilakukan dengan metode Archimedes. Dalam pengukuran Archimedes bahannya dilapisi lilin agar pori-pori yang terbentuk tidak terisi oleh air.
2.10.1.3 POROSITAS
Porositas suatu medium adalah perbandingan volum rongga-rongga pori terhadap volume total seluruh batuan. Perbandingan ini biasanya dinyatakan dalam persen. Pengukuran Porositas dilakukan dengan cara yang sederhana, yakni dengan cara merendam sampel ke dalam air selama ± 6 jam pada suhu dan tekanan ruang, Setelah tercapai waktu tersebut, sampel di lap kemudian ditimbang massanya dengan menggunakan neraca analitis, nilai porositas setiap sampel diperoleh dari perhitungan dengan menggunakan persamaan:
... (2.4)
Keterangan : Msbl M
= massa basah (Kilogram) sbl
ρ = massa jenis air (Kilogram/m
= massa kering (Kilogram) 3
V
) t = Volum total sampel (m3)
2.10.1.4 PERMEABILITAS
Permeabilitas merupakan kemampuan bahan untuk mengalirkan fluida. Permeabilitas di ukur dengan menggunakan alat Leter Detroit. Alat ini terdiri dari dua skala yaitu small oriface (dalam satuan mmH2O) dan large oriface (dalam satuan Pascal), Nilai yang di dapat dalam skala mmH2O diubah dengan cara mengkonversinya dengan menggunakan persamaan berikut:
... (2.5)
Nilai-nilai dan Kisaran Permeabilitas bergantung pada cara yang sangat kompleks terhadap sifat-sifat ruang pori atau tempat retakan. Pengaruh yang dominan antara lain :
- Porositas
- Ukuran pori dan distribusinya
- Susunan pori dan rongga pori (topologi jaringan pori)
Berdasarkan hal tersebut maka terlihat jelas kecenderungan :
- Permeabilitas meningkat dengan meningkatnya porositas - Permeabilitas meningkat dengan meningkatnya ukuran butir
- Permeabilitas menurun dengan kompaksi dan sementasi (Boyles:2000)
2.10.2 SIFAT MEKANIK 2.10.2.1 KUAT TEKAN
Pengujian kekuatan tekan dilakukan secara manual dengan meletakkan sampel pada permukaan yang datar, di atas sampel tepat di bagian tengahnya diletakkan beban tekan secara perlahan-lahan dengan penambahan beban tekan sambil dilakukan pengamatan sampai sampel tersebut pecah dan dicatat nilai beban maksimum yang dipikul sampel.
Standar yang digunakan pada pengujian ini adalah ASTM C 270-04 dan ASTM C 780. Alat yang digunakan pada tes uji tekan mortar adalah Hydraulic Compresive Strength Machine tipe MAC-200. Pembebanan diberikan sampai benda uji runtuh, yaitu pada saat beban maksimum bekerja. Beban maksimum dicatat sebagai F.
Secara matematis besarnya kuat tekan suatu bahan (Sorahatua, 2009):
...(2.6)
= beban tekan maksimum (kgf) 2
2.10.2.2 Kuat Pukul (Impact Strength)
)
Suatu bahan mungkin memiliki kekuatan tarik yang tinggi, tapi tidak memenuhi syarat untuk kondisi pembebanan kejut. Kuat pukul biasanya diuji dengan menggunakan metode izord atau yang bertakik maupun tidak bertakik dengan ASTM E-236-56T, Alat yang digunakan untuk mengukur kuat pukul adalah iber test.
Harga impak menjadi besar dengan meningkatnya absorbsi kadar air dan menjadi kecil karena pengeringan. Impak dari benda uji dapat diperoleh dengan menggunakan persamaan:
W = Kerja pukulan (J)
A = Luas penampang benda uji (m2)
2.10.2.3 KEKERASAN
Pengujian kekerasan dengan menggunakan alat Digital Equotip Hardness Tester dengan ASTM E-18 yang hasilnya dapat langsung dibaca dan diperoleh dalam satuan Hardness of Vickers, dengan menggunakan persamaan (Voort,1995)
HB = 0,941 HV
Untuk mengetahui besar persentase gas buang kendaraan bermotor yang terserap oleh sampel dapat ditentukan dengan persamaan matematis sebagai berikut (Sembiring:2010)
... (2.9)
Keterangan : X0 X
= Jumlah gas / sebelum menggunakan filter
S = Jumlah gas CO2, CO, HC, O2 dan NOX sesudah menggunakan filter
2.12 XRD ( X – RayDiffraction )
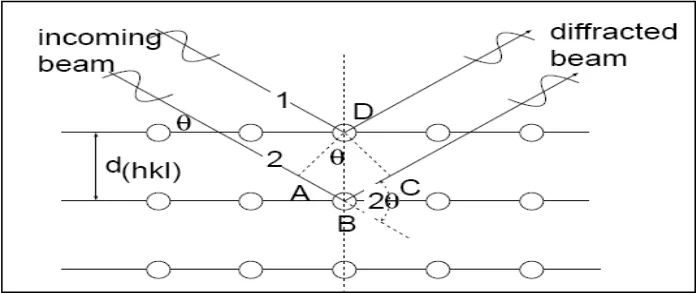
XRD (X–Ray Diffraction) adalah Alat yang digunakan untuk menentukan substansi atau kristal yang terkandung dalam sampel, biasanya selalu menimbulkan pola difraksi yang unik, kecuali amorf atau gas. Pola difraksi yang muncul menampilkan substansi parameter kisi dan tipe kristal dan untuk mengetahui rincian lain misalnya susunan berbagai jenis atom dalam kristal, keberadaan cacat, ukuran butir, orientasi, ukuran dan kerapatan presipitat yang terdapat pada sampel tersebut. Oleh karena itu pola difraksi tiap unsur pada gambar 2.8 adalah spesifik, maka metode ini sangat akurat untuk menentukan komposisi unsur dan senyawa yang terdapat dalam sampel, karena pola yang terbentuk seperti fingerprint dari suatu materi. Difraksi oleh bidang atom di tunjukkan pada gambar 2.8 berikut
Gambar 2.8 Difraksi sinar –X oleh bidang atom (Perdinan:2012)
Jika dari hasil XRD diperoleh nilai FWHM (Full Width at Half Maximum), maka dengan menggunakan persamaan Debye Scherer dapat diperoleh ukuran butir partikel pada sampel. Persamaan Debye Scherer dituliskan sebagai berikut:
... (2.10)
Keterangan :
K = 0,94 dianggap bentuk kristal mendekati bola L = Ukuran kristal
λ = 1,54 Å, jika anoda yang digunakan adalah Cu
2.12.1 Polymorphism Minerals
Polymorphism dalam ilmu bahan adalah kemampuan solid bahan di lebih dari satu bentuk kristal struktur. Polymorphism berpotensi ditemukan dalam kristal bahan termasuk polimer, mineral dan logam. Berikut ini ada dijelaskan beberapa macam mineral Polymorphism yaitu:
1. Calcite dan Aragonite
Mineral Aragonite yang mepunyai rumus kimia CaCO3, bentuk kristal ortorombik merupakan Polymorphism dari mineral kalsit Calcium Carbonat (CaCO3) bentuk kristal trigonal, berwarna putih, kekuningan, abu-abu, kilap cahaya, transparan hingga translusen, kekerasan 3,5 – 4,0 skala Mohs, berat jenis 2.95 g/cm3, merupakan endapan akibat penguapan sumber air panas atau endapan pada gua-gua batu gamping. Calcite adalah carbonate mineral dari Calcium Carbonat (CaCO3) yang paling stabil dari Polymorphism lain. Umumnya berwarna putih transparan dan mudah di gores dengan pisau. Kebanyakan binatang laut terbuat dari Calcite atau
( )
θ
θ
λ
cos
2
B
K
mineral yang berhubungan dengan lime dari batu gamping. Aragonite akan berubah menjadi calcite pada kalsinasi > 470 0C.
2. Quartz, Tridmite dan Cristobolite
Merupakan mineral bersifat polimorfisme yang sama-sama memiliki komposisi kimia silica (SiO2). Quartz (kuarsa) adalah salah satu mineral yang umumnya banyak dijumpai pada kerak bumi. Mineral ini berwarna biru yang memakai indikator, berwarna putih, kilap cahaya dan belahan (cleavage) dan tidak teratur (uneven concoidal), Mineral ini memiliki struktur heksagonal yang terbuat dari silika trigonal dengan skala kekerasan 7 Mohs dan densitas 2,65 g/cm3. Bentuk umum kuarsa adalah prisma segienam yang memiliki ujung piramida segienam. Sedangkan cristobalite adalah polymorph dari kuarsa yang berarti juga terdiri dari bahan SiO2
Gambar sistem kristal dari hasil XRD untuk sampel keramik filter pada penelitian ini yang memenuhi struktur Calcite untuk CaCO
(Dayat:2012)
3 dan Quartz untuk Silika di tunjukkan pada gambar 2.9 berikut ini
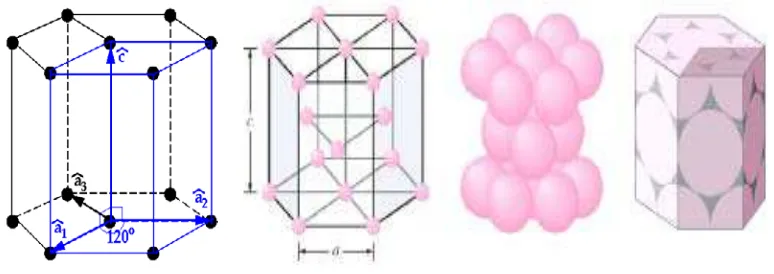
Gambar 2.9 Hexagonal Sistem
Gambar 2.10 Rhombohedral (R) atau Trigonal (S) a = b = c, = ß = g ¹ 90o