BAB II
TINJAUAN PUSTAKA
2.1 Uraian Hewan
Uraian hewan meliputi habitat, sistematika hewan, morfologi hewan, kandungan kimia dan kegunaan (khasiat) hewan kuda laut.
2.1.1 Habitat
Ditemukan pada kedalaman >10 m dari permukaan air dan dilaporkan maksimum pada kedalaman 100 m, koral lunak, dasar yang berpasir disekitar terumbu dangkal, dasar yang berlumpur. Untuk jenis Hippocampus trimaculatus
Leach., banyak ditemukan di Australia, Kamboja, Cina, Hongkong, Taiwan, Tahiti, India, Indonesia, Jepang, Malaysia, Myanmar, Filipina, Singapura, Thailand dan Vietnam (Lourie, et al., 2004).
2.1.2 Sistematika hewan Kerajaan : Animalia Filum : Chordata Kelas : Actinopterygii Bangsa : Syngnathiformes Suku : Syngnathidae Marga : Hippocampus
Spesies : Hippocampus trimaculatus Leach.
Sinonim : H. mannulus Cantor 1850; H. kampylotrachelos Bleeker 1854;
H. planifrons Peters 1877; H. dahli Ogilby 1908; H. takakurae
2.1.3 Morfologi hewan
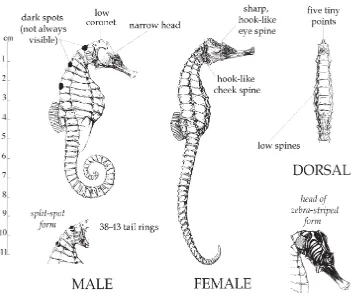
Gambar 2.1 Morfologi hewan kuda laut (Hippocampus trimaculatus Leach.) (Lourie, et al., 2004).
Kuda laut (Hippocampus trimaculatus Leach.) memiliki warna kecoklatan, panjang maksimum 17 cm, trunk rings 11, tail rings 40-41 (38-43), head length/snout length 2,2 (1,9-2,4 cm), coronet rendah dan menyerupai 5 titik, tidak terdapatnya duri hidung, duri pipi tunggal dan berbentuk seperti ‘hook’ (Lourie, et al., 2004).
2.1.4 Kandungan kimia
glutamat 7,63 ± 0,43%, alanin 5,86 ± 0,15%, tirosin 1,36 ± 0,12%, glisin 10,01 ± 1,33%, serin 2,32 ± 0,02%. Asam amino esensial 19,18 ± 1,16%, asam amino total 56,88 ± 2,56%, mengandung asam-asam lemak jenuh dan tak jenuh serta mineral (Lin, et al., 2008).
2.1.5 Kegunaan (khasiat) kuda laut
Kuda laut banyak digunakan oleh masyarakat untuk penyembuhan distosia pada wanita hamil, memperkuat ginjal, meningkatkan imunitas dan menghilangkan tumor. Kuda laut juga dilaporkan dapat meningkatkan jumlah sperma (spermatogenesis), memperpanjang estrum pada tikus dan meningkatkan stamina (Lin, et al., 2008).
2.2 Kanker
Kanker adalah istilah umum untuk pertumbuhan sel yang tidak normal, yaitu suatu kondisi di mana sel telah kehilangan pengendalian dan mekanisme normal, sehingga mengalami pertumbuhan yang tidak normal, cepat dan tidak terkendali. Kanker dapat menyusup ke jaringan tubuh normal dan menekan jaringan tubuh normal sehingga mempengaruhi fungsi tubuh. Kanker bukan merupakan penyakit menular (Diandana, 2009).
Adapun ciri-ciri sel kanker secara khusus yang membedakan dengan sel normal, antara lain sebagai berikut.
a. Sel kanker mampu mencukupi kebutuhan sinyal pertumbuhannya sendiri
tidak bergantung pada rangsangan sinyal pertumbuhan dari luar untuk melakukan proliferasi. Mutasi yang terjadi pada sel kanker memungkinkan sel tersebut untuk memperpendek growth factor pathway. Dengan demikian, sel kanker dapat tumbuh menjadi tidak terkendali (Pecorino, 2005; Kumar, 2005; Adina, 2009). b. Sel kanker tidak sensitif terhadap sinyal antiproliferatif
Sinyal antiproliferatif merupakan sinyal anti pertumbuhan yang dibutuhkan oleh sel untuk mengontrol dan menjaga keteraturan sel serta homeostasis jaringan. Pada kondisi normal, regulasi sinyal pertumbuhan ini menjadi faktor penentu bagi sel untuk berproliferasi atau istirahat. Sinyal ini akan mengatur perkembangan sel dengan memblok proliferasi melalui dua mekanisme, yaitu (1) sel dipaksa keluar dari fase proliferasi yang aktif menuju fase istirahat G0 atau (2) sel diinduksi untuk melepaskan potensi proliferasi secara permanen dengan diinduksi untuk memasuki fase post mitotic. Sel kanker memiliki kemampuan untuk menghindar dari sinyal anti pertumbuhan yang berhubungan dengan daur sel. Hal ini disebabkan oleh adanya mutasi pada beberapa gen (proto-onkogen) (Pecorino, 2005; Kumar, et al., 2005; Adina, 2009).
c. Sel kanker mampu menghindar dari mekanisme apoptosis
protein regulator ini menyebabkan sel kehilangan kontrol proliferasi (Kumar, et al., 2005; Adina, 2009).
d. Kemampuan angiogenesis yang dimiliki oleh sel kanker
Sel kanker memiliki kemampuan untuk memacu pertumbuhan pembuluh darah baru yang dinamakan angiogenesis. Kemampuan tersebut diinisiasi oleh sinyal Vascular Endothelial Growth Factor (VEGF) dan Fibroblas Growth Factor (FGF). Terdapat beberapa regulator proses angiogenesis antara lain: angiopoietin-1, angiotropin, angiogenin, epidermal growth factor, granulocyte
colony-stimulating factor, interleukin (IL-1), IL-6, IL-8, TNF-α, kolagen, dan
cathepsin. Faktor-faktor angiogenensis dapat mengaktifkan angiogenic switch, sehingga pertumbuhan pembuluh darah baru menjadi tidak terkendali (Kumar, et al., 2005; Adina, 2009).
e. Sel kanker mampu menginvasi jaringan di sekitarnya dan membentuk anak sebar (metastasis)
Selama perkembangannya, kebanyakan kanker pada manusia akan membentuk massa tumor primer yang mampu membebaskan diri dari jaringan awalnya, memasuki aliran darah atau pembuluh limfa, dan membentuk tumor sekunder (metastasis) di bagian tubuh yang lain. Hal ini dapat terjadi akibat mutasi yang memungkinkan peningkatan aktivitas enzim-enzim yang terlibat dalam invasi sel kanker dan berkurangnya adhesi antar sel oleh molekul addisi sel (Pecorino, 2005; Adina, 2009).
berkaitan dengan enzim telomerase yang menjaga integritas telomer pada kromosom, sehingga sel tetap memiliki kemampuan untuk membelah diri. Pada kondisi normal, telomer akan mengalami degradasi (pemotongan) pada saat sel mengalami replikasi. Ketidakmampuan sel untuk meregulasi degradasi telomer inilah yang menyebabkan sel kanker memiliki kemampuan tidak terbatas untuk bereplikasi (Kumar, et al., 2005; Adina, 2009)
2.2.1 Karsinogenesis
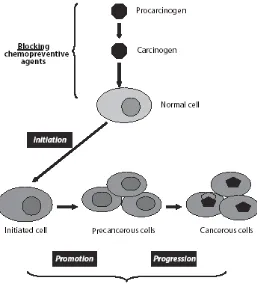
Karsinogenesis merupakan suatu proses terjadinya kanker melalui mekanisme multitahap dengan adanya perubahan neoplastik pada jaringan normal yang disebabkan oleh akumulasi multimutasi genetik dan menyebabkan transformasi progresif sel normal menjadi sel malignan (ganas) (Tsao, et al., 2004). Perubahan ini diawali dari mutasi somatik satu sel tunggal yang mengakibatkan perubahan dari normal menjadi hiperplastik, displastik, dan pada akhirnya menjadi suatu keganasan atau malignansi (memiliki kemampuan metastasis atau menginvasi jaringan di sekelilingnya) (Gambar 2.2). Perubahan genetik ini termasuk perubahan seluler mendasar pada sel kanker yang dipengaruhi oleh beberapa gen seperti: tumor suppressor genes (pRb, p53,PTEN, E-cadherin) dan proto-oncogenes (ras, c-myc, Bcl-2). Karsinogenesis dapat dibagi menjadi empat tahap utama, yaitu tahap inisiasi, promosi, progresi, dan metastasis (Tsao, et al., 2004; Adina, 2009).
Secara singkat, pembentukan dan pertumbuhan sel kanker dapat dijelaskan melalui tahapan-tahapan berikut (Diandana, 2009; Harianto, 2009).
b. Fase induksi, yaitu ketika sel normal yang sedang bermutasi mulai berubah menjadi sel kanker. Fase inisiasi dan induksi tidak bisa diketahui dan sangat susah untuk dideteksi. Fase-fase ini dapat berlangsung hingga puluhan tahun.
c. Fase in situ, yaitu ketika pertumbuhan kanker terbatas pada jaringan tempat asalnya tumbuh. Fase ini lamanya sangat bervariasi. Mungkin saja penderita penyakit kanker berada dalam fase ini selamanya, tetapi umumnya berlangsung sampai 5 tahun.
d. Fase metastasis, yaitu penyebaran kanker ke kelenjar getah bening atau organ lain yang letaknya jauh (misal kanker usus besar menyebar ke hati). Penyebaran ini dapat melalui aliran darah, aliran getah bening, atau langsung dari tumor.
Pada tahap promosi, sel-sel akan memperoleh beberapa keuntungan selektif untuk tumbuh sehingga pertumbuhannya menjadi cepat dan berubah menjadi tumor jinak. Tahap promosi tidak melibatkan perubahan struktural dari genom secara langsung, tetapi biasanya terjadi perubahan ekspresi gen yang terinisiasi (Tsao, et al., 2004).
Adanya mutasi pada satu sel tunggal normal sebagai akibat terpapar oleh karsinogen (inisiasi), akan menyebabkan progresi sel menjadi hiperplasi (promosi), diplasi (progresi) dan pada akhirnya memiliki kemampuan invasi ke jaringan sekitarnya (metastasis) (Tsao, et al., 2004; Adina, 2009).
dan angiogenesis (Kumar, et al., 2005). Pada tahap ini, sel-sel tumor dikatakan sebagai sel malignan. Pada fase ini juga akan terjadi karsinoma dan metastasis melalui aktivasi onkogen dan malfungsi dari enzim topoisomerase (Pecorino, 2005; Adina, 2009).
Gambar 2.2 Multitahap karsinogenesis (Tsao, et al., 2004).
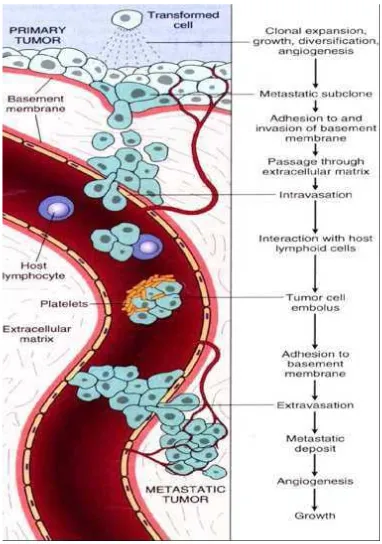
lainnya membentuk tumor sekunder dengan didukung kemampuan neoangiogenesis yang dimilikinya (Kumar, et al., 2005; Adina, 2009).
Gambar 2.3 Metastasis sel kanker melalui pembuluh limpoid (Kumar, et al., 2005).
Tahap metastasis dapat berlangsung karena melemahnya ikatan antarsel yang disebabkan oleh terdegradasinya CAMs (Cell-cell Adhesion Molocules) dan
E-cadherin sebagai molekul yang menjaga pertautan antarsel. Molekul-molekul tersebut diketahui sudah sangat sedikit bahkan tidak ditemukan lagi pada sel kanker, sehingga proses metastasis dapat terus terjadi. Selain itu, kemampuan angiogenesis yang telah dimiliki sel kanker mampu menjaga sel agar tetap hidup selama proses metastasis berlangsung (Kumar, et al., 2005; Adina, 2009).
2.2.2 Kanker payudara
tergolong pada karsinoma. Kanker payudara merupakan kanker yang paling umum diderita oleh wanita, di samping kanker serviks. Penyebab kanker payudara sangat beragam (Torosian, 2002)., antara lain:
a. Kerusakan pada DNA yang menyebabkan mutasi genetik. Kerusakan ini dapat disebabkan oleh radiasi yang berlebihan
b. Kegagalan immune surveillance dalam pencegahan proses malignan pada fase awal
c. Faktor pertumbuhan yang abnormal
d. Malfungsi DNA repairs seperti : BRCA1, BRCA2 dan p53
Kanker payudara terjadi ketika sel-sel pada payudara tumbuh tidak terkendali dan dapat menginvasi jaringan tubuh yang lain baik yang dekat dengan organ tersebut maupun bermetastasis ke jaringan tubuh yang letaknya berjauhan. Semua tipe jaringan pada payudara dapat berkembang menjadi kanker, namun pada umumnya kanker muncul baik dari saluran (ducts) maupun kelenjar (glands). Perkembangannya memerlukan waktu berbulan-bulan atau bertahun-tahun sampai tumor tersebut cukup besar untuk dirasakan pada payudara. Deteksi dapat dilakukan dengan mammograms (Gambar 2.4) yang kadang-kadang dapat mendeteksi tumor sejak dini (Elwood, 1993; Dolinsky, 2002; Adina, 2009).
(sebelum 12 tahun), yang mengalami menopause terlambat (setelah 50 tahun), yang tidak pernah melahirkan atau melahirkan di usia lebih dari 30 tahun, dan yang mengalami mutasi genetik. Dari berbagai macam faktor tersebut, 3 - 10% penyebab kanker payudara diduga berkaitan dengan perubahan baik gen BRCA1
maupun gen BRCA2 (Dolinsky, 2002; Adina, 2009).
Beberapa faktor yang menaikkan resiko menderita kanker payudara yang dapat diubah, yakni mendapatkan terapi pengganti hormon (penggunaan estrogen dan progesteron dalam jangka waktu lama untuk mengatasi gejala menopause), menggunakan pil antikontrasepsi (pil KB), tidak menyusui, mengonsumsi minuman beralkohol 2 - 5 gelas per hari, menjadi gemuk terutama setelah menopause, dan tidak berolahraga (Dolinsky, 2002; Adina, 2009). Perlu diingat bahwa faktor-faktor resiko tersebut hanyalah berdasarkan pada kemungkinan. Seseorang tetap dapat terkena kanker payudara walaupun ia tidak mempunyai satu pun faktor resiko tersebut. Menghindari faktor resiko tersebut dan deteksi awal adalah cara terbaik untuk mengurangi kematian berkaitan dengan kanker ini.
dan ekspresinya mampu meningkatkan efektivitas agen kemoterapi (Zhou, et al., 2006; Adina, 2009).
Payudara normal Kanker payudara Payudara normal Kanker payudara a b
Gambar 2.4 Kanker payudara (Elwood, 1993; Dolinsky, 2002; Adina, 2009). Keterangan gambar:
Proses pembentukan breast cancer yang diawali oleh pertumbuhan satu sel (a), Payudara normal (kiri) dan kanker payudara (kanan) melalui mammography image (b)
Selain itu, paparan estrogen endogen yang berlebihan juga dapat berkontribusi sebagai penyebab kanker payudara. Sekitar 50% kasus kanker payudara merupakan kanker yang bergantung pada estrogen dan sekitar 30% kasus merupakan kanker yang positif mengekspresi HER-2 berlebihan (Gibbs, 2000; Adina, 2009). Kedua protein tersebut selain berperan dalan metastasis, juga berperan dalam perkembangan kanker payudara (early cancer development).
utama dalam sinyal pertumbuhan, misalnya Ras, Myc, dan cycD1 (Foster, et al.,
2001). Aktivasi protein ini mengakibatkan adanya pertumbuhan yang berlebihan melalui aktivasi onkoprotein yang lain seperti P13K, AKT, Raf, ERK, dan MAP kinase (Hahn, et al., 2002). Di lain pihak, kompleks estrogen dengan reseptornya juga akan memacu transkripsi beberapa gen tumor suppressor, seperti BRCA1, BRCA2, dan p53. Namun, pada penderita kanker payudara (yang umumnya telah lewat masa menopause) gen-gen tersebut telah mengalami perubahan (transformed) akibat dari hiperproliferasi sel-sel payudara selama perkembangannya sehingga tidak berperan sebagaimana mestinya (Adelmann, et al., 2000, Clarke, 2001; Ingvarsson, et al., 2001; Adina, 2009).
2.2.3 Sel MCF-7
Salah satu model sel kanker payudara yang sering digunakan dalam penelitian adalah sel MCF-7. Sel ini merupakan sel kanker payudara yang mengekspresikan reseptor estrogen (ER+) dan berasal dari pleural effusion breast adenocarcinoma seorang pasien wanita Kaukasian berumur 69 tahun, golongan darah O (Crawford, 2002). Sel ini termasuk sel adherent (melekat) yang dapat ditumbuhkan dalam media penumbuh DMEM yang mengandung foetal bovine serum (FBS) 10% dan antibiotik penisilin-streptomicin 1% (ATCC, 2008). Sel ini
mengekspresikan reseptor estrogen alfa (ER-α), memiliki sifat resisten terhadap
sel MCF-7. Salah satu cara untuk meningkatkan sensitivitas MCF-7 adalah dengan menghambat ekspresi dan aktivasi Pgp (Zhou, et al., 2006; Adina, 2009). 2.2.4 P-glycoprotein
P-glycoprotein (Pgp) merupakan protein ABC-transporter pada manusia yang termasuk dalam subfamili MDR/TAP (Allen, et al., 2002) Pgp dikenal dalam beberapa sebutan yakni ABCB1, ATP-binding cassette sub-family B member 1, MDR1, dan PGY1 (Choi, 2005). ABCD1 atau Pgp termasuk dalam
ATP-dependent efflux pump yang memiliki substrat spesifik antara lain: obat (colchicine dan tacrolimus), agen kemoterapi (etoposide, adrimycin dan vinblastine), lipid, steroid, xenobiotik, peptide, bilirubin, cardiac glycoside
(digoxin), glucocorticoids (dexamethasone) dan agen terapi HIV tipe 1 (inhibitor
protease dan nonnucleoside reverse transcriptase) (Kitagawa, 2006). Di dalam tubuh, Pgp ini dapat ditemukan pada sel usus, hati, tubula ginjal dan capillary endothelial (Deng, et al., 2001; Adina, 2009).
P-glycoprotein adalah sebuah glikoprotein transmembran yang memiliki 10 - 15 kDa N-terminal glycosylation dengan bobot 170-kDa dikode oleh gen
MDR1 (Kitagawa, 2006). Gen ini dicirikan dengan pompa efflux obat dan anggota dari keluarga ATP-binding transport (Choi, 2005). Dalam sistem organ, Pgp berpengaruh terhadap absorbsi, distribusi dan eliminasi obat (Matheny, et al.,
aktivasi pada Pgp (Choi, et al., 2005). Aktivasi Pgp akan menurunkan intake agen kemoterapi sehingga menurunkan efikasi agen tersebut terhadap sel kanker. Pada kondisi ekspresi yang berlebihan, Pgp dapat menyebabkan resistensi obat terutama agen kemoterapi pada kanker payudara seperti Doksorubisin (Mechetner, et al., 1998). Pgp akan mengikat Doksorubisin sebagai salah satu substratnya untuk dikeluarkan dari dalam sel (Wong, et al., 2006). Pgp atau ABCD1 pertama kali diujikan sebagai multidrug resistance dan terbukti sebagai penyebab resistensi obat kemoterapi (Juliano, 1976; Adina, 2009).
Penghambatan aktivasi dan ekspresi Pgp memegang peranan penting dalam keberhasilan terapi kanker (Zhou, et al., 2006). Penghambatan aktivitas Pgp dapat melalui dua mekanisme yakni (1) penghambatan substrat Pgp secara langsung dengan berikatan pada Pgp-binding domain dan (2) penghambatan hidrolisis ATP oleh ATase melalui ikatan substrat dengan ATP (Kitagawa, 2006). Penghambatan ini dapat dilakukan menggunakan senyawa flavonoid dan polifenol melalui dua sisi ikatan pada ATP-binding sites dan steroid interacting region
dimana ATPase berikatan dengan Pgp cytosolic domain (Kitagawa, 2006).
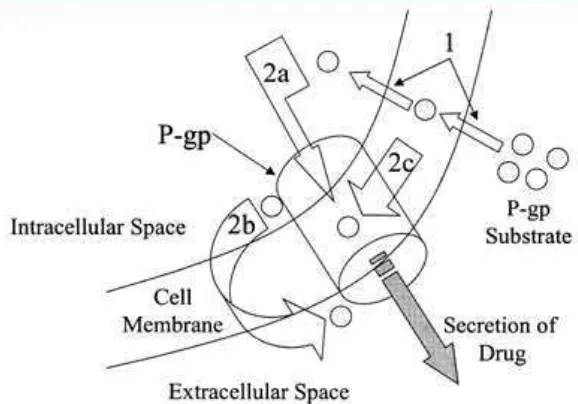
Gambar 2.5 Mekanisme pemompaan oleh Pgp (Matheny, et al., 2001). Penekanan ekspresi Pgp dapat dilakukan melalui berbagai mekanisme antara lain aktivasi jalur sinyal transduksi c-Jun NH2-terminal kinase (JNK) dan
inaktivasi NF-κB transcriptional factor, c-Jun NH2-terminal kinase (JNK)
merupakan protein kinase yang berikatan dengan NH2-terminal yang merupakan sisi aktif pada c-Jun transcriptional factor dan protein ini mampu memfosforilasi c-Jun. Fosforilasi c-Jun akan menstimulasi pembentukan ikatan dengan AP-1, suatu elemen pada gen MDR1. Pembentukan ikatan ini akan mencegah ekspresi mRNA MDR1 dan pada akhirnya akan menghambat ekspresi Pgp. Fosforilasi c-Jun tersebut dapat dilakukan oleh salvicine (quinine diterpenoid sintetik) (Zhou, et al., 2006; Adina, 2009).
Penelitian yang dilakukan oleh Deng, et al., (2001), melaporkan bahwa
aktivasi NF-κB sebagai akibat adanya stimulus dari lingkungan berupa stress,
paparan agen sitotoksik, heat shock, iradiasi, genotoxic stress, inflamasi, paparan
aktif mampu berikatan dengan promoter gen MDR1 sehingga proses ekspresi Pgp
dapat berjalan. Inaktivasi NF-κB mampu menghambat ekspresi Pgp.
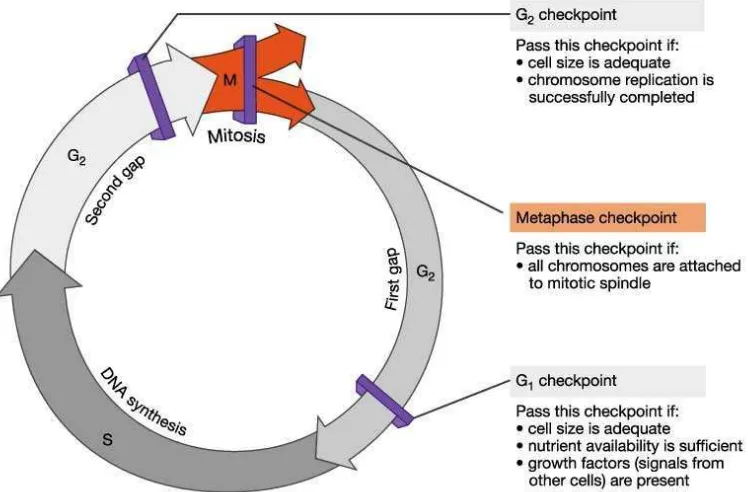
2.2.5 Siklus sel
Siklus sel merupakan proses perkembangbiakan sel yang memperantarai pertumbuhan dan perkembangan makhluk hidup. Setiap sel baik normal maupun kanker mengalami siklus sel. Siklus sel memiliki dua fase utama, yakni fase S (sintesis) dan fase M (mitosis). Fase S merupakan fase terjadinya replikasi DNA kromosom dalam sel, sedangkan pada fase M terjadi pemisahan 2 set DNA kromosom tersebut menjadi 2 sel (Nurse, 2000; Adina, 2009).
Selain itu, terdapat fase yang membatasi kedua fase utama tersebut yang dinamakan Gap. G1 (Gap-1) terdapat sebelum fase S dan setelah fase S dinamakan G-2 (Gap-2). Pada fase G1, sel melakukan persiapan untuk sintesis DNA. Fase ini merupakan fase awal cell cycle progression yang diatur oleh faktor ekstraselular seperti mitogen dan molekul adhesi. Penanda fase ini adalah adanya ekspresi dan sintesis protein sebagai persiapan memasuki fase S. Pada fase G2, sel melakukan sintesis lebih lanjut yang memadai untuk proses pembelahan, sehingga sel siap melakukan pembelahan pada fase M (Ruddon, 2007).
sel (G1-S-G2-M) (Nurse, 2000). Aktivasi CDK dihambat oleh regulator negatif siklus sel, yakni CDK inhibitor (CKI), yang terdiri dari Cip/Kip protein (meliputi p21, p27, p57) dan keluarga INK4 (meliputi p16, p18, p19). Selain itu, tumor suppressor protein yaitu p53 dan pRb juga bertindak sebagai protein regulator negatif (Foster, et al., 2001; Adina, 2009).
Aktivasi CDK memerlukan ekspresi cyclin (Cyc). Kompleks Cyclin-CDK dengan protein CKI dan adanya fosforilasi oleh Wee1 (tyrosin15)/ Myt1 (threonin14) dapat menyebabkan inaktivasi CDK. Aktivasi kompleks Cyc-CDK diawali dengan proteolisis CKI oleh ubiquitin, kemudian fosforilasi CDK oleh CDK-activating kinase (CAK) pada threonin161 dan penghilangan fosfat (defosforilasi) oleh Cdc25 fosfatase pada target fosforilasi Wee1 (tyrosin15)/Myt1 (threonin14) (Heuvel, 2005). CDK bekerja pada awal G1 untuk mengaktifkan
E2F-dependent transcription gen yang diperlukan untuk fase S (di akhir G1 untuk menginisiasi fase S) dan juga di akhir G2 untuk menginisiasi mitosis (M) (Nurse, 2000; Adina, 2009).
Gambar 2.6 Checkpoints siklus sel (Ruddon, 2007).
Checkpoint pada fase G1 akan dapat dilalui jika (1) ukuran sel memadai; (2) ketersediaan nutrien mencukupi; dan (3) adanya faktor pertumbuhan (sinyal dari sel yang lain). Checkpoint pada fase G2 dapat dilewati jika ukuran sel memadai, dan replikasi kromosom terselesaikan dengan sempurna, sedangkan
checkpoint pada metaphase (M) terpenuhi bila semua kromosom dapat menempel pada gelendong (spindle) mitotik (Ruddon, 2007).
sehingga kromatid tidak bergerak menjauh ke kutub yang berlawanan (Ruddon, 2007).
Kontrol checkpoint sangat penting untuk menjaga stabilitas genomik. Kesalahan pada checkpoint akan meloloskan sel untuk berkembang biak meskipun terdapat kerusakan DNA atau replikasi yang tidak lengkap atau kromosom tidak terpisah sempurna sehingga akan menghasilkan kerusakan genetik. Hal ini kritis bagi timbulnya kanker. Oleh karena itu, proses regulasi siklus sel mampu berperan dalam pencegahan kanker (Ruddon, 2007).
2.2.6 Doksorubisin
Doksorubisin adalah golongan antibiotik antrasiklin sitotoksik yang diisolasi dari Streptomyces peucetius var. caesius. Doksorubisin telah digunakan secara luas untuk mengobati kanker payudara (Thurston, et al., 1998). Senyawa ini menunjukkan kemampuan yang kuat dalam melawan kanker dan telah digunakan sebagai obat kemoterapi kanker sejak akhir tahun 1960-an (Singal, et al., 1998; Rock, et al., 2003).
Aplikasi doksorubisin yang telah digunakan secara klinis untuk berbagai jenis tumor ini dibatasi oleh timbulnya efek samping (Tyagi, et al., 2004). Efek samping yang timbul segera setelah pengobatan dengan doksorubisin adalah mual, imunosupresi dan aritmia yang sifatnya revesibel serta dapat dikontrol dengan obat-obat lain. Efek samping yang paling serius akibat pengobatan dengan doksorubisin dalam jangka waktu yang lama adalah cardiomyopathy yang diikuti dengan gagal jantung (Tyagi, et al., 2004). Berdasarkan hasil penelitian restrospektif diketahui bahwa toksisitas kardiak akibat pemberian doksorubisin merupakan efek samping yang bergantung pada dosis. Mekanisme yang memperantarai toksisitas kardiak tersebut diduga disebabkan oleh terbentuknya spesies oksigen reaktif, meningkatnya kadar anion superoksida dan pengurasan ATP yang kemudian menyebabkan perlukaan jaringan kardiak (Wattanapitayakul, et al., 2005).
Permasalahan yang sering timbul dalam terapi kanker terutama kanker payudara menggunakan doksorubisin adalah resistensi obat dan menjadi penyebab kegagalan terapi kanker payudara (Mechetner, et al., 1998). Resistensi ini diperantarai oleh berbagai mekanisme antara lain: mutasi pada target obat, kegagalan inisiasi apoptosis dan pengeluaran obat oleh protein transporter pada membran sel (Notobartolo, et al., 2005). Pengeluaran obat yang disebabkan oleh adanya pompa efflux Pgp menjadi salah satu sebab utama resistensi obat ini (Mechetner, et al., 1998).
konsentrasi efektif doksorubisin dalam sel kanker. Mekanisme pemompaan oleh Pgp sangat bergantung pada aktivasi protein tersebut dan penekanan ekspresi Pgp (Zhou, et al., 2006). Oleh karena itu, inaktivasi Pgp dan penekanan ekspresinya mampu mengatasi permasalahan resistensi sel kanker terhadap doksorubisin (Mechetner, et al., 1998; Zhou, et al., 2006).
2.2.7 Uji sitotoksik menggunakan metode MTT
Uji sitotoksisitas dilakukan secara in vitro, yaitu untuk menentukan potensi sitotoksik suatu senyawa seperti obat antikanker. Toksisitas merupakan kejadian kompleks secara in vivo yang menimbulkan kerusakan sel akibat penggunaan obat antikanker yang bersifat sitotoksik. Respon sel terhadap agen-agen sitotoksik dipengaruhi oleh kerapatan sel (Kupcsik, 2011).
Metode MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolium bromida] adalah salah satu uji sitotoksisitas yang bersifat kuantitatif. Uji ini berdasarkan pengukuran intensitas warna (kolorimetri) yang terjadi sebagai hasil metabolisme suatu substrat oleh sel hidup menjadi produk berwarna (Kupcsik, 2011).
Gambar 2.7 Reduksi MTT menjadi formazan (Kupcsik, 2011).
reduktase suksinat tetrazolium, yang termasuk dalam mitokondria dari sel hidup (Kupcsik, 2011).
Formazan merupakan zat berwarna ungu yang tidak larut dalam air sehingga dilarutkan menggunakan HCl 0,04 N dalam isopropanol atau 10% SDS dalam HCl 0,01 N. Intensitas warna ungu terbentuk dapat ditetapkan dengan spektrofotometri dan berkorelasi langsung dengan jumlah sel yang aktif melakukan metabolisme, sehingga berkorelasi dengan viabilitas sel (Kupcsik, 2011). Persentase viabilitas dapat dihitung dengan persamaan sebagai berikut.
% 𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣= 𝑣𝑣𝑣𝑣𝑣𝑣𝑎𝑎𝑎𝑎𝑣𝑣𝑣𝑣𝑎𝑎𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑣𝑠𝑠𝑠𝑠𝑠𝑠𝑣𝑣
𝑣𝑣𝑣𝑣𝑣𝑣𝑎𝑎𝑎𝑎𝑣𝑣𝑣𝑣𝑎𝑎𝑣𝑣𝑣𝑣𝑘𝑘𝑎𝑎𝑎𝑎𝑣𝑣𝑎𝑎𝑎𝑎𝑣𝑣 𝑥𝑥 100%
2.2.8 Flow cytometry
Flow cytometry merupakan suatu teknologi mutakhir yang dapat diaplikasikan dalam bidang biologi sel maupun medisinal klinis. Prinsip utama dalam metode flow cytometry adalah memisahkan sel atau partikel tunggal yang terdapat dalam suatu suspensi melewat suatu celah sempit dengan waktu singkat yang ditembus seberkas sinar. Sinyal optik yang terbentuk umumnya pada daerah
parameter dapat dianalisis dan dengan teknologi komputer saat ini dapat dikerjakan analisis multiparametrik dengan mudah dan cepat (Robinson, 2004).
Sel yang melewati berkas sinar akan menyebabkan sinar berpencar (scatterd) kedua arah yaitu forward scatterd (FS) yang parallel dengan arah sinar dan side scatterd (SS) yang arahnya tegak terhadap arah sinar. Besarnya FS sebanding dengan ukuran sel dan dapat membedakan antara pecahan sel dengan sel hidup, sedangkan SS menunjukkan morfologi sel dan emisi sinar fluorescence
yang dipancarkan fluorokrom yang digunakan untuk mewarnai sel. FS dan SS masing-masing partikel memiliki keunikan sendiri, sehingga kombinasi keduanya dapat membedakan setiap partikel. Nilai FS dan SS dikonversikan dalam bentuk digital dan histogram sehingga dapat dianalisis (Rahman, 2006).
Aplikasi utama dalam flow cytometry yang digunakan untuk memisahkan sel sesuai dengan sub tipe atau ekspresi epitop yang diinginkan adalah cell sorting
atau analisis Fluororesence Activated Cell Sorter (FACS) (Rahman, 2006). Ketika sampel dimasukkan dan mengalami aliran hidrodinamik, masing-masing partikel akan tersinari. Ketika nilai dari sinyal scattered dan fluorescence
sesuai dengan nilai yang sudah disiapkan, maka akan terjadi proses charging
(pemberian muatan) pada saat keluar dari nozzle sistem fluidic. Partikel bermuatan tersebut dipisahkan sesuai dengan yang diinginkan (Rahman, 2006).
disebut cluster of differentiation (CD) sehingga sistem kompleks antara antigen dengan reseptornya dapat diidentifikasi. Saat ini sudah diketahui ada 166 klasifikasi dari antigen CD (Robinson, 2004).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Setelah diketahui senyawa aktif yang dikandung oleh simplisia, akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. Simplisia yang lunak seperti rimpang dan daun mudah ditembus oleh pelarut, karena itu pada proses ekstraksi tidak perlu diserbuk sampai halus. Simplisia yang keras seperti biji, kulit kayu dan kulit akar sulit untuk ditembus oleh pelarut, karena itu perlu diserbuk sampai halus (Depkes, 2000).
Metode ekstraksi menurut Depkes (2000), ada beberapa cara, yaitu: maserasi, perkolasi, refluks, sokletasi, digesti, infundasi dan dekoktasi.
1. Maserasi
Maserasi digunakan untuk penyarian simplisia yang bersifat lunak seperti daun dan bunga tetapi banyak juga yang menggunakan metode ini untuk menyari simplisia yang keras seperti akar dan korteks karena cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Pada penyarian dengan cara maserasi perlu dilakukan pengadukan untuk meratakan konsentrasi larutan di luar butir serbuk simplisia, sehingga dengan pengadukan tersebut tetap terjaga adanya derajat perbedaan konsentrasi antara larutan di dalam sel dengan larutan di luar sel.
Maserasi dapat dilakukan dengan cara menurut Farmakope Indonesia Edisi III (1979):
Masukkan 10 bagian simplisia dengan derajat halus yang cocok kedalam sebuah bejana, kemudian dituangi dengan 75 bagian cairan penyari, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Pindahkan ke dalam bejana tertutup, biarkan ditempat sejuk, terlindung dari cahaya, selama 2 hari. Enap tuangkan atau saring.
Maserasi dapat dilakukan modifikasi misalnya: 1. Digesti
Digesti adalah cara maserasi dengan menggunakan pemanasan lemah, yaitu pada suhu 40 - 50ºC. Cara maserasi ini hanya dapat dilakukan untuk simplisia yang zat aktifnya tahan terhadap pemanasan.
2. Maserasi dengan mesin pengaduk
Penggunaan mesin pengaduk yang berputar terus menerus sehingga waktu proses maserasi dapat dipersingkat menjadi 6 sampai 24 jam.
3. Remaserasi
Cairan penyari dibagi dua, seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama, sesudah dienap tuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari yang kedua.
4. Maserasi melingkar
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur ruangan. Serbuk simplisia ditempatkan dalam suatu bejana silinder yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya beratnya sendiri dan cairan di atasnya, dikurangi dengan gaya kapiler yang cenderung untuk menahan. Untuk menentukan akhir perkolasi, dilakukan pemeriksaan zat aktif secara kualiitatif pada perkolat terakhir. Proses perkolasi terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak.
1. Reperkolasi
Simplisia dibagi dalam beberapa perkolator, hasil pekolator pertama dipisahkan menjadi perkolat I dan sari selanjutnya disebut susulan II. Susulan II digunakan untuk menyari perkolator 2, hasil perkolator II dipisahkan menjadi perkolat II dan sari selanjutnya disebut susulan III. Pekerjaan tersebut diulang sampai mendapat perkolat yang diinginkan. Untuk cara reperkolasi dapat dilakukan pada herba Timi.
2. Perkolasi Bertingkat
menggunakan cairan penyari yang baru diharapkan agar serbuk simplisia tersebut tersari sempurna. Sebaliknya serbuk simplisia yang baru disari dengan perkolat yang hampir jenuh. Dengan demikian akan diperoleh perkolat akhir yang jenuh. Perkolat dipisahkan dan dipekatkan.
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya dalam jangka waktu tertentu dimana pelarut akan terkondensasi pada pendingin menetes jatuh kembali ke labu. Keuntungan dari metode ini adalah digunakan untuk mengekstraksi sampel-sampel yang mempunyai tekstur kasar dan tahan pemanasan langsung. Kerugiannya adalah membutuhkan volume total pelarut yang besar (Mayo, et al., 1955; Landgrebe, 1982).
4. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet di mana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel dan mengisi bagian tengah alat soklet. Tabung sifon juga terisi dengan larutan ekstraksi dan ketika tinggi cairan mencapai bagian atas tabung sifon, larutan tersebut akan kembali ke dalam labu. Keuntungan metode ini adalah dapat digunakan untuk sampel dengan tekstur yang lunak dan tidak tahan terhadap pemanasan secara langsung, pelarut yang digunakan lebih sedikit, pemanasannya dapat diatur (Mayo, et al., 1955; Landgrebe, 1982).
5. Digesti
6. Infundasi
Infus adalah ekstraksi dengan pelarut air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98ºC) selama waktu tertentu (15-20 menit).
Dekok adalah infus pada waktu yang lebih lama (≥30 menit) dan temperatur sampai titik didih air.
2.3.1 Ekstraksi cair-cair
Ekstraksi cair-cair merupakan suatu teknik yang mana suatu larutan (biasanya dalam air) dibuat bersentuhan dengan suatu pelarut kedua (biasanya pelarut organik), yang pada hakikatnya tidak tercampurkan, pada proses ini terjadi pemindahan satu atau lebih zat terlarut (solute) kedalam pelarut yang kedua (Bassett, dkk., 1994).
Pemisahan yang dapat dilakukan bersifat sederhana, bersih, cepat, dan mudah, yang dapat dilakukan dengan cara mengocok-ngocok dalam sebuah corong pisah selama beberapa menit (Bassett, dkk., 1994). Analit-analit yang mudah terekstraksi dalam pelarut organik adalah molekul-molekul netral yang berikatan secara kovalen dengan substituen yang bersifat nonpolar atau agak polar. Sementara itu senyawa-senyawa yang mudah mengalami ionisasi dan senyawa polar lainnya akan tertahan dalam fase air (Rohman, 2007).
2.4 Kromatografi
Kromatografi adalah suatu metode yang digunakan untuk pemisahan komponen cuplikan yang komponen-komponenya terdistribusi antara dua fase, salah satunya diam dan yang lainnya bergerak. Saat ini, kromatografi merupakan teknik pemisahan yang paling umum dimanfaatkan untuk melakukan analisis, baik analisis kualitatif (analitik) maupun kuantitatif dan preparatif dalam bidang farmasi (Rohman, 2007).
2.4.1 Kromatografi lapis tipis
Penggunaan umum KLT adalah untuk menentukan banyaknya komponen dalam campuran, identifikasi senyawa, memantau proses reaksi, menentukan efektifitas pemurnian, menentukan kondisi yang sesuai untuk kromatografi kolom, serta untuk memantau kromatografi kolom, melakukan screening sampel untuk obat (Gritter, et al., 1991)
mm. Ukuran partikel fase diam yang lebih kecil ini akan menyebabkan semakin besarnya jumlah lempeng teoretis (N), karenanya pemisahan menjadi lebih efisien (Rohman, 2009).
Fase gerak adalah medium angkut, terdiri dari satu atau beberapa pelarut, yang bergerak di dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya kapiler (Stahl, 1985). Pemilihan sistem pelarut yang dipakai didasarkan atas prinsip like dissolve like, artinya untuk memisahkan sampel yang bersifat non polar digunakan sistem pelarut yang bersifat non polar juga. Proses pengembangan akan lebih baik bila ruangan pengembangan tersebut telah jenuh dengan uap sistem pelarut (Adnan, 1997).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan harga Rf atau hRf. Harga Rf didefenisikan sebagai perbandingan antara jarak titik pusat bercak dari titik awal dan jarak garis depan dari titik awal.
Rf = jarak ti tik pusat bercak dari titik awal jarak garis depan pelarut dari titik awal
Harga Rf berkisar antara 0,00 sampai 1,00 dan dituliskan dua desimal. hRf adalah angka Rf dikalikan faktor 100 (h), menghasilkan nilai berjangka 0 sampai 100. Jika dipilih 10 cm sebagai jarak pengembangan, maka jarak rambat suatu senyawa (titik awal-pusat bercak dalam cm) x 10 menghasilkan angka hRf (Stahl, 1985).
Pada TLC (Thin Layer Chromatography) dengan metode pengembangan berganda dimana garis depan pelarut tidak dapat diukur maka dapat dipakai harga Rx sebagai jarak pengembangan senyawa.
Harga Rx dapat lebih besar daripada 1. Tidak satupun dari harga Rf atau Rx yang mempunyai harga konstan tetapi harga Rx lebih reproducible daripada harga Rf (Fried dan Sherma, 1999).
Faktor-faktor yang mempengaruhi harga Rf pada KLT, antara lain: struktur kimia dari senyawa yang dipisahkan, sifat dari penyerap, dan derajat aktivitasnya, tebal dan kerataan lapisan penyerap, derajat kemurnian fase gerak, derajat kejenuhan uap pengembang pada bejana, jumlah cuplikan dan suhu (Sastrohamidjojo, 1991).
2.4.2 Kromatografi Lapis Tipis Preparatif
dikeringkan dan kemudian dimasukkan lagi ke dalam bejana. Bergantung pada nilai Rf pita, proses ini dapat diulang beberapa kali. Kebanyakan penjerap KLTP mengandung indikator fluoresensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok dari plat dengan spatula atau pengerok berbentuk tabung yang disambungkan ke pengumpul vakum. Senyawa diekstraksi dari penjerap dengan pelarut polar (sekitar 5 ml pelarut untuk 1 g penjerap). Ekstrak disaring melalui ‘frit’ kaca berkeporian 4 dan kemudian melalui membran 0,2 - 0,45 µm (Hostettmann, dkk., 1995).
2.4.3 Kromatografi Lapis Tipis Dua Arah
KLT dua arah atau dua dimensi bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia yang hampir sama sehingga nilai Rf juga hampir sama. Selain itu, dua sistem fase gerak yang sangat berbeda polaritasnya dapat digunakan secara berurutan pada suatu campuran tertentu sehingga memungkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama. Penotolan dilakukan di salah satu sudut lapisan lempeng tipis dan mengembangkannya sebagaimana biasa dengan eluen pertama, kemudian lempeng kromatografi dikeluarkan dari chamber
2.4.4 Kromatografi Kolom
Penggunaan kolom besar merupakan metode kromatografi untuk pemisahan campuran dalam jumlah besar (lebih dari 1 g). Campuran yang akan dipisahkan berupa pita pada bagian atas kolom penyerap. Fase gerak dialirkan melalui kolom oleh gaya berat atau tekanan. Pita campuran bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi (Gritter, dkk., 1991)
Ukuran partikel penyerap untuk kolom dengan gaya tarik bumi biasanya lebih besar daripada untuk KLT, yaitu 63-250 µm; sedangkan untuk kolom dengan tekanan biasanya lebih kecil daripada untuk KLT (Gritter, dkk., 1991; Hostettman, dkk., 1995).
Karena memerlukan waktu yang lama dan bahan yang cukup banyak, perlu dipastikan campuran pelarut yang terbaik untuk pemisahan. Masalah ini dapat dipecahkan melalui tiga pendekatan, antara lain, penelusuran pustaka, penerapan data KLT dan pemakaian elusi landaian (Gritter, dkk., 1991).
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) digabungkan, diuapkan dengan tekanan rendah. Jika pelarut dan penyerap murni, maka fraksi-fraksi pun murni. Namun mungkin masih diperlukan penghabluran ulang atau penyulingan kasar untuk memperoleh senyawa murni (Gritter, dkk., 1991)
2.4.5 Kromatografi Cair Vakum
kromatografi dikemas kering dalam keadaan vakum agar diperoleh kerapatan kemasan maksimum. Vakum dihentikan, pelarut yang kepolarannya rendah dituangkan ke permukaan penjerap lalu divakumkan lagi. Kolom dihisap sampai kering dan sekarang siap dipakai.
Sampel dilarutkan dalam pelarut yang cocok, dimasukkan langsung pada bagian atas kolom atau pada lapisan penjerap dan dihisap perlahan-lahan kedalam kemasan dengan memvakumkannya. Kolom dielusi dengan campuran pelarut yang cocok, mulai dari pelarut yang kepolarannya rendah lalu kepolarannya ditingkatkan perlahan-lahan, kolom dihisap sampai kering pada setiap pengumpulan fraksi. Oleh karena itu kromatografi cair vakum menggunakan tekanan rendah untuk meningkatkan laju aliran fase gerak (Hostettmann, dkk., 1995).
2.5 Spektrofotometri Ultraviolet
Spektrum ultraviolet merupakan plot (curve) antara panjang gelombang serapan larutan sampel dan intensitas serapan (absorbansi). Panjang gelombang serapan merupakan ukuran pemisahan tingkatan energi dari elektron dari orbital-orbital yang berbeda. Intensitas dari berkas cahaya sebanding dengan jumlah foton per detik yang melalui satu satuan luas penampang (Sastrohamidjojo, 1991).
serapan (Silverstein, et al., 1986). Baik radiasi ultraviolet maupun tampak berenergi lebih tinggi daripada radiasi inframerah. Absorbsi cahaya ultraviolet atau tampak menyebabkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar, highest occupied molecular orbital (HOMO) berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi lowest unoccupied molecular orbital (LUMO). Transisi ini memerlukan 40 - 300 kkal/mol, energi yang diserap selanjutnya terbuang sebagai kalor, sebagai cahaya, atau tersalurkan dalam reaksi kimia (isomerisasi atau reaksi-reaksi radikal bebas) (Supratman, 2010).
Kegunaan spektrofotometri ultraviolet terletak pada kemampuannya mengukur jumlah ikatan rangkap atau kojugasi aromatik di dalam suatu molekul. Jumlah ikatan rangkap atau konyugasi tersebut disebabkan oleh transisi π →
π*dan n → π* dari sistem konyugasi pada suatu molekul.
2.6 Spektrofotometri inframerah
Spektrofotometri inframerah merupakan teknik spektrofotometri tercepat dan termurah yang digunakan dalam kimia organik.Sampel dapat berupa padatan, cairan atau gas, dan dapat diukur dalam larutan dengan KBr atau minyak mineral.Kemudian spektrum dapat diperoleh hanya dalam beberapa menit dari material murni parsial dengan tujuan memberikan indikasi bahwa reaksi yang terjadi seperti yang diinginkan (Cooper, 1980). Identifikasi senyawa yang tidak diketahui gugus fungsinya dapat diuji struktur inframerahnya, kemudian dideteksi menggunakan data korelasi (Sastrohamidjojo, 1991).
merah, energi yang diserap menyebabkan kenaikan dalam amplitude getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi. Energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi infra merah pada bilangan gelombang yang berlainan. Dengan demikian spektrofotometri infra merah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul.
2.7 Spektrometri Massa
Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian oleh perubahan dalam momen dipol pada saat energi diserap. Ikatan non polar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangakan ikatan polar seperti (O-H, N-H dan C=O) menunjukkan absorpsi yang lebih kuat (Supratman, 2010).
Spektrometer massa adalah suatu instrumen yang memiliki prinsip yang berbeda dengan instrumen lainnya. Dalam sebuah spektrometer, suatu sampel dalam keadaan gas dengan elektron berenergi cukup untuk mengalahkan potensial ionisasi pertama senyawa tersebut (potensial ionisasi kebanyakan senyawa organik antara 185 - 300 kkal/mol) (Supratman, 2010).
berbentuk radikal bebas maupun ion-ion lain. Dalam sebuah spektrometer massa yang khas, fragmen yang bermuatan positif ini akan dideteksi. Oleh karena itu, struktur dan massa fragmen memberikan petunjuk mengenai struktur molekul induknya. Juga digunakan untuk menuntukan bobot molekul suatu senyawa dari spektrum massanya (Supratman, 2010).
2.8 Spektrometri Resonansi Magnetik Inti (Nuclear magnetic Resonance) Pada pengukuran fisikokimia resonansi magnetik inti (nuclear magnetic resonance) lebih popular digunakan dibandingkan instrumen lainnya. Penerapannya tidak terbatas dari senyawa organik yang sederhana tetapi hingga ke biopolimer yang sangat komplek seperti protein dan asam nukleat. Resonansi magnetik inti berhubungan dengan sifat magnet dari inti atom. Spektroskopi NMR didasarkan pada penyerapan gelombang radio oleh inti tertentu dalam molekul organik, bila molekul ini berada dalam magnet yang sangat kuat dan homogen (Supratman, 2010).