MODUL PEMBELAJARAN
KELAS XI PROGRAM MIA
Materi:
LAJU REAKSI
*KHUSUS UNTUK DIPELAJARI
Oleh:
1
LAJU REAKSI
Pernahkah kalian berkendara menggunakan motor atau angkutan umum? Kadang apabila jalan sedang kosong seperti pagi hari, kendaraan yang kita tumpangi akan dijalankan dengan kecepatan tinggi (tanpa melanggar batas kecepatan maksimum tentunya), tapi apabila macet total, jangan harap bisa ngebut, jalan saja susah bukan? Nah, dengan demikian kondisi kemacetan lalu lintas mempengaruhi kecepatan kendaraan kita.
Apa hubungannya dengan Kimia? Peristiwa kecepatan laju kendaraan itu sama dengan yang terjadi pada reaksi kimia. Dalam suatu peristiwa kimia, terkadang reaksi dapat berjalan cepat, namun terkadang berjalan lambat. Apa yang membedakannya? Sudah barang tentu kondisi ketika reaksi itu berlangsung merupakan faktor utama dalam reaksi kimia.
Pernahkah kalian bermain BOM?
Oh, jangan... kita perkecil saja skalanya menjadi kembang api. Nah, pernah kan kalian memainkan benda itu? Terutama di hari lebaran Idul Fitri pasti langit akan ramai dengan bunga-bunga indah hasil ledakan kembang api. Jika sumbu kembang api yang kalian mainkan hanya sepanjang 1 cm tersulut, maka akan terjadi ledakan sebelum sempat kalian lemparkan ke langit (*PERHATIAN: jangan pernah meniru adegan ini). Dengan demikian, reaksi ledakan tergolong cepat bukan?
Coba bandingkan dengan pagar besi rumah kalian yang tidak dicat. Berbulan-bulan lamanya baru muncul tanda-tanda perkaratan. Artinya proses perkaratan besi tidak secepat proses ledakan kembang api.
2
menjadi empuk, dan lain segainya. Ilmu kimia berperan dalam menyesuaikan kondisi yang diinginkan dari proses-proses tersebut. Bagaimana caranya agar gula yang dilarutkan dalam minuman favorit kita dapat melarut dengan cepat? Bagaimana caranya agar kulit mulus remaja kita tidak cepat menua? Bagaimana mempercepat pematangan buah mangga yang masih mentah? Bagaimana membuat daging gepuk yang amat sangat empuk tanpa harus menumbuk-numbuknya seharian?
Untuk menjawab semua permasalahan itu kita harus memahami terlebih dahulu faktor-faktor yang seperti apa saja yang menyebabkan kondisi suatu reaksi memungkinkannya berjalan cepat atau lambat. Baiklah, sebelum kita membahas lebih lanjut faktor-faktor yang mempengaruhi laju reaksi, baiklah marilah kita pahami penjelasan berikut.
A. Faktor-faktor yang Mempengaruhi Laju Reaksi
1. Konsentrasi Zat
Dalam suatu reaksi kimia tentunya kita akan berurusan dengan larutan. Ketika membuat larutan kita tidak memakai zat yang diinginkan secara langsung, tetapi biasanya dilarutkan ke dalam suatu pelarut terlebih dahulu. Oleh karena itu, kita memerlukan besaran khusus yang disebut KONSENTRASI. Konsentrasi menyatakan kepekatan dari suatu larutan (Tim Konsultan Kimia FPTK UPI, 2004).
3
Konsentrasi dapat dinyatakan dengan berbagai macam satuan, seperti mol, molaritas, molalitas, normalitas, dll. Tapi untuk saat ini kita akan fokus pada MOLARITAS.
a) Kemolaran/Molaritas (M)
Kemolaran atau molaritas disimbolkan dengan “M” merupakan satuan
konsentrasi larutan yang digunakan dalam laju reaksi. Molaritas adalah satuan konsentrasi larutan untuk menyatakan jumlah mol zat terlarut
tiap liter larutan. Secara matematika, molaritas dapat diungkapkan dengan persamaan berikut:
Atau bisa juga dicari berdasarkan persamaan berikut:
Apabila nilai molaritas suatu larutan tinggi, artinya konsentrasi yang dimiliki oleh larutan tersebut besar, sehingga larutan tersebut merupakan
Molaritas (M) = 𝑗𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙𝑧𝑎𝑡𝑡𝑒𝑟𝑙𝑎𝑟𝑢𝑡
Keterangan: m = massa zat terlarut (gram) n = jumlah mol zat terlarut (mol) V = volume larutan (mL)
INGAT!!!
Satuan
volume
yang digunakan pada rumus2
adalahmL
1
4
larutan yang pekat. Semakin pekat suatu larutan, maka pengaruhnya pada laju reaksi akan semakin cepat dibandingkan dengan larutan yang encer.
Contoh: Sebanyak 190,6 gram MgCl2 dilarutkan dalam air hingga volume
larutan menjadi 100 mL. Berapakah kemolaran larutan tersebut? Diketahui Mr MgCl2 = 95,3
PEMBAHASAN:
Cara 1: ubah satuan berat (gram) ke dalam mol, kemudian hitung kemolaran larutannya.
n MgCl2
=
1 0 6
5 3
=
Ubah satuan Volume (mL) ke dalam Liter: 100 mL = 0,1 L
Jadi, M MgCl2 = =
=
Cara 2: langsung masukkan ke dalam rumus kedua. M MgCl2 =
×
=
×
=
2. Suhu Reaksi
Kalian pernah menyeduh kopi? Dengan apa kalian menyeduhnya?
Yap! Benar sekali! Dan pastinya lagi kalian akan menyeduh kopi dengan air mendidih agar rasa dan aroma kopi menjadi terasa lebih nikmat.
Ya pastinya pakai
5
Selain itu, tahukah kalian, air panas mampu melarutkan serbuk kopi dengan lebih cepat dibandingkan apabila kalian melarutkannya dengan air dingin. Peristiwa ketika kalian menyeduh kopi merupakan pelarutan. Indikator terjadinya reaksi antara air dengan kopi adalah perubahan warna air dari tidak berwarna menjadi coklat atau hitam.
Laju reaksi antara air dengan serbuk kopi dapat dipercepat dengan meningkatkan suhu pelarutnya, yakni air. Hal inilah yang menyebabkan kopi dapat melarut lebih cepat dalam air panas.
3. Luas Permukaan Bidang Sentuh
Kalian pernah memakan daging sapi? Pada waktu kalian memasaknya, misalkan untuk dijadikan gulai, kalian tentunya tidak akan memasak gelondongan daging sapi begitu saja tanpa memotong-motong terlebih dahulu, bukan? Atau ketika kalian membuat tape, pada saat peragian pasti ragi yang digunakan akan dihancurkan terlebih dahulu sebelum ditaburkan pada singkong, kan?
6
Coba saja bayangkan, berapa lama waktu yang akan kalian gunakan untuk memasak gulai sapi apabila daging yang kalian gunakan tidak tidak dipotong-potong terlebih dahulu?
Semakin kecil ukuran suatu materi, mengandung arti memperluas permukaan bidang sentuh materi tersebut. Yang dimaksud luas permukaan
dalam reaksi kimia adalah luas permukaan zat-zat pereaksi yang bersentuhan untuk menghasilkan reaksi. Dengan demikian, semakin kecil suatu materi, luas permukaan bidang sentuh akan semakin besar, sehingga reaksi akan lebih cepat berlangsung.
4. Katalis
Terkadang dengan memperbesar konsentrasi, suhu, maupun luas permukaan bidang sentuh saja kurang efisien, sehingga perlu ada cara lain yang lebih cepat tapi menguntungkan. Adakah cara seperti itu?
Benar sekali!! Terima kasih profesor!
Ya, dengan menambahkan katalis pada suatu reaksi kimia, maka laju reaksi akan berjalan lebih cepat.
Tentu saja ada! Yakni dengan menambahkan
KATALIS
!!!
Tunggu sebentar,
7
Katalis merupakan zat yang mampu mempengaruhi laju reaksi. Dalam melakukan aksinya, katalis akan ikut bereaksi dengan para reaktan, tapi di akhir proses reaksi katalis itu akan terpisah kembali. Yaah... kasarnya, kalian bisa membayangkan katalis itu seperti mak comblang dalam mempertemukan pasangan suami-istri :>
Sekarang kalian paham, bagaimana keterlibatan katalis dalam reaksi kimia melalui ilustrasi di atas? Nah, sekarang kita bahas, bagaimana
kinerja katalis dalam mempercepat reaksi. Anggaplah hal ini sebagai suatu peristiwa ketika akan menjatuhkan seseorang dari tebing. Agak kejam sih, memang... tapi... perhatikan dulu saja ilustrasi berikut:
Katalis
Selamat berbahagia kalian berdua...
Di awal proses reaksi, katalis berperan mempertemukan
antar “reaktan” dengan cara ikut bereaksi
Tapi, di akhir reaksi, katalis dengan coolnya berpisah dengan
pasangan yang telah
dipertemukan menjadi “produk”
Reaktan
8
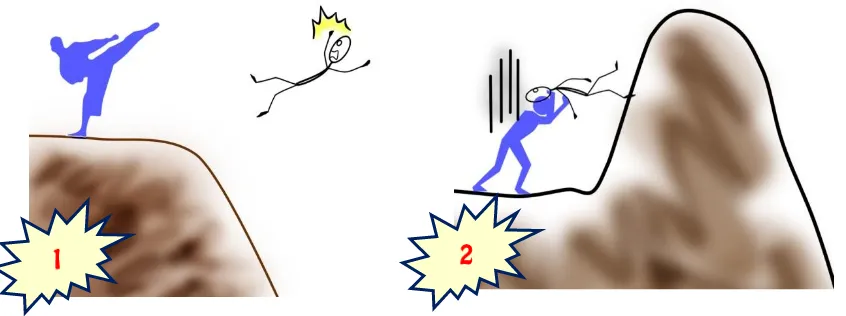
Jika kalian berperan sebagai “si biru” dalam kedua gambar tersebut,
coba bandingkan, gambar manakah yang sepertinya paling mudah ketika kalian akan menjatuhkan “si stikman”? Pastinya kalian akan memilih yang
Gambar 1 bukan? Jika kita misalkan saat “si stikman” jatuh adalah saat
berlangsungnya reaksi, maka tentu saja Gambar 1 mencerminkan reaksi lebih mudah terjadi. Dengan sedikit tendangan saja, “si stikman” langsung jatuh ke jurang, sedangkan pada Gambar 2, “si biru” harus melewati
“gunungan” terlebih dahulu sebelum “si stikman” jatuh. Dengan energi yang sama, besar kemungkinan “si stikman” malah akan kembali lagi, bukannya jatuh ke jurang.
Baiklah... jika kita fokuskan perhatian pada Gambar 2, bagaimana caranya agar dengan energi yang sama, “si biru” dapat menjatuhkan “si
stikman” ke jurang? Nah, dalam laju reaksi ada yang dikenal dengan
ENERGI AKTIVASI (Ea), yaitu energi minimum yang diperlukan supaya
reaksi dapat berlangsung. Pada Gambar 2 “gunungan” yang menghambat
jatuhnya “si stikman” adalah “Ea”.
Nah, dengan menambahkan katalis, reaksi pada Gambar 2 dapat
dipercepat dengan cara “memotong” gunungan penghambat. Perhatikan
9
Jadi, begitulah ceritanya... akhirnya “si biru” dapat dengan mudah menjatuhkan “si stikman” ke jurang dengan bantuan katalis. Dengan kata lain, fungsi penambahan katalis
disini adalah mempercepat terjadinya reaksi dengan cara menurunkan Energi Aktivasi. Lihat saja, gunungan yang awalnya tinggi
(Ea1), dengan ditambahkan katalis menjadi
lebih rendah (Ea2). Dengan demikian, reaksi
akan berlangsung lebih mudah, bukan?
Ok! Karena “si stikman” sudah jatuh, selesailah pembahasan kita dalam faktor-faktor yang mempengaruhi laju reaksi...
B. Lantas Bagaimana Cara Menyatakan Laju Reaksi???
Untuk menjawab pertanyaan tersebut, mari kita pahami terlebih dahulu definisi Laju Reaksi berikut:
Yeah! Ini jauh lebih gampang!!
+
KatalisIyaa.. tapi jangan aku terus yang dijatuhin dooong
10
Laju reaksi dinyatakan sebagai laju pengurangan konsentrasi molar
pereaksi atau laju penambahan konsentrasi molar produk dalam kurun waktu tertentu. Dalam reaksi kimia yang sedang berlangsung, zat-zat pereaksi lambat laun akan berkurang, sebagai gantinya produk akan terus bertambah seiring dengan berkurangnya pereaksi tersebut. Maka dari itu, laju reaksi dirumuskan sebagai berikut:
Keterangan:
R = reaktan (pereaksi) P = produk (hasil reaksi) v = laju reaksi
Δ[R] = perubahan konsentrasi molar pereaksi
Δ[P] = perubahan konsentrasi molar produk
Satuan untuk laju reaksi adalah M/detik atau M detik‒1.
Contoh: Nyatakan persamaan laju reaksi untuk reaksi berikut, 2SO2(g) + O2(g) → 2SO3(g)
Laju reaksi dinyatakan sebagai laju pengurangan konsentrasi molar SO2,
11
v
O2=
M/detik atau
v
SO3=
M/detik
Sesuai dengan perbandingan koefisien reaksinya, laju pembentukan setengah SO3 adalah setengah dari laju pengurangan SO2 atau satu dari
laju pengurangan O2. Oleh karena itu dapat ditulis sebagai berikut:
C. Persamaan Laju Reaksi dan Orde Reaksi
Laju reaksi dapat dinyatakan dalam persamaan yang ditentukan berdasarkan konsentrasi awal setiap zat, dipangkatkan orde reaksinya. Orde reaksi hanya dapat diperoleh melalui data percobaan. Jadi, jangan heran jika setiap menemukan soal orde reaksi kalian menemukan tabel data hasil percobaan... Perhatikan persamaan reaksi berikut:
pA + qB → rC + sD Persamaan laju reaksi untuk reaksi tersebut adalah:
1
2vSO2= vO2 = 1 2vSO3
Untuk mengerjakan soal seperti ini, perhatikan terus tanda negatif (‒) setiap pereaksi dan positif (+) setiap produk, ya!
v
=
k
[A]
x
[B]
y
konstanta laju reaksi
orde reaksi zat A
12
Setiap laju reaksi memiliki nilai k tertentu bergantung pada sifat pereaksi. Semakin besar nilai k, maka reaksi akan semakin cepat berlangsung, begitupun sebaliknya. Satuan nilai k berbeda-beda tergantung nilai orde reaksinya atau nilai pangkat dari persamaan itu, dan selalu positif, bisa berupa bilangan bulat maupun pecahan.
Baiklah, mari kita bahas contoh soal saja kalau begitu...
Karena untuk menentukan orde reaksi harus melalui eksperimen, maka kita yang sedang tidak berada dalam laboratorium diberi kemudahan yakni cukup memperoleh data hasil eksperimen. Misalkan ada data eksperimen untuk reaksi 2A + B2 → 2AB adalah sebagai berikut:
Percobaan ke
Konsentrasi (M) Laju Reaksi (v) (M/detik)
Nah, dari tabel tersebut kita akan menentukan persamaan laju reaksinya.
Hal pertama yang harus dilakukan adalah menentukan orde reaksinya. Misalkan persamaan laju reaksinya adalah: v = k[A]x[B2]y kita akan
mencari nilai x dan y.
Untuk mencari nilai x (orde reaksi A), kita perlu membandingkan data. Caranya, cari data konsentrasi B yangsama. Dari tabel di atas, kiat peroleh data konsentrasi B yang sama adalah data percobaan 4 dan 5.
13
Karena ini perbandingan, maka v percobaan 4 dan 5 juga dibandingkan. Penulisannya seperti berikut:
4
Karena nilai konsentrasi B sama, maka bisa dicoret:
24 54
=
0 2 0 1 0 3 0 1
Angka 24 dan 54 kita perkecil dengan dibagi 6. Sedangkan 0,2 dan 0,3 nilainya akan sama dengan ini:
4
=
2 3 bisa juga ditulis sebagai berikut:4
= (
23
)
, sehingga nilai x = 2Selanjutnya kita akan mencari nilai y (orde reaksi B). Sebelumnya kita cari data konsentrasi A yang sama dari tabel, yakni pada data percobaan 1 dan 2. Sebenarnya data 3 juga sama, tapi karena untuk membandingkan, hanya perlu dua data saja, maka kita sepakat dulu mengambil data 1 dan 2. Buat perbandingannya seperti sebelumnya:
1
Karena nilai konsentrasi A sama, maka bisa dicoret:
14 data hasil percobaan, misal data percobaan 1:
v1 = k[A]2[B2]
Jadi, persamaan laju reaksi lengkapnya adalah
v
= 6000/detik.M
2[A]
2[B
2]
Akhirnya... selesai sudah pembahasan kita mengenai laju reaksi kali ini. Agar kalian cekatan dalam mengerjakan soal, teruslah berlatih dengan soal-soal yang lebih baru. Jika kalian menemukan kesulitasn,
tanyakan pada orang-orang yang kalian percaya dapat menambah kemampuan kalian. Dan yang paling PASTI adalah
15
DAFTAR PUSTAKA
Tim Konsultan Kimia FPTK UPI. (2004). Kinetika Kimia. Jakarta: DEPDIKNAS. Partana, Crys dan Antuni Wiyarsi. (2009). Mari Belajar Kimia. Jakarta:
DEPDIKNAS.
Purba, Michael. (2009). Kimia. Jakarta: Erlangga.
Sunarya, Yayan dan Agus Setiabudi. (2009). Mudah dan Aktif Belajar Kimia. Jakarta: DEPDIKNAS.