DAYA ANTIBAKTERI EKSTRAK ETANOL, FRAKSI ETIL ASETAT, DAN PERASAN DAUN LIDAH MERTUA (Sansevieria trifasciata Prain)
TERHADAP BAKTERI Staphylococcus aureus ATCC 25923 DAN Pseudomonas aeruginosa ATCC 27853
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Palma Aprilia Talino Batuah
NIM :108114149
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
DAYA ANTIBAKTERI EKSTRAK ETANOL, FRAKSI ETIL ASETAT, DAN PERASAN DAUN LIDAH MERTUA (Sansevieria trifasciata Prain)
TERHADAP BAKTERI Staphylococcus aureus ATCC 25923 DAN Pseudomonas aeruginosa ATCC 27853
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Palma Aprilia Talino Batuah
NIM :108114149
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“There is only one way to learn. It’s through action.
Everything you need to know you have learn through your
journey.
”
Paulo Coelho
Kupersembahkan karya ini untuk :
Tuhan Yesus,
Ayah dan ibu, kak icha, dek ria, sahabat,
v PRAKATA
Puji dan syukur kepada Tuhan yang Maha Esa atas berkat, kasih dan
kesempatan-Nya, sehingga penulis dapat menyelesaikan skripsi berjudul “DAYA ANTIBAKTERI EKSTRAK ETANOL, FRAKSI ETIL ASETAT, DAN PERASAN DAUN LIDAH MERTUA (Sansevieria trifasciata Prain) TERHADAP BAKTERI Staphylococcus aureus ATCC 25923 DAN Pseudomonas aeruginosa ATCC 27853”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Strata Satu Farmasi (S. Farm) program studi
fakultas farmasi Universitas Sanata Dharma, Yogyakarta.
Dalam proses pengerjaan skripsi ini, penulis mendapat bimbingan,
dukungan, kritik dan saran dari berbagai pihak. Oleh karena itu, penulis ingin
mengucapkan terima kasih sedalam-dalamnya kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma, Yogyakarta.
2. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Pembimbing dan Penguji
yang telah memberi bimbingan, dukungan, saran dan meluangkan waktu
untuk berdiskusi bersama Penulis dalam proses pembuatan skripsi ini.
3. Dosen Penguji, Bapak Prof. Dr. C. J. Soegihardjo, Apt. yang telah
meluangkan waktunya untuk menguji dan memberikan bimbingan, kritik, dan
vi
4. Dosen Penguji, Ibu Dr. Erna Tri Wulandari, M. Si., Apt. yang telah
meluangkan waktunya untuk menguji dan memberikan bimbingan, kritik, dan
saran yang berhubungan dengan skripsi penulis.
5. Ibu Dr. Sri Hartati Yuliani, M.Si., Apt selaku Kepala Laboratorium Fakultas
Farmasi Universitas Sanata Dharma.
6. Ibu Christophori Maria Ratna Rini Nastiti, M. Pharm., Apt., selaku Dosen
Pembimbing Akademik yang telah membimbing dan memberikan semangat
kepada Penulis untuk menyelesaikan skripsi Penulis.
7. Bapak Wagiran, Bapak Mukminin, Mas Sigit, Mas Andri beserta Laboran dan
karyawan lain yang telah membantu Penulis dalam menyelesaikan skripsi ini.
8. Ibu Maria Dwi Jumpowati, S. Si. yang telah bersedia menyediakan waktunya
untuk berdiskusi, memberikan saran, dan semangat untuk Penulis.
9. Teman-teman FKK B 2010 Farmasi Universitas Sanata Dharma atas
dukungan, semangat, dan canda tawa yang selalu menyeimbangkan
kejenuhan yang dialami Penulis dalam menyelesaikan skripsi ini.
10.Teman-teman seperjuangan di Laboratorium Mikrobiologi dan Laboratorium
Farmakognosi Fitokimia yang selalu menemani dan saling mendukung untuk
menyelesaikan skripsi ini.
11.Kakak, Adik, dan teman-teman senasib sepenanggungan angkatan 2010 di
Asrama Syantikara yang memberikan warna-warni kehidupan bagi Penulis
vii
12.Semua pihak yang tidak dapat Penulis sebutkan satu-persatu yang telah
membantu secara langsung maupun tidak langsung demi kelancaran skripsi
ini.
Penulis menyadari dalam penulisan naskah skripsi ini masih terdapat
kekurangan. Penulis membuka diri terhadap kritik dan saran yang membangun
agar skripsi ini dapat menjadi lebih baik. Akhir kata, Penulis berharap agar skripsi
ini dapat berguna dan bermanfaat terutama demi kemajuan ilmu pengetahuan
khususnya ilmu Farmasi, lebih khusus lagi dalam bidang Mikrobiologi Farmasi.
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PRAKATA ... v
PERNYATAAN KEASLIAN KARYA ... viii
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvii
ABSTRACT ... xviii
BAB I. PENGANTAR ... 1
A. LATAR BELAKANG ... 1
1. Rumusan masalah... 4
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 6
B. TUJUAN PENELITIAN ... 6
1. Tujuan umum ... 6
xi
BAB II. PENELAAHAN PUSTAKA ... 8
A. Infeksi Luka Bakar ... 8
B. Tanaman Sansevieria ... 9
C. Ekstraksi ... 11
D. Kromatografi Lapis Tipis ... 13
E. Senyawa Fitokimia ... 15
F. Staphylococcus aureus ... 18
G. Pseudomonas aeruginosa... 19
H. Metode Uji Kepekaan Antibakteri ... 21
I. Landasan Teori ... 22
J. Hipotesis ... 23
BAB III. METODE PENELITIAN ... 24
A. Jenis dan Rancangan Penelitian... 24
B. Variabel dan Definisi Operasional... 24
1. Variabel penelitian ... 24
2. Definisi operasional ... 25
C. Bahan Penelitian ... 26
D. Alat Penelitian ... 26
E. Tata Cara Penelitian ... 27
1. Determinasi daun S. trifasciata ... 27
2. Pengumpulan bahan daun S. trifasciata ... 27
3. Pembuatan ekstrak daun S. trifasciata dengan metode maserasi ... 27
xii
5. Pembuatan perasan daun S. trifasciata ... 28
6. Preparasi mikroba uji ... 28
7. Sterilisasi peralatan dan media ... 29
8. Pengujian potensi antibakteri secara metode difusi sumuran ... 29
9. Pengujian kepekaan antibiotik dengan menentukan nilai KHM dan KBM dengan dilusi padat ... 31
10.Uji fitokimia ekstrak daun S. trifasciata ... 32
11.Kromatografi Lapis Tipis (Uji Penegasan Senyawa Flavonoid) ... 34
F. Analisis Hasil ... 34
BAB IV. HASIL DAN PEMBAHASAN ... 36
A. Pengumpulan Bahan dan Identifikasi Daun Sansevieria trifasciata ... 36
B. Penyiapan Bahan Daun S. trifasciata ... 37
C. Maserasi, Fraksinasi, dan Pemerasan Daun S. trifasciata ... 38
D. Pengujian Potensi Antibakteri Secara Metode Sumuran ... 41
E. Uji Fitokimia Ekstrak Etanol, Fraksi Etil Asetat dan Perasan Daun S. trifasciata ... 50
F. Uji Penegasan dengan Kromatografi lapis Tipis (KLT) ... 55
BAB V. KESIMPULAN DAN SARAN ... 59
A. Kesimpulan ... 59
B. Saran ... 59
DAFTAR PUSTAKA ... 60
LAMPIRAN ... 65
xiii
DAFTAR TABEL
Tabel I. Rendemen hasil ekstraksi, fraksinasi, dan pemerasan daun
S. trifasciata dengan pelarut etanol 96% dan etil asetat ... 40
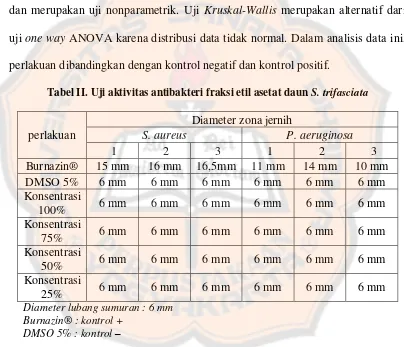
Tabel II. Uji aktivitas antibakteri fraksi etil asetat daun S. trifasciata .... 45
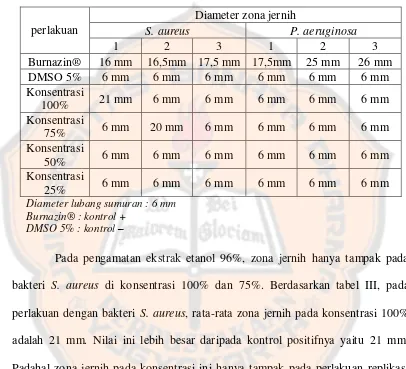
Tabel III. Uji aktivitas antibakteri ekstrak etanol daun S. trifasciata ... 46
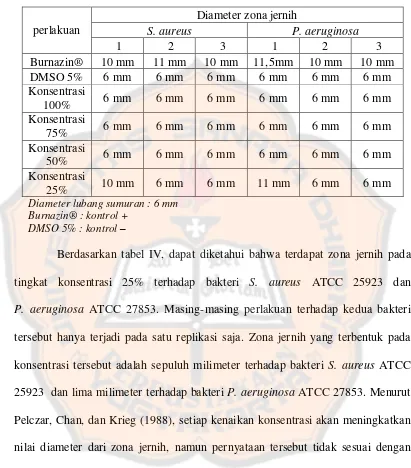
Tabel IV. Uji aktivitas antibakteri perasan daun S. trifasciata ... 48
Tabel V. Hasil uji fitokimia pada ekstrak etanol, fraksi etil asetat, dan
perasan daun S. trifasciata ... 50
Tabel VI. Hasil uji KLT pada ekstrak etanol, fraksi etil asetat
xiv
DAFTAR GAMBAR
Gambar 1. Tanaman S. trifasciata ... 37
Gambar 2. Fraksinasi dengan etil asetat ... 40
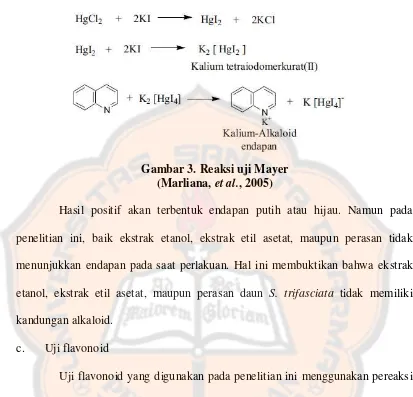
Gambar 3. Reaksi uji Mayer ... 52
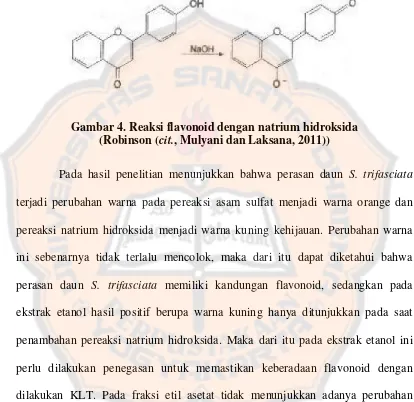
Gambar 4. Reaksi flavonoid dengan natrium hidroksida ... 53
xv
DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Determinasi Tanaman S. trifasciata Prain ... 66
Lampiran 2. Sertifikat Hasil Uji Bakteri Staphylococcus aureus ATCC 25923 67
Lampiran 3. Sertifikat Hasil Uji Bakteri
Pseudomonas aeruginosa ATCC 27853 ... 68
Lampiran 4. Foto Proses Penyiapan Bahan Daun S. trifasciata ... 69
Lampiran 5. Kontrol Kontaminasi, Kontrol pertumbuhan bakteri S. aureus,
Kontrol pertumbuhan bakteri P. aeruginosa ... 70
Lampiran 6. Foto Variasi Konsentrasi Ekstrak Etanol, Fraksi Etil Asetat, dan
Perasan Daun S. trifasciata ... 72
Lampiran 7. Hasil Uji Antibakteri Fraksi Etil Asetat Daun S. trifasciata
terhadap Staphylococcus aureus ATCC 25923 dengan
Metode Sumuran ... 73
Lampiran 8. Hasil Uji Antibakteri Fraksi Etil Asetat Daun S. trifasciata
terhadap Pseudomonas aeruginosa ATCC 27853 dengan
Metode Sumuran ... 74
Lampiran 9. Hasil Uji Antibakteri Ekstrak Etanol Daun S. trifasciata
terhadap Staphylococcus aureus ATCC 25923 dengan
Metode Sumuran ... 75
Lampiran 10. Hasil Uji Antibakteri Ekstrak Etanol Daun S. trifasciata
terhadap Pseudomonas aeruginosa ATCC 27853 dengan
Metode Sumuran ... 76
Lampiran 11. Hasil Uji Antibakteri Perasan Daun S. trifasciata
terhadap Staphylococcus aureus ATCC 25923 dengan
xvi
Lampiran 12. Hasil Uji Antibakteri Perasan Daun S. trifasciata
terhadap Pseudomonas aeruginosa ATCC 27853 dengan
Metode Sumuran ... 78
Lampiran 13. Analisis Statistik ... 79
Lampiran 14. Hasil Uji Tabung Kandungan Fitokimia ... 86
Lampiran 15. Uji Penegasan Kandungan Flavonoid dengan Kromatografi
xvii INTISARI
Luka bakar dapat menyebabkan kecacatan, ketidaknyamanan, bahkan kematian bagi penderita. Salah satu penyebab kematian bagi penderita luka bakar adalah infeksi yang disebabkan oleh bakteri Staphylococcus aureus dan
Pseudomonas aeruginosa. Tanaman Lidah Mertua (Sansevieria trifasciata Prain)
adalah salah satu tanaman hias yang memiliki banyak manfaat sebagai tanaman antibakteri karena tanaman ini memiliki kandungan fitokimia antara lain saponin, alkaloid, flavonoid, dan tanin. Penelitian ini bertujuan untuk mengetahui daya antibakteri pada tanaman S. trifasciata dengan pelarut etanol, etil asetat, dan perasan air yang selanjutnya untuk mengetahui Kadar Hambat Minimum (KHM)
dan Kadar Bunuh Minimum (KBM) terhadap bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853. Masing-masing bahan dibuat dalam konsentrasi 100%, 75%, 50%, dan 25% v/v.
Uji daya antibakteri pada ekstrak etanol, fraksi etil asetat, dan perasan
daun S. trifasciata terhadap bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853 dilakukan dengan metode difusi sumuran, untuk mengetahui perbedaan hasil diameter zona jernih tiap konsentrasi dengan kontrol negatif. Hasil penelitian menunjukkan bahwa fraksi etil asetat tidak memiliki aktivitas antibakteri pada kedua bakteri. Ekstrak etanol menunjukkan zona jernih pada bakteri S. aureus ATCC 25923 di konsentrasi 100% dan 75%. Setelah dianalisis dengan Kruskal Wallis menunjukkan bahwa tidak terdapat perbedaan aktivitas antibakteri yang bermakna antara ekstrak etanol daun S. trifasciata
dengan kontrol negatif. Pada perasan daun S. trifasciata menunjukkan aktivitas
antibakteri yang lemah pada S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853 masing-masing di konsentrasi 25%. Pada uji Kruskal Wallis terdapat perbedaan tidak bermakna antara perasan daun S. trifasciata
dibandingkan dengan kontrol negatif. Berdasarkan uji kandungan fitokimia, fraksi etil asetat tidak memiliki kandungan saponin, tanin, alkaloid, maupun flavonoid. Ekstrak etanol dan perasan daun S. trifasciata memiliki kandungan flavonoid yang dipertegas dengan uji KLT.
xviii ABSTRACT
Burn can cause disabilities, inconvenience, even death for patients. One of the leading causes of death for patients with burn was infection caused by
Staphylococcus aureus and Pseudomonas aeruginosa. Sansevieria trifasciata
Prain ornamental plants is one that has many benefits as plants antibacterial because this plant contains phytochemical saponin, alkaloid, flavonoid, and tannin. Research was meant to know antibacterial plant S.trifasciata with solvent ethanol, ethyl acetate, and juice the next to know Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concetration (MBC) against
S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853. Each items made in concentration 100%, 75%, 50%, and 25% v/v.
The antibacterial assay on ethanol extract, ethyl acetate fraction, and
juice S.trifasciata leaves against S. aureus ATCC 25923 and
P. aeruginosa ATCC 27853 was conducted using diffusion method to determine difference between diameter result each concentration with negative control. Results of the study showed that the ethyl acetate fraction does not have such antibacterial on the two bacteria. Ethanol extract shows a clear zone on
S.aureus ATCC 25923 at concentration 100% and 75% in a repetition. After that
Kruskal Wallis test shows that there is no significant difference between ethanol extract S. trifasciata leaves with negative control. In juice shows such antibacterial is weak in S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853 each in 25%, Kruskal Wallis test was not significant difference compare with negative controls. Based on phytochemical analysis, ethyl acetate fraction
S. trifasciata leaves did not contain saponin, tannin, alkaloids, and flavonoids. Ethanol extract and juice S.trifasciata leaves contains flavonoid that confirm with KLT test.
1
BAB 1 PENGANTAR
A. Latar Belakang
Indonesia merupakan negara yang memiliki banyak keanekaragaman
hayati, salah satunya tanaman. Tanaman yang tumbuh di negara Indonesia
memiliki potensi yang besar untuk dikembangkan sebagai obat dan bahan baku
obat. Penggunaan tanaman sebagai obat sudah digunakan sejak zaman dahulu dan
telah disebarkan secara turun-temurun ataupun dari mulut ke mulut. Menurut
Fajiriah, Darmawan, Sundowo, dan Artanti (2007), tanaman secara fungsional
tidak lagi digunakan sebagai penghias saja, tetapi juga sebagai tanaman obat yang
multi fungsi. Pengobatan yang dilakukan dengan tanaman dipandang sebagai
alternatif yang terjangkau sehingga banyak diminati oleh masyarakat.
Pada saat ini luka bakar menjadi masalah yang diperhatikan banyak
orang. Luka bakar adalah luka pada jaringan yang disebabkan oleh suhu panas,
kimia, elektrik, dan radiasi. Luka bakar merupakan suatu masalah karena dapat
menyebabkan ketidaknyamanan, kecacatan, dan kematian. Di United State of
America (USA) sekitar 2,5 juta orang yang menderita luka bakar memerlukan
penanganan medik setiap tahun. Lebih dari 100.000 pasien masuk rumah sakit dan
sekitar 12.000 orang meninggal karena luka bakar tiap tahun (Mayhall, 2003).
Secara umum, semua luka bakar akan segera mengalami kontaminasi
setelah cedera, baik oleh flora endogen atau organisme residen dari fasilitas
maka dapat terjadi infeksi. Infeksi merupakan salah satu penyebab kematian
pasien infeksi luka bakar yang dapat disebabkan oleh banyak hal, salah satunya
bakteri. Bakteri yang sering ditemukan pada penyakit infeksi luka bakar adalah
Staphylococcus aureus dan Pseudomonas aeruginosa (Church, Elsayed, Reid,
Winston, dan Lindsay, 2006). Stafilokokus merupakan organisme penyebab
infeksi yang paling dominan, salah satunya pada luka bakar. Menjelang akhir
tahun 1950-an, bakteri gram negatif terutama spesies Pseudomonas muncul
sebagai organisme dominan. Pseudomonas dapat menyebabkan infeksi pada luka
bakar akibat adanya penurunan daya tahan tubuh. (Soedarmo, dkk., 2008).
Salah satu alternatif terapi dalam penyembuhan infeksi luka bakar
dengan menggunakan tanaman obat yang memiliki kandungan antibakteri.
Antibakteri bekerja menghambat serta membunuh bakteri penyebab infeksi
tersebut. Keberhasilan penggunaan antibakteri dalam mengobati infeksi sering
disertai dengan terjadinya resistensi bakteri, sehingga mengurangi efektifitas
antibakteri. Sampai saat ini para peneliti berusaha untuk mengembangkan dan
memperbaharui antibakteri. Banyaknya variasi obat antibakteri diharapkan dapat
menurunkan resistensi bakteri.
Tanaman lidah mertua (Sansevieria trifasciata Prain) merupakan salah
satu tanaman hias yang sudah mulai banyak dikenal oleh hampir semua
masyarakat Indonesia. Selain sebagai tanaman hias, tanaman ini juga dikenal
sebagai tanaman antipolutan karena kemampuannya dalam menyerap polutan
berbahaya yang terdapat di udara. S. trifasciata dapat tumbuh di dalam ruangan
yaitu S. roxburghiana dan S. liberica juga telah banyak diteliti kandungan dan
manfaatnya dalam bidang kesehatan. Pada penelitian Sheela, Jeeva, Shamila,
Lekshmi dan Brindha (2012), tanaman Sansevieria jenis S. roxburghiana
memiliki kandungan kimia antara lain alkaloid, flavonoid, saponin, dan tanin yang
dapat berfungsi sebagai antibakteri. Berdasarkan penelitian dari Philip, Kaleena,
Vallivittan, dan Kumar (2011) tanaman S. roxburghiana dapat digunakan untuk
pengobatan penyakit infeksi dan diare pada manusia. Menurut Ikewuchi,
Ikewuchi, Ayalogu, dan Onyeike (2010), tanaman S. liberica memiliki kandungan
flavonoid dan saponin, selain itu juga memiliki kandungan alkaloid dan tanin
dalam jumlah yang sedikit. Sama halnya dengan tanaman S. trifasciata dimana
dalam penelitian Gitasari (2011), tanaman tersebut memiliki aktivitas dalam
menghambat pertumbuhan bakteri Staphylococcus aureus.
Pemilihan pelarut dalam ekstraksi harus berdasarkan kemampuannya
dalam melarutkan zat aktif dalam bahan tanaman yang digunakan dengan
semaksimal mungkin. Etanol dan air merupakan pelarut polar yang dapat
melarutkan senyawa polar, seperti flavonoid glikosida, tanin, dan saponin (Lei,
Wang, Zhou, dan Duan, 2002). Etil asetat merupakan pelarut yang bersifat semi
polar yang dapat melarutkan senyawa flavonoid aglikon yang bersifat kurang
polar (Pranoto, Ma’ruf, dan Pringgenies, 2012).
Berdasarkan penjelasan di atas, perlu dilakukan pembuktian lebih lanjut
untuk memberdayakan tanaman S. trifasciata dalam upaya pengembangan
antibakteri dengan pengujian daya antibakteri daun S. trifasciata dengan berbagai
berupa nilai Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum
(KBM). Pembuktian tersebut diharapkan S. trifasciata dapat dijadikan sebagai
salah satu alternatif obat antibakteri.
1. Rumusan masalah
a. Apakah ekstrak etanol, fraksi etil asetat, dan perasan daun S. trifasciata
memiliki daya antibakteri pada bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853?
b. Berapa nilai KHM dan KBM dalam ekstrak etanol, fraksi etil asetat,
dan perasan daun S. trifasciata terhadap bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian mengenai daya antibakteri ekstrak
etanol, fraksi etil asetat, dan perasan daun S. trifasciata belum pernah dilakukan.
Penelitian sebelumnya terkait dengan daya antibakteri terhadap salah satu jenis
tanaman Sansevieria, yaitu S. roxburghiana. Penelitian tentang tanaman
S. roxburghiana oleh Sheela, et al. (2012) menunjukkan bahwa daun
S. roxburghiana memiliki kandungan alkaloid, flavonoid, tanin, dan saponin. Pada
penelitian ini daun diekstraksi dengan menggunakan pelarut dietil eter, etanol, dan
aseton. Hasil uji antibakteri menunjukkan bahwa daun S. roxburghiana mampu
menghambat pertumbuhan bakteri Staphylococcus aureus, Pseudomonas
aeruginosa, Klebsiella pneumoniae, dan Escherichia coli.
Pada penelitian Philip, et al. (2011) daun dan rhizome tanaman
S. roxburghiana memiliki kandungan karbohidrat, saponin, flavonoid, fenol,
menggunakan pelarut metanol, aseton, etil asetat dan air. Hasil uji antibakteri
menunjukkan bahwa ekstrak metanol dan aseton daun S. roxburghiana
menghambat bakteri gram positif seperti Micrococcus luteus, Bacillus cereus,
Enterococcus spp., Staphylococcus aureus, dan bakteri gram negatif seperti
Proteus vulgaris, Pseudomonas aeruginosa, Pseudomonas fluorescence,
Salmonella typhi, Salmonella paratyphi, Klebsiella pneumoniae, Shigella sonnei
dan Escherichia coli, dan juga menghambat jamur yaitu Cryptococcus spp. dan
Candida albican.
Penelitian lain yang menggunakan tanaman S. trifasciata yang diteliti
oleh Gitasari (2011) menunjukkan bahwa tanaman ini hanya dapat menghambat
pertumbuhan bakteri Staphylococcus aureus saja, dan diduga metabolit lainnya
tidak menunjukkan aktivitas penghambatan pada bakteri uji lain. Penelitian ini
dilakukan 2 tahap yaitu maserasi dan dilanjutkan dengan fraksinasi menggunakan
kromatografi kolom dengan pelarut kloroform:etil asetat (1:6 v/v). Selain itu,
pengujian daya antibakteri pada penelitian tersebut menggunakan metode difusi
agar cakram (paper disk). Kandungan fitokimia yang terdapat pada ekstrak kasar
daun S. trifasciata dalam penelitian ini adalah flavonoid, steroid, dan alkaloid.
Perbedaan penelitian yang akan dilakukan dengan penelitian sebelumnya
adalah bahan tanaman Sansevieria trifasciata yang digunakan berasal dari kebun
obat Fakultas Farmasi Sanata Dharma dengan tiga perlakuan. Bahan akan
diekstraksi dengan metode maserasi dengan pelarut etanol, fraksinasi dengan
pada penelitian ini menggunakan metode difusi sumuran dan metode dilusi untuk
melihat nilai KHM dan KBM.
3. Manfaat penelitian
a. Manfaat teoretis
Penelitian ini diharapkan dapat memberikan informasi bagi ilmu
pengetahuan dalam bidang farmasi tentang khasiat tanaman S. trifasciata
sebagai tanaman antibakteri.
b. Manfaat praktis
Penelitian ini diharapkan dapat mengetahui daya antibakteri ekstrak
etanol, fraksi etil asetat, dan perasan daun S. trifasciata yang dapat
dikembangkan menjadi alternatif pengobatan penyakit infeksi luka bakar
yang disebabkan oleh bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853.
B. Tujuan Penelitian 1. Tujuan umum
Memastikan tanaman Sansevieria trifasciata sebagai tanaman yang
memiliki daya antibakteri pada bakteri S. aureus ATCC 25923 dan bakteri
P. aeruginosa ATCC 27853 untuk dapat menambah alternatif obat antibakteri.
2. Tujuan khusus
a. Mengetahui daya antibakteri ekstrak etanol, fraksi etil asetat, dan perasan
daun S. trifasciata pada bakteri S. aureus ATCC 25923 dan
b. Mengetahui nilai KHM dan KBM dalam ekstrak etanol, fraksi etil asetat, dan perasan daun S. trifasciata terhadap bakteri S. aureus ATCC 25923 dan
8
BAB II
PENELAAHAN PUSTAKA
A. Infeksi Luka Bakar
Infeksi merupakan akibat dari invasi mikroorganisme patogen ke dalam
tubuh dan reaksi jaringan yang terjadi terhadap organisme dan toksinnya.
Sebenarnya hanya ada beberapa dari beribu-ribu mikroorganisme di alam ini yang
bersifat patogen terhadap manusia. Organisme lainnya berperan sebagai flora
normal dan mereka ini menimbulkan daya tahan tubuh alamiah terhadap invasi
mikroorganisme patogen (Corwin, 2008).
Luka bakar dapat timbul akibat kulit terpapar oleh suhu tinggi, syok
listrik, atau bahan kimia. Luka bakar diklasifikasikan berdasar pada kedalaman
dan luas daerah yang terbakar. Luka bakar adalah penyebab utama morbiditas dan
mortalitas pada anak, dan sebagian besar dapat dicegah. Luka bakar yang tidak
dicegah maka akan menimbulkan komplikasi yang berarti setiap luka bakar dapat
terinfeksi yang menyebabkan cacat lebih lanjut atau kematian. Infeksi adalah
penyebab utama morbiditas dan mortalitas pada pasien yang awalnya bertahan
terhadap luka bakar luas. Infeksi luka bakar dapat disebabkan oleh agen-agen
penginfeksi salah satu contohnya adalah bakteri. Staphylococcus aureus
merupakan penyebab infeksi nosokomial paling sering pada pasien luka bakar di
rumah sakit (Corwin, 2008).
Luka bakar yang luas memengaruhi metabolisme dan fungsi setiap sel
organ tubuh memerlukan aliran darah yang adekuat, maka perubahan fungsi
kardiovaskular memiliki dampak luas pada daya tahan hidup dan pemulihan
pasien (Corwin, 2008).
B. Tanaman Sansevieria
Sansevieria trifasciata (mother-in-laws tongue) merupakan tanaman
yang telah banyak ditemukan di Indonesia yang dikenal dengan tanaman lidah
mertua. Ada juga yang menjulukinya snake plant (tanaman ular). Hal ini mungkin
dikarenakan corak beberapa jenis tanaman ini mirip dengan corak ular (Backer
dan Brink, 1968). Klasifikasi tanaman Sansevieria trifasciata Prain. adalah:
Kerajaan : Plantae
Divisi : Magnoliophyta (tumbuhan berbunga)
Kelas : Liliopsida (berkeping satu / monokotil)
Bangsa : Liliales
Suku : Agavaceae
Marga : Sansevieria
Jenis : Sansevieria trifasciata Prain.
(Plantamor, 2012)
Keragaman jenis Sansevieria memang cukup besar. Anggota genus ini
mencapai 130-140 spesies bahkan lebih dari 200 spesies. Selain itu snake plant
mudah berubah bentuk menjadi penampilan baru yang lebih stabil. Hal seperti ini
merupakan penyimpangan yang mendasari tanaman ini memiliki banyak spesies.
Saat ini diduga lebih 60 varian dihasilkan. Di Indonesia, S. trifasciata hampir
dijumpai hingga pelosok daerah. Sosok tanaman ini lebih menarik, mudah
tumbuh, dan jarang mati, meski tidak dipelihara (Purwanto, 2006).
Secara morfologi, tanaman Sansevieria pada umumnya dicirikan dengan
daun yang tebal karena kandungan airnya yang tinggi. Pada beberapa jenis
Sansevieria, daun berkedudukan seperti roset mengelilingi batang semu. Disebut
batang semu karena Sansevieria sesungguhnya tidak memiliki batang. Pada jenis
yang lain, daun berbentuk silinder. Jenis yang lain mempunyai helaian daun kaku
seperti pedang. Sansevieria merupakan tanaman monokotil sehingga memiliki
akar serabut. Selain itu, Sansevieria memiliki rhizome yang tumbuh menjalar di
atas permukaan tanah atau tumbuh di dalam tanah. Bunga Sansevieria termasuk
berumah dua yaitu benang sari dan putik terletak pada bunga yang berbeda. Bunga
Sansevieria berbau harum, terlebih pada malam hari, dan mampu bertahan sampai
tujuh hari. Biji-biji Sansevieria bersifat diploid yaitu terdapat dua embrio dalam
satu biji (Backer dan Brink, 1968).
Banyak penelitian yang telah dilakukan terhadap tanaman S. trifasciata
mengungkapkan bahwa tanaman ini memiliki banyak kandungan metabolit
sekunder. Bagian tanaman ini yang sering digunakan sebagai obat adalah daun
dan rhizome. Ekstrak daun S. trifasciata memiliki kandungan flavonoid, steroid
dan alkaloid (Gitasari, 2011). Selain itu tanaman ini juga mengandung senyawa
saponin, kardenolin dan sedikit senyawa tanin (Dewatisari, 2009). Pada penelitian
S. trifasciata mengandung senyawa alkaloid, flavonoid, saponin, terpenoid, tanin,
protein, dan karbohidrat.
Sansevieria secara umum juga memiliki peranan penting di bidang
kesehatan karena kandungan kimia yang beragam pada berbagai jenis tanaman ini.
Getah spesies tertentu dipercaya mengandung antiseptik. Bagian tumbuhan yang
paling banyak digunakan sebagai obat adalah daunnya yang sering digunakan
sebagai pembalut luka pada pengobatan tradisional. Daun mentah yang
dihancurkan dapat digunakan untuk luka cacar air oleh kelompok etnis asli Afrika.
Ekstrak daun biasanya dipergunakan sebagai obat tetes mata dan penyembuhan
bila terjadi pembengkakan atau infeksi (Dalimartha, 2006). Pada penelitian yang
dilakukan oleh Sunilson, et al. (2009), ekstrak etanol dan air daun S. trifasciata
memiliki khasiat analgesik dan antipiretik yang tidak terlalu tinggi, sehingga
tanaman S. trifasciata ini dapat dijadikan alternatif pengobatan untuk mengatasi
demam dan inflamasi.
C. Ekstraksi
Dalam analisis fitokimia, harus digunakan jaringan tumbuhan segar yang
kemudian dikeringkan sebelum diekstraksi. Bila ini dilakukan, pengeringan
tersebut harus dilakukan dalam keadaan terawasi untuk mencegah terjadinya
perubahan kimia yang terlalu banyak. Bahan harus dikeringkan secepat-cepatnya,
tanpa menggunakan suhu tinggi, lebih baik dengan aliran udara yang baik. Setelah
betul-betul kering, tumbuhan dapat disimpan untuk jangka waktu lama sebelum
telah disimpan bertahun-tahun dalam analisis flavonoid, alkaloid, kuinon, dan
terpenoid (Harborne, 1987).
Ekstraksi merupakan suatu proses dalam upaya penarikan senyawa kimia
dari suatu tanaman, dimana senyawa tersebut akan terlarut dalam cairan pelarut
yang sesuai. Ekstrak merupakan hasil dari proses ekstraksi tersebut yang biasanya
merupakan sediaan kental. Ekstrak tersebut dapat menjadi sediaan kental karena
sebelumnya telah terjadi proses penguapan pelarut dan massa yang tidak
diperlukan (Dirjen POM, 2000).
Metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan
cara dingin misalnya pemerasan, maserasi dan perkolasi serta dapat pula
dilakukan dengan cara panas seperti soxlet, infusa, reflux, dan digesti. Pemilihan
metode dan jenis cairan penyari yang akan digunakan tergantung dari zat aktif
yang akan disari. Metode pemerasan digunakan untuk simplisia segar yang
diawali dengan penghancuran bahan dengan penambahan air, diperas kemudian
disaring. Metode infundasi merupakan cara sederhana untuk menyari kandungan
aktif dari simplisia yang larut dalam air panas. Perkolasi umumnya digunakan
untuk mengekstraksi serbuk kering terutama simplisia yang keras seperti kulit
batang, kulit buah, biji, kayu dan akar. Digesti adalah metode ekstraksi dengan
menggunakan pemanasan pada suhu 40°-50° C. Metode ini sangat tepat untuk
bahan yang memiliki kandungan zat aktif tahan terhadap panas (Direktorat Obat
Asli Indonesia, 2013).
Maserasi adalah salah satu metode ekstraksi dengan merendam serbuk
disebut juga ekstraksi dingin. Proses pemisahan senyawa dalam simplisia
menggunakan pelarut tertentu berdasarkan prinsip like dissolved like, dimana
suatu pelarut polar akan melarutkan senyawa polar yang terdapat dalam simplisia
tersebut. Cairan penyari yang menembus dinding sel dan masuk ke dalam rongga
sel yang mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan
konsentrasi antara larutan zat aktif di dalam sel dengan di luar sel, maka larutan
yang terpekat didesak ke luar. Peristiwa tersebut berulang sehingga terjadi
keseimbangan konsentrasi antara larutan di dalam dan di luar sel (Pratiwi, 2008).
D. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan metode pilihan teknik
pemisahan kandungan tumbuhan bentuk kromatografi planar. Metode KLT ini
lebih khas dibandingkan kromatografi lainnya seperti kromatografi kertas karena
kepekaan, kecepatan, dan dapat lebih dapat dimodifikasi. Kepekaan KLT
memungkinkan proses pemisahan dapat dilakukan dengan jumlah bahan yang
lebih sedikit menggunakan ukuran µg. Kecepatan KLT lebih besar karena
menggunakan fase diam yang lebih padat bila diaplikasikan pada plat. Metode
KLT dapat dimodifikasi, artinya selain dengan fase diam selulosa, beberapa fase
diam yang lain juga dapat diaplikasikan pada plat kaca atau penyangga lainnya
(Harborne, 1987).
Penggunaan KLT dalam beberapa bidang digunakan untuk
mengidentifikasi senyawa dan menentukan banyaknya komponen dalam
identifikasi adalah nilai Rf. Nilai Rf ini dapat diketahui dengan membandingkan
jarak yang ditempuh solut dengan jarak yang ditempuh oleh fase gerak. Apabila
dua senyawa memiliki nilai Rf yang sama maka dua senyawa tersebut merupakan
dua senyawa yang identik jika diukur pada kondisi KLT yang sama (Gandjar dan
Rohman, 2007).
Fase diam yang biasanya digunakan dalam KLT adalah silika dan
selulosa. Fase diam merupakan penjerap berukuran kecil dengan diameter partikel
antara 10-30 µm. Semakin kecil ukuran rata-rata partikel fase diam dan semakin
sempit kisaran ukuran fase diam, maka semakin baik kinerja KLT dalam proses
pengelusiannya. Pengaplikasian fase diam dilakukan diatas plat kaca, gelas, atau
aluminium pada ketebalan tertentu, biasanya dengan ketebalan 250 µ m. Fase
gerak pada KLT merupakan campuran 2 pelarut organik agar daya elusi campuran
tersebut dapat disesuaikan sehingga terjadi pemisahan secara optimal. Pada bahan
yang bersifat polar seperti campuran metanol dan air sebaiknya menggunakan
campuran pelarut sebagai fase gerak (Gandjar dan Rohman, 2007).
Tahap pertama dalam pelaksanaan KLT adalah penotolan sampel pada
plat yang telah disapukan fase diam. Proses penotolan tidak memerlukan sampel
dalam jumlah yang banyak, karena proses kromatografi akan menjadi tidak
optimal. Penotolan yang tidak tepat akan memberikan hasil yang bias seperti
bercak yang menyebar. Tahap selanjutnya adalah tahap pengembangan, dimana
plat yang telah ditotolkan sampel dimasukkan ke dalam bejana kromatografi yang
telah diisikan fase gerak. Bejana kromatografi sebelumnya harus dijenuhkan
Jarak yang ditempuh solut
Rf =
Jarak yang ditempuh fase gerak
(Gandjar dan Rohman, 2007).
E. Senyawa Fitokimia
Beberapa senyawa fitokimia dalam tanaman dapat dimanfaatkan sebagai
obat merupakan hasil metabolisme sekunder tanaman tersebut. Metabolisme
sekunder berbeda dari metabolisme primer yang berupa asam amino, karbohidrat,
nukleotida dan lemak. Hasil dari metabolisme sekunder berupa flavonoid, tanin,
saponin, alkaloid, dan lain-lain, dimana digunakan oleh tanaman untuk
melindungi diri dari serangan bakteri, jamur, dan hama lainnya. Hampir semua
tanaman mempunyai hasil metabolisme sekunder namun akan berbeda
kandungannya tergantung dari spesies dan kadarnya tergantung dari lingkungan
tempat tanaman hidup (Lenny, 2006).
Flavonoid merupakan golongan terbesar dari senyawa fenol yang bersifat
polar, sehingga pada umumnya mudah larut dalam pelarut polar seperti etanol,
metanol, butanol, dan aseton. Senyawa fenol memiliki sifat efektif menghambat
pertumbuhan virus, bakteri, dan jamur. Mekanisme flavonoid dalam menghambat
pertumbuhan bakteri, yaitu dengan merusak permeabilitas dinding sel, mikrosom,
dan lisosom. Adanya gugus hidroksil pada gugus flavonoid dapat menyebabkan
perubahan komponen organik dan transpor nutrisi yang akhirnya akan
Menurut Stahl (cit., Herlianawati, 2005), fase gerak yang biasa
digunakan untuk menghasilkan pemisahan yang baik pada lempeng selulosa
adalah fase atas dari campuran butanol : asam asetat : air (40 : 50 : 10) v/v.
Pembanding baku yang biasanya digunakan pada kromatogram adalah rutin. Rutin
merupakan senyawa glikosida flavonol yang sangat umum terdapat dalam
tumbuhan (Harborne, 1987).
Tanin adalah senyawa polifenol yang dapat membentuk kompleks
dengan protein. Tanin terdapat luas dalam tumbuhan yang letaknya terpisah dari
enzim dan sitoplasma. Tanin dapat dibedakan menjadi dua, yaitu tanin
terkondensasi dan tanin terhidrolisis. Tanin terhidrolisis dapat dihidrolisis oleh
asam atau enzim seperti tannase. Tanin terkondensasi tidak terhidrolisis menjadi
molekul yang lebih sederhana dan tidak mengandung gugus gula (Trease dan
Evans, 2002). Mekanisme tanin dalam menghambat pertumbuhan bakteri adalah
dengan menghambat pembentukan dinding sel, sehingga sel bakteri akan mati
akibat lisisnya sel bakteri karena tekanan osmotik maupun fisik (Ngajow,
Abidjulu, dan Kamu, 2013).
Tanin merupakan senyawa asam karboksilat fenol yang dapat dipisahkan
menggunakan fase diam silika gel atau selulosa. Fase gerak yang digunakan
dalam identifikasi senyawa tanin bermacam ragam. Fase gerak yang umum
digunakan adalah toluene : etil format : asam format (50 : 40 : 10) v/v (Harborne,
1987).
Alkaloid merupakan senyawa organik yang berasal dari alam yang
bentuk bebas, sebagai garam dan N-Oksida. Sebagian besar alkaloid berasa pahit
dan mudah larut dalam pelarut organik (Harborne, 1987). Alkaloid berperan
sebagai antibakteri dengan mengganggu komponen penyusun peptidoglikan yang
menyebabkan lapisan dinding sel tidak terbentuk sehingga berdampak pada
kematian sel (Farida, Dewa, Titis, dan Endrawati, 2010).
Menurut Stahl (cit., Herlianawati, 2005), pemisahan alkaloid secara KLT
dapat menggunakan fase diam silika gel, alumina, selulosa atau kieselguhr.
Alkaloid secara umum dapat dideteksi secara visibel. Reagen yang biasa
digunakan adalah reagen Dragendorf yang akan menghasilkan warna cokelat atau
orange (visibel) yang tidak stabil ketika dilakukan penyemprotan reagen.
Saponin tersebar luas di berbgai jenis tumbuhan. Keberadaan saponin
sangat mudah ditandai dengan pembentukan larutan koloidal dengan air apabila
digojog menimbulkan buih yang stabil (Gunawan dan Mulyani, 2004). Saponin
bekerja sebagai antibakteri dengan mengganggu stabilitas membran sel sehingga
menyebabkan sel lisis. Bakteri mengalami kerusakan membran sel dan
menyebabkan keluarnya berbagai komponen penting dari dalam sel bakteri yaitu
protein, asam nukleat dan nukleotida (Darsana, Besung, dan Mahatmi, 2012).
Menurut Stahl (cit., Herlianawati, 2005), pengujian KLT untuk saponin
menggunakan fase gerak seperti campuran kloroform : metanol : air (65 : 35 : 10)
v/v untuk memisahkan campuran glikosida terpenoid yang netral. Fase diam yang
F. Staphylococcus aureus
Taksonomi dari bakteri Staphylococcus aureus adalah sebagai berikut :
Kerajaan : Bacteria
Filum : Firmicutes
Kelas : Cocci
Bangsa : Bacillales
Suku : Staphylococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
(National Center for Biotechnology Information, 2014)
Staphylococcus aureus merupakan salah satu genus stafilokokus yang
berkaitan dengan medis. Perbedaan S. aureus dengan spesies yang lain adalah
bakteri ini bersifat Gram positif. S. aureus adalah pathogen utama pada manusia.
Hampir setiap orang pernah mengalami infeksi S. aureus selama hidupnya, dari
keracunan makanan yang berat atau infeksi kulit yang kecil, sampai infeksi yang
tidak bisa disembuhkan. Secara umum bakteri stafilokokus tumbuh dengan cepat
pada berbagai tipe media dan dengan aktif melakukan metabolisme, melakukan
fermentasi karbohidrat dan menghasilkan bermacam-macam pigmen dari warna
putih hingga kuning gelap. S. aureus sering menghemolisis darah, mengkoagulasi
plasma dan menghasilkan berbagai enzim ekstraseluler dan toksin. S. aureus cepat
menjadi resisten terhadap beberapa antimikroba dan ini merupakan masalah besar
Bakteri S. aureus pertama kali diteliti oleh seorang ahli fisika dari
Jerman, Anton Rosenbach pada tahun 1884. Bakteri ini merupakan bakteri non
motil (tidak bergerak), tidak memiliki spora dan memiliki struktur seperti anggur.
Ukuran diameter selnya sekitar 1 mikrometer, jadi hanya dalam jarak 1 millimeter
bakteri ini terdiri atas 1000 sel. Bakteri S. aureus terdapat di kulit dan membran
mukosa. Selain itu S. aureus juga dapat hidup berkoloni di membran nasal karena
bakteri ini suka hidup di tempat yang hangat dan lembab. S. aureus memiliki
dinding sel yang tebal dibandingkan dengan bakteri lainnya. Hal ini menjadi salah
satu penyebab obat antibakteri sulit masuk ke dalam sel dan membunuhnya.
(Freeman-Cook dan Freeman-Cook, 2006).
Infeksi S. aureus dapat juga berasal dari kontaminasi langsung dari luka,
misalnya pasca operasi infeksi stafilokokus atau infeksi yang menyertai trauma
osteomielitis kronik setelah patah tulang terbuka, meningitis yang menyertai patah
tulang tengkorak. Jika S. aureus menyebar dan terjadi bakterimia, maka biasanya
terjadi endokarditis, osteomielitis hematogenus akut, meningitis atau infeksi
paru-paru (Brooks, et al., 2001).
G. Pseudomonas aeruginosa
Taksonomi dari bakteri Pseudomonas aeruginosa adalah sebagai berikut:
Kerajaan : Bacteria
Filum : Proteobacteria
Kelas : Gammaproteobacteria
Suku : Pseudomonadaceae
Marga : Pseudomonas
Jenis : Pseudomonas aeruginosa
(National Center for Biotechnology Information, 2014)
Pseudomonas aeruginosa merupakan bakteri Gram negatif, motil,
aerobik, beberapa galur memproduksi pigmen larut air. P. aeruginosa sering ada
dalam jumlah sedikit pada flora normal usus dan kulit manusia dan merupakan
patogen utama dari kelompok jenis pseudomonas. P. aeruginosa bersifat invasive
dan toksigenik, mengakibatkan infeksi pada pasien dengan penurunan daya tahan
tubuh, dan merupakan patogen nosokomial yang penting. P. aeruginosa tersebar
luas di alam dan biasanya ada di lingkungan lembab di rumah sakit. P. aeruginosa
dapat bersifat saprofit pada orang sehat, tetapi dapat menyebabkan penyakit pada
manusia yang memiliki ketahanan tubuh yang tidak normal (Brooks, et al., 2001).
Ciri-ciri dari bakteri ini adalah berbentuk batang dengan ukuran 0,6 x 2
mikrometer. Merupakan bakteri gram negatif yang terlihat sebagai bentuk batang
tunggal, ganda, dan kadang-kadang dalam rantai pendek. Pseudomonas
aeruginosa bersifat aerobik obligat yang tumbuh dengan cepat pada berbagai tipe
media, kadang memproduksi bau manis (corn taco-like odor). Beberapa galur
menghemolisis darah. Pseudomonas aeruginosa tumbuh baik pada 37-42°C.
Pseudomonas aeruginosa pada biakan dapat memproduksi berbagai kelompok
koloni. Dari bentuk koloni yang berbeda mungkin juga memiliki aktivitas
biokimia dan enzimatik yang berbeda, dan memberi kepekaan yang berbeda
H. Metode Uji Kepekaan Antibakteri
Dalam tahun-tahun belakangan ini, bakteri yang resisten terhadap obat
telah menyebabkan beberapa wabah infeksi yang serius, dengan banyak kematian.
Hal ini menyebabkan perlunya program survailans nasional dan internasional
untuk memantau resistensi antimikroba pada bakteri, dengan uji kepekaan
menggunakan metode yang dapat dipercaya dan menghasilkan data yang
sebanding. Ketersediaan informasi mikrobiologis dan epidemiologis akan
membantu klinisi dalam memilih obat antimikroba yang sesuai untuk pengobatan
infeksi mikroba (Vandepitte, et al., 2003).
Prinsip umum pada uji kepekaan antimikroba adalah mengukur
kemampuan zat antimikroba untuk menghambat pertumbuhan bakteri in vitro.
Kemampuan ini dapat diperkirakan melalui metode pengenceran (dilusi) dan
metode difusi. Pada uji difusi, cakram kertas atau sumuran yang diresapi
antibiotik dalam jumlah tertentu, diletakkan pada media agar yang telah ditanami
organisme uji secara merata. Suatu gradien konsentrasi zat antimikroba yang
terbentuk oleh difusi dari cakram atau sumuran dan pertumbuhan organisme uji
dihambat pada suatu jarak dari cakram atau sumuran yang terkait dengan
kepekaan organisme, disamping faktor-faktor lain (Vandepitte, et al., 2003).
Prinsip metode dilusi adalah larutan uji diencerkan hingga diperoleh
beberapa konsentrasi, kemudian masing-masing konsentrasi larutan uji
ditambahkan suspensi bakteri dalam media. Pada dilusi padat, tiap konsentrasi
I. Landasan Teori
Infeksi luka bakar merupakan suatu jenis trauma dengan morbiditas dan
mortalitas yang tinggi sehingga memerlukan penatalaksanaan khusus dalam upaya
penyembuhannya. Bakteri S. aureus dan P. aeruginosa merupakan bakteri yang
dapat menyebabkan infeksi luka bakar. Kedua bakteri ini terdapat dalam kulit
manusia dan dapat menjadi patogen apabila terjadi penurunan daya tahan tubuh
pada manusia. Sehubungan dengan itu diperlukan eksplorasi tanaman yang
memiliki aktivitas antibakteri yang dapat menjadi alternatif dalam penyembuhan
luka bakar.
Sansevieria dikenal sebagai tanaman hias dan memiliki banyak variasi
jenis. Salah satu jenis tanaman hias yang banyak terdapat di Indonesia adalah
S. trifasciata. Kandungan kimia yang terdapat dalam tanaman S. trifasciata yang
berfungsi sebagai senyawa antibakteri antara lain alkaloid, flavonoid, saponin, dan
tanin (Qomariyah, Sarto, dan Pratiwi, 2012).
Proses ekstraksi menggunakan pelarut untuk mengambil senyawa yang
sesuai dengan tingkat kepolarannya. Pelarut etanol dan air merupakan pelarut
polar yang dapat mengambil senyawa flavonoid, alkaloid, saponin, dan tanin.
Pelarut semi polar seperti etil asetat dapat menarik senyawa flavonoid aglikon
(Pranoto, et al., 2012).
Dalam menguji aktivitas antibakteri dapat dilakukan dengan dua metode
yaitu metode difusi dan metode dilusi. Metode difusi dalam uji aktivitas
antibakteri dapat dilihat dengan adanya zona jernih atau zona hambat. Metode
antibakteri, sehingga dapat diketahui dosis yang sesuai untuk pengobatan dengan
tanaman S. trifasciata. Pengujian ini dilakukan untuk melihat aktivitas kandungan
dari tanaman S. trifasciata dalam menghambat pertumbuhan bakteri S. aureus
ATCC 25923 dan P. aeruginosa ATCC 27853.
J. Hipotesis
Ekstrak etanol, fraksi etil asetat, dan perasan daun S. trifasciata memiliki
daya antibakteri terhadap S. aureus ATCC 25923 dan P. aeruginosa ATCC
24
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental dengan rancangan
acak lengkap pola satu arah. Penelitian eksperimental merupakan penelitian
dengan membandingkan kelompok murni perlakuan dan kelompok kontrol.
Rancangan penelitian ini dilakukan dengan pemilihan sampel acak dan memiliki
satu variabel bebas. Penelitian dilakukan di Laboratorium Farmakognosi
Fitokimia dan Laboratorium Mikrobiologi, Fakultas Farmasi Universitas Sanata
Dharma, Yogyakarta.
B. Variabel dan Definisi Operasional 1. Variable penelitian
a. Variabel bebas : berbagai konsentrasi ekstrak, fraksi dan perasan daun
Sansevieria trifasciata : 100, 75, 50, 25 % v/v.
b. Variabel tergantung : diameter zona jernih pertumbuhan
S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853.
c. Variabel pengacau terkendali : media penanaman bakteri, suhu inkubasi
(37 ºC) dan lama inkubasi (24 jam), kepadatan suspensi bakteri yang
dilakukan uji setara dengan larutan Mc Farland II (6.108 CFU/mL), asal daun
S. trifasciata, suhu penyimpanan bahan ekstrak daun S. trifasciata, umur
tanaman, tinggi tanaman (70 - 90 cm), lebar tanaman ( 3 - 4 cm), warna
d. Variabel pengacau tidak terkendali : kelembaban ruang penyimpanan
ekstrak etanol, fraksi etil asetat, dan perasan daun S. trifasciata.
2. Definisi operasional
a. Daun Sansevieria trifasciata adalah daun tanaman hias jenis Sansevieria
yang kaku dan keras, permukaan licin, ujung daun runcing, warnanya hijau,
panjang 30 - 120 cm, lebar 2,5 - 8 cm, kedua permukaan daun terdapat
garis-garis bergelombang berwarna hijau yang letaknya melintang, dan tepi daun
berwarna kuning.
b. Ekstrak etanol daun S. trifasciata adalah daun S. trifasciata basah yang
dimaserasi dengan pelarut etanol 96% dengan menggunakan shacker selama
24 jam, lalu dipekatkan dengan rotary evaporator.
c. Fraksi etil asetat daun S. trifasciata adalah ekstrak etanol daun
S. trifasciata yang dilarutkan dengan aquadest, lalu difraksinasi dengan
pelarut etil asetat dengan menggunakan corong pisah, lalu dipekatkan dengan
rotary evaporator.
d. Perasan daun S. trifasciata adalah daun S. trifasciata basah yang
dihaluskan dengan menggunakan blender serta ditambahkan air secukupnya,
lalu diperas dengan menggunakan kain.
e. Staphylococcus aureus adalah bakteri gram positif yang diperoleh dari
Laboratorium Balai Kesehatan Yogyakarta dengan nomor ATCC 25923.
f. Pseudomonas aeruginosa adalah bakteri gram negatif yang diperoleh dari
g. Daya antibakteri adalah kekuatan ekstrak etanol, fraksi etil asetat, dan
perasan daun S. trifasciata dalam menghambat dan membunuh
S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853 yang memiliki
perbedaan bermakna dibandingkan dengan kontrol negatif (DMSO 5%)
berupa zona jernih.
h. Zona jernih adalah zona atau daerah pada media yang menunjukkan
penghambatan pertumbuhan bakteri oleh suatu antibakteri.
C. Bahan Penelitian
Daun tumbuhan S. trifasciata yang diperoleh dari kebun obat Fakultas
Farmasi Universitas Sanata Dharma, Yogyakarta, aquadest dari Laboratorium
Kimia Organik, etil asetat (General Labora®), etanol 96% teknis (General
Labora®), suspensi bakteri S. aureus ATCC 25923, suspensi bakteri
P. aeruginosa ATCC 27853, dimethyl-sulfhoxide (DMSO) 5% (Merck®), larutan
standar Mc Farland II, perak sulfadiazine (Burnazin®), media Nutrient Agar
(NA) (Oxoid®).
D. Alat Penelitian
Alat-alat gelas, yaitu Erlenmeyer, tabung rekasi, corong, labu ukur, pipet
tetes, cawan petri, batang pengaduk, gelas ukur, sendok, pelubang sumuran 6 mm,
blender (Cosmos®), Platform Shaker(Innova™ 2100), autoclave (Model KT-40,
ALP Co. Ltd Hamurasi Tokyo Japan), oven (memmert), rotary evaporator (Janke
GmbH + CoKG-D91126, Swahaban FRG Germany microbiological safety
cabinet), neraca analitik (Scaltec Instruments Heiligen stadt Germany),
mikropipet, paper disc, vortex mixer, spreader, pinset, flakon, tempat
pengembang (Chamber) KLT, penyangga lempeng kaca, kertas saring, lempeng
kaca kromatografi lapis tipis.
E. Tata Cara Penelitian 1. Determinasi daun S. trifasciata
Daun S. trifasciata dideterminasi dengan mencocokkan ciri-ciri tanaman
dengan tanaman S. trifasciata menggunakan pustaka acuan Backer dan Brink
(1968).
2. Pengumpulan bahan daun S. trifasciata
Daun S. trifasciata diperoleh dari kebun obat Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta. Daun yang akan digunakan diambil pada
pagi hari. Kriteria daun yang diambil adalah memiliki panjang daun 70 – 90 cm,
lebar daun 3 – 4 cm, dan warna daun hijau tua dengan tepi corak berwarna kuning.
Daun S. trifasciata dicuci dengan air mengalir dan dipotong kecil-kecil ukuran 1 x
1 cm. lalu dibuat tiga perlakuan.
3. Pembuatan ekstrak etanol daun S. trifasciata dengan metode maserasi
Sebanyak 100 gram bahan daun segar yang telah dipotong kecil-kecil,
lalu dihaluskan dengan blender. Bahan selanjutnya dimasukkan dalam Erlenmeyer
dan ditambahkan pelarut etanol 96% sampai bahan terendam semua. Erlenmeyer
selama 24 jam. Selanjutnya bahan disaring dengan menggunakan corong Buchner,
lalu dipekatkan dengan rotary evaporator, disimpan dalam lemari pendingin.
4. Pembuatan fraksi etil asetat daun S. trifasciata dengan metode fraksinasi
Sebanyak 100 gram bahan daun segar yang telah dipotong kecil-kecil,
lalu dihaluskan dengan blender. Bahan selanjutnya dimasukkan dalam erlenmeyer
dan ditambahkan pelarut etanol 96% sampai bahan terendam semua. Erlenmeyer
ditutup rapat dengan alumunium foil, lalu digojog dengan menggunakan shaker
selama 24 jam. Selanjutnya bahan disaring dengan menggunakan corong Buchner,
lalu dipekatkan dengan suhu 40°C. Bahan yang telah dipekatkan, ditambah
dengan aquadest sampai seluruh ekstrak larut sempurna, lalu dimasukkan ke
dalam corong pisah. Ditambahkan pelarut etil asetat dengan jumlah yang
sebanding dengan jumlah air yang ditambahkan ke dalam ekstrak etanol
(perbandingan 1:1), lalu corong pisah ditutup untuk selanjutnya digojog. Fase etil
asetat yang diperoleh kemudian ditampung, lalu dipekatkan dengan rotary
evaporator dan disimpan pada lemari pendingin.
5. Pembuatan perasan daun S. trifasciata
Sebanyak 100 g bahan daun segar yang telah dipotong kecil-kecil,
selanjutnya dihaluskan dengan penambahan aquadest menggunakan blender.
Bahan diperas dengan menggunakan kain saring.
6. Preparasi mikroba uji
Bakteri diperoleh dari Balai Laboratorium Kesehatan Yogyakarta.
Bakteri yang digunakan adalah P. aeruginosa ATCC 27853 yang merupakan
gram positif. Mikroba uji disetarakan kekeruhannya dengan larutan standar Mc
Farland II dengan konsentrasi mikroba 6x108 CFU/mL.
7. Sterilisasi peralatan dan media
Peralatan yang digunakan dalam penelitian, terutama yang berhubungan
dengan bakteri uji seperti: tabung reaksi, cawan petri, jarum ose, pipet ukur,
flakon, dan lain-lain disterilisasi dengan menggunakan autoklaf selama 20 menit.
Media NA yang digunakan disterilisasi dengan menggunakan autoklaf pada suhu
121ºC selama 15 menit.
8. Pengujian potensi antibakteri secara metode difusi sumuran
a. Penyiapan larutan uji
Ekstrak etanol daun S. trifasciata dibuat berbagai variasi konsentrasi.
Konsentrasi yang dibuat adalah 100 %, 75 %, 50 %, dan 25 % v/v. DMSO
5% digunakan sebagai pelarut untuk membuat tingkat konsentrasi. Hal yang
sama juga dilakukan pada fraksi etil asetat dan perasan air.
b. Penyiapan larutan perak sulfadiazine (Burnazin®) sebagai kontrol positif
Kontrol positif yang digunakan adalah krim perak sulfadiazine
(Burnazin®). Konsentrasi kontrol positif yang dibuat adalah 1 %. Sebanyak
satu gram krim Burnazin® dilarutkan menggunakan DMSO 5% ke dalam
labu ukur 100 mL, kemudian divortex.
c. Penanaman isolat Pseudomonas aeruginosa ATCC 27853 dan
Staphylococcus aureus ATCC 25923 secara pour plate (metode tuang)
Suspensi bakteri P. aeruginosa ATCC 25923 dan
secara aseptis. Selanjutnya media NA yang telah dicampur suspensi bakteri
dituang ke dalam cawan petri yang telah steril. Perlu dilakukan penggoyangan
untuk memastikan suspensi bakteri S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853 tercampur secara homogen dengan media NA.
Setelah memadat, diinkubasi secara terbalik selama 24 jam.
d. Pembuatan kontrol kontaminasi dan kontrol pertumbuhan bakteri uji
Uji potensi antibiotik secara difusi sumuran terlebih dahulu dibuat
kontrol pertumbuhan bakteri uji, kontrol pelarut, kontrol kontaminasi. Kontrol
pertumbuhan bakteri uji S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853 dibuat dengan mengambil 0,5 mL
masing-masing bakteri uji dan ditambahkan ke dalam media nutrientagar. Media NA
yang telah ditambahkan suspensi bakteri dituang ke dalam cawan petri steril
secara aseptis dan dibiarkan sampai memadat. Setelah agak mengering
diinkubasi secara terbalik selama 24 jam. Kontrol pelarut dilakukan dengan
membuat lubang sumuran dalam cawan petri yang telah berisi media yang
diinokulasikan bakteri uji secara aseptis dan diisi pelarut DMSO 5%. Kontrol
kontaminasi dilakukan dengan cara menuangkan media NA ke dalam cawan
petri steril.
e. Uji potensi antibiotik secara difusi sumuran
Secara aseptis, dibuat enam lubang sumuran dengan menggunakan
pelubang sumuran 6 mm pada permukaan media NA yang diatur dengan jarak
tertentu. Ekstrak etanol daun S. trifasciata dengan berbagai konsentrasi (100
selama 24 jam dengan suhu 37 ºC, cawan petri diamati zona jernih yang
dihasilkan. Daya antibakteri diamati berdasarkan diameter zona jernih yang
terbentuk dibandingkan dengan kontrol pelarut DMSO 5% diukur dengan
menggunakan penggaris. Hal yang sama juga dilakukan pada fraksi etil asetat
dan perasan air.
9. Pengujian kepekaan antibiotik dengan menentukan nilai KHM dan KBM dengan dilusi padat
Penentuan nilai KHM dan KBM dilakukan dengan melakukan metode
dilusi padat. Metode ini dilakukan dengan menambahkan ekstrak etanol daun
S. trifasciata pada masing-masing konsentrasi yang menunjukkan zona jernih
pada uji potensiasi ke dalam tabung berisi 15 mL media NA dan 0,5 mL suspensi
bakteri S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853. Selanjutnya
tabung tersebut dituang ke dalam cawan petri dengan metode pour plate. Setelah
masa inkubasi, kekeruhan yang menunjukkan kepadatan pertumbuhan bakteri
diamati dan diberi penilaian menggunakan notasi (+) dan (-) jika tidak ada tampak
pertumbuhan bakteri pada media agar tersebut.
Dari pengamatan kekeruhan, dilakukan uji penegasan hasil dengan
dengan memilih cawan petri dengan tingkat kekeruhan (-) dan tingkat kekeruhan
(+). Selanjutnya, media agar yang memiliki tingkat kekeruhan (-) dicuplik 1 ose
lalu ditanam pada media agar baru dengan metode streak plate. Hal yang sama
juga dilakukan pada fraksi etil asetat dan perasan air.
Hasil uji yang digunakan adalah semua media yang memberikan
menghambat bakteri, ditandai dengan S. aureus ATCC 25923 dan
P. aeruginosa ATCC 27853 masih dapat tumbuh pada hasil streak plate,
sedangkan KBM adalah konsentrasi terkecil yang dapat membunuh bakteri,
ditandai dengan keadaan S. aureus ATCC 25923 dan P. aeruginosa ATCC 27853
sudah tidak dapat tumbuh pada hasil streak plate yang menandakan bakteri uji
mati karena larutan uji dengan konsentrasi tersebut.
10.Uji fitokimia ekstrak daun S. trifasciata
Uji fitokimia yang dilakukan adalah uji saponin, alkaloid, flavonoid dan
tanin. Kandungan senyawa fitokimia yang diuji memiliki sifat sebagai antibakteri.
a. Uji saponin
Uji busa : ekstrak etanol daun S. trifasciata diambil sebanyak satu
mililiter, ditambahkan lima mililiter air destilasi dan dikocok dalam tabung reaksi
selama 15 menit. Terbentuknya layer berupa busa setebal satu sentimeter pada
bagian atas menunjukkan adanya saponin. Hal yang sama dilakukan pada fraksi
etil asetat dan perasan daun S. trifasciata (Philip, et al., 2011).
b. Uji alkaloid
Uji Mayer : ekstrak etanol daun S. trifasciata diambil sebanyak dua
mililiter, ditambahkan dua mililiter asam klorida 1%. Selanjutnya ditambahkan
lima tetes reagen Mayer. Terbentuknya endapan warna hijau atau putih
menunjukkan indikasi adanya alkaloid. Hal yang sama juga dilakukan pada fraksi
c. Uji flavonoid
Uji asam sulfat : ekstrak etanol daun S. trifasciata diambil satu mililiter,
ditambahkan dengan asam sulfat pekat dan diamati perubahan warna menjadi
orange. Hal yang sama juga dilakukan pada etil asetat dan perasan daun
S. trifasciata (Philip, et al., 2011).
Uji natrium hidroksida : ekstrak etanol daun S. trifasciata diambil satu
mililiter, ditambahkan natrium hidroksida dan diamati perubahan warna menjadi
kuning. Hal yang sama juga dilakukan pada fraksi etil asetat dan perasan daun S.
trifasciata (Asih, 2009).
d. Uji tannin
Uji besi (III) klorida : ekstrak etanol daun S. trifasciata diambil satu
mililiter, ditambahkan dua mililiter besi (III) klorida5%. Terbentuknya warna biru
tua atau hijau kehitaman mengindikasikan adanya tanin. Hal yang sama juga
dilakukan pada fraksi etil asetat dan perasan daun S. trifasciata (Philip, et al.,
2011).
Uji dengan larutan gelatin 1 % : ekstrak etanol daun S. trifasciata
diambil sebanyak tiga mililiter, ditambahkan ke dalam sepuluh mililiter aquadest,
dipanaskan selama 30 menit di atas waterbath. Setelah itu, hasil pemanasan,
disaring dengan kertas saring sebanyak lima mililiter. Hasil saringan tersebut
ditambahkan dengan natrium klorida 2% sebanyak satu mililiter. Apabila terdapat
endapan disaring dengan kertas saring. Selanjutnya hasil saringan ditambahkan
mengindikasikan adanya tanin. Hal yang sama juga dilakukan pada fraksi etil
asetat dan perasan daun S. trifasciata (Sangi, Momuat, Kumaunang, 2012).
11.Kromatografi Lapis Tipis (Uji Penegasan Senyawa Flavonoid)
Fase diam yang digunakan adalah selulosa dan fase gerak yang
digunakan adalah n-butanol : asam asetat glasial : air (40 : 10 : 50) v/v. Ekstrak
etanol daun S. trifasciata ditotolkan sebanyak tiga mikroliter pada plat kaca KLT.
Pembuatan standar rutin dengan melarutkan 10 mg serbuk rutin dengan satu
mililiter etanol pra analisis 70 %. Standar rutin selanjutnya ditotolkan sebanyak
tiga mikroliter pada plat KLT. Hasil KLT dideteksi pada panjang gelombang 254
nm, 365 nm, pereaksi uap amonia, dan pereaksi semprot besi (III) klorida. Hal
yang sama juga dilakukan pada fraksi etil asetat dan perasan air.
F. Analisis Hasil
Berdasarkan uji potensi antibiotik, didapatkan data diameter zona jernih
yang kemudian diuji normalitas distribusi data tersebut dengan metode analisis
Shapiro-Wilk. Kriteria distribusi normal dilihat dari nilai kebermaknaan (p) >
0,05. Apabila distribusi normal, dianalisis statistic one way ANNOVA yang
dilanjutkan dengan LSD test untuk mengetahui adanya kebermakaan dalam
perbedaan hasil diameter zona jernih tiap konsentrasi uji dengan kontrol negatif.
Apabila distribusi tidak normal, dianalisis dengan metode Kruskal-Wallis yang
dilanjutnya dengan uji Post Hoc untuk melihat adanya kebermaknaan dalam
Berdasarkan data uji aktivitas antibakteri, dianalisis secara deskriptif
untuk menentukan KHM dan KBM. Analisis deskriptif dengan disertai data