UNIVERSITAS INDONESIA
POTENSI NANOPARTIKEL PERAK SEBAGAI
ELEMEN SENSOR PESTISIDA
SARTIKA SALASWATI 0806326380
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM STUDI S1 FISIKA
DEPOK DESEMBER 2012
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh
Nama : SARTIKA SALASWATI
NPM : 0806326380
Program Studi : S-1 Reguler Fisika
Judul Skripsi : Potensi Nanopartikel Perak sebagai Elemen Sensor Pestisida
Telah berhasil dipertahakan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Sains pada Program Studi S-1 Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia
DEWAN PENGUJI
Pembimbing : Dr.-Ing. Cuk Imawan ( ) Pembimbing : Dr. Susiani Purbaningsih, DEA ( ) Penguji : Dr. Sastra Kusuma Wijaya ( )
Penguji : Dr. Ariadne L. Juwono ( )
Ditetapkan di : Depok
Ringkasan Tugas Akhir / Skripsi
Nama, NPM : Sartika Salaswati, 0806326380 Pembimbing : 1. Dr.-Ing Cuk Imawan
2. Dr. Susiani Purbaningsih, DEA
Judul (Indonesia) : Potensi Nanopartikel Perak sebagai Elemen Sensor Pestisida
Judul (Inggris) : Potential of Silver Nanoparticles as Sensor Elements Pesticide
Abstrak
Pembuatan elemen sensor pestisida berbasis nanopartikel perak dengan metode kolorimetri telah dipelajari dan diamati. Secara sederhana, metode kolorimetri adalah metode yang berdasarkan penyerapan sinar oleh larutan. Adanya proses penyerapan ini, memungkinkan dilakukannya analisis absorbansi dari larutan tersebut . Pada metode ini, sinyal membawa informasi target berupa energi cahaya dengan panjang gelombang dan intensitas tertentu. Sinyal inilah yang diamati dengan menggunakan spektrofotometer ultraviolet visible (UV-Vis). Metode kolorimetri berbasis nanopartikel perak telah digunakan untuk mendeteksi pestisida. Dengan memanfaatkan sifat optis nanopartikel perak, maka sinyal informasi berupa output dari elemen sensor dapat dideteksi dan dianalisis informasi dari sinyal input yang diberikan. Hasil karakterisasi elemen sensor menggunakan media visual dan spektrofotometer UV-Vis menunjukkan bahwa terjadi kenaikan absorbansi elemen sensor (nanopartikel termodifikasi asam asetat 0,1%) dengan penambahan konsentrasi insektisida dari golongan peritroid. Hubungan linier antara input dan sinyal output ini bersesuaian dengan hukum Beer-Lambert yang menyatakan kesebandingan antara absorbansi dan konsentrasi sample. Sementara pengujian dengan dua pestisida lainnya, fungisida dari golongan karbamat dan herbisida dari golongan organofosfat tidak menunjukkan
pola yang bersesuaian dengan hukum Beer-Lambert. Hasil juga menunjukkan bahwa elemen sensor pestisida dapat diproduksi kembali untuk mendeteksi insektisida peritroid.
Kata kunci : elemen sensor pestisida, nanopartikel perak, kolorimetri, pestisida, insektisida peritroid
Abstract
Production of sensor elements pesticide based on silver nanoparticles with colorimetry method was studied and monitored. In a simple, colorimetry method is a method based on the absorption of light. The absorption process allows analysis of absorbance from the solution. In this method, signals carry information formed energy of light with specific wavelength and intensity. Signals is observed by using a UV-Vis spectrophotometer.
Colorimetry method based silver nanoparticles have been used to detection of pesticides. With optical properties of silver nanoparticles, output signal can be detected and analyzed from input signal. The result of characterization from visual and UV-Vis spectrophotometer show that an increase in absorbance sensor element (silver nanoparticles with modified acetic acid 0,1%) with increase concentration of insecticide from peritroid group. Linear relationship between input and output signal is compatible with the Beer-Lambert law which states proportionality between absorbance and sample concentration. While testing with two other pesticide, fungicides from the carbamate group and herbicides from the organophosphate group did not show a pattern corresponding to the Beer-Lambert law. Results also showed that the sensor element reproducible to detect insecticide peritroid.
Keyword : sensor elements pesticide, silver nanoparticles, colorimetry method, pesticide, insecticide peritroid
1. PENDAHULUAN
Nanopartikel merupakan bagian dari nanoteknologi yang sangat populer dan banyak diteliti akhir dasawarsa ini. Hal ini disebabkan karena manfaatnya yang sangat luas bagi peradaban modern manusia. Manfaat dan aplikasi nanopartikel saat ini telah merambah diberbagai bidang, antara lain di bidang lingkungan, biomedis, perawatan kesehatan, pertanian dan pangan, tekstil, industry, elektronika, serta energy terbarukan (Tsuzuki, 2009). Di bidang elektronik, salah satu pemanfaatan nanopartikel perak digunakan sebagai sensor. Measurand yang telah berhasil dideteksi diantaranya ion-ion logam berat (Haibing Li et al., 2009), melamin (Han, C. dan Haibing Li., 2010), asam amino, DNA, dan pestisida (L. Shaoqin,et al., 2008, Vamvakaki, et.al., 2007, Dubas S.T. dan Pimpan, V., 2008).
Dalam penelitian ini dikembangkan sensor pestisida berbasis nanopartikel perak dengan biosintesis rimpang jahe. Nanopartikel yang terbentuk kemudian dimodifikasi dengan penambahan modifikator untuk mempermudah pengikatan molekul pestisida. Indikasi terdeteksinya pestisida ditandai dengan adanya perubahan absorbansi yang memiliki pola teratur sehingga dapat dimodelkan dengan fungsi transfer. Penelitian ini dilakukan untuk mengembangkan penelitian sebelumnya yang telah berhasil menggunakan nanopartikel perak dari biosintesis air rebusan daun bisbul segar untuk mendeteksi logam Cu (Bakir, 2011).
2. TINJAUAN PUSTAKA
2.1 Metode Kolorimetri
Pendeteksian dengan menggunakan metode chromatography dan mass
spectrometer menghasilkan hasil analisis yang kuantatif dan lebih spesifik. Dari
kedua proses tersebut dapat diketahui besarnya konsentrasi dan jenis pestisida secara detail yang terkandung di dalam sample. Akan tetapi, kedua metode ini membutuhkan biaya yang mahal, waktu yang lama, dan tenaga ahli dalam proses pendeteksiannya. Disamping itu, metode tersebut tidak cocok digunakan di lapangan (L. Shaoqin,et al., 2008). Oleh karena itu dibutuhkan metode yang
murah, mudah, insitu, sederhana, dan tidak perlu operator handal dalam pengoperasiannya, sehingga penggunaannya dapat dimanfaatkan oleh masyarakat luas. Salah satu metode yang ditawarkan adalah metode kolorimetri. Secara sederhana, metode kolorimetri adalah metode yang berdasarkan penyerapan sinar oleh larutan. Adanya proses penyerapan ini, memungkinkan dilakukannya analisis absorbansi dari larutan tersebut . Pada metode ini, sinyal yang membawa informasi target berupa energi cahaya dengan panjang gelombang dan intensitas tertentu. Sinyal inilah yang nantinya dikarakterisasi dengan menggunakan spektrofotometer UV-Vis, spectrometer IR, maupun spectrometer Fluoro luminescence (Z. Chui, et.al., 2011).
Metode kolorimetri telah digunakan untuk mendeteksi berbagai macam analit. Analit yang telah berhasil dideteksi diantaranya berupa ion-ion logam berat (S.T. Dubas & V. Pimpan, 2008, Yao, et.al., 2010, H.B. Li, et al., 2009), melamin (C. Han & H. Li, 2010), asam amino, DNA, dan pestisida (Vamvakaki, et.al., 2007, Dubas S.T. & Pimpan, V., 2008). Pendeteksian analit dengan metode ini yaitu dengan cara mendeteksi perubahan absorbansi atau pergeseran panjang gelombang yang terjadi. Dengan mengamati perubahan yang terjadi, maka dapat diketahui hubungan antara konsentrasi analit dengan perubahan yang terjadi, absorbansi ataupun panjang gelombang. Pendeteksian pestisida dengan menggunakan metode kolorimetri telah berhasil dilakukan. Pestisida yang telah berhasil dideteksi dengan metode ini diantaranya jenis pestisida yang mengandung senyawa organophosphate, paraoxon, parathion, dichlorvos, omethoate (Vamvakaki, et.al., 2007), pestisida optunal (parathion-methyl, pyrimethanil, methomyl, acetamiprid) (Dejun Xiong dan Haibing Li, 2008), sulfurazon-ethyl herbicide (S.T. Dubas & V. Pimpan, 2008), dan fenamithion (Z. Chui, 2011). Organophosphat dapat dideteksi dengan menggunakan biosensor yang tersusun dari enzim acetilcholine (Vamvakaki, et.al., 2007). Sementara herbisida, pestisida optunal dan fenamithion dapat dideteksi dengan nanopartikel perak yang telah dimodifikasi oleh modifikator tertentu (Vamvakaki, et.al., 2007, Dubas S.T. & V. Pimpan, 2008).
2.2 Elemen Sensor Berbasis Nanopartikel Perak
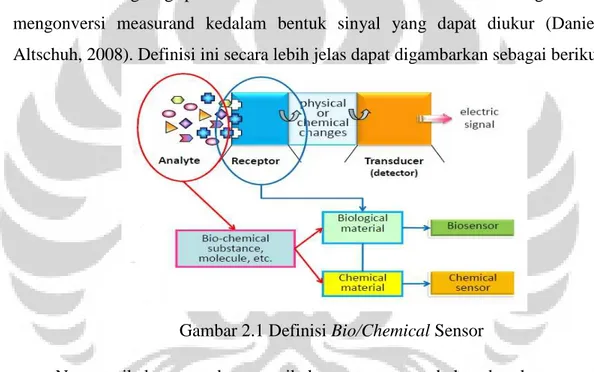
Secara umum, sensor didefinisikan sebagai suatu divais yang dapat merespon sinyal atau stimulus. Berdasarkan IEEE 1451, sensor adalah divais yang dapat menghasilkan listrik, optik, atau data digital yang diperoleh dari kondisi fisik atau suatu kejadian. Sementara bio/chemical sensor merupakan sensor yang memanfaatkan material kimia/biologi sebagai sensing element. Merujuk dari definisi awal, maka bio/chemical sensor terdiri dari dua elemen yaitu sensing
element dan transducer. Sensing element tersusun dari material kimia/biologi yang
berinteraksi langsung pada measurand sementara transducer berfungsi untuk mengonversi measurand kedalam bentuk sinyal yang dapat diukur (Daniele Altschuh, 2008). Definisi ini secara lebih jelas dapat digambarkan sebagai berikut
Gambar 2.1 Definisi Bio/Chemical Sensor
Nanopartikel merupakan partikel yang sangat halus berukuran orde nanometer atau memiliki ukuran dalam interval 1 – 100 nm (M. Hosokawa, et.al., 2007 dan R. Nagarajan, 2008). Nanopartikel tersebut dapat berupa logam. oksida logam, semikonduktor, polimer, material karbon, senyawa organic, dan biologi seperti DNA, protein atau enzim (R. Nagarajan & T. Alan Horton, 2008). Pemanfaatan teknologi nanopartikel telah merambah diberbagai bidang, dintaranya di bidang industri, pertanian, elektronik, dan lain-lain.
Karena sifatnya yang dapat digunakan sebagai pendeteksi, maka dapat dikatakan nanopartikel perak dapat digunakan sebagai basis dari pembuatan elemen sensor. Nanopartikel perak yang dimodifikasi dapat digunakan untuk mendeteksi keberadaan pestisida pada konsentrasi tertentu (Sahoiqin Liu, et.al,
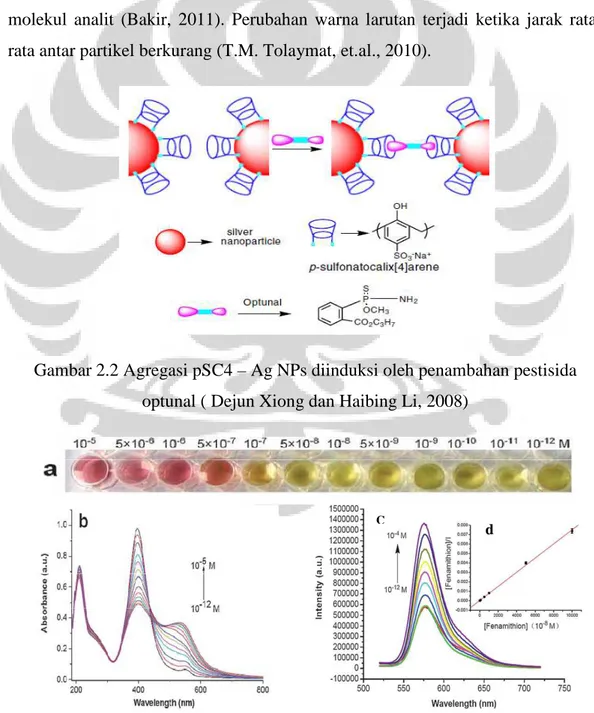
2008, Vamvaki Vicky, et.al, 2007, S.T. Dubas & Pimpan, 2008, Z. Chui, Cuiping Han, & Haibing Li, 2011). Penggunaan nanopartikel logam mulia, seperti perak dan emas secara luas sudah dimanfaatkan. Hal ini dikarenakan nanopartikel logam mulia memiliki koefisien punah (extinction coefficient) yang sangat tinggi dan sifat optis yang bergantung pada ukuran dan bentuk partikel, konstanta dielektrik medium, komposisi, dan jarak antarpartikel (A. Moores & F. Goettmann, 2006, Yao, et.al., 2010). Secara umum, metode kolorimetri dengan menggunakan nanopartikel logam mulia berdasarkan pada agregasi nanopartikel. Agregasi ini terjadi karena adanya reaksi antara ligan pada permukaan nanopartikel dengan molekul analit (Bakir, 2011). Perubahan warna larutan terjadi ketika jarak rata-rata antar partikel berkurang (T.M. Tolaymat, et.al., 2010).
Gambar 2.2 Agregasi pSC4 – Ag NPs diinduksi oleh penambahan pestisida optunal ( Dejun Xiong dan Haibing Li, 2008)
C
Gambar 2.3 Pendeteksian pestisida fenamition 10-12 – 10-5dengan menggunakan nanopartikel perak termodifikasi Rhodamin-B. a. Pendeteksian visual, b. Spektrum
UV-Vis, c. Spektrum emisi FL, d. Grafik sensitivitas sensor
(Zhimin Cui, Cuiping Han, dan Haibing Li, 2011)
2.3 Biosintesis Nanopartikel Perak
Preparasi nanopartikel perak secara garis besar dapat diselesaikan secara top-down (fisika) dan bottom-up (kimia). Metode top-down dilakukan dengan cara mereduksi padatan logam menjadi partikel berukuran nano secara mekanik melalui metode khusus, seperti litografi dan ablasi laser. Kelemahan dari metode ini adalah sifat-sifat material sulit untuk dikontrol. Metode bottom-up dilakukan dengan cara melarutkan garam perak ke dalam pelarut tertentu, kemudian ditambahkan agen preduksi dan agen penstabil. Namun demikian, metode-metode ini memiliki banyak permasalahan diantaranya menggunakan pelarut beracun, limbah berbahaya, dan konsumsi energy tinggi (K.N. Thakkar, et al., 2011).
Suatu metode alternatif untuk sintesis nanopartikel adalah dengan memanfaatkan makhluk hidup sebagai agen biologi pada proses sintesisnya yang dikenal sebagai biosintesis (V. Kumar & S. K. Yadav, 2009). Kelebihan utama proses biosintesis dibandingkan dengan proses kimia dan fisika ialah dari segi prosesnya yang sederhana, jauh lebih murah, dan minim dalam penggunaan bahan kimia yang berbahaya. Senyawa-senyawa yang terlibat di proses biosintesis berupa senyawa organik seperti enzim, protein, dan karbohidrat ataupun senyawa metabolit sekunder dari tumbuhan (S.S. Shankar, A. Rai, A, Ahmad & M. Sastry, 2004). Senyawa-senyawa tersebut jauh lebih aman dan tidak membahayakan. Oleh karena itu, metode biosintesis dikenal juga sebagai metode green synthesis (Shikuo Li, Yuhua Shen, Anjian Xie, Xuerong Yu, Lingguang Qiu, Li Zhang & Qingfeng Zhang, 2007).
Biosintesis nanopartikel dengan menggunakan tumbuhan memberikan beberapa keuntungan, seperti ramah lingkungan, kompatibel untuk aplikasi farmasi dan medis, murah, tidak memerlukan tekanan, energy, dan temperatur tinggi serta tidak memerlukan bahan kimia beracun (E.K. Elumalai, et al., 2011). Terdapat beberapa tumbuhan yang telah dimanfaatkan untuk menghasilkan
nanopartikel perak secara ekstraseluler maupun intraseluler (Bakir, 2011). Tumbuhan yang telah dimanfaatkan sebagai agen biosintesis untuk mengh
nanopartikel perak diantaranya
loonga, Azadiracta indica
Aloe vera (Chandran, S. Prathap., et al., 2006)
tumbuhan lainnya.
menggunakan tumbuhan, Ag (0) terbentuk melalui reaksi reduksi oksidasi (redoks) ion Ag (I) pada larutan maupun ion Ag (I) yang terkandung dalam senyawa tumbuhan, seperti enzim dan reduktan yang terkandung dal
(V. Kumar & S. K. Yadav, 2009). Hingga saat ini, proses biosintesis terkait
dengan reduksi Ag+menjadi nanopartikel perak masih terus diteliti.
2.4 UV-Vis Spektrofotometer
Spektrofotometer adalah adalah photometer / instrument pengukur
intensitas cahaya sebagai fungsi panjang gelombang. Berdasarkan banyaknya sumber cahaya, spektrofotometer terbagi menjadi
spektrofotometer UV
Gambar 2.4. Skematik
Prinsip kerja dari
adanya pemisahan berkas cahaya sumber oleh
berkas cahaya tersebut diseleksi oleh kisi agar didapatkan intensitas tertentu. Kemudian berkas cahaya ini akan diserap oleh
oleh detektor. Sebelum dilakukan pengukuran terhadap larutan uji, terlebih dahulu nanopartikel perak secara ekstraseluler maupun intraseluler (Bakir, 2011). Tumbuhan yang telah dimanfaatkan sebagai agen biosintesis untuk mengh
nanopartikel perak diantaranya Diospyros blancoi (Bakir, 2011),
Azadiracta indica (S.S. Shankar, A. Rai, A, Ahmad & M. Sastry, 2004),
Chandran, S. Prathap., et al., 2006), dan masih terdapat beberapa
Pada proses biosintesis nanopartikel perak dengan
menggunakan tumbuhan, Ag (0) terbentuk melalui reaksi reduksi oksidasi (redoks) ion Ag (I) pada larutan maupun ion Ag (I) yang terkandung dalam senyawa tumbuhan, seperti enzim dan reduktan yang terkandung dal
(V. Kumar & S. K. Yadav, 2009). Hingga saat ini, proses biosintesis terkait menjadi nanopartikel perak masih terus diteliti.
Vis Spektrofotometer
Spektrofotometer adalah adalah photometer / instrument pengukur cahaya sebagai fungsi panjang gelombang. Berdasarkan banyaknya
sumber cahaya, spektrofotometer terbagi menjadi single beam dan
spektrofotometer UV-Vis.
4. Skematik single-beam UV-Vis spektrofotometer
Prinsip kerja dari single-beam spektrofotometer UV-Vis diawali dengan
adanya pemisahan berkas cahaya sumber oleh diffraction grating
berkas cahaya tersebut diseleksi oleh kisi agar didapatkan intensitas tertentu.
Kemudian berkas cahaya ini akan diserap oleh sample cuvette kemudian dideteksi
oleh detektor. Sebelum dilakukan pengukuran terhadap larutan uji, terlebih dahulu nanopartikel perak secara ekstraseluler maupun intraseluler (Bakir, 2011).
Tumbuhan yang telah dimanfaatkan sebagai agen biosintesis untuk menghasilkan
(Bakir, 2011), Curcuma
(S.S. Shankar, A. Rai, A, Ahmad & M. Sastry, 2004), , dan masih terdapat beberapa da proses biosintesis nanopartikel perak dengan menggunakan tumbuhan, Ag (0) terbentuk melalui reaksi reduksi oksidasi (redoks) ion Ag (I) pada larutan maupun ion Ag (I) yang terkandung dalam
senyawa tumbuhan, seperti enzim dan reduktan yang terkandung dalam tumbuhan
(V. Kumar & S. K. Yadav, 2009). Hingga saat ini, proses biosintesis terkait menjadi nanopartikel perak masih terus diteliti.
Spektrofotometer adalah adalah photometer / instrument pengukur cahaya sebagai fungsi panjang gelombang. Berdasarkan banyaknya
dan double beam
Vis spektrofotometer
Vis diawali dengan
diffraction grating. Kemudian
berkas cahaya tersebut diseleksi oleh kisi agar didapatkan intensitas tertentu. kemudian dideteksi oleh detektor. Sebelum dilakukan pengukuran terhadap larutan uji, terlebih dahulu
diujikan sample cuvette yang berisi pelarut dari larutan uji. Pada pengujian ini akan didapatkan I0 yang merupakan intensitas cahaya yang melewati cuvette pelarut. Kemudian dengan proses yang sama dilakukan pengujian terhadap larutan uji dan akan didapatkan I yang merupakan intensitas cahaya yang melewati larutan uji. Kedua proses ini kemudian dibandingkan.
Gambar 2.5. Skematik double beam UV-Vis spektrofotometer (Bauer, H.H., Christian, G.D.,& O'Reilly, J.E., 1978)
Sementara pada double-beam spektrofotometer UV-Vis, prinsip kerja dari instrument ini diawali dengan adanya pemisahan komponen panjang gelombang cahaya yang berasal dari sumber radiasi UV-Visible oleh prisma ataupun diffraction grating. Kemudian berkas sinar monokromatis akan terbagi menjadi dua bagian dengan intensitas yang sebanding dengan mirror dan dipantulkan. Berkas cahaya yang dipantulkan masing-masing melewati
cuvette berisi larutan referensi (berisi pelarut dari larutan uji) dan cuvette
berisi larutan uji,kemudian berkas cahaya yang melewati kedua cuvette ini dideteksi oleh detektor. Kedua proses yang bersamaan ini kemudian dibandingkan.
3. METODE EKSPERIMEN
3.1 Pembuatan Elemen Sensor Pendeteksi Pestisida
Proses pembuatan elemen sensor pestisida dilakukan melalui beberapa tahapan yaitu proses pembuatan air rebusan jahe, pembuatan nanopartikel perak,
dan modifikasi nanopartikel perak dengan asam asetat 0,1%, dan karakterisasi elemen sensor dengan spektrofoto
pembuatan elemen sensor pendeteksi pestisida ditunjukkan pada gambar berikut :
Gambar 3.1
elemen sensor pendeteksi pestisida (npp termodifikasi asam asetat 0,1%)
Tahapan pertama yang dila
pestisida adalah proses biosintesis rimpang jahe. Tahapan ini bertujuan untuk mendapatkan air rebusan jahe yang sesuai untuk biosintesis pembentukan nanopartikel perak. Langkah pertama yang dilakukan adalah menimbang jah seberat 5 gram kemudian jahe tersebut direbus ke dalam 100 mL akuabides sampai dengan suhu 100
dibiarkan selama 15 menit. Kemudian air rebusan dikondisikan hingga mencapai
suhu 30oC. Untuk mendapatkan
penyaringan terhadap air rebusan tersebut dengan menggunakan kertas Whatman dan modifikasi nanopartikel perak dengan asam asetat 0,1%, dan karakterisasi
elemen sensor dengan spektrofotometer UV-Vis. Secara spesifik, diagram
pembuatan elemen sensor pendeteksi pestisida ditunjukkan pada gambar berikut :
Gambar 3.1 Diagram tahapan pembuatan
elemen sensor pendeteksi pestisida (npp termodifikasi asam asetat 0,1%)
Tahapan pertama yang dilakukan dalam pembuatan elemen sensor pestisida adalah proses biosintesis rimpang jahe. Tahapan ini bertujuan untuk mendapatkan air rebusan jahe yang sesuai untuk biosintesis pembentukan nanopartikel perak. Langkah pertama yang dilakukan adalah menimbang jah seberat 5 gram kemudian jahe tersebut direbus ke dalam 100 mL akuabides
sampai dengan suhu 100oC. Setelah mencapai suhu 100oC, air rebusan tersebut
dibiarkan selama 15 menit. Kemudian air rebusan dikondisikan hingga mencapai C. Untuk mendapatkan kemurnian air rebusannya, maka dilakukan penyaringan terhadap air rebusan tersebut dengan menggunakan kertas Whatman dan modifikasi nanopartikel perak dengan asam asetat 0,1%, dan karakterisasi Vis. Secara spesifik, diagram pembuatan elemen sensor pendeteksi pestisida ditunjukkan pada gambar berikut :
elemen sensor pendeteksi pestisida (npp termodifikasi asam asetat 0,1%)
kukan dalam pembuatan elemen sensor pestisida adalah proses biosintesis rimpang jahe. Tahapan ini bertujuan untuk mendapatkan air rebusan jahe yang sesuai untuk biosintesis pembentukan
nanopartikel perak. Langkah pertama yang dilakukan adalah menimbang jahe
seberat 5 gram kemudian jahe tersebut direbus ke dalam 100 mL akuabides C, air rebusan tersebut dibiarkan selama 15 menit. Kemudian air rebusan dikondisikan hingga mencapai kemurnian air rebusannya, maka dilakukan penyaringan terhadap air rebusan tersebut dengan menggunakan kertas Whatman
no. 41. Setelah didapatkan air rebusan dari proses penyaringan, air rebusan siap untuk digunakan proses pelanjutnya.
Proses selanjutnya yang dilakukan dalam pembuatan elemen sensor pestisida adalah pembuatan nanopartikel perak. Pembuatan nanopartikel perak dilakukan melalui proses biosintesis larutan AgNO3 1 mM oleh air rebusan jahe. Proses ini merupakan proses pencampuran kedua larutan tersebut dengan perbandingan volume masing-masing 5:1 (AgNO3 : air rebusan jahe). Kemudian hasil biosintesis ini direaksikan selama 24 jam untuk selanjutnya dikarakterisasi dengan spektrofotometer UV-Vis. Karakterisasi dengan spektrofotometer UV-Vis ini dilakukan untuk memastikan keberadaan nanopartikel perak serta mengetahui puncak absorbansi yang terbentuk. Setelah terbentuk nanopartikel perak, kemudian dilakukan proses modifikasi dengan menggunakan larutan asam asetat 0,1%. Proses modifikasi dilakukan untuk mempermudah proses pengikatan pestisida oleh nanopartikel perak. Proses ini dilakukan dengan cara mencampurkan larutan nanopartikel perak dan larutan asam asetat 0,1% dengan perbandingan volum 7:2 (NPP : asam asetat 0,1%). Setelah proses pencampuran, larutan tersebut kemudian distirer selama dua jam. Larutan siap digunakan untuk tahapan pengujian.
3.2 Pengujian Elemen Sensor Terhadap Pestisida
Pengujian dibuat dengan cara membuat larutan uji kemudian melihat dan mengambil data perubahan absorbansi yang terjadi dengan spektrofotometer UV-Vis. Sementara pengujian dengan faktor tertentu dilakukan dengan membuat larutan uji, penambahan faktor yang dianggap berpengaruh, kemudian melihat dan mengambil data perubahan absorbansi yang terjadi. Larutan uji dibuat dengan cara mencampur 2 mL larutan pendeteksi dengan 1 mL larutan analit (larutan yang dideteksi). Diagram dari tahapan pengujian ini adalah sebagai berikut :
Gambar 3.2 Diagram pengujian elemen sensor pestisida
3.2 Uji Sensitivitas Elemen Sensor Terhadap 3 Jenis Pestisida
Sensitivitas merupakan kemampuan sensor yang menggambarkan seberapa baik sensor dapat mengenali measurand.
mencampur 2 mL larutan pendeteksi (
pestisida. Dibuat berbagai variasi dengan memvariasikan 3 jenis pestisida, yaitu herbisida organofosfat (ROUNDUP), insektisida peritroid (DECIS)
karbamat (DITHANE M
adalah 0,5 ; 5; 10; 15; 20 ppm pestisida. Kemudian dari berbagai larutan variasi yang dibuat dilakukan screening dan pengambilan data absorbansi dengan
spektrofotometer UV
3.3 Uji Reproduksibilitas Sensor
Reproduksibilitas sensor merupakan kemampuan sensor untuk kembali diproduksi dengan karakteristik yang sama.
membuat sensor sebanyak 2 kali pengulangan dengan komposisi, kondisi material, dan pengaruh lingkungan yang sama. Kemudian melakukan pengujian seperti pada proses pengujian 3.3.2.
Gambar 3.2 Diagram pengujian elemen sensor pestisida
Sensitivitas Elemen Sensor Terhadap 3 Jenis Pestisida
Sensitivitas merupakan kemampuan sensor yang menggambarkan seberapa
baik sensor dapat mengenali measurand. Uji sensitivitas dilakukan dengan cara
mencampur 2 mL larutan pendeteksi (sensing element) dengan 1 mL larutan
pestisida. Dibuat berbagai variasi dengan memvariasikan 3 jenis pestisida, yaitu herbisida organofosfat (ROUNDUP), insektisida peritroid (DECIS)
karbamat (DITHANE M-45). Konsentrasi yang digunakan dalam pengujian ini
adalah 0,5 ; 5; 10; 15; 20 ppm pestisida. Kemudian dari berbagai larutan variasi yang dibuat dilakukan screening dan pengambilan data absorbansi dengan
UV-Vis.
Uji Reproduksibilitas Sensor
Reproduksibilitas sensor merupakan kemampuan sensor untuk kembali
diproduksi dengan karakteristik yang sama. Pengujian ini dilakukan dengan cara
membuat sensor sebanyak 2 kali pengulangan dengan komposisi, kondisi material, dan pengaruh lingkungan yang sama. Kemudian melakukan pengujian seperti pada proses pengujian 3.3.2.
Gambar 3.2 Diagram pengujian elemen sensor pestisida
Sensitivitas merupakan kemampuan sensor yang menggambarkan seberapa Uji sensitivitas dilakukan dengan cara ) dengan 1 mL larutan pestisida. Dibuat berbagai variasi dengan memvariasikan 3 jenis pestisida, yaitu
herbisida organofosfat (ROUNDUP), insektisida peritroid (DECIS), dan fungisida
45). Konsentrasi yang digunakan dalam pengujian ini adalah 0,5 ; 5; 10; 15; 20 ppm pestisida. Kemudian dari berbagai larutan variasi yang dibuat dilakukan screening dan pengambilan data absorbansi dengan
Reproduksibilitas sensor merupakan kemampuan sensor untuk kembali ini dilakukan dengan cara membuat sensor sebanyak 2 kali pengulangan dengan komposisi, kondisi material, dan pengaruh lingkungan yang sama. Kemudian melakukan pengujian
3.4 Aging Effect dan Stabilitas Sensor
Aging effect mendeskripsikan pengaruh waktu terhadap kinerja dan karakteristik sensor. Sementara stabilitas sensor mendeskripsikan kestabilan sensor sampai dengan periode tertentu. Pengujian ini dilakukan dengan melihat perubahan yang terjadi pada sensor baik secara visual dan optik (karakterisasi dengan spektrofotometer UV-Vis) selama periode tertentu. Pengambilan data absorbansi dilakukan selama 1 bulan dengan interval waktu pengambilan data absorbansi selama 1 minggu.
4. HASIL DAN DISKUSI 4.1 Hasil
4.1.1 Pembuatan Elemen Sensor Pestisida
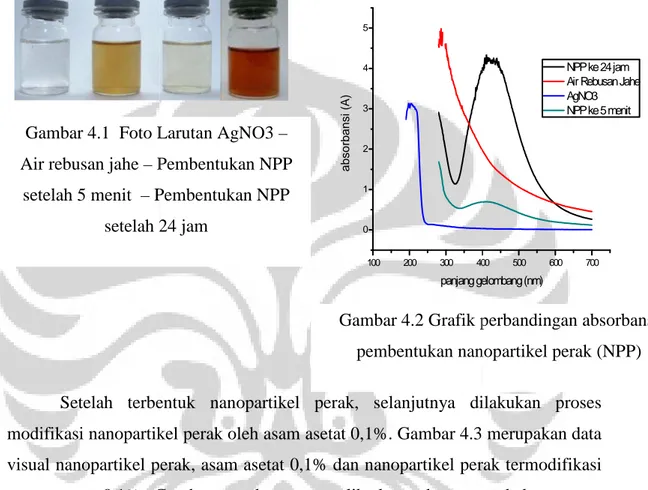
Gambar 4.1 merupakan foto perbandingan larutan AgNO3, air rebusan jahe, dan kedua larutan setelah dicampurkan selama 5 menit, dan 24 jam. Perbandingan ini dilakukan untuk mengetahui perubahan yang terjadi antara larutan pembentuk nanopartikel perak sampai terbentuknya nanopartikel perak di dalam larutan tersebut. Larutan AgNO3 berwarna bening, air rebusan jahe berwarna cokelat muda. Setelah dilakukan pencampuran kedua larutan tersebut dengan perbandingan 5:1 (AgNO3 : air rebusan jahe) dan bereaksi selama 5 menit, larutan berwarna krem. Setelah larutan direaksikan selama 24 jam larutan berubah warna menjadi cokelat tua.
Kemudian dari larutan tersebut dilakukan pengambilan data absorbansi dengan menggunakan spektrofotometer UV-Vis. Dan dihasilkan Gambar 4.2. gambar tersebut memperlihatkan perbandingan absorbansi antara larutan AgNO3, air rebusan jahe, campuran kedua larutan setelah bereaksi 5 menit dan setelah bereaksi 24 jam, telah terbentuk nanopartikel perak. Gambar 4.2 menunjukkan bahwa AgNO3 tidak memiliki puncak absorbansi pada 400 – 500 nm, akan tetapi puncak absorbansi AgNO3 terdapat pada panjang gelombang sekitar 200 nm. Demikian pula dengan air rebusan jahe yang tidak memiliki puncak absorbansi
pada 400 – 500 nm. Campuran antara kedua larutan ini (AgNO jahe) menghasilkan larutan dengan puncak absorbansi pa puncak absorbansi pada panjang gelombang 400
terbentuknya nanopartikel perak (S.D. Solomon, et al., 2007).
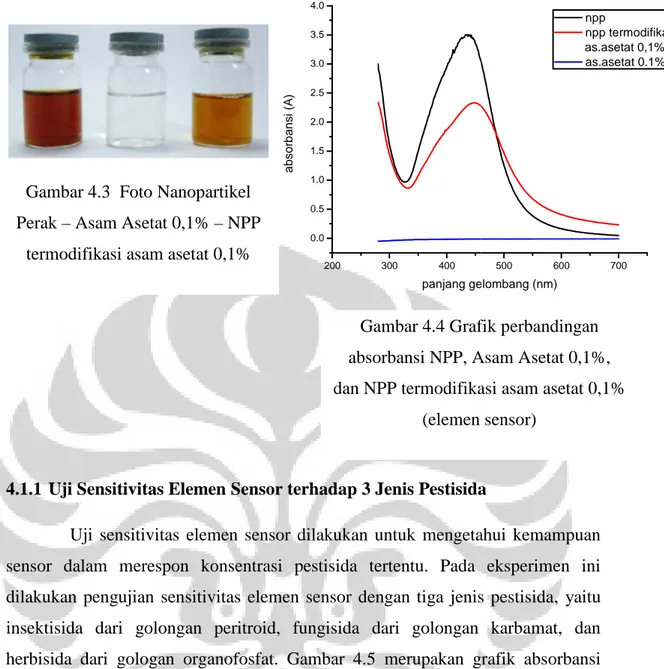
Setelah terbentuk nanopartikel perak, selanjutnya dilakukan proses modifikasi nanopartikel perak oleh asam asetat 0,1%. Gambar 4.3 merupakan data visual nanopartikel perak, asam asetat 0,1% dan nanopartikel perak termodifikasi asam asetat 0,1%. Gambar ters
larutan nanopartikel perak dari cokelat tua menjadi cokelat lebih muda ketika dimodifikasi asam asetat 0,1%.
Perubahan warna yang terjadi didukung oleh grafik absorbansi pada gambar
4.4. Gambar tersebut memperlihatkan adanya penurunan absorbansi dari 3,431 A menjadi 3,311 A dan pergeseran panjang gelombang pada puncak absorbansi dari 452 nm menjadi 440 nm setelah termodifikasi asam asetat 0,1%.
Gambar 4.1 Foto Larutan AgNO3
Air rebusan jahe – Pembentukan NPP
setelah 5 menit – Pembentukan NPP setelah 24 jam
500 nm. Campuran antara kedua larutan ini (AgNO3
jahe) menghasilkan larutan dengan puncak absorbansi pada 450. Terbentuknya
puncak absorbansi pada panjang gelombang 400 – 500 nm menunjukkan telah
terbentuknya nanopartikel perak (S.D. Solomon, et al., 2007).
Setelah terbentuk nanopartikel perak, selanjutnya dilakukan proses modifikasi nanopartikel perak oleh asam asetat 0,1%. Gambar 4.3 merupakan data visual nanopartikel perak, asam asetat 0,1% dan nanopartikel perak termodifikasi asam asetat 0,1%. Gambar tersebut memperlihatkan adanya perubahan warna larutan nanopartikel perak dari cokelat tua menjadi cokelat lebih muda ketika dimodifikasi asam asetat 0,1%.
ubahan warna yang terjadi didukung oleh grafik absorbansi pada gambar Gambar tersebut memperlihatkan adanya penurunan absorbansi dari 3,431 A menjadi 3,311 A dan pergeseran panjang gelombang pada puncak absorbansi dari 452 nm menjadi 440 nm setelah termodifikasi asam asetat 0,1%.
100 200 300 400 0 1 2 3 4 5 a b s o rb a n s i (A ) panjang gelombang (nm)
Gambar 4.2 Grafik perbandingan absorbansi pembentukan nanopartikel perak (NPP)
.1 Foto Larutan AgNO3 –
Pembentukan NPP Pembentukan NPP setelah 24 jam
3 dan air rebusan
da 450. Terbentuknya 500 nm menunjukkan telah
Setelah terbentuk nanopartikel perak, selanjutnya dilakukan proses modifikasi nanopartikel perak oleh asam asetat 0,1%. Gambar 4.3 merupakan data visual nanopartikel perak, asam asetat 0,1% dan nanopartikel perak termodifikasi ebut memperlihatkan adanya perubahan warna larutan nanopartikel perak dari cokelat tua menjadi cokelat lebih muda ketika
ubahan warna yang terjadi didukung oleh grafik absorbansi pada gambar Gambar tersebut memperlihatkan adanya penurunan absorbansi dari 3,431 A menjadi 3,311 A dan pergeseran panjang gelombang pada puncak absorbansi dari
400 500 600 700
panjang gelombang (nm)
NPP ke 24 jam Air Rebusan Jahe AgNO3 NPP ke 5 menit
2 Grafik perbandingan absorbansi pembentukan nanopartikel perak (NPP)
200 300 400 500 0.0 0.5 1.0 1.5 2.0 2.5 3.0 a b s o rb a n s i (A ) panjang gelombang (nm)
4.1.1 Uji Sensitivitas Elemen Sensor terhadap 3 Jenis Pestisida
Uji sensitivitas elemen sensor dilakukan untuk mengetahui kemampuan sensor dalam merespon konsentrasi pestisida tertentu. Pada eksperimen ini dilakukan pengujian sensitivitas elemen sensor dengan tiga jenis pestisida
insektisida dari golongan peritroid, fungisida dari golongan karbamat, dan
herbisida dari gologan organofosfat. Gambar 4.5 dari proses pendeteksian insektisida
dapat diketahui lebih jelas bahwa kurva absorbansi pada puncak absorbansi semakin meningkat jika konsentrasi pestisida diperbesar.
Gambar 4.3 Foto Nanopartikel
Perak – Asam Asetat 0,1% termodifikasi asam asetat 0,1%
600 700 panjang gelombang (nm) sensor sensor+0,5 ppm decis sensor+5 ppm decis sensor+10 ppm decis sensor+15 ppm decis sensor+20 ppm decis
Sensitivitas Elemen Sensor terhadap 3 Jenis Pestisida
Uji sensitivitas elemen sensor dilakukan untuk mengetahui kemampuan sensor dalam merespon konsentrasi pestisida tertentu. Pada eksperimen ini dilakukan pengujian sensitivitas elemen sensor dengan tiga jenis pestisida
insektisida dari golongan peritroid, fungisida dari golongan karbamat, dan
gologan organofosfat. Gambar 4.5 merupakan grafik absorbansi
dari proses pendeteksian insektisida-peritroid oleh elemen sensor. Dari gambar 4.6
i lebih jelas bahwa kurva absorbansi pada puncak absorbansi semakin meningkat jika konsentrasi pestisida diperbesar.
200 300 400 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 a b s o rb a n s i (A ) panjang gelombang (nm)
Gambar 4.4 Grafik perbandingan absorbansi NPP, Asam Asetat 0,1%, dan NPP termodifikasi asam asetat 0,1%
(elemen sensor)
Nanopartikel
Asam Asetat 0,1% – NPP
termodifikasi asam asetat 0,1%
Gambar 4.5 Kurva absorbansi dan foto pengujian sensitivitas elemen sensor
insektisida-peritroid a). elemen
sensor ditetesi insektisida-peritroid 0,5 ppm,
a b c d
Sensitivitas Elemen Sensor terhadap 3 Jenis Pestisida
Uji sensitivitas elemen sensor dilakukan untuk mengetahui kemampuan sensor dalam merespon konsentrasi pestisida tertentu. Pada eksperimen ini
dilakukan pengujian sensitivitas elemen sensor dengan tiga jenis pestisida, yaitu
insektisida dari golongan peritroid, fungisida dari golongan karbamat, dan merupakan grafik absorbansi h elemen sensor. Dari gambar 4.6 i lebih jelas bahwa kurva absorbansi pada puncak absorbansi
500 600 700 panjang gelombang (nm) npp npp termodifikasi as.asetat 0,1% as.asetat 0.1% 4 Grafik perbandingan absorbansi NPP, Asam Asetat 0,1%, dan NPP termodifikasi asam asetat 0,1%
elemen sensor)
Gambar 4.5 Kurva absorbansi dan foto pengujian sensitivitas elemen sensor
peritroid a). elemen sensor, b).
peritroid 0,5 ppm,
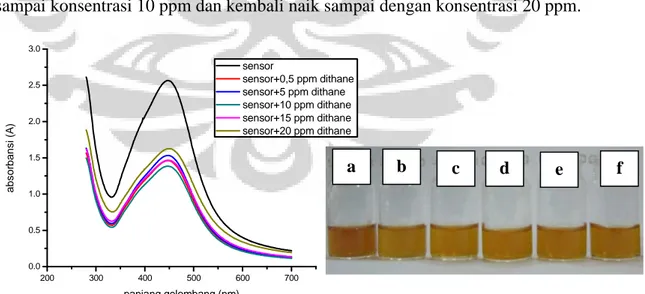
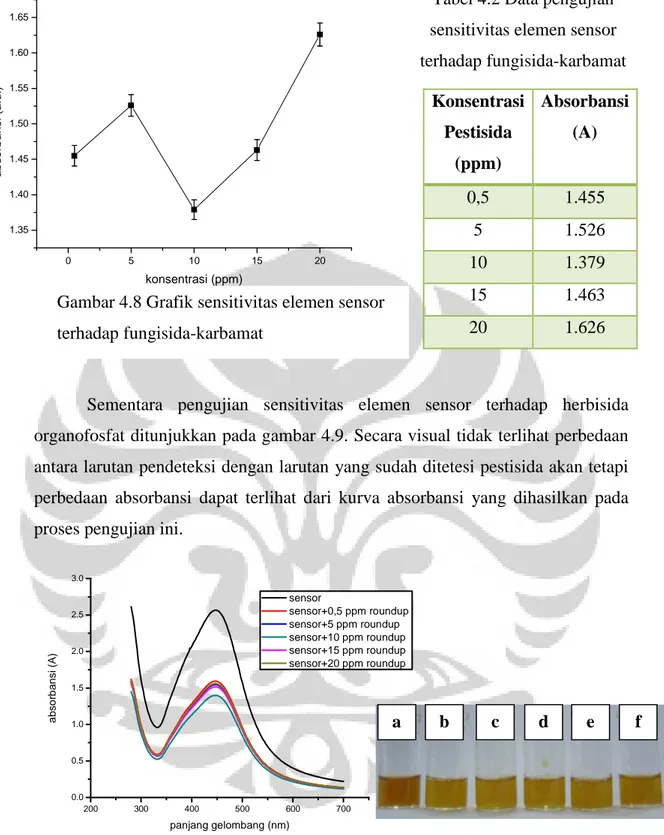
Pengujian sensitivitas elemen sensor juga dilakukan terhadap fungisida golongan karbamat. Secara visual pada gambar 4.7 tidak menunjukkan adanya perubahan warna. Akan tetapi perbedaan antar larutan tersebut dapat dideteksi melalui pengambilan data absorbansi dengan menggunakan spektrofotometer UV-Vis. Dari gambar 4.7 kemudian puncak absorbansi grafik tersebut diplot sehingga menghasilkan grafik seperti pada gambar 4.8. Grafik tersebut menunjukkan pola naik dari 0,5 hingga 5 ppm. Kemudian dari 5 ppm terjadi penurunan absorbansi sampai konsentrasi 10 ppm dan kembali naik sampai dengan konsentrasi 20 ppm.
Konsentrasi Pestisida (ppm) Absorbansi (A) 0,5 1.435 5 1.48 10 1.485 15 1.506 20 1.534 0 5 10 15 20 1.42 1.44 1.46 1.48 1.50 1.52 1.54 1.56 a b so rb a n si (A ) konsentrasi pestisida (ppm)
Tabel 4.1 Data pengujian sensitivitas elemen sensor terhadap insektisida-peritroid
Gambar 4.6 Grafik sensitivitas elemen sensor terhadap insektisida-peritroid 200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 sensor sensor+0,5 ppm dithane sensor+5 ppm dithane sensor+10 ppm dithane sensor+15 ppm dithane sensor+20 ppm dithane a b s o rb a n s i (A ) panjang gelombang (nm)
Gambar 4.7 Kurva absorbansi dan foto pengujian sensitivitas elemen sensor fungisida-karbamat a). elemen sensor, b). sensor ditetesi fungisida-karbamat 0,5
ppm, c) 5 ppm, d) 10 ppm, e) 15 ppm, f) 20 ppm
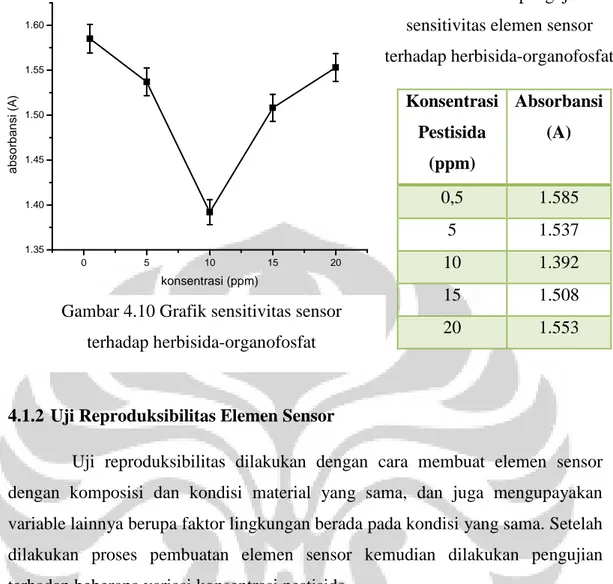
Sementara pengujian sensitivitas elemen sensor terhadap herbisida organofosfat ditunjukkan pada gambar 4.9. Secara visual tidak terlihat perbedaan antara larutan pendeteksi dengan larutan yang sudah ditetesi pestisida akan tetapi perbedaan absorbansi dapat terlihat dari kurva absorbansi yang dihasilkan pada proses pengujian ini.
Konsentrasi Pestisida (ppm) Absorbansi (A) 0,5 1.455 5 1.526 10 1.379 15 1.463 20 1.626 0 5 10 15 20 1.35 1.40 1.45 1.50 1.55 1.60 1.65 a b s o rb a n s i (a .u .) konsentrasi (ppm)
Gambar 4.8 Grafik sensitivitas elemen sensor terhadap fungisida-karbamat
Tabel 4.2 Data pengujian sensitivitas elemen sensor terhadap fungisida-karbamat 200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 sensor sensor+0,5 ppm roundup sensor+5 ppm roundup sensor+10 ppm roundup sensor+15 ppm roundup sensor+20 ppm roundup a bs o rb ans i (A ) panjang gelombang (nm) a b c d e f
Gambar 4.9 Kurva absorbansi dan foto pengujian sensitivitas elemen sensor herbisida-organofosfat a). elemen sensor, b). sensor ditetesi herbisida-herbisida-organofosfat 0,5 ppm, c) 5 ppm,
4.1.2 Uji Reproduksibilitas Elemen Sensor
Uji reproduksibilitas dilakukan dengan cara membuat elemen sensor dengan komposisi dan kondisi material yang sama, dan juga mengupayakan variable lainnya berupa faktor lingkungan berada pada kondisi yang sama. Setelah dilakukan proses pembuatan elemen sensor kemudian dilakukan pengujian terhadap beberapa variasi konsentrasi pestisida.
Gambar 4.11a menunjukkan grafik reproduksibilitas elemen sensor terhadap insektisida-peritroid. Dilakukan dua eksperimen pembuatan elemen sensor pestisida kemudian didapatkan grafik sensitivitas yang cenderung mengalami peningkatan absorbansi ketika konsentrasi pestisida dinaikkan. Keduan eksperimen menunjukkan pola yang hampir sama dan data antara eksperimen 1 dan 2 cenderung berdekatan. Sementara gambar 4.11b dan 4.11c merupakan grafik resproduksibilitas elemen sensor terhadap fungisida karbamat dan herbisida organofosfat. Dari kedua gambar tersebut terlihat grafik eksperimen 1 dan 2 pada masing-masing grafik reproduksibilitas menunjukkan trendline yang berbeda pada gambar 4.11b dan titik yang jauh berbeda pada 4.11c.
Konsentrasi Pestisida (ppm) Absorbansi (A) 0,5 1.585 5 1.537 10 1.392 15 1.508 20 1.553 0 5 10 15 20 1.35 1.40 1.45 1.50 1.55 1.60 a b s o rb a n s i (A ) konsentrasi (ppm)
Tabel 4.3 Data pengujian sensitivitas elemen sensor terhadap herbisida-organofosfat
Gambar 4.10 Grafik sensitivitas sensor terhadap herbisida-organofosfat
4.1.3 Aging Effect dan Uji Stabilitas Sensor
Uji pengaruh waktu dan stabilitas elemen sensor dilakukan dengan cara mengambil data absorbansi elemen sensor berupa nanopartikel perak termodifikasi asam asetat 0,1% pada 0, 1, 2, dan 3 minggu. Gambar 4.12a dan b merupakan kurva absorbansi nanopartikel dan elemen sensor (nanopartikel termodifikasi asam asetat 0,1% selama 0, 1, 2, 3 minggu. Dari gambar tersebut terlihat bahwa terjadi kenaikan absorbansi dan kenaikan Full Width Half Maximum (FWHM) seiring dengan bertambahnya waktu. Kenaikan ini secara lebih jelas diperlihatkan pada gambar 4.13 (absorbansi) dan 4.14 (FWHM).
0 5 10 15 20 1.42 1.44 1.46 1.48 1.50 1.52 1.54 1.56 1.58 1.60 eksperimen 1 eksperimen 2 a b s o rb a n s i (A ) konsentrasi pestisida (ppm) 0 5 10 15 20 1.36 1.38 1.40 1.42 1.44 1.46 1.48 1.50 1.52 1.54 1.56 1.58 1.60 1.62 1.64 a b s o rb a n s i (A ) konsentrasi pestisida (ppm) eksperimen 1 eksperimen 2 0 2 4 6 8 10 12 14 16 1.10 1.15 1.20 1.25 1.30 1.35 1.40 1.45 1.50 1.55 1.60 eksperim en ke-1 eksperim en ke-2 A b s o rb a n s i (A ) konsentrasi pestisida (ppm )
Gambar 4.11 Uji reproduksibilitas elemen sensor terhadap a) insektisida-peritroid, b) fungisida-karbamat, c) herbisida-karbamat
a b
4.2 Diskusi
4.2.1 Pembuatan Elemen Sensor
Material dasar yang digunakan untuk pembuatan sensor ini adalah nanopartikel perak. Terbentuknya nanopartikel perak pada suatu larutan ditandai dengan adanya perubahan warna larutan menjadi kuning hingga kecokelatan (S.S.
200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 NPP 1 hari NPP 5 hari NPP 12 hari NPP 20 hari a b s o rb a n s i (a .u .) panjang gelombang (nm) 200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 a b s o rb a n s i (a .u .) panjang gelombang (nm) NPP+asetat 1 hari NPP+asetat 8 hari NPP+asetat 15 hari NPP+asetat 22 hari a b
Gambar 4.11 Grafik absorbansi a) nanopartikel perak, b) elemen sensor pestisida (nanopartikel termodifikasi asam asetat 0,1%)
0 5 10 15 20 25 1.8 2.0 2.2 2.4 2.6 2.8 3.0 3.2 3.4 3.6 3.8 4.0 4.2 NPP NPP+as.asetat 0,1% a b s o rb a n s i (a .u .) waktu (hari) 0 5 10 15 20 25 0 20 40 60 80 100 120 140 160 180 200 220 240 F W H M waktu (hari) FWHM NPP FWHM NPP+as. asetat
Gambar 4.12 Grafik perbandingan nanopartikel perak dan elemen sensor a) absorbansi, b) FWHM
Shankar, A. Rai, A, Ahmad & M. Sastry, 2004). Larutan AgNO3 setelah dibiosintesis dengan rimpang jahe, berwarna krem dan setelah 24 jam berubah menjadi kecokelatan (Gambar 4.1). Hal ini terjadi karena proses reduksi dari ion perak sehingga terbentuk nanopartikel perak (V. Kumar & S. K. Yadav, 2009). Selain perubahan warna larutan menjadi kuning atau kecokelatan, indikasi lain terbentuknya nanopartikel perak ditandai dengan terbentuknya puncak absorbansi pada panjang gelombang 400 – 500 nm (S.D. Solomon, et al., 2007). Larutan AgNO3 maupun air rebusan jahe tidak memiliki puncak absorbansi pada panjang gelombang 400 – 500 nm. Sementara campuran keduanya dengan perbandingan 5:1 (AgNO3 : air rebusan jahe) memiliki puncak absorbansi pada 400 – 500 nm. Dengan adanya indikasi-indikasi tersebut, yang mungkin terbentuk dari kedua campuran larutan tersebut adalah nanopartikel perak. Larutan AgNO3 dibiosintesis dengan rimpang jahe setelah 24 jam menghasilkan puncak absorbansi maksimum pada panjang gelombang berkisar 425 – 433 nm. Sementara nilai absorbansi maksimum berkisar antara 2,5 – 4,5 A (Gambar 4.2). Gambar 4.2 menunjukkan adanya grafik absorbansi yang juga meningkat pada panjang gelombang kurang dari 350 nm, hal ini dikarenakan karena kemampuan kuvet yang hanya dapat mendeteksi antara kisaran 280 – 700 nm. Dengan demikian, nilai absorbansi tersebut diperkirakan berasal dari absorbansi dinding kuvet.
Berdasarkan penelitian yang dilakukan oleh M. Irfan Hasan pada tahun 2012, AgNO3 dibiosintesis dengan air rebusan daun bisbul menghasilkan ukuran partikel sebesar 61,07 nm (Lampiran 3). Metode yang digunakan dalam proses pembuatan nanopartikel tersebut identik dengan yang dilakukan pada penelitian ini. Menurut Solomon, et al. (2007) munculnya puncak absorbansi pada panjang gelombang maksimum 438 nm, partikel berukuran 60 – 80 nm. Dengan demikian nanopartikel yang dipergunakan sebagai basis pembuatan sensor ini diperkirakan berukuran 60 – 80 nm.
Pemilihan air rebusan jahe sebagai agen pereduksi AgNO3 berdasarkan pada penelitian yang telah dilakukan sebelumnya. Terlihat pada gambar 2.2 (Lampiran 2) bahwa AgNO3 ditambah dengan air rebusan jahe menghasilkan nilai absorbansi yang paling tinggi. Setelah dilakukan proses modifikasi dan pengujian dengan
pestisida, nilai absorbansi yang dihasilkan mengalami penurunan yang sangat ekstrem. Oleh karena itu penggunakan nanopartikel perak dengan jenis rimpang lainnya tidak dilakukan karena nilai absorbansi yang dihasilkan tidak dapat dibedakan secara jelas setelah diberi gangguan berupa pestisida. Adapun senyawa di dalam air rebusan jahe yang berperan sebagai agen pereduksi AgNO3 diperkirakan adalah terpenoid atau flavonoid (Handayani, 2011).
Gambar 4.2 menunjukkan grafik perbandingan absorbansi dari pembentukan nanopartikel perak. Larutan AgNO3 sebelum disintesis dengan rimpang jahe memiliki puncak absorbansi pada panjang gelombang 200 nm (A. Leela & M. Vivekananda, 2008). Sementara air rebusan jahe memiliki puncak absorbansi pada 300 nm. Kedua senyawa ini sebelum proses pencampuran, tidak memiliki puncak absorbansi pada panjang gelombang 400 – 500 nm. Setelah disintesis dengan rimpang jahe selama 5 menit larutan tersebut sudah memiliki puncak absorbansi pada 400 – 500 nm, akan tetapi puncak absorbansi pada waktu tersebut relative masih rendah. Setelah larutan tersebut bereaksi selama 24 jam, puncak absorbansi pada panjang gelombang 400 – 500 nm meningkat sampai 4,5 A. Hal ini menunjukkan bahwa jumlah nanopartikel perak pada larutan tersebut semakin bertambah. Tidak terdapatnya puncak absorbansi pada panjang gelombang 400 -500 nm baik pada air rebusan jahe dan AgNO3 menunjukkan bahwa tidak ada senyawa lain yang mungkin terbentuk selain nanopartikel perak. Pertimbangan ini mengacu pada indikasi terbentuknya nanopartikel perak yang ditandai dengan terbentuknya puncak absorbansi pada panjang gelombang 400 – 500 nm (S.D. Solomon, et al., 2007).
Setelah terjadi pembentukan nanopartikel perak dengan absorbansi yang cukup, dilakukan modifikasi larutan dengan menggunakan asam asetat 0,1%. Hal ini bertujuan untuk menstabilkan nanopatrtikel perak dan memudahkan terjadinya proses pengikatan partikel pestisida dengan nanopartikel perak. Larutan yang telah termodifikasi inilah yang kemudian berperan sebagai sensing element dari sensor atau elemen yang berhubungan secara langsung dengan partikel pestisida. Gambar 4.3 merupakan foto dari nanopartikel perak, asam asetat 0,1% dan nanopartikel perak termodifikasi asam asetat 0,1%. Terlihat dari gambar tersebut
bahwa terjadi perubahan warna dari NPP yang berwarna cokelat menjadi NPP termodifikasi asam aasetat 0,1% berwarna cokelat kekuningan. Secara lebih detail perubahan ini ditunjukkan oleh grafik aborbansi pada gambar 4.4. Gambar 4.4 merupakan grafik perbandingan absorbansi nanopartikel perak dengan elemen sensor pestisida. Gambar tersebut menunjukkan adanya penurunan absorbansi dan pergeseran panjang gelombang. Dari gambar tersebut dapat diketahui bahwa asam asetat 0,1% yang berperan sebagai modifikator menurunkan puncak absorbansi dari 3,431 A menjadi 3,311 A. Selain terjadi penurunan absorbansi juga terjadi pergeseran panjang gelombang pada puncak absorbansi dari 452 nm menjadi 440 nm. Gambar 4.4 juga menunjukkan bahwa asam asetat 0,1% menghalangi nanopartikel perak untuk menyerap berkas cahaya, sehingga terjadi penurunan absorbansi.
Penambahan asam asetat 0,1% berdampak pada penurunan nilai FWHM. FWHM nanopartikel perak tanpa penambahan asam asetat 0,1% bernilai 132,446 setelah ditambahkan dengan asam asetat 0,1%, nilai FWHM menurun menjadi 127, 949. Semakin sempit FWHM, maka nanopartikel perak semakin homogen (distribusi ukuran partikel semakin merata) sehingga nanopartikel perak lebih stabil (Dejun Xiong dan Haibing Li, 2008).
4.2.2 Sensitivitas Elemen Sensor Terhadap 3 Jenis Pestisida
Gambar 4.13 merupakan grafik perbandingan sensitivitas sensor. Perbandingan grafik sensitivitas elemen sensor dilakukan karena elemen sensor hanya mengalami perubahan absorbansi dan tidak mengalami pergeseran panjang gelombang sehingga tidak dapat dilakukan perbandingan absorbansi elemen sensor pada satu konsentrasi tertentu.
0 5 10 15 20 1.35 1.40 1.45 1.50 1.55 1.60 1.65 sensor + OP sensor + Peritroid sensor + Karbamat a b s o rb a n s i (A ) konsentrasi pestisida (ppm)
Gambar 4.13 Perbandingan grafik sensitivitas elemen sensor dengan pengujian herbisida-organofosfat, insektisida-peritroid, fungisida-karbamat
Gambar 4.13 menunjukkan terdapat satu trendline yang cenderung naik dengan adanya penambahan konsentrasi pestisida, yaitu terdapat pada grafik elemen sensor ketika mendeteksi insektisida peritroid. Sementara dua grafik lainnya, pada konsentrasi dibawah 10 ppm menunjukkan trendline menurun dan naik setelahnya. Akan tetapi ketiga grafik menunjukkan adanya pola yang teratur dan kemungkinan dapat dimodelkan dalam persamaan matematik. Sehingga dapat berlaku fungsi transfer pada ketiga grafik. Adanya pola yang teratur ini diperkirakan ada proses kimia yang terjadi antara nanopartikel perak, asam asetat 0,1%, dan pestisida sehingga dari proses tersebut dapat diketahui perubahan konsentrasi pestisida.
Gambar 4.5 merupakan kurva absorbansi dan foto yang dihasilkan dari proses pengujian elemen sensor dengan insektisida peritroid. Sementara gambar 4.6 menunjukkan grafik sensitivitas dari kurva absorbansi tersebut. Nilai absorbansi yang digunakan sebagai sumbu y grafik sensitivitas merupakan nilai absorbansi pada puncak grafik absorbansi dari pengukuran absorbansi menggunakan spektrofotometer UV-Vis. Gambar 4.6 menunjukkan adanya perubahan absorbansi pada konsentrasi pestisida yang berbeda. Akan tetapi pada data ketiga dan keempat dari grafik tersebut terjadi overlap pada kedua data tersebut. Sehingga kemungkinan yang terjadi absorbansi pada range data tersebut
bernilai sama. Perhitungan deviasi pendeteksian elemen sensor terhadap insektisida peritroid ditunjukkan pada lampiran 1, Tabel 1.2. Secara keseluruhan data-data tersebut menunjukkan bahwa absorbansi yang dideteksi sensor semakin besar dengan penambahan konsentrasi pestisida.
0 5 10 15 20 1.42 1.44 1.46 1.48 1.50 1.52 1.54 1.56 a b s o rb a n s i (A ) konsentrasi pestisida (ppm) Equation y = a + b*x Adj. R-Square 0.91288
Value Standard Error
absorbansi Intercept 1.44169 0.01152
absorbansi Slope 0.00458 9.59266E-4
Gambar 4.14 Grafik sensitivitas elemen sensor dengan pengujian insektisida-peritroid
Gambar 4.14 menunjukkan bahwa absorbansi yang merupakan output dari elemen sensor sebanding dengan konsentrasi insektisida peritroid. Hubungan antara input dan output ini sesuai dengan relasi pada hukum Beer-Lambert yaitu :
A = Є c l
dengan A adalah absorbansi, Є koefisien molar absorbansi, c konsentrasi
pestisida, dan l path length (lebar kuvet berisi larutan sample yang disinari berkas cahaya). Adanya kesinambungan hubungan input dan output pada eksperimen dan hukum Beer-Lambert ini menunjukkan bahwa elemen sensor dapat digunakan dengan baik untuk mendeteksi insektisida peritroid. Hubungan antara grafik sensitivitas yang dihasilkan dari eksperimen dan hukum Beer-Lambert ini memungkinkan nanopartikel perak termodifikasi asam asetat 0,1% ini dapat digunakan sebagai elemen sensor insektisida peritroid yang memiliki fungsi transfer y = 1,44 + 0,0046 x dengan y adalah absorbansi dan x konsentrasi pestisida.
Kesalahan relative yang dihasilkan dari selisih absorbansi eksperimen dengan absorbansi perhitungan melalui fungsi transfer ditunjukkan pada lampiran 2, Tabel 2.1. Dari hasil perhitungan tersebut didapatkan kesalahan relative 0.0007– 0.11. Kesalahan relative ini terbilang kecil, hal ini menunjukkan bahwa model fungsi transfer mendekati kebenaran data keseluruhan eksperimen. karena adanya kesinambungan antara arti fisis fungsi transfer dengan hukum Beer-Lambert dan kecilnya kesalahan relative dari proses pendeteksian, maka dapat dikatakan bahwa model fungsi transfer yang dihasilkan dari eksperimen ini mendekati kebenaran.
Gambar 4.5 – 4.8 merupakan kurva absorbansi dan grafik sensitivitas elemen sensor untuk pengujian fungisida karbamat dan herbisida organofosfat. Grafik sensitivitas kedua pengujian tersebut menunjukkan pola tertentu yang kemungkinan juga dapat dimodelkan dalam persamaan matematik tertentu. Akan tetapi setelah dilakukan proses pembuatan kembali sensor dengan komposisi material dan kondisi yang sama, grafik sensitivitas yang dihasilkan tidak
reproducible sehingga menghasilkan deviasi yang besar (Lampiran 1, Tabel 1.2
dan 2.2). Setelah grafik diplot disertakan dengan deviasinya, data-data yang dihasilkan hampir keseluruhan overlap sehingga dapat dikatakan tidak ada perubahan absorbansi dengan adanya kenaikan konsentrasi pestisida (Lampiran 1, gambar 1.2 dan 2.2).
4.2.3 Reproduksibilitas Elemen Sensor
Perbedaan absorbansi sensor pada dua eksperimen yang berbeda ditunjukkan pada gambar 4.11. Dari data-data tersebut menunjukkan ketidakmampuan sensor menghasilkan nilai pengukuran yang sama pada kondisi identik. Pengujian reproduksibilitas sensor dilakukan dengan cara melakukan pengulangan pembuatan sensor dengan metode dan kompisisi material yang sama kemudian diuji dengan konsentrasi pestisida yang sama. Sensor dapat dikatakan
reproducible jika dalam setiap proses pembuatan menghasilkan output berupa
Gambar 4.11a merupakan perbandingan grafik sensitivitas pendeteksian insektisida peritroid oleh elemen sensor pada 2 eksperimen yang berbeda. Kedua eksperimen dibuat dalam komposisi dan kondisi yang sama. Secara umum, kedua grafik tersebut memiliki trendline yang sejenis. Akan tetapi pada data pertama dan terakhir memiliki perbedaan yang cukup jauh jika dibandingkan dengan data lainnya. Dari lampiran 1 tabel 1.1 terlihat jelas bahwa deviasi pengukuran dari dua data tersebut sekitar 0,04 A. Secara umum, trendline yang terbentuk antara dua eksperimen tersebut berpola sama dan jarak data lainnya relative tidak terlalu jauh, 0,01 – 0,02 A. Sehingga elemen sensor untuk mendeteksi insektisida peritroid dapat diproduksi kembali (reproducible). Perbedaan absorbansi yang terjadi diperkirakan terdapat faktor pengganggu yang sulit untuk dihindari dalam proses pembuatan elemen sensor.
Sementara dua grafik reproduksibilitas elemen sensor ketika digunakan untuk mendeteksi fungisida karbamat dan herbisida peritroid memiliki deviasi pengukuran yang cukup besar (lampiran 1, tabel 1.2 dan 1.3), meskipun trendline pada grafik memiliki pola hampir sama (Gambar 4.11c). Perbedaan trendline yang terjadi pada eksperimen yang berbeda (Gambar 4.11b) diperkirakan karena elemen sensor tidak mampu memberikan tanggapan yang sama pada fungisida karbamat di setiap proses. Sementara untuk herbisida organofosfat yang memiliki
trendline yang sejenis memiliki perbedaan absorbansi elemen sensor (pestisida 0
ppm). Perbedaan ini disebabkan karena nanopartikel perak yang digunakan dalam pembuatan elemen sensor tidak memiliki nilai absorbansi yang sama. Akan tetapi, karena deviasi dari dua proses pendeteksian pestisida ini terlampau besar, maka dihasilkan grafik sensitivitas dengan semua data overlap (lampiran 1 gambar 1.1 dan 1.2). Sehingga dapat dikatakan tidak terjadi perubahan dengan adanya penambahan sinyal input berupa konsentrasi pestisida.
4.2.4 Aging Effect dan Stabilitas Elemen Sensor
Gambar 4.12a menunjukkan bahwa absorbansi elemen sensor, output sensor ketika input sama dengan nol dipengaruhi oleh waktu. Dari grafik tersebut terlihat lamanya waktu reaksi menyebabkan terjadinya peningkatan absorbansi. Kemungkinan yang terjadi adalah terjadi peningkatan jumlah nanopartikel perak
karena masih terjadi reaksi antara AgNO3 dengan agen pereduksi dari rimpang jahe. Disamping itu juga dapat terjadi berkurangnya pengaruh asam asetat 0,1% terhadap nanopartikel perak sehingga nanopartikel perak dapat secara langsung menyerap cahaya (tidak terhalang asam asetat 0,1%). Selama dua minggu, elemen sensor tetap memiliki kurva absorbansi yang relative stabil. Akan tetapi, terlihat pada minggu ketiga mulai memperlihatkan kondisi saturasi karena tidak ada lagi reaksi yang memungkinkan nilai absorbansi dapat terus meningkat (Gambar 4.12a).
Berdasarkan Gambar 4.12a, diperkirakan sensor masih dapat digunakan untuk mendeteksi dengan usia elemen sensor 2 minggu. Karena pada usia 2 minggu, absorbansi yang ditunjukkan sebesar 2, 869 A. Yang berdasarkan beberapa eksperimen yang dilakukan absorbansi elemen sensor yang dipergunakan sekitar 2,557 A. dan mengalami penurunan 1,102 A ketika diuji dengan pestisida 0,5 ppm. Sehingga kemungkinan yang terjadi tidak akan terjadi perbedaan yang cukup signifikan pada grafik sensitivitas yang dihasilkan dari proses pendeteksian.
Gambar 4.12b menunjukkan grafik pengaruh waktu reaksi terhadap FWHM elemen sensor. Nilai FWHM didapatkan dari proses fit grafik dengan fungsi Gaussian. Hasil fitting tersebut menghasilkan beberapa informasi mengenai grafik, diantaranya nilai FWHM dan luas dibawah grafik. Nilai FWHM memberikan informasi tentang distribusi ukuran nanopartikel (P. Pimpang dan Choopun S, 2011). Sementara luas di bawah grafik menunjukkan banyaknya partikel yang dapat terdeteksi. Berdasarkan penelitian yang dilakukan oleh Dejun Xiong dan haibing Li pada tahun 2008, nanopartikel yang cocok digunakan sebagai pendeteksi pestisida memiliki nilai FWHM yang semakin kecil. Atau dapat dikatakan ukuran partikel semakin homogen (monodisperse). Berbeda dengan grafik yang diperlihatkan oleh gambar 4.18 yang menunjukkan adanya kenaikan nilai FWHM dengan semakin lamanya waktu penyimpanan elemen sensor. Hal ini menunjukkan bahwa distribusi nanopartikel perak semakin tidak merata (heterogen) dan mulai menunjukkan indikasi saturasi memasuki minggu ketiga.
5 SIMPULAN DAN SARAN 5.1 Simpulan
1. Nanopartikel perak yang dimodifikasi asam asetat 0,1% dapat digunakan sebagai elemen sensor insektisida dari golongan peritroid
2. Elemen sensor (nanopartikel perak dimodifikasi asam asetat 0,1%) bersifat sensitive dan reproducible (dapat diproduksi kembali) untuk mendeteksi insektisida golongan peritroid
3. Waktu penyimpanan elemen sensor mempengaruhi kinerja dan kestabilan elemen sensor
4. Metode kolorimetri berbasis nanopartikel perak dapat digunakan untuk mendeteksi pestisida
5.2 Saran
1. Pembuatan elemen sensor berbasis nanopartikel perak untuk mendeteksi jenis pestisida lainnya perlu dilakukan
2. Divais portable untuk mengkondisikan sinyal dan menampilkan informasi mengenai konsentrasi pestisida yang mencemari sample perlu dibuat
DAFTAR ACUAN
Andres, R.T., Narayanaswamy, R., 1997. Talanta 44, 1335–1352
Altschuh, Daniele (2008). Immunochemistry and Biosensors. ESONN’08,
Grenoble – France
Bakir, Pengembangan Biosintesis Nanopartikel Perak Menggunakan Air Rebusan
Daun Bisbul (Diospyros Blancoi) Untuk Deteksi Ion Tembaga dengan Metode Kolorimetri, skripsi sarjana (Depok : Fakultas MIPA Universitas
Indonesia, 2011)
Chandran, S. Prathap., et al. (2006). Synthesis of Gold Nanotriangles and Silver Nanoparticles Using Aloe vera Plant Extract. Biotechnol. Prog., 22, 577-583.
Choi, Hun. 2010. Advantages of Photodiode Array. SCINCO. Co., Ltd
Chui, Z., Han, Cuiping, dan Li, Haibing. (2011). Dual-Signal Fenamithion Probe by Combining Fluorescence with Colorimetry Based on Rhodamine B Modified Silver Nanoparticles. Analyst, 2011, 136, 1351
Dubas, S.T. dan Pimpan, V. (2008). Green Synthesis of Silver Nanoparticles for Ammonia Sensing. Talanta, 76, 29–33.
Dubas, S.T. dan Pimpan, V. (2008). Humic Acid Assisted Synthesis of Silver Nanoparticles and Its Application to Herbicide Detection. Materials Letters 62 (2008) 2661–2663
Dwivedi, P., Narvi, S.S., dan Tewari, R.P. Natural Route to a Novel Nanocomposite Biomaterial: an Embodiment for the Abatement of Implant Associated Infection
Elumalai, E.K., et al (2011). A Bird’s Eye View on Biogenic Silver
Nanoparticles and Their Applications. Der Chemica Sinica, 2 (2), 88-97. Fraden, Jacob. 2004. Handbook of Modern Sensors Physics, Design, and
Applications Third Edition. Springer : San Diego
Han, C. dan Li, H. (2010). Visual Detection of Melamine in Infant Formula at 0.1 ppm Level Based on Silver Nanoparticles. Analyst, 135, 583–588.
Jaffrezic, Nicole & Renault. 2001. New Trends in Biosensors for Organophosphorus Pesticides. Sensors 2001, 1, 60-74
Kumar, V. & S. K. Yadav. 2009. Plant-mediated synthesis of silver and gold nanoparticles and their applications. Journal Chemical Technology and
Biotechnology 84:151—157.
Leela, A. & M. Vivekananda. 2008. Tapping the Unexploited Plant Resources for the er Nanoparticles. African Journal of Biotechnology 7(17), 3162—3165. Li, H., Cui, Z., dan Han, C. Glutathione-Stabilized Silver Nanoparticles as
Colorimetric Sensor for Ni2+ Ion. Sensors and Actuators B, 143, 87–92. Li, H.B., et al. (2009). Triazole-Ester Modified Silver Nanoparticles: Click
Synthesis and Cd 2+ Colorimetric Sensing. Chem. Commun., 4812–4814. Li, H., Cui, Z., dan Han, C. Glutathione-Stabilized Silver Nanoparticles as
L. Shaoqin,et al. (2008). Recent Advances in Nanosensors for Organophosphate Pesticide Detection. Advanced Powder Technology19 : 419 - 441
Moores, A. dan Goettmann, F. (2006). The Plasmon Band in Noble Metal Nanoparticles: an Introduction to Theory and Applications. New J. Chem., 30, 1121–1132.
Shankar, S.S., A. Rai, A, Ahmad & M. Sastry. 2004. Rapid synthesis of Au, Ag, and bimetallic Au core–Ag shell nanoparticles using Neem (Azadirachta
indica) leaf broth. Journal of Colloid and Interface Science 275: 4: 496—
502.
Shikuo Li, Yuhua Shen, Anjian Xie, Xuerong Yu, Lingguang Qiu, Li Zhang & Qingfeng Zhang. 2007. Green synthesis of silver nanoparticles using
Capsicum annuum L.extract. Green Chemistry 9: 852—858.
Shugar, G. J. & Ballinger, J.T. (2000). Chemical Technician’s Ready Referrence
Handbook. 4th ed. New York: McGraw-Hill Inc.
Solomon, S.D., et al. (2007). Synthesis and Study of Silver Nanoparticles.
Journal of Chemical Education, 84(2), 322-325.
Takuya Tsuzuki, Commercial scale production of inorganic nanoparticles, International Journal of Nanotechnology 2009 - Vol. 6, No.5/6 pp. 567 - 578.
Thakkar, K.N., et al. (2011). Biological Synthesis of Metallic Nanoparticles.
Nanomedicine: Nanotechnology, Biology, and Medicine, 6, 257–262 Tolaymat, T.M, et al. (2010). An Evidence-Based Environmental Perspective of
Manufactured Silver Nanoparticle in Syntheses and Applications: A Systematic Review and Critical Appraisal of Peer-Reviewed Scientific Papers. Sciences of the Total Environment, 408, 999-1006.
Vamvakaki, Vicky dan Chaniotakis, Nikos A. (2007). Pesticide Detection with a Liposome-Based Nano Niosensor. Biosensors and Bioelectronics22 (2007) 2848–2853
Wikipedia.2012. Surface Plasmon Resonance.
http://en.wikipedia.org./wiki/Surface Plasmon Resonance. Wilson, Jon S. 2005. Sensor Technology. Newnes : USA
Xavier, M.P., Vallejo, B., Marazuela, M.D., Moreno-Bondi, M.C., Baldini, F.,Falai, A., 2000.Biosens.Bioelectron. 14, 895–905
Xiong, Dejun dan Haibing Li (2008). Colorimetric detection pesticides based on calixarene modified silver nanoparticles in water. Nanotechnology 19
(2008) 465502 (6pp)
Yao, Y., Tian, D.M., dan Li, H.B. (2010). Cooperative Binding of
Bifunctionalized and Click Synthesized Silver Nanoparticles for Colorimetric Co2+ Sensing. ACS Applied Materials and Interfaces, 2(3), 684–690