SKRINING AKTIVITAS KITINASE JAMUR ENDOFIT TUMBUHAN ZINGIBERACEAE DAN KEMAMPUANNYA MENGHAMBAT Fusarium oxysporum DAN Ganoderma boninense
SKRIPSI
ANNA 150805049
PROGRAM STUDI S1 BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
SKRINING AKTIVITAS KITINASE JAMUR ENDOFIT TUMBUHAN ZINGIBERACEAE DAN KEMAMPUANNYA MENGHAMBAT Fusarium oxysporum DAN Ganoderma boninense
SKRIPSI
DIAJUKAN UNTUK MELENGKAPI TUGAS DAN MEMENUHI SYARAT MENCAPAI GELAR SARJANA SAINS
ANNA 150805049
PROGRAM STUDI S1 BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
PERNYATAAN ORISINALITAS
SKRINING AKTIVITAS KITINASE JAMUR ENDOFIT TUMBUHAN ZINGIBERACEAE DAN KEMAMPUANNYA MENGHAMBAT Fusarium
oxysporum DAN Ganoderma boninense
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2020
Anna 150805049
SKRINING AKTIVITAS KITINASE JAMUR ENDOFIT TUMBUHAN ZINGIBERACEAE DAN KEMAMPUANNYA MENGHAMBAT Fusarium
oxysporum DAN Ganoderma boninense
ABSTRAK
Jamur endofit adalah jamur yang tumbuh dalam jaringan tumbuhan tanpa menimbulkan efek negatif pada tanaman inangnya. Penelitian tentang aktivitas kitinase dari jamur endofit tumbuhan Zingiberaceae serta kemampuannya dalam menghambat Fusarium oxysporum dan Ganoderma boninense telah dilakukan.
Sebanyak tiga puluh satu isolat jamur endofit telah diujikan pada medium kitin agar dan dua isolat yaitu JRE 1A dan JRE 4B memiliki aktivitas kitinase. Aktivitas kitinase kedua isolat secara berturut yaitu 4,15 U/mL dan 4,76 U/mL. Kitinase yang dihasilkan dari kedua isolat jamur bekerja optimum pada rentang pH antara 6 hingga 7. Aktivitas ekstrak kasar enzim dari kedua isolat ditingkatkan oleh ion logam Mn2+, namun dihambat oleh ion logam K+ dan Ca2+. Kedua isolat JRE 1A dan JRE 4B mampu menghambat pertumbuhan Fusarium oxysporum dan Ganoderma boninense pada medium kitin agar. Aktivitas penghambatan JRE 1A dan JRE 4B lebih tinggi terhadap Fusarium oxysporum. Ekstrak kasar kitinase setelah presipitasi dengan amonium sulfat 70% dari kedua isolat juga memiliki kemampuan dalam menghambat pertumbuhan Fusarium oxysporum dan Ganoderma boninense.
Kata kunci: Enzim Kitinase, Fusarium oxysporum, Ganoderma boninense, Jamur Kitinolitik
SCREENING OF CHITINOLYTIC ACTIVITY OF ENDOPHYTIC FUNGI FROM ZINGIBERACEAE AND THEIR POTENTIAL TO INHIBIT Fusarium
oxysporum AND Ganoderma boninense
ABSTRACT
Endophytic fungi is a fungal community inhabiting a plant tissue without exhibiting any negative effect to its host. The study of chitinase activity from Zingberaceae endophytic fungi and their abilities in inhibiting Fusarium oxysporum and Ganoderma boninense has been conducted. Thirty endophytic fungal isolates were tested for its growth on chitin agar medium and two isolates namely JRE 1A and JRE 4B had chitinase activity. Chitinase activity of the both isolates were 4.15 and 4.76 U/mL, respectively. The optimum activity of chitinase produced by both isolates were detected at pH 6 to 7. The activity crude enzyme was increased by Mn2+ ion, while being inhibited by the presence of K+ and Ca2+ ions. The isolates JRE 1A and JRE 4B were able to inhibit Fusarium oxysporum and Ganoderma boninense on chitin agar. Inhibitory activity of JRE 1A and JRE 4B were higher against Fusarium oxysporum. Crude chitinase of both isolates precipitated with 70% ammonium sulphate also exhibited antifungal activities against Fusarium oxysporum and Ganoderma boninense.
Keywords: Chitinase, Chitinolytic Fungi, Fusarium oxysporum, Ganoderma boninense
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa yang telah memberikan kekuatan, kesehatan dan kesabaran sehingga penulis dapat menyelesaikan skripsi yang berjudul “Skrining Aktivitas Kitinase Jamur Endofit Tumbuhan Zingiberaceae dan Kemampuannya Menghambat Fusarium oxysporum dan Ganoderma boninense”.
Pada kesempatan ini penulis ingin mengucapkan terimakasih kepada kedua orang tua tercinta, Ayahanda Solichin dan Ibunda Nurhayati yang selalu memberikan doa, semangat, dukungan, perhatian dan kasih sayang serta pengorbanan kepada penulis. Semoga Tuhan memberikan kekuatan, kesehatan dan umur panjang. Kepada abangda dan kakanda (Bang Sera, Bang Surat, Bang Falex dan kak Elfi) yang senantiasa mendukung dan mendoakan penulis.
Terimakasih penulis sampaikan kepada Bapak Prof. Dr. Erman Munir, M.Sc yang telah memberikan bimbingan, arahan, motivasi, nasehat, semangat dan waktu kepada penulis dalam menyelesaikan penelitian ini. Terimakasih penulis sampaikan kepada dosen penguji Bapak Dr. Kiki Nurtjahja, M.Sc dan Ibu Dr. Liana Dwi Sri Hastuti, S.Si., M.Si yang telah memberikan arahan dan masukan demi penyempurnaan skripsi ini.
Terimakasih penulis sampaikan kepada Ibu Dr. Saleha Hannum M.Si dan Bapak Riyanto Sinaga M.Si selaku Ketua dan Sekretaris Departemen Biologi FMIPA USU yang telah memberikan banyak bantuan kepada penulis. Terimakasih penulis sampaikan kepada laboran Kak Pia dan Bang Yudha serta pegawai Departemen Biologi FMIPA USU Bang Ewin dan Kak Winda yang telah membantu penulis dalam menyelesaikan keperluan laboraorium dan administrasi selama perkuliahan.
Terimakasih penulis sampaikan kepada staf pengajar yang tidak dapat penulis tuliskan satu-persatu, terimakasih atas segala ilmu yang yang bermanfaat, arahan, motivasi dan kemurahan hati selama masa perkuliahan. Semoga kedepannya penulis dapat menggunakan ilmu yang berharga ini untuk menolong sesama.
Terimakasih penulis sampaikan kepada Rizki Fernando Saragih yang selalu memberikan waktu dan semangat kepada penulis. Terimakasih penulis sampaikan kepada Jesica Sitorus partner penelitian berbagi suka dan duka. Terimakasih juga kepada sahabat terheboh (Measy, Tika, Ocha, Ike, Plok, Libora, Cende, dan Phony) yang telah memberikan kebahagiaan dan tempat curhat penulis. Terimakasih juga untuk asisten mikro (Bang Randi, Bang Irfan, Ando, Jetor, Jema, Betri, Ruth, Marvelyn, Wita, Novita, CG, Edy, Diki dan Ibah) yang telah memberikan penghiburan dan sukacita yang luar biasa dalam menjalani masa penelitian ini.
Terimakasih penulis sampaikan kepada warga SOY 2015, PKBKB’15, kakak asuh (kak Artha) dan adek asuh (Joshua, Maria, Agnes) yang telah membagi pengalaman dan menemani kehidupan perkuliahan.
Penulis menyadari masih banyak kekurangan dalam penyusunan hasil penelitian ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan hasil penelitian ini. Akhir kata semoga skripsi ini bermanfaat bagi kita semua.
Medan, September 2020
Anna
DAFTAR ISI
Halaman
Pengesahan i
Abstrak ii
Abstract iii
Penghargaan iv
Daftar Isi vi
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
Daftar Singkatan xi
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Perumusan Masalah 3
1.3 Tujuan 3
1.4 Manfaat 3
BAB 2 TINJAUAN PUSTAKA
2.1 Tumbuhan Zingiberaceae 4
2.2 Jamur Endofit Suku Zingiberaceae 5
2.3 Kitin dan Karakteristik Kitinase 7
2.4 Mikroorganisme Penghasil Kitinase 8
2.5 Peranan Kitinase Jamur Endofit 9
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 10
3.2 Peremajaan Jamur Endofit 10
3.3 Skrining Aktivitas Kitinase 10
3.4 Produksi Kitinase Jamur Endofit Kitinolitik 10 3.5 Pengukuran Aktivitas Kitinase Jamur Endofit Kitinolitik 11
3.6 Pengukuran Kadar Protein 12
3.7 Karakterisasi pH 13
3.8 Karakterisasi Ion Logam 12
3.9 Uji Antagonis Jamur Endofit Kitinolitik dengan Jamur
Patogen 13
3.10 Pengendapan Amonium Sulfat Ekstrak Kasar Kitinase 13 3.11 Uji Kemampuan Daya Hambat Ekstrak Kasar Kitinase
terhadap Jamur Patogen 14
BAB 4 HASIL DAN PEMBAHASAN
4.1 Skrining Aktivitas Kitinase Jamur Endofit 15 4.2 Produksi dan Aktivitas Kitinase Jamur Endofit Kitinolitik 17 4.3 Pengaruh pH terhadap Aktivitas Kitinase Jamur Endofit
Kitinolitik 19
4.4 Pengaruh Ion Logam terhadap Aktivitas Kitinase Jamur
Endofit Kitinolitik 21
4.5 Kemampuan Antagonis Isolat Jamur Kitinolitik terhadap
Jamur Patogen Tanaman 22
4.6 Kemampuan Ekstrak Kasar Kitinase dalam Menghambat
Jamur Patogen Tanaman 25
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 27
5.2 Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 34
DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 Hasil skrining jamur endofit pada medium garam minimum kitin (MGMK) agar, umur 7 hari, suhu ±28°C
15 4.2 Total Aktivitas, Kadar Protein dan Aktivitas Spesifik
Isolat Jamur Endofit Kitinolitik
19 4.3 Pengaruh Ion Logam terhadap Aktivitas Kitinase Jamur
Endofit Kitinolitik
21 4.4 Persentase Hambatan Miselium Fusarium oxysporum dan
Ganoderma boninense oleh Isolat Jamur Endofit Kitinolitik pada MGMK Agar Umur 5 Hari dan Suhu Inkubasi ±28°C
24
4.5 Persentase Hambatan Miselium Fusarium oxysporum dan Ganoderma boninense oleh Ekstrak Kasar Kitinase Jamur Endofit Kitinolitik pada MGMK Agar Umur 5 hari dan Suhu inkubasi ±28°C
26
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.3 Struktur Kitin yang Terdiri dari Monomernya N-asetil- glukosamin dan Sisi Spesifik Pemotongan Kitinase
7 4.1 Koloni Jamur Endofit Potensial Penghasil Kitinase di
medium garam minimum kitin (MGMK) Agar
16 4.2 Aktivitas Kitinase Jamur Endofit Kitinolitik selama
Inkubasi 7 Hari pada MGMK cair pada suhu ±28°C
17 4.3 Jamur Endofit Kitinolitik pada MGMK Cair setelah 6 Hari
pada suhu ±28°C
18 4.4 Pengaruh pH terhadap aktivitas kitinase dengan suhu
inkubasi 37°C selama 30 menit
20 4.5 Hasil Uji Antagonis Isolat Jamur Endofit Kitinolitik Umur
5 Hari terhadap Fusarium oxysporum dan Ganoderma boninense pada MGMK Agar dengan suhu ±28°C.
23
4.6 Hasil Uji Ekstrak Kasar Kitinase Jamur Endofit Kitinolitik Umur 5 Hari terhadap Fusarium oxysporum dan Ganoderma boninense pada MGMK Agar dengan suhu
±28°C.
25
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Daftar Isolat Jamur Endofit 34
2. Komposisi Medium dan Cara Pembuatan 35
3. Pembuatan Reagen 3,5-dinitrosalicyclic acid (DNS) 36 4. Kurva Standar GlcNac dan Bovine Serum Albumin 37
5. Pengukuran Aktivitas Kitinase 38
6. Metode Penentuan Kadar Protein (Bradford, 1976) 39 7. Uji Antagonis Jamur Endofit Kitinolitik terhadap Jamur
Patogen
40
8. Presipitasi Kitinase 41
9. Uji Antagonis Ekstrak Kasar Kitinase terhadap Jamur Patogen
42
DAFTAR SINGKATAN
MGMK = Medium Garam Minimum Kitin
DNS = Dinitrosalicyclic Acid GlcNac = N-asetil-D-glukosamin NAG = N-asetil-D-glukosamin
BSA = Bovine Serum Albumin
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Tumbuhan Zingiberaceae di Indonesia secara umum dikenal dengan tumbuhan jahe-jahean. Anggota suku ini mempunyai ciri khas pada rhizomnya yang mengandung minyak volatil atau berbau aromatik. Jenis-jenis dari suku ini secara alami tumbuh di hutan hujan, dari dataran rendah hingga dataran tinggi. Tumbuhan Zingiberaceae diperkirakan mencapai 50 genera dan sekitar 1.400 jenis yang tersebar mulai dari daerah tropis hingga subtropis. Persebaran yang paling besar terdapat di Asia Tenggara, khususnya wilayah Malaysia termasuk Indonesia (Pandey, 2003).
Tumbuhan Zingiberaceae banyak dimanfaatkan oleh masyarakat sejak dulu hingga sekarang, karena mempunyai potensi ekonomi yang penting yaitu antara lain sebagai obat tradisional seperti jamu, bahan ramuan herbal, rempah-rempah, bumbu masak, bahan tonik rambut, bahan minuman, sayuran segar dan penyedap makanan (Dalimartha, 2003). Zingiberaceae ini juga banyak diminati sebagai tanaman hias karena warna bunganya yang sangat menarik, sehingga terjadi peningkatan penanaman Zingiberaceae sebagai tanaman hias di taman-taman kota, rumah kaca dan juga sebagai bunga potong. Beberapa jenis di antaranya memegang peran penting secara ekologi sebagai tumbuhan penutup di dalam hutan, khususnya setelah adanya penebangan liar, fragmentasi lahan ataupun kebakaran hutan (Poulsen, 2006).
Tumbuhan Zingeberaceae memiliki beberapa kandungan senyawa metabolit sekunder seperti flavanoid, fenol, terpenoid dan minyak atsiri.
Jamur endofit adalah mikroorganisme yang berada di dalam suatu sistem jaringan tumbuhan seperti biji, daun, bunga, ranting, batang dan akar. Jamur endofit mampu menghasilkan berbagai senyawa fungsional. Senyawa yang dihasilkan seperti senyawa antikanker, antivirus, antibakteri, antifungi, hormon pertumbuhan tanaman, insektisida dan lain-lain (Strobel, 2004). Kelimpahan jamur endofit dipengaruhi oleh faktor biotik dan biotik. Faktor tersebut meliputi varietas dan spesies inang, iklim, kadar air tanah dan teknik budidaya (Lewis et al., 1997). Jamur endofit bersimbiosis mutualisme pada tanaman. Peran yang menguntungkan tanaman yaitu meningkatkan
2
ketahanan terhadap serangga dan mamalia herbivora (Faeth, 2002), meningkatkan ketahanan tanaman terhadap penyakit (Narisawa et al., 2002), memacu pertumbuhan dan meningkatkan ketahanan tanaman terhadap kekeringan dan suhu tinggi (Lehtonen et al., 2005) dan bioindikator kesehatan tanaman (Gennaro et al., 2003).
Selain itu, jamur endofit dapat dimanfaatkan sebagai agen antagonis yang dapat digunakan untuk mengendalikan beberapa patogen tumbuhan, baik dari golongan jamur maupun bakteri. Kelompok jamur endofit yang berperan sebagai agen pengendali hayati antara lain adalah Acremonium zeae, Verticillium sp., Phomopis cassiae, Muscodor albus, Periconia sp., Ampelomyces sp., Neotyphodium lolii (Gao et al., 2010).
Mikroorganisme kitinolitik adalah mikroorganisme yang menghidrolisis kitin dan menghasilkan enzim kitinase. Mikrob tersebut dapat diperoleh dari berbagai sumber lingkungan tanah, laut, danau, kolam, tempat pembuangan limbah udang dan sebagainya (Meata, 2014). Beberapa kelompok bakteri dan jamur dengan kemampuan kitinolitik telah digunakan dalam mengendalikan patogen tanaman seperti Bacillus (Huan et al., 2005), Enterobacter (Chernin et al., 1995), jamur Trichoderma (Harighi et al., 2007) dan Streptomyces (Sadeghi et al., 2006).
Degradasi kitin yang dilakukan mikroorganisme melibatkan enzim hidrolitik yaitu kitinase.
Kitinase adalah enzim yang menghidrolisis senyawa kitin pada ikatan β-1,4- glikosidiknya dan menghasilkan monomer N-asetil-D-glukosamin (NAG). Kitinase banyak dimanfaatkan sebagai pengendali hayati terutama bagi tanaman yang terserang jamur patogen, hal ini dikarenakan kitin, β-1,3-glukan dan protein merupakan struktur utama komponen dinding sel jamur pada umumnya, sehingga enzim litik yang dihasilkan berperan penting dalam merusak atau menguraikan dinding sel jamur patogen. Prapagdee et al. (2008), melaporkan S. hygroscopius mampu menghambat Colletotrichum gloeosproides dan Sclerotium rolfsii dengan aktivitas enzim hidrolitik seperti kitinase dan glukanase.
Berbagai penelitian telah berhasil mengisolasi mikroorganisme kitinolitik dan mempelajari karakterisasi kitinase (Haedar et al., 2017). Enzim kitinase yang dihasilkan mikroorganisme memiliki karakteristik dan tipe yang berbeda-beda.
Kitinase dari Penicillium sp. LYG 0704 memiliki pH optimum 5 (Lee et al., 2009),
3
sedangkan pada Isaria fumosorosea memiliki pH optimum 5,7 (Ali et al., 2010).
Hasil penelitian Sharaf et al. (2012) menyebutkan kondisi optimum kitinase dari Trichoderma viride diperoleh pada pH 4. Ion logam pada konsentrasi tertentu dapat berfungsi mengaktifkan enzim (aktivator) dan juga dapat menghambat kerja enzim (inhibitor). Noviendri et al. (2008) melaporkan ion logam Mn2+, Mg2+, Cu2+, Co2+, Zn2+, Ba2+, NH4+, K+, dan Na+ bertindak sebagai inhibitor terhadap kitinase isolat T5a1, sedangkan kation Fe3+ dan Ca2+ berfungsi sebagai aktivator.
1.2 Perumusan Masalah
Pada penelitian sebelumnya (Hartanto et al. 2019; Lutfia et al. 2019; Lutfia et al. 2020; Munir et al. 2019) telah diisolasi sebanyak 31 jenis jamur endofit yang berasal dari rhizom tumbuhan Zingiberaceae yang terdiri dari Alpinia sp., Amomum centrocephalum, Etlingera sp., Elettaria sp. dan Hedychium coronarium. Jamur ini telah diujikan kemampuannya dalam menghambat pertumbuhan jamur patogen seperti Fusarium oxysporum dan Ganoderma boninense (Lutfia et al., 2019).
Penghambatan pertumbuhan jamur patogen diduga karena adanya aktivitas enzim.
Oleh karena itu, perlu dipelajari sejauh mana kemampuan isolat jamur endofit dari tumbuhan Zingiberaceae dalam menghasilkan enzim kitinase.
1.3 Tujuan Penelitian
1. Mengetahui kemampuan jamur endofit asal tumbuhan Zingiberaceae dalam menghasilkan enzim kitinase
2. Mengetahui karakteristik enzim kitinase yang dihasilkan isolat jamur endofit kitinolitik tumbuhan Zingiberaceae
3. Mengetahui kemampuan isolat jamur endofit kitinolitik tumbuhan Zingiberaceae dan ekstrak kasar enzim dalam menghambat pertumbuhan Ganoderma boninense dan Fusarium oxysporum
1.4 Manfaat
Memperoleh informasi mengenai aktivitas, karakteristik kitinase dan kemampuan ekstrak kasar kitinase dari jamur endofit asal tumbuhan Zingiberaceae
4
dalam menghambat jamur patogen tanaman serta sebagai bahan referensi bagi penelitian selanjutnya.
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Zingiberaceae
Tumbuhan merupakan salah satu sumber daya yang sangat penting dalam upaya pengobatan. Sampai saat ini diperkirakan 25% dari obat-obat modern yang beredar di dunia berasal dari bahan aktif yang diisolasi dan dikembangkan dari tumbuhan (Ernawati et al., 2009). Zingiberaceae merupakan kelompok tumbuhan yang banyak ditemukan pada kawasan hutan tropis, terutama di Indo-Malaya.
Zingiberaceae dapat hidup dari dataran rendah sampai pada ketinggian lebih dari 2.000 mdpl terutama di daerah dengan curah hujan yang tinggi. Zingiberaceae belum diketahui secara pasti berapa jumlah jenisnya. Sejauh ini daerah yang kaya akan jenis-jenis Zingiberaceae adalah wilayah Indonesia, Malaysia, Brunei, Singapura, Thailand, Filipina dan Papua. Di pulau Sumatera keragaman jenis jahe-jahean belum diketahui secara lengkap (Larsen, 1999). Di Sarawak terdapat sekitar 141 jenis dari 18 genera, Sabah dengan 152 jenis dari 13 genera dan di Brunei terdapat 110 jenis dari 13 genera. Di Kalimantan belum banyak dilakukan penelitian mengenai keanekaragaman jenis Zingiberaceae (Suriyanto et al., 2015).
Masyarakat dari berbagai etnis telah memanfaatkan suku Zingiberaceae sebagai bahan obat tradisional. Bagian dari tanaman yang digunakan sebagai bahan obat sebagian besar adalah rhizom, dengan pengolahan dan penggunaan yang beragam antara lain dengan cara direbus atau dibuat jamu, diambil sarinya dengan cara diparut kemudian diminum airnya atau dioleskan pada bagian tubuh yang diobati yaitu bagian perut, kening atau bagian lainnya dan ada juga yang langsung dimakan misalnya rhizom kencur (Kuntorini, 2005). Beberapa spesies tumbuhan Zingiberaceae yang dapat digunakan sebagai obat-obatan diantaranya jahe (Zingiber officinale), kunyit (Curcuma domestica), lengkuas (Alpinia galanga), kencur (Kaempferia galanga L), kecombrang (Nicolaia speciosa), temulawak (Curcuma xanthorrhiza), lempuyang (Zingiber aromaticum Val.), temu giring (Curcuma heyneane Val.). Kandungan senyawa metabolit sekunder pada tumbuhan jahe-jahean
terutama golongan flavonoid, fenol, terpenoid dan minyak atsiri. Senyawa metabolit
sekunder yang dihasilkan
7
tumbuhan Zingiberaceae ini umumnya dapat menghambat pertumbuhan patogen yang merugikan kehidupan manusia, diantaranya bakteri Escherichia coli, Bacillus subtilis, Staphylococcus aureus, jamur Neurospora sp, Rhizopus sp. dan Penicillium sp. (Nursal et al., 2006).
2.2 Jamur Endofit Suku Zingiberaceae
Endofit adalah mikroorganisme yang hidup di dalam jaringan bawah epidermis tumbuhan baik itu pada daun, akar, ranting dan biji. Berbagai jenis tumbuhan dapat menjadi inang dari mikroorganisme yang disebut endofit (Strobel dan Daisy, 2003). Sebagian besar endofit mampu menghasilkan zat bioaktif yang dapat dimanfaatkan dalam dunia farmasi, industri, dan pertanian. Salah satu jenis endofit yang sangat berpotensi adalah jamur endofit.
Jamur endofit dapat menghasilkan berbagai senyawa fungsional berupa senyawa antikanker, antivirus, antibakteri, antifungi serta hormon pertumbuhan tanaman (Noverita et al., 2009). Motaal et al. (2010) menyatakan bahwa jamur endofit banyak menghasilkan senyawa bioaktif yang digunakan untuk meningkatkan ketahanan inang dari serangan patogen. Jamur endofit menginfeksi tumbuhan yang sehat pada jaringan tertentu dan mampu menghasilkan mikotoksin, enzim serta antibiotik (Kumala dan Siswanto, 2007). Jamur endofit yang diisolasi dari tanaman inangnya dapat menghasilkan senyawa metabolit sekunder yang sama dengan yang dihasilkan oleh tanaman inangnya (Radji, 2005), contohnya jamur endofit yang berhasil diisolasi dari tumbuhan taxus juga memiliki kemampuan yang sama untuk memproduksi senyawa taxol (Strobel dan Daisy, 2003).
Kemampuan jamur endofit dalam meniru dan memproduksi metabolit sekunder dari tanaman inangnya disebabkan jamur endofit mengalami rekombinasi genetik atau mengambil beberapa informasi genetik dari inangnya melalui suatu proses evolusi di dalam jaringan tanaman inang (Agusta, 2009). Kehadiran jenis jamur endofit dihubungkan dengan kondisi mikrohabitat tanaman inang dan kecocokan genotip antara tanaman inang dan endofit, sehingga akan berpengaruh terhadap perbedaan dalam komposisi koloni endofit dan tingkat infeksi tanaman inang yang di tempati oleh jamur endofit pada lokasi yang sama (Wang et al., 2014).
Jamur endofit mendapat keuntungan berupa adanya cadangan nutrisi, terlindungi dari
8
tekanan lingkungan yang kurang menguntungkan, yang membantu dalam upaya reproduksi dan kolonisasi (Schulz dan Boyle, 2006). Di sisi lain, tanaman inang memperoleh keuntungan berupa adanya penginduksian ketahanan terhadap berbagai tekanan, baik oleh faktor biotik maupun abiotik, dan juga dapat meningkatkan pertumbuhan, yaitu melalui produksi fitohormon, peningkatan akses terhadap mineral dan nutrisi, serta sintesis metabolit antagonistik (Agusta, 2009).
Amomum centrocephalum A.D. Poulsen merupakan salah satu spesies tumbuhan Zingiberaceae yang masih sedikit diteliti mengenai keanekaragaman dan sifat antimikrobanya. Spesies tumbuhan ini diasumsikan sebagai inang dari berbagai strain jamur yang terdapat pada organ tumbuhan terutama pada rimpang yang sehat.
Kelompok jamur endofit tersebut terdiri dari 7 Ascomycetes dan 26 jamur mitosporic asal Amomum siamense dari Thailand. Genus dominan yang ditemukan adalah Colletotrichum, Glomerella, dan Phomopsis sp. (Bussaban et al., 2001).
Uzma et al. (2016) telah mengisolasi jamur endofit yang berasal dari suku Zingiberaceae. Tumbuhan Zingiber officinale, Hedychium flavescens dan Hedychium coronarium diketahui menjadi habitat dari jamur endofit beberapa genera seperti Aspergillus, Bipolaris, Cladosporium, Alternaria, Curvularia, Mucor, Penicillium, Nigrospora, Colletotrichum dan Pithomyces. Hastuti et al. (2018) juga berhasil mengisolasi 9 jamur endofit dari Hedychium acuminatum antara lain Fusarium oxysporum, Colletotrichum alienum, C. aotearoa, C. cocodes, C. gloeosporoides dan Aspergillus parasiticus. Ginting et al. (2013) juga melaporkan jamur endofit asal jahe merah (Zingiber officinale) yakni Acremoniium, Cochliobolus, Curvularia, Fusarium, Glomerella, Lecanicillium, Leiosphaerella, Myrothecium, Neonectria, Periconia, Rhizopycnis dan Talaromyces. Sebagian besar isolat tersebut potensial dalam menghambat pertumbuhan Fusarium oxysporum.
Penelitian Noverita et al. (2009) memperoleh 10 isolat jamur endofit dari daun dan rimpang Zingiber ottensi Val. yang memiliki kemampuan menghambat pertumbuhan dua jenis bakteri uji yaitu Staphylococcus aureus dan Escherichia coli.
Diameter zona hambat yang dibentuk oleh jamur endofit pada bakteri S. aureus antara 15 hingga 19 mm. Sedangkan penelitian Rante et al. (2013) memperoleh 2 isolat jamur endofit, namun setalah diujikan hanya 1 isolat yang menujukkan zona hambat pada Escherichia coli sebesar 16,6 mm, Staphylococcus aureus sebesar 16,6
9
mm, dan Pseudomonas aeruginosa sebesar 25,9 mm. Sinaga et al. (2009) juga memperoleh 10 isolat jamur endofit dari tanaman lengkuas, 7 isolat dari daun lengkuas menunjukkan daya antibakteri terhadap Staphylococcus aureus dan Escherichia coli. Diameter zona hambat yang dibentuk oleh jamur endofit terhadap Staphylococcus aureus antara 16 hingga 19 mm, sedangkan terhadap Escherichia coli berkisar antara 15 hingga 18,33 mm.
Trichoderma sp. adalah salah satu jamur endofit yang tumbuh pada permukaan akar berbagai tanaman dan tanah. Trichoderma dapat menghambat pertumbuhan jamur patogen dengan menghasilkan enzim yang mampu mendegradasi dinding sel seperti kitinase, β-1,3-glukanase, protease, mannanase dan hidrolisat lainnya (Inbar dan Chet, 1995).
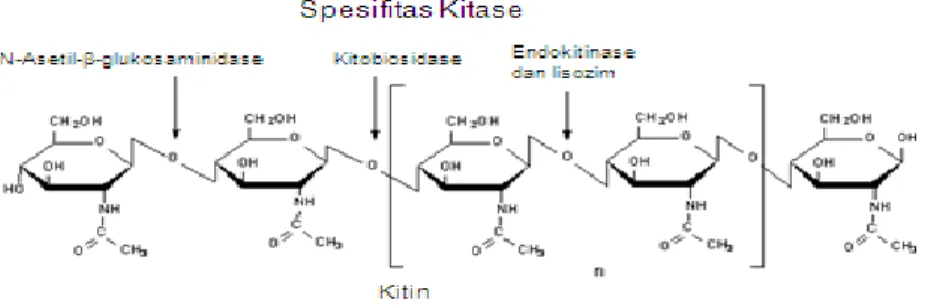
2.3 Kitin dan Karakteristik Kitinase
Kitin adalah suatu polisakarida, polimer linier yang tersusun oleh monomernya β-1,4-N-asetilglukosamin (Gambar 2.3). Lingkar ini membentuk fibril linier. Kelimpahan kitin di alam menempati urutan terbesar kedua setelah selulosa dan tersebar luas di lingkungan biosfer seperti pada kulit crustaceae (kepiting, udang dan lobster), ubur-ubur, komponen struktural eksoskeleton insekta, dinding sel jamur (22 hingga 40%), alga juga pada nematoda, binatang ataupun tumbuhan (Herdyastuti et al., 2009).
Gambar 2.3 Struktur kitin yang terdiri dari monomernya N-asetil-glukosamin dan sisi spesifik pemotongan kitinase (Herdyastuti et al., 2009)
Kitinase merupakan enzim yang mampu menghidrolisis senyawa polimer kitin menjadi kitin oligosakarida atau monomer N-asetil glukosamin dengan menghidrolisis kitin secara acak pada ikatan glikosidik. Ada tiga jenis enzim kitinase
10
yang dibedakan berdasarkan cara kerjanya dalam mendegradasi kitin, yaitu eksokitinase, endokitinase dan N-asetil-glukosaminidase. Eksokitinase memotong polimer kitin hanya dari ujung non reduksi. Endokitinase memotong polimer kitin secara acak dan menghasilkan dimer, trimer, tetramer, dan oligomer gula. N-asetil- glukosaminidase yang memutuskan diasetilkitobiosa dan menghasilkan N-asetil- glukosamin (Herdyastuti et al., 2009). Kitinase dikelompokkan menjadi 3 keluarga glikosil hidrolase yaitu keluarga 18, 19 dan 20. Kitinase yang dihasilkan organisme prokariotik dan eukariotik termasuk dalam golongan famili 18 sedangkan pada famili 19, enzim kitinase ditemukan pada bakteri Gram positif, Streptomyces, dan tanaman tingkat tinggi (Susi, 2002).
2.4 Mikroorganisme Penghasil Kitinase
Mikroorganisme kitinolitik saat ini banyak diteliti terutama kemampuannya sebagai agen pengendali hayati penyakit tumbuhan terutama yang disebabkan oleh jamur patogen (Gohel et al., 2006). Jamur umumnya memiliki dinding sel yang mengandung senyawa kitin. Keberadaan mikroorganisme kitinolitik di tanah terutama pada rhizoplane dan filoplane tanaman dapat melindungi tanaman dari infeksi jamur. Kitin yang terdapat pada dinding sel jamur patogen dapat didegradasi atau dilisiskan oleh mikroorganisme kitinolitik sehingga mengurangi terjadinya infeksi penyakit. Kitin yang terdapat pada dinding sel jamur terikat bersama komponen dinding sel lainnya seperti glukan, mannan dan protein. Jumlah kitin pada dinding sel jamur tidak sama untuk setiap jenis. Secara umum kandungan kitin dan kitosan pada spesies jamur berbeda dan bervariasi mulai dari 2 hingga 60% berat kering miselium. Kandungan kitin juga bervariasi diantara jenis dalam genus yang sama. Jamur kelas Ascomycetes, Zygomycetes, Basidiomycetes dan Deuteromycetes umumnya mengandung kitin. Sedangkan kelas Oomycetes dominan glukan (Knezevic-Jugovic et al., 2011). Beberapa genus bakteri kitinolitik adalah Aeromonas, Psedomonas, Bacillus, Vibrio, Xanthomonas, Serratia (Ayu et al., 2010) dan Burkholderia (Syamsuddin dan Ulim, 2013). Selain genus bakteri, alternatif pengendalian penyakit tular tanah secara biologi dapat dilakukan oleh jamur seperti, Trichoderma harzianum, Trichoderma viridae, Gliocladium dan Aspergillus sp.
11
(Khaeruni dan Gusnawaty, 2012), Aspergillus terreus (Ghanem et al., 2010), Bauveria bassiana (Suryadi et al., 2013).
2.5 Peranan Kitinase Jamur Endofit
Kitinase saat ini banyak digunakan sebagai senyawa pengendali hayati atau biokontrol karena dapat mendegradasi kitin menjadi produk yang ramah lingkungan dan dapat digunakan dalam bidang kesehatan, pangan, dan industri (Herdyastuti et al., 2009). Kitinase dalam bidang pertanian dimanfaatkan sebagai senyawa antifungi, nematisida dan biopestisida. Aktivitas kitinase bersama dengan endo-ß-1,3-glukanase Trichoderma harzianum telah terbukti dapat mengendalikan Sclerotium rolfsii yang merupakan jamur fitopatogenik pada tanaman kacang tanah (El-Katatny et al., 2000).
Gunalan et al. (2012) melaporkan aktivitas kitinase Aspergillus flavus setelah presipitasi mampu menghambat Rhizopus stolonifera sebesar 17,73%, Aspergillus niger sebesar 19,08%, Fusarium solani sebesar 12,62% dan Aspergillus solani sebesar 10,75%. Kitinase murni dari Aspergillus terreus menunjukkan aktivitas penghambatan lebih tinggi terhadap beberapa jamur seperti Aspergillus niger dengan diameter zona hambat sebesar 28 mm, Aspergillus oryzae sebesar 22 mm dan Penicillum oxysporium sebesar 18 mm dibandingkan Rhizocotonia solani sebesar 12 mm, Fusarium solani sebesar 8 mm dan Candida albicans sebesar 7 mm (Farag et al., 2016). Hasil penelitian Harighi et al. (2007), kitinase murni dari Trichoderma atroviride PTTC5220 dan Trichoderma ressei mampu menghambat pertumbuhan Rhizoctonia solani dan Ganoderma philippii. Enzim endokitinase murni dari Trichoderma ressei pada konsentrasi 100-200 μg/ml, dapat melisiskan ujung hifa Ganoderma philippii.
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli 2019 hingga Juni 2020 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Medan.
3.2 Peremajaan Jamur Endofit
Isolat jamur endofit yang digunakan dalam penelitian ini adalah isolat yang berasal dari beberapa jenis rhizom tumbuhan suku Zingiberaceae (Lampiran 1).
Isolat jamur yang digunakan adalah sebanyak 31 jenis. Jamur endofit diremajakan pada media Potato Dextrose Agar (PDA) steril, lalu diinkubasi selama 3 hingga 5 hari pada suhu ±28°C.
3.3 Skrining Aktivitas Kitinase
Kultur jamur endofit yang sudah diremajakan diinokulasikan pada medium garam minimum kitin (MGMK) agar (Komposisi medium di lampiran 2) sebanyak satu cork borer dan diletakkan di tengah permukaan medium. Kultur jamur endofit diinkubasi pada suhu ±28°C selama 7 hari. Pengamatan dilakukan setiap hari untuk melihat adanya zona bening yang terbentuk dan diukur diameter koloni jamur yang tumbuh pada medium menggunakan jangka sorong. Terbentuknya zona bening mengindikasikan bahwa isolat jamur endofit memiliki aktivitas kitinase. Selanjutnya, jamur endofit yang memiliki zona bening dipilih untuk dilakukan uji selanjutnya.
3.4 Produksi Kitinase Jamur Endofit Kitinolitik
Dari hasil uji skrining sebelumnya, diperoleh sebanyak 2 isolat jamur endofit yang mampu menghasilkan zona bening dari 31 jenis jamur yang sudah diujikan.
Produksi kitinase dilakukan dengan cara meremajakan isolat jamur endofit terlebih dahulu. Isolat jamur endofit yang sudah berumur 3 hari diinokulasikan sebanyak 5
13
cork borer ke dalam 100 ml medium garam minimum kitin (MGMK) cair pada erlenmeyer 250 ml. Kultur diinkubasi di atas orbital shaker pada kecepatan 120 rpm selama 7 hari pada suhu ±28°C. Setiap sehari sekali diambil kultur sebanyak 10 ml dalam erlenmeyer yang sama, lalu disentrifugasi pada kecepatan 11.000 rpm selama 10 menit pada suhu 4°C untuk memperoleh supernatan. Supernatan yang terbentuk diukur aktivitasnya.
3.5 Pengukuran Aktivitas Kitinase Jamur Endofit Kitinolitik
Pengukuran aktivitas kitinase dilakukan dengan metode Monreal dan Reese (1969) yang telah dimodifikasi. Aktivitas kitinase ditentukan berdasarkan jumlah gula reduksi (N-asetil-D-Glukosamin) yang dilepas dan diukur secara kolorimetri.
Pengukuran diawali dengan membuat kurva standar N-asetil-D-Glukosamin dengan rangkaian konsentrasi (0, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 ppm) dalam 3,5-Dinitrosalicyclic acid (DNS) dan akuades. Campuran dihomogenkan dan dipanaskan pada suhu 100°C selama 10 menit. Selanjutnya, campuran didinginkan dan diukur nilai absorbansinya pada panjang gelombang 540 nm.
Pengujian enzim dilakukan dengan mereaksikan enzim pada tabung reaksi yang terdiri dari perlakuan sampel, kontrol dan blanko. Reaksi perlakuan sampel dilakukan dengan mencampurkan 2 ml supernatan dengan 2 ml buffer fosfat pH 7 dan 2 ml koloidal kitin 0,3%. Sedangkan kontrol dibuat dengan reaksi yang sama tanpa penambahan supernatan. Blanko dibuat dengan mencampurkan 2 ml akuades dan 1 ml DNS. Kemudian masing-masing perlakuan diinkubasi pada suhu 37°C selama 30 menit di dalam inkubator shaker dengan kecepatan 120 rpm. Reaksi enzimatis dihentikan dengan penambahan 1 ml DNS dan dipanaskan pada suhu 100°C selama 10 menit. Selanjutnya, nilai absorbansi diukur dengan menggunakan spektrofotometer UV-VIS mini (Shimadzu) pada panjang gelombang 540 nm. Nilai absorbansi yang diperoleh dimasukkan ke dalam persamaan regresi kurva standar untuk mengetahui konsentrasi enzim.
14
3.6 Pengukuran Kadar Protein
Pengukuran kadar protein enzim dilakukan berdasarkan metode Bradford (1976) dan menggunakan bovine serum albumin (BSA) sebagai standar. Pengukuran diawali dengan pembuatan kurva standar dengan rangkaian konsentrasi (0, 20, 40, 60, 80 dan 100 ppm) dalam akuades dan reagen Bradford. Larutan kemudian dihomogenkan dan diukur niali absorbansinya pada panjang gelombang 595 nm.
Pengukuran dilakukan dengan mencampurkan 1 ml enzim dengan 3 ml reagen Bradford, lalu dihomogenkan dan diukur nilai absorbansinya dengan spektrofotometer UV-VIS mini (Shimadzu) pada panjang gelombang 595 nm. Nilai absorbansi yang diperoleh dimasukkan ke dalam persamaan regresi kurva standar untuk mengetahui kadar konsentrasi protein enzim.
3.7 Karakterisasi pH
Pengujian ini dilakukan dengan mereaksikan 2 ml enzim dengan 2 ml koloidal kitin 0,3% dan 2 ml larutan penyangga pada pH 4 hingga 9. Buffer asetat digunakan pada rentang pH 4-5, buffer fosfat digunakan pada rentang pH 6-7 dan buffer Tris-HCl pada pH 8-9. Konsentrasi masing-masing buffer adalah 50 mM.
Selanjutnya, campuran dihomogenkan dan diinkubasi pada suhu 37°C selama 30 menit. Lalu, disentrifugasi pada kecepatan 11.000 rpm selama 10 menit pada suhu 4°C. Sebanyak 2 ml supernatan yang terbentuk direaksikan dengan 1 ml DNS, lalu dipanaskan pada suhu 100°C selama 10 menit untuk menghentikan reaksi. Nilai absorbansi diukur menggunakan spektrofotometer UV-VIS mini (Shimadzu) pada panjang gelombang 540 nm. Pengujian ini dilakukan untuk mengetahui pH optimum kitinase yang akan digunakan untuk uji selanjutnya.
3.8 Karakterisasi Ion Logam
Pengujian ini dilakukan dengan mereaksikan 2 ml enzim, 2 ml buffer fosfat pH 6, koloidal kitin 0,3% dan 0,1 ml larutan ion logam dalam bentuk garam yaitu MnCl2, CaCl2, KCl, CuSO4, NaCl, MgCl2, ZnCl2, FeSO4, Pb(NO3)2. Konsentrasi masing-masing larutan ion logam adalah 1 mM. Selanjutnya, campuran dihomogenkan dan diinkubasi pada suhu 37°C selama 30 menit. Lalu, disentrifugasi pada kecepatan 11.000 rpm selama 10 menit pada suhu 4°C. Sebanyak 2 ml
15
supernatan yang terbentuk direaksikan dengan 1 ml DNS, lalu dipanaskan pada suhu 100°C selama 10 menit untuk menghentikan reaksi. Nilai absorbansi diukur menggunakan spektrofotometer UV-VIS mini (Shimadzu) pada panjang gelombang 540 nm.
3.9 Uji Antagonis Jamur Endofit Kitinolitik dengan Jamur Patogen
Jamur patogen yang digunakan pada uji ini adalah Ganoderma boninense dan Fusarium oxysporum yang diperoleh dari koleksi Laboratorium Mikrobiologi Departemen Biologi, Universitas Sumatera Utara, Medan. Jamur patogen terlebih dahulu ditumbuhkan pada media PDA untuk memperoleh miselium segar. Miselium jamur patogen diambil menggunakan cork borer dan diletakkan di tengah permukaan MGMK agar. Setelah tiga hari inkubasi, blok jamur endofit dimasukkan ke kedua sisi jamur patogen dengan jarak yang sama. Selanjutnya, diinkubasi selama 5 hari pada suhu ruang. Persentase hambatan miselium yang terbentuk diukur dengan rumus (Bivi et al., 2010):
CGI (%) = (R1 − R2)
R1 × 100
Ket:
CGI = Colony Growth Inhibition (hambatan pertumbuhan miselium ) R1 = Jari-jari jamur patogen yang berlawanan arah dengan jamur endofit R2 = Jari-jari koloni jamur patogen menuju jamur endofit
3.10 Pengendapan Amonium Sulfat Ekstrak Kasar Kitinase
Pengujian dilakukan menggunakan jenis jamur patogen yang sama dengan uji sebelumnya. Ekstrak kasar kitinase sebelumnya dipresipitasi menggunakan garam amonium sulfat dengan kejenuhan 70% pada suhu 10°C. Amonium sulfat ditambahkan ke dalam supernatan sedikit demi sedikit sambil diaduk menggunakan magnetic stirrer selama 1 jam. Hasil presipitasi selanjutnya disimpan pada suhu 4°C selama 24 jam, lalu disentrifugasi pada kecepatan 11.000 rpm selama 10 menit pada suhu 4°C. Pelet yang terbentuk dilarutkan dalam buffer fosfat pH 7 sebanyak 2 ml.
Ekstrak kasar kitinase yang dihasilkan akan diujikan kemampuan daya hambatnya terhadap jamur patogen tanaman dengan menggunakan kertas cakram.
16
3.11 Uji Kemampuan Daya Hambat Ekstrak Kasar Kitinase terhadap Jamur Patogen
Uji antagonis dilakukan dengan menginokulasikan jamur patogen menggunakan cork borer, lalu diletakkan di tengah permukaan media MGMK agar.
Setelah 3 hari inkubasi, sebanyak 10 μl kitinase hasil presipitasi diinokulasikan pada kertas cakram di bagian kanan dan kiri jamur patogen dengan jarak 3,5 cm. Biakan diinkubasi pada suhu ±28°C selama 5 hari. Aktivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk Persentase hambatan miselium yang terbentuk dihitung dengan rumus Bivi et al. (2010).
BAB 4
HASIL DAN PEMBAHASAN
4.1 Skrining Aktivitas Kitinase Jamur Endofit
Skirining aktivitas kitinase diujikan terhadap 31 isolat jamur asal tumbuhan Zingiberaceae. Pengujian ini dilakukan dengan melihat adanya zona bening yang terbentuk di sekitar koloni jamur dan diukur diameter koloni jamur endofit yang tumbuh pada medium. Hasil pengamatan dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil skrining jamur endofit pada medium garam minimum kitin (MGMK) Agar, umur 7 hari, suhu ±28⁰C
No. Kode Isolat Diameter Koloni (mm) Zona Bening
1 JRD 1A 19,1 -
2 JRD 2A 18 -
3 JRD 3A 31 -
4 JRD 2C 63 -
5 JRE 1A 90 +
6 JRE 2A 23,3 -
7 JRE 1B 90 -
8 JRE 2B 21,4 -
9 JRE 4B 58,3 +
10 JRL 1A 17,6 -
11 JRL 2A 49,8 -
12 JRL 3A 55,7 -
13 JRL 4A 32,2 -
14 JRL 1B 47,5 -
15 JRL 2D 39,7 -
16 JRN 2A 29 -
17 JRN 3A 16,4 -
18 JRN 4A 29 -
19 JRN 1B 20,7 -
20 JRN 4B 48,7 -
21 JRN 1C 32 -
22 JRS 1A 30 -
23 JRS 2A 42 -
24 JRS 1B 39 -
25 JRS 2B 46,8 -
26 JRS 1C 49,4 -
27 JRT 1A 32,6 -
28 JRT 2A 51,1 -
29 JRT 3A 25 -
30 JRT 1B 57,5 -
31 JRT 2C 48,9 -
Keterangan: +: Terbentuk zona bening; - : Tidak terbentuk zona bening
18
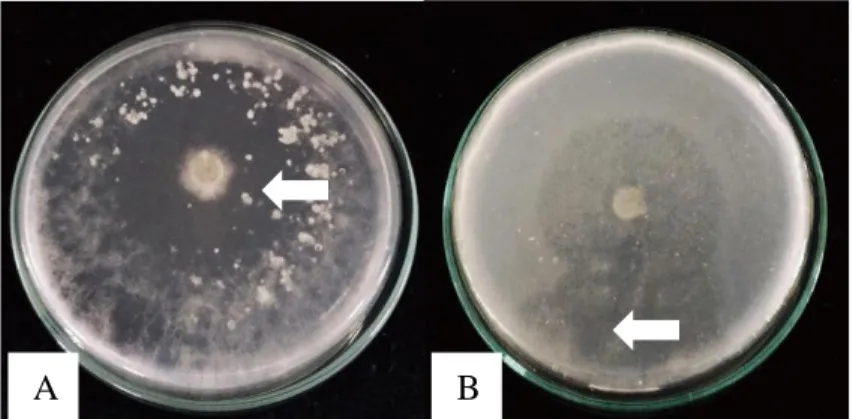
Diameter koloni jamur endofit terbesar terdapat pada isolat JRE 1A dan JRE 1B sebesar 90 mm, lalu disusul dengan isolat JRD 2C sebesar 63 mm dan JRE 4B sebesar 58,3 mm, sedangkan terkecil ialah isolat JRN 3A sebesar 16,4 mm. Ketiga puluh satu isolat jamur endofit yang telah diujikan, diperoleh 2 isolat yang mampu menghasilkan zona bening. Kedua isolat tersebut adalah JRE 1A dan JRE 4B. Zona bening yang terbentuk disebabkan karena adanya degradasi kitin yang dilakukan oleh enzim kitinase. Kitinase adalah enzim hidrolitik yang mendegradasi kitin yaitu polimer b-1,4 N-asetil-D-glukosamin (Yurnaliza, 2011). Menurut Dewi (2008), ukuran zona bening yang dihasilkan ditentukan oleh jumlah monomer N- asetilglukosamin dari proses hidrolisis kitin. Semakin besar zona bening yang terbentuk maka semakin banyak N-asetilglukosamin yang dihasilkan. Kitinase adalah metabolit yang tidak berwarna, sehingga untuk mengetahui produksi kitinase dapat diamati dari warna medium menjadi lebih transparan (Wijaya, 2002). Keberadaan zona bening yang terdapat di sekitar koloni jamur dapat dilihat pada Gambar 4.1.
Gambar 4.1 Koloni jamur endofit potensial penghasil kitinase di medium garam minimum kitin (MGMK) agar; (A) JRE 1A, (B) JRE 4B inkubasi 4 hari pada suhu ±28ᵒC
Penambahan koloidal kitin pada medium mampu menginduksi bakteri, jamur maupun aktinomisetes dalam menghasilkan kitinase. Menurut Hsu dan Lockwood (1975), colloidal chitin agar adalah medium selektif yang mengandung kitin sebagai satu-satunya sumber karbon untuk mengisolasi mikrob kitinolitik. Pemanfaatan koloidal kitin sebagai substrat lebih efektif digunakan untuk menentukan aktivitas kitinase. Kitin merupakan substrat yang dapat digunakan untuk produksi baik endo maupun eksokitinase. Degradasi substrat kitin bersandar pada aktivitas kitinase,
A B
19
faktor lingkungan seperti pH, suhu dan aerasi, sumber nutrisi yang digunakan dalam media, serta karakter metabolisme mikroorganisme penghasil kitinase (Herdyastuti et al., 2009). Penelitian Harjono dan Widyastuti (2001) membuktikan bahwa Trichoderma reesei memiliki aktivitas spesifik endokitinase yang tinggi dibandingkan dengan 1% crab shell chitin. Yurnaliza et al. (2008) juga melaporkan Streptomyces RKt5 memiliki aktivitas kitinase optimum pada penggunaan 0,2%
koloidal kitin.
4.2 Produksi dan Aktivitas Kitinase Jamur Endofit Kitinolitik
Isolat jamur endofit yang menghasilkan zona bening diukur aktivitasnya.
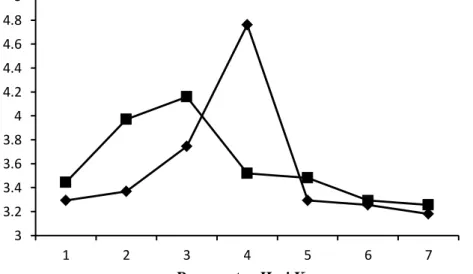
Aktivitas kitinase adalah ukuran jumlah produk yang dihasilkan dari suatu pemecahan substrat kitin (Herdyastuti et al., 2009). Hasil yang diperoleh menunjukkan bahwa masa inkubasi optimum aktivitas kitinase kedua isolat jamur endofit berbeda. Aktivitas kitinase isolat jamur endofit dapat dilihat pada Gambar 4.2.
Gambar 4.2 Aktivitas kitinase jamur endofit kitinolitik selama inkubasi 7 hari pada MGMK cair pada suhu ±28°C
Gambar 4.2 menunjukkan hasil pengukuran aktivitas kitinase kedua isolat berbeda. Isolat JRE 4B memiliki waktu inkubasi optimum untuk produksi enzim adalah 4 hari dengan nilai aktivitas enzim sebesar 4,76 U/mL, sedangkan isolat JRE
3 3.2 3.4 3.6 3.8 4 4.2 4.4 4.6 4.8 5
1 2 3 4 5 6 7
Aktivitas Enzim (U/mL)
Pengamatan Hari Ke-
JRE 4B JRE 1A
20
1A adalah 3 hari dengan nilai aktivitas enzim sebesar 4,15 U/mL. Hal ini menunjukkan bahwa kedua waktu tersebut merupakan waktu yang tepat untuk dilakukan pemanenan enzim dari masing-masing isolat jamur. Pemanenan enzim biasanya dilakukan pada fase log karena pada fase ini sel jamur endofit mengalami pertumbuhan yang cukup cepat dengan jumlah sel yang banyak. Elawati et al.
(2018), menyatakan bahwa hari ke 0 sampai hari ke 3 adalah fase log (eksponensial).
Pada fase ini, sel mikrob membelah dengan cepat mengikuti kurva logaritmik.
Puncak waktu inkubasi terjadi pada fase stasioner yaitu hari ke 4. Hari ke 5 inkubasi menunjukkan penurunan jumlah sel mikrob. Apabila jumlah sel yang tumbuh banyak maka enzim yang dihasilkan juga banyak karena masing-masing sel mensekresikan enzim (Karso et al., 2014). Setelah mencapai waktu optimum, aktivitas enzim menurun disebabkan karena terjadinya akumulasi produk hidrolisis yang selanjutnya dapat menghambat aktivitas enzim (Purkan et al., 2014).
Waktu inkubasi optimum untuk produksi enzim setiap mikroorganisme berbeda-beda seperti pada penelitian Verena (2008), waktu produksi enzim kitinase dari isolat Streptomyces sp. adalah 6 hari ditunjukkan dengan aktivitas paling tinggi sebesar 34 U/ml. Rachmawaty dan Madiha (2013), melaporkan produksi kitinase dari Trichoderma virens menghasilkan aktivitas kitinase tertinggi 0.194 U/g setelah 3 hari fermentasi menggunakan substrat limbah udang dengan perlakuan microwave.
Gambar 4.3 Jamur endofit kitinolitik JRE 4B (kiri), JRE 1A (tengah), medium tanpa jamur (kanan) pada medium garam minimum kitin (MGMK) cair setelah 6 hari pada suhu ±28ᵒC
Keberadaan kitin dalam medium garam minimum kitin akan menstimulasi jamur endofit untuk mengeluarkan kitinase dari sel sehingga dapat memecah polimer
21
kitin menjadi monomernya. Produksi kitinase dapat dilihat dari warna media yang menjadi transparan dalam erlenmeyer (Gambar 4.3). Warna media yang transparan dikarenakan adanya enzim kitinase yang disekresikan ke dalam media sebagai metabolit jamur endofit. Kitinase adalah enzim ekstraseluler yang berperan dalam menghidrolisis kitin. Enzim ekstraseluler merupakan enzim yang dihasilkan di dalam sel, tetapi dikeluarkan ke media tumbuhnya (Tsujibo et al., 1999). Enzim kitinase (E.C.3.2.1.14) digolongkan dalam kelompok enzim hidrolase yang dapat mengidrolisis kitin secara langsung menjadi produk dengan berat molekul kecil, yang banyak dihasilkan oleh mikroorganisme (Wang dan Chang, 1997), baik secara intra maupun ekstraseluler. Kitinase mampu menghidrolisis kitin polimerik menjadi oligosakarida kitin, deasetilkitobiosa, dan N-asetilglukosamin (Thompson et al., 2001). Mikroorganisme kitinolitik memenuhi nutrisinya dengan mendegradasi kitin.
Salah satu faktor dalam menentukan kemampuan isolat jamur kitinolitik dalam mendegradasi substrat kitin adalah aktivitas spesifik kitinase dapat dilihat pada Tabel 4.2.
Tabel 4.2 Total aktivitas, kadar protein dan aktivitas spesifik isolat jamur endofit kitinolitik hari ke 7
No. Kode Isolat
Total Aktivitas Enzim (U)
Kadar Protein (mg/mL)
Aktivitas Spesifik (U/mg)
1 JRE 1A 32,54 910,2 0,03
2 JRE 4B 31,79 776,0 0,04
Berdasarkan Tabel 4.2, isolat JRE 1A memiliki nilai aktivitas spesifik lebih kecil yaitu 0,03 U/mg dengan kadar protein sebesar 910,2 mg/ml dibandingkan isolat JRE 4B yang memiliki nilai aktivitas spesifik sebesar 0,04 U/mg dan kadar protein 776 mg/ml. Hal ini sesuai dengan pernyataan Herdyastuti et al. (2009), bahwa aktivitas spesifik enzim dihitung berdasarkan kadar protein yang dihasilkan, apabila nilai kadar protein semakin rendah maka semakin tinggi nilai aktivitas spesifiknya dan begitu sebaliknya. Nilai aktivitas spesifik menunjukkan tingkat kemurnian suatu enzim (Haliza dan Suhartono, 2012).
4.3 Pengaruh pH terhadap Aktivitas Kitinase Jamur Endofit Kitinolitk
22
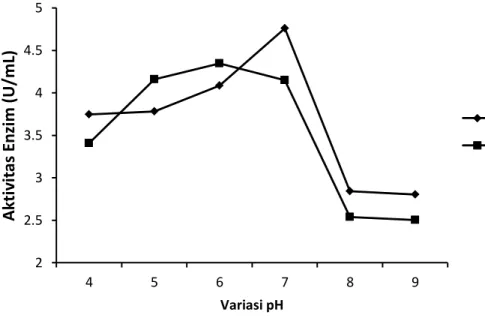
Kedua isolat jamur endofit menunjukkan aktivitas optimum pada pH yang bebeda yaitu dapat dilihat pada Gambar 4.4.
Ket: pH 4-5: buffer asetat 6-7: buffer fosfat 8-9: buffer Tris-HCl
Gambar 4.4 Pengaruh pH terhadap aktivitas kitinase dengan suhu inkubasi 37°C selama 30 menit
Gambar 4.4 menunjukkan bahwa enzim kitinase yang dihasilkan isolat JRE 4B dan JRE 1A bereaksi pada pH optimum yang berbeda. Aktivitas enzim isolat JRE 4B optimum pada pH 7 yaitu dengan nilai aktivitas enzim sebesar 4,76 U/mL sedangkan aktivitas enzim isolat JRE 1A optimum pada pH 6 dengan nilai aktivitas sebesar 4,35 U/mL. Perbedaan ini dikarenakan setiap enzim memiliki kemampuan menghidrolisis substrat pada pH optimum yang berbeda-beda. Nielsen et al. (1999), menyatakan bahwa pada pH optimum terjadi perubahan ionisasi dalam gugus ionik enzim pada sisi aktifnya. Gugus pemberi dan penerima proton berada dalam tingkat ionisasi yang diinginkan, sehingga konformasi sisi aktif menjadi efektif dalam mengikat dan mengubah substrat menjadi produk. Perubahan pH lingkungan dapat mempengaruhi perubahan ionisasi enzim, substrat, atau kompleks enzim dengan substrat, sehingga menurunnya aktivitas enzim.
2 2.5 3 3.5 4 4.5 5
4 5 6 7 8 9
Aktivitas Enzim (U/mL)
Variasi pH
JRE 4B JRE 1A
23
Beberapa hasil penelitian menunjukkan bahwa enzim-enzim penghidrolisis kitin pada umumnya bekerja optimal pada kisaran pH asam sampai netral (Sharaf et al., 2012). Rahayu (2000) melaporkan Streptomyces sp. J-13-3 optimum pada pH 6.
Demikian juga kitinase pada Trichoderma harzianum, Bacillus licheniformis MB2 (Situmorang, 2003), Vibrio sp 98CJ1102 (Park et al., 2000) dan isolat 13,30 yang diisolasi dari Manado (Jayanti, 2002) memiliki nilai pH optimum 6. Kitinase dari Aspergillus terreus optimum pada rentang pH 5 sampai 8 (Farag et al., 2016). Wang et al. (2002), juga melaporkan aktivitas kitinase asal Monascus purpureus stabil pada rentang pH 6 sampai 8.
4.4 Pengaruh Ion Logam terhadap Aktivitas Kitinase Jamur Endofit Kitinolitik Beberapa ion logam telah diujikan dan hasil pengujian ion logam terhadap aktivitas relatif kitinase isolat jamur endofit kitinolitik dapat dilihat pada Tabel 4.3.
Pengukuran ini dilakukan pada kondisi pH optimum yang diperoleh pada pengujian sebelumnya. Konsentrasi ion logam yang digunakan ialah 1 mM. Ion logam berfungsi sebagai aktivator atau inhibitor dalam proses katalisis enzim. Apabila nilai aktivitas relatif lebih besar daripada kontrol maka ion logam tersebut bersifat aktivator, sedangkan nilai aktivitas relatif lebih kecil daripada kontrol maka ion logam bersifat inhibitor.
Tabel 4.3 Pengaruh ion logam terhadap aktivitas kitinase jamur endofit kitinolitik dengan suhu inkubasi 37⁰C selama 30 menit
Ion Logam Aktivitas Relatif Kitinase (%)
JRE 4B JRE 1A
Kontrol 100 100
K+ 80 83
Ca2+ 82 96
Pb+ 90 108
Na+ 91 111
Cu2+ 91 115
Fe3+ 95 118
Mg2+ 94 128
Zn2+ 105 152
Mn2+ 136 156
24
Penambahan ion logam pada konsentrasi optimum mampu meningkatkan konsentrasi komplek logam substrat, kemudian merubah potensial elektrokinetik protein enzim sehingga proses aktivasi menjadi optimal (Setyahadi et al., 2006).
Apabila konsentrasi logam lebih besar atau lebih kecil dari konsentrasi optimum, maka kesetimbangan dan potensial elektrokinetik tidak mencapai atau melebihi batas yang diinginkan dan menyebabkan proses aktivasi tidak optimal bahkan dapat menghambat enzim sehingga aktivitas enzim akan menurun.
Tabel 4.3 memperlihatkan bahwa beberapa ion logam yang diujikan terhadap aktivitas kitinase menunjukkan ion logam K+, Ca2+, Pb+, Na+, Cu2+, Fe3+, Mg2+
menurunkan aktivitas kitinase isolat JRE 4B, sedangkan ion logam Zn2+ dan Mn2+
meningkatkan aktivitas kitinase. Pada isolat JRE 1A aktivitas enzim kitinase diturunkan oleh ion logam K+ dan Ca2+, namun ditingkatkan oleh ion logam Na+, Cu2+, Fe3+, Mg2+, Pb+, Zn2+ dan Mn2+. Keberadaan ion logam tidak berpengaruh signifikan terhadap aktivitas kitinase jamur endofit dalam penelitian ini, hal ini menunjukkan bahwa aktivitas kitinase jamur endofit di dalam jaringan tumbuhan memiliki konsistensi akan keberadaan ion logam di lingkungan.
Hasil penelitian Farag et al. (2016) melaporkan aktivitas kitinase Aspergillus terreus ditingkatkan oleh ion logam Ca2+, Mn2+, Na2+, K+, Mg2+ dan Cu2+, namun dihambat oleh ion logam Cd2+, Zn2+, Pb2+ dan Hg2+. Aktivitas kitinase Streptomyces sp. M-20 optimal pada pH 5 dan pada suhu 30°C. Ion logam Mg2+, Ca2+, Cu2+, Co2+, Ag+, Hg+, Sn2+, Fe2+, Fe3+ bertindak sebagai inhibitor (Kim et al., 2003). Bacillus sp.
BG-11 ion logam Ca2+, Ni2+ dan Triton x-100 dapat memacu aktivitas enzim hingga 20%, sedangkan ion logam Ag2+ dan Hg2+ menghambat aktivitas enzim hingga 50%
(Bhushan dan Hoondal, 1998), namun ion logam Co2+, Fe3+, Zn2+, Cd2+ dan Cu2+
bertindak sebagai aktivator kitinase (Wang et al., 2015).
4.5 Kemampuan Antagonis Isolat Jamur Endofit Kitinolitik terhadap Jamur Patogen Tanaman
Hasil uji antagonis isolat jamur endofit kitinolitik JRE 1A dan JRE 4B dapat menghambat pertumbuhan kedua jamur patogen tanaman dengan kemampuan yang berbeda-beda. Pertumbuhan jamur patogen tanaman yang terhambat diamati dengan melihat adanya zona bening di sekitar koloni jamur endofit kitinolitik yang tidak
25
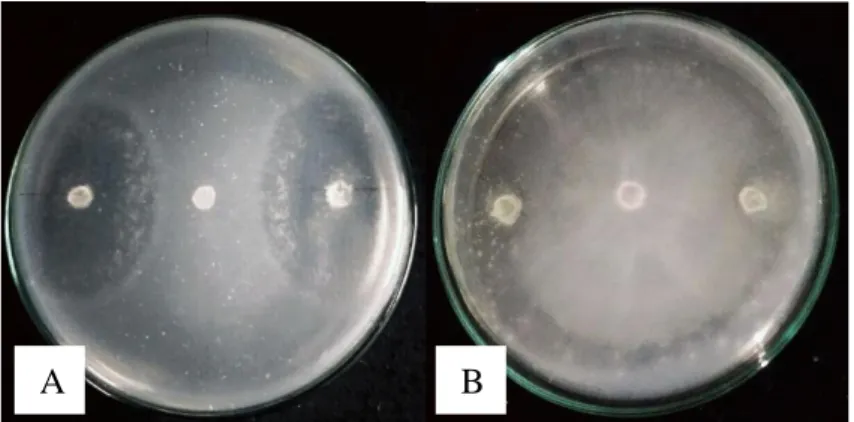
dapat ditumbuhi oleh hifa jamur patogen. Kemampuan dua isolat jamur endofit kitinolitik dalam menghambat pertumbuhan jamur patogen dapat dilihat pada Gambar 4.5 dan Tabel 4.4.
Kedua isolat jamur kitinolitik JRE 4B dan JRE 1A mampu menghambat pertumbuhan jamur patogen. Pengamatan secara langsung dapat dilihat dari adanya zona bening atau zona hambat yang terbentuk di antara pertumbuhan jamur patogen dengan jamur endofit kitinolitik yang diletakkan di kiri dan kanan sisi jamur patogen.
Terbentuknya zona hambat karena didukung oleh ketersediaan kitin dalam media uji, sehingga menstimulasi jamur endofit untuk mensekresikan kitinase dan lama kelamaan akan mendegradasi dinding sel jamur patogen. Gohel et al. (2006) menyatakan selain adanya kitin dalam media uji, besarnya zona hambat juga dipengaruhi oleh jumlah kandungan kitin yang terdapat pada dinding sel jamur.
Mikroorganisme dengan kemampuan mendegradasi kitin berperan dalam mengatasi serangan jamur patogen tanaman dengan memanfaatkan kitin sebagai sumber kabon (Kamil et al., 2007).
Gambar 4.5 Hasil uji antagonis isolat jamur endofit kitinolitik umur 5 hari terhadap Fusarium oxysporum (a) isolat JRE 1A, (b) isolat JRE 4B pada MGMK Agar pada suhu ±28⁰C
Hasil uji antagonis terkhusus isolat JRE 1A dapat dilihat terjadi pertemuan antara miselium jamur patogen dengan isolat jamur endofit. Pertumbuhan isolat jamur endofit mendekati jamur patogen sehingga menghasilkan penghambatan pertumbuhan jamur Fusarium oxysporum. Hal ini dikarenakan selain adanya enzim
A B
26
ataupun senyawa metabolit sekunder lainnya yang disekresikan oleh jamur endofit, penghambatan kedua isolat juga dapat terjadi karena adanya persaingan nutrisi dan ruang tumbuh di medium uji. Sesuai dengan pernyataan Soesanto (2008) bahwa kompetisi nutrisi dan ruang hidup merupakan fungsi utama oleh semua agen pengendali hayati.
Tabel 4.4 Persentase hambatan miselium Fusarium oxysporum dan Ganoderma boninense oleh isolat jamur endofit kitinolitik pada MGMK Agar umur 5 hari dan suhu inkubasi ±28⁰C
Isolat Jamur Endofit
Persentase Hambatan (%)
Fusarium oxysporum Ganoderma boninense
JRE 1A 50,1 42,8
JRE 4B 28,5 2,7
Pada Tabel 4.4 dapat dilihat bahwa isolat JRE 1A memilki kemampuan lebih baik dalam menghambat Fusarium oxysporum dan Ganoderma boninense.
Persentase hambatan Fusarium oxysporum terhadap isolat JRE 1A lebih tinggi daripada isolat JRE 4B yaitu sebesar 50,1%, demikian dengan persentase hambatan Ganoderma boninense terhadap isolat JRE 1A juga lebih tinggi daripada isolat JRE 4B yaitu sebesar 42,8%. Persentase hambatan yang paling rendah ditunjukkan oleh isolat JRE 4B terhadap Ganoderma boninense dengan nilai 2,7%.
Perbedaan persentase penghambatan terjadi karena pada setiap isolat jamur endofit yang diujikan memiliki kemampuan yang berbeda-beda dalam mengendalikan Fusarium oxysporum dan Ganoderma boninense, hal ini disebabkan perbedaan mekanisme antagonis yang dihasilkan oleh jamur endofit. Dutta et al.
(2014) menyatakan bahwa pada saat endofit berkolonisasi dengan jamur patogen lainnya, jamur endofit dapat menghasilkan enzim seperti β-1,3-glukanase, kitinase, dan selulase yang berfungsi untuk menghidrolisis dinding sel jamur patogen.
Senyawa lainnya yang dapat dihasilkan oleh jamur endofit dalam menekan patogen adalah berupa senyawa antijamur seperti alkaloid, peptide, steroid, terpenoid, fenol, quinine, dan flavonoid (Yu et al., 2010).
Penelitian Alviodinasyari et al. (2005), melaporkan isolat Trichoderma sp.
SBJ8 dapat menghambat pertumbuhan Ganoderma boninense pada hari ke 4 sebesar 65,25%. Ginting et al. (2013) juga melaporkan jamur endofit yang diisolasi dari jahe
27
merah (Zingiber officinale) mampu menekan pertumbuhan Fusarium oxysporum berkisar antara 1,4 hingga 68,8%.
4.6 Kemampuan Ekstrak Kasar Kitinase dalam Menghambat Jamur Patogen Tanaman
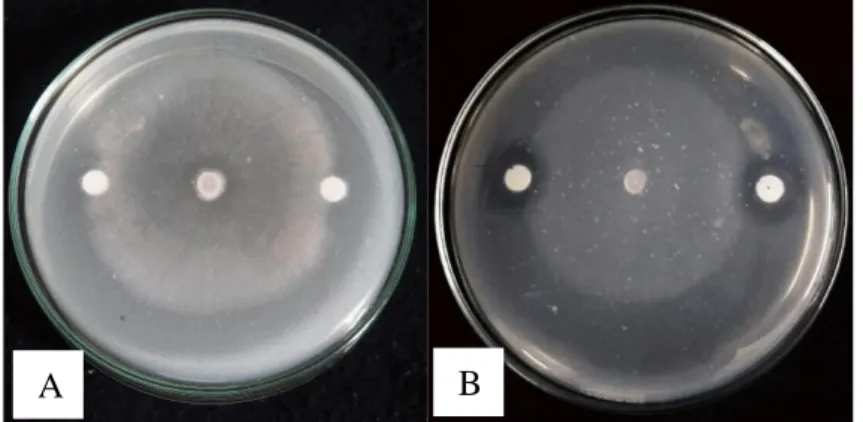
Ekstrak kasar kitinase hasil pengendapan amonium sulfat 70% diujikan terhadap Fusarium oxysporum dan Ganoderma boninense. Kemampuan ekstrak kasar kitinase kedua isolat jamur endofit kitinolitik dalam menghambat jamur patogen tanaman dapat dilihat pada Gambar 4.6. Zona hambat yang terbentuk menunjukkan kemampuan kitinolitik dari ekstrak kasar kitinase yang telah dipresipitasi.
Gambar 4.6 Hasil uji ekstrak kasar kitinase jamur endofit kitinolitik umur 5 hari terhadap Fusarium oxysporum (a) ekstrak kasar enzim kitinase jamur endofit JRE 1A (b) ekstrak kasar enzim kitinase jamur endofit JRE 1B pada MGMK Agar pada suhu ±28⁰C
Enzim kitinase banyak digunakan sebagai agen biokontrol terutama bagi tanaman yang terserang infeksi jamur. Hal ini dikarenakan kitin merupakan komponen utama dinding sel jamur yang dapat didegradasi oleh enzim kitinase (Herdyastuti et al., 2009). Beberapa penelitian tentang pengendalian hayati jamur patogen tanaman dengan menggunakan mikroorganisme kitinolitik telah banyak dilakukan, diantaranya melihat kemampuan dalam menghambat pertumbuhan jamur Fusarium semitectum pada cabai dan Ganoderma pada kelapa sawit (Suryanto et al.,
A B
28
2011). Kemampuan kitinase dalam melisiskan dinding sel jamur patogen oleh mikroorganisme kitinolitik mampu bertindak sebagai agen pengendali hayati jamur (El-Katatny et al., 2000). Hasil pengukuran persentase hambatan miselium oleh ekstrak kasar kitinase terhadap jamur patogen tanaman dapat dilihat pada Tabel 4.5.
Tabel 4.5 Persentase hambatan miselium Fusarium oxysporum dan Ganoderma boninense oleh ekstrak kasar kitinase jamur endofit kitinolitik pada MGMK Agar umur 5 hari dan suhu inkubasi ±28⁰C
Ekstrak Kasar Kitinase Jamur Endofit
Persentase Penghambatan (%)
Fusarium oxysporum Ganoderma boninense
JRE 1A 19,4 13,3
JRE 4B 18,3 15,8
Tabel 4.5 menunjukkan hasil persentase penghambatan Fusarium oxysporum terhadap kitinase isolat JRE 1A tidak berselisih jauh dengan isolat JRE 4B yaitu 19,4% dan 18,3%. Kemampuan kitinase isolat JRE 1A lebih rendah daripada isolat JRE 4B dalam menghambat Ganoderma boninense yaitu sebesar 13,3%.
Penghambatan jamur patogen oleh ektrak kasar kitinase tidak memberikan hasil yang cukup baik, hal ini dikarenakan ekstrak kasar kitinase dari kedua isolat isolat jamur endofit kitinolitik kurang mampu menghambat kedua jenis jamur patogen tanaman.
Yurnaliza et al. (2011) menyatakan bahwa kitinase murni sulit untuk menembus miselium jamur yang utuh dan aktivitas enzim kitinase akan bekerja lebih baik apabila miselium jamur utuh berbentuk dalam potongan-potongan kecil. Selain itu, aktivitas penghambatan oleh kitinase juga membutuhkan enzim lain selama menghambat pertumbuhan jamur patogen.
Penghambatan pertumbuhan miselium jamur patogen terjadi pada media yang mengandung kitin. Menurut Wijaya (2002), senyawa kitin yang merupakan homopolimer ikatan β-1,4 dari N-asetilglukosamin adalah komponen terbesar dari struktural dinding sel jamur patogen. Enzim kitinase yang disekresikan dari jamur kitinolitik dapat mengkatalisis hidrolisis ikatan β-1,4 homopolimer N- asetilglukosamin menjadi monomer N-asetilglukosamin, sehingga dinding sel jamur patogen lisis. Penelitian yang sama juga dilakukan El-Katatny et al. (2000) yaitu enzim kitinase yang telah dimurnikan dari jamur Trichoderma menunjukkan aktivitas antifungi melawan Sclerotium rolfsii, Aspergillus flavus dan Fusarium moniliforme.
29
Parani et al. (2011) juga melaporkan ekstrak kasar kitinase asal Serratia marcescens dapat menghambat Fusarium oxysporum, Sclerotium rolfsii, Rhizoctonia solani dan
Alternaria alternata.