1
2 TINJAUAN PUSTAKA
PERAN KOLONISASI
STAPHYLOCOCCUS AUREUS PADA INFEKSI KULIT SUPERFISIAL ANAK
dr. N. L. P Ratih Vibriyanti Karna, Sp.KK, FINSDV dr. Gst. A. Vina Mery Giovani
PROGRAM PENDIDIKAN DOKTER SPESIALIS I BAGIAN/SMF ILMU KESEHATAN KULIT DAN
KELAMIN FAKULTAS KEDOKTERAN UNUD/
RSUP SANGLAH DENPASAR
2017
3 DAFTAR ISI
DAFTAR ISI……….. i
DAFTAR GAMBAR ………. ii
DAFTAR TABEL... iii
BAB I PENDAHULUAN………... 1
BAB II TINJAUAN PUSTAKA……….. 3
2.1 Karakteristik Staphylococcus aureus……… 3
2.2 Patogenesis Infeksi Kulit Superfisial Staphylococcus aureus... 4
2.2.1 Susunan Kulit pada Anak dan Fungsi Barier Kulit……… 4
2.2.2 Faktor Host………. 8
2.2.3 Virulensi bakteri S. aureus……….... 10
2.2.3 Mekanisme Pertahanan Kutaneus Host Melawan Infeksi……… 12
2.3 Manifestasi Infeksi Kulit Superfisial Akibat Staphylococcus aureus 15 2.3.1 Impetigo……… 15
2.3.2 Ektima... 17
2.3.3 Folikulitis……….. 18
2.3.4 Furunkel dan Karbunkel………... 19
2.4 Penatalaksanaan Infeksi Kulit Superfisial pada Anak Akibat S. aureus... 19
2.4.1 Antibiotik Topikal……… 20
2.4.2 Antibiotik Oral………. 20
BAB III RINGKASAN... 23 DAFTAR PUSTAKA
4 DAFTAR GAMBAR
Gambar 1 Morfologi Staphylococcus aureus……… 3
Gambar 2 Interaksi host dan patogen selama kolonisasi Staphylococcus aureus 6 Gambar 3 Faktor virulensi Staphylococcus aureus selama infeksi kulit……….. 11
Gambar 4 Superantigens (SAg) dan relevansinya pada penyakit imunologi kulit... 12
Gambar 5 Pola pengenalan reseptor pada pertahanan host terhadap infeksi kulit Staphylococcus aureus……… 13
Gambar 6 Respons imun kutaneous yang dimediasi IL-1 IL-17 dalam melawan Staphylococcus aureus……….. 15
Gambar 7 Gambaran klinis impetigo bulosa dan non bulosa………... 17
Gambar 8 Gambaran klinis ektima………... 18
Gambar 9 Gambaran klinis folikulitis……….. 18
Gambar 10 Gambaran klinis furunkel dan karbunkel………. 19
5 DAFTAR TABEL
Tabel 1 Perbandingan kulit anak dan kulit dewasa……….. 6 Tabel 2 Terapi antibiotik skin and soft tissue infections Staphylococcus aureus… 21
6 BAB I
PENDAHULUAN
Kulit manusia secara normal akan terkolonisasi oleh sejumlah bakteria, beberapa saat setelah lahir. Beberapa minggu setelah kelahiran, diperkirakan jumlah bakteri yang terkolonisasi hampir sama dengan jumlah bakteri pada orang dewasa. Kulit merupakan barier utama untuk melindungi tubuh dari infeksi, meskipun demikian ketidakseimbangan homeostasis antara flora kulit dan daya tahan tubuh host serta higienitas yang kurang, dapat menyebabkan timbulnya penyakit.1,2
Infeksi kulit superfisial merupakan salah satu penyebab tersering dari kunjungan poliklinik pada populasi anak-anak di Indonesia. Mayoritas dari infeksi kulit superfisial tersebut disebabkan oleh Staphylococcus aureus (S. aureus).
Staphylococcus aureus merupakan bakteri komensal sekaligus patogen oportunistik yang dapat dijumpai pada kulit manusia dan merupakan salah satu penyebab infeksi kulit superfisial tersering pada anak. Lubang hidung merupakan lokasi tersering ditemukannya kolonisasi S. aureus, dimana kolonisasi secara permanen dapat ditemukan pada + 20% populasi. Sekitar + 60% individu sehat dapat menjadi pembawa S. aureus secara intermiten pada beberapa lokasi di tubuhnya. Kolonisasi ini merupakan salah satu faktor risiko terjadinya infeksi kulit terutama pada anak. Transmisi S. aureus dapat terjadi melalui kontak kulit secara langsung, atau kontak dengan area yang baru saja terkontaminasi S. aureus.
Dalam hal ini, tangan berperan penting dalam transmisi S. aureus dari lubang hidung ke berbagai area tubuh lainnya. Selain itu belum sempurnanya fungsi barier kulit pada anak akan mempermudah masuknya S. aureus untuk dapat menimbulkan infeksi pada kulit.3,4,5,6
Manifestasi klinis infeksi kulit superfisial akibat S. aureus pada anak memiliki perbedaan dibandingkan dewasa. Hal ini diakibatkan struktur kulit anak yang berbeda dibandingkan orang dewasa. Kulit bayi dan anak memiliki kerentanan terhadap berbagai iritasi, infeksi, paparan mekanis dan termal, juga permeabilitas agen topikal yang tinggi. Kondisi ini menyebabkan karakteristik
7 infeksi S. aureus cenderung lebih berat pada anak disamping kondisi imunitas yang belum terbentuk secara sempurna pada kelompok usia ini.7,8
Penatalaksanaan infeksi kulit superfisial akibat S. aureus berbasis pada aplikasi antibiotik selain manajemen suportif sesuai kebutuhan tatalaksana.
Penggunaan antibiotik topikal masih menjadi pilihan utama pada infeksi kulit superfisial tanpa komplikasi. Namun pada keadaan infeksi yang telah mengenai banyak lokasi pada tubuh maka antibiotik sistemik dapat diberikan. Selain pengobatan, perawatan pada luka juga dapat membantu pencegahan perluasan infeksi serta mencegah komplikasi yang dapat timbul.10,12,15
Mengingat infeksi S. aureus pada kulit dapat mengakibatkan infeksi sistemik yang mengancam nyawa, maka diperlukan pemahaman dalam pencegahan infeksi sekaligus pengobatan paska terjadinya infeksi untuk mencegah berbagai komplikasi yang dapat ditimbulkan.9,11
8 BAB II
TINJAUAN PUSTAKA
2.1 Karakteristik Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif yang berbentuk kokus (Gambar 1).9 Bakteri ini bersifat non motil, tidak membentuk spora, dan merupakan organisme anaerob fakultatif karena dapat bertahan hidup dengan respirasi aerobik atau fermentasi. Karakteristik lain yang dimiliki S. aureus dan membedakan dengan genus streptococcus adalah bakteri ini termasuk organisme katalase positif dan oksidase negatif, disamping kemampuan memproduksi koagulase untuk menggumpalkan darah.10 S. aureus dilindungi oleh dinding sel yang kuat yang terutama tersusun atas peptidoglikan dan asam teikoat dan bertanggung jawab pada 20-40% kasus mortalitas akibat bakteremeia.14,15
Gambar 1. Morfologi Staphylococcus aureus9
Sebagai bakteri gram positif, S. aureus memiliki dinding sel tebal, yang terdiri atas 50% berat peptidoglikan, namun tidak memiliki membran luar.
Peptidoglikan terdiri dari subunit bergantian asam N-asetilglukosamin dan N- asetilmuramat di mana rantai dihubungkan oleh jembatan pentaglycine S.
9 aureus spesifik antara rantai tetrapeptida yang terikat pada subunit asam N- asetilmuramat.8 Konstituen utama lebih lanjut dari dinding sel adalah asam sitokin ribitol, terikat secara kovalen dengan peptidoglikan, dan asam lipoteikloro, yang tertanam di membran. Bakteri memiliki mekanisme untuk mengurangi kerentanan terhadap peptida antimikroba yang diproduksi di jaringan dan oleh sel seperti neutrofil dan trombosit, di mana S. aureus mengurangi muatan negatif permukaannya dengan aksi protein Dlt dan MprF.7,8 Strategi lain untuk menetralisir peptida kationik adalah sekresi staphylokinase dan aureolysin, dengan karakteristik keduanya mengikat peptida antimikroba yang berasal dari host.11,12
Lokasi utama kolonisasi S. aureus pada umumnya di kulit dan mukosa manusia. Pada 20% populasi, S. aureus secara permanen berkolonisasi pada nares anterior. Loksi kolonisasi lainnya meliputi aksila, perineum, faring dan tangan. Pada neonatus, lokasi kolonisasi terseing S. aureus yaitu pada kulit, umbilikus, konjungtiva dan area sirkumsisi. Di Amerika Serikat, diperkirakan sekitar 30% individu sehat memiliki kolonisasi S. aureus di kulit atau mukosa.6,7 Kolonisasi oleh S. aureus ditentukan oleh faktor host (inang) dan organisme komensal yang melawan kolonisasi, di sisi lain faktor virulensi S.
aureus yang memudahkan kolonisasi.13
2.2 Patogenesis Infeksi Kulit Superfisial Staphylococcus aureus
Patogenesis infeksi kulit superfisial akibat S. Aureus pada anak dipengaruhi oleh beberapa faktor, seperti susunan kulit dan fungsi barier kulit, faktor host, virulensi bakteri, serta adanya mekanisme pertahanan kutaneus host melawan infeksi
2.2.1 Susunan Kulit pada Anak dan Skin Barrier Function
Kulit merupakan barrier penting yang melindungi tubuh dari mikroorganisme patogen dari lingkungan (Gambar 2A).6 Susunan kulit pada anak tersusun atas dasar lapisan yang sama dengan kulit dewasa, di mana terdiri atas lapisan epidermis, dermis, dan subkutan.13 Lapisan epidermis terdiri atas stratum korneum, granulosum, spinosum dan basal epidermis. Lapisan korneum terdiri
10 atas keratinosit yang telah berdiferensiasi akhir di mana tidak memiliki organel dan tinggi mengandung ikatan silang fibril keratin. Keratinosit mengandung protein yang disebut filagrin, yang membentuk lapisan tahan air, mikroba dan alergen, serta menjaga integritas kulit, sehingga stratum korneum berfungsi sebagai penghalang fisik utama kulit.14,15 Selain itu, keratinosit juga memproduksi peptida antimikroba seperti hBD2, hBD3, LL-37 cathelicidin dan RNase7 yang memiliki aktivitas bakteriostatik atau bakterisidal. Stratum granulosum, spinosum dan basalis terletak dibawah stratum korneum.
Epidermis selalu mengalami regenerasi saat keratinosit bermigrasi dari stratum basalis ke stratum korneum. Lapisan dermis terletak di bawah lapisan epidermis, yang tersusun atas fibrous stroma berserat yang terdiri atas serat kolagen dan elastin.14,15 Selain itu, terdapat pula struktur penunjang kulit seperti kelenjar keringat (eccrine dan apocrine), kelenjar sebaseous dan folikel rambut. Struktur yang tidak kalah penting adalah vaskulatur kulit yaitu superficial plexus dan deep plexus. 6,7,13
11 Gambar 2. Interaksi host dan patogen selama kolonisasi S. aureus13
(A) Permukaan kulit memiliki sifat konstitutif seperti suhu rendah dan pH rendah, komensal dan peptida antimikroba kulit yang melawan kolonisasi S. aureus. Pada epidermis terdapat banyak sel imun residensial di kulit yang berpartisipasi dalam respon imun, seperti sel Langerhans di epidermis dan sel dendritik dermal, makrofag, sel mast, sel T dan B, sel plasma dan sel NK di lapisan dermis. (B) Kolonisasi S. aureus membutuhkan pertautan terhadap permukaan kulit (dan mukosa hidung), yang dimediasi oleh komponen permukaan (surface component) S. aureus seperti fibronectin-binding protein A (Fnbp A) and Fnbp B, fibrinogen- binding proteins (ClfA and ClfB), iron regulated surface determinant A (IsdA) dan wall teichoic acid (WTA). Penghindaran dari sistem imun juga dimediasi oleh IsdA dengan mekanisme menghindari respon antimikroba host.
Meskipun barier kulit telah berfungsi secara kompeten sejak lahir pada kondisi bayi sehat dan sesuai masa kehamilan, kulit anak berbeda dengan kulit orang dewasa dalam komponen struktural, fungsional, dan komposisinya (Tabel 1).16 Hal ini terus berkembang selama tahun-tahun pertama kehidupan.6,7
12 Tabel 1. Perbandingan kulit anak dan kulit dewasa.7
Indikator Kulit Anak Kulit Dewasa
Perbedaan Struktural:
• Korneosit Kecil Besar
• Sel granular Kecil Besar
• Stratum korneum dan epidermis
Tipis Tebal
• Pigmentasi (melanin) Kurang Lebih
Perbedaan komposisi:
• Konsentrasi natural moisturizing factor
Rendah Tinggi
• Ph Tinggi (pada neonatus) Rendah
• Sebum Rendah (7-12 bulan) Tinggi
• Kandungan air stratum korneum
Tinggi Rendah
Perbedaan Fungsional:
• Laju absorpsi air Tinggi Rendah
• Laju desorpsi air Tinggi Rendah
• Skin barrier function Kompeten Kompeten
• Transdermal water loss
Tinggi Rendah
Fungsi barier kulit sangat tergantung pada struktur dan derajat hidrasi lapisan korneum. Korneosit yang relatif lebih kecil dan lebih tipis pada stratum korneum anak mengakibatkan kemampuan barier yang lebih rendah dibandingkan dengan kulit dewasa. Hidrasi yang memadai dari stratum korneum sangat penting untuk menjaga integritas struktur dan fungsionalitas stratum korneum. Kandungan air pada kulit juga mempengaruhi fungsi barier kulit melalui aktivitas enzim hidrolitik yang terlibat dalam pematangan stratum korneum serta regenerasi korneosit.7
Namun demikian, karena daya simpan air (water-handling) tidak sepenuhnya sempurna sebelum akhir tahun pertama kehidupan anak, stratum korneum anak mengalami laju kehilangan air yang lebih tinggi dari stratum korneum dewasa, meskipun lebih terhidrasi daripada kulit orang dewasa (Tabel 1).16,19 Besarnya derajat kehilangan air pada kulit anak, serta tingkat produksi sebum yang lebih rendah akan meningkatkan risiko kekeringan pada kulit.
13 Oleh sebab itu, kulit anak memiliki kecenderungan lebih tinggi untuk menjadi kulit kering dan berujung pada kerentanan terhadap infeksi dan dermatitis kontak iritan.20
Tingkat keasaman (pH) kulit juga penting dalam fungsinya sebagai barier kulit. Kondisi pH kulit matur dipertahankan antara 4,5-6,7 di mana hal ini menciptakan mantel asam.19,20 Lapisan asam ini berfungsi sebagai pertahanan terhadap infeksi dan memfasilitasi aktivitas biologis enzim pada stratum korneum yang berfungsi optimal pada pH 5,6.20 Pembentukan stratum korneum dalam suasana asam juga diperlukan untuk pematangan pelindung kulit dan proses regenerasi. Kulit neonatus memiliki pH lebih tinggi (6,6-7,5) dibanding kulit anak yang berusia lebih tua dan orang dewasa, kemudian menjadi lebih asam pada usia 5-6 minggu dan tetap stabil setelah usia tersebut.7,19,20
Salah satu kondisi patologis yang sering dijumpai pada anak adalah dermatitis atopik. Dermatitis atopik merupakan inflamasi kulit yang bersifat kronik, berulang, disertai rasa gatal dan berhubungan dengan penyakit atopik lainnya. Selain kondisi fisik kulit anak, dermatitis atopik dapat berperan sebagai predisposisi timbulnya infeksi kulit S. Aureus di kulit. Dermatitis atopik dapat menjadi faktor yang meningkatkan kecenderungan untuk lebih rentan terinfeksi S. aureus karena pada dermatitis atopik, fungsi barier kulit tidak sempurna, terutama pada saat eksaserbasi. Infeksi terjadi ketika anak menggaruk hidung atau lokasi kolonisasi S. aureus lainnya pada tubuh, kemudian menyentuh lesi atopik kulit, sehingga berimplikasi pada timbulnya infeksi akibat S. aureus.6,13,19
Kulit selain sebagai barier fisik, juga merupakan barier imunologis.
Keratinosit di epidermis mengekspresikan pattern recognition receptors (PRRs), seperti Toll-like receptors (TLRs) dan nucleotide-binding oligomerization domain (NOD)-like receptors yang mengenali pathogen- associated molecular patterns (PAMPs) dari mikroorganisme.14,15 Setelah pengenalan dari PAMPs, PRR memicu produksi mediator proinflamasi seperti sitokin, kemokin, dan peptida antimikroba untuk early innate cutaneous
14 immune responses.14,15 Respons imun ini termasuk aktivasi sel endotel yang membatasi pembuluh darah kulit untuk memulai perekrutan sel imun dari sirkulasi ke kulit.14,15 Selain itu, terdapat banyak sel imun residen di kulit. Pada epidermis terdapat sel dendritik yang disebut sel Langerhans, sedangkan pada lapisan dermis terdapat sel dendritik dermal, makrofag, sel mast, sel T dan B, sel plasma, dan sel N.14,15 Masing-masing tipe sel ini terlibat dalam respon kekebalan kutaneus, termasuk pertahanan host terhadap patogen dan berbagai penyakit kulit berbasis imun.
2.2.2 Faktor Host
Permukaan kulit memiliki sifat konstitutif yang mencegah kolonisasi dan infeksi oleh S. aureus (Gambar 2A). Pertama, permukaan kulit memiliki suhu rendah dan pH yang tahan pertumbuhan mikroba.21,22 Dengan relevansi khusus terhadap S. aureus, komponen struktural epidermal berupa filaggrin telah dilaporkan mengalami pemecahan selama diferensiasi epidermal menjadi urocanic acid dan pyrrolidone carboxylic acid.23 Produk pemecahan ini tidak hanya berkontribusi pada pH rendah permukaan kulit tetapi juga telah terbukti dapat mengurangi pertumbuhan S. aureus dan menurunkan ekspresi faktor bakteri yang terlibat dalam kolonisasi, seperti clumping factor B (ClfB) dan fibronectin binding protein A (FnbpA).23,24,25,26
Organisme komensal normal pada permukaan kulit seperti S.
epidermidis, P. acnes, dan Malassezia spp. menempati microbial niches sehingga dapat mencegah kolonisasi dan invasi oleh S. aureus dan patogen lainnya.21,22 Organisme komensal kulit juga telah dilaporkan menghambat secara langsung kolonisasi S. aureus pada kulit dan mukosa hidung. Sebagai contoh, S. epidermidis mengeluarkan protease serin yang disebut Esp, yang menghambat kolonisasi oleh S. aureus dengan cara menghancurkan S. aureus biofilm.24 S. epidermidis juga menghasilkan phenol-soluble modulins (PSMγ dan PSMδ) yang memiliki aktivitas antimikroba langsung terhadap S. aureus.25 Mekanisme selanjutnya, S. epidermidis mengaktifkan TLR2 pada keratinosit
15 sehingga menyebabkan produksi peptida antimikroba seperti hBD2, hBD3 and RNase 7, yang memperkuat respon imun dan memicu degradasi S. aureus.26,27
Peptida antimikroba, disisi lain juga diproduksi oleh keratinosit pada lapisan korneum yang memiliki aktivitas bakteriostatik atau bakterisidal terhadap S. aureus, termasuk hBD2, hBD3, LL-37 cathelicidin dan RNase 7.28,30 Pentingnya peptida antimikroba pada sistem pertahanan host terhadap kolonisasi S. aureus ditunjukkan oleh peningkatan kolonisasi S. aureus pada lesi kulit penyakit dermatitis atopik, dengan kadar β-defensin dan cathelicidin yang rendah.31
2.2.3 Virulensi Bakteri S. aureus
Salah satu mekanisme penting untuk memicu kolonisasi adalah perlekatan S.
aureus terhadap adherence protein pada epitel nasal atau keratinosit epidermis.
Pada mekanisme ini, S. aureus menggunakan microbial surface component recognizing adhesive matrix molecules (MSCRAMMs) untuk mengikat komponen adherence protein, termasuk fibronectin-binding protein A (Fnbp A) and Fnbp B, fibrinogen-binding proteins (ClfA and ClfB), iron regulated surface determinant A (IsdA), dan wall teichoic acid (WTA) (Gambar 2B).6,32,34,35
Dengan relevansi khusus pengikatan S. aureus terhadap kulit manusia, lesi kulit dari pasien dermatitis atopik yang sangat rentan terhadap kolonisasi S.
aureus menunjukkan peningkatan sitokin Th2, seperti IL-4 yang meningkatkan pengikatan fibronektin dan fibrinogen.35,36 Selain itu, S. aureus menghasilkan superantigen seperti staphylococcal enterotoksin A dan B (SEA dan SEB) dan toxic shock syndrome toxin-1 (TSST-1) yang telah terbukti menghambat respon imun kutaneous terhadap profil sitokin Th2, di mana berkontribusi terhadap peningkatan kolonisasi S. aureus pada atopic dermatitis.37 Staphylococcus aureus juga memiliki mekanisme untuk menghindari respon peptida antimikroba host. Sebagai contoh, IsdA meningkatkan hidrofobisitas bakteri, yang membuat S. aureus tahan terhadap sifat bakterisidal asam lemak kulit serta menghambat β-defensin dan cathelicidin.38 Staphylococcus aureus
16 kemudian mengeluarkan protein aureolysin yang merupakan metaloproteinase ekstraselular yang menghambat aktivitas antimikroba cathelicidin.12
Selama infeksi, S. aureus memiliki beberapa mekanisme untuk menghancurkan sel imun host dan menghambat perekrutan neutrofil serta fungsi antimikroba (Gambar 3).6 Staphylococcus menghasilkan toksin pembentuk lubang yang memiliki kemampuan untuk melisiskan sel host, termasuk komponen tunggal α-hemolysin (atau α-toxin) dan biokomponen leukotoxin (γ-hemolysin, Panton-Valentine leukocidin [PVL], leukocidin E/D, and leukocidin M/F-PVlike).6 Staphylococcus berperan dalam induksi lisis sel host, dengan cara menghambat perekrutan neutrofil oleh sekresi chemotaxis inhibitory protein of staphylococci (CHIPS) yang berinteraksi dengan CD5aR dan formyl peptide receptor (FPR), juga extracellular adherence protein (Eap) yang mengurangi ekspresi ICAM-1 endotel. Staphylococcus aureus juga menghasilkan faktor penghambat reactive oxygen species (ROS)-mediated killing oleh neutrofil, seperti pigmen karotenoid keemasan dari S. aureus dan enzim superoksida dismutase.6,39
Staphylococcus aureus mampu memproduksi sejumlah besar eksotoksin yang disebut superantigen (SAg) yang dapat menimbulkan toxic shock syndrome (TSS), staphylococcal scarlet fever, exfoliative dermatitis dan food poisoning. Superantigen adalah suatu mitogen sel limfosit T yang sangat kuat, berikatan dengan MHC II dan menstabilkan ikatan MHC II dengan CD4 T cell receptor β chain sehingga sel Th1 berproliferasi dan mensekresi berbagai interleukin dan sitokin seperti TBF dan IFN γ (Gambar 4).40
Gambar 3. Faktor virulensi S. aureus selama infeksi kulit14
17 Gambar 4. Superantigens (SAg) dan relevansinya pada penyakit imunologi kulit.
AC= accessory cell (Sel Langerhans, sel dendritik, keratinosit dengan HLA-DR);
CLA= cutaneous lymphocyte-associated antigen, faktor skin homing.25
Rangkaian dari peran superantigen tersebut, selanjutnya akan menghasilkan keadaan khas yaitu penyakit sistemik akut yang disebut TSS. Hal ini menghasilkan aktivasi secara simultan dan tidak spesifik dari sebagian besar populasi sel T total, sehingga menyebabkan badai sitokin yang mengancam jiwa. Selain ekspresi berlebih dari berbagai sitokin tersebut, toxic shock syndrome toxin 1 (TSST-1) berikatan dengan makrofag terutama sel Kuffper dihati, melumpuhkannya sehingga tidak mampu menghilangkan substansi asing. 32,33,35
2.2.3 Mekanisme Pertahanan Kutaneus Host Melawan Infeksi
Beberapa respon imun kutaneus yang telah terbukti melindungi infeksi kulit S.
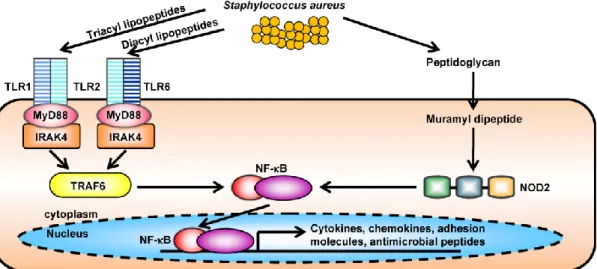
aureus. Keratinosit dan sel residen lain pada kulit mengekspresikan PRRs yang mengenali komponen S. aureus (Gambar 5).6 Secara khusus, keratinosit mengekspresikan TLR2 pada membran sel yang dapat mengalami heterodimerisasi dengan TLR1 atau TLR6 untuk mengenali lipopeptida tri-asil
18 dan di-asil (termasuk lipoteichoic acid S. aureus).41 Keratinosit juga mengekspresikan PRR dan NOD2 sitoplasma terhadap TLRs yang mengenali muramil-dipeptida (produk pemecahan peptidoglikan S. aureus). Hasil dari pemicuan PRRs ini mengaktivasi kaskade pensinyalan yang mengarah pada produksi sitokin pro-inflamasi, kemokin, dan peptida antimikroba.33,35
Gambar 5. Pola pengenalan reseptor pada pertahanan host terhadap infeksi kulit S. aureus14,26 Keratinosit mengekspresikan model reseptor pengenalan seperti Toll-like receptor 2 (TLR2) yang mengenali lipopeptida dan lipoteichoic acid S. aureus, dan nucleotide-binding oligomerization domain containing 2 (NOD2) yang mengenali produk pemecahan peptidoglikan S. aureus berupa muramil peptida. Pensinyalan TLR2 dan NOD2 menyebabkan aktivasi NF-κB dan faktor transkripsi lainnya yang menginduksi transkripsi mediator proinflamasi (sitokin, kemokin, molekul adhesi dan peptida antimikroba) yang terlibat dalam pertahanan inang kulit melawan S. aureus.
Perekrutan neutrofil ke lokasi infeksi S. aureus di kulit merupakan ciri khas infeksi S. aureus yang diperlukan untuk pembersihan bakteri (Gambar 4).
Pada model tikus dengan infeksi kutaneus S. aureus, tikus dengan defisiensi IL-1R telah mengalami gangguan rekrutmen neutrofil menuju tempat infeksi di kulit.44-46 Terdapat aktivasi IL-1R oleh ligand IL-1α dan IL-1β.14,15 Berdasarkan hasil penelitian, ditemukan bahwa IL-1α dan IL-1β berkontribusi terhadap pertahanan host melawan infeksi kulit superfisial S. aureus, sedangkan IL-1β sebagian besar membentuk pertahanan host selama infeksi intradermal S. aureus yang lebih dalam.47 Data tersebut menunjukkan bahwa baik IL-1α dan IL-1β berkontribusi pada pertahanan host melawan infeksi
19 kulit superfisial S. aureus, seperti impetigo atau erosi yang terinfeksi, sedangkan IL-1β berperan sebagai pertahanan host yang dominan terhadap infeksi kulit S. aureus yang lebih dalam seperti selulitis, folikulitis, abses subkutan, dan ulkus atau luka yang terinfeksi. 14
Perbedaan cakupan IL-1α dan IL-1β dalam respon imun kutaneous terhadap S. aureus dapat disebabkan oleh perbedaan ekspresi dari sitokin ini.
Inteleukin-1α dilepaskan dari keratinosit sebagai respon terhadap infeksi dan menginduksi keratinosit untuk menghasilkan kemokin neutrofil, seperti CXCL1, CXCL2 dan IL-8.48 Sebaliknya, IL-1β diinduksi oleh berbagai jenis sel yang berbeda selama infeksi di kulit.14,15
Lebih lanjut, pelepasan IL-1β selama infeksi S. aureus di kulit memerlukan aktivasi inflammasome (kompleks intraselular protein yang memicu pembelahan pro-IL-1β yang dipengaruhi caspase-1 menjadi bentuk aktifnya.49 Pada konteks ini, aktivasi inflammasome telah dilaporkan dimediasi oleh toksin S. aureus seperti hemolysin α, β, dan γ dan digesti lisozim peptidoglikan S. aureus. Telah dilaporkan bahwa pasien dengan defek pada jalur sinyal molekul kelompok IL-1R dan TLR (MyD88 dan IRAK-4) sangat rentan terhadap infeksi kutaneus S. aureus, di mana hal ini menunjukkan peran penting jalur pensinyalan IL-1R dalam pertahanan host melawan infeksi kulit S. aureus pada manusia.21,22
Penelitian terbaru telah menemukan peran penting IL-17 pada perekrutan neutrofil dan pertahanan host melawan infeksi kulit S. aureus, selain IL-1 (Gambar 6). Produksi IL-17 sebagian besar dihasilkan oleh subset sel T (seperti sel Th17, sel NKT dan sel T) dan sel NK, telah diketahui menginduksi perekrutan neutrofil melalui induksi kemokin neutrofil (CXCL1, CXCL2 dan IL-8) dan faktor granulopoesis (G-CSF dan GM-CSF).21,22,25
20 Gambar 6. Respons imun kutaneous yang dimediasi IL-1 IL-17 dalam melawan S. aureus14
Infeksi S. aureus pada kulit menghasilkan produksi IL-1α, IL-1β dan IL- 17. Berbagai sitokin proinflamasi tersebut menginduksi produksi peptida antimikroba yang dihasilkan keratinosit (misalnya β-defensins 2 dan 3, cathelicidin, RNase 7) dan sitokin, kemokin, molekul adhesi, dan faktor granulopoesis sehingga mendorong perekrutan neutrofil. Neutrofil yang direkrut dari sirkulasi membentuk abses yang membantu mengendalikan dan membatasi penyebaran infeksi sehingga sangat dibutuhkan dalam degradasi bakteri patogen.
2.3 Manifestasi Infeksi Kulit Superfisial Akibat S. aureus
Manifestasi infeksi kulit superfisial akibat S. aureus melibatkan keseimbangan antara mekanisme pertahanan kekebalan kulit dan faktor virulensi patogen.6 Perpindahan S. aureus dari lokasi kolonisasi ke area lain hingga menimbulkan infeksi, secara predominan disebabkan oleh terbawanya bakteri melalui garukan tangan ke area kulit lain yang tidak intak. Manifestasi penyakit kulit superfisial akibat S. aureus meliputi infeksi impetigo, ektima, folikulitis, furunkulosis dan karbunkel34,35,36
2.3.1 Impetigo
Impetigo merupakan infeksi bakteri yang paling umum pada anak-anak, memiliki sifat sangat menular. Impetigo dapat mengenai anak-anak serta
21 dewasa. Impetigo timbul sebagai akibat infeksi bakteri pada kulit dengan predisposisi seperti trauma, dermatitis atau penyakit lainnya, yang memungkinkan bakteri S. aureus untuk masuk ke dalam kulit. Impetigo dibagi menjadi impetigo non bulosa dan impetigo bulosa. Impetigo non bulosa dapat timbul setelah adanya paparan S. aureus pada kulit normal, dan diperlukan waktu + 11 hari untuk menimbulkan gejala klinis. Lesi biasanya timbul pada wajah (dekat dengan hidung) serta ekstremitas (setelah trauma).
Lesi yang ditemukan dapat berupa vesikel atau pustule yang dapat pecah dengan cepat membentuk erosi ditutupi krusta kekuningan seperti madu atau honey colored dengan dikelilingi kulit yang eritema. Diameter lesi dapat mencapai + 2 cm. Lesi satelit yang disebabkan oleh self-inoculation sering terjadi (Gambar 6b). Lesi kulit umumnya tanpa disertai rasa sakit namun dapat ditemukan limfadenopati regional.35 Manifestasi gejala sistemik jarang terjadi, meskipun demam dapat terjadi pada kasus yang parah. Impetigo non- bulosa cenderung sembuh tanpa jaringan parut dan apabila tidak diobati dapat sembuh secara spontan dalam 2-3 minggu.34,35
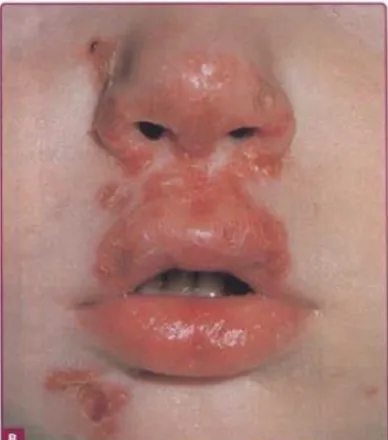
Impetigo bulosa terjadi pana bayi baru lahir ataupun pada anak-anak, ditandai dengan bula kendor (flaccid) yang mudah pecah dan meninggalkan skuama kolaret tipis. Kondisi ini umumnya tidak terkait limfadenopati.
Impetigo bulosa dimediasi oleh toksin eksfoliatif, yang juga menyebabkan staphylococcal scalded-skin syndrome (SSSS).56,57 Impetigo bulosa awalnya muncul sebagai lesi berupa vesikel kecil, kemudian berkembang menjadi bula dinding kendor berdiameter sekitar 2 cm diatas kulit normal, dengan cairan kuning jernih yang kemudian berubah menjadi keruh. Bula tidak mengalami ruptur semudah vesikel pada impetigo non-bulosa dan dapat bertahan dalam beberapa hari. Ketika bula pecah dapat diamati dasar jaringan dengan karakteristik basah dan eritematosa, dapat ditutupi krusta tipis berwarna coklat kekuningan (Gambar 6a). Gejala sistemik jarang terjadi, namun apabila muncul dapat bermanifestasi sebagai demam, diare, dan kelemahan. Infeksi cenderung terjadi pada tubuh (trunk), daerah intertriginosa (diaper area, aksila), dan daerah ekstremitas, meskipun dapat
22 pula terjadi pada daerah kutaneous lain. Seperti bentuk impetigo lainnya, infeksi umumnya sembuh dalam waktu 2-3 minggu tanpa jaringan parut.34,36
Gambar 7. Gambaran klinis impetigo bulosa (a) dan non bulosa (b)
2.3.2 Ektima
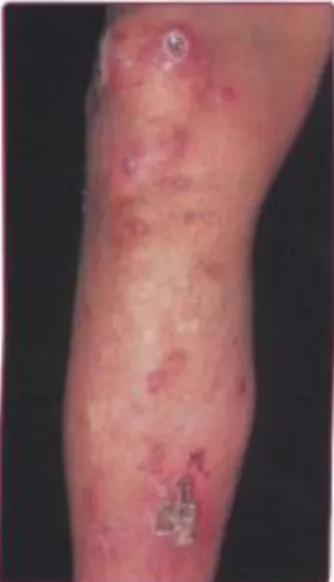
Ektima adalah infeksi S. aureus yang lebih dalam dari impetigo, di mana ulserasi terbentuk di bawah plak berkrusta. Ektima dapat terjadi sebagai komplikasi dari impetigo yang tidak terobati. Ektima ditandai oleh vesikel yang pecah menghasilkan ulkus yang ditutupi dengan krusta cokelat kehitaman. Ketika krusta diangkat, maka akan didapatkan ulkus dengan gambaran punched out, dengan tepi meninggi dan berindurasi, serta warna keunguan. Pada umumnya terdapat edema dan eritematosa disekitar lesi.
Keluhan dapat disertai rasa gatal dan garukan dapat memperluas penularan infeksi. Ektima terutama terjadi pada ekstremitas bawah pada anak-anak, pada lansia yang tidak terawat serta atau pada diabetes melitus, terutama setelah trauma atau saat gigitan serangga. Lesi ektima menyembuh perlahan dengan terapi antibiotik. Tidak seperti impetigo, ektima meninggalkan bekas jaringan parut pada proses akhir penyembuhannya.34,35
23 Gambar 8. Gambaran klinis ektima
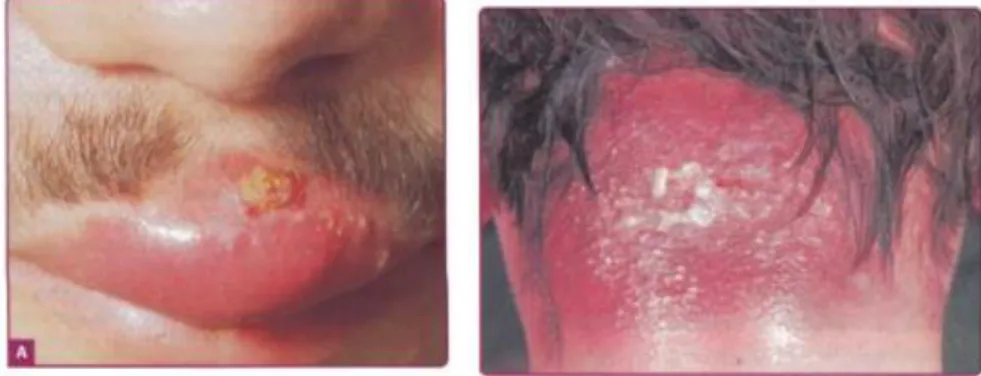
2.3.3 Folikulitis
Folikulitis disebabkan oleh S. aureus, ditandai dengan pustul diskret dengan folikel rambut pada pusatnya. 57 Lokalisasi tersering timbulnya folikulitis adalah pada daerah kulit berambut, paling sering pada kulit kepala dan ekstremitas. Gambaran efloresensi lesi berupa makula eritematosa, papula, pustula, dan miliar sampai lentikular, regional sesuai dengan pertumbuhan rambut. Terlihat pustula folikuker kecil dan berbentuk kubah, sering ditembus oleh rambut halus. Krusta tipis dapat menutupi muara folikel yang menyembul. Gambaran jumlah lesi umumnya lesi banyak, meskipun lesi tunggal dapat terjadi. Masing-masing lesi saling terpisah dengan diselingi kulit normal, tanpa ada kecenderungan untuk berkonfluensi. 34
Gambar 9. Gambaran klinis folikulitis
24 2.3.4 Furunkel dan Karbunkel
Furunkel merupakan inflamasi nodul pada area berambut, terutama yang sering mengalami friksi, oklusi daan perspirasi seperti leher, wajah, aksila dan gluteal. Nodul tersebut disertai nyeri dan berfluktuasi setelah beberapa hari, serta dapat menjadi abses. Apabila ruptur maka akan mengeluarkan cairan pus dan debris nekrotik Karbunkel merupakan beberapa furunkel yang berkonfluensi membentuk abses besar, dalam, dan saling terhubung.56,57 Lokalisasi predominan timbulnya karbunkel adalah pada tengkuk, punggung dan paha. Gambaran efloresensi lesi pada awalnya berupa makula eritematosa lentikular-numular terlokalisasi (setempat), kemudian menjadi nodul lentikular-numular berbentuk kerucut. Dalam satu minggu terjadi supurasi dan pus keluar melalui beberapa muara folikel. Proses selanjutnya muara-muara ini bersatu dan terbentuklah nekrosis sebagai jaringan mati berwarna kuning, yang jika dibuang akan terbentuk cekungan seperti kawah. Lesi yang sembuh akan membentuk parut.35,36
Gambar 10. Gambaran klinis furunkel (a) dan karbunkel (b)
2.4 Penatalaksanaan Infeksi Kulit Superfisial pada Anak Akibat S. aureus Terdapat berbagai modalitas atau pilihan pengobatan yang dapat digunakan sebagai terapi infeksi kulit superfisial akibat S. aureus. Hal ini bergantung pada derajat keparahan kondisinya, dimana terapi yang dapat diberikan berupa antibiotik topikal maupun oral. Pemilihan antibiotik untuk infeksi kulit dan jaringan lunak berbeda di tiap kalangan klinisi maupun institusi, di mana mencerminkan bahwa hal ini tergantung populasi pasien, lokasi
25 anatomis, pola resistensi, risiko timbulnya MRSA, dan kebijakan lokal.
Impetigo tanpa ringan cenderung mengalami resolusi secara self-limiting dan akan sembuh dalam beberapa minggu tanpa bekas jaringan parut. Meskipun demikian, karena karakteristik impetigo yang sangat menular, cara terbaik adalah mengobati dengan medikasi berupa antibiotik topikal. Menurut Infectious Diseases Society of America (IDSA) untuk antibiotik yang diberikan, disesuaikan dengan prosedur pemberian (oral atau topikal) dan sensitivitas terhadap strain S. aureus (Tabel 3).3,10,35
Untuk perawatan luka, dianjurkan agar lesi terjadi dibersihkan dengan lembut, krusta diangkat dengan melakukan kompres atau penggunaan wet dressing.35
Dalam beberapa panduan pengobatan, mupirosin topikal memiliki menunjukkan efektivitas yang lebih baik dibandingkan eritromisin oral dan telah terbukti menjadi pilihan tepat bagi pasien dengan strain S. aureus yang resisten terhadap eritromisin. Selain itu, efektivitas antara agen topikal dan oral tidak menunjukkan perbedaan yang signifikan. Menurut panduan Infectious Diseases Society of America, baik impetigo bulosa dan non-bulosa dapat diobati dengan antibiotik oral atau topikal selama lima sampai tujuh hari (Tabel 2), namun terapi oral dianjurkan pada pasien dengan banyak lesi atau pada kondisi outbreaks yang menyerang beberapa orang orang dengan tujuan untuk membantu mengurangi transmisi infeksi.14,26,27
2.4.1 Antibiotik Topikal
Antibiotik topikal adalah pilihan utama untuk impetigo derajat ringan hingga sedang. Antibiotik topikal cenderung tidak meningkatkan resistensi bakteri dan efek samping minimal. Untuk bayi, anak - anak, dan remaja, mupirosin dan retapamulin adalah dua agen topikal yang paling umum digunakan.
Mupirosin menghambat sintesis protein bakteri secara reversibel dan berikatan spesifik pada transfer-RNA synthetase. Mupirosin memiliki efek samping yang dapat ditoleransi seperti reaksi lokal, pruritus dan perih.
Retapamulin bekerja dengan menghambat sintesis protein bakteri pada unit
26 ribosom 50S [14]. Karena kecenderungan risiko epistaksis, retapamulin tidak boleh digunakan pada mukosa hidung. Asam fusidat juga merupakan agen topikal yang umum digunakan namun tidak disetujui Food and Drug Administration (FDA).2,10
2.4.2 Antibiotik Oral
Pada lesi yang luas, dianjurkan penggunaan antibiotik oral. Agen pilihan untuk populasi pediatri mencakup berbagai jenis penisilin dan sefalosporin (Tabel 3). Kedua kelas antibiotik ini bekerja dengan menghambat sintesis dinding sel bakteri. Dicloxacillin dan cephalexin umumnya digunakan pada bayi (kecuali neonatus), anak-anak, dan remaja. Apabila dicurigai MRSA atau dikonfirmasi melalui uji kultur dan sensitivitas, antibiotik yang direkomendasikan adalah klindamisin, doksisiklin, atau trimethoprim- sulfametoksazol. Pasien neonatal dengan impetigo bulosa dapat diobati dengan nafcillin, oxacillin, atau klindamisin. Eritromisin merupakan golongan macrolide sebagai modalitas obat pilihan untuk neonatus dengan impetigo non-bullosa. Pada kasus MRSA direkomendasikan penggunaan vankomisin secara intravena. Obat antibiotik sistemik ditunjukkan pada kondisi apabila terdapat keterlibatan struktur jaringan yang lebih dalam, demam, limfadenopati, faringitis, infeksi di dekat rongga mulut, dan infeksi pada kulit kepala dan/atau timbulnya banyak lesi.2,10,34,35
Tabel 2. Terapi antibiotik skin and soft tissue infections S. aureus Kategori Antibiotik Dosis Anak
Impetigo Cephalexin 25–50 mg/kg/hari dibagi 3–4 dosis po
Erythromycin 40 mg/kg/hari mg/kg/hari dibagi 3–4 dosis po
Clindamycin 20 mg/kg/hari dibagi 3–4 dosis
27 po
Amoxicillin-clavulanate 25 mg/kg/hari dari komponen amoxicillin dibagi 2 dosis po Salep Retapamulin Aplikasikan pada lesi 2 kali
sehari
Salep Mupirosin Aplikasikan pada lesi 2 kali sehari
MSSA SSTI Nafcillin atau oxacillin 100–150 mg/kg/hari dibagi 4 dosis po
Cefazolin 50 mg/kg/hari dibagi 3 dosis po Clindamycin 25–40 mg/kg/hari dibagi 3 dosis
IV atau
25–30 mg/kg/hari dibagi 3 dosis po
Dicloxacillin 25–50 mg/kg/hari dibagi 4 dosis po
Cephalexin 25–50 mg/kg/hari dibagi 4 dosis po
Trimethoprim- sulfamethoxazole
8–12 mg/kg (berdasarkan kandungan trimethoprim) dibagi 4 dosis IV atau dibagi 2 dosis po
* IV (intravena); MSSA (methicillin-susceptible Staphylococcus aureus); po (per- oral); SSTI (skin and soft tissue infection).
28 BAB III
RINGKASAN
Staphylococcus aureus merupakan bakteri gram positif yang berbentuk kokus.
Bakteri S. aureus bertanggung jawab atas sebagian besar infeksi kulit yang diakibatkan oleh bakteri pada tubuh manusia, khususnya anak-anak. Susunan dan fungsi barier kulit pada anak berbeda dengan orang dewasa dalam struktur, fungsi, dan komposisinya sehingga lebih rentan terhadap infeksi S. aureus.
Kecenderungan S. aureus untuk menginfeksi kulit melibatkan keseimbangan antara mekanisme pertahanan kekebalan kulit dan faktor virulensi patogen. Manifestasi klinis yang terjadi dapat berupa impetigo, ektima, folikulitis, furunkulosis, karbunkel. Selain itu, S. aureus juga memiliki toksin berupa superantigen (Sag) yang memiliki kemampuan menghindari sistem pengenalan antigen secara konvensional sehingga aktivasi secara simultan dan tidak spesifik dari sebagian besar populasi sel T total menyebabkan badai sitokin yang mengancam jiwa.
Penatalaksanaan infeksi kulit superfisial akibat S. aureus berbasis pada aplikasi antibiotik selain manajemen supportif sesuai kebutuhan tatalaksana.
Antibiotik dalam pemilihannya untuk infeksi kulit dan jaringan lunak (skin and soft tissue infections [SSTI]) berbeda di kalangan klinisi maupun institusi, di mana untuk infeksi local derajat ringan hingga sedang, terapi antibiotik topikal menjadi pilihan utama, sedangkan untuk lesi yang luas disertai gejala sistemik dapat diterapi dengan antibiotik oral.
29 DAFTAR PUSTAKA
1. Stamatas GN, et al. Infant skin physiology and development during the first years of life: a review of recent findings based on in vivo studies. Int J Cosmet Sci. 2011;33(1):17-24.
2. Telofski LS, et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? Dermatol Res Pract. 2012:1987-89.
3. World Health Organization. World Health Organization Report on Infectious Diseases: Removing Obstacles To Healthy Development. 2007.
URL: http://www.who.int/infectious-disease-report/pages/textonly.html [diakses tanggal 12 September 2017].
4. Stamatas GN, et al. Infant skin microstructure assessed in vivo differs from adult skin in organization and at the cellular level. Pediatr Dermatol.
2010;27(2):125-31.
5. King A, et al. Biology and function of fetal and pediatric skin. Facial Plast Surg Clin North Am. 2013;21(1):1-6.
6. Grice EA, Kong HH, Conlan S, Deming CB, Davis J, Young AC, Bouffard GG, Blakesley RW, Murray PR, Green ED, Turner ML, Segre JA. Topographical and temporal diversity of the human skin microbiome.
Science. 2009; 324:1190–1192.
7. Stamatas GN, et al. Infant skin microstructure assessed in vivo differs from adult skin in organization and at the cellular level. Pediatr Dermatol.
2010;27(2):125-31.
8. King A, et al. Biology and function of fetal and pediatric skin. Facial Plast Surg Clin North Am. 2013;21(1):1-6.
9. Grice EA, Kong HH, Conlan S, Deming CB, Davis J, Young AC, Bouffard GG, Blakesley RW, Murray PR, Green ED, Turner ML, Segre JA. Topographical and temporal diversity of the human skin microbiome.
Science. 2009; 324:1190–1192.
30 10. World Health Organization. Health topics: Infectious diseases. 2013.
URL: http:// www. who.int/topics/infectious_diseases/en/ [diakses tanggal 23 Juli 2013]
11. Dzen SM, Roektiningsih, Santoso S, Winarsih S. Bakteriologi Medik.
Malang : Bayumedia; 2003.
12. Talan DA, Krishnadasan A, Gorwitz RJ, Fosheim GE, Limbago B, Albrecht V, Moran GJ; EMERGEncy ID Net Study Group. Comparison of Staphylococcus aureus from skin and soft-tissue infections in US emergency department patients, 2004 and 2008. Clin Infect Dis.
2011;53(2):144-9. doi: 10.1093/cid/cir308.
13. Krishna S and Miller LS. Host–pathogen interactions between the skin and Staphylococcus aureus. Current opinion in microbiology. 2012;15(1): 28- 35.
14. Foster TJ, Geoghegan, Ganesh VK, and Höök M. Adhesion, Invasion and evasion: the many functions of the surface proteins of Staphylococcus aureus. Nat Rev Microbiol. 2014; 12(1): 49-62.
15. Tong SY, Davis JS, Eichenberger E, Holland TL, and Fowler VG.
Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clinical microbiology reviews.
2015;28(3):603-661.
16. Seaton RA. Skin and soft tissue infection diagnosis and management.
Clinical Pharmacist. 2009;1:13-22.
17. Kupper TS, Fuhlbrigge RC. Immune surveillance in the skin: mechanisms and clinical consequences. Nat.Rev.Immunol. 2004; 4:211–222.
18. Nestle FO, Di MP, Qin JZ, Nickoloff BJ. Skin immune sentinels in health and disease. Nat.Rev.Immunol. 2009; 9:679–691.
19. Cork MJ, et al. Epidermal barrier dysfunction in atopic dermatitis. J Invest Dermatol. 2009;129(8): 1892-908.
20. Grice EA, Segre JA. The skin microbiome. Nat.Rev.Microbiol. 2011;
9:244–253.
31 21. Miajlovic H, Fallon PG, Irvine AD, Foster TJ. Effect of filaggrin breakdown products on growth of and protein expression by Staphylococcus aureus. J.Allergy Clin.Immunol. 2010; 126:1184–1190.
22. Iwase T, Uehara Y, Shinji H, Tajima A, Seo H, Takada K, Agata T, Mizunoe Y. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization. Nature. 2010; 465:346–
349.
23. Cogen AL, Yamasaki K, Sanchez KM, Dorschner RA, Lai Y, Macleod DT, Torpey JW, Otto M, Nizet V, Kim JE, Gallo RL. Selective antimicrobial action is provided by phenol-soluble modulins derived from Staphylococcus epidermidis, a normal resident of the skin. J.Invest Dermatol. 2010; 130:192–200.
24. Lai Y, Cogen AL, Radek KA, Park HJ, Macleod DT, Leichtle A, Ryan AF, Di NA, Gallo RL. Activation of TLR2 by a small molecule produced by Staphylococcus epidermidis increases antimicrobial defense against bacterial skin infections. J.Invest Dermatol. 2010; 130:2211–2221.
25. Wanke I, Steffen H, Christ C, Krismer B, Gotz F, Peschel A, Schaller M, Schittek B. Skin commensals amplify the innate immune response to pathogens by activation of distinct signaling pathways. J.Invest Dermatol.
2011; 131:382–390.
26. Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell.
2010; 140:805–820.
27. Kim MH, Granick JL, Kwok C, Walker NJ, Borjesson DL, Curry FR, Miller LS, Simon SI. Neutrophil survival and c-kit+-progenitor proliferation in Staphylococcus aureus-infected skin wounds promote resolution. Blood. 2011; 117:3343–3352.
28. Molne L, Verdrengh M, Tarkowski A. Role of neutrophil leukocytes in cutaneous infection caused by Staphylococcus aureus. Infect.Immun.
2000; 68:6162–6167.
29. Cho JS, Zussman J, Donegan NP, Ramos RI, Garcia NC, Uslan DZ, Iwakura Y, Simon SI, Cheung AL, Modlin RL, Kim J, Miller LS.
32 Noninvasive In Vivo Imaging to Evaluate Immune Responses and Antimicrobial Therapy against Staphylococcus aureus and USA300 MRSA Skin Infections. J.Invest Dermatol. 2011; 131:907–915.
30. Olaru F, Jensen LE. Staphylococcus aureus stimulates neutrophil targeting chemokine expression in keratinocytes through an autocrine IL-1α signaling loop. J.Invest Dermatol. 2010; 130:1866–1876.
31. Munoz-Planillo R, Franchi L, Miller LS, Nunez G. A critical role for hemolysins and bacterial lipoproteins in Staphylococcus aureus-induced activation of the Nlrp3 inflammasome. J.Immunol. 2009; 183:3942–3948.
32. Shimada T, Park BG, Wolf AJ, Brikos C, Goodridge HS, Becker CA, Reyes CN, Miao EA, Aderem A, Gotz F, Liu GY, Underhill DM.
Staphylococcus aureus evades lysozyme-based peptidoglycan digestion that links phagocytosis, inflammasome activation, and IL-1beta secretion.
Cell Host.Microbe. 2010; 7:38–49.
33. Cua DJ, Tato CM. Innate IL-17-producing cells: the sentinels of the immune system. Nat.Rev.Immunol. 2010; 10:479–489.
34. Craft N, Lee PK, Zipoli MT, Weinberg AN, Swartz, and Johnson RA.
Superficial Cutaneus Infections and Pyodermas. In: Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K, editors. Fitzpatrick’s Dermatology in General Medicine. 8th ed. New York: McGraw Hill; 2012.
p. 3025-41.
35. Ghazvini P, Treadwell P, Woodberry K, Nerette E Jr, Powery H II.
Impetigo in the Pediatric Population. J Dermatolog Clin Res. 2017; 5(1):
1092.
36. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJ, Gorbach SL, and Wade JC. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clinical infectious diseases. 2014;
59(2): e10-e52.