LARUTAN
Pendahulun
• Larutan adalah campuran zat zat yang homogen, memiliki komposisi merata atau serba sama diseluruh bagian
volumenya.
Sifat Dasar Larutan
Zat yang jumlahnya lebih sedikit disebut zat terlarut
Zat yang jumlahnya lebih banyak disebut zat pelarut.
Sifat Dasar Larutan
Pada proses terbentuknya larutan selalu terjadi dua hal secara
bersamaan:
• Molekul solut terpisah (terjadi
penguraian) → prosesnya membutuhkan energi (endotermik)
• Molekul solut bergabung dengan
molekul pelarut dengan melepaskan energi (eksotermik)
Sifat Dasar Larutan
• Untuk melarutkan suatu kristal zat berion membutuhkan energi kisi
• Energi kisi: energi yang dibutuhkan untuk memutuskan ikatan antara ion positif dan negatif
• Penguraian kristal
→
proses endoterm• Proses hidrasi atau solvasi
→
eksoterm• Suatu zat akan larut dengan baik jika energi yang terjadi pada proses hidrasi lebih besar daripada energi kisi
Sifat Dasar Larutan
• Zat-zat dengan struktur kimia yang mirip umumnya dapat saling bercampur dengan baik, sedangkan zat-zat yang struktur
kimianya berbeda umumnya kurang dapat saling bercampur (like dissolves like).
• Senyawa non polar cenderung larut dalam pelarut yang bersifat non polar, dan
senyawa polar dengan pelarut polar
• Contohnya alkohol dan air bercampur
sempurna (completely miscible), air dan eter bercampur sebagian (partially miscible),
sedangkan minyak dan air tidak bercampur (completely immiscible)
Sifat Dasar Larutan
• Zat dikatakan tidak terlarut (insoluble) = Jika zat tersebut larut sangat sedikit (<
0,1 g dalam 1000 g pelarut)
• Dua zat dengan gaya-gaya antarmolekul yang sama akan cenderung saling melarutkan.
• Molekul non-polar dapat larut dalam pelarut non-polar : CCl4 dalam C6H6
• Molekul polar dapat larut dalam pelarut polar : C2H5OH dalam H2O
• Senyawa ionik lebih dapat larut dalam pelarut polar : NaCl dalam H2O atau NH3 (l)
Larutan jenuh
• Larutan yang telah mengandung zat terlarut dalam jumlah maksimal
• Terjadi keseimbangan antara solut yang larut dan solut yang tidak larut
• Kecepatan pelarutan sama dengan kecepatan pengendapan
• Istilah jenuh dan tidak jenuh tidak berhubungan secara langsung dengan larutan pekat dan encer
Larutan tak jenuh (Unsaturated)
• Larutan yang mengandung jumlah solut lebih sedikit (encer) dibandingkan larutan jenuhnya
Larutan lewat jenuh (Supersaturated)
• Larutan yang mengandung jumlah solut lebih banyak (pekat) dibandingkan larutan jenuhnya pada suhu yang sama
Sifat Koligatif Larutan adalah sifat zat yang hanya bergantung pada jumlah partikel dalam laturan
Faktor-faktor yang mempengaruhi kelarutan
1. Pengaruh Jenis Zat pada Kelarutan
• Zat-zat dengan struktur kimia yang mirip umumnya dapat saling bercampur dengan baik, sedangkan zat-zat yang struktur kimianya berbeda umumnya kurang dapat saling bercampur (like dissolves like).
Senyawa yang bersifat polar akan mudah larut dalam pelarut polar, sedangkan senyawa nonpolar akan mudah larut dalam pelarut nonpolar.
Faktor-faktor yang mempengaruhi kelarutan
2. Pengaruh Temperatur pada Kelarutan
• Kelarutan gas umumnya berkurang pada temperatur yang lebih tinggi. Misalnya jika air dipanaskan, maka timbul gelembung- gelembung gas yang keluar dari dalam air, sehingga gas yang terlarut dalam air
tersebut menjadi berkurang.
• Kebanyakan zat padat kelarutannya lebih besar pada temperatur yang lebih tinggi.
• Ada beberapa zat padat yang kelarutannya berkurang pada temperatur yang lebih
tinggi, misalnya natrium sulfat dan serium sulfat.
Faktor-faktor yang mempengaruhi kelarutan
3. Pengaruh tekanan pada kelarutan
• Perubahan tekanan pengaruhnya kecil terhadap kelarutan zat cair atau
padat. Perubahan tekanan sebesar 500 atm hanya merubah kelarutan NaCl sekitar 2,3 % dan NH4Cl sekitar 5,1 %.
• Kelarutan gas sebanding dengan tekanan partial gas itu.
• Menurut hokum Henry (William Henry: 1774-1836) massa gas yang melarut dalam sejumlah tertentu cairan (pelarutnya) berbanding lurus
dengan tekanan yang dilakukan oleh gas itu (tekanan partial), yang berada dalam kesetimbangan dengan larutan itu. Contohnya kelarutan oksigen dalam air bertambah menjadi 5 kali jika tekanan partial-nya dinaikkan 5 kali. Hukum ini tidak berlaku untuk gas yang bereaksi dengan pelarut, misalnya HCl atau NH3 dalam air.
Konsentrasi Larutan
• Konsentrasi larutan adalah jumlah zat terlarut dalam
setiap satuan
larutan atau pelarut.
Lambang Konsentras Larutan
Lambang Konsentrasi Larutan
Satuan-satuan Konsentrasi
Persen berdasar Massa
% massa = massa zat terlarut x 100%
massa zat terlarut + massa pelarut
= massa zat terlarut x
100% massa larutan
Fraksi Mol (X)
X =A mol zat A
jumlah mol seluruh komponen
M = mol zat terlarut liter larutan
Molalitas (m) Molaritas (M)
m = mol zat terlarut massa pelarut (kg)
Satuan-satuan Konsentrasi
Persen konsentrasi
Parts per million / bagian per juta
Molaritas (M)
Molalitas (m)
Normalitas
• Normalitas menyatakan jumlah ekuivalen zat terlarut dalam setiap liter larutan
• Massa ekuivalen adalah massa zat yang diperlukan untuk menangkap atau melepaskan 1 mol elektron dalam reaksi (reaksi redoks)
N = Normalitas larutan
ek = ekuivalen zat terlarut V = volume larutan
M = molaritas
a = valensi (banyaknya ion) m = massa zat terlarut
Contoh:
• Jika 0,5 liter larutan NaOH dibuat dengan melarutkan 5 gram NaOH (Mr = 40) dalam air.Hitunglah Normalitas larutan tersebut ?
Jawab :
• NaOH → Na + OH-
• n = 5 gram/40 = 0,125 mol
• Ek = n x a
Ek = 0,125 x 1 = 0,125
• N = Ek/V
• N = 0,125/0,5 = 0,25 N
Contoh:
• Berapa gr larutan 0,25 N asam sulfat (Mr = 98) dalam 500 liter larutan ?
Fraksi mol (X)
Soal:
• Hitung berapa % berat larutan infus yang dibuat dengan melarutkan 25 gram NaCl dalam 75 g air.
• 117 g NaCl dilarutkan dalam 3 kg H2O Hitung fraksi mol NaCl dan H2O dalam larutan tersebut. (Mr NaCl = 58,5, Mr H2O = 18)
• 80 g NaOH dilarutkan dalam air kemudian diencerkan menjadi 1 L larutan. Hitung kemolaran (Molaritas). Mr NaOH = 40
• 147,0 g asam sulfat (Mr = 98) dilarutkan dengan air hingga volume larutan menjadi 2 liter. Tentukan normalitas larutan
LARUTAN ELEKTROLIT DANNON-ELEKTROLIT
LARUTAN ELEKTROLIT DANNON-ELEKTROLIT
• Larutan Elektrolit : larutan yang dapat menghantarkan arus listrik
• Larutan non elektrolit: larutan yang tidak dapat menghantarkan arus listrik
• Menurut Arrhenius, larutan
elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang dapat bergerak
bebas
Elektrolit Kuat dan Lemah
• Senyawa elektrolit adalah senyawa yang jika dilarutkan ke dalam air akan terion (atau terionisasi).
• Senyawa elektrolit dapat
dibedakan menjadi senyawa elektrolit kuat dan senyawa elektrolit lemah.
- + + - +- + -
+ -+ - + +
- - Aki
)
( ( +
- )
_
ELEKTROLITKUAT
• Senyawa elektrolit kuat adalah senyawa yang di dalam air terion sempurna atau mendekati sempurna, sehingga senyawa tersebut
semuanya atau hampir semua berubah menjadi ion
• Senyawa yang termasuk senyawa elektrolit kuat adalah:
a. Asam kuat, contohnya: HCl, HBr, HI, H2SO4, HNO3, HCLO4
b. Basa kuat, contohnya: NaOH, KOH, Ba(OH)2, Sr(OH)2 c. Garam, contohnya: NaCl, KCl, MgCl2, KNO3, MgSO4
- + + - +- + -
+ -+ - + +
- - Aki
( + - )
) ( _
ELEKTROLITLEMAH
• Senyawa elektrolit lemah adalah senyawa yang di dalam air ter-ion sebagian atau senyawa tersebut hanya sebagian saja yang berubah menjadi ion dan sebagian yang lainnya masih sebagai molekul senyawa yang terlarut.
• Senyawa yang termasuk senyawa elektrolit lemah adalah:
a. Asam lemah, contohnya: HF, H2S, HCN, H2CO3, HCOOH, CH3COOH
b. Basa lemah, contohnya: Fe(OH)3 , Cu(OH)2 , NH3, N2H4, CH3NH2, (CH3)2NH
Aki
)
( ( +
- )
DERAJATIONISASI
• Perbandingan antara zat yang terionisasi dengan zat mula-mula disebut sebagai derajat ionisasi yang diberi lambang a
a = banyaknya zat yang terurai ´100%
banyaknya zat mula - mula
• Elektrolit kuat mempunyai harga a = 1. Contohnya larutan NaCl dan larutan HCl.
• Nonelektrolit a = 0, contohnya larutan glukosa dan larutan urea.
• Harga a elektrolit lemah mendekati 0, misalnya asam asetat (CH3COOH) dan amonium hidroksida (NH4OH).
LARUTANNON-ELEKTROLIT
• Senyawa nonelektrolit adalah senyawa yang di dalam air tidak terion, sehingga partikel-partikel yang ada di dalam larutan adalah molekul- molekul senyawa yang terlarut.
• Dalam larutan tidak terdapat ion, sehingga larutan tersebut tidak dapat menghantarkan arus listrik. Kecuali asam atau basa, senyawa kovalen adalah senyawa nonelektrolit, contohnya: C6H12O6, CO(NH2)2, CH4, C3H8, C13H10O
• Pada larutan non elektrolit gelembung gas tidak muncul dan lampu tidak menyala pada larutan uji.
SISTEM
KOLOID
Konsep Materi
¨ Koloid merupakan campuran fase peralihan homogen menjadi heterogen.
¨ Sistem koloid terdiri dari dua fase, yaitu fase pendispersi (pelarut) dan fase terdispersi (terlarut).
Perbedaan Larutan, Koloid, dan Suspensi
No Larutan Koloid Suspensi
1 1 fase 2 fase 2 fase
2 Jernih Keruh Keruh
3 Homogen Antara homogen dan
heterogen
Heterogen 4 Diameter partikel < 1 nm 1 nm < d < 100nm d > 100 nm 5 Tidak dapat disaring Tidak dapat disaring
dengan penyaring biasa
Dapat disaring 6 Tidak memisah jika
didiamkan
Tidak memisah jika didiamkan
Memisah jika didiamkan
Jenis-Jenis Koloid
Padat Cair Gas
Padat Sol padat
(logam paduan, kaca berwarna, baja)
Sol cair
(cat, tinta, kanji)
Sol gas
(asap dan debu)
Cair Emulsi padat
(mentega, keju, jelly, dan
mutiara)
Emulsi Cair
(susu, minyak ikan, santan kelapa)
Emulsi gas
(obat insektisida semprot), kabut, hair spray
Gas Buih padat
(busa jok, batu apung)
Buih Cair
(buih sabun, buih soda, dan krim kocok)
-
¨ Berdasarkan fase zat terdispersi, maka sistem
koloid terbagi 3, yaitu koloid sol, emulsi, dan buih.
Sifat-Sifat Koloid
1. Sifat optik/dapat menghamburkan cahaya
Peristiwa penghamburan cahaya oleh partikel-partikel koloid disebut efek Tyndall
Larutan > meneruskan cahaya Koloid > menghamburkan cahaya
Dalam kehidupan sehari-hari, efek Tyndalldapat pula kita amati, seperti:
-Di bioskop, jika ada asap mengepul, maka dari cahaya proyektor akan terlihat lebih terang.
- Didaerah berkabut, sorot lampu mobil terlihat lebih jelas.
- Sinar matahari yang masuk melewati celah, kedalam ruangan yang berdebu, maka partikel debu akan
kelihatan dengan jelas.
Sifat kinetik koloid ada dua, yaitu gerakan termal dan gerakan akibat gaya grafitasi.
Partikel koloid senantiasa bergerak terus menerus dengan
gerakan patah-patah (zig-zag) yang kemudian dikenal dengan Gerak Brown
Gerak Brown ini pertama kali dikemukakan oleh Robert Brown, pada waktu mempelajari gerak serbuk tepung sari di atas air.
Gerak Brown terjadi sebagai akibat tumbukan yang tidak seimbang dari molekul-molekul medium terhadap pertikel koloid.
PENYEBAB GERAKBROWN
Mengapa Gerak Brown dinyatakan dapat menstabilkan koloid?
Gerak brown dapat
menstabilkan koloid karena partikel-partikel koloid
bergerak terus menerus
menghasilkan gerakan yang dapat mengimbangi
gravitasi, sehingga koloid itu tidak akan mengendap.
Partikel koloid dapat bergerak dalam medan listrik, pergerakan ini lah yang disebut elektroforesis.
Partikel koloid mempunyai muatan di permukaannya disebabkan oleh pengionan atau penyerapan muatan.
Sol hidrofilik seperti larutan protein, muatan diperoleh terutama karena ionisasi gugus karboksil –COOH dan gugus amino NH3+. Pada pH tinggi protein bermuatan negatif dan pada pH rendah protein bermuatan positif.
Beberapa sifat listrik dari koloid
¨ Elektroforesis: gerak partikel koloid bermuatan oleh pengaruh medan listrik
¨ Elektroosmosis: gerak partikel koloid bermuatan melalui membran semipermeabel oleh pengaruh medan listrik.
¨ Potensial aliran: partikel koloid dipaksa bergerak
melalui pori membran (kebalikan dari elektroosmosis)
¨ Potensial sedimentasi: partikel koloid bermuatan mengendap karena pengaruh perbedaan potensial.
Ukuran partikel koloid kecil sehingga permukaannya luas dan menyebabkan kemampuan adsorpsinyabesar.
Partikel koloid akan bermuatan listrik, apabila partikel koloid menyerap ion yang bermuatan, dan ion tersebut menempel pada permukaan koloid,
sehingga partikel koloid itu akan bermuatan.
Sol Fe(OH)3 mampu mengadsorpsi ion-ion H+, sehingga Sol Fe (OH)3 bermuatan positif.
Adsorpsi adalah proses melekatnya suatu zat pada permukaan padatan
atau cairan. Partikel koloid mudah
mengadsorpsi warna.
Sol As2S3 mempu mengabsorbsi ion-ion S2-,
sehingga sol As2S3 menjadi bermuatannegative.
Koagulasi adalah penggumpalan partikel koloid, sehingga kestabilan system koloid menjadi hilang.
Penyebab koagulasi pada sistem koloid, antara lain karena pengaruh :
• pemanasan,
• pendinginan,
• pencampuran elektrolit
• elektroforesis yang berlangsung lama.
Koagulasi koloid karena penambahan elektrolit terjadi sebagai berikut:
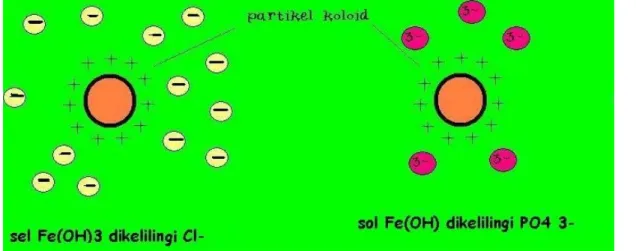
Koloid yang bermuatan negatif akan menarik ion positif (kation), sedangkan koloid yang bermuatan positif akan menarik ion negatif (anion). Ion-ion
tersebut akan membentuk selubung lapisan kedua. Apabila selubung lapisan kedua itu terlalu dekat maka selubungitu akan menetralkan muatan koloid sehingga terjadi koagulasi. Makin besar muatan ion makin kuat daya tariknya dengan partikel koloid, sehingga makin cepat terjadi koagulasi.
Gambar di atas memperlihatkan bahwa ion fosfat yang bermuatan 3- tertarik lebih dekat daripada ion klorida yang bermuatan 1-,
walaupun konsentrasi ion fosfat itu lebihkecil.
- -
- - -
- + - +
+ - + Na+ 2.Ion-ion Na+ ditambahkan ke sistem koloid dengan
partikel-pertikel sol yang
bermuatan negatif
1.Sistem koloid dengan
partikel-pertikel sol yang
bermuatan negatif
3.Partikel- pertikel sol sistem koloid menjadi netral
4.Partikel- pertikel sol sistem koloid akan
menggumpal dan selanjutnya mengendap (terkoagulasi)
CONTOHKOAGULASI
Coba Anda amati, proses koagulasi yang sering terjadi sehari-hari :
- Merebus telur mentah di dalam air - Mendinginkan agar-agar
panas
- Pembentukan delta dimuara sungai
- Penjernihan air sungai.
- Penggumpalan karet dalam lateks
- Penggumpalan asap debu pabrik dengan pengendap cottrel
Adalah suatu sistem koloid yang ditambahkan pada koloid lain, sehingga dihasilkan koloid yang stabil.
Misalnya : pada pembuatan es krim, agar dihasilkan es krim yang lembut, perlu ditambahkan gelatin sebagai koloid pelindung.
Koloid yang medium pendispersinya cair dibedakan atas 2 jenis yaitu.
¨ Adalah koloid yang mempunyai gaya tarik menarik yang cukup besar antara zat
terdispersi dengan mediumnya.
Umumnya koloid liofil lebih kental dan lebih stabil dari koloid liofob, karena fase terdispersi dibungkus oleh mediumnya, sehingga terhindar dari pengelompokkan (koagulasi), hal ini disebut Solvatasi/hidratasi.
Koloid liofil bersifat reversible, karena apabila terjadi
penggumpalan/pengendapan, dan endapan itu ditambah kembali koloid liofil.
¨ Adalah koloid yang gaya tarik menarik antara zat terdispersi dengan mediumnya tidak ada atau sangat lemah.
¨ Koloid liofob akan stabil, apabila mengadsorbsi suatu ion.
¢ Perbedaan antara koloid liofil dengan koloid liofob.
¨ Jika medium pendispersi yang dipakai adalah air, maka kedua jenis koloid di atas masing-
masing disebut :
Sabun
Detergen Agar-Agar Gelatin
Susu Mayonaise
¨ Perbedaan antara koloid hidrofil dengan koloid hidrofob.
Hidrofil Hidrofob
Mengadsobsi mediumnya Tidak mengabsorbsi mediumnya
Dapat dibuat dengan konsentrasi
yang relatif besar Hanya stabil pada konsentrasi kecil
Tidak mudah digumpalkan dengan penambahan
elektrolit
Mudah meggumpal pada penambahan elektrolit
Viskositas lebih besar
daripada mediumnya Viskositas hampir sama dengan mediumnya
Bersifat reversible Tidak reversible
Efek Tyndal Lemah Ekek Tynal lebih jelas
Pembuatan Koloid
¨ Cara Dispersi
- Dispersi mekanik, dengan menggerus partikel besar hingga diperoleh partikel koloid.
Contoh: belerang dan urea digerus kemudian diaduk dengan air membentuk hidrosol.
- Dispersi elektrolitik, cara pembuatan ini dilakukan dengan alat yang dikenal sebagai busur Bredig.
- Peptisasi, dibuat dari partikel kasar yang diubah menjadi partikel koloid dengan penambahan air atau zat lain.
Contoh: koloid AgCl terbentuk dengan menambahkan akuades pada endapan AgCl
Koloid aluminium hidroksida dibuat dengan menambahkan asam klorida encer (sedikit) pada endapan Al(OH)3 yang baru dibuat.
¨ Cara Hidrolisis
Sol besi(III) hidroksida dibuat dengan cara menambahkan larutam besi(III) klorida pada air panas, FeCl3
(aq) + H2O → Fe(OH)3 (sol) + 3HCl (aq)
-
¨ Dekomposisi Rangkap
- Pembuatan sol As2S3dibuat dengan mengalirkan gas H2S dengan asam arsenit (H3AsO3) yang encer.
Reaksi: 2H3AsO3 (aq) + 3H2S (g) As2S3(koloid) + 6H2O
Pembuatan sol perak bromida untuk membuat film, kertas, atau peat fotografi. KNO3 dihilangkan dengan cara dialisis, kemudian ditambahkan gelatin. Emulsi fotografi adalah suspensi butir-butir perak bromida dalam gel gelatin.
- AgNO3 (aq) + KBr (aq) → AgBr (sol) + KNO3 (aq)
Pemurnian Koloid
Dialisis adalah, suatu proses untuk menghilangkan ion-ion yang dapat mengganggu kestabilan koloid.
Pada proses ini, sistem koloid yang berada dalam kantong koloid, dimasukkan ke dalam bejana yang berisi air
mengalir.
Kantong koloid terbuat dari selaput
semipermeable, yang dapat dilewati oleh ion- ion, tetapi tidak dapat dilewati oleh partikel koloid.
Pori kertas dapat diperkecil dengan mencelupkan ke dalam kolodian. Pada penyaringan perlu menggunakan pompa air atau pompa vakum.
a. Penjernihan air (misalnya air sungai). Penambahan tawas pada air sungai, akanmembentu koloid Al(OH)3, yang akan mengadsorbsi pengotor dalam air,sehingga
menggumpal dan mengendap, sehingga air akan menjadi jernih.
b. Menghilangkan bau badan
Produk roll on deodorant menggunakan Aluminiumstearat sebagai adsorben, jika deodorant digosokkan pada
anggota badan, maka Al-stearat akan mengadsorbsi keringat yang menyebabkan bau badan.
c. Penggunaan Norit
Norit mengandung arang aktif yang akan menyerap berbagai racun dalam usus.
PENJERNIHAN. A I R
DEODORANT
NORIT
Sifat koagulasi koloid dapat dimanfaatkan untuk mengurangi polusi udara dari pabrik
PENGENDAPCOTTREL
Asap dari pabrik sebelum meninggalkan cerobong asap dialirkan melalui ujung-ujung logam yang tajam dan bermuatan pada tegangan tinggi
(20.000 - 75.000). Ujung-ujung yang runcing akan mengionkan molekul-molekul dalam udara. Ion-ion tersebut akan diadsorbsi oleh partikel asap dan menjadi bermuatan. Selanjutnya, partikel
bermuatan itu akan tertarik dan diikat pada elektroda yang lainnya. Pengendap Cottrel ini banyak digunakan dalam industri untuk dua tujuan yaitu, mencegah udara oleh buangan beracun atau memperoleh kembali debu yang berharga
(misalnya debu logam)
Dari gambar ini, jelas terlihat bahwa ion-ion pengganggu keluar dari sistem koloid, kemudian hanyut bersama air
mengalir, sekarang sistem koloid itu sudah bebas
dari ion pengganggu, sehingga tetap stabil.
Prinsip dialisis ini digunakan dalam alat cuci darah. Bagi penderita gagal ginjal, fungsi ginjal diganti dengan mesin dialisator.
Kegunaan lainnya
§ Pada pencelupan tekstil digunakan zat koloid untuk mempermudah pemberian warna.
§ Cat emulsi dan emulsi fotografi termasuk koloid pengotor yang tidak bercampur dengan air.
§ Untuk keperluan kosmetik seperti bodylotion dan handcream, dsb.