KAJIAN BEBERAPA ISOLAT Pseudomonad fluorescens DAN METODE APLIKASI TERHADAP PENYAKIT LAYU DAN PERTUMBUHAN TANAMAN
CABAI (Capsicum annum L.) DI LAHAN
SKRIPSI
Diajukan untuk Memenuhi Sebagian Persyaratan Dalam Memperoleh Gelar Sarjana Pertanian
Program Studi Agroteknologi
Oleh : TRIONO NPM : 1025010006
kepada
FAKULTAS PERTANIAN
UNIVERSITAS PEMBANGUNAN NASIONAL “ VETERAN” JAWA TIMUR SURABAYA
2014
Diajukan oleh :
TRIONO NPM : 1025010006
Telah dipertahankan di hadapan dan diterima oleh Tim Penguji Skripsi Program Studi Agroteknologi Fakultas Pertanian
Universitas Pembangunan Nasional “ Veteran” Jawa Timur Pada tanggal...,Januari 2014
Dr. Ir. Ketut Sri Marhaeni J., MSi. 2. Pembimbing Pendamping
Dr. Ir. Yenny Wuryandari, MP.
Telah Direvisi
Tanggal : ... 2014
Pembimbing Utama
Dr. Ir. Ketut Sri Marhaeni J., MSi.
Pembimbing Pendamping
Dr. Ir. Yenny Wuryandari, MP.
Berdasarkan Undang-Undang No.19 Tahun 2002 tentang Hak Cipta dan Permendiknas No 17, Pasal 1 Ayat 1 tentang plagiarisme
Maka, saya sebagai Penulis Skripsi dengan judul :
KAJIAN BEBERAPA ISOLAT Pseudomonad fluorescens DAN METODE APLIKASI TERHADAP PENYAKIT LAYU DAN PERTUMBUHAN TANAMAN CABAI (Capsicum annum L.) DI LAHAN.
menyatakan bahwa Skripsi tersebut di atas bebas dari plagiarism.
Demikian surat pernyataan ini saya buat dengan sebenar-benarnya dan saya sanggup mempertanggungjawabkan sesuai dengan hukum dan perundangan yang berlaku.
Surabaya,..., Januari, 2014 Yang Membuat Pernyataan,
TRIONO NPM. 1025010006
STUDY OF SOME ISOLATE Pseudomonad fluorescens AND APPLICATIONS METHODS ON WILT DISEASE AND GROWTH OF CHILI
(Capsicum annum L.) IN THE LAND.
Triono, Ketut Sri Marhaeni Julyasih and Yenny Wuryandari Faculty of Agriculture UPN “ Veteran” East Java, Surabaya
ABSTRACT
Pseudomonads fluorescens bacteria are biological agents that can suppress plant disease development and growth promoter. The objective of this research was to study of isolate Pseudomonads fluorecens who has the most excellent in suppressing the development of chili plants to wilt disease and spur growth. This research was conducted in the Laboratory Health Plant the Faculty of Agriculture Universitas Pembangunan Nasional “Veteran” East Java and in the Agricultural Land Ketimang Village, Regency Wonoayu, District of Sidoarjo using Randomized Block Design (RBD). This study is a factorial experiment (two factors). The first factor is kinds isolate Pseudomonads fluorescens with four (4) levels: Control / distilled water (P0), isolates Pf B (P1), isolates Pf 122 (P2) and isolates Pf 160 (P3). The second factor is the method of application of biological agents with two (2) levels, the submersion method (C1) and the sprinkling method (C2). The results showed that treatment of Pf 122 is the most excellent in suppressing the development of wilt disease, followed Pf and Pf B 160 consecutive able to suppress the development of wilt disease in pepper by 31.35%, 24.69% and 23.02 %. Treatment of Pf 122 is the most excellent in spurring the growth of chili plants in the land.
Keywords: Pseudomonads fluorescens, Chili Plants Wilt Disease, Method of Application.
Triono, Ketut Sri Marhaeni Julyasih dan Yenny Wuryandari Fakultas Pertanian UPN “ Veteran” Jawa Timur, Surabaya
ABSTRAK
Bakteri Pseudomonad fluorescens merupakan agensia hayati yang dapat menekan perkembangan penyakit tanaman dan pemacu pertumbuhan. Penelitian ini bertujuan untuk mendapatkan isolat Pseudomonad fluorecens yang paling baik dalam menekan perkembangan penyakit layu tanaman cabai serta memacu pertumbuhan. Penelitian ini dilakukan di Laboratorium Kesehatan Tanaman Fakultas Pertanian Universitas Pembangunan nasional “veteran” Jawa Timur dan di Lahan Pertanian Desa Ketimang Kecamatan Wonoayu Kabupaten Sidoarjo menggunakan Rancangan acak Kelompok (RAK). Penelitian ini merupakan percobaan faktorial (2 faktor). Faktor pertama macam isolat Pseudomonad fluorescens dengan 4 (empat) level yaitu Kontrol/Aquadest (P0), Isolat Pf B (P1), Isolat Pf 122 (P2) dan Isolat Pf 160 (P3). Faktor kedua yaitu metode aplikasi agensia hayati dengan dua (2) level, yaitu metode perendaman (C1) dan metode penyiraman (C2). Hasil penelitian menunjukkan bahwa perlakuan Pf 122 merupakan yang paling baik dalam menekan perkembangan penyakit layu, kemudian diikuti Pf 160 dan Pf B secara berturut-turut mampu menekan perkembangan penyakit layu pada tanaman cabai sebesar 31,35 %, 24,69 % dan 23,02 %. Perlakuan Pf 122 merupakan yang paling baik dalam memacu pertumbuhan tanaman cabai di lahan.
Kata Kunci : Pseudomonad fluorescens, Penyakit Layu Tanaman Cabai, Metode Aplikasi.
TRIONO NPM : 1025010006. KAJIAN BEBERAPA ISOLAT Pseudomonad flourescens DAN METODE APLIKASI TERHADAP PENYAKIT LAYU DAN PERTUMBUHAN TANAMAN CABAI (Capsicum annum L.) DI LAHAN. Dibawah bimbingan Dr. Ir. Ketut Sri Marhaeni Julyasih, MSi. selaku Dosen Pembimbing Utama dan Dr. Ir. Yenny Wuryandari, MP. selaku Dosen Pembimbing Pendamping.
RINGKASAN (SUMMARY)
Cabai (Capsicum annum L.) merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomis penting di Indonesia. Permintaan cabai merah di Indonesia meningkat setiap tahun baik untuk keperluan rumah tangga maupun industri. Kendala produksi cabai merah antara lain penyakit layu kompleks yang disebabkan oleh jamur Fusarium oxysporum dan bakteri Ralstonia solanacearum. Penelitian ini bertujuan untuk mengetahui kemampuan agensia hayati Pseudomonad fluorescens dalam menekan perkembangan penyakit layu pada tanaman cabai di lahan, mengetahui isolat agensia hayati Pseudomonad fluorescens yang paling efektif dalam menekan perkembangan penyakit layu pada tanaman cabai di lahan, mengetahui isolat agensia hayati Pseudomonad fluorescens yang paling baik untuk memacu pertumbuhan tanaman cabai di lahan serta mengetahui metode aplikasi agensia hayati Pseudomonad fluorescens yang efektif untuk menekan penyakit layu serta memacu pertumbuhan tanaman cabai di lahan.
Penelitian ini dilakukan di Laoratorium Kesehatan Tanaman Fakultas Pertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur dan di Lahan pertanian Desa Ketimang Kecamatan Wonoayu Kabupaten Sidoarjo, mulai awal bulan November sampai Desember 2013. Penelitian ini merupakan percobaan faktorial (2 faktor). Faktor pertama macam isolat Pseudomonad fluorescens dengan 4 (empat) level yaitu Kontrol/Aquadest (P0), Isolat Pf B (P1), Isolat Pf 122 (P2) dan Isolat Pf 160 (P3). Faktor kedua yaitu metode aplikasi agensia hayati dengan dua (2) level, yaitu metode perendaman (C1) dan metode penyiraman (C2). Kombinasi perlakuan terdapat 8 macam dan diulang sebanyak 5 kali. Data yang diperoleh dianalisis dengan analisis sidik ragam Anova (Analisis Variansi). Apabila F hitung > F tabel dianjurkan uji perbandingan rata–rata hasil dengan uji Beda Nyata Jujur (BNJ 5 %.
Hasil dari data pengamatan delapan perlakuan tersebut menunjukkan bahwa semua isolat Pf mampu menekan perkembangan penyakit layu dan memacu pertumbuhan tanaman cabai di lahan dibandingkan kontrol. Perlakuan metode aplikasi tidak menunjukkan pengaruh terhadap penyakit layu dan memacu petumbuhan tanaman cabai di lahan, serta tidak ada interaksi yang nyata pada kombinasi perlakuan tersebut. Perlakuan Pf 122 merupakan yang paling baik dalam menekan perkembangan penyakit layu, kemudian diikuti Pf 160 dan Pf B secara berturut-turut mampu menekan perkembangan penyakit layu pada tanaman cabai sebesar 31,35 %, 24,69 % dan 23,02 %. Perlakuan Pf 122 merupakan yang paling baik dalam memacu pertumbuhan tanaman cabai di lahan. Agensia hayati Pseudomonad fluorescens terutama isolat Pf 122 merupakan yang paling baik untuk diaplikasikan di lahan tanaman cabai.
i Segala puji syukur saya panjatkan kepada Tuhan Yang Maha Esa yang telah memberikan rahmat-Nya kepada penulis serta shalawat dan salam semoga terlimpah atas junjungan kita Nabi Muhammad SAW sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul “KAJIAN BEBERAPA ISOLAT Pseudomonad fluorescens DAN METODE APLIKASI TERHADAP PENYAKIT LAYU DAN PERTUMBUHAN TANAMAN CABAI (Capsicum annum L.) DI LAHAN.
Penyusunan skripsi ini merupakan salah satu persyaratan untuk penyelesaian jenjang Strata 1 (S1) Program Studi Agroteknologi Fakultas Pertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur.
Penyusunan skripsi ini tidak akan berhasil dan selesai dengan baik tanpa bantuan dan bimbingan dari berbagai pihak. Maka dari itu, melalui tulisan ini penulis ingin mengucapkan rasa terima kasih yang sebesar-besarnya kepada yang terhormat:
1.
Dr. Ir. Ketut Sri Marhaeni Julyasih. M.Si. selaku Dosen Pembimbing Utama yang telah meluangkan waktu serta pikiran untuk memberikan segala bimbingan, perhatian dan kesabaran mulai dari awal hingga akhir dalam penyusunan skripsi ini.2.
Dr. Ir. Yenny Wuryandari, MP. selaku Dosen Pembimbing Pendamping yang telah meluangkan waktu serta pikiran untuk memberikan segala bimbingan, perhatian dan kesabaran mulai dari awal hingga akhir dalam penyusunan skripsi ini.3.
Dr. Ir. Ramdan Hidayat, MS. selaku Dekan Fakultas Pertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur.ii
4.
Ir. Mulyadi. MS. selaku Ketua Program Studi Agroteknologi FakultasPertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur.
5.
Ayah dan Ibunda tercinta yang telah susah payah mendidik penulishingga sekarang dan memberikan dukungan baik moril maupun spirituil selama melaksanakan studi di Universitas Pembangunan Nasional “Veteran” Jawa Timur, sehingga dapat menyelesaikan penyusunan skripsi ini dengan baik.
6.
Buat kakakku Eko Purwanto, S.Pd., dan Krisna Dwijanto, SE. serta adikku Kerta Adi Wasana terima kasih atas do’a dan motivasinya.7.
Spesial terima kasih buat kekasihku Anita Putra Anggraini yang tiada hentinya memberikan motivasi, bantuan, semangat, waktu dan doa dalam penyusunan skripsi ini.8.
Teman-teman seangkatan yang selalu membantu dan saling memberikan pengarahan sehingga skripsi ini dapat terselesaikan.9.
Semua pihak yang sengaja ataupun tidak sengaja memberikan bantuan dalam penyusunan skripsi ini.Semoga Allah SWT berkenan memberikan balasan, limpahan, berkah, rahmat dan karunia-Nya, Amien.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih belum sempurna, maka dari itu penulis mengharapkan saran dan kritik yang bersifat membangun demi sempurnanya skripsi ini.
Surabaya, Januari 2014
Penyusun
iii
2.3. Penyakit Layu Ralstonia (Ralstonia solanacearum) ... 13
2.3.1. Gejala Penyakit ... 13
2.3.2. Patogen Penyebab ... 14
2.3.3. Siklus Hidup ... 15
2.4. Pengendalian Hayati ... 16
2.5. Agensia Hayati Pseudomonas fluorescens ... 17
2.5.1. Potensi dan Kelebihan Bakteri Pseudomonas fluorescens.. 18
2.5.2. Pseudomonas fluorescens Sebagai Penekan Penyakit Layu ... 19
2.5.3. Pseudomonas fluorescens Sebagai Pemacu Pertumbuhan 20
2.5.4. Aplikasi Agensia Hayati ... 21
III. METODOLOGI PENELITIAN ... 22
3.1. Tempat dan Waktu ... 22
3.2. Alat dan Bahan... 22
3.2.1. Alat ... 22
iv
3.4.5. Pembiakan Bakteri Pseudomonad fluorscens ... 25
3.4.6. Aplikasi Agensia Hayati Pseudomonad fluorescens... 26
3.4.7. Pemeliharaan Tanaman Cabai ... 28
3.5. Pengamatan ... 29
3.6. Analisa Data ... 31
IV. HASIL DAN PEMBAHASAN... 32
4.1. Hasil Survey Pendahuluan Lokasi Penelitian ... 32
4.2. Pengaruh Pseudomonad fluorescens dan Metode Aplikasi Terhadap Perkembangan Penyakit ... 33
4.2.1. Masa Inkubasi... 33
4.2.2. Indeks Penyakit ... 36
4.3. Panjang Perubahan Warna Jaringan Pangkal Batang ... 42
4.4. Pengaruh Pseudomonad fluorescens dan Metode Aplikasi Terhadap Pertumbuhan Cabai ... 45
v Nomor Halaman
Teks
1. Gejala Penyakit Layu yang Disebabkan oleh Jamur Fusarium sp ... 10
2. Jamur Fusarium oxysporum pada Media PDA dan Konidia Jamur Fusarium oxysporum... 11
3. Gejala Penyakit Layu Bakteri yang Disebabkan oleh Ralstonia solanacearum pada Tanaman Cabai ... 14
4. Denah Percobaan dan Ulangan ... 23
5. Perbanyakan Isolat Bakteri Pseudomonad fluorescens pada Media King’s B... 26
6. Suspensi Agensia Hayati Pseudomonad fluoresces Pada Masing- Masing Isolat ... 27
7. a. Perendaman Bibit Cabai Menggunakan Suspensi Pseudomonad fluorescens, b. Penyiraman Suspensi Pseudomonad fluorescens pada Lubang Tanam ... 27
8. Denah Tanaman Sampel ... 28
9. Tanaman Cabai Dewasa yang Terserang Penyakit Layu ... 32
10. a. Gejala Daun Layu Dan Menguning, b. Daun Tanaman Sehat ... 33
11. Diagram Masa Inkubasi Penyakit Layu Tanaman Cabai ... 35
12. Diagram Rata-rata Indeks Penyakit Setiap Perlakuan pada Tanaman Cabai ... 41
13. (a) Warna Jaringan Pembuluh Tanaman Cabai yang Sehat, (b) Warna Jaringan Tanaman Cabai yang Terserang Penyakit ... 42
14. Diagram Rata-rata Panjang Perubahan Warna Jaringan Pangkal Batang Tanaman Cabai Hari ... 44
15. Diagram Rata-rata Tinggi Tanaman Cabai 30 HST ... 46
16. Diagram Rata-rata Jumlah Daun Tanaman Cabai ... 48
17. Diagram Rata-rata Panjang Akar Tanaman Cabai Hari ke-30 ... 50
18. Diagram Rata-rata Berat Kering Daun Tanaman Cabai Hari ke-30 ... 52
19. Diagram Rata-rata Berat Kering Akar Tanaman Cabai Hari ke-30 ... 54
vi DAFTAR TABEL
Nomor Halaman Teks
1. Perkembangan Produksi Cabai Besar Menurut Wilayah Pulau Jawa dan
Luar Pulau Jawa, Tahun 2010–2012 ... 7
2. Perkembangan Produksi Cabai Besar Di Pulau Jawa Menurut Provinsi Tahun 2011–2012. ... 8
3. Rata-rata Masa Inkubasi Penyakit Layu pada Tanaman Cabai ... 34
4. Rata-rata Indeks Penyakit Layu Pada Tanaman Cabai Di Lahan ... 37
5. Rata-rata Panjang Perubahan Warna Jaringan Pangkal Batang Tanaman Cabai ... 43
6. Rata-rata Tinggi Tanaman Cabai Umur 30 HST Di Lahan... 45
7. Rata-rata Jumlah Daun Tanaman Cabai Hari ke-30 ... 47
8. Rata-rata Panjang Akar Tanaman Cabai Hari ke-30 ... 49
9. Rata-rata Berat Kering Daun Tanaman Cabai ... 51
10. Rata-rata Berat Kering Akar Tanaman Cabai ... 53
Nomor Halaman Lampiran 1. Anova Masa Inkubasi ... 60
2. Anova Indeks Penyakit Hari ke-5 ... 60
3. Anova Indeks Penyakit Hari ke-10 ... 60
4. Anova Indeks Penyakit Hari ke-15 ... 61
5. Anova Indeks Penyakit Hari ke-20 ... 61
6. Anova Indeks Penyakit Hari ke-25 ... 61
7. Anova Indeks Penyakit Hari ke-30 ... 62
8. Anova Panjang Perubahan Warna Jaringan Pangkal Batang Tanaman Cabai Hari ke-30 ... 64
9. Anova Tinggi Tanaman Cabai Hari ke-30 ... 62
vii 12. Anova Berat Kering Akar Tanaman Cabai Hari ke-30 ... 63 13. Anova Berat Kering Daun Tanaman Cabai Hari ke-30 ... 63
1 I. PENDAHULUAN
1.1. Latar Belakang
Cabai (Capsicum annum L.) merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomis penting di Indonesia. Secara umum cabai memiliki banyak kandungan gizi dan vitamin. Di antaranya kalori, protein, lemak, kabohidarat, kalsium, vitamin A, B1 dan Vitamin C. Manfaat cabai sangat banyak, selain digunakan untuk keperluan rumah tangga, cabai juga dapat digunakan untuk bahan baku industri diantaranya, industri bumbu masakan, industri makanan dan industri obat - obatan atau jamu. Buah cabai ini selain dijadikan sayuran atau bumbu masak juga memiliki peluang eksport (Prajnanta,1998; Haryoto, 2009).
Hasil pengukuran Badan Pusat Statistik (2013) menunjukkan, peningkatan produksi cabai besar segar dengan tangkai di Indonesia tahun 2012, yaitu sebesar 954,36 ribu ton dengan luas panen sebesar 120,275 ribu hektar dan rata-rata produktivitas sebesar 7,94 ton per hektar. Dibandingkan tahun 2011 telah terjadi kenaikan produksi sebesar 65,51 ribu ton (7,37 %). Kenaikan tersebut disebabkan oleh kenaikan produktivitas 0,59 ton/ha (8,04 %), sementara luas areal panen terjadi penurunan sebesar 788 hektar (0,65 %) dibandingkan tahun 2011. Rata-rata produksi cabai nasional baru mencapai 7,94 ton/hektar, sementara potensi produksi cabai dapat mencapai 10 ton/hektar. Produktifitas cabai merah masih rendah yaitu 5,2 ton/ha dengan biaya produksi Rp 78 juta/ha. Sedangkan harga pokok produksi Rp. 12.000/kg (Anonimus, 2012).
Salah satu kendala yang mempengaruhi produksi dan mutu cabai adalah adanya serangan penyakit layu Fusarium yang disebabkan oleh jamur Fusarium oxysporum. Jamur Fusarium sp. merupakan jamur yang sangat merugikan karena dapat menyerang tanaman cabai mulai dari masa perkecambahan
sampai fase dewasa (Semangun, 2001; Wiryanta, 2002). Menurut Duriat, Gunaeni dan Wulandari (2007), selain jamur Fusarium sp. penyakit yang sering ditemui pada tanaman cabai atau tanaman terung-terungan yaitu penyakit layu bakteri yang disebabkan oleh bakteri Ralstonia solanacearum. Menurut Asrul (2003), kedua jenis patogen ini adalah soil-borne disease (patogen tular tanah) yang dapat mematikan tanaman cabai sehingga produksi menjadi puso. Kehilangan hasil oleh Ralstonia solanacearum dapat mencapai lebih dari 60% bahkan bisa mencapai 100%. Menurut Agrios (2005), penyakit layu bakteri umumnya ditemukan pada daerah tropis, subtropis dan pada daerah beriklim hangat di wilayah dunia.
Bakteri Ralstonia solanacearum berkembang di dalam jaringan tanaman setelah melalui bagian interseluler tanaman dengan bantuan angin atau melalui lubang alami, misalnya stomata dan tempat keluarnya akar sekunder. Bakteri juga dapat menginfeksi melalui luka-luka karena tusukan nematoda akar, Meloidogyne sp. Secara alami, patogen ini menginfeksi akar dengan kisaran inang yang luas dan secara agresif mengkolonisasi jaringan xilem, menyebabkan layu letal yang diketahui sebagai penyakit layu bakteri, bahkan tidak jarang menyebabkan kematian pada inang (Semangun, 2001).
Penyakit layu kompleks yang disebabkan oleh jamur Fusarium oxysporum dan bakteri Ralstonia solanacearum sulit dikendalikan, baik pada tanaman cabai maupun tanaman lainnya (Duriat dkk., 2007). Penyakit layu yang disebabkan oleh kedua patogen tersebut ditemukan di Sumatera Barat yang menyerang tanaman pisang, jamur Fusarium oxysporum f.sp cubense (Foc) bersimbiosis dengan bakteri Ralstonia solanacearum (Nasir dan Jumjunidang, 2004). Kedua patogen tular tanah tersebut saling bersinergi di dalam jaringan akar sehingga pertumbuhan tanaman tidak bisa berlangsung dengan baik.
3
Salah satu agensia hayati yang berpotensi untuk pengendalian hayati adalah Pseudomonad fluorescens. Hasil penelitian sebelumnya yang dilakukan di rumah kaca (Wuryandari, Purnawati, Arwiyanto, dan Hadisutrisno, 2005), bahwa diperoleh beberapa isolat agensia Pseudomonad fluoresens yang berhasil menekan layu bakteri dan dapat memacu pertumbuhan pada tanaman tomat. Menurut Krisnawan (2011), agensia hayati Pseudomonad fluorescens isolat Pf 36, isolat Pf 160 dan Pf 122 mampu menekan perkembangan penyakit layu Fusarim sp., yang indeks penyakitnya kurang dari 20 %.
Hasil penelitian pada skala green house yang dilakukan Nurfitriana (2012), membuktikan bahwa perendaman akar tanaman cabai dengan Pseudomonad fluorescens mampu menekan perkembangan serangan penyakit layu Fusarium sp. dan penyakit layu Ralstonia solanacearum. Dari hasil penelitian tersebut diperoleh 3 isolat Pf yang paling baik dalam menekan penyakit layu pada tanaman cabai. Hasil pengamatan indeks penyakit pada hari ke-30 isolat Pf 122 menunjukkan hasil yang terbaik yaitu 33,78 % diikuti Pf 160 sebesar 40,58 % dan Pf B sebesar 46,69 %. Perlakuan kontrol menunjukkan indeks penyakit tertinggi yaitu 71,25 %.
Pseudomonas fluorescens yang hidup di daerah perakaran tanaman dapat berperan sebagai jasad renik pelarut posfat, mengikat nitrogen dan menghasilkan zat pengatur tumbuh (ZPT) bagi tanaman. Kemampuan Pseudomonas fluorescens tersebut dapat dimanfaatkan sebagai pupuk biologis yang dapat menyediakan hara untuk pertumbuhan tanaman (Anonimus, 2013). Menurut Soesanto (2008), bakteri Pseudomonas fluorescens juga menghasilkan antibiotika dan bersifat Plant Growth Promoting Rhizobacteria (PGPR), yang dapat memacu pertumbuhan tanaman dan menghambat pertumbuhan patogen.
Menurut Soesanto, Mugiastuti, dan Rahayuniati (2011), metode aplikasi agensia hayati Pseudomonas fluorescens baik perendaman bibit/benih maupun penyiraman pada tanaman kentang mampu menurunkan indeks penyakit serta dapat memacu pertumbuhan tanaman kentang. Sementara Gunawan (2012), melaporkan bahwa formula cair Pseudomonas fluorescens, baik dalam metode aplikasi penyiraman maupun perendaman mampu mengendalikan penyakit busuk pangkal batang kacang tanah, yaitu menurunkan intensitas penyakit.
Mencermati hal tersebut dan mengkaji hasil penelitian sebelumnya, maka perlu diadakan pengujian lanjutan untuk mengetahui kemampuan agensia hayati Pseudomonad fluorescens dalam menekan perkembangan penyakit layu dan memacu pertumbuhan tanaman cabai pada skala lahan. Selain itu, karena metode aplikasi penelitian dilahan belum dilakukan maka sangat perlu dilakukan penelitian tentang aplikasi yang efektif pada skala lahan.
1.2. Rumusan Masalah
Berdasarkan uraian hal tersebut di atas dapat dirumuskan permasalahan sebagai berikut :
1. Apakah agensia hayati Pseudomonad fluorescens dapat menekan perkembangan penyakit layu dan memacu pertumbuhan tanaman cabai di lahan?
2. Isolat agensia hayati Pseudomonad fluorescens mana yang paling baik dalam menekan penyakit layu pada tanaman cabai di lahan?
3. Isolat agensia hayati Pseudomonad fluorescens mana yang paling baik dalam memacu pertumbuhan tanaman cabai di lahan?
4. Metode aplikasi mana yang paling efektif dalam menekan penyakit layu serta pemacu pertumbuhan pada tanaman cabai di lahan?
5
1.3. Tujuan
Tujuan dari penelitian ini adalah sebagai berikut :
1. Mengetahui kemampuan agensia hayati Pseudomonad fluorescens dalam menekan perkembangan penyakit layu pada tanaman cabai di lahan.
2. Mengetahui isolat agensia hayati Pseudomonad fluorescens yang paling efektif dalam menekan perkembangan penyakit layu pada tanaman cabai di lahan.
3. Mengetahui isolat agensia hayati Pseudomonad fluorescens yang paling baik untuk memacu pertumbuhan tanaman cabai di lahan.
4. Mengetahui metode aplikasi agensia hayati Pseudomonad fluorescens yang efektif untuk menekan penyakit layu serta memacu pertumbuhan tanaman cabai di lahan.
1.4. Hipotesis
1. Agensia hayati Pseudomonad fluorescens dapat menekan perkembangan penyakit layu dan memacu pertumbuhan tanaman cabai di lahan.
2. Agensia hayati Pseudomonad fluorescens isolat Pf 122 diduga paling baik dalam menekan penyakit layu pada tanaman cabai di lahan.
3. Agensia hayati Pseudomonad fluorescens isolat Pf 122 diduga paling baik dalam memacu pertumbuhan tanaman cabai di lahan.
4. Metode aplikasi agensia hayati Pseudomonad fluorescens dengan cara perendaman lebih efektif dibandingkan metode penyiraman terhadap penekanan penyakit layu serta pemacu pertumbuhan pada tanaman cabai di lahan.
1.5. Manfaat
Manfaat dari penelitian ini antara lain sebagai berikut:
1. Mendapatkan informasi tentang isolat agensia hayati Pseudomonad fluorescens yang paling baik dalam menekan penyakit layu pada tanaman cabai di lahan.
2. Mendapatkan informasi tentang isolat agensia hayati Pseudomonad fluorescens yang paling baik dalam memacu pertumbuhan tanaman cabai di lahan.
3. Mendapatkan metode aplikasi yang tepat untuk pengendalian penyakit layu serta memacu pertumbuhan tanaman cabai di lahan menggunakan agensia hayati Pseudomonad fluorescens .
7 II. TINJAUAN PUSTAKA
2.1. Produksi Cabai Di Indonesia
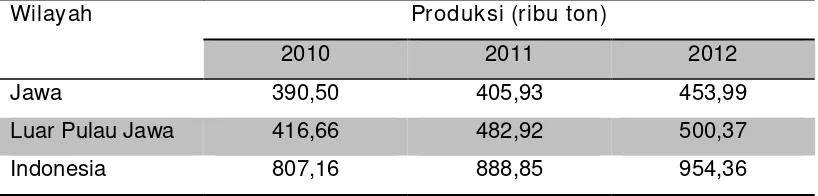
Hasil pengukuran Badan Pusat Statistik (2013) menunjukkan, peningkatan produksi cabai besar segar dengan tangkai di Indonesia tahun 2012, yaitu sebesar 954,36 ribu ton dengan luas panen sebesar 120,275 ribu hektar dan rata-rata produktivitas sebesar 7,94 ton per hektar. Dibandingkan tahun 2011 telah terjadi kenaikan produksi sebesar 65,51 ribu ton (7,37 %). Kenaikan tersebut disebabkan oleh kenaikan produktivitas 0,59 ton/ha (8,04 %), sementara luas areal panen terjadi penurunan sebesar 788 hektar (0,65 %) dibandingkan tahun 2011. Rata-rata produksi cabai nasional baru mencapai 7,94 ton/hektar, sementara potensi produksi cabai dapat mencapai 10 ton/hektar.
Peningkatan produksi cabai besar tahun 2012, berdasarkan prosentase menurut wilayah peningkatan produksi di Pulau Jawa sebesar 48,06 ribu ton (11,84 %), sedangkan untuk luar Pulau Jawa peningkatanya sebesar 17,45 ribu ton (3,61 %).
Tabel 1. Perkembangan Produksi Cabai Besar Menurut Wilayah Pulau Jawa dan Luar Pulau Jawa, Tahun 2010–2012.
Wilayah Produksi (ribu ton)
2010 2011 2012
Jawa 390,50 405,93 453,99
Luar Pulau Jawa 416,66 482,92 500,37
Indonesia 807,16 888,85 954,36
(Sumber data : BPS-2013)
Peningkatan produksi cabai besar tahun 2012, berdasarkan Provinsi di seluruh Pulau Jawa yaitu peningkatan produksi di Jawa Barat sebesar 6,000 ribu ton (3,07 %), Jawa Tengah sebesar 10,998 ribu ton (9,23 %), DI Yogyakarta
sebesar 2,048 ribu ton (14,21 %), Jawa Timur sebesar 25,997 ribu ton (35,29 %), dan Banten sebesar 3,018 ribu ton (90,74 %).
Tabel 2. Perkembangan Produksi Cabai Besar Di Pulau Jawa Menurut Provinsi Tahun 2011–2012.
Provinsi Produksi (Ribu ton) Perkembangan
2011 2012 Absolute Prosentase (%)
DKI Jakarta - - - -
Jawa Barat 195,383 201,383 6,000 3,07
Jawa Tengah 119,131 130,129 10,998 9,23
DI Yogyakarta 14,412 16,460 2,048 14,21
Jawa Timur 73,677 99,674 25,997 35,29
Banten 3,326 6,344 3,018 90,74
(Sumber data: BPS-2013)
2.1.1. Kendala Produksi Cabai
Kendala produksi cabai di Indonesia khususnya Jawa timur sangat kompleks, salah satu pembatas faktor produksi cabai adalah penyakit Virus Kuning, Patek, layu Bakteri dan layu Fusarium (Anonimus, 2012). Salah satu kendala penyebab rendahnya produksi adalah gangguan penyakit yang dapat menyerang sejak tanaman di persemaian sampai hasil panen bahkan dapat menyebabkan kegagalan panen. Penyakit pada tanaman cabai disebabkan oleh patogen atau Organisme Pengganggu Tanaman (OPT). Patogen atau penyebab penyakit tersebut tidak selalu berupa makhluk hidup (animate pathogen), tetapi juga sesuatu yang tidak hidup (inanimate pathogen) seperti virus, hara, air atau penyebab lainnya (Duriat dkk., 2007).
Jamur Fusarium sp. merupakan jamur yang sangat merugikan karena dapat menyerang tanaman cabai mulai dari masa perkecambahan sampai fase dewasa (Semangun, 2001; Wiryanta, 2002). Menurut Duriat dkk. (2007), selain jamur Fusarium sp. penyakit yang sering ditemui pada tanaman cabai atau
9
tanaman terung-terungan yaitu penyakit layu bakteri yang disebabkan oleh bakteri Ralstonia solanacearum. Menurut Asrul (2003), kedua jenis patogen ini adalah soil-borne disease (patogen tular tanah) yang dapat mematikan tanaman cabai sehingga produksi menjadi puso. Kehilangan hasil oleh Ralstonia solanacearum dapat mencapai lebih dari 60% bahkan bisa mencapai 100%. Menurut Agrios (2005), penyakit layu bakteri umumnya ditemukan pada daerah tropis, subtropis dan pada daerah beriklim hangat di wilayah dunia.
2.2. Penyakit Layu Fusarium (Fusarium oxysporum)
Salah satu penyakit penting yang sering menyerang pada tanaman cabai adalah penyakit layu Fusarium. Jamur penyebab layu pada tanaman cabai adalah Fusarium oxysporum f.sp capsici. Tanaman cabai yang terserang penyakit ini akan mengalami kelayuan mulai pada daun-daun tua, kemudian menyebar ke daun-daun muda dan menguning. Jamur ini menyerang empulur batang melalui akar yang mengalami luka dan terinfeksi (Kurnianti, 2013). Penyakit layu yang disebabkan oleh patogen tular tanah jamur Fusarium sp. selalu menjadi masalah yang serius karena dapat mengurangi hasil tanaman sampai 100% (Taufik, 2008).
Penyakit layu Fusarium sp. menimbulkan kerugian yang cukup besar dalam bidang pertanian. Di daerah Lembang dan Pacet Jawa Barat intensitas penyakit layu Fusarium sp. mencapai 16,7 % (Manohara, 1977 dalam Semangun 2001), sedangkan di daerah Malang Jawa Timur intensitas penyakit layu Fusarium sp. mencapai 10,25 % (Djauhari, 1987 dalam Semangun, 2001). Kerugian akibat penyakit layu fusarium pada tanaman cabai cukup besar. Penyakit ini dapat menyebabkan kerugian dan gagal panen hingga 50% (Rostini, 2011 dalam Mahartha, Khalimi dan Wirya, 2013).
2.2.1. Gejala Penyakit
Gejala awal dari daun ini adalah menjadi pucatnya tulang-tulang daun, terutama daun tanaman bagian atas, kemudian diikuti menggulungnya daun yang lebih tua (epinasti) karena merunduknya tangkai daun, dan akhirnya tanaman menjadi layu secara keseluruhan (Agrios, 1988; Anon, 1976 dalam Semangun, 2001).
Gambar 1. Gejala Penyakit Layu yang Disebabkan oleh Jamur Fusarium (Sumber:http://erlanardianarisma nsyah.wordpress.com)
Kelayuan akibat penyakit layu Fusarium sp. didahului dengan menguningnya daun, terutama daun-daun tua menuju ke daun muda. Pada batang kadang-kadang terbentuk akar adventif. Pada tahap selanjutnya tanaman menjadi kerdil dan merana, jika tanaman yang sakit tersebut dipotong dekat pangkal batang atau dikelupas dengan pisau akan terlihat suatu cincin berwarna coklat dari berkas pembuluh. Pada serangan berat, gejala tersebut juga terdapat pada tanaman bagian atas. Serangan pada tanaman yang masih sangat muda penyakit ini dapat menyebabkan kematian tanaman secara mendadak, karena pada pangkal batang terjadi kerusakan atau kanker yang menggelang, sedangkan pada tanaman dewasa yang terinfeksi masih dapat bertahan hidup dan membentuk buah, tetapi hasilnya tidak maksimal (Semangun, 2001).
11
2.2.2. Patogen Penyebab
Semua jamur Fusarium yang menyebabkan penyakit layu dan berada dalam pembuluh (vascular disease) dikelompokkan dalam satu jenis (spesies), yaitu Fusarium oxysporum Schlecht. Jenis ini mempunyai banyak bentuk (forma) yang mengkhususkan diri pada jenis (spesies) tumbuhan tertentu (Semangun, 2001). Jamur penyebab layu pada tanaman cabai adalah Fusarium oxysporum f.sp capsici (Kurnianti, 2013).
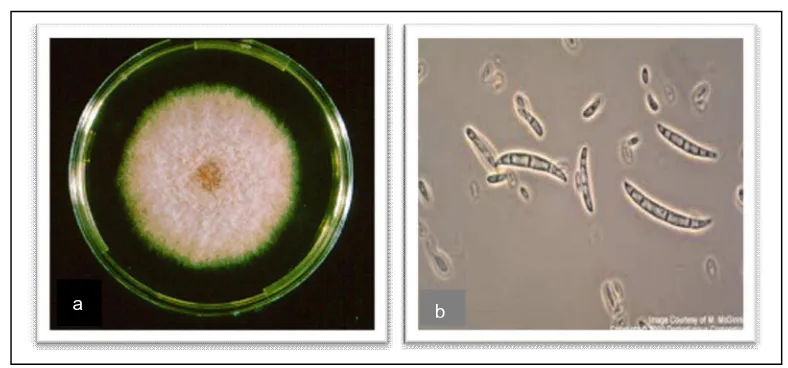
Gambar 2. (a) Jamur Fusarium oxysporum pada Media PDA (b) Konidia Jamur Fusarium oxysporum.
(Sumber: Djaenuddin, 2011).
Jamur Fusarium sp. membentuk miselium bersekat dan dapat tumbuh dengan baik pada berbagai kondisi. Awal pertumbuhan jamur ini, miselium berwarna putih keabu-abuan, semakin tua berwarna menjadi krem, akhirnya koloni tampak mempunyai benang-benang berwarna oker. Jamur membentuk banyak mikrokonidium bersel satu (1), tidak berwarna, lonjong atau bulat telur, silindris, dan berukuran 9-16 x 2-4 µm dan bersekat satu. Mikrokonidium dapat dibentuk dalam pembuluh kayu dan terangkut ke atas bersama-sama dengan air dan hara tanah. Makroknidium berkembang dari konidiofor, silindris atau ramping, berbentuk kumparan, tidak berwarna, kebanyakan bersekat dua atau tiga, berukuran 40-100 x 5-7,5 µm. Klamidiospora berbentuk bulat atau bulat
a b
panjang, berdinding halus sampai kasar, berukuran 10-11 x 8-9 um, dan terletak terminal (diujung) atau interkalar (ditengah) (Soesanto, 2013).
Menurut Soesanto (2013), jamur Fusarium sp. menghasilkan klamidiospora apabila keadaan lingkungan tidak sesuai bagi patogen dan berfungsi untuk mempertahankan kelangsungan hidup patogen. Klamidospora dibentuk sebagai respon terhadap kondisi lingkungan yang tidak sesuai yang bertujuan mempertahankan kelangsungan hidup patogen. Klamidospora berukuran 7-11 μ m, bersel satu atau dua, berdinding tebal dan dihasilkan di dalam makrokonidium atau miselium yang sudah tua (Semangun, 2001).
2.2.3. Siklus Hidup
Jamur Fusarium oxysporum dapat bertahan lama dalam tanah dalam bentuk klamidiospora. Jamur ini merupakan jamur tanah, atau yang lazim disebut sebagai soil inhabitant. Tanah yang sudah terinfestasi sulit dibebaskan kembali dari jamur ini, walaupun tidak ada tumbuhan inang, jamur dapat bertahan dalam tanah lebih dari 10 tahun (Kranz dkk., 1977 dalam Semangun, 2001).
Daur hidup jamur Fusarium oxysporum mengalami fase patogenesis dan saprogenesis. Pada fase patogenesis, jamur hidup sebagai parasit pada tanaman inang. Apabila tidak ada tanaman inang, patogen hidup di dalam tanah sebagai saprofit pada sisa tanaman dan masuk fase saprogenesis, yang dapat menjadi sumber inokulum untuk menimbulkan penyakit pada tanaman lain. Penyebaran propagul dapat terjadi melalui angin, air tanah, serta tanah terinfeksi dan terbawa oleh alat pertanian dan manusia (Djaenuddin, 2011). Jamur Fusarium oxysporum juga dapat menyebar melalui biji tanaman, karena jamur ini juga dapat menginfeksi buah-buahan (Semangun, 2001).
13
2.3. Penyakit Layu Ralstonia (Ralstonia solanacearum)
Penyakit pada tanaman cabai sangat beragam, diantaranya peyakit layu bakteri. Penyakit tersebut disebabkan oleh bakteri Ralstonia solanacearum yang mempunyai banyak inang diantaranya Tomat (Licopersicon esculentum), Kentang (Solanum tuberosum L.), Kacang Tanah (Arachis hypogea), dan Cabai (Capsicum spp) (Harpenas dan Dermawan, 2010). Deny dan Hayward (2001), bahwa bakteri Ralstonia solanacearum dapat menyerang lebih dari 50 famili tanaman. Menurut Semangun (2001), bakteri Ralstonia solanacearum mempunyai inang lebih dari 140 jenis tanaman. Tumbuhan yang rentan terserang oleh bakteri ini antara lain Tampu (Macaranga tanarius), Sengon (Albazzia spp.), Kacang Tanah (Arachis hypogea), Cabai (Capsicum annum L.), Kedelai (Glycine max L Merill), Terung (Solanum mengolena), Wijen (Sesamum indicum), Tomat (Licopersicon esculentum), Kacang Panjang (Vigna unguiculata), dan Kacang Hijau (Vigna radiata).
2.3.1. Gejala Penyakit
Gejala khas yang ditimbulkan oleh bakteri ini adalah terjadinya kelayuan, tanaman menjadi kerdil dan penguningan daun, kemudian tanaman layu total dan mati. Pada tanaman cabai yang sudah tua, gejala layu terjadi pada daun yang bagian bawah, sedangkan pada tanaman cabai yang masih muda gejala layu mulai dari daun yang masih muda ke daun yang sudah tua. Semakin muda umur tanaman yang terserang maka gejala yang ditimbulkan semakin parah (Black, Green, Hartman dan Poulus, 2010). Tanaman cabai yang masih muda daunya mulai layu dari bagian pucuk, selanjutnya seluruh bagian tanaman layu mendadak dan mati (Duriat dkk., 2007).
Gambar 3. Gejala Penyakit Layu Bakteri yang Disebabkan oleh Ralstonia solanacearum pada Tanaman Cabai.
(Sumber : Duriat dkk., 2007)
Penyakit Ralstonia solanacearum, jika batang atau akar tumbuhan sakit dipotong melintang akan keluar lendir bakteri seperti susu kental yang disebut nenes (ooze). Lendir akan keluar lebih banyak jika batang atau akar ditekan atau diletakkan dalam ruangan yang lembab. Bakteri patogen menginfeksi melalui luka pada jaringan akar (Semangun, 2001). Gejala layu pada tanaman cabai terjadi mendadak dan akan menyebabkan kematian beberapa hari kemudian (Harpenas dan Dermawan, 2010).
2.3.2. Patogen Penyebab
Patogen penyebab penyakit layu Ralstonia solanacearum yaitu bakteri Ralstonia solanacearum. Bakteri ini mempunyai morfologi berbentuk batang lurus sampai melengkung, berukuran 0,5-1 x 1,5-4 um (Soesanto, 2008). Bakteri Ralstonia solanacearum tidak berspora, tidak berkapsul, bergerak dengan satu flagel (bulu cambuk) yang terdapat di ujung, aerob, gram negatif. Di atas medium agar-agar bakteri ini membentuk koloni yang keruh, berwarna kecoklatan, kecil, tidak beraturan, halus, berlendir dan bercahaya. Bakteri ini menghasilkan enzim
15
pektinmetilesterase (PME), poligalakturonase (PG), dan selulase (Cx) (Semangun, 2001). Bakteri ini tidak menghasilkan pigmen fluorescens dan tidak dapat tumbuh pada suhu di atas 40 oC (Deny dan Hayward, 2001).
Menurut Hayward, Prior, dan Allen (2005), bakteri Ralstonia solanacearum mempunyai peran penting dalam bidang pertanian. Bakteri ini dapat bertahan hidup dalam waktu yang lama di dalam air, tanah, dan tanaman maupun sisa-sisa tanaman. Kelangsungan hidup yang lama dan petumbuhan bakteri di pengaruhi oleh suhu, pH, kadar garam, ketersediaan nutrisi, persaingan/kompetisi, antagonis atau mikroorganisme yang bersifat parasit. Bakteri Ralstonia solanacearum dapat tumbuh dengan baik pada kisaran suhu 12 oC, 20 oC, dan 28 oC.
2.3.3. Siklus Hidup Patogen
Siklus hidup Ralstonia solanacearum merupakan bagian penting untuk menyusun strategi pengendalian. Secara ringkas, siklus hidup Ralstonia solanacearum dapat dimulai dari terjadinya infeksi patogen ke dalam akar, baik secara sendiri maupun melalui luka yang dibuat oleh nematoda peluka akar, atau akibat serangga dan alat-alat pertanian. Setelah berhasil masuk ke dalam jaringan akar, Ralstonia solanacearum akan berkembang biak di dalam pembuluh kayu (xylem) dalam akar dan pangkal batang, kemudian menyebar ke seluruh bagian tanaman. Akibat tersumbatnya pembuluh kayu oleh jutaan sel Ralstonia solanacearum, transportasi air dan mineral dari tanah terhambat sehingga tanaman menjadi layu dan mati (Supriadi 1994; Hartati dkk., 1994; Supriadi dkk., 1995 dalam Supriadi, 2011).
Bakteri Ralstonia solanacearum dapat meginfeksi akar-akar tanaman melalui luka yang terjadi pada waktu pemindahan, maupun langsung masuk ke bulu-bulu akar atau akar-akar yang masih muda dengan melarut dinding sel.
Infeksi secara langsung lebih banyak terjadi jika populasi bakteri dalam tanah semakin tinggi. Bakteri ini juga dapat menginfeksi melalui luka-luka karena tusukan nematoda akar, Meloidogyne sp., bahkan melalui tempat keluarnya akar-akar sekunder. Selain melalui akar-akar bakteri ini dapat menginfeksi melalui (stomata) lubang alami pada daun (Semangun, 2001).
Faktor lingkungan seperti suhu, kelembapan udara dan air, serta faktor kebugaran tanaman sangat memengaruhi perkembangan patogen. Ralstonia solanacearum berkembang pesat pada kondisi suhu udara 24-35°C, tetapi perkembangannya menurun pada suhu di atas 35°C atau di bawah 16°C (Ciampi dan Sequeira 1980 dalam Supriadi, 2011). Kenyataan ini dimanfaatkan untuk memproduksi benih kentang bebas Ralstonia solanacearum di dataran tinggi yang suhunya cukup dingin (Hayward, 1991 dalam Supriadi, 2011).
2.4. Pengendalian Hayati
Upaya pengendalian penyakit tanaman yang sering dilakukan oleh para petani yaitu penggunaan bahan pestisida sintetik. Penggunaan pestisida kimia tersebut untuk mengendalikan patogen-patogen yang sulit diatasi, seperti patogen tular tanah dan virus. Petani menggunakan pestisida tersebut sering melebihi dosis anjuran dan digunakan secara terus-menerus sehingga mengakibatkan akumulasi pestisida di tanah. Akumulasi pestisida yang tinggi menimbulkan dampak negatif terhadap lingkungan bahkan menimbulkan dampak negatif pada kesehatan manusia. Salah satu alternatif pengendalian yang ramah lingkungan adalah penggunaan agensia hayati (Taufik, 2008).
Pengendalian hayati penyakit tanaman mempunyai arti luas yaitu semua cara pengendalian penyebab penyakit atau pengaruh patogen tersebut yang berhubungan dengan keberadaan organisme lain selain manusia. Pengendalian hayati meliputi: 1) rotasi tanaman, cara pengolahan tanah, pemupukan dan
17
sebagainya yang dapat mempengaruhi kehidupan mikroba tanah, 2) memberikan langsung mikroba antagonis terhadap patogen atau yang sesuai dengan tanamanya, 3) penggunaan bahan kimia untuk mengubah mikroflora 4), pemuliaan tanaman untuk mendapatkan varietas tanaman yang tahan terhadap penyakit atupun hama (Campbell, 1989).
Pengendalian hayati merupakan upaya mengurangi kepadatan inokulum atau mengurangi kegiatan patogen atau parasit baik waktu aktif maupun dorman dengan menggunakan mikroorganisme lain yang dilakukan secara alami atau melalui manipulasi lingkungan, penyediaan benih sehat, rotasi tanaman, pengelolaan lahan yang baik, sanitasi lingkungan, penyediaan varietas tahan terhadap penyakit, dan penyediaan senyawa kimia penginduksi ketahanan tanaman (Supriadi, 2011).
Keberhasilan pengendalian hayati terhadap penyakit tanaman ditentukan oleh mekanisme penghambatan agensia pengendali hayatinya. Mekanisme penghambatan dari setiap agensia hayati berbeda, dan setiap agensia hayati dapat mempunyai lebih dari satu mekanisme penghambatan. Mekanisme penghambatan yang sering dijumpai pada agensia hayati adalah siderofor, antibiosis, persaingan/kompetisi, mikroparasitisme, PGPR, ketahanan terimbas, enzim dan toksin. Mekanisme antibiosis merupakan penghambatan patogen oleh senyawa metabolik yang dihasilkan oleh agensia hayati seperti: enzim, senyawa-senyawa volatile, zat pelisis dan senyawa-senyawa antibiotik lainnya. Siderofor merupakan senyawa organik selain antibiotik yang dapat berperan dalam pengendalian hayati penyakit tumbuhan (Soesanto, 2008).
2.5. Agensia Hayati Pseudomonad fluorescens
Bakteri Pseudomonas fluorescens dapat memberikan pengaruh yang menguntungkan terhadap perkembangan dan pertumbuhan tanaman yaitu
sebagai PGPR “Plant Growth Promoting Rhibacteria”. Bakteri ini juga menghasilkan siderofor yang dapat menghambat pertumbuhan patogen terutama patogen tular tanah dan mempunyai kemampuan mengkoloni akar tanaman. Bakteri Pseudomonas fluorescens mempunyai tipe interaksi dengan patogen berupa pesaing unsur hara, penghasil antibiotik, siderofor dan asam sianida (Soesanto, 2008).
Bakteri Pseudomonas flourescens termasuk kedalam bakteri yang dapat ditemukan dimana saja (ubiquitous), seringkali ditemukan pada bagian tanaman (permukaan daun dan akar) dan sisa tanaman yang membusuk, tanah dan air (Bradbury, 1986 dalam Supriadi, 2006). Ciri yang mencolok dan mudah dilihat dari Pseudomonas flourescens adalah kemampuannya menghasilkan pigmen pyoverdin dan atau fenazin pada medium King’s B sehingga terlihat berpijar bila terkena sinar UV. Pseudomonas flourescens telah dimanfaatkan sebagai agens hayati untuk beberapa jamur dan bakteri patogen tanaman.
Bakteri Pseudomonas fluorescens merupakan salah satu genus dari Famili Pseudomonadaceae. Bakteri ini berbentuk batang lurus atau lengkung, ukuran tiap sel bakteri 0.5-1.1 μ m x 1.5-4.0 μ m, tidak membentuk spora dan bereaksi negatif terhadap pewarnaan gram, aerob, menggunakan H2 atau karbon sebagai energinya, kebanyakan tidak dapat tumbuh dalam kondisi masam (pH 4,5) (Soesanto, 2008).
2.5.1. Potensi dan Kelebihan Bakteri Pseudomonad fluorescens
Menurut Soesanto (2008), Pseudomonas fluorescens merupakan pengkoloni akar yang agresif dan efektif, hal ini karena kebutuhan nutrisinya yang mudah karena mampu menggunakan berbagai sumber karbon serta kemampuanya untuk membentuk senyawa penghambat seperti HCN,
19
monoaceptil phloroglucinol, siderofor, 2,4-diaceptil phloroglucinol, piolutrin, asam salisilat, pyrolnitrin, altericidins dan cepacin.
Pseudomonas fluorescens banyak digunakan sebagai agensia hayati karena: 1) habitat alami bakteri ini adalah pada partikel bahan organik dan rizosfer, 2) mampu menggunakan berbagai sumber karbon, 3) laju pertumbuhan relatif cepat dibandingkan bakteri jenis lain, 4) kebutuhan nutrisi mudah, 5) merupakan bakteri pengkoloni akar yang agresif, 6) menghasilkan berbagai senyawa penghambat patogen tanaman dan 7) pengimbas ketahanan tanaman (Induced Systemic Resistance = ISR).
Metabolit sekunder yang dihasilkan oleh Pseudomonas fluorescens mempunyai peranan penting dalam pengendalian hayati penyakit tanaman. Siderofor merupakan metabolit sekunder yang berperan penting dalam pengendalian hayati, yang berfungsi menghambat pertumbuhan patogen atau membunuh langsung. Produksi metabolit sekunder sangat dipengaruhi oleh faktor lingkungan, seperti kimia tanah, suhu, kelembaban dan potensi air (Soesanto, 2008).
2.5.2. Pseudomonad fluorescens Sebagai Penekan Penyakit Layu
Wuryandari dkk. (2005), melaporkan bahwa diperoleh beberapa agensia Pseudomonad fluoresens yang berhasil menekan layu bakteri Ralstonia solanacearum pada tomat dan dapat memacu pertumbuhan tanaman. Hasil pengamatan terhadap indeks penyakit, isolat Pf-22 menunjukkan menghambat paling tinggi diikuti isolat Pf-81 dan Pf-142. Pada akhir pengamatan yaitu pada hari ke-30, indeks penyakit tanaman tomat yang diperlakukan dengan Pf-122 hanya mencapai 49,99 %, sedangkan kontrol sudah mencapai indeks penyakit 100 % pada hari ke-20. Pada pot yang diperlakukan dengan Pf-81 dan Pf-142, indeks penyakit pada akhir pengamatan berturut-turut adalah 61,33 % dan 66,67
%. Apabila dilihat perkembangan penyakitnya mulai dari hari ke-1 sampai ke-30, terlihat bahwa perkembangan penyakit layu pada tomat yang paling lambat adalah tomat yang diperlakukan dengan isolat Pf-122 kemudian diikuti Pf-81 dan Pf-142.
Hasil penelitian pada rumah kaca yang dilakukan oleh Krisnawan (2011), membuktikan bahwa perendaman akar tanaman cabai dengan Pseudomonad flourescens mampu menekan perkembangan serangan penyakit layu Fusarim sp., hasil akhir pengamatan rata – rata indeks penyakit pemberian isolat Pf 36 merupakan yang terbaik untuk menghambat Fusarium sp. pada tanaman cabai, kemudian diikuti oleh isolat Pf 160 dan Pf 122 yang indeks penyakitnya kurang dari 20 %.
2.5.3. Pseudomonad fluorescens Sebagai Pemacu Pertumbuhan
Bakteri Pseudomonas fluorescens yang hidup di daerah perakaran tanaman dapat berperan sebagai jasad renik pelarut fosfat (P), mengikat nitrogen (N), dan menghasilkan zat pengatur tumbuh (ZPT) tanaman. Kemampuan agensia hayati Pseudomonas fluorescens tersebut dapat dimanfaatkan sebagai pupuk biologis yang menyediakan unsur hara bagi tanaman (Baharuddin dkk., 2005).
Pseudomonas fluorescens adalah salah satu group mikroorganisme yang punya potensi untuk dikembangkan sebagai agensia hayati. Bakteri ini juga berperan sebagai pemacu pertumbuhan (Plant Growth Promoting Rhizobakteria = PGPR), karena menghasilkan zat pengatur tumbuh (ZPT) dan dapat pula meningkatkan ketersediaan hara melalui produksi asam organic (Linderman dan Paulizt, 1985 dalam Yanti, Gustian dan Rahma, 2009). Bakteri ini juga dapat berkembang biak dengan baik karena bersimbiosis dengan akar tanaman (Anonimus, 2013).
21
2.5.4. Aplikasi Agensia Hayati
Menurut Nurjanani (2011), bahwa metode aplikasi agensia hayati Pseudomonas fluorescens atau agensia hayati jenis lain masih banyak mengalami kendala baik secara in vitro maupun in vivo. Aplikasi agensia hayati yang efektif dilakukan yaitu dengan cara pencelupan dan cara penyiraman. Metode aplikasi ini dapat diterapkan pada bibit tanaman atau benih. Sementara Soesanto dkk. (2011), melaporkan bahwa aplikasi agensia hayati Pseudomonas fluorescens strain P60 yang diaplikasikan dengan perendaman maupun penyiraman bersamaan tanam pada bibit tanaman kentang mampu menurunkan intesitas penyakit layu pada tanaman kentang. Selain itu, metode penyiraman mempunyai kecenderungan menaikan berat tanaman dan hasil umbi tanaman kentang.
Teknik aplikasi suspensi agensia hayati Nematoda (Heterorhabditis sp.) dengan cara penyemprotan (spraying) mempunyai patogenisitas yang tinggi terhadap rayap tanah, dibuktikan dengan tingkat mortalitas yang tinggi pada rayap tanah (Djunaedy, 2011). Menurut Mugiastuti, Soesanto, dan Rahayuniati (2010), mengatakan bahwa metode aplikasi dengan penyiraman menggunakan formula cair Pseudomonas fluorecens pada tanaman tomat merupakan cara aplikasi yang terbaik, karena dapat meningkatkan tinggi tanaman 39,3%, panjang akar 21,5%, bobot kering tanaman 63%, serta cenderung lebih baik dalam menekan kejadian penyakit dan kepadatan populasi akhir pathogen.
22 3.1. Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Kesehatan Tanaman Fakultas Pertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur dan di lahan pertanian Desa Ketimang Kecamatan Wonoayu Kabupaten Sidoarjo, pada titik koordinat 07o26’32.05” LS dan 112o38’21.17” BT dengan ketinggian 8 mdpl, mulai awal bulan November sampai Desember 2013.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan dalam pelaksanaan penelitian yaitu, cangkul, bak perendaman, kamera, alat tulis, laminar airflow, pinset, jarum ose, tabung reaksi, beaker glass, lampu bunsen, erlenmeyer, oven, dan autoklaf.
3.2.2. Bahan
Bahan yang digunakan dalam pelaksanaan penelitian yaitu bibit tanaman cabai berumur 1 bulan, isolat Pseudomonad flourescens berasal dari eksplorasi Dr. Ir. Yenny Wuryandari, MP., aquadest steril, media King’s B, alkhohol 70%, alkhohol 90% dan pupuk NPK (16:16:16).
3.3. Metode Penelitian
Penelitian ini merupakan percobaan dua (2) faktor atau faktorial dengan menggunakan Rancangan Acak Kelompok (RAK). Faktor pertama macam isolat Pseudomonad flourescens (P) dengan empat level yaitu P0 (Aquadest), P1 (isolat Pf-B), P2 (isolat Pf-122), P3 (isolat Pf-160). Faktor kedua yaitu metode aplikasi (C) dengan 2 level yaitu C1 (metode perendaman) dan C2 (metode penyiraman). Kombinasi perlakuan dalam penelitian ini memperoleh 8 macam perlakuan dan diulang sebanyak 5 kali.
23
Perlakuan yang diperoleh dari kombinasi tersebut yaitu: - P0C1, bibit tanaman direndam dengan aquadest.
- P1C1, bibit tanaman direndam dengan agensia hayati Pf isolat B. - P2C1, bibit tanaman direndam dengan agensia hayati Pf isolat 122. - P3C1, bibit tanaman direndam dengan agensia hayati Pf isolat 160.
Perendaman bibit dilakukan selama 30 menit. - P0C2, aquadest dituangkan pada lubang tanam.
- P1C2, agensia hayati Pf isolat B dituangkan pada lubang tanam. - P2C2, agensia hayati Pf isolat 122 dituangkan pada lubang tanam. - P3C2, agensia hayati Pf isolat 160 dituangkan pada lubang tanam.
Suspensi yang digunakan 10 ml per lubang tanam, dengan konsentrasi 1010 CFU/ml.
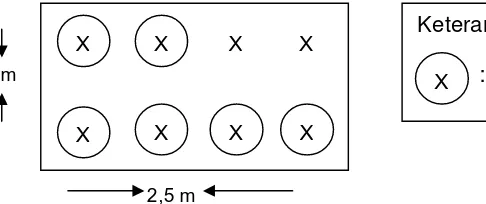
Gambar 4. Denah Percobaan Perlakuan dan Ulangan. T
3.4. Pelaksanaan
3.4.1. Survey Pendahuluan Lokasi Penelitian
Survey pendahuluan dilakukan di Desa Pilang dan Desa Ketimang, Kecamatan Wonoayu, Kabupaten Sidoarjo. Lokasi survey tersebut merupakan daerah sentra tanaman hortikultura yang salah satunya adalah tanaman cabai. Survey dilakukan dengan cara menginventarisasi tanaman cabai yang menunjukkan gejala penyakit layu di areal pertanaman cabai. Pengamatan di lapang dilakukan secara visual terhadap tanaman cabai yang menunjukkan gejala penyakit layu, setelah mendapatkan tanaman yang terserang penyakit layu maka lokasi tersebut ditentukan sebagai lahan penelitian.
3.4.2. Penyiapan Lahan
Lahan yang digunakan untuk penelitian merupakan lahan pertanian yang setiap tahun ditanami tanaman cabai. Luas lahan yang digunakan yaitu berukuran 6 m X 25 m. Penyiapan lahan untuk penelitian meliputi dari pengolahan tanah sampai membuat petakan. Lahan terlebih dahulu dibersihkan dari gulma yang tumbuh dengan menggunakan cangkul, kemudian diolah menggunakan cangkul agar tanah menjadi gembur serta aerasi menjadi baik. Tanah yang sudah diolah kemudian dibentuk petakan dengan ukuran 1 m X 2,5 m. Setiap petakan diberi pembatas saluran drainase dengan lebar 0,2 m.
3.4.3. Penyiapan Bibit Cabai
Bibit cabai yang digunakan untuk penelitian ini merupakan jenis cabai merah (besar). Bibit yang digunakan berumur sekitar 1 bulan, dengan jumlah daun sekitar 5-6 helai. Bibit tanaman dipilih yang tumbuh baik dengan tinggi tanaman yang seragam (sama).
25
3.4.4. Pembuatan Media King’s B
Bahan yang digunakan untuk pembuatan media King’s B yaitu: - 20 gr Protease pepton - 1,5 gr K2HPO4
- 10 ml Gliserol - 15 gr Agar - 1,5 gr MgSO47H2O - 1 liter air steril
Cara pembuatannya yaitu semua bahan dimasukan ke dalam beaker glass kemudian mengaduk sampai homogen sambil memanaskan diatas hotplate. Setelah panas menyesuaikan pH (keasaman) media menjadi 7 (netral). Kemudian mensterilkan media di dalam autoklaf pada suhu 121o C selama 25 menit.
3.4.5. Pembiakan Bakteri Pseudomonad fluorescens
Pembiakan Bakteri Pseudomonad fluorescens dilakukan di Laboratorium Kesehatan Tanaman Fakultas Pertanian UPN “veteran” Jatim. Adapun langkah – langkah pembiakan bakteri sebagai berikut:
a. Menyiapkan semua peralatan dan media yang sudah disterilisasi serta isolat bakteri Pseudomonad fluorescens.
b. Membiakan bakteri dari biakan murni untuk dipindahkan ke media King’s B yang sudah disterilkan di dalam laminar airflow.
c. Hasil isolasi bakteri Pseudomonad fluorescens pada tabung reaksi diinkubasikan selama 48 jam pada suhu ruangan (Gambar 5).
d. Bakteri yang sudah berumur 48 jam kemudian disuspensikan menggunakan air steril dengan konsentrasi 1010 CFU/ml dan dimasukkan ke dalam air steril pada bak perendaman.
e. Suspensi agensia hayati Pseudomonad fluorescens tersebut siap diaplikasikan di lahan tanaman cabai.
Gambar 5. Perbanyakan Isolat Bakteri Pseudomonad fluorescens pada Media King’s B. 3.4.6. Aplikasi Agensia Hayati Pseudomonad fluorescens
a. Penyiapan Suspensi
Isolat Pseudomonad fluorescens yang diinkubasikan selama 48 jam, kemudian disuspensikan dengan konsentrasi 1010 CFU/ml. Setiap tabung reaksi yang berisi isolat Pseudomonad fluorescens disuspensikan menggunakan air aquadest sebanyak 60 ml. Suspensi Pseudomonad fluorescens yang diperlukan untuk untuk perendaman bibit tanaman cabai sebanyak 1200 ml pada masing-masing perlakuan, sedangkan untuk perakuan dengan metode penyiraman membutuhkan suspensi 400 ml setiap perlakuan. Isolat Pseudomonad fluorescens yang diperlukan untuk membuat suspensi tersebut sebanyak 27 tabung pada setiap isolat, jumlah tabung reaksi yang digunakan sebanyak 81 tabung reaksi.
27
Gambar 6. Suspensi Agensia Hayati Pseudomonad fluorescens pada Masing-Masing Isolat b. Penanaman Bibit Cabai
Penanaman bibit cabai dilakukan pada sore hari untuk menghindari sinar matahari langsung pada siang hari, sebelum melakukan penanaman terlebih dahulu membuat lubang tanam dengan jarak 50 cm X 80 cm. Penanaman pada metode perendaman, bibit tanaman cabai direndam menggunakan suspensi agensia hayati Pseudomonad flourescens selama 30 menit pada bak perendaman, sedangkan pada metode penyiraman masing-masing lubang tanam diberikan 10 ml suspensi Pseudomonad fluorescens.
Gambar 7. a. Perendaman Bibit Cabai Menggunakan Suspensi Pseudomonad fluorescens, b. Penyiraman Suspensi Pseudomonad fluorescens pada Lubang Tanam.
a b
Setiap perlakuan terdapat lima kali ulangan dan setiap ulangan membutuhkan 8 tanaman sehingga untuk delapan (8) kali perlakuan membutuhkan 320 tanaman, sedangkan untuk tanaman border (tepi) membutuhkan 124 tanaman. Setiap ulangan yang terdiri dari 8 tanaman diambil 6 tanaman sampel, berikut ini denah pengambilan tanaman sampel (Gambar 8).
Gambar 8. Denah Tanaman Sampel.
3.4.7. Pemeliharaan Tanaman Cabai
Pemupukan tanaman cabai dilakukan sebanyak dua kali, pupuk yang digunakan adalah pupuk NPK (16:16:16) dengan dosis 5 gram/tanaman. Pemupukan pertama dilakukan setelah tanaman berumur 1 minggu setelah tanam (HST) ½ dosis yaitu 2,5 gram/tanaman. Pemupukan susulan dilaksanakan setelah tanaman berumur 3 minggu setelah tanam ½ dosis. Cara pemberian pupuk yaitu dengan cara ditugal kemudian ditutup dengan tanah.
Pengendalian gulma dilakukan saat tanaman cabai berumur 2 minggu setelah tanam (HST). Pengendalian gulma dilakukan secara mekanis yaitu dengan menggunakan cangkul. Apabila tidak dilakukan pengendalian gulma, maka pertumbuhan tanaman cabai akan terganggu. Pengendalian yang kedua dilakukan apabila sudah mulai tumbuh gulma.
Pengairan dilakukan pada sore hari dengan interval penyiraman 1 hari, atau melihat kondisi tanah di lokasi penelitian. Air yang digunakan adalah air sumur yang ada di lahan pertanian.
X X X X
29
3.5. Pengamatan
Parameter yang diamati pada penelitian ini adalah sebagai berikut: 1. Masa Inkubasi
Pengamatan inkubasi yaitu dengan cara mengamati gejala awal munculnya penyakit setelah penanaman cabai di lapang.
2. Indeks Penyakit (satuan %)
Pengamatan perkembangan gejala layu pada tanaman cabai dengan interval waktu pengamatan setiap 5 hari sampai hari ke – 30 setelah tanam.
Berat serangan dihitung menurut skala seperti yang digunakan oleh Arwiyanto (1994), sebagai berikut:
a) 0 adalah tidak ada serangan
b) 1 adalah 1 % sampai dengan 10 % daun layu c) 2 adalah 11 % sampai dengan 30 % daun layu d) 3 adalah 31% sampai dengan 60 % daun layu e) 4 adalah 61 % sampai dengan 99 % daun layu f) 5 adalah 100 % daun layu.
Besarnya indeks penyakit dihitung dengan rumus (Djatnika et al., 2012) dalam Krisnawan (2012) sebagai berikut:
X 100%
Keterangan :
I = Indeks Penyakit
nk = Jumlah tanaman yang bergejala sakit dengan skala (k) (0,1,2,3,4,5) N = Jumlah tanaman yang diamati
Z = Kategori serangan tertinggi
3. Panjang perubahan warna jaringan pangkal batang ( satuan cm).
Pengukuran panjang gejala penyakit pada pangkal batang tanaman cabai pada hari ke – 30. Pengamatan ini dilakukan untuk mengetahui perbedaan perubahan warna jaringan pangkal batang pada masing-masing perlakuan. Pengamatan dilakukan dengan cara membelah batang secara vertikal, apabila ada perubahan warna jaringan kemudian mengukur panjang perubahan tersebut menggunakan penggaris.
4. Tinggi tanaman cabai (satuan cm).
Pengamatan tinggi tanaman pada hari ke – 30 untuk megetahui perbedaan pertumbuhan pada setiap tanaman pada masing-masing perlakuan yang diberi isolat Pf yang berbeda serta kontrol. Cara pengukuran tanaman yaitu mulai bagian pangkal batang tanaman (permukaan tanah) sampai titik tumbuh tanaman.
5. Panjang akar tanaman cabai (satuan cm).
Pengukuran panjang akar tanaman cabai dilakukan pada hari ke – 30, setelah tanaman dicabut (destruktif). Pengukuran panjang akar mulai dari pangkal batang tanaman sampai akar yang terpanjang.
6. Rata-rata jumlah daun tanaman cabai pada hari ke – 30 (satuan helai).
Rata-rata jumlah daun tanaman cabai digunakan sebagai salah satu indikator pertumbuhan tanaman, serta untuk mengetahui perlakuan mana yang paling baik terhadap pertumbuhan daun tanaman cabai. Daun tanaman yang diamati yaitu semua daun yang telah membuka sempurna.
31
7. Berat kering daun tanaman cabai (satuan gram).
Penimbangan berat kering daun tanaman cabai dilakukan pada hari ke – 30. Penimbangan berat kering ini bertujuan untuk mengetahui isolat Pf mana yang baik untuk memacu pertumbuhan daun tanaman cabai. Penimbangan berat kering daun dilakukan dengan cara mengambil semua daun tanaman beserta tangkai, kemudian mengoven semua daun tanaman selama 2 x 24 jam pada suhu 60 oC.
8. Berat kering akar tanaman cabai (satuan gram).
Pengukuran berat kering akar tanaman cabai dilakukan pada hari ke – 30. Pengukuran berat kering akar tanaman ini bertujuan untuk mengetahui perlakuan mana yang baik terhadap pertumbuhan akar tanaman cabai serta sebagai indikator tingkat serangan penyakit layu tanaman cabai. Pengukuran berat kering akar tanaman cabai dengan cara memotong pangkal batang sampai semua akar yang ikut tercabut, kemudian mengoven akar tanaman cabai selama 2 x 24 jam pada suhu 60 oC, kemudian menimbang akar untuk mengetahui berat kering.
3.6. Analisa Data
Data yang diperoleh dianalisa dengan teknik Anova (Analisis Variansi) dengan kriteria pengujian hipotesis adalah sebagai berikut:
F hitung ≥ F tabel, maka H0 ditolak. F hitung < F tabel, maka H0 diterima.
Jika hasil analisa menunjukkan F hitung > F tabel maka dilanjutkan uji perbandingan rata – rata hasil dengan uji Beda Nyata Jujur (BNJ 5 %).
32 4.1. Hasil Survey Pendahuluan Lokasi Penelitian
Hasil survey pendahuluan yang dilakukan di Desa Pilang dan Desa Ketimang, Kecamatan Wonoayu, Kabupaten Sidoarjo menunjukkan bahwa pada daerah tersebut terdapat serangan penyakit layu pada tanaman cabai. Hal tersebut dibuktikan dengan ditemukanya tanaman cabai dewasa yang layu pada areal pertanaman (Gambar 9). Sementara berdasarkan informasi petani di desa tersebut setiap tahun terjadi serangan penyakit layu pada tanaman cabai, walaupun intensitas serangannya tidak terlalu tinggi.
Gambar 9. Tanaman Cabai Dewasa yang Terserang Penyakit Layu.
Menurut Duriat dkk. (2007), penyakit layu pada tanaman cabai baik yang disebabkan oleh jamur Fusarium oxysporum maupun bakteri Ralstonia solanacearum dapat menyerang pada fase vegetatif dan generatif. Serangan penyakit layu bakteri pada tanaman cabai yaitu daunya mulai layu dari bagian bawah, selanjutnya seluruh tanaman layu mendadak dan mati. Semangun (2001), menjelaskan bahwa kelayuan akibat penyakit jamur Fusarium sp. didahului dengan menguningnya daun, terutama daun-daun tua menuju ke daun muda.
33
4.2. Pengaruh Pseudomonad fluorescens dan Metode Aplikasi Terhadap Perkembangan Penyakit
4.2.1. Masa Inkubasi
Masa inkubasi merupakan waktu awal munculnya gejala penyakit pada tanaman, dengan satuan hari. Pada penelitian ini pengamatan masa inkubasi dilakukan setiap hari setelah tanam bibit sampai munculnya gejala penyakit layu pada tanaman cabai. Gejala penyakit layu kompleks pada tanaman cabai terlihat dengan dimulainya daun tanaman layu dari daun tertua menuju daun muda (dapat dilihat pada Gambar 10. a) dengan membandingkan daun tanaman sehat sebagai kontrol (dapat dilihat pada Gambar 10. b). Masa inkubasi yaitu dihitung sejak aplikasi sampai munculnya gejala pertama, dalam satuan hari setelah inokulasi (Soesanto dkk., 2011). Menurut Semangun (2001), kelayuan akibat penyakit layu Fusarium sp. didahului dengan menguningnya daun, terutama daun-daun tua menuju ke daun muda. Sementara Duriat dkk. (2007), melaporkan bahwa serangan penyakit layu bakteri pada tanaman cabai yaitu daunya mulai layu dari bagian bawah, selanjutnya seluruh tanaman layu mendadak dan mati.
Gambar 10. (a) Gejala Daun Layu pada Tanaman Cabai, (b) Daun Tanaman Sehat.
a b
Berdasarkan hasil analisis sidik ragam memperlihatkan bahwa kombinasi antara isolat Pseudomonad fluorescens dengan metode aplikasi tidak menunjukkan interaksi yang nyata terhadap masa inkubasi tanaman cabai. Pemberian Pseudomonad fluorescens terhadap masa inkubasi penyakit layu pada tanaman cabai di lahan menunjukkan hasil berpengaruh sangat nyata, sedangkan metode aplikasi agensia hayati Pseudomonad fluorescens tidak berpengaruh nyata terhadap masa inkubasi tanaman cabai (data ditunjukan pada Lampiran 1. Tabel 1).
Tabel 3. Rata-rata Masa Inkubasi Penyakit Layu pada Tanaman Cabai.
Perlakuan Rata-rata Masa Inkubasi (hari)
Aquadest 6 a
Keterangan : Angka-angka pada kolom yang didampingi oleh huruf yang sama menunjukan tidak berbeda nyata pada uji BNJ 5 %.
Pada uji beda nyata jujur 5 % rata-rata masa inkubasi penyakit layu menunjukkan bahwa perlakuan menggunakan Pseudomonad fluorescens mampu menunda munculnya gejala penyakit layu pada tanaman cabai di lahan. Perlakuan kontrol paling cepat menunjukkan gejala penyakit layu pada tanaman cabai yaitu pada 6 hari setelah tanam. Perlakuan menggunakan Pseudomonad fluorescens isolat Pf 122, Pf 160 dan Pf B menunjukkan gejala secara berturut-turut pada 9, 8, dan 7 hari setelah tanam. Perlakuan menggunakan Pf 122 mampu menunda menculnya gejala penyakit selama 3 hari, kemudian diikuti dengan Pf 160, Pf B, yang berturut-turut mampu menunda 2 hari dan 1 hari dibandingkan dengan kontrol. Perlakuan metode aplikasi Pseudomonad
35
fluorescens tidak berpengaruh nyata pada uji beda nyata jujur 5 % terhadap masa inkubasi penyakit layu tanaman cabai (dapat dilihat pada Tabel 3). Metode aplikasi perendaman menunjukkan gejala penyakit pada hari ke-7 setelah tanam, sedangkan pada penyiraman menunjukkan gejala pada hari ke-8 setelah tanam.
Gambar 11. Diagram Masa Inkubasi Penyakit Layu Tanaman Cabai.
Berdasarkan (Gambar 11) dapat dilihat bahwa rata-rata perlakuan kontrol dengan metode perendaman menunjukkan awal munculnya gejala penyakit pada hari ke-5 setelah aplikasi di lahan. Perlakuan yang menunjukkan gejala penyakit muncul paling lambat adalah perlakuan isolat Pseudomonad fluorescens 122 dengan metode penyiraman yaitu mampu menunda munculnya gejala selama 3 hari. Rata-rata munculnya gejala penyakit pada perlakuan Pf 122 baik pada metode perendaman maupun penyiraman pada hari ke-8 setelah aplikasi dan diikuti pada perlakuan Pf 160 metode penyiraman, Pf 160 dengan perendaman, Pf B dengan metode perendaman dan penyiraman, berturut-turut mampu menunda masa inkubasi selama 3, 2, 2, dan 1 hari setelah aplikasi di lahan.
Pemberian isolat Pseudomonad fluorescens pada tanaman cabai di lahan mampu menunda munculnya gejala penyakit layu pada tanaman cabai. Agensia
hayati Pseudomonad fluorescens mungkin dapat menghasilkan suatu senyawa penghambat yang dapat menghambat patogen-patogen sebelum masuk ke dalam jaringan tanaman. Senyawa penghambat yang dihasilkan oleh Pf 122, Pf 160 dan Pf B diduga mampu memperlambat munculnya gejala penyakit layu pada tanaman cabai. Agensia hayati Pseudomonad fluorescens yang diaplikasikan di daerah perakaran tanaman cabai dapat menunda munculnya gejala penyakit layu yang disebabkan oleh patogen-patogen di lahan. Hal tersebut sesuai dengan hasil penelitian Baharuddin dkk. (2005), bahwa Pseudomonas spp. kelompok fluorescens mampu berkolonisasi dengan akar secara baik, sehingga akan menghambat patogen masuk ke dalam jaringan tanaman. Menurut Soesanto (2008), metabolit sekunder yang dihasilkan oleh Pseudomonas fluorescens mempunyai peranan penting dalam pengendalian hayati penyakit tanaman. Siderofor merupakan metabolit sekunder yang berperan penting dalam pengendalian hayati, yang berfungsi menghambat pertumbuhan patogen atau membunuh langsung.
4.2.2. Indeks Penyakit
Berdasarkan hasil analisis sidik ragam memperlihatkan bahwa kombinasi perlakuan antara isolat Pseudomonad fluorescens dengan metode aplikasi tidak menunjukkan interaksi yang nyata terhadap indeks penyakit tanaman cabai dari awal sampai akhir pengamatan. Pemberian agensia hayati Pseudomonad fluorescens di lahan berpengaruh sangat nyata terhadap indeks penyakit layu tanaman cabai pada hari 10, 15, 20, 25 dan 30 hari setelah aplikasi, sedangkan pada hari ke-5 setelah aplikasi tidak menunjukkan hasil berbeda nyata. Metode aplikasi Pseudomonad fluorescens tidak menunjukkan hasil yang berbeda nyata pada hari ke-5 sampai hari ke-20 setelah aplikasi, akan tetapi berpengaruh nyata pada hari ke-25 dan 30 setelah aplikasi (data dapat dilihat pada Lampiran 1, 2,