PENGUKURAN AKTIVITAS PROTEASE
Oleh :
Nama : Shinta Prabawati
NIM : B1J014049
Rombongan : II Kelompok : 2
Asisten : Ristiandani Riana P.
LAPORAN PRAKTIKUM FISIOLOGI NUTRISI
KEMENTERIAN RISET, TEKNOLOGI, DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI PURWOKERTO
I. PENDAHULUAN
1.1 Latar Belakang
Bahan pangan secara garis besar tersusun dari 2 komponen utama, yaitu organik dan anorganik. Komponen organik dibagi lagi, ada yang dalam jumlah besar seperti karbohidrat, protein, dan lemak, adapula yang sedikit seperti vitamin, enzim,
emulsifier, asam, oksidan, pigmen, dan komponen citarasa. Komponen anorganik
yaitu berbagai bentuk mineral, dan air. Bahan-bahan makanan di atas tidak dapat diserap dalam bentuk alami melalui mukosa saluran pencernaan dan karena alasan ini, bahan-bahan tersebut tidak berguna sebagai zat nutrisi tanpa proses pencernaan, baik pencernaan mekanik maupun pencernaan kimiawi. Proses pencernaan kimiawi sesungguhnya sangat sederhana, karena pada ketiga jenis zat makanan utama (karbohidrat, protein, dan lemak) terjadi proses hidrolisis dasar yang sama (Guyton & Hall, 1997).
Protein berguna sebagai zat pembangun (untuk pertumbuhan dan mengganti sel-sel yang rusak), sebagai penghasil energi (bukan sumber energi utama), membuat substansi penting (seperti enzim dan hormon yang membantu proses metabolisme), dan menjaga keseimbangan pH tubuh. Protein dipecah menjadi asam amino oleh enzim protease. Enzim protease dalam makhluk hidup dapat dijumpai pada saluran pencernaannya terutama pada usus (Hidayati, 2007).
Usus halus merupakan tempat terjadinya absorbsi makanan, karena itulah dapat dikatakan bahwa sebenarnya pencernaan makanan secara kimiawi berpusat di usus halus (intestinum), terutama pada spesies ikan. Hal tersebut dikarenakan proses pencernaan kimiawi pada ikan baru di mulai di bagian ususnya karena rongga mulut ikan tidak memilki kelenjar saliva yang mampu menghasilkan amilase saliva. Percobaan kali ini dilakukan untuk mengetahui aktivitas protease pada ikan yang dipuasakan dan yang diberi makan (Hidayati, 2007).
Ikan yang digunakan pada percobaan kali ini yakni ikan lele (Clarias
batrachus) dan ikan nilem (Osteochilus vittatus). Ikan lele dan ikan nilem merupakan
ikan air tawar yang sudah banyak dibudayakan. Ikan tersebut digunakan sebagai bahan percobaan karena keberadaannya yang melimpah di alam, selain itu ukuran tubuh kedua ikan ini cukup besar sehinga mempermudah dalam mengisolasi usunya (Alamsjah & Rahardjo, 1977).
1.2 Tujuan
Tujuan praktikum acara Pengukuran Aktivitas Protease pada Ikan Lele (Clarias batrachus) dan Ikan Nilem (Osteochilus vittatus) adalah mengetahui perbedaan kapasitas pencernaan ikan yang terukur sebagai aktivitas protease pada ikan yang memperoleh asupan pakan dengan kualitas berbeda.
II. MATERI DAN CARA KERJA
2.1 Materi
Alat yang digunakan pada percobaan ini yaitu tabung reaksi, tabung eppendorf, mikropipet, yellow tip, refrigerator, inkubator, spektrofotometer, homogenizer, sentrifugator, dan kamera.
Bahan yang digunakan meliputi kertas tisu, ekstrak enzim dari ikan Nilem (Osteochilus vittatus) dan ikan Lele (Clarias batrachus), substrat kasein 1%, reagen TCA 8%, akuabides , dan buffer Tris HCl 50mM.
2.2 Cara Kerja
Metode yang digunakan pada percobaan kali ini yakni:
1. Dua buah tabung reaksi untuk blanko dan 4 untuk sampel disiapkan. 2. Buffer Tris-HCl sebanyak 350µL dipipetkan ke dalam masing-masing
tabung.
3. Ekstrak enzim dari ikan puasa dan makan dipipetkan sebanyak 50µL ke dalam tabung sampel (masing-masing 2 tabung).
4. Semua tabung diinkubasi selama 10 menit pada suhu 37˚C.
5. Substrat kasein 1% sebanyak 350µL dipipetkan ke masing-masing tabung. 6. Diinkubasi selama 20 menit pada suhu 37˚C.
7. Asam trikloroasetat (TCA) 8% sebanyak 750 µL dipipetkan ke dalam masing-masing tabung.
8. Ekstrak enzim sebanyak 50 µL dipipetkan ke dalam tabung blanko. 9. Semua tabung dimasukkan ke dalam refrigerator selama kurang lebih 15
menit.
10. Campuran reaksi disentrifugasi dengan kecepatan 6000 rpm selama 10 menit.
11. Supernatan sebanyak 1000 µL diambil dan dimasukkan dalam tabung berisi akuabides 1500 µL.
12. Campuran reaksi divortex hingga homogen.
13. Absorbansi campuran reaksi diukur pada panjang gelombang 280 nm. 14. Aktivitas protease dihitung menggunakan kurva standard tirosin yang
III. HASIL DAN PEMBAHASAN
3.1 Hasil
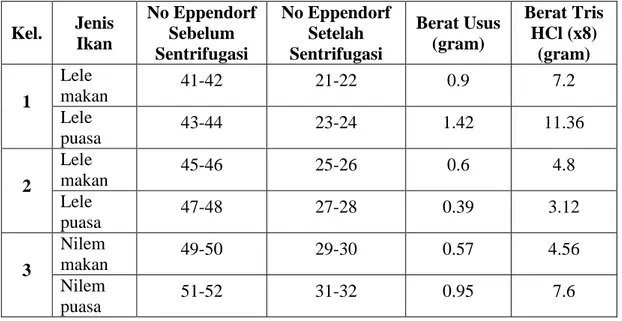
Tabel 1. Berat Usus dan Berat Tris HCl Ikan Makan dan Ikan Puasa
Kel. Jenis Ikan No Eppendorf Sebelum Sentrifugasi No Eppendorf Setelah Sentrifugasi Berat Usus (gram) Berat Tris HCl (x8) (gram) 1 Lele makan 41-42 21-22 0.9 7.2 Lele puasa 43-44 23-24 1.42 11.36 2 Lele makan 45-46 25-26 0.6 4.8 Lele puasa 47-48 27-28 0.39 3.12 3 Nilem makan 49-50 29-30 0.57 4.56 Nilem puasa 51-52 31-32 0.95 7.6 Keterangan:
Berat Usus : Berat Tris HCl = 1 : 8
Tabel 2. Hasil Absorbansi Blanko dan Sampel Protease Ikan Makan dan Ikan Puasa
No Tabung Absorbansi Konsentrasi
31 0.265 104.132 32 0.264 103.932 33 0.167 47.462 34 0.174 51.262 35 0.154 39.402 36 0.115 16.907 37 0.200 66.597 38 0.234 86.518 39 0.179 54.172 40 0.224 80.719 41 0.186 58.535
42 0.186 58.081 43 1.048 561.415 44 0.593 296.004 45 0.159 42.451 46 0.779 404.022 47 0.688 350.924 48 0.333 144.133 Keterangan:
= Blanko kelompok 1, 2, dan 3
= Sampel kelompok 1 ikan makan dan puasa = Sampel kelompok 2 ikan makan dan puasa = Sampel kelompok 3 ikan makan dan puasa
Tabel 3. Hasil Absorbansi Larutan Standar
Nomor Absorbansi Konsentrasi
1 0.125 25.000 2 0.144 50.000 3 0.306 100.000 4 0.422 200.000 5 0.762 400.000 Perhitungan kelompok 2
Aktivitas enzim dalam konsentrasi (x) = 𝑠𝑎𝑚𝑝𝑒𝑙 1 + 𝑠𝑎𝑚𝑝𝑒𝑙 2
2 − 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑏𝑙𝑎𝑛𝑘𝑜
Aktivitas enzim dalam menit = 𝑥
𝑤𝑎𝑘𝑡𝑢 𝑖𝑛𝑘𝑢𝑏𝑎𝑠𝑖 (20 𝑚𝑒𝑛𝑖𝑡) A. Ikan makan X = 𝑠𝑎𝑚𝑝𝑒𝑙 1 + 𝑠𝑎𝑚𝑝𝑒𝑙 2 2 − 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑏𝑙𝑎𝑛𝑘𝑜 =66.597 + 86.518 2 − 54.172 = 76.558 – 54.172 = 22.386 mikrogram
Aktivitas enzim dalam menit = 𝑥 𝑤𝑎𝑘𝑡𝑢 𝑖𝑛𝑘𝑢𝑏𝑎𝑠𝑖 (20 𝑚𝑒𝑛𝑖𝑡) = 22.386 20 = 1.119 mikrogram/menit B. Ikan puasa X = 𝑠𝑎𝑚𝑝𝑒𝑙 1 + 𝑠𝑎𝑚𝑝𝑒𝑙 2 2 − 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑏𝑙𝑎𝑛𝑘𝑜 =80.719 + 58.535 2 − 58.081 = 69.627 – 58.081 = 11.546 mikrogram
Aktivitas enzim dalam menit = 𝑥
𝑤𝑎𝑘𝑡𝑢 𝑖𝑛𝑘𝑢𝑏𝑎𝑠𝑖 (20 𝑚𝑒𝑛𝑖𝑡)
= 11.546
20
3.2 Pembahasan
Enzim merupakan senyawa protein yang berfungsi sebagai katalisator reaksi-reaksi kimia yang terjadi dalam sistem biologi makhluk hidup karena itulah enzim sering disebut biokatalisator dalam sistem biologi. Katalisator adalah suatu zat yang mempercepat reaksi kimia, tetapi tidak mengubah kesetimbangan reaksi atau tidak mempengaruhi hasil akhir reaksi. Zat itu sendiri (enzim) tidak ikut dalam reaksi sehingga bentuknya tetap atau tidak berubah. Tanpa adanya enzim, reaksi-reaksi kimia dalam tubuh akan berjalan lambat. Sifat-sifat enzim selain sebagai biokatalisator dan sebagai suatu protein, enzim mempunyai sifat yaitu berperan tidak bolak-balik. Artinya enzim dapat bekerja menguraikan suatu substrat menjadi substrat tertentu dan tidak sebaliknya dapat menyusun substrat sumber dari hasil penguraian, misalya enzim
protease dapat menguraikan protein menjadi asam amino, tetapi tidak menggabungkan
asam aminonya menjadi protein (Winarno, 1995).
Protease adalah enzim-enzim yang mengkatalisis pemecahan protein. Pemecahan Protein adalah proses normal yang diperlukan untuk mempertahankan homeostasis seluler. Protease yang aktif dapat ditemukan di seluruh tubuh, termasuk saluran pencernaan, di dalam sel dan beredar dalam darah. Menurut ” Biochemistry: A Case-Oriented Approach”, protease mengkatalisis proteolisis, proses ireversibel yang memecah protein menjadi asam amino komponennya. Proteolisis memotong ikatan peptida antara asam amino dalam protein. Asam amino bebas dan fragmen protein yang lebih kecil adalah produk dari aktivitas protease (Winarno, 1995).
Protease, disebut juga peptidase atau proteinase, merupakan enzim golongan hidrolase yang akan memecah protein menjadi molekul yang lebih sederhana, seperti menjadi oligopeptida pendek atau asam amino,dengan reaksi hidrolisis pada ikatan peptida. Enzim ini diperlukan oleh semua makhluk hidup karena bersifat esensial dalam metabolisme protein. Peranannya dalam tubuh antara lain membantu pencernaan protein dalam makanan, menggunakan kembali protein-protein intraseluler, koagulasi sel darah, dan akivasi berbagai jenis protein, enzim, hormon, serta neurotransmiter (Winarno, 1995).
Menurut Guyton dan Hall (1997), faktor-faktor utama yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, substrat, pH, suhu, senyawa inhibitor dan aktivator. Faktor lain yang juga berpengaruh diantaranya berat molekul, titik isoelektrik dan struktur enzim tersebut untuk mengetahui golongan fungsional
padalokasi aktif dan urutan asam amino enzim. Berikut ini adalah penjelasan dari faktor-faktor utama yang mempengaruhi kerja enzim protease:
1. Suhu
Semua enzim membutuhkan suhu yang cocok agar dapat bekerja dengan baik. Laju reaksi biokimia meningkat seiring kenaikan suhu. Hal ini karena panas meningkatkan energi kinetik dari molekul sehingga menyebabkan jumlah tabrakan diantara molekul-molekul meningkat. Dalam kondisi suhu rendah, reaksi menjadi lambat karena hanya terdapat sedikit kontak antara substrat dan enzim. Suhu yang ekstrim juga tidak baik untuk enzim. Pengaruh suhu yang sangat tinggi akan menyebabkan molekul enzim terdistorsi, sehingga laju reaksi pun jadi menurun. Enzim yang terdenaturasi gagal melaksanakan fungsi normalnya.
2. Nilai pH
Efisiensi suatu enzim sangat dipengaruhi oleh nilai pH atau derajat keasaman sekitarnya. Ini karena muatan komponen asam amino enzim berubah bersama dengan perubahan nilai pH. Kebanyakan enzim tetap stabil dan bekerja baik pada kisaran pH 6 dan 8, tapi ada beberapa enzim tertentu yang bekerja dengan baik hanya di lingkungan asam atau basa. Nilai pH yang menguntungkan bagi enzim tertentu sebenarnya tergantung pada sistem biologis tempat enzim tersebut bekerja. Ketika nilai pH menjadi terlalu tinggi atau terlalu rendah, maka struktur dasar enzim dapat mengalami perubahan, sehingga sisi aktif enzim tidak dapat mengikat substrat dengan benar. Hal tersebut menyebabkan enzim tidak dapat melakukan aktivitasnya dengan benar, bahkan enzim dapat sampai benar-benar berhenti berfungsi.
3. Konsentrasi Substrat
Konsentrasi substrat yang lebih tinggi berarti lebih banyak jumlah molekul substrat yang terlibat dengan aktivitas enzim yang akan meningkatkan kerja enzim. Konsentrasi substrat yang rendah berarti lebih sedikit jumlah molekul substrat yang dapat melekat pada enzim, menyebabkan berkurangnya aktivitas enzim. Laju enzimatik yang sudah mencapai maksimum dan enzim sudah dalam kondisi paling aktif menyebabkan peningkatan konsentrasi substrat tidak akan memberikan perbedaan dalam aktivitas enzim. Sisi aktif semua enzim dalam kondisi ini terus terdapat substrat, sehingga tidak ada tempat untuk substrat ekstra.
4. Konsentrasi Enzim
Semakin besar konsentrasi enzim maka kecepatan reaksi akan semakin cepat. Konsentrasi enzim berbanding lurus dengan kecepatan reaksi, tentunya selama masih
ada substrat yang perlu diubah menjadi produk. Konsentrasi enzim yang banyak akan meningkatkan kecepatan reaksi, begitupula sebaliknya.
5. Aktivator & Inhibitor
Aktivator merupakan molekul yang membantu enzim agar mudah berikatan dengan substrat. Inhibitor adalah substansi yang memiliki kecenderungan untuk menghambat aktivitas enzim. Inhibitor enzim memiliki dua cara berbeda mengganggu fungsi enzim. Berdasarkan caranya, inhibitor dibagi menjadi 2 kategori, yaitu inhibitor kompetitif dan inhibitor non-kompetitif. Inhibitor kompetitif memiliki struktur yang sama dengan molekul substrat, inhibitor ini melekat pada sisi aktif enzim sehingga menghalangi pembentukan ikatan kompleks enzim-substrat. Inhibitor non-kompetitif dapat melekat pada sisi enzim yang bukan merupakan sisi aktif, dan membentuk kompleks enzim-inhibitor. Inhibitor ini mengubah bentuk/struktur enzim, sehingga sisi aktif enzim menjadi tidak berfungsi dan substrat tidak dapat berikatan dengan enzim tersebut.
Aktivitas protease pada percobaan kali ini diukur dengan menggunakan metode hidrolisis kasein. Pengukuran aktivitas ekstrak kasar protease digesti menggunakan metode hidrolisis kasein yaitu disiapkan tujuh buah tabung reaksi, masing-masing tabung diberi label. Satu buah tabung untuk sampel, satu buah tabung untuk kontrol, satu buah tabung untuk blanko dan empat buah tabung untuk keempat standar dengan konsentrasi (larutan 0,01 mg/ml, 0,05 mg/ml, 0,10 mg/ml dan 0,25 mg/ml) larutan tirosin 1%. Tabung sampel diisi 0,35 ml larutan kasein 1%, 0,30 ml larutan buffer dan 0,10 ml larutan ekstrak kasar enzim. Semua tabung selanjutnya diinkubasi selama 60 menit pada suhu 37°C, reaksi dihentikan dengan menambahkan 0,75ml larutan tricholoacetic acid (TCA) 8%. Tabung kontrol diisi larutan buffer sebanyak 0,30 ml, 0,10 ml akuades, dan ditambahkan 0,75 ml TCA 8%, kemudian diinkubasi selama 60 menit pada suhu 37°C. Larutan kasein sebanyak 0,35ml ditambahkan setelah inkubasi. Tabung blanko diisi dengan 0,30 ml buffer, 0,45 ml akuades, selanjutnya diinkubasi selama 60 menit pada suhu 37°C, setelah inkubasi ditambahkan dengan 0,75 ml TCA. Tabung standar diisi dengan 0,35 ml larutan tirosin standar, lalu ditambahkan 0,30 ml buffer, 0,10 ml akuades, dan diinkubasi selama 60 menit pada suhu 37°C. Semua tabung dimasukkan kedalam refrigerator selama 1 jam, campuran reaksi disentrifugasi pada kecepatan 6000 rpm selama 10 menit; Absorbansinya diukur pada panjang gelombang 280 nm. Hasilnya dicatat dan dibuat
kurva standarnya. Aktivitas enzim ditentukan dengan cara memplotkan angka absorbansi sampel ke dalam kurva standar (Affandi et al., 1992).
Percobaan yang dilakukan dengan waktu yang dipersingkat untuk menghemat waktu karena minimnya waktu. Perpendekan waktu tersebut yakni waktu inkubasi kedua yang seharusnya 30 menit diperpendek menjadi 20 menit dan waktu sentrifugasi yang seharusnya 60 menit diperpendek menjadi hanya 10 menit. Waktu tersebut merupakan waktu minimal untuk reaksi ditinjau dari hasil yang didapat. Inkubasi pertama bertujuan untuk mengaktifkan enzim, inkubasi kedua berfungsi untuk optimatisasi kerja enzim, dan penyimpanan dalam refrigerator bertujuan untuk mengendapkan enzim. Larutan maupun reagen yang digunakan berupa tris-HCl,
trichloroacetat acid (TCA), tirosin standar, dan akuades. Tris-HCl dengan pH 8,1
berfungsi sebagai buffer/penyangga pH enzim dan substrat. Reagen trichloroacetat
acid (TCA) berfungsi untuk menghentikan kerja dari enzim. Tirosin standar
merupakan hasil digesti dari kasein yang bermanfaat untuk perhitungan kurva standar konsentrasi (Affandi et al., 1992).
Percobaan yang dilakukan oleh kelompok 2 rombongan II menggunakan ikan lele makan dan ikan lele puasa setelah dilakukan absorbansi di panjang gelombang 280 nm, diperoleh hasil konsentrasi ikan makan sampel 1 sebesar 66.597 µg, sampel 2 sebesar 86.518 µg, dan blanko sebesar 54.172 µg, sementara konsentrasi ikan puasa sampel 1 sebesar 80.719 µg, sampel 2 sebesar 58.535 µg, dan blanko sebesar 58.081 µg. Hasil tersebut selanjutnya digunakan untuk menghitung aktivitas enzim dalam konsentrasi dengan rumus
X = 𝑠𝑎𝑚𝑝𝑒𝑙 1 + 𝑠𝑎𝑚𝑝𝑒𝑙 2
2 − 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑏𝑙𝑎𝑛𝑘𝑜, sehingga diperoleh aktivitas enzim
dalam konsentrasi ikan makan sebesar 22.386 µg dan aktivitas enzim dalam konsentrasi ikan puasa sebesar 11.546 µg. Aktivitas enzim dalam menit kemudian dihitung dengan rumus
aktivitas enzim dalam menit = 𝑥
𝑤𝑎𝑘𝑡𝑢 𝑖𝑛𝑘𝑢𝑏𝑎𝑠𝑖 (20 𝑚𝑒𝑛𝑖𝑡), sehingga diperoleh hasil pada
ikan makan sebesar 1.119 µg/menit dan hasil pada ikan puasa sebesar 0.577 µg/menit. Hasil dari perhitungan tersebut menunjukkan bahwa aktivitas enzim protease per menitnya pada ikan makan lebih tinggi dari ikan puasa. Hal tersebut sesuai dengan referensi yang menunjukkan bahwa konsentrasi substrat yang lebih tinggi berarti lebih banyak jumlah molekul substrat yang terlibat dengan aktivitas enzim yang akan meningkatkan kerja enzim, sementara konsentrasi substrat yang rendah berarti lebih sedikit jumlah molekul substrat yang dapat melekat pada enzim, menyebabkan berkurangnya aktivitas enzim. Ikan makan memperoleh asupan protein (substrat) dari makanan, sementara pada ikan puasa tidak memperoleh asupan protein (substrat). Meskipun demikian, laju
enzimatik yang sudah mencapai maksimum dan enzim sudah dalam kondisi paling aktif menyebabkan peningkatan konsentrasi substrat tidak akan memberikan perbedaan dalam aktivitas enzim. Ikan yang dipuasakan untuk mencapai berat tubuh yang sama di akhir pemeliharaan pada umumnya akan mengalami pertumbuhan kompensasi, yakni ikan akan mempercepat pertumbuhannya saat memperoleh makan kembali. Namun, pada percobaan dengan menggunakan ikan lele menunjukkan hasil perbedaan yang tidak signifikan antara ikan lele dengan pemuasaan dan tanpa pemuasaan (Afiah et al., 2009).
Protease komersial pada beberapa spesies ikan memiliki aktivitas antioksidan. Antioksidan adalah molekul yang mampu menghambat oksidasi molekul lain seperti radikal bebas. Radikal bebas dapat dihasilkan dari oksigen oleh organisme aerobik selama proses respirasi normal, salah satunya adalah ROS (Reactive Oxygen Spesies). ROS dalam tubuh organisme sebenarnya sudah dapat diatasi dengan produksi enzim superoksida dismutase, peroksidase, katalase, dan glutation peroksidase, namun jumlah ROS yang berlebih dapat menyebabkan beberapa penyakit seperti kanker. Banyak peneliti menganggap peptida bioaktif dari protein makanan sebagai bahan alternatif untuk antioksidan sintetik. Peptida bioaktif dapat dilepaskan dari protein oleh proteolisis enzimatik dari protein dan dapat bertindak sebagai potensi modulator fisiologis metabolisme selama pencernaan usus. Penelitian yang telah dilakukan mengenai hidosilat pada otot ikan Paralichthys olivaceus menunjukkan adanya aktivitas antioksidan. Hidrosilat disusun oleh reaksi enzimatik menggunakan delapan protease komersial seperti papain, pepsin, tripsin, neutrase, alkalase, kojizim, protamex, dan α-Chymotripsin. Hidrosilat α-Chymotripsin menunjukkan aktivitas antioksidan terkuat diantara delapan hidrosilat enzimatik. Dua peptida yang dimurnikan dari hidrosilat α-Chymotripsin ikan Paralichthys olivaceus yaitu VCSV (Val-Cys-Ser-Val) dan CAAP (Cys-Ala-Ala-Pro) memiliki aktivitas antioksidan yang kuat, yang dapat berguna sebagai agen terapeutik (Young et al., 2013).
IV. KESIMPULAN
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa ikan yang diberi asupan pakan memiliki aktivitas enzim protease dalam konsentrasi per menitnya lebih tinggi yaitu sebesar 1.119 µg/menit dari pada ikan dengan pemuasaan dengan nilai sebesar 0.577 µg/menit.
DAFTAR REFERENSI
Affandi, R., D.S. Sjafei, M.F. Rahardjo, dan Sulistiono. 1992. Iktiologi. Suatu
Pedoman Kerja Laboratorium. Departemen Pendidikan dan Kebudayaan.
Direktorat Jenderal Pendidikan Tinggi. Pusat Antar Universitas Ilmu Hayat. Institut Pertanian Bogor, Bogor.
Afiyah, H. N., Susilo, U., & Rachmawati, F. N. 2009. Aktivitas Enzim Digesti dan Efisiensi Pakan pada Ikan Lele (Clarias gariepinus) yang Diinduksi dengan Daur Pemuasaan Pemberian Pakan Kembali. Sains Akuatik, 14 (1): 17 – 24. Alamsjah, Z. dan M.F. Rahardjo. 1977. Penuntun Untuk Identifikasi Ikan. Departemen
Biologi Perairan. Fakultas Perikanan. Institut Pertanian Bogor, Bogor.
Fujaya, Yushinta. 2004. Fisiologi Ikan Dasar Pengembangan Teknik Perikanan. Rineka Cipta, Jakarta.
Guyton & Hall. 1997. Fisiologi Kedokteran. EGC, Jakarta.
Hidayati, Dewi. 2007. Modul Fisiologi Hewan. Program Studi Biologi ITS, FMIPA, Surabaya.
Winarno, F.G. 1995. Enzim Pangan. PT. Gramedia pustaka Utama, Jakarta.
Young, J. K., Hyeok, J. L., Samarakoon, K., Soo, J. K., & Jin, Y. J. 2013. Purification and determination of two novel antioxidant peptides from flounder fish (Paralichthys olivaceus) using digestive proteases. Food and Chemical