BAB IV Hasil dan Pembahasan
Analisis fingerprinting menggunakan pendekatan biologi molekul berbasis urutan DNA berpotensi memberikan gambaran yang menyeluruh mengenai biodiversitas mikroba karena komponen komunitas yang dapat ditumbuhkan dalam kultur maupun yang tidak dapat ditumbuhkan bisa diamati. Biodiversitas mikroba yang terdapat pada Kawah Hujan A dan B dianalisis menggunakan metode berbasis biologi molekul melalui 2 pendekatan, yaitu pendekatan yang tidak bergantung kultivasi dan melalui kultivasi. Kedua pendekatan tersebut, seperti halnya semua metode penelitian pada umumnya, memiliki kelebihan dan kekurangannya masing-masing. Pendekatan melalui kultivasi telah banyak diketahui memiliki kekurangan dalam menganalisis biodiversitas mikroba dari sampel lingkungan karena keterbatasan kemampuan mikroba untuk ditumbuhkan dalam media dengan metode yang ada saat ini. Sedangkan pendekatan tanpa kultivasi terbatas dalam menganalisis mikroba yang tidak terlalu dominan di alam. Dengan demikian, perpaduan kedua pendekataan tersebut diharapkan dapat saling melengkapi dalam memberikan gambaran mengenai biodiversitas mikroba secara lebih menyeluruh.
Pada bagian ini akan dipaparkan hasil-hasil penelitian mengenai biodiversitas mikroba pada Kawah Hujan A dan B dari sampel mikroba yang diisolasi langsung dari habitat alaminya dan yang sudah dikultivasi di laboratorium. Pemaparan dibagi dalam beberapa bagian, antara lain diawali dengan penggambaran kondisi fisik dan kimia Kawah Hujan, DNA kromosom mikroba sampel Kawah Hujan, fragmen gen 16S rRNA yang diamplifikasi dari DNA kromosom tersebut beserta profil DGGE-nya, dan analisis filogenetik urutan fragmen 16S rRNA mikroba dari masing-masing kawah, serta kultur murni yang berhasil diisolasi dari sampel yang sudah dikultivasi.
IV.1 Kondisi Fisik dan Kimia Kawah Hujan
Lokasi kawah yang menjadi objek dalam penelitian adalah kawah-kawah kecil di sekitar Kawah Hujan. Kawah Hujan merupakan salah satu dari sejumlah kawah
yang ada di area geotermal Kamojang, yang terletak di perbatasan kabupaten Garut dan Bandung, Jawa Barat.
Lokasi Kawah Hujan yang relatif mudah dijangkau dan terbuka untuk umum menyebabkan daerah di sekitar kawah ini banyak dikunjungi wisatawan. Di sekitar Kawah Hujan terdapat sekitar 4 kawah utama. Akan tetapi, untuk kepentingan penelitian ini, sampel hanya diambil dari dua kawah, yaitu Kawah Hujan A (E 107°48’14.67”, N -7°8’21.33”), dan Kawah Hujan B (E 107°48’14.38”, N -7°8’21.7”) yang memiliki kondisi fisik dan kimia paling berbeda.
Kondisi fisik dan kimia kawah ditentukan untuk melihat karakteristik dari masing-masing kawah. Kondisi fisik diamati berdasarkan temperatur dan bentuk fisik dari kawah. Sedangkan sifat kimia diamati melalui penentuan pH, kadar Ca, Na, Mg, Fe, Mn, K, Pb, Cu, ion klorida, sulfat, nitrat, nitrit, dan florida. Pengukuran temperatur dilakukan langsung di lokasi pengambilan sampel sedangkan pengukuran pH dilakukan di lokasi dengan menggunakan kertas pH indikator dan di laboratorium menggunakan pH meter. Pengukuran temperatur dan pH kawah dilakukan sebanyak 3 kali dalam selang waktu mulai dari bulan Juli 2004 sampai Januari 2007.
Secara fisik, Kawah Hujan A merupakan geyser yang menyemburkan air tanpa lumpur dengan tekanan sangat tinggi. Ketinggian semburan mencapai lebih dari 5 meter. Sumber air berasal dari bagian dalam bumi dan yang tampak di permukaan hanyalah lobang tempat keluarnya semburan air. Kawah Hujan B merupakan solfatar atau mud pool yang berada di permukaan tanah (Gambar IV.1). Temperatur Kawah Hujan A yang terukur rata-rata di atas 80°C, sedangkan Kawah Hujan B di atas 90°C. Akan tetapi, temperatur Kawah Hujan A yang terukur adalah temperatur air kawah yang ditampung dari semburannya dengan kemungkinan temperatur pada sumber air di bawah permukaan tanahnya jauh lebih tinggi. Tumbuhan yang berada di sekeliling kawah sebagian besar merupakan jenis pakis dan rumput.
Gambar IV.1 Keadaan Kawah Hujan pada saat pengambilan sampel.
Posisi tempat keluarnya semburan pada Kawah Hujan A ditunjukkan dengan anak panah.
Berdasarkan sifat kimianya, Kawah Hujan A memiliki pH cenderung netral dengan kandungan sulfat, klor, nitrat/nitrit yang rendah, sedangkan Kawah Hujan B bersifat sangat asam dengan kandungan sulfat sangat tinggi tetapi klor dan nitrat/nitrit rendah. Dibandingkan dengan Kawah Hujan B, Kawah Hujan A mengandung kadar Ca, Na, dan K relatif lebih tinggi, akan tetapi Kawah Hujan B memiliki kandungan Fe, Mn, Pb, dan Cu relatif lebih tinggi. Data kondisi fisik dan kimia Kawah Hujan A dan B yang telah ditentukan, selengkapnya disajikan pada Tabel IV.1 dan data hasil penentuan kadar logam dengan cara AAS diberikan pada Lampiran H.
Perbedaan sifat kimia yang paling menonjol antara Kawah Hujan A dengan Kawah Hujan B adalah kandungan sulfatnya. Pada Kawah Hujan B, kandungan sulfat sangat tinggi diduga karena adanya proses oksidasi dari senyawa H2S
(Druschel et al., 2003) yang merupakan kandungan gas terbesar pada uap di sekitar Kamojang (Zuhro, 2004). H2S akan teroksidasi membentuk asam sulfat
ketika bereaksi dengan air dalam kondisi aerob. Kawah Hujan B yang berada di atas permukaan tanah berada dalam kondisi aerob sedangkan Kawah Hujan A yang berada di bawah permukaan tanah kemungkinan besar dalam kondisi
anaerob. Perbedaan kondisi fisik dan kimia menjadikan Kawah Hujan A dan Kawah Hujan B merupakan habitat yang berbeda bagi pertumbuhan mikroba.
Tabel IV.1. Perbedaan kondisi fisik dan kimia Kawah Hujan A dan B Parameter Analisis Satuan Kawah Hujan A Kawah Hujan B Temperatur °C 80-86 90-92 pH 7,2 - 7,4 1,8 - 1,9 Ca mg/L 27,79 9,48 Mg mg/L 0,22 0,23 Fe mg/L 0,08 11,81 Mn mg/L Ttd 0,22 Na mg/L 13,64 9,46 K mg/L 7,25 1,37 Pb mg/L Ttd 0,02 Cu mg/L Ttd 0,46 Cl- mg/L 18,04 32,67 SO4-2 mg/L 156,59 2.740,85 Nitrat (NO3-) mg/L Ttd 2,11 Nitrit (NO2-) mg/L 0,01 0,03 Flourida (F-) mg/L 0,71 0,63 Ttd artinya tidak terdeteksi
IV.2 DNA Kromosom Mikroba
Ekstraksi DNA kromosom dalam keadaan murni dan dalam jumlah relatif banyak merupakan tahap yang penting dalam analisis berbasis biologi molekul terhadap komunitas mikroba. Efisiensi lisis sel di dalam kelompok mikroba sangat bervariasi. Sel mikroba gram positif relatif lebih sulit dilisis dibandingkan dengan mikroba gram negatif karena perbedaan komposisi senyawa pembentuk dinding selnya (Madigan dan Martinko, 2006). Kemampuan lisis juga bisa berbeda untuk sel yang berspora (Prosser, 2002) atau yang terperangkap dalam agregat. Pada sampel yang diperoleh dari lingkungan alami, kemungkinan mendapatkan
bermacam jenis sel sangat besar. Beberapa studi perbandingan telah dilakukan untuk menganalisis efisiensi metode ekstraksi dan pemurnian DNA dari tanah dan sedimen (Zhou et al. 1996; Yeates et al. 1998; Chauduri et al. 2006). Akan tetapi sampai saat ini, belum ada metode universal yang dapat digunakan untuk mengekstraksi DNA kromosom dari bermacam sampel alami. Dengan demikian, pencarian metode ekstraksi DNA kromosom yang paling sesuai masih diperlukan.
Pada penelitian ini, sampel air dari masing-masing kawah diambil sekitar 5 liter untuk kepentingan analisis komunitas mikroba secara langsung maupun melalui kultivasi. Penanganan sampel untuk kepentingan isolasi langsung dan kultivasi mikroba dilakukan secara berbeda selama dalam perjalanan dari lokasi kawah ke laboratorium. Waktu perjalanan yang diperlukan dari lokasi pengambilan sampel ke laboratorium adalah sekitar 2-3 jam. Untuk kepentingan isolasi langsung mikroba tanpa kultivasi, sampel diupayakan dalam keadaan dingin, sedangkan sampel yang sudah dicampur dengan media pengaya untuk ditumbuhkan di laboratorium temperatur di sekitarnya diupayakan tetap tinggi. Pada penelitian yang telah dilakukan, semua sampel ditangani secara aerobik tanpa aerasi.
Pada sampel mikroba yang langsung diisolasi dari air kawah (sampel filtrasi), baik dari Kawah Hujan A maupun Kawah Hujan B, digunakan 2 metode lisis sel yaitu lisis sel berbasis enzimatik (enzim lisozim) dan perusakan fisik (bead-beating). Sedangkan sampel mikroba hasil kultivasi hanya dilisis dengan metode bead-beating saja.
IV.2.1 DNA kromosom sampel Kawah Hujan A
Seperti yang sudah diungkapkan pada bagian sebelumnya, pendekatan yang tidak bergantung pada kultivasi (sampel filtrasi) dan yang bergantung kultivasi (sampel kultivasi) digunakan dalam melakukan analisis biodiversitas mikroba. Pada bagian berikut ini akan dipaparkan hasil isolasi DNA kromosom mikroba dari sampel filtrasi dan sampel melalui kultivasi Kawah Hujan A.
IV.2.1.1. DNA kromosom sampel filtrasi
Mikroba yang tumbuh dalam habitat alami seperti air kawah biasanya berada dalam konsentrasi yang relatif rendah. Hal ini disebabkan oleh laju pertumbuhan mikroba di alam yang pada umumnya di bawah laju pertumbuhan maksimum karena kondisi fisik dan kimia yang kurang optimal dengan nutrisi yang rendah. Karenanya, untuk kepentingan identifikasi jenis-jenis mikroba yang ada dalam habitat tersebut perlu dilakukan pemekatan untuk mendapatkan jumlah sel mikroba yang cukup banyak sebelum dilakukan isolasi DNA Kromosom.
Pada penelitian yang telah dilakukan, pemekatan dilakukan dengan cara filtrasi menggunakan filter steril berukuran pori 0,22 μm. Padatan yang terendapkan selama perjalanan diupayakan tidak ikut tersaring untuk menghindari penyumbatan filter yang terlalu cepat. Proses penyaringan dilakukan secara aseptik untuk menghindari kontaminasi. Mikroba beserta pengotor yang tertahan pada filter selanjutnya diperlakukan sebagai sampel mikroba untuk diisolasi DNA kromosomnya.
Sampel mikroba beserta pengotor yang tertahan pada filter Kawah Hujan A memiliki warna coklat tua (Gambar IV.2). Adanya pengotor-pengotor pada sampel seringkali menghambat proses pemekatan akibat penyumbatan pori dari filter. Oleh sebab itu, satu filter berdiameter sekitar 47 mm hanya dapat menyaring sekitar 1-1,5 liter sampel. Endapan pada masing-masing filter digunakan untuk keperluan isolasi DNA kromosom menggunakan metode enzimatis dan bead-beating. Volume ddH2O yang digunakan untuk melarutkan
DNA kromosom hasil isolasi adalah 10 μL.
Larutan DNA kromosom yang dihasilkan seringkali berwarna kecoklatan. Larutan DNA yang diekstraksi dengan metode bead-beating memiliki warna kecoklatan yang lebih pekat dibandingkan dengan hasil ekstraksi secara enzimatis.Warna coklat tersebut menunjukkan adanya senyawa lain (pengotor) yang ikut terekstraksi. Berdasarkan beberapa literatur (Yeates et al., 1998; Harry et al., 1999; Menking et al., 1999; Chaudhuri et al., 2006), ekstraksi DNA dari sumber alamiah seperti sampel dari tanah biasanya disertai ekstraksi senyawa lain seperti logam-logam dan asam humat yang berwarna kecoklatan. Asam humat memiliki sifat fisikokimia yang mirip dengan DNA sehingga sulit dipisahkan. Senyawa asam humat sangat potensial menjadi inhibitor pada proses PCR walaupun dalam jumlah yang sangat kecil (1 ng). Pencucian dengan dapar STE (10 mM Tris-HCl [pH 8.0], 0,1 M NaCl, 1 mMEDTA) beberapa kali terhadap pelet sampel sebelum dilakukan isolasi DNA kromosom kemungkinan dapat mengurangi sebagian pengotor (terutama logam-logam divalen yang dapat dikhelat oleh EDTA), akan tetapi kemungkinan besar tidak dapat menghilangkan pengotor asam humatnya.
Berdasarkan hasil elektroforesis pada gel agarosa yang diwarnai dengan etidium bromida, DNA kromosom sampel filtrasi Kawah Hujan A yang diisolasi dengan metode lisis sel enzimatis dan bead-beating menunjukkan perbedaan intensitas warna. DNA kromosom yang diisolasi dengan metode bead-beating pada umumnya memberikan pita dengan intensitas yang lebih tinggi dibandingkan dengan metode enzimatis untuk volume sampel DNA yang sama (Gambar IV.3).
Selain intensitas pita yang lebih rendah, metode enzimatik juga memerlukan perlakuan tambahan pada tahap pemurnian DNA. Pada metode bead-beating pemurnian DNA dilakukan dengan kloroform-isoamilalkohol untuk memisahkan protein, debris sel dan pengotor lainnya, sedangkan pada metode enzimatik sisa protein masih cukup tinggi jika hanya dilakukan pemurnian dengan cara yang sama. Penggunaan lisozim untuk proses lisis menambah jumlah protein yang cukup besar pada campuran sampel. Beberapa cara telah dicoba untuk menghilangkan protein pada metode enzimatik ini seperti penambahan fenol tetapi
tidak memberikan hasil yang memuaskan. Hasil yang lebih baik diperoleh dengan menggunakan larutan kalium asetat dan asam asetat glasial dingin (Sambrook dan Russel, 2001). Tingkat kemurnian DNA yang tinggi diperlukan bagi keberhasilan proses amplifikasi pada tahap selanjutnya.
Gambar IV.3 Perbandingan DNA kromosom sampel Kawah Hujan A menggunakan metode ekstraksi berbeda
(1) marker λ/HindIII; (2) menggunakan metode bead-beating; (3) menggunakan metode lisozim.
Perbedaan intensitas DNA dari hasil isolasi menggunakan metode enzimatis dan bead-beating bisa menunjukkan perbedaan efesiensi lisis sel mikroba. Metode enzimatis menunjukkan efesiensi yang lebih rendah. Hal ini kemungkinan karena adanya selektifitas kerja enzim yang menyebabkan selektifitas lisis lebih tinggi. Sebaliknya, metode berbasis perusakan secara fisik lebih memungkinkan untuk melisis berbagai jenis sel. Akan tetapi, kelemahan perusakan fisis adalah bisa menyebabkan fragmentasi pada DNA kromosom (Wintzingerode et al., 1997; Yeates et al., 1998) yang bisa mengganggu proses PCR pada tahap selanjutnya. Selain itu, adanya perlakuan tambahan pada tahap pemurnian DNA pada metode enzimatis juga dapat menurunkan yield dari DNA terekstraksi walaupun mungkin kemurniannya semakin tinggi.
Berdasarkan intensitas pita dan warna larutan, walaupun metode bead-beating dapat mengekstrak DNA dengan efesiensi yang lebih baik dibandingkan metode enzimatis, akan tetapi kontaminan yang terekstrak juga diduga lebih tinggi berdasarkan warna larutan yang terbentuk semakin berwarna gelap.
23130 9416 6557 2322 2027 1 2 3 pb
IV.2.1.2. DNA kromosom sampel hasil kultivasi
Laju pertumbuhan mikroba ditentukan oleh ketersediaan sumber nutrien dan kondisi pertumbuhan. Untuk meningkatkan laju pertumbuhan mikroba yang tidak dominan di habitat alaminya dilakukan pengkulturan mikroba dengan menggunakan kultur kaya. Penambahan sumber nutrien sebagai sumber karbon, nitrogen dan mineral yang berbeda dimaksudkan untuk dapat menumbuhkan sebanyak mungkin jenis mikroba yang terdapat di dalam sampel yang sesuai dengan media yang diberikan.
Dalam penelitian yang telah dikerjakan, media kaya ditambahkan ke dalam sampel air kawah dengan perbandingan volum air kawah : media = 50 : 1. Perbandingan seperti ini dimaksudkan untuk mendapatkan kondisi pH dan kandungan mineral yang mendekati kondisi alaminya. Jenis media yang digunakan dalam kultivasi dapat dilihat pada Tabel IV.2. Inkubasi dilakukan pada temperatur 70°C. Pertumbuhan mikroba diamati dari perubahan densitas sel (peningkatan kekeruhan pada kultur) dan pengamatan sel dilakukan di bawah mikroskop dengan pembesaran 400 kali.
Tabel IV.2 Media yang digunakan untuk kultivasi sampel Kawah Hujan A No Nama Media Komposisi media Keterangan
1 P Pepton 0,1% (b/v) Tumbuh
2 ½ Termus (T) Ekstrak ragi 0,05% (b/v); tripton 0,05% (b/v) dalam ½ media Castenholtz D
Tumbuh 3 ¼ LB Tripton 0,25% (b/v); NaCl 0,25% (b/v); ekstrak ragi 0,125% (b/v) Tumbuh 4 PB Pepton 0,2% (b/v); beef extract 0,1% (b/v) Tumbuh 5 Cast D Media Castenholtz D (Lampiran A) Tidak tumbuha
6 CzD Media Czapek Dox (Lampiran A) Tumbuh 7 SRM Media sulfat-reducing (Lampiran A) Tidak tumbuha
aKeterangan tidak tumbuh didasarkan pada pengamatan penambahan
kekeruhan media setelah inkubasi paling lama 1 bulan dibandingkan dengan sebelum inkubasi.
Adanya lumpur dan pengotor lainnya yang menimbulkan kekeruhan pada sampel kadang menyulitkan dalam pengamatan pertumbuhan berdasarkan peningkatan densitas sel. Waktu pertumbuhan berdasarkan pengamatan kekeruhan adalah 1-3
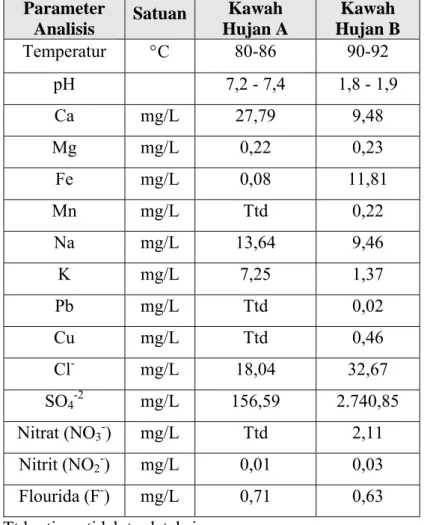
hari dan waktu maksimum pengamatan adalah 1 bulan. Tidak semua media yang digunakan menunjukkan adanya pertumbuhan mikroba. Media yang menunjukkan adanya pertumbuhan mikroba adalah media P, T, ¼ LB, PB, dan CzD. Pada umumnya media tersebut adalah media kompleks yang mengandung ekstrak ragi, tripton, pepton, atau ekstrak daging, kecuali media Czapek Dox yang mengandung sukrosa sebagai sumber karbonnya. Kekeruhan kultur berbeda-beda untuk media yang berbeda. Kultur dalam media PB dan ¼ LB relatif lebih keruh dibandingkan media lain. Kultur dalam media P merupakan kultur yang paling tidak keruh dan memerlukan waktu inkubasi paling lama. Pengamatan di bawah mikroskop menunjukkan bahwa sebagian besar mikroba yang tumbuh adalah berbentuk batang (Gambar IV.4)
Berdasarkan sumber karbon yang digunakan mikroba yang berhasil dikulturkan kemungkinan adalah mikroba heterotrop. Beberapa media yang hanya mengandung garam-garam anorganik seperti media Castenholtz D dan Sulfat-reducing kemungkinan bukan merupakan media yang disukai atau memerlukan waktu yang lebih lama untuk pertumbuhan mikroba.
Penggunaan air kawah sebagai media dasar dimaksudkan untuk mendapatkan kondisi kimia media yang mendekati kondisi alaminya. Beberapa penelitian menunjukkan bahwa penggunaan media dari sumber alami yang diperkaya dapat meningkatkan diversitas mikroba dalam kultur (Santegoeds et al, 1996). Metode serupa berhasil digunakan untuk mengkulturkan mikroba galur baru misalnya Metallospaera sp dari filum Crenarchaeote (Kozubal et al., 2008) dan Thermus sp (Kieft et al., 1999).
Gambar IV.4 Mikroba hasil pewarnaan Gram sampel Kawah Hujan A hasil kultivasi (perbesaran 400 kali)
(A) Kultur sel dalam media CzD setelah inkubasi selama 2 hari; (B) Kultur sel dalam media P setelah inkubasi selama 3 hari; (C) Kultur sel dalam media LB setelah inkubasi selama 1 hari; (D) Kultur sel dalam media PB setelah inkubasi selama 1 hari; (E) Kultur sel dalam media T setelah inkubasi selama 1 hari
DNA kromosom yang diisolasi dari kultur pada media yang berbeda menunjukkan intensitas warna yang berbeda setelah dilakukan elektroforesis pada gel agarosa dan diwarnai dengan etidium bromida. Dari beberapa kali isolasi, DNA
A B
C D
kromosom dari kultur pada media PB dan ¼ LB pada umumnya menghasilkan pita yang paling tebal, sedangkan kultur dalam media P paling tipis (Gambar IV.5). Larutan DNA kromosom yang dihasilkan semuanya berwarna bening.
Gambar IV.5 DNA kromosom kultur isolat Kawah Hujan A
(1) marker λ/HindIII; (2) kultur dalam media CzD; (3) kultur dalam media T; (4) kultur dalam media P; (5) kultur dalam media PB; (6) kultur dalam media ¼ LB
Perbedaan intensitas DNA kromosom menunjukkan bahwa jumlah sel yang terkulturkan tidak sama pada media yang berbeda. Media PB dan ¼ LB merupakan media yang relatif kaya, sedangkan media P lebih miskin. Intensitas DNA kromosom paling tinggi yang dihasilkan oleh kultur dalam media PB dan ¼ LB dibandingkan dengan media lainnya sejalan dengan kekeruhan kultur yang juga lebih tinggi. Demikian juga kultur dalam media P yang paling tidak keruh menghasilkan DNA kromosom yang paling sedikit. Umumnya, pada media kaya pertumbuhan mikroba lebih tinggi karena biasanya didominasi oleh mikroba yang unggul (superior). Pengurangan nutrisi akan banyak memberi kesempatan kepada mikroba yang lebih lemah (inferior) untuk bersaing (Santegoeds et al. 1996). Akan tetapi, pertumbuhan mikroba yang inferior tidak lebih subur dibandingkan mikroba superior, sehingga pada media lebih miskin pertumbuhan mikroba terkadang hanya terlihat sedikit keruh (turbidity). Dengan demikian, kultur yang ditumbuhkan dalam media yang berbeda kemungkinan akan memiliki diversitas yang berbeda. 1 2 3 4 5 6 23130 9416 6557 2322 2027 pb 4361
IV.2.2 DNA kromosom sampel Kawah Hujan B
Pada sampel Kawah Hujan B, DNA kromosom diisolasi dari sampel filtrasi dan sampel kultivasi, seperti yang dilakukan pada sampel Kawah Hujan A.
IV.2.2.1. DNA kromosom sampel filtrasi
Seperti halnya sampel Kawah Hujan A, sampel mikroba dari Kawah Hujan B dipekatkan dengan cara filtrasi dengan perlakuan sama seperti sampel filtrasi Kawah Hujan A (Sub bab IV.2.1.1). Bagian lumpur yang mengendap selama perjalanan dari lokasi kawah ke laboratorium diupayakan tidak ikut tersaring untuk mengurangi penyumbatan pori filter. Walaupun demikian, pada permukaan filter berukuran pori 0,22 mikrometer, beserta sampel mikroba tetap ada pengotor yang tertahan berwarna coklat muda (Gambar IV.6). Sampel mikroba dalam setiap filter yang menyaring sekitar 1-1,5 liter air kawah dikumpulkan dalam 2 tabung untuk keperluan isolasi DNA kromosom menggunakan metode enzimatis dan bead-beating. Masing-masing DNA kromosom dilarutkan dalam 50 μL ddH2O.
Gambar IV.6 Hasil filtrasi sampel Kawah Hujan B
DNA kromosom dari sampel filtrasi Kawah Hujan B dengan metode lisis enzimatis menunjukkan intensitas warna yang lebih rendah di dalam gel agarosa yang diwarna dengan etidium bromida (Gambar IV.7). Larutan DNA kromosom dari metode lisis enzimatis berwarna bening, sedangkan metode bead-beating menghasilkan larutan DNA sedikit berwarna kuning.
Gambar IV.7 Perbandingan DNA kromosom sampel Kawah Hujan B menggunakan metode ekstraksi berbeda
(1) marker λ/HindIII; (2) menggunakan metode bead-beating; (3) menggunakan metode lisozim.
Hasil isolasi DNA kromosom sampel filtrasi Kawah Hujan B konsisten dengan hasil isolasi sampel filtrasi Kawah Hujan A yang sudah disebutkan pada bagian sebelumnya. Metode bead-beating menunjukkan efisiensi ekstraksi yang lebih baik dibandingkan metode enzimatis dilihat dari ketebalan pita DNA kromosom yang terisolasi. Walaupun demikian, berdasarkan warna larutan DNA, hasil lisis sel secara enzimatis yang tidak berwarna kemungkinan mengkoekstraksi kontaminan lebih kecil dibandingkan dengan metode bead-beating yang berwarna agak kekuningan.
IV.2.2.2. DNA kromosom sampel hasil kultivasi
Kultivasi sampel Kawah Hujan B dalam beberapa macam media dilakukan untuk melihat biodiversitas mikroba yang kemungkinan tidak dominan pada habitat alaminya. Jenis media dan juga metode kultivasinya pada umumnya sama seperti yang dilakukan pada sampel Kawah Hujan A (sub bab IV.2.1.2). Selain media seperti yang digunakan pada sampel Kawah Hujan A, sampel Kawah Hujan B juga diupayakan ditumbuhkan dalam media sulfolobus (komposisi media dapat dilihat pada Lampiran A)
Untuk sampel Kawah Hujan B, media yang berhasil digunakan untuk pertumbuhan mikroba adalah media P, PB, ¼ LB, dan T. Tingkat kekeruhan
23130 9416 6557 4361 2322 2027 1 2 3 pb
kultur pada media PB dan ¼ LB adalah paling tinggi dibandingkan dengan media T dan media P. Waktu yang diperlukan untuk mencapai tingkat kekeruhan tersebut adalah 1-2 hari, kecuali untuk media P mencapai 5 hari. Hasil pengamatan sel yang dilakukan di bawah mikroskop menunjukkan bahwa sebagian besar mikroba yang terkulturkan adalah berbentuk batang (Gambar IV.8).
Gambar IV.8 Mikroba hasil pewarnaan Gram sampel Kawah Hujan B hasil kultivasi (perbesaran 400 kali)
(A) Kultur sel dalam media P setelah inkubasi selama 5 hari; (B) Kultur sel dalam media ¼ LB setelah inkubasi selama 1 hari; (C) Kultur sel dalam media PB setelah inkubasi selama 3 hari; (D) Kultur sel dalam media T setelah inkubasi selama 1 hari
DNA kromosom yang diisolasi dari kultur pada media yang berbeda menunjukkan intensitas warna yang berbeda setelah dielektroforesis pada gel agarosa dan diwarnai dengan etidium bromida. DNA kromosom dari kultur pada media PB dan ¼ LB menghasilkan pita yang lebih tebal, sedangkan kultur dalam media P
A B
paling tipis (Gambar IV.9). Larutan DNA kromosom yang dihasilkan semuanya berwarna bening.
Gambar IV.9 DNA kromosom kultur sampel Kawah Hujan B
(1) marker λ/HindIII; (2) kultur dalam media ¼ LB; (3) kultur dalam media P; (4) kultur dalam media PB; (5) kultur dalam media T
Seperti yang sudah dijelaskan pada sub bab IV.2.1.2, ketebalan pita DNA kromosom berkaitan dengan jumlah sel yang terkulturkan. Seperti halnya sampel kultivasi Kawah Hujan A, ketebalan pita DNA pada kultur dalam media PB dan ¼ LB sejalan dengan pertumbuhan kultur yang baik dilihat dari tingkat kekeruhan kultur dan waktu untuk pertumbuhannya. Demikian juga untuk kultur dalam media P yang menghasilkan pita paling tipis, tingkat kekeruhannya juga paling rendah dan waktu yang diperlukan untuk pertumbuhan paling lama. Hal ini mirip dengan hasil kultivasi sampel Kawah Hujan A yang diungkapkan pada bagian sebelumnya.
IV.3 Fragmen gen 16S rRNA
Analisis biodiversitas mikroba dari sampel Kawah Hujan A dan Kawah Hujan B dilakukan melalui pendekatan molekular. Identifikasi mikroba dari komunitas didasarkan pada urutan gen 16S rRNA. Untuk kepentingan analisis DGGE, diperlukan fragmen DNA dengan ukuran maksimum 500 pb (Muyzer, 1999) sehingga dapat memberikan hasil analisis yang optimum. Pada penelitian yang telah dilakukan, fragmen gen 16S rRNA yang digunakan untuk identifikasi
1 2 3 4 5 23130 9416 6557 4361 2322 2027 pb
berukuran sekitar 350 pb. Fragmen tersebut diperoleh dengan cara amplifikasi PCR pada sebagian daerah gen 16S rRNA dari DNA kromosom sampel Kawah Hujan A dan Kawah Hujan B, baik hasil filtrasi maupun kultivasi. Amplifikasi parsial gen 16S rRNA dilakukan dengan menggunakan metode touchdown PCR. Pada 10 siklus pertama digunakan temperatur annealing antara 53° sampai 43°C dengan penurunan 1°C per siklus, sedangkan siklus selanjutnya pada temperatur annealing 43°C. Salah satu primer yang digunakan komplemen dengan daerah lestari pada domain bakteri (posisi 1055-1070 pada gen 16S rRNA Escherichia coli) dan primer yang lain didasarkan pada daerah lestari universal (posisi 1392-1406 pada E. coli, dengan tambahan 40 basa GC-clamp). Pasangan primer yang digunakan dimaksudkan untuk mengamplifikasi daerah variabel V7-V8 pada gen 16S rRNA.
IV.3.1 Fragmen gen 16S rRNA sampel Kawah Hujan A
Seperti yang sudah diungkapkan pada sub bab IV.2.1.1, DNA kromosom yang diisolasi dari sampel filtrasi Kawah Hujan A, baik yang diisolasi menggunakan metode enzimatis maupun bead-beating, kemungkinan mengandung kontaminan berdasarkan warna larutan DNA-nya (kekuningan). Kedua sampel filtrasi pada mulanya tidak pernah berhasil diamplifikasi. Untuk mencari konsentrasi kontaminan minimal yang tidak mengganggu proses amplifikasi dilakukan pengenceran berseri terhadap DNA kromosom sebelum dijadikan template untuk amplifikasi. Variasi dilakukan pada 5x, 10x, 100x, dan 1000x pengenceran.
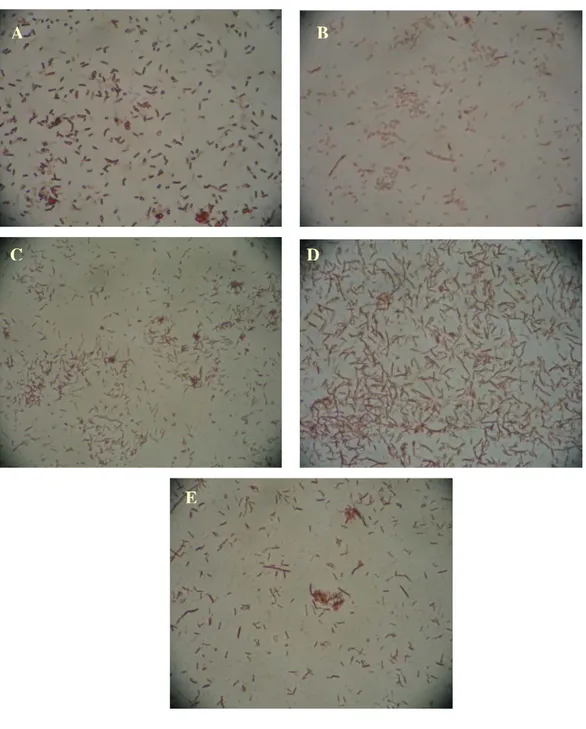
Amplifikasi fragmen gen 16S rRNA dari sampel Kawah Hujan A hasil filtrasi, dilakukan dari template DNA kromosom hasil dari berbagai pengenceran. Amplifikasi menghasilkan fragmen DNA dengan ukuran sekitar 390 pb, sesuai dengan ukuran yang diharapkan. Ukuran fragmen gen 16S rRNA adalah sekitar 350 pb dan 40 basa tambahan berasal dari GC-clamp yang terdapat pada salah satu primer amplifikasi. Elektroforegram hasil amplifikasi diperlihatkan pada Gambar IV.10.
Elektroforesis hasil amplifikasi PCR pada gel agarosa menunjukkan bahwa pengenceran 5x dan 1000x menghasilkan pita yang lebih tipis dibandingkan dengan pengenceran lainnya (Gambar IV.10, lajur 1 dan 4). Pada pengenceran 5x kemungkinan konsentrasi kontaminan masih cukup tinggi untuk mengganggu proses amplifikasi, sedangkan pada pengenceran 1000x konsentrasi template DNA terlalu rendah untuk menghasilkan produk PCR yang optimum. Pengenceran 10x dan 100x menghasilkan pita yang relatif sama tebal (Gambar IV.10, lajur 2 dan 3). Dengan demikian, pengenceran 10x merupakan konsentrasi optimum pada serial pengenceran yang dilakukan karena memberikan hasil amplifikasi yang baik dengan konsentrasi template DNA yang masih cukup tinggi.
Gambar IV.10 Elektroforegram fragmen gen 16S rRNA hasil amplifikasi sampel filtrasi Kawah Hujan A yang diencerkan berseri
(1) pengenceran template 5x; (2) pengenceran template 10x; (3) pengenceran template 100x; (4) pengenceran template 1000x; (5) kontrol negatif; (6) kontrol positif; (7) Marker pUC19/HinfI. Posisi pita hasil amplifikasi ditunjukkan dengan arah panah.
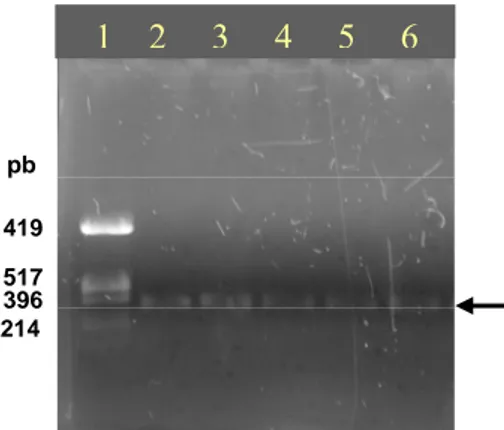
Berbeda dengan sampel hasil filtrasi, amplifikasi fragmen gen 16S rRNA dari DNA kromosom sampel hasil kultivasi dari Kawah Hujan A berhasil dilakukan tanpa banyak mengalami kesulitan. Hasil amplifikasi masing-masing sampel menghasilkan fragmen DNA dengan ukuran sekitar 390 pb (Gambar IV.11). Kemudahan proses amplifikasi DNA kromosom dari sampel kultivasi dibandingkan dengan amplifikasi sampel filtrasi kemungkinan karena DNA kromosom sampel kultivasi tingkat kemurniannya lebih tinggi berdasarkan warna larutannya (bening) dan berasal dari jumlah sel yang lebih banyak.
1 2 3 4 5 6 7
1419
517 396 pb
Gambar IV.11 Elektroforegram fragmen gen 16S rRNA hasil amplifikasi sampel kultivasi Kawah Hujan A
(1) marker pUC19/HinfI; (2) kultur dalam media PB; (3) kultur dalam media P; (4) kultur dalam media CzD; (5) kultur dalam media ¼ LB; (6) kultur dalam media T. Posisi pita hasil amplifikasi ditunjukkan dengan tanda panah.
Berdasarkan warna larutan DNA kromosom sampel filtrasi yang berwarna kuning, kontaminan yang dapat mengganggu proses amplifikasi sampel diduga berasal dari senyawa asam humat yang biasa terkoekstraksi bersama DNA yang diisolasi dari sumber alami. Senyawa asam humat memiliki ukuran dan sifat yang mirip dengan DNA sehingga tidak mudah dipisahkan (Yeates et al., 1998). Beberapa metode untuk mendapatkan DNA murni yang diekstrak dari sampel tanah atau sedimen telah banyak dikembangkan seperti gradien CsCl, pengendapan berulang dan bertahap, penggunaan bermacam kolom mini berbasis filtrasi gel atau kromatografi, seperti resin penukar ion, membran gel silika dan gel filtrasi Sephacryl, dan penambahan senyawa-senyawa tertentu (Zhou et al., 1996; Harry et al., 1999). Pada umumnya, penggunaan gabungan beberapa kolom mini memberikan hasil yang paling baik (Zhou et al., 1996; Harry et al., 1999), akan tetapi memerlukan biaya yang tidak sedikit.
Salah satu metode sederhana untuk mengurangi konsentrasi senyawa asam humat dan inhibitor lainnya adalah pengenceran berseri dari ekstrak kasar sampel DNA kromosom. Kelemahan terbesar metode pengenceran berseri adalah mengurangi limit deteksi yang bisa menimbulkan bias pada analisis komunitas mikroba. Pada
1419 517 396 214 1 2 3 4 5 6 pb
penelitian ini, pengaruh pengenceran terhadap deteksi diversitas mikroba akan dilihat dari profil DGGE hasil amplifikasi masing-masing pengenceran.
IV.3.2 Fragmen gen 16S rRNA sampel Kawah Hujan B
Amplifikasi fragmen gen 16S rRNA dari sampel Kawah Hujan B hasil filtrasi maupun kultivasi menghasilkan fragmen DNA dengan ukuran yang sama yaitu sekitar 390 pb (Gambar IV.12).
Gambar IV.12 Elektroforegram fragmen gen 16S rRNA hasil amplifikasi sampel Kawah Hujan B
(1) marker pUC19/HinfI; (2) hasil filtrasi (metode bead-beating); (3) hasil filtrasi (metode enzimatis); (4) kultur dalam media ¼ LB; (5) kultur dalam media ½ T. Posisi pita hasil amplifikasi ditunjukkan dengan tanda panah.
Kemudahan proses amplifikasi menunjukkan tingkat kemurnian DNA cukup tinggi walaupun dari sampel filtrasi. Hal ini berbeda dengan sampel Kawah Hujan A yang memerlukan perlakuan khusus (untuk sampel filtrasi) sebelum dapat teramplifikasi. Senyawa asam humat diduga sebagai inhibitor amplifikasi pada sampel Kawah Hujan A. Asam humat terbentuk dari penguraian tumbuhan, hewan, dan sel mikroba oleh proses biologi atau kimia (Andelkovic et al., 2001; Coates et al., 2002). Kelarutan senyawa asam humat bergantung pada kondisi pH dan pada pH <2 senyawa ini tidak larut dalam air (Coates et al., 2002). Berdasarkan kondisi fisik kawah seperti yang sudah diungkapkan pada sub bab IV.1, Kawah Hujan B kemungkinan mengandung asam humat adalah lebih tinggi dibandingkan Kawah Hujan A karena berada di permukaan tanah. Akan tetapi, kondisi pH Kawah Hujan B yang sangat asam (pH <2) kemungkinan
1 2 3 4 5 1419 517 396 214 pb
menyebabkan senyawa asam humat tersebut terendapkan dan tidak ikut tersaring pada proses filtrasi (sub bab IV.2.2.1). Hal ini didukung oleh warna larutan DNA kromosom sampel Kawah Hujan B yang relatif lebih tidak berwarna. Dengan demikian, warna larutan DNA kelihatannya bisa dijadikan sebagai gambaran kasar mengenai tingkat kemurnian DNA terutama dari kontaminasi dengan senyawa berwarna seperti asam humat.
IV.4 Profil DGGE Fragmen Gen 16S rRNA
Fragmen DNA hasil amplifikasi dari campuran mikroba perlu dipisahkan untuk melihat diversitasnya. Salah satu metode yang bisa digunakan untuk memisahkan campuran DNA adalah metode DGGE. Pemisahan DNA didasarkan pada penurunan mobilitas elektroforetik dari molekul DNA untai ganda yang terbuka sebagian pada gel poliakrilamid yang mengandung gradien linier denaturan DNA, yaitu campuran urea dan formamida (Muyzer dan Smalla, 1998).
Pada penelitian ini digunakan gel poliakrilamid 8% dengan konsentrasi denaturan antara 30% - 40% yang memberikan pemisahan terbaik. Pita-pita DNA yang sudah terpisahkan pada gel DGGE kemudian dipotong dan dilarutkan untuk dijadikan template reamplifikasi. Primer yang digunakan untuk reamplikasi adalah sama dengan primer amplifikasi fragmen gen 16S rRNA sebelum dipisahkan dengan cara DGGE, akan tetapi tanpa urutan GC-clamp. Masing-masing hasil reamplifikasi kemudian ditentukan urutan nukleotidanya. Semua urutan nukleotida sampel dilihat kemungkinan adanya chimera menggunakan program CHECK_CHIMERA dari RDPII (http://rdp.cme.msu.edu) (Maidak et al., 1996).
IV.4.1 Profil DGGE sampel Kawah Hujan A
Hasil pemisahan fragmen gen 16S rRNA untuk Kawah Hujan A dapat dilihat pada Gambar IV.14. Profil pita dari sampel filtrasi dengan metode isolasi DNA secara enzimatis dan bead-beating tidak menunjukkan perbedaan yang signifikan. Di antara sampel kultivasi ada sedikit perbedaan profil pita pada kultur dalam media berbeda, terutama pada media CzD yang menunjukkan pita lebih banyak dan
media T yang tidak memperlihatkan pita tebal di bagian bawah gel. Sedangkan antara sampel kultivasi dengan sampel filtrasi juga hanya menunjukkan sedikit perbedaan. Beberapa pita yang sangat tipis seperti FK-2, FK-4, FK-7, FK-8, FZ-3, FZ-5, dan FZ-8 tidak selalu muncul dalam gel DGGE (data tidak ditampilkan).
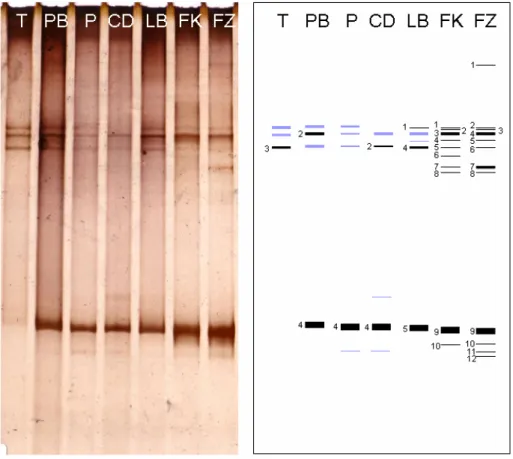
Gambar IV.13 Profil DGGE komunitas mikroba Kawah Hujan A dan penomoran pita-pita yang dipotong dan direamplifikasi
T: kultur campuran dalam media termus; PB: kultur campuran dalam media PB; P: kultur campuran dalam media P; CD: kultur campuran dalam media Czapek Dox; LB: kultur campuran dalam media ¼ LB; FK: hasil filtrasi dengan menggunakan metode lisis sel enzimatik; FZ: hasil filtrasi dengan menggunakan metode lisis bead-beating.
Seperti diungkapkan pada sub bab IV.3.1, pengaruh pengenceran template DNA kromosom sampel filtrasi Kawah Hujan A terhadap deteksi diversitas mikroba akan dilihat dari profil DGGE hasil amplifikasi masing-masing pengenceran. Berdasarkan profil DGGE, proses pengenceran berseri tersebut tidak menunjukkan perbedaan yang signifikan terhadap deteksi biodiversitasnya (Gambar IV.14). Bahkan pada pengenceran yang lebih tinggi, yaitu 100x dan
1000x, terlihat ada satu pita yang tidak muncul pada pengenceran 5x dan 10x (ditunjukkan dengan arah panah pada Gambar IV.14). Hasil ini menunjukkan bahwa metode pengenceran berseri bisa digunakan untuk mengatasi inhibisi reaksi amplifikasi PCR karena adanya kontaminan dengan memperkecil konsentrasi kontaminan.
Gambar IV.14 Elektroforegram hasil DGGE Kawah Hujan A.
(1-4) amplikon hasil filtrasi KH A (metode enzimatik) dengan pengenceran berseri berturut-turut 5x, 10x, 100x, dan 1000x. Tanda panah menunjukan pita yang tidak muncul pada pengenceran 5x dan 10x
IV.4.2 Profil DGGE sampel Kawah Hujan B
Profil DGGE pada sampel Kawah Hujan B menunjukkan lebih banyak variasi, baik antara sampel filtrasi yang diperoleh dengan metode lisis enzimatis dan bead-beating, maupun antara sampel kultivasi dalam media berbeda. Pada sampel filtrasi dengan metode lisis enzimatis, pita-pita menyebar di sepanjang gel, sedanngkan sampel filtrasi dengan metode lisis bead-beating pita-pita terkonsentrasi di bagian atas dan bawah gel. Untuk sampel kultivasi, kultur dalam media P menghasilkan paling banyak pita dengan posisi menyebar di sepanjang gel, sedangkan media T dan ¼ LB memberikan pita yang relatif lebih sedikit (Gambar IV.15). Berdasarkan profil DGGE-nya sampel-sampel pada Kawah Hujan B kemungkinan menunjukkan deteksi biodiversitas yang berbeda-beda.
Gambar IV.15 Profil DGGE komunitas mikroba Kawah Hujan B dan penomoran pita-pita yang dipotong dan direamplifikasi
T: kultur campuran dalam media T; PB: kultur campuran dalam media PB; P: kultur campuran dalam media P; LB: kultur campuran dalam media ¼ LB; FK: hasil filtrasi dengan menggunakan metode lisis sel enzimatik; FZ: hasil filtrasi dengan menggunakan metode lisis bead-beating.
IV.4.3 Urutan fragmen gen 16S rRNA sampel Kawah Hujan
Pita-pita DGGE selanjutnya direamplifikasi untuk ditentukan urutannya. Posisi-posisi pita DNA yang direamplifikasi berikut penomorannya ditunjukkan pada Gambar IV.13 untuk sampel Kawah Hujan A dan Gambar IV.15 untuk sampel Kawah Hujan B. Semua hasil reamplifikasi menunjukkan pita tunggal dengan ukuran sekitar 350 pb. Sebagian dari hasil reamplifikasi ditunjukkan pada Gambar IV.16.
Gambar IV.16 Elektroforegram hasil reamplifikasi pita-pita DGGE.
(1)-(4) sampel filtrasi Kawah Hujan A; (5) marker pUC19/HinfI; (6)-(8) sampel kultivasi Kawah Hujan B dalam media P
Untuk sampel Kawah Hujan A, sekitar 10 pita dan 12 pita dari sampel filtrasi masing-masing dengan metode lisis enzimatis dan bead-beating telah berhasil direamplifikasi. Pada sampel kultivasi, sebagian besar pita cukup tebal berhasil direamplifikasi, akan tetapi beberapa pita tipis tidak dapat direamplifikasi.
Sebagian besar pita-pita sampel Kawah Hujan B berhasil direamplifikasi. Dari sampel filtrasi, masing-masing sebanyak 13 dan 15 pita sampel filtrasi dengan metode lisis enzimatik dan bead-beating dapat direamplifikasi. Sedangkan sampel hasil kultivasi dapat teramplifikasi sebanyak 11 pita untuk sampel dari media PB, 17 pita dari media P, 4 pita dari media T, dan 5 pita dari media ¼ LB.
Hasil reamplifikasi kemudian ditentukan urutan nukleotidanya. Keberhasilan sekuensing sangat menentukan ketepatan deteksi mikroba. Hasil sekuensing pita-pita DGGE dari sampel kultivasi, Kawah Hujan A maupun Kawah Hujan B, pada umumnya memberikan puncak-puncak yang lebih tajam dibandingkan dengan hasil sekuensing sampel filtrasi pada elektroforegramnya. Beberapa pita seperti FK-2 dan FZ-11 pada sampel filtrasi Kawah Hujan A menunjukkan adanya chimera. Sedangkan pada sampel Kawah Hujan B, 7 pita menunjukkan adanya chimera, dan satu pita tidak memberikan hasil sekuensing yang baik.
Untuk semua sampel dari Kawah Hujan A maupun Kawah Hujan B, pita-pita yang dianalisis lebih lanjut adalah pita-pita yang tidak menunjukkan adanya
1 2 3 4 5 6 7 8 1419 pb
517 pb 396 pb 214 pb
chimera dan cukup jelas terlihat di dalam gel. Sebanyak 67 urutan nukleotida telah disimpan ke GenBank dengan nomor akses (accession number) EU625407- EU625473. Nomor akses untuk masing-masing sampel dapat dilihat pada lampiran C.
Pada beberapa elektroforegram hasil sekuensing, terutama untuk sampel hasil filtrasi, terdapat puncak-puncak pendek di samping puncak utamanya (contoh elektroforegram hasil sekuensing dapat dilihat pada Lampiran D). Untuk mengetahui penyebab tersebut, pada penelitian ini telah dilakukan amplifikasi dari gel DGGE yang tidak menunjukkan adanya pita DNA. Luas gel yang dipotong adalah sekitar 10 kali luas rata-rata gel yang berpita. Hasil amplifikasi menunjukkan bahwa gel kosong di antara pita-pita pada 2 posisi yang berbeda menunjukkan hasil amplifikasi yang cukup tebal (Gambar IV.17. lajur 1-2). Sedangkan hasil amplifikasi gel di atas pita tertinggi jauh lebih tipis (Gambar IV.17 lajur 5). Hasil amplifikasi yang tipis juga diperoleh dari bagian di atas pita utama pada gel DGGE dari mikroba kultur tunggal (data DGGE tidak ditampilkan) yang hanya memiliki sedikit profil pita (Gambar IV.17 lajur 6). Amplifikasi gel di bawah pita terbawah pada 2 tempat berbeda tidak memberikan hasil yang signifikan (Gambar IV.17 lajur 4 dan 7).
Adanya hasil amplifikasi tersebut di atas bisa disebabkan oleh beberapa kemungkinan. Salah satu diantaranya adalah adanya hasil amplifikasi DNA yang tidak dominan, karena jumlah template yang terlalu sedikit atau primer yang tidak terlalu sesuai, tidak memberikan pita yang jelas pada gel DGGE. Untuk sampel-sampel yang langsung diambil dari habitat alami, adanya biodiversitas mikroba yang tinggi dalam jumlah (populasi) yang berbeda-beda sangat memungkinkan. Sedangkan biodiversitas kultur kemungkinan didominasi oleh mikroba-mikroba tertentu yang paling sesuai dengan nutrisi yang disediakan. Hasil amplifikasi di atas dihasilkan dari gel dengan luas 10x gel berpita. Dengan demikian, kemungkinan kontaminasi terhadap konsentrasi DNA template pita utama (sampel) akan kecil kemungkinannya untuk mempengaruhi hasil sekuensing, akan tetapi bisa memberikan background pada puncak-puncak hasil sekuensing.
Gambar IV.17 Elektroforegram hasil reamplifikasi gel DGGE tanpa pita.
(1-2) posisi di antara pita-pita; (3) kontrol negatif; (4,7) posisi di bawah pita terendah; (5) posisi di atas pita tertinggi; (6) posisi di antara pita dari kultur koloni tunggal; (8) marker pUC/HinfI.
IV.5 Kekerabatan terdekat Sampel Mikroba Kawah Hujan
Analisis filogenetik dimaksudkan untuk melihat hubungan kekerabatan terdekat antara urutan fragmen gen 16S rRNA sampel dengan urutan DNA mikroba yang sudah ditemukan saat ini. Terhadap urutan DNA sampel dilakukan penjajaran dengan data nukleotida yang ada di GenBank dengan menggunakan program BLASTN (http://www.ncbi.nlm.nih.gov). Semua urutan DNA yang menunjukkan kemiripan tertinggi dengan urutan sampel pada hasil penjajaran dijadikan sebagai urutan pembanding pada pembuatan pohon filogenetik. Metode yang dipakai dalam penyusunan pohon filogenetik adalah metode jarak melalui program DNADIST (Phylip versi 3.6) dengan menggunakan model F84 untuk model substitusi nukleotida.
IV.5.1 Kekerabatan terdekat sampel Kawah Hujan A
IV.5.1.1. Kekerabatan terdekat sampel hasil filtrasi dari Kawah Hujan A
Berdasarkan pendekatan filogenetik molekular yang digunakan pada penelitian ini, komunitas mikroba yang terdeteksi ada pada Kawah Hujan A menunjukkan diversitas yang rendah. Semua urutan fragmen gen 16S dari sampel Kawah Hujan A tanpa kultivasi yang diperoleh melalui lisis sel enzimatik maupun bead-beating menunjukkan kedekatan dengan kelompok bakteri. Urutan DNA dari metode lisis sel enzimatik sebagian besar membentuk cluster paling dekat dengan gamma Proteobakteria dan satu urutan berada di antara gamma dan beta Proteobakteria
1 2 3 4 5 6 7 8 1419 517 396 214 pb
(Gambar IV.18). Hasil yang hampir sama ditunjukkan oleh urutan DNA yang dilisis dengan metode bead-beating (Gambar IV.19). Kemiripan hasil analisis filogenetik menunjukkan bahwa kedua metode lisis sel yang digunakan tidak memberikan perbedaan yang signifikan dalam mendeteksi ragam mikroba dari sampel Kawah Hujan A.
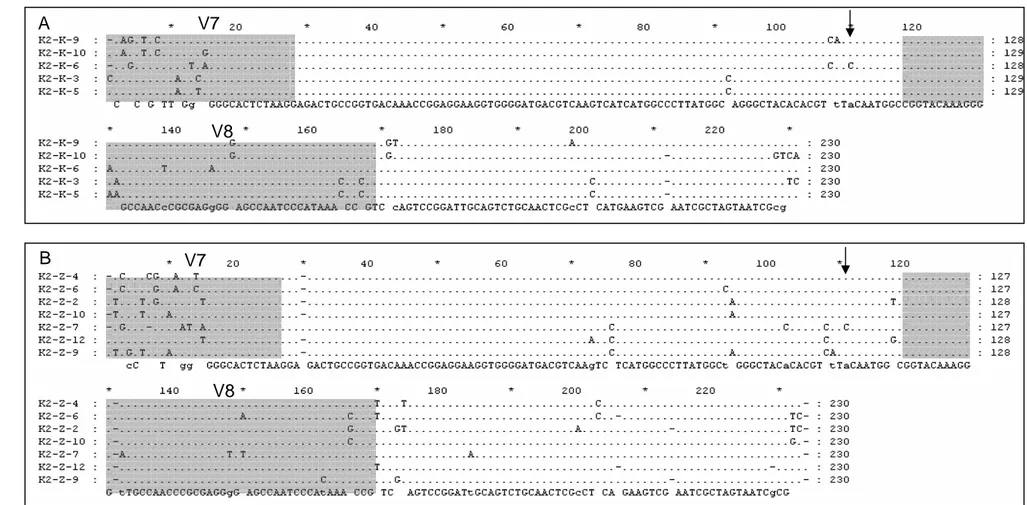
Hasil penjajaran urutan nukleotida di antara sampel Kawah Hujan A yang membentuk satu cluster pada pohon filogenetik, baik hasil lisis sel secara enzimatik maupun bead-beating, menunjukkan variasi yang cukup tinggi (Gambar IV.20A-B). Pada umumnya perbedaan di antara urutan-urutan nukleotida tersebut mencapai 4% atau lebih dan terjadi di daerah variabel V7 dan V8. Beberapa perbedaan yang teramati di luar daerah variabel V7 dan V8 juga tidak terjadi di daerah lestari, kecuali untuk sampel K6 dan Z7 yang menunjukkan perbedaan satu basa di daerah lestari (ditunjukkan oleh arah panah pada Gambar IV.20A-B). Posisi daerah variabel dan daerah lestari pada gen 16S rRNA E. coli dapat dilihat pada Lampiran E.
Variasi urutan yang cukup besar teramati juga pada hasil penjajaran urutan DNA sampel dengan urutan DNA mikroba kelompok gamma Proteobakteria pembanding yang berdekatan pada pohon filogenetik (Gambar IV.21). Perbedaan urutan terutama teramati pada daerah variabel V7 maupun V8, dan beberapa urutan variabel di luar V7 dan V8 kecuali untuk sampel K6 dan Z7 yang secara konsisten menunjukkan perbedaan di daerah lestari.
Gambar IV.18 Pohon filogenetik urutan fragmen gen 16S rRNA sampel filtrasi Kawah Hujan A dengan metode lisis sel enzimatis
Gambar IV.19 Pohon filogenetik urutan fragmen gen 16S rRNA sampel filtrasi Kawah Hujan A dengan metode lisis sel bead-beating
Gambar IV.20. Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan A hasil filtrasi
(A) sampel hasil lisis sel secara enzimatis; (B) sampel hasil lisis sel dengan bead-beating. Daerah berwarna abu-abu merupakan domain variabel V7dan V8. Tanda panah hitam menunjukkan perbedaan urutan sampel di daerah lestari A B V7 V8 V7 V8
Gambar IV.21 Hasil penjajaran urutan fragmen gen 16S rRNA sampel filtrasi Kawah Hujan A dengan urutan pembanding
Daerah variable V7 dan V8 ditunjukkan dengan warna abu-abu. Perbedaan urutan sampel di daerah lestari (conserved) ditunjukkan dengan kotak. Tanda titil (.) menunjukkan urutan nukleotida yang sama.
V7
Di dalam sel, gen 16S rRNA biasanya berjumlah lebih dari satu kopi (multi copy). Variasi urutan nukleotida dari masing-masing kopi dapat berbeda-beda (Case et al., 2007). Salah satu contoh hasil penjajaran gen 16S rRNA multi kopi yang diambil dari urutan genom lengkap spesies Geobacillus kaustophilus dan Methylococcus capsulatus pada posisi yang bersesuaian dengan urutan sampel menunjukkan hampir tidak ada perbedaan (Gambar IV.22). Pada spesies Geobacillus kaustophilus dari 9 multi kopi fragmen gen 16S rRNA, 7 kopi memiliki urutan nukleotida yang sama, satu kopi menunjukkan perbedaan satu basa dan satu kopi lainnya terdapat 4 nukleotida yang berbeda. Sedangkan 2 kopi pada Methylococcus capsulatus menunjukkan urutan yang sama.
Gambar IV.22 Hasil penjajaran urutan fragmen gen 16S rRNA multi kopi. (A) Geobacillus kaustophilus; (B) Methylococcus capsulatus
Berdasarkan kemiripan urutan multi kopi fragmen gen 16S rRNA pada satu spesies, perbedaan urutan nukleotida di antara sampel mengindikasikan bahwa
A
urutan fragmen gen 16S rRNA tersebut bukan berasal dari organisme yang sama. Variasi urutan yang terjadi di daerah variabel dapat menunjukkan perbedaan pada level genus atau spesies. Perbedaan urutan yang cukup tinggi antara sampel Kawah Hujan A dengan pembanding menunjukkan bahwa mikroba yang teridentifikasi dari sampel Kawah Hujan A berbeda dengan mikroba yang sudah terkulturkan saat ini walaupun masih berada dalam kelas yang sama, yaitu gamma Proteobakteria. Adanya perbedaan di daerah lestari memperbesar kemungkinan bahwa mikroba yang terdeteksi pada sampel Kawah Hujan A merupakan mikroba yang khas dan berbeda dengan yang sudah terdeteksi dari tempat lain.
Seperti yang sudah disebutkan sebelumnya, Kawah Hujan A memiliki temperatur dan tekanan tinggi. Kondisi tersebut dan letak sumber air yang berada di bawah permukaan tanah menyebabkan Kawah Hujan A kemungkinan besar merupakan habitat yang anoksik. Dengan demikian, mikroba yang hidup dominan pada habitat tersebut, selain bersifat termofilik diduga bersifat anaerob dan memiliki toleransi terhadap tekanan (barotoleran). Pada sel mikroba, temperatur dan tekanan tinggi akan mempengaruhi fisiologi dan biokimia sel seperti struktur dan aktivitas membran dan proteinnya (Madigan dan Martinko, 2006). Keunikan kondisi Kawah Hujan A diduga akan menyebabkan mikroba yang terdeteksi pada kawah tersebut juga bersifat unik. Dugaan ini diperkuat dengan hasil penjajaran urutan fragmen gen 16S rRNA sampel yang menunjukkan perbedaan dibandingkan dengan urutan yang sudah ditemukan saat ini.
Keterbatasan diversitas komunitas Kawah Hujan A yang hanya didominasi oleh kelompok gamma Proteobakteria kemungkinan karena hanya mikroba yang mampu menempel pada batuan dan sedimen yang dapat bertahan hidup dalam arus bertekanan tinggi dengan sumber nutrisi yang rendah. Habitat dengan kondisi berarus seperti di aliran Octopus Spring dan Calcite Springs juga menunjukkan diversitas mikroba yang rendah. Octopus Spring didominasi oleh bakteri pink filament dan cyanobacteria (Reysenbach et al., 1994; Ferris et al., 1996; Huber et al., 1998) sedangkan Calcite Springs didominasi oleh archaea (Reysenbach et al., 2000). Kedua tempat tersebut berada di Yellowstone National Park, USA.
Kelompok gamma Proteobakteria beberapa spesiesnya dikenal karena bersifat pathogen. Akan tetapi, pada saat ini gamma Proteobakteria banyak terdeteksi pada lingkungan termal seperti sumber air panas (Baker et al., 2001; Ghosh et al., 2003; Khalil et al., 2006) dan lubang hidrotermal (Hou et al., 2004), dan juga pada batuan bertekanan sangat tinggi (Zhang et al., 2005). Selain itu, gamma Proteobakteria seringkali merupakan kelompok bakteri utama yang terkulturkan dari bawah permukaan tanah (Biddle et al., 2005), dan beberapa diketahui merupakan bakteri pengoksidasi besi (Edwards, et al., 2003; Dhugana et al., 2007).
IV.5.1.2. Kekerabatan terdekat sampel hasil kultivasi dari Kawah Hujan A
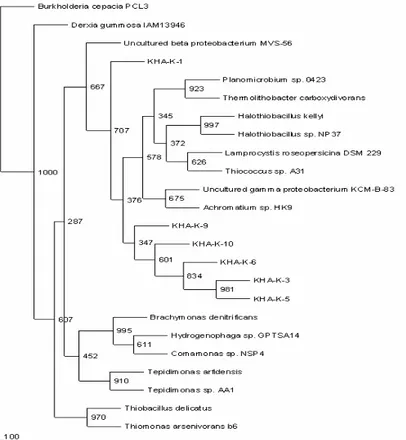
Biodiversitas mikroba dari sampel Kawah Hujan A yang ditumbuhkan dalam beberapa media kompleks berbeda dengan kelompok mikroba yang terdeteksi pada hasil filtrasi. Sebagian besar urutan fragmen gen 16S rRNA dari mikroba yang ditumbuhkan dalam media berbeda membentuk cluster yang dekat dengan Anoxybacillus, dua urutan lebih dekat dengan Geobacillus, dan satu dekat dengan Thermus (Gambar IV.23). Anoxybacillus dan Geobacillus keduanya termasuk dalam filum Firmicutes, sedangkan Thermus termasuk filum Deinococcus.
Gambar IV.23 Pohon filogenetik urutan fragmen gen 16S rRNA sampel Kawah Hujan A hasil kultivasi dalam beberapa media
Gambar IV.24 Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan A hasil kultivasi
(A) dekat dengan Anoxybacillus; (B) dekat dengan Geobacillus; (C) dekat dengan Thernus. Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu. Perbedaan urutan sampel di daerah lestari ditunjukkan dengan panah.
A B C V7 V8 V7 V8
Hasil penjajaran urutan nukleotida sampel dengan mikroba pembanding terdekatnya menunjukkan adanya perbedaan, baik dari kelompok urutan yang membentuk cluster dengan Anoxybacillus, Geobacillus, maupun Thermus (Gambar IV.24). Perbedaan urutan sampel yang dekat dengan kelompok Anoxybacillus terutama berada pada daerah variabel V7. Dua sampel (PB2 dan T3) memperlihatkan perbedaan satu basa di daerah lestari (Gambar IV.24A). Perbedaan urutan sampel yang dekat dengan kelompok Thermus dan Geobacillus tidak sebanyak kelompok Anoxybacillus. Perbedaan hanya teramati pada beberapa basa saja di daerah variabel. Dalam pohon filogenetiknya, urutan sampel yang dekat dengan kelompok Anoxybacillus membentuk cluster berbeda terhadap kelompok Anoxybacillus yang sudah terkulturkan.
Berdasarkan hasil penjajaran urutan nukleotida, mikroba yang terdeteksi dekat dengan Thermus (Gambar IV.24B) dan Geobacillus (Gambar IV.24C) kemungkinan memiliki kedekatan yang sangat tinggi dengan Thermus dan Geobacillus yang sudah diisolasi saat ini. Sedangkan untuk sampel yang memiliki kedekatan dengan Anoxybacillus yang menunjukkan perbedaan urutan nukleotida cukup tinggi dibandingkan dengan urutan pembanding kemungkinan merupakan galur berbeda dengan yang sudah ada saat ini.
Keberadaan Geobacillus dan Anoxybacillus pada Kawah Hujan A tidak mengherankan karena kedua organisme ini banyak ditemukan pada area geotermal (Pikuta et al., 2000; Baker et al., 2001; Belduz et al., 2003; Indrajaya dkk, 2003; McMullan et al., 2004; Akhmaloka et al., 2006; Pavlostathis et al., 2006; Faiz et al., 2007). Geobacillus dan Anoxybacillus merupakan bakteri gram positif berbentuk batang, dapat berspora, dan dapat menggunakan banyak macam sumber karbon untuk pertumbuhan secara heterotrop atau autotrop. Geobacillus bersifat aerobik dan anaerobik fakultatif, sedangkan Anoxybacillus bersifat anaerobik dan anaerobik fakultatif. Penanganan sampel yang bersifat aerobik tanpa aerasi masih memungkinkan untuk menumbuhkan mikroba yang bersifat aerob maupun anaerob fakultatif (Madigan dan Martinko, 2006).
Keberadaan genus Thermus pada lingkungan termal juga telah banyak dilaporkan. Bakteri ini telah ditemukan pada sumber air panas (Nunes et al., 1995; Brock, 1998), area di bawah permukaan tanah (Marteinsson et al., 2001; Kieft et al., 1999). Sebagian besar strain Thermus bersifat aerobik obligat, beberapa bersifat anaerobik fakultatif dan dapat menggunakan O2, NO3-, Fe (III), dan S0 sebagai
akseptor elektron akhir (Kieft et al., 1999).
IV.5.2 Kekerabatan terdekat sampel Kawah Hujan B
Kawah Hujan B bersifat sangat asam dengan kadar sulfat sangat tinggi dan kandungan Fe yang cukup tinggi, seperti yang sudah disampaikan pada bagian sebelumnya. Pada saat ini, mikroba termofilik yang toleran terhadap asam telah banyak terdeteksi dari bermacam-macam habitat seperti sumber air geothermal, kolam lumpur, dan lubang bawah laut (deep-sea vents) (Cleaver et al., 2007; Boyd et al., 2007; Kozubal et al., 2008). Beberapa di antara mikroba-mikroba tersebut menggunakan senyawa anorganik tereduksi, seperti hidrogen, sulfida, sulfur, tiosulfat, metana, atau Fe(II) sebagai sumber energi untuk metabolismenya (Kozubal et al., 2008).
IV.5.2.1. Kekerabatan terdekat sampel hasil filtrasi dari Kawah Hujan B
Berdasarkan hasil analisis filogenetik, pada sampel Kawah Hujan B terdeteksi adanya mikroba dari kelompok bakteri dan archaea, baik dari hasil lisis sel secara enzimatis maupun dengan cara bead-beating. Dari hasil lisis sel secara enzimatis, sebagian besar urutan fragmen gen 16S rRNA membentuk cluster yang dekat dengan filum Crenarchaeote (archaea) dan satu urutan dekat dengan Glacial ice bacterium dari kelas gamma Proteobakteria (bakteri) (Gambar IV.25). Sedangkan sebagian besar mikroba sampel Kawah Hujan B yang dilisis dengan cara bead-beating termasuk ke dalam kelas gamma Proteobakteria. Hanya 3 urutan yang membentuk cluster yang dekat dengan Crenarchaeote. Pada kelompok gamma Proteobakteria, tiga urutan dekat dengan Aeromonas, dua urutan dekat dengan Pantoea atau Enterobacter, dan dua urutan cenderung dekat dengan Aeromonas atau Xenorhabdus (Gambar IV.26).
Gambar IV.25 Pohon filogenetik urutan fragmen gen 16S rRNA sampel filtrasi Kawah Hujan B dengan metode lisis sel enzimatis
Gambar IV.26 Pohon filogenetik urutan fragmen gen 16S rRNA sampel filtrasi Kawah Hujan B dengan metode lisis sel bead-beating.
Hasil penjajaran urutan nukleotida di antara sampel yang membentuk cluster dengan archaea pada sampel filtrasi dengan metode enzimatis menunjukkan variasi yang cukup tinggi. Perbedaan urutan menyebar hampir di semua bagian fragmen gen 16S rRNA. Variasi urutan juga terlihat pada hasil penjajaran sampel dengan urutan pembanding yang paling dekat, yaitu archaea dari filum Crenarchaeota. Perbedaan urutan tidak hanya terlihat di daerah variabel, tetapi juga terlihat di daerah-daerah yang lestari. Beberapa perbedaan di daerah lestari maupun di daerah variabel konsisten di antara sampel dibandingkan dengan urutan pembanding. Di daerah V7 terlihat cukup banyak perbedaan yang mengelompok antara urutan sampel dibandingkan dengan urutan pembanding, demikian juga di luar daerah variabelnya (Gambar IV.27).
Pada sampel yang memiliki kedekatan dengan kelas gamma Proteobakteria, perbedaan urutan terutama terlihat pada daerah variabel V7 dan V8. Hasil penjajaran ditunjukkan pada Gambar IV.28. Beberapa variasi juga terlihat di luar daerah V7 dan V8, akan tetapi sebagian besar merupakan urutan yang variabel. Beberapa perbedaan basa pada sampel berada di daerah lestari.
Berdasarkan hasil penjajaran di atas, sampel filtrasi Kawah Hujan B yang dekat dengan kelompok archaea menunjukkan perbedaan yang sangat besar dibandingkan dengan urutan kelompok Crenarchaeota pembandingnya. Hal ini menjadi indikasi bahwa kelompok archaea pada sampel Kawah Hujan B sangat berbeda dengan archaea yang sudah dikulturkan atau terdeteksi saat ini. Sedangkan sampel yang dekat dengan kelas gamma Proteobakteria lebih menunjukkan kedekatan dengan mikroba yang sudah teridentifikasi saat ini, walaupun kemungkinan merupakan organisme yang unik dari kelas gamma Proteobakteria.
Gambar IV.27 Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil filtrasi menggunakan metode lisis enzimatis dengan urutan nukleotida pembandingnya.
Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu.
V7
Gambar IV.28. Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil filtrasi menggunakan metode lisis enzimatis dengan urutan pembanding dari kelas gamma Proteobakteria
Daerah hipervariabel V7 dan V8 ditunjukkan dengan kotak abu-abu. Perbedaan urutan sampel di daerah lestari ditunjukkan dengan panah.
Dugaan bahwa pada sampel Kawah Hujan B terdapat mikroba dari kelompok archaea yang khas diperkuat dengan hasil penjajaran urutan nukleotida sampel dari metode lisis bead-beating dengan urutan pembanding yang paling dekat (Gambar IV.29A). Seperti halnya sampel Kawah Hujan B yang dilisis secara enzimatis, urutan nukleotida yang dekat dengan archaea menunjukkan perbedaan yang sangat tinggi terhadap urutan pembandingnya. Perbedaan tersebut tersebar di sepanjang fragmen gen 16S rRNA, baik di daerah variabel maupun di daerah lestari.
Variasi urutan cukup tinggi terlihat juga pada sampel yang dekat dengan Aeromonas (Gambar IV.29B). Perbedaan di daerah variabel V7 maupun V8 terlihat cukup banyak. Perbedaan juga teramati pada bagian awal fragmen gen 16S rRNA, sebelum daerah variasi V7. Pada bagian tersebut sebagian besar merupakan daerah dengan urutan yang lestari. Di antara semua sampel filtrasi Kawah Hujan B, sampel yang dekat dengan Pantoea/Enterobacter memiliki kemiripan urutan yang paling tinggi terhadap urutan pembandingnya.
Berdasarkan hasil analisis filogenetik sampel filtrasi Kawah Hujan B yang diperoleh dari metode lisis enzimatis menunjukkan diversitas yang sedikit berbeda dibandingkan dengan metode bead-beating. Mikroba-mikroba yang memiliki kedekatan dengan Aeromonas dan Pantoea/Enterobacter yang terdeteksi dengan metode lisis bead-beating tidak terdeteksi dengan metode enzimatis. Sebaliknya, sampel yang memiliki kedekatan dengan Glacial ice bacterium/Pseudomonas yang terdeteksi dengan metode enzimatis, tidak terdapat pada sampel dengan lisis secara bead-beating. Yang konsisten dari kedua metode tersebut adalah dapat mengidentifikasi keberadaan archaea walaupun dengan jumlah sampel yang berbeda.
Gambar IV.29AHasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil filtrasi menggunakan lisis sel bead-beating yang dekat dengan kelompok archaea.
Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu. Tanda titil (.) menunjukkan urutan nukleotida yang
A V7
Gambar IV.29B Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil filtrasi menggunakan lisis sel bead-beating yang dekat dengan Aeromonas
Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu. Tanda titil (.) menunjukkan urutan nukleotida yang sama.
B V7
Kondisi fisik Kawah Hujan B yang berada di permukaan tanah dengan temperatur tinggi merupakan lingkungan yang memiliki kontak yang relatif luas dengan oksigen. Walaupun demikian, kelarutan oksigen pada temperatur tinggi relatif kecil. Berdasarkan sifat kimianya, Kawah Hujan B memiliki pH yang sangat asam dengan kandungan sulfat tinggi. Dengan demikian, berdasarkan kondisi fisik dan kimia lingkungannya, Kawah Hujan B merupakan habitat potensial bagi kelompok mikroba yang bersifat aerob atau fakultatif anaerob, termofilik, dan asidofilik, serta menggunakan senyawa sulfur atau sulfida sebagai sumber energi metabolismenya (Madigan dan Martinko, 2006).
Keberadaan Crenarchaeota pada habitat Kawah Hujan B diduga berhubungan dengan kondisi fisik dan kimia lingkungannya. Crenarchaeota termasuk kelompok archaea yang banyak ditemukan pada lingkungan sangat ekstrim (Boyd et al., 2007; Kozubal et al., 2008). Sebagian besar Crenarchaeota merupakan hipertermofilik yang diisolasi dari laut atau area vulkanik. Beberapa spesies merupakan termoasidofil yang tinggal pada lingkungan dengan konsentrasi sulfat yang tinggi (Boyd et al., 2007). Crenarchaeota bersifat aerob, anearob fakultatif dan anaerob, kemoorganotrop maupun litotrop, dan beberapa menggunakan sulfur sebagai sumber energi metabolismenya (Bintrim et al. 1997; DeLong et al. 1994; Furhman et al.1992; Hersberger et al.1996).
IV.5.2.2. Kekerabatan terdekat sampel hasil kultivasi dari Kawah Hujan B
Sampel Kawah Hujan B telah dikulturkan dalam beberapa macam media kaya (media P, PB, dan ¼ LB). Berdasarkan hasil analisis filogenetik, mikroba yang terdeteksi pada kultur dalam media yang berbeda menunjukkan diversitas berbeda. Pada media P, semua sampel memiliki kedekatan dengan kelas gamma Proteobakteria. Sebagian besar urutan sampel memiliki kedekatan dengan Pantoea/Enterobacter, tiga urutan membentuk cluster berbeda, dan satu urutan paling dekat dengan Pseudomonas (Gambar IV.30).
Gambar IV.30 Pohon filogenetik urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil kultivasi dalam media P
Berbeda dengan kultur dalam media P, kultur mikroba dalam media PB sebagian besar memiliki kedekatan dengan Alicyclobacillus dari filum Firmicutes. Hanya tiga sampel yang dekat dengan kelompok gamma Proteobakteria, dan dua di antaranya dekat dengan Pantoea/Enterobacter (Gambar IV.31). Keberadaan sampel yang dekat dengan Alicyclobacillus juga terdeteksi dalam kultur yang ditumbuhkan dalam media ¼ LB (Gambar IV.32). Empat urutan sampel dalam media ¼ LB cenderung membentuk cabang dekat dengan kelompok Alicyclobacillus, dan hanya satu urutan yang berada di antara klas gamma Proteobacterium.
Gambar IV.31 Pohon filogenetik urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil kultivasi dalam media PB
Gambar IV.32 Pohon filogenetik urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil kultivasi dalam media ¼ LB
Hasil penjajaran urutan sampel dalam media P yang dekat dengan Pseudomonas menunjukkan beberapa perbedaan, terutama pada daerah variabel V7, dibandingkan dengan urutan DNA pembanding dari GenBank yang telah diketahui sebelumnya. Beberapa variasi urutan di luar daerah V7 pada umumnya merupakan urutan yang variabel. Hanya satu basa yang berbeda di daerah lestari (Gambar IV.33). Berdasarkan hasil penjajaran tersebut, Pseudomonas yang terdeteksi dalam kultur media P kemungkinan merupakan spesies atau galur baru yang berbeda.
Gambar IV.33 Hasil penjajaran urutan fragmen gen 16S rRNA sampel kultivasi Kawah Hujan B dalam media P dengan urutan pembanding
Hasil penjajaran urutan sampel kultur dalam media ¼ LB yang dekat dengan Alicyclobacillus menunjukkan perbedaan cukup besar terutama di daerah variabel V7 dan V8 (Gambar IV.34A). Pada umumnya perbedaan antara urutan sampel dengan urutan pembanding mengelompok di antara sampel. Sampel yang berada di antara kelompok gamma Proteobakteria pada kultur ¼ LB tidak menunjukkan perbedaan yang berarti dengan urutan pembandingnya yang paling dekat, yaitu uncultured gamma Proteobakteria (Gambar IV.34B).
Gambar IV.34A Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil kultivasi dalam media ¼ LB dengan pembandingnya yang dekat dengan Alicyclobacillus
Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu. Tanda titil (.) menunjukkan urutan nukleotida yang sama.
V8 V7
Gambar IV.34B Hasil penjajaran urutan fragmen gen 16S rRNA sampel Kawah Hujan B hasil kultivasi dalam media ¼ LB dan pembandingnya yang dekat dengan kelas gamma Proteobakteria
Daerah hipervariabel V7dan V8 ditunjukkan dengan kotak abu-abu. Tanda titil (.) menunjukkan urutan nukleotida yang sama.
V7
Berdasarkan hasil analisis filogenetik, komunitas mikroba yang terdeteksi dalam kultur berbeda dengan komunitas yang terdeteksi dari sampel filtrasi. Pada kultur terdeteksi mikroba dari filum Firmicutes (Alicyclobacillus) yang tidak terlihat pada sampel hasil filtrasi. Demikian juga, kelompok archaea yang dominan pada sampel filtrasi tidak terdeteksi pada kultur. Hal ini kemungkinan karena media yang digunakan untuk kultivasi tidak sesuai bagi pertumbuhan archaea. Dari hasil penjajaran antara urutan nukleotida sampel dengan urutan pembanding, untuk mendapatkan mikroba yang berbeda dengan isolat yang sudah ada saat ini sangat memungkinkan terutama untuk genus Alicyclobacillus.
IV.6 Mikroba Kultur Tunggal
Mikroba yang ditumbuhkan dari sampel air kawah dalam beberapa macam media berdasarkan hasil analisis filogenetik merupakan kultur campuran. Untuk keperluan praktis seperti isolasi enzim tertentu, seringkali dibutuhkan mikroba dalam bentuk kultur murni. Beberapa kultur campuran yang ditumbuhkan dari sampel Kawah Hujan A telah dimurnikan dengan cara pengenceran berseri. Kultur murni tersebut kemudian diidentifikasi berdasarkan urutan gen 16S rRNA. Untuk keperluan identifikasi dilakukan isolasi DNA kromosom, amplifikasi gen 16S rRNA menggunakan pasangan primer Bact27 F dan Uni1492 R. Hasil amplifikasi ditentukan urutan nukleotidanya dengan menggunakan primer yang sama dengan primer amplifikasinya ditambah dengan sepasang primer di bagian dalam gen, yaitu Com1-F dan Com-2 R.
IV.6.1 DNA kromosom mikroba kultur tunggal
DNA kromosom yang diisolasi dari kultur tunggal menunjukan ketebalan pita yang berbeda-beda. Sebagian dari hasil isolasi DNA kromosom ditunjukkan pada Gambar IV.35. Kultur tunggal yang diperoleh dari media ¼ LB pada umumnya menunjukkan pita-pita yang paling tebal dan mempunyai pola pita yang khas, yaitu terdapat dua pita di bagian bawah gel selain pita utama di bagian atas. Pola pita khas tersebut tidak teramati pada kultur tunggal dari media P dan T. Posisi 2
pita di bagian bawah tersebut bentuknya diskrit dan konsisten ukurannya pada 3 kultur yang diisolasi terpisah. Hal ini menunjukkan kecilnya kemungkinan pita-pita tersebut merupakan hasil degradasi DNA kromosom selama proses isolasi. Ada kemungkinan pita-pita tersebut berasal dari DNA di luar DNA kromosom (misalnya plasmid). Akan tetapi, untuk memastikan hal tersebut masih perlu dilakukan analisis lebih lanjut.
Gambar IV.35 Elektroforegram DNA kromosom kultur tunggal sampel Kawah Hujan A
(1-3) media ¼ LB koloni 1, 4 dan 11; (4-5) media T koloni 25 dan 11; (6-7) media P koloni 1 dan 11; (8) media PB koloni 7.
IV.6.2 Gen 16S rRNA mikroba kultur tunggal
Hasil amplifikasi gen 16S rRNA menunjukkan pita DNA dengan ukuran sekitar 1,5 kb dengan ketebalan yang berbeda-beda. Contoh beberapa hasil amplifikasi ditunjukkan pada Gambar IV.36. Primer yang digunakan untuk amplifikasi adalah primer yang komplemen dengan urutan pada gen 16S rRNA yang conserved pada bakteri dan primer universal. Perbedaan ketebalan pita kemungkinan disebabkan karena perbedaan jumlah sel atau ketidakcocokan primer yang digunakan.
Gen 16S rRNA hasil amplifikasi kemudian ditentukan urutan nukleotidanya untuk keperluan identifikasi. Untuk mendapatkan pembacaan urutan gen 16S rRNA yang hampir utuh diperlukan paling sedikit 4 primer sekuensing. Pada penelitian ini, tidak semua isolat ditentukan urutan gen 16S rRNA secara utuh. Sebagian besar isolat ditentukan urutan gen 16S rRNA dengan menggunakan satu primer dengan hasil pembacaan urutan sekitar 500-600 basa. Hanya sekitar 5 isolat yang sudah ditentukan urutan gen 16S rRNA hampir secara utuh, dengan hasil
pembacaan sekitar 1350 basa. Kelima urutan tersebut sudah dideposit ke GenBank dengan nomor akses EU784082-EU784086. Nomor akses untuk masing-masing isolat dapat dilihat pada Lampiran C. Untuk melihat tingkat kemiripan urutan tersebut dengan urutan DNA yang sudah terdaftar di GenBank dilakukan penjajaran dengan menggunakan program BLAST dari NCBI (http://www.ncbi.nlm.nih.gov).
Gambar IV.36 Elektroforegram hasil amplifikasi gen 16S rRNA kultur tunggal sampel Kawah Hujan A
(1) DNAλ/HindIII; (2-3) media ¼ LB koloni 4 dan 11; (4) media PB koloni 7; (5-6) media T koloni 25 dan 11; (7) media P koloni 11
IV.6.3 Kemiripan tertinggi mikroba kultur tunggal
Berdasarkan hasil penjajaran urutan parsial gen 16S rRNA sampel isolat dengan data nukleotida yang ada di Gen Bank, sebagian besar isolat yang ditumbuhkan dalam media P, PB, T, dan ¼ LB memiliki kemiripan yang tinggi dengan genus Geobacillus. Sebagian kecil isolat menunjukkan kemiripan dengan genus Pantoea atau Enterobacter. Hasil penjajaran antara urutan gen 16S rRNA hampir utuh beberapa isolat sampel dengan isolat Geobacillus yang sudah ada menunjukkan tingkat kemiripan yang berbeda, diantaranya isolat T12 dan T13 menunjukkan kemiripan dengan Geobacillus kaustophilus yang hanya dibedakan oleh adanya dua gap dari sekitar 1350 urutan nukleotida. Sedangkan isolat T25 menunjukkan kemiripan paling dekat dengan Geobacillus sp atau Geobacillus thermocatenulatus akan tetapi dengan perbedaan urutan nukleotida relatif lebih tinggi, yaitu masing-masing berbeda sekitar 20 basa dan terdapat beberapa gap.
1 2 3 4 5 6 7 23130 bp 9416 bp 6557 bp 4361 bp 2322 bp 2027 bp