TESIS
AHMAD FAISAL NASUTION 147030009
PROGRAM PASCASARJANA BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2018
TESIS
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Magister Sains
AHMAD FAISAL NASUTION 147030009
PROGRAM PASCASARJANA BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
ISOLASI DAN UJI TOKSISITAS ISOLAT Bacillus thuringiensis LOKAL TERHADAP LARVA NYAMUK Aedes aegypti
TESIS
Saya menyatakan bahwa tesis ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2018
Ahmad Faisal Nasution NIM. 147030009
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Ahmad Faisal Nasution
NIM : 147030009
Program Studi : Magister Ilmu Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksekutif (Non-Executive Free Right) atas tesis saya yang berjudul :
Isolasi dan Uji Toksisitas Isolat Bacillus thuringiensis Lokal Terhadap Larva Nyamuk Aedes aegypti
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non- Eksekutif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Juni 2018
Ahmad Faisal Nasution
Judul : Isolasi dan Uji Toksisitas Isolat Bacillus thuringiensis Lokal Terhadap Larva Nyamuk Aedes aegypti
Katagori : Tesis
Nama Mahasiswa : Ahmad Faisal Nasution Nomor Induk Mahasiswa : 147030009
Program Studi : Magister Ilmu Biologi
Fakultas : MIPA – Universitas Sumatera Utara
Disetujui di Medan, Juni 2018
Komisi Pembimbing
Ketua Anggota
Prof. Dr. Dwi Suryanto, M.Sc Ameilia Zuliyanti Siregar, M.Sc, Ph.D NIP. 19640409 1994 03 1 003 NIP. 19730527 200512 002
Ketua Program Studi, Dekan,
Prof. Dr. Syafruddin Ilyas, M.Biomed Dr. Kerista Sebayang, M.S NIP. 196600209 1992 03 1 003 NIP. 19580623 198601 1 001
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Dwi Suryanto, M.Sc
Anggota : 1. Ameilia Zuliyanti Siregar, M.Sc, Ph.D 2. Prof. Dr. Erman Munir, M.Sc
3. Dr. It Jamilah, M.Sc
ABSTRAK
Bacillus thuringiensis (Bt) adalah bakteri gram-positif, pembentuk spora, dan menghasilkan protein kristal yang digunakan sebagai bioinsektisida.
Tujuan penelitian ini adalah untuk mengetahui potensi isolat Bt lokal dalam mengendalikan larva nyamuk Aedes aegypti. Isolasi Bt dari sampel tanah Hutan Tongkoh, Brastagi, Sumatra Utara, Indonesia. Spora Bt dan protein kristal diamati menggunakan mikroskop cahaya dan selanjutnya menggunakan mikroskop skaning elektron. Dua isolat yang memiliki kemiripan dengan Bt dipilih berdasarkan karakteristik morfologi dan biokimia. Identifikasi lebih lanjut dilakukan dengan menggunakan gen 16S rRNA. Untuk mengetahui pola pertumbuhan Bt pada sumber C dan N, isolat Bt ditanam pada media biakan dengan molase dan urea sebagai sumber C dan N. Untuk menguji isolat Bt dalam mengendalikan nyamuk, larva nyamuk instar 3 dimasukkan ke dalam 50 ml media uji dengan volume 5, 10, 15, 20, dan 25 ml dari kultur Bt dalam gelas plastik.
Pengamatan dilakukan setelah 24 jam. Dua isolat SP7 dan SP15 menunjukkan karakteristik morfologi dan biokimia yang mirip dengan Bt. Identifikasi berdasarkan urutan gen 16S rRNA menunjukkan bahwa SP7 dan SP15 sebagai B.
thuringiensis strain MCCC 1A00395 dengan kemiripan 99%. Kedua isolat Bt memiliki kemiripan dengan B. thuringiensis strain MCCC 1A00395. Isolat SP7 dan SP15 mencapai pertumbuhan maksimum pada 30 jam waktu inkubasi dengan jumlah sel berturut-turut 17,01 log CFU/ml dan 17,97 Log CFU/ml dalam media kultur molase dan urea sebagai sumber C dan N. Isolat SP7 dan SP15 menunjukkan membunuh larva nyamuk hingga berturut-turut 97,5% dan 95%
pada volume 25 ml kultur bakteri.
Kata kunci: Bacillus thuringiensis, pertumbuhan sel dan toksisitas
ABSTRACT
Bacillus thuringiensis (Bt) is a gram-positive bacteria, spore-forming, and producing crystal proteins used as bioinsecticides. The purpose of the study was to know potential of local isolates of Bt in controlling mosquito larva of Aedes aegypti. Isolation of Bt was conducted from soil samples of Tongkoh Forest, Brastagi, North Sumatra, Indonesia. Bt spore and crystal protein were observed using compound light microscope and further using scanning electron microscope. Two suspected isolates were choosen based on their morphological and biochemical characteristic. Further identification was done using their 16S rRNA gene. To know Bt growth pattern in inexpensive C and N-source, Bt isolate was grown in culture media with molasses and urea as C and N sources. To assay on Bt isolate to control mosquito, larva instar 3 of mosquito were put in 50 ml of test media of volume of 5, 10, 15, 20, and 25 ml of Bt culture in plastic cup.
Observation was done after 24 hrs. Two isolates SP7 and SP15 showed to have morphological and biochemical characteristic similar tothat of Bt. Identification based on 16S rRNA gene sequence showed that SP7 and SP15 were closed to B.
thuringiensis strain MCCC 1A00395 with similarity of 99%. Since two Bt isolates seemed to be similar to B. thuringiensis strain MCCC 1A00395. SP7 and SP15 isolates reached its maximum growth at 30 hrs of incubation time with cell number of 17.01 log CFU/ml and 17,97 Log CFU/ml respectivly in culture media with molasses and urea as C and N sources. SP7 and SP15 isolates showed to kill up to 97.5% and 95% respectivly mosquito larvae at volume of 50% bacterial culture.
Keywords: Bacillus thuringiensis, cell growth and toxicity
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat, kekuatan, hidayah dan kemudahan sehingga tesis ini diselesaikan dengan baik.
Tesis dengan judul “Isolasi dan Uji Toksisitas Isolat Bacillus thuringiensis Lokal Terhadap Larva Nyamuk Aedes aegypti” adalah merupakan syarat untuk memperoleh gelar Magister Sains pada Program Pascasarjana Magister Ilmu Biologi FMIPA USU.
Keberhasilan dari penelitian dan penulisan tesis ini tidak terlepas dari bantuan dari berbagai pihak yang terlibat secara langsung maupun tidak langsung dan telah memberikan dukungan secara moril maupun materil. Pada kesempatan ini penulis ingin mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Ayah dan Ibu tercinta, Kakak saya Sofia, Adik-adik saya Nisa dan Nikita terima kasih atas doa, semangat dan dukungannya serta bantuannya selama pelaksanaan penelitian hingga akhir penulisan tesis ini.
2. Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku dosen Pembimbing I dan Ibu Ameilia Zuliyanti Siregar, M.Sc, Ph.D sekalu dosen Pembimbing II. Terima kasih atas bimbingan, pengarahan, bantuan dan nasihat yang telah diberikan selama penulis melaksanakan penelitian dan penulisan tesis ini.
3. Bapak Prof. Dr. Erman Munir, M.Sc selaku dosen Penguji I dan Ibu Dr. It Jamilah, M.Sc selaku dosen Penguji II. Terima kasih atas saran, nasihat dan pengarahan yang diberikan untuk kesempurnaan penulisan tesis ini.
4. Bapak Prof. Dr. Syafruddin Ilyas, M.Biomed dan Ibu Dr. It Jamilah, M.Sc selaku keyua dan sekretaris Departemen S2 Biologi .
5. Seluruh staf pengajar yang tidak dapat penulis tuliskan satu persatu , terimakasih atas segala ilmu dan kemurahan hati selama masa perkuliahan 6. Seluruh staf pegawai S2 Biologi, Pak Rizal, Bu Ipit, Kak Pia atas segala
bantuan yang diberikan kepada penulis selama ini.
7. Sahabat-sahabatku sekaligus teman-teman persejuangan Restya, Lukas, Adit dan Ira yang selalu memberikan dukungan dan semangat dan yang selalu ada untuk membantuku.
8. Teman-temanku di Keluarga Besar S2 Biologi yang tidak bisa disebutkan satu per satu. Terima kasih atas keceriaan, kebahagiaan dan kenangan yang telah kalian berikan selama ini .
9. Seluruh staf Laboratorium Mikrobiologi dan Laboratorium Genetika Universitas Sumatera Utara terimakasih atas bantuannya. Semoga hasil penelitian ini dapat bermanfaat bagi yang memerlukan.
ilmu pengetahuan.
Medan, Juni 2018
Ahmad Faisal Nasution
Halaman PENGESAHAN TESIS
PENETAPAN PANITIA PENGUJI ABSTRAK
ABSTRACT PRAKATA DAFTAR ISI DAFTAR TABEL DAFTAR GAMBAR
i iii iv v vii ix x
BAB 1 PENDAHULUAN 1
1.1 Latar Belakang 1.2 Permasalahan 1.3 Tujuan Penelitian 1.4 Manfaat Penelitian
1 2 3 3
BAB 2 TINJAUAN PUSTAKA 4
2.1 Karakteristik Bacillus thuringiensis 2.2 Bioinsektisida
2.3 Faktor Pengaruh Pertumbuhan 2.3.1 Komposisi Media 2.3.2 Sumber Karbon 2.3.3 Sumber Nitrogen 2.3.4 Mineral
2.4 Molase 2.5 Urea
2.6 Nyamuk Aedes aegypti
2.7 Mekanisme Kerja Kristal Protein Bacillus thuringiensis 2.8 Manfaat Bioteknologi Bacillus thuringiensis
4 6 7 7 7 7 7 7 8 8 9 9
BAB 3 METODE PENELITIAN 11
3.1 Waktu dan Tempat 3.2 Metode Penelitian
3.2.1 Preparasi Medium Luria Bertani 3.2.2 Pengambilan Sampel Tanah
3.2.3 Isolasi dan Pemurnian Bakteri Bacillus thuringiensis 3.2.4 Karakterisasi Morfologi Isolat
3.2.5 Pewarnaan Kristal Protein
3.2.6 Pengamatan Kristal Protein Menggunakan SEM (Scanning Electron Microscopy)
3.2.7 Identifikasi Bacillus thuringiensis Berdasarkan 16S 11 11 11 11 11 12 12 13 13
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakteristik Isolat Bakteri 4.2 Pengamatan Kristal Protein
4.3 Hasil SEM (scanning electron microscopy)
4.4 Identifikasi Bacillus thuringiensis Berdasarkan Gen Penyandi 16S rRNA
4.5 Pengaruh Media Molase-Urea Terhadap Pertumbuhan Bacillus thuringiensis
4.6 Uji Toksisitas Bacillus thuringiensis terhadap Aedes aegypti
16 16 19 20 21 24 27
BAB 5 KESIMPULAN 5.1 Kesimpulan 5.2 Saran
30 30 30 DAFTAR PUSTAKA
LAMPIRAN
31 38
Nomor Tabel
Judul Halaman
2.1 Klasifikasi kristal protein (cry) Bacillus thuringiensis dan spesifikasi terhadap serangga
5
4.1 Karakteristik morfologi dan sifat gram bakteri isolat 16
4.2 Karakteristik biokimia bakteri isolat 18
4.3 Konsentrasi dan kemurnian DNA genom 21
4.4 Konsentrasi dan kemurnian amplicon 22
4.5 Hasil skuensing isolat berdasarkan gen penyandi 16S rRNA
24
4.6 Hasil analisis laboratorium kandungan molase 24
Nomor Gambar
Judul Halaman
2.1 (a) Sel vegetatif Bacillus thuringiensis, (b) spora, (c) bypiramydal, (d) rhomboidal, (e) spherical
4
4.1 Hasil pengamatan mikroskop : (a) Isolat SP7 dan (b) Isolat SP15
19
4.2 Hasil pengamatan SEM (scanning electron microscopy) : (a) Isolat SP7 dan (b) Isolat SP15
20
4.3 Hasil elektroforesis DNA genom isolat bakteri. Lajur (1) Marker DNA 1 kb; Lajur (2) DNA genom SP7 dan Lajur (3) DNA genom SP15
22
4.4 Hasil PCR gen penyandi 16S rRNA. Lajur (1) Marker DNA 1 kb; Lajur (2) Kontrol negatif dan lajur (3 dan 4) DNA gen penyandi 16S rRNA isolatSP7 dan SP15
23
4.5 Profil kurva pertumbuhan sel isolat SP7 dan SP15 26 4.6 Persentase mortalitas larva Aedes aegypti akibat
perlakuan isolat SP7 dan SP15 selama 24 Jam
27
4.7 Kerusakan membran saluran pencernaan larva A.
aegypti. (a) Larva normal; (b) Hasil uji toksisitas oleh B.
thuringiensis. Keterangan : x = saluran pencernaan yang terinfeksi
29
BAB I PENDAHULUAN
1.1 Latar Belakang
Negara Indonesia merupakan salah satu negara tropis yang selalu dihadapkan dengan berbagai masalah wabah penyakit yang disebabkan nyamuk, seperti malaria, DBD (demam berdarah dengue) dan vektor penyakit lainnya.
DBD merupakan penyakit yang disebabkan oleh virus Flavivirus yang ditularkan ke manusia melalui gigitan nyamuk Aedes. Penyakit ini banyak ditemukan di daerah tropis dan sub-tropis. Data dari seluruh dunia menunjukkan Asia menempati urutan pertama dalam jumlah penderita DBD setiap tahunnya dan negara Indonesia menempati urutam pertama dengan kasus DBD tertinggi di Asia Tenggara berdasarkan WHO (World Health Organization).
Upaya penanggulangan dan pencegahan nyamuk sudah banyak dilakukan.
Penggunaan insektisida kimiawi banyak digunakan padahal penggunaan insektisida ini sangat tidak menguntungkan karena dapat membahayakan bagi manusia dan pencemaran lingkungan serta resistensi serangga (Rahayuningsih dkk., 2007). Salah satu upaya untuk mengendalikan nyamuk tanpa menimbulkan bahaya bagi manusia dan lingkungan adalah dengan menggunakan insektisida biologis. Penggunaan bakteri Bacillus thuringiensis dapat dijadikan sebagai alternatif bioinsektisida (Aksoy dkk., 2015).
B. thuringiensis dapat mematikan berbagai larva nyamuk baik Aedes, Culex maupun Anopheles, tetapi tidak mematikan bagi organisme yang bukan sasarannya. Berbagai strain B. thuringiensis diketahui sebagai produk komersial yang dijadikan bioinsektisida. Studi untuk mengisolasi dan mengidentifikasi B.
thuringienis masih terus dilakukan, karena masih banyak vektor penyakit yang disebabkan oleh nyamuk yang tidak dapat dikontrol dengan menggunakan insektisida yang ada (Purnawati dkk., 2015).
Penggunaan B. thuringiensis sebagai bioinsektisida telah banyak diaplikasikan untuk menghambat perkembangan nyamuk sebagai vektor berbagai
penyakit maupun perkembangan serangga hama pertanian. Protein toksin B.
thuringiensis dihasilkan dalam bentuk protoksin dan aktif jika bakteri berada dalam kondisi yang tidak menguntungkan seperti nutrisi makanan yang berkurang. Toksin B. thuringiensis akan bereaksi di dalam usus serangga dan mengubah protoksin menjadi toksin (Broderick dkk., 2006).
Produksi bioinsektisida dan proses sporulasi sangat dipengaruhi oleh komposisi media pertumbuhan B. thuringiensis antara lain sumber karbon dan nitrogen, garam-garam mineral (K2HPO4, MgSO4.7H2O, CaCO3, Fe, Mn, dan Cu), suhu, dan pH awal medium (Mummigati dan Raghunathan 1990;
Rahayuningsih 2003; Sikdar dkk. 1991). Medium yang biasa digunakan untuk pertumbuhan bakteri B. thuringiensis adalah medium LB (luria bertani). Oleh karena itu, masih perlu dilakukan modifikasi media untuk mendapatkan formulasi pertumbuhan jumlah sel B. thuringiensis. Molase merupakan salah satu sumber karbon yang tinggi dan urea sebagai sumber nitrogen dapat dijadikan sebagai media pertumbuhan B. thuringiensis yang murah dan ramah lingkungan.
Penelitian Lantang dkk. (2012), B. thuringiensis diujikan terhadap larva nyamuk Anopheles. Hasil penelitian menunjukkan bahwa toksisitas B.
thuringiensis terhadap larva nyamuk sebesar 50%, 3 isolat diantaranya mempunyai toksisitas 80%. Berdasarkan penelitian Aksoy dkk. (2015), isolat Bt 22.19 menunjukkan tingginya toksisitas terhadap larva Culex pipiens.
Mummigati dan Raghunathan (1990), sumber karbon dan sumber nitrogen sangat berpengaruh terhadap pertumbuhan jumlah sel B. thuringiensis dan produksi bionisektisida. Oleh karena itu, penelitian ini dilakukan untuk mengisolasi dan mengkarakterisasi B. thuringiensis yang dapat dijadikan sebagai bioinsektisida terhadap nyamuk Aedes aegypti serta mengetahui pengaruh sumber karbon dan nitrogen terhadap pertumbuhan jumlah sel B. thuringiensis.
1.2 Permasalahan
Nyamuk merupakan salah satu vektor penyakit malaria dan DBD serta penyakit vektor lainnya. Penanggulangan dan pencegahan nyamuk terus menerus dilakukan, baik secara kimiawi maupun biologis. Di Indonesia, penggunaan
insektisida kimiawi banyak digunakan sebagai pengendali vektor nyamuk karena dapat menurunkan jumlah populasi nyamuk secara cepat dan mudah. Insektisida kimiawi dapat menyebabkan berbagai penyakit pada manusia dan pencemaran lingkungan. Oleh karena itu perlu dilakukan penelitian untuk mengisolasi bakteri B. thuringiensis sebagai bioinsektidsida yang dapat menurunkan jumlah populasi nyamuk yang relatif aman dan tidak menimbulkan berbagai penyakit pada manusia.
1.3 Tujuan Penelitian
a. Mengisolasi dan mengkarakterisasi isolat bakteri B. thuringiensis.
b. Mengetahui pengaruh sumber karbon dan nitrogen terhadap pertumbuhan jumlah sel B. thuringiensis
c. Mengetahui potensi isolat bakteri B. thuringiensis sebagai bioinsektisida terhadap larva nyamuk A. aegypti.
1.4 Manfaat Penelitian
Memberikan tambahan informasi tentang manfaat bioinsektisida dari B.
thuringiensis sebagai penanggulangan dan pencegahan nyamuk A. aegypti yang efektif dan ramah lingkungan tanpa menimbulkan berbagai penyakit pada manusia.
BAB II
TINJAUAN PUSTAKA
2.1 Karakteristik Bacillus thuringiensis
B. thuringiensis pertama kali dijumpai di Jepang pada tahun 1901. Bakteri ini merupakan bakteri gram positif berbentuk batang, aerob yang umumnya ditemukan di tanah dan menghasilkan protein kristal selama masa sporulasinya (Ahmed dkk. 2015; Bel dkk. 1997). Kristal-kristal parasporal terdiri dari satu atau lebih ICP (Insecticidal Crystal Protein) yang dikodekan dengan gen crystal (cry) dan gen cytolytic (cyt). Kedua gen ini sangat beragam jumlahnya dengan lebih dari 30 jenis protein cry dan 8 jenis cyt (Muniady dkk., 2011). Protein-protein ini bersifat patogen terhadap beberapa ordo serangga, antara lain Lepidoptera, Diptera, Coleoptera, Hymenoptera, Homoptera, Mallophaga, dan Acari (Hofte dan Whiteley 1989; Feitelson 1993; Bravo dkk. 1998). Parasporal terbentuk dari kristal protein berbeda-beda yang memiliki bentuk yang berbeda-beda, antara lain bypiramidal, rhombidal, spherical, dan campuran dari dua jenis kristal dapat dilihat pada Gambar 2.1. Perbedaan bentuk ini tergantung dari komposisi masing- masing kristal (Swamy dkk., 2011).
B. thuringiensis hanya tumbuh pada fase vegeatatif dan apabila nutrisi makanannya sedikit maka B. thuringiensis akan membentuk spora yang mengandung satu atau lebih jenis kristal protein. Kristal ini mengandung protein toksin yang dikenal dengan δ-endotoksin (Bahagiawati., 2002).
Gambar 2.1 (a) Sel vegetatif B. thuringiensis, (b) spora, (c) bypiramydal, (d) rhomboidal, (e) spherical (Swamy dkk., 2011)
Menurut Ciccarelli dkk. (2006), klasifikasi B. thuringiensis adalah sebagai berikut :
Kingdom : Eubacteria
Filum : Firmicutes
Kelas : Bacilli
Ordo : Bacillales
Famili : Bacillaceae
Genus : Bacillus
Spesies : Bacillus thuringiensis
B. thuringiensis terdiri dari beberapa subspesies, antara lain kurstaki, aizawai, entomocidus, berliner, san diego, tenebroid, morrisoni, dan islaelensis.
Dalam satu subspesies B. thuringiensis dijumpai beberapa strain dari B.
thuringiensis, antara lain HD-1, HD-5 dan sebagainya.
Insektisida B. thuringiensis menghasilkan parasporal body selama sporulasi. Inklusi ini dapat dibedakan dari bentuk kristalnya yang khas. Inklusi protein ini dikenal dengan nama ICP (insecticidal crystal protein) atau δ- endotoksin yang sangat beracun pada beberapa ordo serangga (Okassov dkk., 2015).
Umumnya lebih dari satu jenis kristal protein yang ditemukan dalam strain B. thuringiensis. Gen yang mengkode kristal protein dikenal dengan gen cry.
Menurut Hofte dan Whiteley (1989), kristal δ-endotoksin telak dikelompokkan menjadi 4 kelas utama, antara lain cryI sampai dengan cryIV.
Tabel 2.1 Kalsifikasi kristal protein (cry) B. thuringiensis dan spesifikasi terhadap serangga (Hofte dan Whiteley, 1989)
Kelas Ukuran Protein Sasaran Serangga
CryI 60-65 kDa Lepidoptera
CryII 68-71 kDa Lepidoptera dan Diptera
CryIII 73 kDa Coleoptera
CryIV 72-135 kDa Diptera
Pada tahun (1999) Mizuki dkk, pertama kalinya mempelajari inklusi parasporal yang diekstraksi dari strain B. thuringiensis sebagai sitotoksik terhadap leukimia. Sampai saat ini ada 6 jenis parasporin diidentifikasi sebgai agen antitumor (Okassov dkk., 2015).
Parasporin-1 (PS1) mengandung tiga domain protein cry, diaktifkan oleh N- terminal pencernaan. Protein ini memiliki berat molekul 81 kDa. Protein selanjutnya parasporin-2 (PS2) tidak mengandung 3 domain dan diaktifkan oleh N- dan C-pencernaan terminal. Protein ini memiliki berat molekul 37 kDa.
Parasporin-3 (PS3) terdiri dari 3 domain protein cry yang diaktifkan oleh N- dan C-pencernaan terminal. PS3 terdiri dari 825 residu asam amino dengan prediksi berat molekul 93 kDa. Parasporin-4 (PS4) tidak mengandung ke-3 jenis domain dan diaktifkan oleh C-pencernaan terminal. PS4 terdiri dari 275 residu asam amino dengan prediksi berat molekul 30 kDa. Parasporin-5 (PS5) memiliki analisis urutan sesuai dengan cry64Aa yang merupakan epsilon atau racun.
Parasporin-6 (PS6) terdiri dari 3 domain (Ito dkk. 2004; Ohba dkk. 2009; Saitoh dkk. 2006; Krishnan dkk. 2013)
2.2 Bioinsektisida
Bioinsektisida merupakan salah satu produk yang dihasilkan oleh mikoorganisme yang dapat membunuh serangga hama dan vektor berbagai penyakit. Bioinsektisida disebut juga sebagai insektisida mikrobial yang berarti racun yang dapat menghambat pertumbuhan dan perkembangan, tingkah laku, perkembangbiakan, dan lain sebagainya yang dihasilkan oleh mikroorganisme entomopatogen. Salah satu bakteri entomopatogen yang dimanfaatkan sebagai bioinsektisida adalah bakteri B. thuringiensis.
Penggunaan B. thuringiensis sebagai bioinsektisida telah banyak diaplikasikan untuk menghambat perkembangan nyamuk sebagai vektor berbagai penyakit maupun perkembangan serangga hama pertanian. Protein toksin B.
thuringiensis dihasilkan dalam bentuk protoksin jika bakteri berada dalam kondisi yang tidak menguntungkan seperti nutrisi makanan yang berkurang. Toksin B.
thuringiensis akan bereaksi di dalam usus serangga dan mengubah protoksin menjadi toksin (Broderick dkk., 2006).
2.3 Faktor Pengaruh Pertumbuhan 2.3.1 Komposisi Media
Media pertumbuhan B. thuringiensis memiliki peran yang sangat penting dalam proses sporulasi dan mempengaruhi produksi toksin (Mummigati dan Raghunathan, 1990). Berdasakan penelitian Rogoff dkk. (1969), bahwa komposisi media mempengaruhi aktivitas dari beberapa strain bakteri entomopatogen.
2.3.2 Sumber Karbon
Sumber karbon memiliki peran penting dalam pertumbuhan B.
thuringiensis. Namun, apabila digunakan pada konsentrasi yang tinggi dapat menyebabkan efek samping. Adapun sumber karbon antara lain sukrosa, laktosa, whey, gliserol, dekstrin, maltosa atau inulin, pati, glukosa dan molase (Icgen dkk., 2002)
2.3.3 Sumber Nitrogen
Nitrogen merupakan elemen yang sangat penting dalam proses biogenesis dari asam amino. Menurut Egorov dkk. (1983), pembentukan spora dari berbagai strain B. thuringiensis ditentukan oleh nitrogen represi katabolit.
2.3.4 Mineral
Mineral merupakan nutrisi yang sangat penting bagi organisme dan mikroorganisme. Menurut Dulmage dkk. (1990), terdapat lima ion logam yang sangat penting dalam pertumbuhan dan sporulasi dari bakteri. Unsur-unsur tersebut antara lain Mg2+, Ca2+, Zn2+, Fe2+, dan Mn2+.
2.4 Molase
Molase merupakan salah satu hasil samping dari proses pembuatan gula tebu. Meningkatnya produksi gula tebu di Indonesia tentunya akan meningkatkan produksi molase. Molase dapat dijadikan sebagai media pertumbuhan mikroorganisme yang sangat baik, karena mengandung gula, asam amino dan mineral yang cukup.
Menurut Suastuti (1998), molase mengandung senyawa nitrogen, trace element dan kandungan sukrosa sekitar 34% dan kandungan C-total sekitar 37%.
Tingginya kandungan gula pada molase menjadikan molase sebagai sumber karbon pada medium pertumbuhan mikroorganisme. Molase juga dapat dimanfaatkan sebagai bahan dasar pembuatan biogas dan etanol.
2.5 Urea
Urea merupakan salah satu sumber nitrogen yang banyak digunakan pada media pertumbuhan mikroorganisme karena kemampuannya dalam mempertahankan pH (Stanburry dan Whitaker, 1984). Sumber nitrogen mampu menghasilkan kristal protein dan spora dalam jumlah yang besar dengan tingkat toksisitas yang tinggi terhadap serangga. Berdasarkan penelitian Hendra (2006), urea mengandung senyawa karbon sekitar 20 % dan nitrogen sekitar 45,20%.
2.6 Nyamuk Aedes aegypti
Nyamuk A. aegypti merupakan salah satu vektor berbagai penyakit yang disebabkan oleh parasit dan virus dan banyak ditemukan di pemukiman penduduk. A. aegypti berperan sebagai vektor penyakit DBD yang disebabkan oleh virus Flavivirus.
A. aegypti termasuk ordo Diptera, memiliki sepasang sayap transparan pada mesotoraks. Sayap metotoraks diganti oleh halter (2 buah), memiliki antena variabel, alat mulut digunakan untuk menusuk dan mengisap (Brotowidjoyo, 1990). Nyamuk ini mengalami metamorfosis sempurna, siklus daur hidup dari telur sampai dewasa memiliki waktu yang pendek sekitar 1-2 minggu. Tempat perkembang biakan nyamuk ini di air jernih, maupun air keruh. Nyamuk ini
memiliki kebiasaan mengisap darah hospes pada malam hari dan jarak terbang dari nyamuk ini pendek (Pei dkk. 2002; Goldberg dan Margalit 1977).
Larva A. aegypti terdiri dari kepala, 3 segmen toraks, 10 ruas abdomen, siphon, dan ruas anal. Pada ruas abdomen ke-8 terdapat comb teeth yang berjumlah lebih dari dua baris. Siphon berbentuk kerucut dan panjang. Bulu siphon lebih dari satu pasang dan pada ujungnya terdapat alat pernapasan (Pusarawati dkk., 2008).
Siklus hidup nyamuk terdiri dari telur, larva, pupa dan dewasa. Nyamuk ini meletakkan telurnya di atas permukaan air satu per satu sampai membentuk kelompok yang menyerupai rakit. Dalam satu kelompok terdapat puluhan sampai ratusan telur. Telur nyamuk dapat bertahan hidup dalam waktu lama dalam bentuk dorman. Bila nutrisi dalam air cukup tersedia telur-telur ini dapat menetas 2-3 hari setelah di letakkan (Sembel, 2009).
Larva nyamuk terdiri dari stadium instar I, instar II, instar III, dan instar IV.
Larva nyamuk sering juga disebut sebagai jentik. Larva akan menggantungkan dirinya tegak lurus pada permukaan air untuk mendapatkan oksigen dari udara.
Larva nyamuk akan menyaring mikroorganisme-mikroorganisme dan partikel- partikel yang ada di dalam air sebagai sumber nutrisi untuk pertumbuhannya (Sembel, 2009).
Setelah melewati stadium instar IV, maka larva tersebut akan memasuki fase pupa. Pupa bergerak aktif di dalam air dan berenang naik turun dari bagian dasar ke permukaan air secara cepat. Setelah 1-3 hari maka kulit pupa akan pecah dan nyamuk dewasa akan keluar (Sembel, 2009).
2.7 Mekanisme Kerja Kristal Protein Bacillus thuringiensis
Menurut Hofte dan Whiteley (1989), cara kerja B. thuringiensis adalah dengan menghancurkan usus serangga. B. thuringiensis menghasilkan kristal protein yang bersifat insektisidal yang sering dikenal dengan δ-endotoksin. Kristal ini merupakan protoksin yang jika larut di dalam usus serangga akan berubah menjadi polipeptida yang lebih pendek (27-149 kd). Hal ini terjadi karena adanya
akan berinteraksi dengan sel-sel epitelium di midgut serangga dan menyebabkan terbentuknya pori-pori (lubang yang sangat kecil) di saluran pencernaan dan mengganggu keseimbangan osmotik. Oleh karena itu, sel menjadi bengkak dan menyebabkan matinya serangga.
2.8 Manfaat Bioteknologi Bacillus thuringiensis
Sampai saat ini bioteknologi B. thuringiensis sebagai bioinsektisida berkembang sangat pesat dari 24 juta dolar Amerika Serikat pada tahun 1980 menjadi 107 juta dolar Amerika Serikat pada tahun 1989. B. thuringiensis dikomersilkan dalam bentuk spora yang membentuk parasporal body. Parasporal body mengandung kristal protein (protein toksin) yang dikeluarkan pada saat sel mengalami lisis.
Feitelson dkk. (1992), produk B. thuringiensis digunakan sebanyak 10-50 g per acre. Potensi toksisitas dari B. thuringiensis 300 kali lipat dibandingkan pestisida. Menurut James (2000), manfaat penggunaan B. thuringiensis tidak hanya dalam bentuk microbial spray tetapi juga dalam bentuk tanaman transgenik.
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2016 sampai dengan Januari 2018 di Laboratorium Mikrobiologi dan Laboratorium Genetika Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara.
3.2 Metode Penelitian
3.2.1 Preparasi Medium Luria Bertani (LB)
Medium pertumbuhan yang digunakan dalam penelitian ini adalah medium Luria Bertani (LB). Medium LB (per liter mengandung 10 g tripton, 5 g yeast extract, 10 g NaCl). Bahan-bahan tersebut dimasukkan ke dalam erlenmeyer dan diaduk rata, kemudian dipanaskan hingga mendidih dan setelah itu disterilisasi menggunakan autoklaf pada suhu 1210C selama 15 menit.
3.2.2 Pengambilan Sampel Tanah
Sampel tanah diperoleh dari hutan Tongkoh. Sebelum sampel dikoleksi, terlebih dahulu diukur kondisi tanah yang meliputi pengukuran GPS, pH tanah, dan kelembapan tanah. Pengambilan lokasi sampel pada 3 titik dilakukan secara acak dan sampel tanah yang diambil merupakan bagian permukaan tanah 5-10 cm.
Sampel tanah yang diambil sebanyak 100 gram secara aseptis menggunakan sekop, dimasukkan ke dalam kantong plastik steril, dan disimpan pada suhu 40C.
Sampel tanah dibawa ke Laboratorium Mikrobiologi MIPA Universitas Sumatera Utara untuk diidentifikasi (Lantang dkk. 2012; Chandra dkk. 2015).
3.2.3 Isolasi dan Pemurnian Bakteri B. thuringiensis
Teknik isolasi menggunakan metode yang dijelaskan oleh Travers dkk.
(1987), yang dimodifikasi (Lampiran 3). Sampel Tanah ditimbang sebanyak 25
gram. Sampel tanah dimasukkan ke dalam erlenmeyer yang telah berisi 250 ml buffer asetat 0,25 M pH 6,8 (Lampiran 2), dan dikocok kuat selama 15 menit, kemudian dipanaskan pada suhu 800 C selama 30 menit dalam waterbath, lalu di kocok kuat untuk meratakan penyebaran spora selama 15 menit (Ozturk dkk., 2008). Suspensi kemudian diencerkan menggunakan pengenceran berseri, sebanyak 1 ml supensi dimasukkan ke dalam tabung berisi 9 ml 0,25 M buffer asetat pH 6,8 (pengenceran 102) lalu dihomogenkan menggunakan vortex.
Suspensi sebanyak 1 ml pada pengenceran 102 di masukkan ke dalam tabung berisi buffer asetat 0,25 M pH 6,8 (pengenceran 103) dan seterusnya sampai pengenceran 108. Sebanyak 0,1 ml suspensi disebarkan pada cawan petri yang berisi mediun LB dan di inkubasi pada suhu 300C selama 48 jam, hingga muncul koloni yang memiliki kesamaaan morfologi dan warna yang sama dengan B.
thuringiensis (Moazamian dkk. 2016). Hasil isolasi yang diperoleh, dipilih koloni yang mirip dengan B. thuringiensis, lalu di transfer ke medium LB agar dan di inkubasi pada suhu 300C selama 4-5 hari sampai terjadi sporulasi (Senfi dkk., 2012).
3.2.4 Karakterisasi Morfologi Isolat
Morfologi isolat bakteri diamati pada kultur isolat. Pengamatan yang dilakukan meliputi bentuk, elevasi, tepian, dan warna koloni, sifat gram, kristal protein, dan dilakukan uji biokimia.
3.2.5 Pewarnaan Kristal Protein
Setiap kultur murni ditumbuhkan pada medium LB agar selama 48-72 jam pada suhu 300C. Kultur biakan diambil 1-2 lup ose steril ke permukaan slide dan diberi 1-2 tetes akuades. Slide kemudian difiksasi dan diberi 1-2 tetes Coomassie Brilliant Blue Solution (0,25% Coomassie Brilliant Blue, 50% etanol dan 7%
asam asetat) selama 3 menit. Slide kemudian dicuci dengan air, lalu dikeringkan dan diamati di bawah mikroskop cahaya untuk mengamati morfologi kristal (Senfi dkk., 2012). Isolat yang didefinisikan sebagai B. thuringiensis yang membentuk
kristal protein disimpan pada LB agar miring sebagai isolat baru dan diberi nomor isolat (Lampiran 4).
3.2.6 Pengamatan Kristal Protein Menggunakan SEM (Scanning Electron Microscopy)
Pengamatan SEM dilakukan di Laboratorium Zoologi LIPI (Lembaga Ilmu Pengetahuan Indonesia) Cibinong. Isolat bakteri diinokulasikan pada medium LB dan diinkubasi pada incubator shaker pada 150 rpm dengan suhu 300C selama 72 jam. Proses preparasi spesimen dalam suhu 40C. Isolat di sentrifugasi pada 10.000xg selama 10 menit, supernatan dibuang dan ditambahkan caccodylate buffer 2%, (Lampiran 2) kemudian direndam beberapa jam. Cairan disentrifugasi kembali, larutan fiksatif dibuang, kemudian ditambahkan caccodylate buffer 2%.
Cairan disentifugasi kembali, larutan buffer dibuang dan ditambahkan tetra oksida 1%, kemudian direndam selama 1 jam. Cairan disentrifugasi kembali, kemudian larutan dibuang dan ditambahkan alkohol 50%, selanjutnya berturut-turut ditambahkan alkohol 70%; alkohol 80%; alkohol 95%; dan alkohol absolut.
Sentrifugasi kembali, kemudian larutan dibuang, ditambahkan butanol dan dibuat suspensi di dalam butanol. Potongan cover slip dibekukan dan dibuat ulasan suspensi pada cover slip, lalu dikeringkan dengan freeze drier. Objek pada cover slip dilapisi emas menggunakan vaccum drier. Objek diamati dengan mikroskop skaning elektron JSM-5310 pada 20 KV (Ahmed dkk., 2015).
3.2.7 Identifikasi Bacillus thuringiensis Berdasarkan Gen Penyandi 16S rRNA
Isolasi DNA dilakukan dengan metode Muharsini dkk. (2003), isolat bakteri murni ditumbuhkan pada media LB agar. Sebanyak satu ose isolat disuspensikan ke dalam tabung ependorf yang berisi 100 µl akuabidest steril. Suspensi sel dibekukan pada suhu -100C sampai larutan mengkristal lalu dipanaskan pada suhu 900C selama 10 menit. Pengulangan siklus dilakukan sebanyak 5 kali untuk efisiensi pemecahan sel (Nursyiwarni dan Kathy, 2007).
Suspensi sel diputar dengan sentrifugasi pada kecepatan 10.000xg selama 10 menit. Supernatan (yang telah mengandung DNA bakteri) disimpan pada suhu 40C. DNA hasil isolasi digunakan untuk amplifikasi gen 16S rRNA dengan menggunakan mesin Polymerase Chain Reaction (PCR). Primer yang digunakan untuk untuk amplifikasi gen 16S rRNA adalah primer 63f (5’ – CAG GCC TAA CAC ATG CAA GTC - 3’) dan 1387r (5’ – GGG CGG WGT GTA CAA GGC - 3’) yang merupakan primer universal untuk berbagai strain bakteri (Salaki dan Sembiring 2011; Marchesi dkk. 1998).
Sebanyak 2 µl DNA template; 12,5 Master Mix 2x GoTaqGreen; 1 µl (10 pmol) masing-masing primer; 8,5 µl Nuclease Free Water sehingga volume total 25 µl. PCR dilakukan pada volume total 25 µl dengan menambahkan 12,3 µl akuabides. Mesin PCR diprogram dan dijalankan pada kondisi pradenaturasi 940C selama 2 menit, denaturasi 920C selama 30 detik, annealing 550C selama 30 detik, elongasi atau perpanjangan primer 720C selama 1 menit dan post PCR 720C selama 5 menit dan dilakukan sebanyak 40 siklus selama satu jam.
Hasil PCR divisualisasi pada gel agarosa 1% (1 gr agarosa dalam 100 ml TAE 1X), dipanaskan serta distirer sampai larut, didinginkan selama 5 menit lalu diteteskan 10 µl EtBr dan dihomogenkan lalu dituang ke dalam cetakan gel. Pada waktu elektroforesis diberikan marker atau penanda molekul DNA 1 kb.
Elektroforesis dilakukan pada kondisi 80 volt dan 400 mA selama 60 menit, kemudian divisualisasi dengan UV-transluminator.
DNA hasil amplifikasi tersebut dimurnikan lalu disekuen secara komersial untuk mengetahui urutan basa DNA-nya. Data sekuen tersebut dibandingkan dengan data di GenBank dari database The National Center for Biotechnology Information (NCBI) (http://www.ncbi.nlm.nih.gov), menggunakan program Basic Local Alignment Search Tool (BLAST).
3.2.8 Pengaruh Medium Molase-Urea Terhadap Pertumbuhan Bacillus thuringiensis
Isolat diinokulasikan ke dalam tabung reaksi yang berisi 10 ml NaCl 0,9%
steril dan dihitung optical density dengan menggunakan spektrofotometer. Kultur
isolat dengan OD600 ≈ 0,5 diambil sebanyak 2,5 ml dan dimasukkan ke dalam media pertumbuhan, molase sebagai sumber karbon dan urea sebagai sumber nitrogen. Medium MU (molase-urea) perliter mengandung molase sebanyak 20%
(w/v), urea sebanyak 3% (w/v) (Nasrah 2012; Fifendy dkk. 2013) dan komposisi garam-garam mineral berdasarkan Dulmage dan Rhodes (1971), yaitu 1,0 g/l CaCO3; 0,03 g/l MgSO4.7H2O; 0,02 g/l MnSO4.7H2O; 0,02 g/l ZnSO4.7H2O; dan 0,02 g/l FeSO4.7H2O, masing-masing dimasukkan ke dalam erlenmeyer. Media molase-urea disterilkan dengan autoklaf selama 15 menit pada suhu 1210C, kemudian di inkubasi dalam rotary shaker selama 72 jam pada 150 rpm. Setiap kultur pada interval 6 jam diambil.
Sebanyak 1 ml dimasukkan ke dalam tabung yang berisi 9 ml akuades steril, kemudian di vortex sampai homogen dan kemudian dilakukan pengenceran berseri 101-1010. Masing-masing pengenceran diambil sebanyak 0,1 ml dan ditambahkan ke dalam media PCA (Plate Count Agar) dengan menggunakan metode cawan sebar dan diikubasi selama 24 jam. Pengamatan bakteri di lakukan dengan menentukan nilai ALT (Angka Lempeng Total) pada PCA (Lampiran 7).
3.2.9 Uji Toksisitas Terhadap Larva Aedes aegypti
Isolat bakteri ditumbuhkan pada medium LB agar dan diinkubasi pada suhu 300C selama 24 jam. Isolat diinokulasikan ke dalam tabung reaksi yang berisi 10 ml air akuades steril dan dihitung optical density dengan menggunakan spektrofotometer. Kultur isolat dengan OD600 ≈ 0,5 diambil sebanyak 2,5 ml dan diinokulasikan ke dalam 47,5 ml medium MU (molase-urea) dan diinkubasi pada suhu 300C selama 36 jam. Kultur isolat pada media MU diambil sebanyak 5 ml, 10 ml, 15 ml, 20 ml, dan 25 ml dan diinokulasikan ke dalam erlenmeyer yang berisi 10 ekor larva nyamuk A. aegypti instar III. Toksisitas ditentukan berdasarkan persentase kematian larva 50 % setelah 24 jam. Pengamatan dilakukan sebanyak empat kali ulangan dengan enam konsentrasi perlakuan dan nilai mortalitas dihitung (Lampiran 8).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakteristik Isolat Bakteri
Isolasi bakteri dari tanah yang diinkubasi menggunakan media LB agar pada suhu 300C diperoleh 18 isolat yang masing-masing memiliki karakteristik morfologi yang berbeda. Dua dari 18 isolat diduga memiliki kemiripan dengan B.
thuringiensis, yaitu SP7 dan SP15. Kemiripan tersebut terlihat dari karakterisitik morfologi koloni yang tumbuh, sifat gram, dan kristal protein seperti yang terlihat pada Tabel 4.1 berikut.
Tabel 4.1 Karakteristik morfologi dan sifat gram bakteri isolat Isolat
Bakteri
Morfologi Koloni Sifat
Gram
Kristal Protein
Bentuk Tepi Elevasi Warna
SP1 Irregular Lobate Flat Cream - -
SP2 Filamentous Filamentous Flat Cream + - SP3 Filamentous Filamentous Flat Cream + -
SP4 Circular Entire Flat Cream + -
SP5 Irregular Lobate Flat Cream + -
SP6 Filamentous Filamentous Flat Cream + -
SP7 Circular Entire Flat Cream + +
SP8 Filamentous Filamentous Flat Cream + -
SP9 Irregular Lobate Flat Cream - -
SP10 Rhizoid Lobate Flat Cream - -
SP11 Filamentous Filamentous Flat Cream + -
SP12 Irregular Undulate Flat Cream - -
SP13 Filamentous Filamentous Flat Cream + -
SP14 Circular Entire Flat Cream + -
SP15 Circular Entire Flat Cream + +
SP16 Irregular Lobate Flat Cream - -
SP17 Filamentous Filamentous Flat Cream + -
SP18 Rhizoid Lobate Flat Cream - -
Pada Tabel 4.1, dapat dilihat bahwa 5 isolat bakteri yaitu SP1, SP5, SP9, SP12, dan SP16 memiliki bentuk morfologi irregular dengan tepi koloni lobate kecuali SP12 yang memiliki tepi koloni undulate dan memiliki sifat gram negatif yang sama. Tujuh isolat antara lain SP2, SP3, SP6, SP8, SP11, SP13, dan SP17
memiliki bentuk bentuk morfologi dan tepi morfologi yang sama yaitu filamentous dan sifat gram positif . Empat isolat bakteri SP4, SP7, SP14 dan SP15 memiliki bentuk morfologi koloni circular dengan tepi koloni yang sama entire dan memiliki sifat gram yang sama yaitu positif. Dua isolat bakteri SP10 dan SP18 memiliki bentuk morfologi koloni rhizoid dan tepi koloni lobate dengan sifat gram yang sama yaitu negatif. Semua bakteri hasil isolasi memiliki elevasi koloni flat dan warna koloni yang sama yaitu cream. Dua dari 18 isolat SP7 dan SP15 memiliki kristal protein.
Dua koloni bakteri yaitu SP7 dan SP15 menunjukkan karakteristik koloni mirip dengan B. thuringiensis. Karakteristik koloni tersebut sama dengan yang dikemukakan oleh Lantang (2005), Netharavhati dkk. (2010), dan Blondine dkk.
(2004). Karakterisasi tersebut antara lain adalah bentuk morfologi koloni circular dengan warna koloni cream serta memiliki sifat gram positif dan memiliki kristal protein yang merupakan ciri khas B. thuringiensis.
Pengamatan tentang karakterisasi morfologi koloni bakteri B. thuringiensis perlu dilakukan untuk mempermudah dalam proses identifikasi jenis bakteri. Lay (1994) mengemukakan bahwa berdasarkan ciri morfologi koloni bakteri dan biakan murni maka dapat dilakukan proses identifikasi jenis-jenis mikroorganisme untuk membedakan mikroorganisme yang satu dengan mikroorganisme yang lainnya dan untuk memperoleh hasil identifikasi yang sempurna maka selanjutnya harus dilakukan uji biokimia.
Bakteri hasil isolasi yang telah dikarakterisasi secara morfologi meliputi bentuk, tepi koloni, elevasi koloni, warna koloni, sifat gram, dan kristal protein selanjutnya dikarakterisasi secara biokimia. Karakterisasi sifat biokimia yang dilakukan meliputi uji hidrolisis pati, uji hidrolisis gelatin, uji sitrat, uji hidrogen sulfida, uji motilitas, dan uji katalase. Hasil pengujian menunjukkan isolat bakteri memiliki karakteristik biokimia yang sama satu sama lain dan dapat dilihat pada Tabel 4.2 berikut.
Tabel 4.2 Karakteristik biokimia bakteri isolat Isolat
Bakteri
Uji Biokimia Hidrolisis
Pati
Hidrolisis
Gelatin Sitrat Hidrogen
Sulfida Motilitas Katalase
SP1 + + - Kuning + +
SP2 + + - Kuning + +
SP3 + + - Kuning + +
SP4 + + - Kuning + +
SP5 + + - Kuning + +
SP6 + + - Kuning + +
SP7 + + - Kuning + +
SP8 + + - Kuning + +
SP9 + + - Kuning + +
SP10 + + - Kuning + +
SP11 + + - Kuning + +
SP12 + + - Kuning + +
SP13 + + - Kuning + +
SP14 + + - Kuning + +
SP15 + + - Kuning + +
SP16 + + - Kuning + +
SP17 + + - Kuning + +
SP18 + + - Kuning + +
Keterangan : (+) = Uji positif; (-) = Uji negatif
Berdasarkan hasil pengamatan uji biokimia ke-18 isolat bakteri menunjukkan karakteristik yang sama. Delapan belas isolat menunjukkan hasil yang positif untuk uji hidrolisis pati, hidrolisis gelatin, hidrogen sulfida, motilitas, katalase, dan hasil negatif untuk uji sitrat. Menurut Cappucino dan Sherman (1983), uji sitrat menggunakan media SCA (Simmons Citrat Agar) sebagai media pertumbuhan dengan Na-sitrat sebagai sumber karbon dan NH4+ sebagai sumber nitrogen. Hasil uji sitrat negatif pada media SCA menunjukkan bahwa sitrat tidak dapat dijadikan sebagai sumber energi bagi metabolisme sel. Hasil biokimia isolat SP7 dan SP15 didukung oleh penelitian Jung dkk. (1994), menunjukkan bahwa isolat BT-14 memiliki hasil uji positif hidrolisis pati, hidrolisis gelatin, motilitas, katalase, dan hasil negatif untuk uji sitrat.
4.2 Pengamatan Kristal Protein
Isolat dari sampel SP7 dan SP15 yang memiliki hasil pengujian karakterisasi biokimia yang sama dengan B. thuringiensis dilihat kembali untuk mengetahui sel dengan kristal protein yang merupakan salah satu ciri dari B.
thuringiensis. Isolat SP7 dan SP15 diwarnai dengan pewarna CBB. Berikut merupakan hasil pengamatan mikroskop dengan perbesaran 40x10 pada sampel SP7 dan SP15 seperti yang terlihat pada Gambar 4.1.
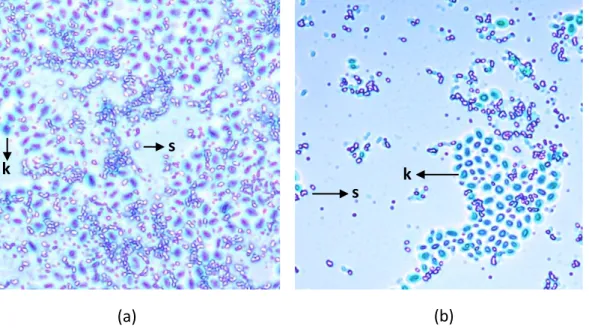
Gambar 4.1 Hasil pengamatan mikroskop : (a) Isolat SP7 dan (b) Isolat SP15.
Keterangan: s = spora dan k = kristal protein
Berdasarkan Gambar 4.1, pada hasil pengamatan mikroskop menujukkan bahwa spora dan kristal protein terlihat pada hasil pewarnaan CBB untuk isolat SP7 dan SP15 yang memiliki kemiripan dengan B. thuringiensis. Hasil pengamatan mikroskop menunjukkan SP7 dan SP15 memiliki spora yang berbentuk bulat dan kristal protein berbentuk bulat padat. Hasil penelitian yang sama dilakukan oleh Chai dkk. (2014), sel yang mengalami lisis dan setelah diwarnai CBB menunjukkan bentuk kristal protein spherical dengan warna yang gelap.
s s
k k
(a) (b)
Menurut Hofte dan Whitelay (1989), bentuk kristal protein spherical (bulat) memiliki tipe kristal protein cry IV yang dimiliki oleh Bacillus thuringiensis subsp israelensis (Bti) yang dapat menyerang serangga ordo diptera. Hasil penelitian Lakxmy dkk. (2011), menunjukkan isolat BtReX02 memiliki bentuk kristal protein spherical, pewarnaan CBB memberikan hasil yang sangat jelas untuk melihat bentuk kristal protein dan spora di bawah mikroskop fase kontras.
Muniady dkk. (2011), mengemukakan bahwa penggunaan pewarnaan CBB untuk melihat lebih jelas bentuk dari kristal protein dan bentuk morfologi kristal bakteri sehingga dapat memberi informasi tentang serangga target. Lee dkk. (2008), mengemukakan bahwa Bti merupakan larvasida biologis yang memproduksi kristal protein yang bersifat toksik untuk larva nyamuk dan lalat hitam dan aman bagi manusia.
4.3 Hasil Pengamatan SEM
Pengamatan kristal protein menggunakan mikroskop kemudian diamati kembali menggunakan SEM untuk melihat lebih jelas bentuk dari kristal protein (Sezen dkk. 2018; Sun dkk. 2018; Lone dkk. 2017; Kebdani dkk. 2016; Silva dkk.
2010). Berikut merupakan hasil pengamatan SEM isolat SP7 dan isolat SP15 seperti yang terlihat pada Gambar 4.2.
(a) (b)
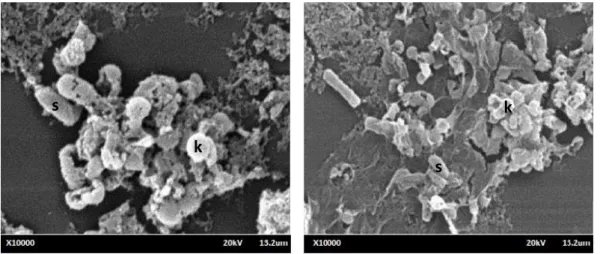
Gambar 4.2 Hasil pengamatan SEM: (a) Isolat SP7 dan (b) Isolat SP15.
Keterangan : s = spora, k = kristal protein
k k
s
s
Hasil pengamatan menggunakan SEM dengan perbesaran 10000 kali menunjukkan dengan jelas bentuk spora dan kristal protein. Isolat SP7 memiliki bentuk kristal protein berbentuk bulat (spherical), SP15 dari hasil pengamatan menunjukkan bentuk kristal protein bulat (spherical). Hasil yang sama ditunjukkan Ahmed dkk. (2015), pengamatan kristal protein menggunakan SEM menunjukkan hasil yang sama yaitu bentuk kristal protein spherical. Monerat dkk (2005), analisis menggunakan SEM menunjukkan semua starin S447, S479, S550, dan 1255 memiliki kristal protein berbentuk round dengan ukuran yang sama.
Kebdani dkk. (2016), analisis pengamatan SEM menunjukkan bahwa isolat yang diisolasi dari Kota Tlemcen, Oran, Aln Delta, dan Kota Seltif memiliki bentuk kristal protein cubical dan rhomboidal.
SEM dapat memberikan perbesaran yang jauh lebih besar daripada mikroskop fase kontras. Hal ini karena SEM memiliki daya-pisah yang lebih besar, karena berkas elektron yang digunakan memiliki panjang gelombang pendek 0,005- 0,0003 µm dibandingkan dengan mikroskop fase kontras yang memiliki panjang gelombang 400 sampai 700 µm (Irianto 2013; Waluyo 2007) .
4.4 Identifikasi Bacillus thuringiensis Berdasarkan Gen Penyandi 16S rRNA
Genom isolat bakteri hasil isolasi dianalisis secara kuantitatif menggunakan spektrofotometer untuk mengetahui konsentrasi DNA dan kemurniannya (Tabel 4.3) dan kualitatif menggunakan elektroforesis (Gambar 4.3).
Tabel 4.3 Konsentrasi dan kemurnian DNA genom
No Kode Isolat Konsentrasi (ng/µl) Kemurnian (260/280 nm)
1 SP7 2,357 1,980
2 SP15 2,930 1,906
Berdasarkan hasil uji kuantitatif DNA genom isolat SP7 san SP15 menunjukkan bahwa konsentrasi DNA dan kemurnian DNA genom telah memnuhi standar untuk dianalisis. Konsetrasi DNA yang biasanya dapat digunakan dalam proses amplifikasi PCR adalah berkisar 0,5-50 ng/µl dengan
kemurnian berkisar 1,4-2,0 (Gultom, 2015). Menurut Sambrok dkk. (1989), bahwa kemurnian molekul DNA yang diukur pada panjang gelombang A260/A280 akan memiliki kuantitas yang baik jika menunjukkan nilai pada kisaran 1,8-2,0. Jika DNA mengalami kontaminasi oleh protein dan senyawa organik seperti asam humat, maka rasio A260/A280 akan menjadi lebih kecil dari 1,8. Sedangkan DNA hasil isolasi akan memiliki nilai lebih besar dari 2,0 jika DNA terkontaminasi oleh fenol.
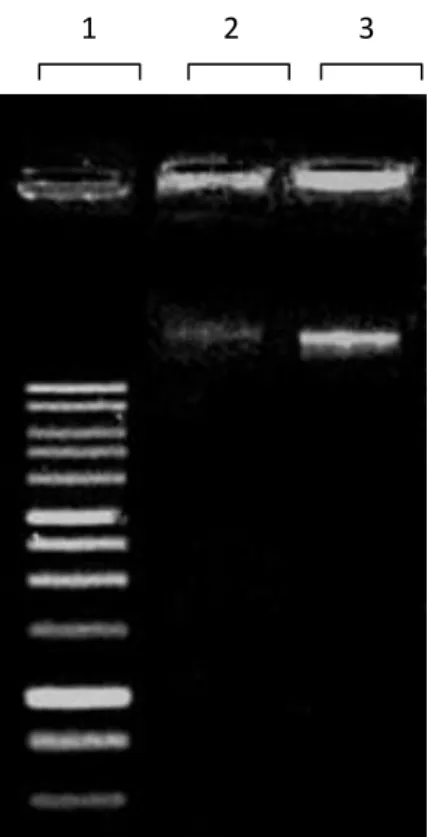
Gambar 4.3 Hasil elektroforesis DNA genom isolat bakteri. Lajur (1) Marker DNA 1 kb; Lajur (2) DNA genom SP7 dan Lajur (3) DNA genom SP15.
Gen 16S rRNA diisolasi dengan reaksi PCR menggunakan primer 63f dan 1387r sebanyak 40 siklus. Produk PCR hasil isolasi gen 16S rRNA dianalisis secara kuantitatif menggunakan spektrofotometer untuk mengetahui konsentrasi DNA dan kemurniannya (Tabel 4.4).
2000 bp 1500 bp 750 bp 500 bp
1 2 3
Tabel 4.4 Konsentrasi dan kemurnian amplicon
No. Kode Isolat Konsentrasi (ng/µl) Kemurnian (260/280 nm)
1. SP7 5,430 1,879
2. SP15 6,400 1,813
Berdasarkan uji kuantitatif konsentrasi DNA hasil PCR berkisar antara 12,2- 22,3. Jumlah tersebut dapat dikatagorikan baik untuk digunakan dalam anlisis sekuensing. Hasil PCR DNA genom selanjutnya divisualisasi dengan elektroforesis. Pita yang dihasilkan pada hasil reaksi PCR menunjukkan bahwa fragmen gen 16S rRNA berada pada 1500 bp. Marchesi dkk. (1998), menyatakan bahwa primer 63f dan 1387r baik digunakan untuk identifikasi bakteri. Primer pada proses PCR berfungsi sebagai pembatas fragmen DNA target yang akan diamplifikasi. Amplicon hasil PCR divisualisasi dengan 1% gel agarosa dengan menggunakan marker DNA 1 kb (Gambar 4.4).
Gambar 4.4 Hasil PCR gen penyandi 16S rRNA. Lajur (1) Marker DNA 1 kb;
Lajur (2) Kontrol negatif dan lajur (3 dan 4) DNA gen penyandi 16S rRNA isolat SP7 dan SP15.
2000 bp
1500 bp 1500 bp
750 bp 500 bp 250 bp
1 2 3 4
Kedua isolat terpilih yakni isolat SP7 dan SP15 selanjutnya diidentifikasi berdasarkan gen penyandi 16S rRNA. Berdasarkan hasil identifikasi yang dilakukan dengan menggunakan primer 63f (5’ CAGGCCTAACACATGCAAGT C-3’) dan 1387R (5’-GGCGGWGTGTACAAGGC-3’) (Marchesi dkk. 1998).
Isolat SP7 teridentifikasi sebagai Bacillus thuringiensis strain MCCC 1A00395 dengan tingkat kemiripan 99% dan isolat bakteri SP15 teridentifikasi sebagai Bacillus thuringiensis strain strain MCCC 1A00395 dengan tingkat kemiripan 99% (Tabel 4.5).
Tabel 4.5 Hasil sekuensing isolat berdasarkan gen penyandi 16S rRNA Kode Isolat Hasil Blast Nukleotida Kemiripan Nomor AC
SP7 Bacillus thuringiensis strain
MCCC 1A00395 99% KJ812420.1
SP15 Bacillus thuringiensis strain
MCCC 1A00395 99% KJ812420.1
B. thuringiensis merupakan salah satu bakteri patogen pada serangga.
Bakteri ini tergolong ke dalam kelas Bacilli, ordo Bacillaes dan famili Bacillaceae. Bakteri memiliki bentuk sel batang, memiliki sifat gram positif dan membutuk spora. Bakteri ini bersifat aerob dan dapat tumbuh pada berbagai media. Ciri khas B. thuringiensis ini adalah kemampuannya membentuk kristal protein bersamaan dengan pembentukan spora (Ciccarelli dkk. 2006; Poopathi dan Archana 2012). Pada penelitian yang dilakukan oleh Pratiwi dkk (2013), B.
thuringiensis mampu membunuh larva A. aegypti instar III lebih dari 50% dan memiliki nilai toksisitas yang tinggi. Hasil yang sama juga diperoleh Lantang dkk.
(2012), diperoleh 19 isolat B. thuringiensis yang toksisitasnya sama dengan atau lebih dari 50%, 3 isolat diantaranya mempunyai toksisitas di atas 80%.
4.5 Pengaruh Media Molase-Urea terhadap Pertumbuhan Bacillus thuringiensis
Media pertumbuhan diketahui dapat mempengaruhi jumlah kristal protein yang dihasilkan dalam suatu produksi. Media pertumbuhan B. thuringiensis dengan menggunakan molase sebagai sumber karbon dan urea sebagai sumber
nitrogen dapat digunakan sebagai media alternatif produksi bioinsektisida B.
thuringiensis yang lebih menguntungkan karena mempunya harga yang relatif lebih murah. Hasil pengukuran yang telah dilakukan terhadap molase di Laboratorium Riset dan Teknologi Fakultas Pertanian Universitas Sumatera Utara menunjukkan bahwa kandungan karbon dan nitrogen dari molase tersebut adalah sebagai berikut.
Tabel 4.6 Hasil analisis laboratorium kandungan molase
Parameter Molase
(%)
C-organik 17,39
N-total 2,05
Hasil analisis menunjukkan bahwa molase mengandung sumber C-organik sebesar 17,39 % dan sumber N-total sebesar 2,05 %, dengan demikian molase dapat digunakan sebagai sumber karbon pada media pertumbuhan mikroorganisme. Berbeda dengan penelitian yang dikemukakan oleh Kusuma dkk.
(2017), kandungan C-organik molase sekitar 58% dan nilai N-total sekitar 0,9%.
Perbedaan kadar molase ini disebabkan karena komposisi molase dipengaruhi oleh varietas, kematangan tebu, kondisi iklim, dan tanah serta kondisi proses pada pabrik gula juga mempengaruhi komposisi molase. Dengan demikian perlu digunakan urea sebagai sumber penambah N-total.
Urea merupakan salah satu sumber nitrogen yang berpengaruh terhadap pertumbuhan mikroorganisme. Menurut James (1993), menyatakan bahwa kadar nitrogen tertinggi di dalam urea sebesar 46%. Hasil analisis kandungan urea yang dilakukan oleh Rahayuningsih dkk. (2007), menunjukkan kandungan karbon pada urea sebesar 20% dan kandungan nitrogen sebesar 45,2%. Urea sebagai sumber nitrogen juga mempengaruhi pembentukan kristal protein B. thuringiensis (Morris dkk. 1997). Berdasarkan hasil analisis tersebut sumber karbon dan nitrogen pada medium tumbuh mikroorganisme sangat mempengaruhi pertumbuhan jumlah sel suatu mikrorganisme.
Untuk melihat kemampuan media molase-urea dalam pengaruhnya terhadap
teridentifikasi B. thuringiensis dan diamati memiliki kristal protein selanjutnya diukur jumlah selnya menggunakan medium pertumbuhan dengan molase sebagai sumber karbon, urea sebagai sumber nitrogen dan garam-garam mineral. Jumlah sel dihitung menggunakan metode angka lempeng total (ALT) pada media PCA (Plate Count Agar). Berikut ini merupakan profil pertumbuhan jumlah sel isolat SP7 dan SP15 sebagai berikut.
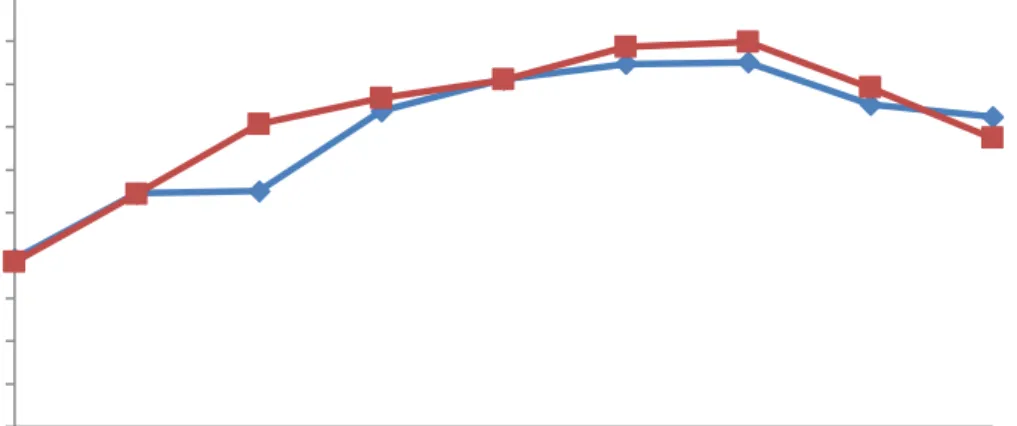
Gambar 4.5 Profil kurva pertumbuhan sel isolat SP7 dan SP15
Berdasarkan profil kurva pertumbuhan jumlah sel di atas dapat dilihat aktivitas pertumbuhan bakteri isolat SP7 dan SP15 cendrung meningkat setiap jamnya. Pertumbuahn sel paling tinggi terjadi pada jam ke-36 dan mengalami penurunan pada jam ke-42. Isolast SP7 dan SP15 mengalami fase eksponensial pada jam ke-6 dan pada jam ke-24 pertumbuhan mencapai fase stasioner sampai pada jam ke-36.
Pada saat mencapai fase stasioner dilakukan perhitungan jumlah sel dengan metode ALT. Jumlah sel isolat SP7 pada saat stasioner mencapai 17,01 Log CFU/ml sedangkan untuk jumlah sel isolat SP15 pada saat stasioner mencapai 17,97 Log CFU/ml. Menurut Khudra (2011), pertumbuhan isolat B. thuringiensis
0 2 4 6 8 10 12 14 16 18 20
0 6 12 18 24 30 36 42 48
Jumlah Sel (log CFU/ml)
Waktu Inkubasi (Jam)
SP7 SP15
dengan kode isolat 47 dan Lot2 mengalami fase eksponensial pada jam ke-4 dan mencapai fase stasioner pada jam ke-36.
Pada Gambar 4.5 di atas dapat disimpulkan bahwa penggunaan molase-urea sebagai sumber karbon dan nitrogen sangat berpengaruh terhadap pertumbuhan jumlah sel bakteri. Hal ini sejalan dengan penelitian yang dilakukan oleh Setyoningrum dkk. (2014), dan Younis dkk. (2010), bahwa molase dapat meningkatkan pertumbuhan bakteri karena mengandung sumber karbon, nitrogen, mineral, vitamin, dan komponen lainnya. Fardiaz (1987) mengemukakan bahwa molase banyak mengandung zat-zat organik seperti karbohidrat, protein, vitamin, dan bahan organik lainnya yang dibutuhkan oleh bakteri untuk melakukan metabolisme.
4.6 Uji Toksisitas Bacillus thuringiensis terhadap Aedes aegypti
Larva nyamuk A. aegypti diperoleh dari BTKL PP (Balai Teknik Kesehatan Lingkungan dan Pengendalian Penyakit) Kelas I Kota Medan, Sumatera Utara.
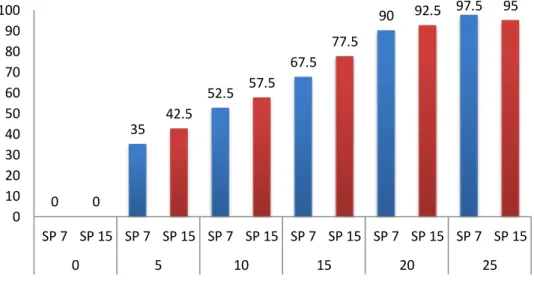
Hasil penelitian diperoleh isolat SP7 dan SP15 dapat membunuh larva A. aegypti setelah 24 jam pemberian B. thuringiensis berupa persentase mortalitas pada Gambar 4.6.
Gambar 4.6 Persentase mortalitas larva A. aegypti akibat perlakuan isolat SP7
0 0
35 42.5
52.5 57.5 67.5
77.5
90 92.5 97.5 95
0 10 20 30 40 50 60 70 80 90 100
SP 7 SP 15 SP 7 SP 15 SP 7 SP 15 SP 7 SP 15 SP 7 SP 15 SP 7 SP 15
0 5 10 15 20 25
Persentase Mortalitas (%)
Volume (ml)
Pada Gambar 4.6, dapat dilihat bahwa isolat SP7 dan SP15 memiliki daya bunuh yang paling efektif karena memiliki nilai mortalitas yang tinggi.
Peningkatan persentase mortalitas larva seiring dengan meningkatnya konsentrasi isolat SP7 dan SP15 yang dipaparkan. Isolat SP7 memiliki tingkat mortalitas tertinggi 97,5% dengan volume 25 ml dan isolat SP15 memiliki tingkat mortalitas yang tidak berbeda jauh dengan SP7 yaitu 95% dengan volume yang sama 25 ml.
Sedangkan persentase mortalitas terendah pada volume 5 ml dengan persentase mortalitas pada isolat SP7 35% dan isolat SP15 sebesar 42,5 %.
Berdasarkan hasil penelitian, bahwa pada volume 10 ml isolat SP7 dan SP15 memiliki persentase mortalitas lebih dari 50%. Pada volume 25 ml isolat SP7 dan SP15 memiliki presentase mortalitas hampir 100%. Hal ini membuktikan bahwa pada perlakuan ini isolat SP7 dan SP15 mampu menghasilkan δ- endotoksin dengan toksisitas paling tinggi. Menurut Yamamoto (1983), isolat yang memiliki toksisitas yang paling baik adalah isolat yang membutuhkan konsentrasi bakteri paling sedikit dengan persentase mortalitas 50% dengan waktu yang paling cepat. Yunus dan Satoto (2017), persentase mortalitas pada pemaparan Bti selama 24 jam memberikan reaksi patogenisitas terhadap larva A.
aegypti lebih dari 80% dengan konsentrasi 4,5 ppm. Hasil penelitian Gama dkk.
(2010), menunjukkan bahwa toksisitas bakteri B. thuringiensis isolat Madura dalam membunuh larva nyamuk sampai 88,89%, toksisitas yang tinggi tersebut terdapat pada kepadatan bakteri sebanyak 1,51x108 sel/ml. Uji toksisitas B.
thuringiensis terhadap mortalitas Spodoptera litura yang dilakukan oleh Tampubolon dkk. (2013), menunjukkan bahwa persentase mortalitas yang efektif 100% terdapat pada perlakuan B3 (B. thuringiensis 30 g/ liter air).
Perbedaan persentase mortalitas isolat SP7 dan SP15 disebabkan oleh berbagai faktor. Kondisi lingkungan habitat, perbedaan kristal protein terhadap ordo Diptera, dan perbedaan jumlah kristal protein yang dimakan larva A. aegypti menyebabkan perbedaan persentase mortalitas (Momami dan Obeidat 2011;
Gholamreza dkk. 2007).
Bioinsektisida yang dihasilkan oleh isolat SP7 dan SP15 memiliki daya toksisitas yang tinggi terhadap larva nyamuk A. aegypti, hal ini sesuai dengan
karaktersitik kristal protein yang sudah diamati dengan pewarnaan CBB dan pengamatan menggunakan SEM. Pada Gambar 4.7, dapat dilihat larva hasil uji dengan pemberian isolat SP7 dan SP15 terlihat mengalami kerusakan pada saluran pencernaannya.
Gambar 4.7 Kerusakan membran saluran pencernaan larva A. aegypti. (a) Larva normal. (b) Hasil uji toksisitas oleh B. thuringiensis. Keterangan : x
= saluran pencernaan yang terinfeksi
Berdasarkan gambar diatas dapat dilihat telah terjadi kerusakan pada membran saluran pencernaan larva A. aegypti yang menunjukkan warna hitam pada saluran pencernaannya. Hal ini didukung oleh penelitian yang dilakukan Blondie dan Widyastuti (1997), menyatakan bahwa larva nyamuk yang diberi bakteri B. thuringiensis maka saluran pencernaan larva tersebut akan mengalami pembengkakan, berwarna hitam dan dalam waktu beberapa hari akan mengalami kehancuran. Menurut Chilcot dkk. (1990), serangga yang diberikan bakteri B.
thuringiensis akan menyebabkan organel epitel membengkak dan jaringan usus tengah serangga terganggu sehingga kemampuan makan serangga tersebut akan terhenti.
Kristal protein yang termakan oleh serangga akan terlarut dalam lingkungan basa pada usus serangga target, protein tersebut akan diaktifkan oleh enzim pencerna protein serangga. Protein yang teraktifkan akan menempel pada protein reseptor yang berada pada permukaan sel epitel usus sehingga mengakibatkan
(a) (b)
x
terbentuknya pori atau lobang pada sel sehingga sel mengalami lisis dan akhirnya serangga tersebut akan mengalami gangguan pencernaan dan mati (Wabiko dkk.
1986). Ciri-ciri larva yang terinfeksi oleh B. thuringiensis tubuh larva bewarna coklat kehitaman dan mengalami paralisis usus. Indikasi yang lainnya dapat dilihat dari aktifitas makan larva yang menurun bahkan dapat berhenti sehingga larva menjadi lemah (Wibowo, 2017).
BAB V KESIMPULAN
5.1 Kesimpulan
Dari hasil penelitian yang dilakukan sebelumnya maka dapat ditarik kesimpulan yaitu :
a. Dua isolat yaitu SP7 dan SP15 memiliki kemiripan dengan B. thuringiensis.
b. Hasil pengamatan kristal protein dengan menggunakan CBB dan SEM diketahui bahwa kristal protein berbentuk bulat (spherical).
c. Dua isolat SP7 dan SP15 teridentifikasi sebagai bakteri Bacillus thuringiensis strain MCCC 1A00395 dengan tingkat kemiripan 99%.
d. Molase-urea sebagai sumber karbon dan nitrogen sangat berpengaruh terhadap pertumbuhan jumlah sel. Jumlah sel isolat SP7 dan SP15 cendrung meningkat setiap jamnya. Jumlah sel isolat SP7 pada saat stasioner mencapai 17,01 Log CFU/ml sedangkan untuk jumlah sel isolat SP15 pada saat stasioner mencapai 17,97 Log CFU/ml.
e. Hasil toksisitas isolat SP7 dan SP15 terhadap larva A. aegypti didapat hasil isolat SP7 memiliki tingkat mortalitas tertinggi 97,5% dengan konsentrasi 25 ml dan isolat SP15 memiliki tingkat mortalitas yang tidak berbeda jauh dengan SP7 yaitu 95% dengan konsentrasi yang sama 25 ml.
5.2 Saran
Dari hasil penelitian di atas, disarankan penelitian lebih lanjut untuk mengeksplorasi B. thuringiensis penghasil protein toksin yang berpotensi sebagai bioinsektisida dan mengidentifikasi tipe protein yang dihasilkan.