xvii INTISARI
Daun salam (Syzygium polyanthum [Wight.] Walp.) merupakan tanaman obat yang banyak digunakan dalam pengobatan tradisional dan digunakan sebagai bumbu masak untuk penyedap makanan. Kandungan kimia yang terdapat dalam daun salam yaitu tanin, flavonoid, dan minyak atsiri yang terdiri dari sitral dan eugenol yang diketahui memiliki aktivitas sebagai antibakteri. Tujuan dari penelitian ini yaitu untuk mengetahui daya antibakteri pada berbagai variasi konsentrasi ekstrak etanolik daun salam terhadap bakteri penyebab karies gigi
Streptococcus mutans. Diameter zona hambat pertumbuhan bakteri ditentukan dengan menggunakan metode difusi sumuran dan penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) dilakukan dengan metode dilusi padat.
Penelitian uji daya antibakteri ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans penyebab karies gigi merupakan jenis penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Data berupa diameter zona hambat pada pertumbuhan bakteri Streptococcus mutans dianalisis secara statistik menggunakan uji Shapiro-Wilk dan uji Kruskal-Wallis yang selanjutnya harus dilakukan analisis Wilcoxon, lalu pada metode dilusi padat dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa ekstrak etanolik daun salam memiliki daya antibakteri terhadap Streptococcus mutans, dan memiliki nilai KHM yaitu 15 mg/mL serta KBM yaitu 18 mg/mL.
xviii ABSTRACT
Bay leaf (Syzygium polyanthum [Wight.] Walp.) is a medicinal plant used in traditional medicine and food seasoning. Profile chemical constituents present in these leaf are tannins, flavonoids, and essential oil (citral and eugenol) that known have antibacterial activity. This study was aimed to determine antibacterial activity of the Bay leaf ethanolic extract at various concentrations againts
Streptococcus mutans that causes dental caries. Diameter of inhibitory zone of bacterial growth was determined by using diffusion method and determination of Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) is done with solid dilution method.
This study purely experimental study used randomized study design complete unidirectional pattern. Inhibition zone diameter data on the growth of bacteria Streptococcus mutans were statistically analyzed using the Shapiro-Wilk
test and the Kruskal-Wallis test to do next Wilcoxon test, and the dillution test were analyzed descriptively.
The results showed that the Bay leaf ethanolic extract had antibacterial activities against Streptococcus mutans, and the MIC value is 15 mg / mL and MBC value is 18 mg / mL.
UJI DAYA ANTIBAKTERI EKSTRAK ETANOLIK DAUN SALAM
(Syzygium polyanthum [Wight.] Walp.)TERHADAP BAKTERI Streptococcus mutans PENYEBAB KARIES GIGI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Wanda Indriani Wibowo 098114003
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat, rahmat, tuntunan serta penyertaan dan kasih karunia yang telah diberikanNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan
skripsi yang berjudul “Uji Daya Antibakteri Ekstrak Etanolik Daun Salam
(Syzygium polyanthum [Wight.] Walp.) terhadap Bakteri Streptococcus mutans
Penyebab Karies Gigi” dengan baik sebagai salah satu syarat untuk memperoleh
gelar Kesarjanaan Strata Satu (S1) Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa keberhasilan penulisan skripsi ini tidak terlepas dari bantuan serta dukungan dari berbagai pihak secara langsung maupun tidak langsung baik berupa moral, materiil maupun spiritual. Oleh sebab itu, penulis menghaturkan banyak terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Agustina Setiawati, S.Farm., M.Sc., Apt. selaku Dosen Pembimbing Utama yang dengan sabar membimbing dan memberikan arahan, saran, kritikan serta dukungan kepada penulis selama proses penelitian dan penulisan skripsi. 3. Prof. Dr. C.J. Soegihardjo, Apt. selaku Dosen Penguji yang memberikan saran
viii
4. Yohanes Dwiatmaka, M.Si. selaku Dosen Penguji yang memberikan saran dan kritikan serta dukungan kepada penulis dalam proses menyempurnakan naskah skripsi.
5. Segenap dosen Fakultas Farmasi Sanata Dharma yang telah mengajar dan membimbing penulis selama masa perkuliahan.
6. Teman-teman kelompok penelitian, Johanes Putra Wicaksono, Hermawan Deny Prasetyo, dan Bernadetta Arum Wijayanti yang telah saling menguatkan, memberikan semangat dan bantuan kepada penulis serta bersama-sama menjalani suka dan duka selama menjalankan penelitian ini.
7. PMK Apostolos yang sudah seperti keluarga dan selalu memberikan dukungan doa, kekuatan, dan semangat bagi penulis untuk dapat menyelesaikan penelitian dengan baik.
8. Sahabat-sahabatku A.A.S Suari Dewi, Intan Yunita Sari, Dharmesti Wijaya, A.A Nara Kusuma, Yudha Wijaya, Ida Bagus Dwi Indrawan, Christiana Lambang Christanti, Yosin Guruh Herawati, dan Bertha Trifina Mardhani yang selalu memberikan dukungan semangat, dan doa.
9. Pak Wagiran, Pak Mukmin, Pak Heru, dan Pak Parlan dan seluruh staf laboran yang telah bersedia memberikan bantuan bagi penulis dalam mengerjakan penelitian.
ix
praktikum serta dorongan semangat dan doa yang telah diberikan kepada penulis selama penyusunan skripsi ini hingga dapat terselesaikan dengan baik. 11.Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuannya
sehingga penulis dapat menyelesaikan skripsi ini.
Penulis menyadari bahwa tidak ada yang sempurna dalam kehidupan ini. Oleh karena itu, penulis sangat mengharapkan kritik dan saran agar skripsi ini dapat menjadi lebih baik. Akhir kata, dengan segala kerendahan hati penulis berharap semoga skripsi ini dapat bermanfaat untuk menambah pengetahuan bagi yang membutuhkan, terutama untuk kemajuan pengetahuan dalam bidang ilmu Farmasi.
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
PERSETUJUAN PEMBIMBING ... ii
PENGESAHAN SKRIPSI ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Keaslian Penelitian ... 3
D. Manfaat Penelitian ... 4
1. Manfaat teoritis ... 4
2. Manfaat praktis ... 4
E. Tujuan Penelitian ... 5
1. Tujuan umum ... 5
xi
BAB II. PENELAAHAN PUSTAKA ... 6
A. Syzygium polyanthum (Wight.) Walp. ... 6
B. Karies Gigi ... 7
1. Peran karbohidrat makanan ... 10
2. Lingkungan gigi ... 11
3. Waktu ... 12
C. Streptococcus mutans ... 13
D. Uji Daya Antibakteri ... 16
1. Metode dilusi ... 16
2. Metode difusi ... 16
E. Kromatografi Lapis Tipis... 17
F. Landasan Teori ... 18
G. Hipotesis ... 19
BAB III. METODOLOGI PENELITIAN... 20
A. Jenis dan Rancangan Penelitian ... 20
B. Variabel Penelitian ... 20
1. Variabel utama ... 20
2. Variabel pengacau ... 20
C. Definisi Operasional ... 21
D. Bahan Penelitian ... 22
E. Alat Penelitian ... 23
F. Tata Cara Penelitian ... 23
1. Pengumpulan bahan daun salam ... 23
2. Pembuatan serbuk daun salam ... 23
xii
4. Skrining fitokimia serbuk daun salam ... 24
5. Analisis flavonoid dan tanin serbuk daun salam dengan KLT ... 24
6. Uji daya antibakteri ekstrak etanolik daun salam terhadap Streptococcus mutans ... 25
a. Pembuatan konsentrasi ekstrak etanolik daun salam ... 25
b.Pembuatan stok bakteri Streptococcus mutans ... 25
c. Pembuatan suspensi bakteri Streptococcus mutans ... 26
d.Pembuatan kontrol kontaminasi media ... 26
e. Pembuatan kontrol pertumbuhan bakteri uji Streptococcus mutans ... 26
f. Uji daya antibakteri ekstrak etanolik daun salam terhadap Streptococcus mutans dengan metode difusi sumuran ... 26
g.Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanolik daun salam terhadap Streptococcus mutans dengan metode dilusi padat ... 27
G. Analisis Data ... 28
BAB IV. HASIL DAN PEMBAHASAN ... 30
A. Pengumpulan Bahan Daun Salam ... 30
B. Pembuatan Serbuk Daun Salam ... 30
C. Pembuatan Ekstrak Etanolik Daun Salam ... 31
D. Skrining Fitokimia Ekstrak Etanolik Daun Salam ... 33
1. Uji flavonoid ... 34
2. Uji tanin ... 35
E. Uji Daya Antibakteri Ekstrak Etanolik Daun Salam Terhadap Streptococcus mutans dengan metode Difusi Sumuran ... 37
xiii
G. Uji Penegasan Daya Antibakteri Ekstrak Etanolik Daun Salam dengan
Metode Streak Plate ... 50
BAB V. KESIMPULAN DAN SARAN ... 52
A. Kesimpulan ... 52
B. Saran ... 52
DAFTAR PUSTAKA ... 53
LAMPIRAN ... 57
xiv
DAFTAR TABEL
Halaman Tabel I. Hasil skrining fitokimia serbuk daun salam ... 33 Tabel II. Rata-rata diameter zona hambat pertumbuhan bakteri Streptococcus
mutans yang dihasilkan pada uji daya antibakteri ekstrak etanolik
daun salam ... 42 Tabel III. Hasil uji statistik keberbedabermaknaan antara diameter zona
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Syzygium polyanthum ... 6
Gambar 2. Proses terjadinya karies gigi ... 7
Gambar 3. Empat lingkaran yang menggambarkan paduan faktor penyebab karies gigi ... 10
Gambar 4. Streptococcus mutans. ... 13
Gambar 5. Hasil skrining fitokimia serbuk daun salam ... 33
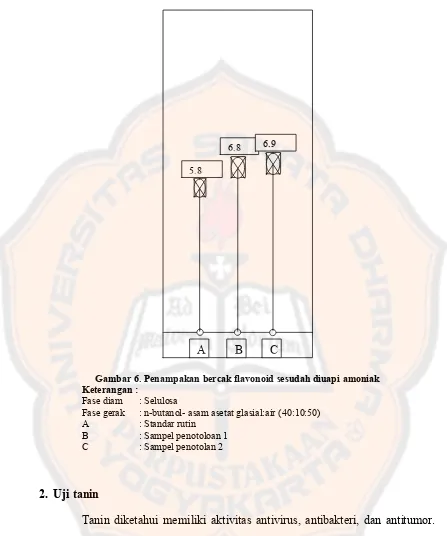
Gambar 6. Penampakan bercak flavonoid sesudah diuapi amoniak. ... 35
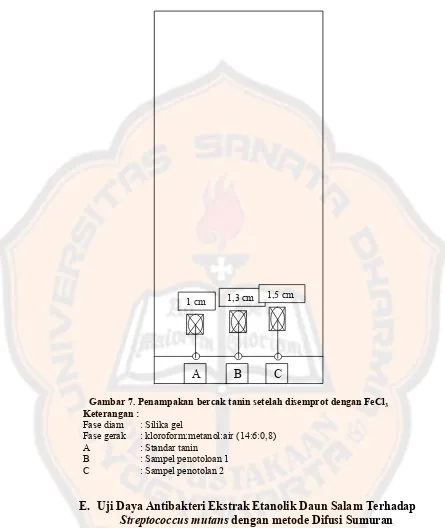
Gambar 7. Penampakan bercak tanin setelah disemprot dengan FeCl3. ... 37
Gambar 8. Zona hambat yang terbentuk pada difusi sumuran ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans. ... 43
Gambar 9. Hasil dilusi padat pada konsentrasi 15 dan 18 mg/mL... 50
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi ... 57
Lampiran 2. Surat keterangan sertifikasi hasil uji Streptococcus mutans ... 58
Lampiran 3. Hasil pengeringan dan penyerbukan daun salam ... 59
Lampiran 4. Hasil uji tabung dari skrining fitokimia serbuk daun salam ... 60
Lampiran 5. Identifikasi flavonoid dan tanin dengan KLT ... 62
Lampiran 6. Hasil ekstraksi daun salam menggunakan pelarut etanol 96% ... 65
Lampiran 7. Konsentrasi larutan uji pada metode difusi sumuran dan dilusi padat ... 67
Lampiran 8. Hasil uji kelarutan ekstrak etanol daun salam ... 68
Lampiran 9. Hasil pengamatan zona hambat pada metode difusi sumuran ... 70
Lampiran 10. Uji normalitas Shapiro-Wilk ... 74
Lampiran 11. Analisa data dengan uji Wilcoxon ... 76
Lampiran 12. Hasil pengamatan dilusi padat ... 87
xvii
INTISARI
Daun salam (Syzygium polyanthum [Wight.] Walp.) merupakan tanaman obat yang banyak digunakan dalam pengobatan tradisional dan digunakan sebagai bumbu masak untuk penyedap makanan. Kandungan kimia yang terdapat dalam daun salam yaitu tanin, flavonoid, dan minyak atsiri yang terdiri dari sitral dan eugenol yang diketahui memiliki aktivitas sebagai antibakteri. Tujuan dari penelitian ini yaitu untuk mengetahui daya antibakteri pada berbagai variasi konsentrasi ekstrak etanolik daun salam terhadap bakteri penyebab karies gigi
Streptococcus mutans. Diameter zona hambat pertumbuhan bakteri ditentukan
dengan menggunakan metode difusi sumuran dan penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) dilakukan dengan metode dilusi padat.
Penelitian uji daya antibakteri ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans penyebab karies gigi merupakan jenis penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Data berupa diameter zona hambat pada pertumbuhan bakteri Streptococcus mutans dianalisis secara statistik menggunakan uji Shapiro-Wilk dan uji Kruskal-Wallis yang selanjutnya harus dilakukan analisis Wilcoxon, lalu pada metode dilusi padat dianalisis secara deskriptif.
Hasil penelitian menunjukkan bahwa ekstrak etanolik daun salam memiliki daya antibakteri terhadap Streptococcus mutans, dan memiliki nilai KHM yaitu 15 mg/mL serta KBM yaitu 18 mg/mL.
Kata kunci: daun salam (Syzygium polyanthum [Wight.] Walp.), Streptococcus
mutans, daya antibakteri, Kadar Hambat Minimum (KHM), Kadar
xviii
ABSTRACT
Bay leaf (Syzygium polyanthum [Wight.] Walp.) is a medicinal plant used in traditional medicine and food seasoning. Profile chemical constituents present in these leaf are tannins, flavonoids, and essential oil (citral and eugenol) that known have antibacterial activity. This study was aimed to determine antibacterial activity of the Bay leaf ethanolic extract at various concentrations againts
Streptococcus mutans that causes dental caries. Diameter of inhibitory zone of
bacterial growth was determined by using diffusion method and determination of Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) is done with solid dilution method.
This study purely experimental study used randomized study design complete unidirectional pattern. Inhibition zone diameter data on the growth of bacteria Streptococcus mutans were statistically analyzed using the Shapiro-Wilk test and the Kruskal-Wallis test to do next Wilcoxon test, and the dillution test were analyzed descriptively.
The results showed that the Bay leaf ethanolic extract had antibacterial activities against Streptococcus mutans, and the MIC value is 15 mg / mL and MBC value is 18 mg / mL.
Keywords: bay leaf (Syzygium polyanthum [Wight.] Walp.), Streptococcus
mutans, antibacterial activity, Minimum Inhibitory Concentration
1
BAB I
PENGANTAR
A. Latar Belakang
Menurut Ardani, Pratiwi, dan Hertiani (2010) karies gigi merupakan masalah yang sering terjadi karena kesadaran masyarakat yang rendah dalam menjaga kesehatan mulut. Berdasarkan data Riset Kesehatan Dasar (2007) menunjukkan bahwa prevalensi nasional karies gigi aktif adalah sebesar 43,4% dimana D.I. Yogyakarta termasuk diantara 14 provinsi yang memiliki prevalensi karies aktif diatas prevalensi nasional. Selain itu, untuk penduduk usia 12 tahun keatas sebesar 72,1% penduduk pernah memiliki pengalaman karies dan sebesar 46,5% diantaranya merupakan karies aktif yang belum dirawat. Menurut Astoeti (2011) apabila karies gigi tidak ditangani dengan baik maka dapat menurunkan produktivitas, menjadi sumber infeksi, bahkan bisa mengakibatkan atau memperparah beberapa penyakit sistemik diantaranya stroke, diabetes, dan penyakit jantung.
Menurut Alcamo (1996) bakteri berperan penting dalam proses terjadinya karies gigi. Salah satu spesies bakteri yang dominan dalam mulut yaitu
Streptococcus mutans. Streptococcus mutans adalah bakteri gram positif fakultatif
anaerob yang merupakan bakteri penyebab karies gigi.
Streptococcus mutans bersifat kariogenik dan memiliki suatu enzim pada
(GTF) yang dapat menyebabkan polimerisasi glukosa pada sukrosa dengan pelepasan dari fruktosa, sehingga mampu mensintesis polisakarida ekstraseluler
(EPS) glukan ikatan α (1-3) yang tidak larut dalam air dan sangat lengket. Glukan
bersama dengan bakteri melekat dengan erat pada enamel gigi sehingga akan terbentuk biofilm pada permukaan gigi dan lebih bersifat asidogenik. Hal ini akan menyebabkan terjadinya demineralisasi pada gigi yang selanjutnya mengarah pada pembentukan karies (Smith, 2003). Oleh karena itu, bakteri ini menjadi target utama dalam upaya mencegah terjadinya karies gigi.
Penggunaan antibiotika dalam pemberantasan plak seperti penisilin, vankomisin, dan klorheksidin secara rutin dapat menyebabkan terjadinya resistensi bakteri dan efek samping seperti diskolorisasi gigi (Schuurs, 1993). Jika suatu bakteri resisten terhadap antibakterial, maka organisme itu akan terus bertumbuh walaupun telah dilakukan pemberian obat antibakterial (Kee and Hayes, 1994). Salah satu usaha yang dapat dilakukan untuk mengatasi masalah resistensi bakteri, yaitu dengan memanfaatkan bahan alam. Pada saat ini, banyak orang yang kembali menggunakan bahan alam untuk mengobati berbagai penyakit. Pemanfaatan bahan alam sebagai antibakteri banyak dikembangkan karena efek samping yang dihasilkan tidak merugikan dibandingkan dengan obat yang dibuat dari bahan sintetis (Kardinan dan Kusuma, 2004).
diabetes, dan diare. Daun salam kaya akan kandungan, tanin, flavonoid, dan minyak atsiri 0,05% yang terdiri dari eugenol dan sitral (Winarto, 2003).
Hasil penelitian ini diharapkan dapat memberikan pengetahuan kepada masyarakat mengenai manfaat daun salam sebagai antibakteri terhadap bakteri
Streptococcus mutans untuk salah satu terapi alternatif penyakit karies gigi dan
dapat dikembangkan dalam bentuk sediaan farmasi sehingga lebih praktis dan mudah dalam pemakaiannya.
B. Perumusan Masalah
Permasalahan yang akan diteliti adalah :
1. Apakah ekstrak etanolik daun salam memiliki daya antibakteri terhadap bakteri
Streptococcus mutans penyebab karies gigi?
2. Berapakah Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans penyebab karies gigi?
C. Keaslian Penelitian
Berdasarkan penelusuran pustaka dan jurnal yang dilakukan, penelitian mengenai daya antibakteri ekstrak etanol daun salam terhadap bakteri
Streptococcus mutans penyebab karies gigi belum pernah dilakukan.
Penelitian terkait yang pernah dilakukan adalah Daya Antibakteri Minyak Atsiri Daun Salam (Eugenia polyantha Wight.) terhadap Bakteri Shigella
Salam (Syzygium polyanthum [Wight.] Walp.) terhadap Bakteri Penyebab Diare (Hustani, 2009), dan Uji Daya Antibakteri Ekstrak Etanol Daun Salam (Syzygium
polyanthum (Wight.) Walp.) terhadap Staphylococcus aureus ATCC 6538 dan
Escherichia coli ATCC 11229 secara in vitro (Sari, 2012).
D. Manfaat Penelitian
1. Manfaat teoritis
Penelitian ini diharapkan mampu memberikan informasi bagi ilmu pengetahuan mengenai khasiat antibakteri dari daun salam dan konsentrasi yang paling efektif dari ekstrak etanolik daun salam untuk menghambat bakteri
Streptococcus mutans penyakit karies gigi.
2. Manfaat praktis
E. Tujuan Penelitian
1. Tujuan umum
Mengetahui manfaat daun salam sebagai antibakteri terhadap bakteri
Sterptococcus mutans penyebab karies gigi akibat infeksi bakteri untuk
meningkatkan status kesehatan masyarakat dan menjadi terapi alternatif penyakit karies gigi di masyarakat.
2. Tujuan khusus
a. Mengetahui daya antibakteri ekstrak etanolik daun salam terhadap bakteri
Streptococcus mutans penyebab karies gigi.
6
BAB II
PENELAAHAN PUSTAKA
A. Syzygium polyanthum (Wight.) Walp.
Klasifikasi dari tanaman salam menurut Backer and Van Den Brink (1963) yaitu :
Kerajaan : Plantae
Divisi : Spermatophyta Kelas : Magnoliopsida Sub Kelas : Rosidae Bangsa : Myrtales Suku : Myrtaceae Marga : Eugenia
Jenis : Syzygium polyanthum (Wight.) Walp. Gambar 1. Syzygium polyanthum
35 mm sampai 65 mm; terdapat 6 sampai 10 urat daun lateral, panjang tangkai daun 5 mm sampai 12 mm. Perbungaan berupa malai, keluar dari ranting, dan berbau harum. Kelopak bunga berbentuk cangkir yang lebar, ukuran lebih kurang 1 mm. Mahkota bunga berwarna putih, panjang 2,5 mm sampai 3,5 mm. Benang sari terbagi dalam 4 kelompok, panjang lebih kurang 3 mm berwarna kuning lembayung. Buah buni, berwarna merah gelap, bentuk bulat dengan garis tengah 8 mm sampai 9 mm, pada bagian tepi berakar lembaga yang sangat pendek (Departemen Kesehatan Republik Indonesia, 1980).
Tanaman ini mengandung tanin, flavonoid, minyak atsiri (0,05%) yang terdiri dari sitrat dan eugenol (Winarto, 2003). Kandungan dari daun salam merupakan bahan aktif yang diduga mempunyai efek farmakologis. Menurut Robinson, 1995 cit Sumono dan Wulan, 2009 tanin dan flavonoid memiliki efek antiinflamasi dan antimikroba. Khasiat dari daun salam yaitu untuk mengobati diabetes melitus, sakit maag, katarak, gatal-gatal, kudis, dan diare (Kurniawati, 2010).
B. Karies Gigi
Karies gigi adalah suatu penyakit jaringan keras gigi yang diakibatkan oleh mikroorganisme pada karbohidrat yang dapat difermentasikan sehingga akan terbentuk asam dan menurunkan pH di bawah pH kritis (5,2-5,5). Hal ini dapat menyebabkan terjadinya demineralisasi jaringan keras gigi (Sumawinata, 2002).
Menurut Kidd and Bechal (1992) karies merupakan penyakit jaringan keras gigi, yaitu email, dentin dan sementum, yang disebabkan oleh adanya aktivitas mikroorganisme dalam suatu karbohidrat yang diragikan. Penyakit ini ditandai dengan adanya demineralisasi pada jaringan keras gigi sehingga menyebabkan kerusakan bahan organiknya. Bakteri yang menyebabkan terjadinya karies gigi, yaitu Streptococcus sp, diantaranya adalah Streptococcus mutans,
Streptococcus salivarius, Streptococcus sanguis, dan Streptococcus mitis
(Alcamo, 1996).
Beberapa jenis karbohidrat makanan misalnya sukrosa dan glukosa, dapat diragikan oleh bakteri tertentu dan membentuk asam sehingga pH plak akan menurun sampai di bawah 5 dalam waktu 1-3 menit. Penurunan pH yang berulang-ulang dalam waktu tertentu akan mengakibatkan demineralisasi permukaan gigi yang rentan dan proses karies terjadi (Kidd and Bechal, 1992).
Adanya akumulasi plak gigi memegang peranan penting dalam proses terjadinya karies gigi. Plak merupakan massa yang lengket berisi bakteri beserta produk-produknya yang terbentuk pada semua permukaan gigi. Akumulasi bakteri ini tidak terjadi secara kebetulan melainkan terbentuk melalui serangkaian tahapan. Jika email yang bersih terpapar dalam rongga mulut maka akan ditutupi oleh lapisan organik yang amorf yang disebut pelikel. Pelikel ini terutama terdiri atas glikoprotein yang diendapkan dari saliva dan terbentuk segera setelah penyikatan gigi tanpa adanya bakteri. Sifatnya sangat lengket dan mampu membantu melekatkan bakteri-bakteri tertentu pada permukaan gigi. Pada awal pembentukan plak, kokus gram positif merupakan jenis yang paling banyak dijumpai seperti Streptococcus mutans, Streptococcus sanguis, Streptococcus
mitis dan Streptococcus salivarius serta beberapa strain lainnya. Walaupun
Gambar 3. Empat lingkaran yang menggambarkan paduan faktor penyebab karies gigi (Kidd and Bechal, 1992)
Akumulasi bakteri ini terjadi melalui serangkaian tahap, yaitu :
1. Peran karbohidrat makanan
2. Lingkungan gigi
Dalam keadaan normal, gigi selalu dibasahi oleh saliva. Karena kerentanan gigi terhadap karies banyak tergantung kepada lingkungannya, maka peran saliva sangat besar. Saliva dapat mempengaruhi proses karies dalam berbagai cara, yaitu :
a. Aliran saliva dapat menurunkan akumulasi plak pada permukaan gigi dan menaikkan tingkat pembersihan karbohidrat dari rongga mulut.
b. Difusi komponen saliva seperti kalsium, fosfat, ion OH dan F ke dalam plak dapat menurunkan kelarutan email dan meningkatkan reminalisasi karies dini. c. Sistem buffer asam karbonat-bikarbonat, serta kandungan amonia dan urea
dalam saliva dapat menyangga dan menetralkan penurunan pH yang terjadi saat bakteri plak sedang memetabolisme gula. Kapasitas penyangga dan pH saliva erat hubungannya dengan kecepatan sekresinya.
d. Beberapa komponen saliva yang termasuk dalam komponen non imunologi seperti lysozyme, lactoperoxydase, dan lactofrein mempunyai daya antibakteri yang langsung terhadap mikroflora tersebut sehingga derajat asidogeniknya berkurang.
e. Molekul imunoglobulin (IgA) disekresi oleh sel-sel plasma yang terdapat di dalam kelenjar liur, sedangkan komponen protein lainnya diproduksi di lapisan epitel luar yang menutup kelenjar. Kadar IgA di saliva berbanding terbalik dengan timbulnya karies.
Saliva mampu meremineralisasikan karies yang masih awal terbentuk karena banyak mengandung ion kalsium dan fosfat. Kemampuan saliva dalam melakukan remineralisasi meningkat jika ada ion fluor. Keberadaan fluor dalam konsentrasi optimum pada jaringan gigi dan lingkungannya dapat merangsang efek anti karies. Kadar fluor yang bergabung dengan email selama proses pertumbuhan gigi bergantung pada ketersediaan fluor tersebut dalam air minum atau makanan lain yang mengandung fluor. Keberadaan fluor di sekitar gigi selama proses pelarutan email akan mempengaruhi proses remineralisasi (Kidd and Bechal, 1992).
3. Waktu
C. Streptococcus mutans
Klasifikasi dari Streptococcus mutans menurut Bergey’s Manual of
Systematic Bacteriology (2009) yaitu :
[image:33.595.80.518.162.602.2]Kerajaan : Monera
Gambar 4. Streptococcus mutans dengan menggunakan scanning electron micrograph
(SEM) pada perbesaran 8000x dengan ukuran 6x7 cm
(Anonim, 2011). Divisi : Firmicutes
Kelas : Bacilli
Ordo : Lactobacilalles Famili : Streptococcaceae Genus : Streptococcus
Spesies : Streptococcus mutans
Streptococcus merupakan bakteri gram positif berbentuk bulat yang
mempunyai karakteristik dapat membentuk pasangan atau rantai selama pertumbuhannya. Bakteri ini tersebar di alam, dimana beberapa diantaranya
merupakan flora normal pada manusia (Jawetz, Melnick, dan Adelberg’s, 2005).
Streptococcus mutans merupakan bakteri gram positif, nonmotil, anaerob
fakultatif, bentuk kokus tersusun dalam rantai, tumbuh optimal pada suhu sekitar
180-400C. Streptococcus mutans bersifat asidogenik yaitu menghasilkan asam,
Streptococcus mutans merupakan bakteri yang kariogenik karena mampu membuat asam dari karbohidrat yang dapat diragikan. Bakteri tersebut dapat tumbuh subur dalam suasana asam dan dapat menempel pada permukaan gigi karena kemampuannya membuat polisakarida ekstra sel yang sangat lengket dari karbohidrat makanan. Polisakarida ini terdiri dari polimer glukosa yang menyebabkan matriks plak gigi mempunyai konsistensi seperti gelatin sehingga bakteri tersebut akan terbantu untuk melekat pada gigi serta saling melekat satu sama lain. Dan karena plak semakin tebal maka akan menghambat fungsi saliva dalam menetralkan plak (Kidd and Bechal, 1992).
Koloni Streptococcus mutans ditutupi oleh glukan yang dapat mengurangi perlindungan dan aktivitas antibakteri pada saliva terhadap plak gigi. Plak dapat menghambat difusi asam keluar dalam saliva sehingga konsentrasi asam pada permukaan enamel akan meningkat. Hal ini akan membuat produksi asam meningkat dan reaksi dalam rongga mulut menjadi asam dan kondisi ini akan membuat produksi asam meningkat dan reaksi dalam rongga mulut menjadi asam dan kondisi ini akan membuat deminerasilasi gigi terus menerus yang merupakan proses awal terjadinya karies (Smith, 2003).
bermuatan negatif. Interaksi hidrofobik didasari oleh kontak yang rapat antara molekul pada pelikel dengan permukaan bakteri. Komponen organik
Streptococcus mutans dengan menggunakan enzim glucosyltransferase (GTF) dan
non-enzym glucan binding protein untuk mensintesis polisakarida ekstraseluler
dan membentuk suatu glukan yang bersifat lengket. Glukan merupakan tempat perlekatan, sehingga keduanya dapat membantu perlekatan Streptococcus mutans pada permukaan gigi, sedangkan perlekatan bakteri melalui multiple binding site karena adanya interaksi lectinlike, yaitu protein yang terdapat pada permukaan
Streptococcus mutans bereaksi dengan high molecular weight salivary
glycoproteins dan mengadsorpsi hidroksiapatit enamel sehingga terjadi interaksi
antara bakteri dengan pelikel gigi (Ferracane, Berge, and Condon, 1994, cit Anggraeni, Yuliati, dan Nirwana, 2005).
Mekanisme terbentuknya karies gigi dimulai dari perlekatan
Streptococcus mutans pada permukaan gigi. Adhesin pada Streptococcus mutans
yaitu antigen I/II berinteraksi dengan α-galaktosida pada senyawa glikoprotein
turunan saliva pada pelikel gigi. Streptococcus mutans yang terakumulasi pada permukaan gigi dapat terbentuk apabila mendapat bantuan dari glukosa. Glukosa diubah oleh enzim glukosiltransferase (GTF) pada bakteri menjadi glukan ekstraselular. Glukan yang tidak larut ini melekat pada permukaan gigi dan disebut dengan plak gigi. Streptococcus mutans memiliki glucan binding protein (GBP) yang dapat berikatan dengan glukan secara spesifik. Selain berikatan dengan GBP, glukan dapat berikatan dengan GTF yang memiliki glucan binding
mutans dapat terakumulasi pada permukaan gigi. Proses perubahan glukosa menjadi glukan menghasilkan asam laktat. Adanya asam menurunkan pH saliva menjadi 5,5 sehingga dapat melarutkan jaringan keras pada permukaan gigi (Taubman and Nash, 2006).
D. Uji Daya Antibakteri
Tujuan pengujian ini adalah untuk mengetahui kemampuan suatu agen dalam menghambat maupun membunuh bakteri. Ada beberapa metode yang digunakan untuk pengujian daya antibakteri, yaitu :
1. Metode dilusi
Metode ini digunakan untuk menentukan Kadar Hambat Minimal (KHM), yaitu konsentrasi terendah yang dapat menghambat pertumbuhan bakteri, dan menentukan Kadar Bunuh Minimal (KBM), yaitu konsentrasi terendah yang dapat membunuh bakteri. Prinsip dari metode dilusi, yaitu pengenceran senyawa antibakteri dalam beberapa konsentrasi dalam media cair yang ditambahkan bakteri uji hingga didapatkan larutan uji agen antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya bakteri uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba uji ataupun agen antibakteri. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
2. Metode difusi
Metode ini dilakukan dengan menempatkan agen antibakteri pada media padat yang telah diinokulasikan biakan bakteri (Pratiwi, 2008).
Ada beberapa metode difusi, yaitu :
a. Cara sumuran. Cara ini dilakukan dengan mengiinokulasikan bakteri ke media kemudian setelah memadat dibuat sumuran dengan diameter tertentu tegak lurus dengan permukaan media. Agen antibakteri kemudian dimasukkan ke dalam sumuran tersebut. Daya antibakteri yang diukur adalah diameter zona jernih yang dihasilkan di sekitar sumuran (Pratiwi, 2008).
b. Cara paper disc. Cara ini dilakukan dengan menginokulasikan bakteri dalam media lalu setelah memadat, paper disc diletakkan di atas media dan ditetesi dengan agen antibakteri, sehingga agen antibakteri akan meresap ke dalam paper disc. Daya antibakteri yang diukur adalah diameter zona jernih yang dihasilkan di sekitar paper disc (Pratiwi, 2008).
E. Kromatografi Lapis Tipis
Fase gerak berfungsi untuk pengelusi yang terbuat dari berbagai macam campuran pelarut (Gritter, 1991).
Kromatogram pada KLT berupa noda-noda yang terpisah. Untuk mengetahui noda-noda yang terpisah dapat digunakan dua cara, yaitu dengan pereaksi warna (secara kimia) dan diletakkan di bawah sinar UV 254 nm dan 365 nm (secara fisika) (Mulja dan Suharman, 1995).
Pada kromatogram KLT terdapat faktor retardasi dinyatakan dengan :
Rf = jarak titik pusat bercak dari awal
jarak yang ditempuh fase gerak
Angka Rf memiliki rentang dari 0,00 – 1,00. Nilai Rf adalah angka Rf dikalikan faktor 100(h), menghasilkan nilai dengan rentang antara 0 hingga 100 (Stahl, 1985). Keuntungan dari KLT yaitu pemisahan senyawa dapat dilakukan dalam waktu singkat dengan alat yang harganya tidak terlalu mahal, pelarut dan cuplikan yang digunakan jumlahnya relatif sedikit (Gritter, 1991).
F. Landasan Teori
Karies merupakan suatu penyakit jaringan keras gigi yang disebabkan oleh bakteri Streptococcus mutans yang menempel pada permukaan gigi karena kemampuan membuat polisakarida yang lengket dari karbohidrat dan dapat difermentasikan sehingga akan terbentuk asam dan menurunkan pH di bawah pH kritis. Penurunan pH yang berulang-ulang dalam waktu tertentu menyebabkan demineralisasi permukaan gigi dan proses karies pun dimulai. Streptococcus
mutans memiliki suatu enzim, yaitu glukosiltransferase (GTF) yang akan
lengket sehingga akan terbentuk plak gigi. Akumulasi plak gigi memegang peranan yang sangat penting dalam proses terjadinya karies gigi. Oleh karena itu, untuk mencegah karies gigi dilakukan dengan meminimalisasi pertumbuhan
Streptococcus mutans dengan menggunakan agen antibakteri. Daun salam
memiliki kandungan tanin dan flavonoid yang bersifat sebagai antibakteri sehingga memiliki potensi untuk dilakukan penelitian mengenai daya antibakteri terhadap Streptococcus mutans penyebab karies gigi.
Daya antibakteri ekstrak etanolik daun salam ditunjukkan dengan metode difusi sumuran berdasarkan diameter zona hambat yang dihasilkan dan metode dilusi untuk menentukan nilai KHM dan KBM. Prinsip metode difusi, yaitu pengukuran daya antibakteri berdasarkan pengamatan luas zona hambat pertumbuhan bakteri karena berdifusinya obat dari tempat awal pemberian ke daerah difusi.
G. Hipotesis
20
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian uji daya antibakteri ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans penyebab karies gigi merupakan jenis penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Penelitian dilakukan di Laboratorium Farmakognosi-Fitokimia, Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta, dan Balai Laboratorium Kesehatan Yogyakarta.
B. Variabel Penelitian
1. Variabel utama
a. Variabel bebas. Variabel bebas yang digunakan dalam penelitian ini yaitu variasi konsentrasi ekstrak etanolik daun salam (uji daya antibakteri: 5, 10, 20, 30, dan 50 mg/mL; konsentrasi penentuan nilai KHM dan KBM: 15, 18, 20, 22, 24, 26, 28, dan 30 mg/mL).
b. Variabel tergantung. Variabel tergantung yang digunakan dalam penelitian ini yaitu diameter zona hambat ekstrak etanolik daun salam terhadap
Streptococcus mutans, nilai KHM, dan nilai KBM.
2. Variabel pengacau
tanaman, waktu pengambilan tanaman, waktu inkubasi (24 jam), suhu inkubasi (370C), volume suspensi bakteri uji yang diinokulasikan dalam media (1 mL), konsentrasi suspensi bakteri uji yang setara dengan kepadatan standar 0,5 Mc Farland II (diperkirakan 1,5x108 sel bakteri/mL).
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali yang digunakan dalam penelitian ini yaitu suhu pengeringan di bawah sinar matahari, kelembaban ruangan, suhu penyimpanan serbuk, dan lingkungan tempat tumbuh tanaman.
C. Definisi Operasional
1. Ekstrak etanolik daun salam adalah hasil maserasi dari serbuk daun salam menggunakan penyari etanol 96%.
2. Ekstrak etanolik daun salam kental yaitu hasil maserasi yang dipekatkan menggunakan rotary vacuum evaporator kemudian dipanaskan di atas penangas air selama 15-20 menit pada suhu 500-600C sampai didapatkan ekstrak kental.
3. Zona hambat adalah zona jernih di sekitar sumuran yang ditambahkan ekstrak etanolik daun salam dimana tidak menunjukkan pertumbuhan bakteri
Streptococcus mutans dilihat dari kejernihan media yang dibandingkan dengan
kontrol negatif (aquadest steril).
5. Metode difusi sumuran adalah metode yang digunakan untuk mengetahui aktivitas ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans dengan cara mengukur diameter zona hambat di sekitar sumuran.
6. Metode dilusi padat adalah metode pengukuran aktivitas ekstrak etanolik daun salam terhadap Streptococcus mutans dengan menentukan KHM dan KBM. 7. Kadar Hambat Minimal (KHM) adalah konsentrasi terendah ekstrak etanolik
daun salam yang mampu menghambat pertumbuhan bakteri Streptococcus
mutans dilihat dari uji penegasan penentuan KHM dan KBM dengan metode
streak plate yang masih menunjukkan pertumbuhan bakteri.
8. Kadar Bunuh Minimal (KBM) adalah konsentrasi terendah ekstrak etanolik daun salam yang mampu membunuh bakteri Streptococcus mutans dilihat dari uji penegasan penentuan KHM dan KBM dengan metode streak plate yang tidak menunjukkan pertumbuhan bakteri.
D. Bahan Penelitian
Bahan-bahan yang digunakan pada penelitian ini, yaitu bakteri uji
Streptococcus mutans (asal dari Prof. Yosihara Prev. Dent Dept Kyushu Univ
Japan) yang diperoleh dari Balai Laboratorium Kesehatan Yogyakarta (Lampiran
E. Alat Penelitian
Alat-alat yang digunakan pada penelitian ini yaitu alat gelas (Pyrex), jarum ose, mikropipet, inkubator (Heraeus), autoclave tipe KT-40 (ALP),
Densichek (Vitek), neraca analitik (Mettler Toledo GB 3002), shaker (Innova
2100), oven (Memmert), Microbiological Safety Cabinet, jangka sorong, alat pembuat sumuran No. 3 (diameter 6 mm), cawan petri (Pyrex), vortex, corong
Buchner, pompa vacuum, rotary vacuum evaporator (IKAVAC®), dan kamera
digital (Samsung).
F. Tata Cara Penelitian
1. Pengumpulan bahan daun salam
Daun salam yang diperoleh dari pohon salam berasal dari daerah Kaliurang dikumpulkan pada bulan Agustus dan September 2012. Daun salam yang diambil berwarna hijau tua mulai dari daun ketiga dari ujung dan kedua dari pangkal dan diambil dalam keadaan segar.
2. Pembuatan serbuk daun salam
3. Pembuatan ekstrak etanolik daun salam
Maserasi dilakukan pada 50 g serbuk daun salam/ 500 mL pelarut etanol 96% dengan kecepatan 120 rpm selama 5 hari. Disaring dengan kertas saring dengan bantuan pompa vacuum lalu dipekatkan menggunakan rotary vacuum
evaporator sampai terbentuk cairan kental. Dilanjutkan dengan menggunakan
penangas air selama 15-20 menit dengan suhu antara 500-600C sampai diperoleh ekstrak kental.
4. Skrining fitokimia serbuk daun salam
a. Uji flavonoid. Sebanyak 1 g serbuk daun salam ditambahkan dengan 5 mL aquadest, lalu dipanaskan selama 10 menit. Selanjutnya disaring, filtrat ditambahkan dengan NaOH LP kemudian ditambahkan dengan HCl. Adanya perubahan warna merah menjadi kurang pekat menunjukkan adanya flavonoid.
b. Uji tanin. Sebanyak 2 g serbuk daun salam ditambahkan dengan 10
mL aquadest, lalu dipanaskan selama 30 menit dalam penangas air hingga
mendidih. Selanjutnya disaring, filtrat sebanyak 5 mL ditambahkan larutan natrium klorida 2% sebanyak 1 mL. Apabila terbentuk suspensi atau endapan disaring dengan kertas saring kemudian filtrat ditambahkan larutan gelatin 1% sebanyak 5 mL. Terbentuknya endapan menunjukkan adanya tanin. Selain itu dapat juga dengan menambahkan 5 tetes FeCl3 pada filtrat. Dikatakan positif tanin jika terjadi perubahan warna menjadi biru kehitaman.
5. Analisis flavonoid dan tanin serbuk daun salam dengan KLT
Filtrat jernih ditotolkan pada lempeng KLT sebanyak 25-30 µL. Dibuat standar rutin dengan konsentrasi 0,05% dilarutkan dengan metanol. Fase diam yang digunakan adalah selulosa dengan fase gerak n-butanol:asam asetat glasial:air (40:10:50). Deteksi bercak hasil elusi diamati pada sinar UV dengan panjang gelombang 254 dan 365 nm. Bercak yang muncul ditandai untuk dihitung nilai Rfnya. Plat KLT kemudian dimasukkan dalam chamber yang telah dijenuhkan dengan amoniak. Hasil positif ditunjukkan dengan penampakan bercak yang berwarna merah kekuningan.
b. Tanin. Sebanyak 1 g daun salam ditimbang dan ditambahkan dalam 10 mL metanol, selanjutnya dipanaskan selama 5 menit pada suhu 600C. Filtrat jernih ditotolkan pada lempeng KLT sebanyak 25-30 µL. Standar tanin dibuat dengan membuat larutan asam tanat 0,05% dalam etanol. Fase diam yang digunakan adalah silika gel GF254 dengan fase gerak kloroform:metanol:air (14:6:0,8). Penampak noda yang digunakan adalah FeCl3. Apabila timbul warna biru kehitaman sampai hitam menunjukkan adanya senyawa tanin.
6. Uji daya antibakteri ekstrak etanolik daun salam terhadap Streptococcus mutans
a. Pembuatan konsentrasi ekstrak etanolik daun salam. Dibuat dalam beberapa konsentrasi (5, 10, 20, 30, dan 50 mg/mL) menggunakan pelarut
aquadest steril dengan suhu pemanasan 400-500C.
b. Pembuatan stok bakteri Streptococcus mutans. Diambil 1-3 ose bakteri dari biakan murni Streptococcus mutans, lalu diinokulasikan secara streak
plate pada media MHA miring, diinkubasikan selama 24 jam pada suhu 370C.
c. Pembuatan suspensi bakteri Streptococcus mutans. Diambil 1-3 ose dari stok bakteri Streptococcus mutans, lalu diinokulasikan ke dalam tabung reaksi yang berisi NaCl 0,9% dan divortex agar tercampur rata, diinkubasikan selama 24 jam pada suhu 370C. Kekeruhan suspensi bakteri Streptococcus mutans disetarakan dengan standar 0,5 Mc Farland II (diperkirakan 1,5x108 sel bakteri/mL) dengan menggunakan Densicheck.
d. Pembuatan kontrol kontaminasi media. Media MHA steril dituang ke dalam cawan petri, dibiarkan memadat, diinkubasi selama 24 jam dengan suhu 370C. Setelah diinkubasi, diamati, dan dibandingkan dengan perlakuan.
e. Pembuatan kontrol pertumbuhan bakteri uji Streptococcus mutans. Media MHA steril dengan suhu 400-500C, diinokulasikan suspensi bakteri uji, lalu dituang ke cawan petri steril dan digoyang sehingga pertumbuhan bakteri merata. Cawan petri lalu diinkubasi 24 jam dengan suhu 370C. Diamati pertumbuhan bakteri uji melalui kekeruhan media yang dibandingkan dengan perlakuan.
f. Uji daya antibakteri ekstrak etanolik daun salam terhadap
Streptococcus mutans dengan metode difusi sumuran. Diambil 1 mL dari suspensi
sebagai kontrol positif. Cawan petri diinkubasi selama 24 jam pada suhu 370C, kemudian diamati serta diukur diameter zona hambat yang dihasilkan dengan menggunakan jangka sorong.
g. Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanolik daun salam terhadap Streptococcus mutans dengan metode dilusi padat. Diambil 1 ose bakteri uji, kemudian disuspensikan ke dalam 10 mL NaCl 0,9%, dicampur sampai rata. Hasil suspensi dibandingkan dengan standar 0,5 Mc Farland II (diperkirakan 1,5x108 sel bakteri/mL) menggunakan Densicheck, lalu diambil sebanyak 1 mL dan dimasukkan ke dalam media MHA cair. Ekstrak dengan konsentrasi 15, 18, 20, 22, 24, 26, 28, 30 mg/mL masing-masing ditambahkan sebanyak 1 mL ke dalam 30 mL MHA dengan suhu 400-500C. Dituang ke dalam cawan petri secara pour plate. Cawan petri diinkubasikan selama 24 jam dalam suhu 370C, dan dilakukan pengamatan. Pertumbuhan bakteri ditunjukkan dengan kekeruhan media. Semakin subur pertumbuhan bakteri pada media, maka semakin keruh media tersebut. KHM dan KBM dapat diketahui dengan cara membandingkan kejernihan media yang diinokulasikan larutan uji dengan kontrol negatif dan kontrol positif.
pertumbuhan pada hasil streak plate yang menandakan bakteri uji mati karena larutan uji dengan konsentrasi tersebut.
Uji ini menggunakan dua macam kontrol, yaitu kontrol negatif dan kontrol positif. Kontrol negatif dibuat dengan menambahkan sebanyak 1 mL bakteri uji dan 1 mL aquadest ke dalam media MHA pada cawan petri steril secara pour plate. Kontrol positif dibuat dengan menambahkan sebanyak 1 mL bakteri uji dan 1 mL klorheksidin pada media MHA secara pour plate pada cawan petri. Penentuan rentang konsentrasi uji yang digunakan dalam uji ini mengacu pada hasil uji sebelumnya di mana pada konsentrasi terendah ekstrak etanolik daun salam masih menunjukkan adanya zona hambat yang terbentuk.
G. Analisis Data
Daya antibakteri ekstrak etanolik daun salam dengan berbagai variasi konsentrasi dengan metode difusi sumuran dianalisis berdasarkan besarnya diameter zona hambat yang dihasilkan pada perlakuan yang dibandingkan dengan kontrol negatif dan positif. Data berupa diameter zona hambat pada pertumbuhan bakteri Streptococcus mutans dianalisis secara statistik menggunakan uji Shapiro-Wilk dan uji Kruskal-Wallis. Pemilihan uji Shapiro-Wilk untuk mengetahui apakah data yang didapatkan terdistribusi normal atau tidak dengan syarat jumlah sampel data yang ada berjumlah kurang dari 50 data. Data yang didapatkan dinyatakan terdistribusi normal jika nilai p>0,05. Selanjutnya dilakukan uji
Kruskal-Wallis untuk mengetahui paling tidak terdapat dua kelompok data yang
harus dilakukan analisis Wilcoxon untuk mengetahui pada variasi konsentrasi ekstrak etanolik daun salam berapakah terdapat perbedaan yang bermakna dengan kontrol negatif (aquadest) dan kontrol positif.
30
BAB IV
HASIL DAN PEMBAHASAN
A. Pengumpulan Bahan Daun Salam
Daun salam yang digunakan dalam penelitian ini diperoleh dari daerah Kaliurang, Yogyakarta yang dikumpulkan pada bulan Agustus dan September 2012. Daun salam yang berwarna hijau dan dalam keadaan segar diambil mulai dari daun ketiga dari ujung dan kedua dari pangkal. Tidak diambil daun salam yang masih muda dikarenakan kandungan senyawa didalamnya masih belum optimal, sedangkan pada daun yang sudah tua kandungan senyawanya sudah berkurang. Oleh karena itu, diambil daun ketiga dari ujung dan kedua dari pangkal yang diperkirakan kandungan senyawanya optimal. Daun salam diambil dalam keadaan segar dimana tidak ada jamur dan bekas gigitan serangga karena adanya kemungkinan dihasilkannya metabolit sekunder yang bersifat toksik. Jika dihasilkan metabolit tersebut maka dapat berpengaruh terhadap hasil uji yang didapat pada penelitian ini.
B. Pembuatan Serbuk Daun Salam
ditutup kain hitam. Pengeringan dilakukan untuk mengurangi kadar air yang ada dalam simplisia dan dihentikan jika daun saat diremas mudah remuk. Pengurangan kadar air ini bertujuan untuk menghindari tumbuhnya jamur, kapang, atau bakteri yang dapat merusak simplisia, selain itu dapat menekan terjadinya peruraian senyawa kimia akibat adanya reaksi enzimatis yang bisa menimbulkan perubahan senyawa aktif.
Setelah dikeringkan, daun salam lalu diserbuk dengan menggunakan blender hingga halus. Serbuk daun selanjutnya diayak menggunakan pengayak No.40. Penyerbukan dan pengayakan dilakukan untuk memperkecil ukuran partikel bahan karena dengan ukuran partikel yang kecil maka akan memperluas permukaan partikel yang kontak dengan cairan penyari, sehingga diharapkan selama proses penyarian kandungan kimia yang dapat terlarut lebih banyak. Daun salam yang sudah diserbuk disimpan di dalam wadah yang kering dan tertutup rapat (Lampiran 3).
C. Pembuatan Ekstrak Etanolik Daun Salam
adalah caranya yang sederhana, peralatan yang digunakan sederhana, dan juga mudah dilakukan. Prinsip maserasi adalah perbedaan konsentrasi antara larutan senyawa aktif di dalam sel dengan pelarut ekstraksi, yang menyebabkan terjadinya difusi sehingga terjadi kesetimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Semakin lama waktu ekstraksi, maka kesempatan untuk kontak antara serbuk daun salam dengan pelarut akan semakin besar sehingga hasil ekstraksi semakin bertambah banyak. Tidak digunakan metode soxhlet pada proses ekstraksi karena dikhawatirkan senyawa aktif yang terkandung di dalam ekstrak tidak tahan panas selain itu, senyawa flavonoid mudah teroksidasi pada suhu yang tinggi.
Ekstraksi dilakukan dengan menggunakan pelarut etanol 96% sebanyak 500 mL untuk setiap 50 gram serbuk. Sejumlah simplisia kering beserta pelarut dimasukkan ke dalam erlenmeyer bertutup dan dilakukan di atas shaker dengan kecepatan 120 rpm selama 5 hari. Penggunaan shaker bertujuan untuk meratakan konsentrasi senyawa aktif dalam pelarut ekstraksi, sehingga perbedaan konsentrasi antara larutan di dalam dan di luar sel tetap terjaga.
D. Skrining Fitokimia Ekstrak Etanolik Daun Salam
[image:53.595.71.521.307.712.2]Pada penelitian ini dilakukan skrining fitokimia daun salam yang bertujuan untuk mengetahui senyawa yang terkandung di dalam daun salam. Bahan yang digunakan dalam skrining fitokimia adalah serbuk daun salam. Menurut Winarto (2003), kandungan daun salam yang memiliki aktivitas sebagai antibakteri yaitu flavonoid dan tanin. Dilakukan uji kualitatif yang bertujuan untuk memastikan keberadaan flavonoid dan tanin di daun salam dengan menggunakan uji tabung reaksi dan uji KLT. Berdasarkan skrining fitokimia yang telah dilakukan terhadap keberadaan flavonoid dan tanin, diperoleh hasil yang dapat diamati pada tabel I.
Tabel I. Hasil skrining fitokimia serbuk daun salam
Uji Hasil uji tabung Penafsiran Hasil Flavonoid Terjadi perubahan warna dari warna merah menjadi
merah pudar (+)
Tanin Terbentuk endapan dan terjadi perubahan warna
menjadi biru kehitaman (+)
Gambar 5. Hasil skrining fitokimia serbuk daun salam
Flavonoid
Tanin
1. Uji flavonoid
Gambar 6. Penampakan bercak flavonoid sesudah diuapi amoniak Keterangan :
Fase diam : Selulosa
Fase gerak : n-butanol- asam asetat glasial:air (40:10:50) A : Standar rutin
B : Sampel penotoloan 1 C : Sampel penotolan 2
2. Uji tanin
Tanin diketahui memiliki aktivitas antivirus, antibakteri, dan antitumor. Tanin merupakan senyawa fenol. Pereaksi yang sering digunakan untuk identifikasi senyawa fenol adalah FeCl3. Warna biru kehitaman yang ditimbulkan dari reaksi FeCl3 menunjukkan adanya kandungan tanin terhidrolisis. Uji lain yang dilakukan yaitu dengan menggunakan gelatin 1% dengan mengamati
A B C
5,8
terbentuknya endapan saat direaksikan dengan gelatin. Berdasarkan hasil yang telah didapatkan maka dapat disimpulkan bahwa daun salam mengandung tanin.
Tanin terdiri dari katekin, leukoantosianin dan asam hidroksi yang masing-masing dapat menimbulkan warna bila bereaksi dengan ion logam. Warna ini terbentuk karena adanya kompleks antara logam Fe dari FeCl3 dengan gugus hidroksil dari tanin sehingga menghasilkan warna yang spesifik karena gugus hidroksil berkonyugasi dengan ikatan rangkap (Winarno, 2002). Menurut Lemmens dan Soetjipto, 1991 cit Mukhlisoh, 2010, terbentuknya endapan putih dengan menggunakan larutan gelatin dikarenakan adanya ikatan hidrogen antara tanin dan protein pada gelatin. Ikatan hidrogen antara gugus karbonil dari ikatan peptida dengan gugus hidroksil dari tanin merupakan ikatan yang paling dominan di dalam kompleks tanin-protein.
Gambar 7. Penampakan bercak tanin setelah disemprot dengan FeCl3
Keterangan :
Fase diam : Silika gel
Fase gerak : kloroform:metanol:air (14:6:0,8) A : Standar tanin
B : Sampel penotoloan 1 C : Sampel penotolan 2
E. Uji Daya Antibakteri Ekstrak Etanolik Daun Salam Terhadap Streptococcus mutans dengan metode Difusi Sumuran
Pengujian daya antibakteri ini dilakukan untuk mengetahui sejauh mana aktivitas suatu bakteri terhadap agen antibakteri. Uji daya antibakteri dengan menggunakan metode difusi sumuran dilakukan untuk menentukan rentang konsentrasi yang akan digunakan dalam penentuan nilai KHM dan KBM. Prinsip
A B C
metode difusi yaitu pengukuran daya antibakteri berdasarkan pengamatan luas zona hambat pertumbuhan bakteri karena berdifusinya obat dari tempat awal pemberian ke daerah difusi. Pada pengujian difusi sumuran ekstrak daun salam dibuat dalam beberapa konsentrasi yaitu 5, 10, 20, 30, dan 50 mg/mL dengan menggunakan pelarut aquadest steril (Lampiran 7). Penentuan konsentrasi ini berdasarkan orientasi yang telah dilakukan peneliti. Berdasarkan hasil orientasi, konsentrasi tertinggi yang dapat larut sempurna adalah konsentrasi 50 mg/mL, sedangkan diatas konsentrasi 50 mg/mL ekstrak tidak dapat larut sempurna sehingga akan berpengaruh pada hasil yang akan didapat.
terbentuk pada ekstrak daun salam lebih besar dibandingkan dengan klorheksidin, maka ekstrak daun salam memiliki potensi yang kuat sebagai antibakteri dan dapat dikembangkan dalam formulasi bahan alam menjadi sediaan farmasi dengan dosis terapi ekstrak etanolik daun salam yang dapat digunakan secara mudah oleh masyarakat.
Pengujian aktivitas antibakteri pada ekstrak etanolik daun salam dilakukan dengan metode difusi sumuran menggunakan media MHA dengan konsentrasi 5, 10, 20, 30, dan 50 mg/mL terhadap bakteri Streptococcus mutans. Kultur bakteri Streptococcus mutans yang digunakan pada penelitian ini merupakan bakteri yang berasal dari Balai Laboratorium Kesehatan Yogyakarta. Perlu dilakukan sterilisasi media dan alat-alat yang akan digunakan dengan menggunakan autoklaf. Prinsip kerja dari autoklaf adalah sterilisasi dengan menggunakan uap panas bertekanan tinggi yaitu 1210C, 1 atm selama 15 menit. Sterilisasi dengan autoklaf akan mendenaturasi protein sel bakteri dan mengkoagulasi protoplasma. Pada saat akan disterilisasi, tutup tabung tidak boleh ditutup terlalu kencang karena digunakannya tekanan tinggi. Tabung yang ditutup terlalu kencang dikhawatirkan akan pecah karena tekanan yang tinggi.
ekstrak daging sapi (2 g), asam hidroksilat dari kasein (17,5 g), pati (1,5 g), dan agar (17 g). Ekstrak daging sapi dan asam hidroksilat dari kasein menyediakan nitrogen, vitamin, karbon, dan asam amino. Pati ditambahkan untuk menyerap metabolit beracun yang dihasilkan, dan agar berfungsi untuk memadatkan media (Acumedia, 2011). Media MHA dibuat dengan cara melarutkan 38 gram bubuk media MHA dalam aquadest sampai volume 1 L. Larutan dimasukkan ke dalam erlenmeyer dan dipanaskan sampai larutan menjadi jernih dengan bantuan stearer. Pengujian ini dilakukan dengan pengulangan sebanyak 3 kali replikasi dimana setiap replikasi dilakukan 3 kali repetisi. Sebanyak 1-2 ose Streptococcus
mutans dimasukkan ke dalam natrium klorida 0,9% dimana jumlah suspensi
bakteri yang digunakan disetarakan dengan standar 0,5 Mc Farland II (diperkirakan 1,5x108 sel bakteri/mL) dengan menggunakan Densicheck. Penggunaan natrium klorida 0,9% berfungsi untuk menjaga sel bakteri dalam keadaan isotonis, karena jika bakteri dalam keadaan hipotonis atau hipertonis maka selnya akan pecah sehingga bakteri akan mati. Selain itu, natrium klorida 0,9% merupakan sumber mineral yang dibutuhkan untuk pertumbuhan bakteri. Pada setiap petri yang berisi media MHA dibuat sebanyak 7 lubang dengan menggunakan pelubang berdiameter 6 mm. Sumuran yang terbentuk kemudian ditambal dengan media MHA cair sebanyak 30 µL, dan dibiarkan memadat. Selanjutnya masing-masing lubang ditambahkan sebanyak 50 µL yang berisi 5 konsentrasi larutan uji, 1 kontrol positif, dan 1 kontrol negatif.
mengetahui apakah proses pengujian yang dilakukan aseptis atau tidak dan juga untuk mengetahui apakah media yang digunakan terkontaminasi atau tidak. Kontrol pertumbuhan bakteri berfungsi untuk mengetahui pertumbuhan
Streptococcus mutans tanpa pemberian agen antibakteri. Dari hasil pengamatan
untuk kontrol media tidak menunjukkan adanya kontaminasi, hal ini berarti media yang digunakan adalah media steril dan pengerjaan dilakukan secara aseptis. Pada kontrol negatif tidak terbentuk zona hambat, hal ini berarti pelarut yang digunakan tidak memberikan pengaruh terhadap zona hambat yang terbentuk pada perlakuan. Apabila pelarut memiliki kemampuan untuk dapat menghambat pertumbuhan bakteri uji maka akan mempengaruhi hasil uji karena zona hambat yang dihasilkan tidak hanya dari larutan uji, tetapi juga dari pelarut yang digunakan. Pada kontrol pertumbuhan menunjukkan adanya pertumbuhan Streptococcus
mutans dilihat dari koloni bakteri yang seragam dan tidak terdapat kontaminasi
Tabel II. Rata-rata diameter zona hambat pertumbuhan bakteri Streptococcus mutans yang dihasilkan pada uji daya antibakteri ekstrak etanolik daun salam
Konsentrasi ekstrak (mg/mL)
Diameter zona hambat (mm)
Rata-rata
I II III
Kontrol negatif 0 0 0 0
Kontrol positif 11 12 12 12
5 6 6 5 6
10 8 8 7 7
20 9 9 8 8
30 10 10 10 10
50 12 11 12 11
Keterangan : Diameter zona hambat sudah dikurangi dengan diameter sumuran sebesar 6 mm
Gambar 8. Zona hambat yang terbentuk pada difusi sumuran ekstrak etanolik daun salam terhadap bakteri Streptococcus mutans
Keterangan :
A : Kontrol Negatif (aquadest) B : Kontrol Positif (klorheksidin) C : Konsentrasi 5 mg/mL D : Konsentrasi 10 mg/mL E : Konsentrasi 20 mg/mL F : Konsentrasi 30 mg/mL G : Konsentrasi 50 mg/mL
Menurut Davis Stout cit Moerfiah dan Supomo (2011), menyatakan bahwa ketentuan antibakteri adalah sebagai berikut :
1. Sangat kuat (diameter zona hambat 20 mm atau lebih) 2. Kuat (diameter zona hambat 10-20 mm)
3. Sedang (diameter zona hambat 5-10 mm) 4. Lemah (diameter zona hambat < 5 mm)
Adanya zona hambat di sekitar sumuran karena adanya flavonoid dan tanin berdasarkan analisis fitokimia yang merupakan senyawa golongan fenol yang dapat menyebabkan terjadinya denaturasi dan koagulasi protein sel bakteri. Turunan fenol dapat berinteraksi dengan membran sitoplasma, enzim, dan lipid pada bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Menurut Siswandono dan Soekardjo (2008) fenol pada konsentrasi rendah akan membentuk kompleks protein fenol dengan ikatan lemah dan segera menyebabkan penguraian diikuti penetrasi fenol ke dalam sel bakteri dan menyebabkan presipitasi serta denaturasi protein, sedangkan pada konsentrasi tinggi fenol menyebabkan koagulasi protein membran sehingga membran sel bakteri menjadi lisis dan mengalami kematian. Protein merupakan komponen enzim sehingga jika terjadi kerusakan pada enzim akan mengakibatkan metabolisme menurun yang mengakibatkan terhambatnya pertumbuhan dan perkembangan sel bakteri dan selanjutnya menyebabkan kematian sel.
bakteri mengalami kematian sel (McKarns, Hansch, Caldwell, Morgan, Moore, Doolittle, 1997; Hunt, 1975).
Sebagai antibakteri, flavonoid dapat membentuk kompleks dengan protein ekstraseluler dan dinding sel bakteri. Selain itu, flavonoid yang bersifat lipofilik dapat merusak membran bakteri (Cowan, 1999). Menurut Cushnie and Lamb (2005), pada golongan flavonoid, termasuk flavon, flavanon, isoflavon, dan isoflavanon menunjukan aktivitas antibakteri yang berbeda pada metode difusi agar paper disc. Pada 5-hidroksiflavanon dan 5-hidroksiisoflavanon dengan
adanya penambahan satu, dua, atau tiga golongan hidroksil pada posisi 7, 2’ dan
4’ menunjukkan adanya penghambatan pertumbuhan Streptococcus mutans.
Selain itu, chalcone 2,4,2’-trihydroxy-5’-methylchalcone dapat menginduksi terjadinya kebocoran substansi Streptococcus mutans seperti nukleotida dengan mengubah permeabilitas membran selular dan menyebabkan kerusakan fungsi membran sitoplasma yang teramati pada panjang gelombang 260 nm.
Analisis secara statistik dilakukan untuk melihat perbedaan bermakna antara variasi konsentrasi ekstrak etanolik daun salam dengan kontrol negatif dan kontrol positif. Menurut Dahlan (2011), analisis diawali dengan menggunakan uji
Shapiro-Wilk yang dilanjutkan dengan uji Kruskal-Wallis terlebih dahulu.
menggunakan uji Kruskal-Wallis untuk mengetahui paling tidak terdapat dua kelompok data yang mempunyai perbedaan yang bermakna dengan nilai p<0,05 yang selanjutnya harus dilakukan analisis Wilcoxon (Dahlan, 2011). Hasil uji
[image:67.595.69.523.229.621.2]Kruskal-Wallis didapatkan nilai p=0,005328 (Tabel III).
Tabel III. Hasil uji statistik keberbedabermaknaan antara diameter zona hambat dengan berbagai variasi konsentrasi ekstrak etanolik daun salam terhadap Streptococcus mutans
dengan metode Kruskal-Wallis
Tabel IV. Data hasil uji Wilcoxon
K.+ K.- 5 10 20 30 50
K.+ - b.b b.b b.b b.b b.b b.b
K.- b.b - b.b b.b b.b b.b b.b
5 b.b b.b - b.b b.b b.b b.b
10 b.b b.b b.b - b.b b.b b.b
20 b.b b.b b.b b.b - b.b b.b
30 b.b b.b b.b b.b b.b - b.b
50 tb.b b.b b.b b.b b.b b.b -
Keterangan :
tb.b p=0,2752 b.b p=0,0369 b.b p=0,04953
F. Penentuan KHM dan KBM Ekstrak Etanolik Daun Salam dengan Metode Dilusi Padat
[image:69.595.72.516.268.687.2]Pengujian ini dilakukan untuk mengetahui konsentrasi minimal ekstrak etanolik daun salam yang dibutuhkan untuk mendapatkan efek daya antibakteri terhadap Streptococcus mutans. Konsentrasi larutan uji yang digunakan dalam metode dilusi ini mengacu pada hasil uji difusi sumuran. Sebagai perlakuan digunakan 8 konsentrasi larutan uji, yaitu 15, 18, 20, 22, 24, 26, 28, dan 30 mg/mL (Lampiran 7). Penentuan kosentrasi larutan uji tersebut didasarkan pada pengujian sebelumnya yang dilakukan dengan menggunakan konsentrasi 1, 2, 3, 4, 5, 6, 7, 8, dan 9 mg/mL dimana pada hasil pengamatan tidak didapatkan media pertumbuhan yang jernih. Oleh karena itu, konsentrasi larutan uji dinaikkan untuk mendapatkan hasil media yang jernih dengan tidak adanya pertumbuhan bakteri. Penilaian uji ini berdasarkan tingkat kekeruhan yang dihasilkan dengan adanya penambahan larutan uji. Pada metode dilusi padat ini dilakukan pengujian sebanyak 1 replikasi yang kemudian direpetisi sebanyak tiga kali.
Tabel V. Hasil pengamatan penentuan nilai KHM dan KBM
Konsentrasi (mg/mL) Kekeruhan Replikasi I
15 -
18 -
20 -
22 -
24 -
26 -
28 -
30 -
Kontrol negatif +++
Kontrol positif -
Gambar 9. Hasil dilusi padat pada konsentrasi 15 dan 18 mg/mL
Pengamatan kekeruhan hasil dilusi padat dilakukan secara visual yang dibandingkan dengan kontrol negatif dan kontrol positif. Kekeruhan yang dihasilkan pada media menunjukkan adanya pertumbuhan bakteri. Oleh karena itu, dilakukan penggolongan tingkat kekeruhan bakteri, apakah sangat keruh (+++), keruh (++), agak keruh (+), dan jernih (-) yang berarti tidak terdapat pertumbuhan bakteri uji. Berdasarkan hasil pengamatan, semua petri pada semua konsentrasi menghasilkan kejernihan yang sama dan tidak terdapat pertumbuhan bakteri (Lampiran 12).
G. Uji Penegasan Daya Antibakteri Ekstrak Etanolik Daun Salam dengan Metode Streak Plate
dinyatakan sebagai nilai KHM apabila dari pengamatan hasil streak plate masih menunjukkan adanya pertumbuhan bakteri. Sedangkan penentuan nilai KBM ditandai dengan tidak adanya pertumbuhan pada hasil streak plate yang menandakan bakteri uji mati karena larutan uji dengan konsentrasi tersebut.
Gambar 10. Hasil streak plate pada konsnetrasi 15 dan 18 mg/mL
52
BAB V
A. Kesimpulan
1. Ekstrak etanolik daun salam memiliki daya antibakteri terhadap bakteri
Streptococcus mutans penyebab karies gigi.
2. Ekstrak etanolik daun salam memiliki Kadar Hambat Minimum (KHM) pada konsentrasi 15 mg/mL dan Kadar Bunuh Minimum (KBM) pada konsentrasi 18 mg/mL terhadap bakteri Streptococcus mutans penyebab karies gigi.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut untuk mendapatkan kepastian kandungan kimia yang terkandung dalam ekstrak etanol daun salam yang menyebabkan efek antibakteri dengan metode identifikasi yang lebih spesifik. 2. Dapat dilakukan penelitian lebih lanjut mengenai pengembangan bentuk
sediaan farmasi yang mengandung senyawa aktif daun salam sehingga dapat digunakan sebagai antibakteri terhadap bakteri Streptococcus mutans dan menjadi terapi alternatif penyakit karies gigi akibat infeksi bakteri yang dapat digunakan secara mudah oleh masyarakat, misalnya sediaan pasta gigi atau
53
DAFTAR PUSTAKA
Acumedia, 2011, Mueller Hinton Agar (77101), http:// www.neogen.com/Acumedia/pdf/ProdInfo/7101_PI.pdf, diakses 18 Januari 2013.
Alcamo, I.E., 1996, Laboratory Fundamentals of Microbiology, 5th Edition, Addison Wesley Longman Publishing Company, Canada, p.309.
Anggrae