x
INTISARI
Polusi timbal merupakan masalah lingkungan serius yang potensial merusak sistem saraf dan otak. Selama ini Na2CaEDTA digunakan sebagai
antiracun timbal. Bawang putih memiliki kemampuan untuk menurunkan kadar timbal darah. Penelitian ini bertujuan untuk mengetahui efektifitas serta lama waktu ekstrak etanol umbi bawang putih (Allium sativum L.) setelah pemberian Na2CaEDTA dalam menurunkan kadar timbal darah tikus.
Antiracun Na2CaEDTA dan ekstrak etanol umbi bawang putih diberikan
selama 10 hari setelah pemejanan timbal asetat 0,5 g/kg BB/oral/hari/tikus selama 30 hari. Besarnya kadar timbal darah sampel dari setiap kelompok perlakuan ditentukan dengan metode spektroskopi serapan atom pada panjang gelombang 283,3 nm. Perbedaan kadar timbal kelompok perlakuan dianalisis dengan taraf kepercayaan 95%. Uji Kruskal-Wallis dilakukan untuk mengetahui perbedaan kadar timbal antarkelompok perlakuan, sedangkan perbedaan kadar timbal darah dalam satu kelompok dianalisis dengan uji Friedman.
Hasil penelitian menunjukkan bahwa Na2CaEDTA dan ekstrak etanol
umbi bawang putih 200 mg/kg BB dapat menurunkan kadar timbal darah. Efektifitas penurunan kadar timbal terlihat setelah pemberian selama 10 hari. Kata kunci: Na2CaEDTA, bawang putih, ekstrak etanol, kadar timbal darah,
xi
ABSTRACT
Lead poisoning is a serious enviromental problem, potentially damages nervous systems and brain. Na2CaEDTA has been use as lead antidote. Allii sativi
Bulbus ethanol extract has ability to decrease blood lead level. The examination is directed to find out the effectiveness and duration of Allii sativi Bulbus ethanol extract after administration of Na2CaEDTA to decrease blood lead level in rat.
Antidote Na2CaEDTA and Allii sativi Bulbus ethanol extract were
administered for 10 days after 30 days lead intoxication. The concentration of blood lead was determined by atomic absorption spectroscopy method at 283,3 nm wavelength. The results were tested with stastitical analysis method with 95% of confidence interval. Kruskal-Wallis and Friedman approach are used to know the effectiveness of administrations.
The results indicated Na2CaEDTA and Allii sativi Bulbus ethanol extract
200 mg/kg body weight have ability to decrease blood lead level. After 10 days, Allii sativi Bulbus ethanol extract and Na2CaEDTA were decrease blood lead level
effectively.
Keywords: Na2CaEDTA, Allii sativi Bulbus, ethanol extract, blood lead level,
PENGARUH EKSTRAK ETANOL UMBI BAWANG PUTIH (Allium
sativum L.) SETELAH PEMBERIAN Na2CaEDTA
TERHADAP KADAR TIMBAL DARAH TIKUS DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Filana Fedelia NIM: 048114042
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PENGARUH EKSTRAK ETANOL UMBI BAWANG PUTIH (Allium
sativum L.) SETELAH PEMBERIAN Na2CaEDTA
TERHADAP KADAR TIMBAL DARAH TIKUS DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Filana Fedelia NIM: 048114042
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
G a nja ra n te rb e sa r pa da pe ke rja a n ya ng sa ng a t sulit
b uka n ha sil ya ng a ka n dipe ro le h, m e la inka n a ka n
m e nja di a pa Anda ka re na nya .
( Jo hn Ruskin )
vii
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Bapa yang Maha Kuasa atas segala karunia, kemudahan, dan kebaikan-Nya sehingga skripsi dengan judul “Pengaruh Ekstrak Etanol Umbi Bawang Putih (Allium sativum L.) Setelah Pemberian Na2CaEDTA terhadap Kadar Timbal Darah Tikus dengan Metode
Spektroskopi Serapan Atom” dapat terselesaikan. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S. Farm.) pada Program Studi Farmasi Universitas Sanata Dharma.
Selama penelitian dan penyusunan skripsi ini, penulis mendapat banyak bantuan dan dukungan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi USD.
2. Ipang Djunarko, S. Si, Apt., selaku dosen pembimbing yang telah meluangkan waktu, tenaga, dan saran dalam penyusunan skripsi ini.
3. Drs. Sulasmono, Apt., selaku dosen penguji atas pengarahan dan kesediannya menguji.
4. Drs. A. Tri Priantoro, M.For.Sc, selaku dosen penguji atas pengarahan dan kesediannya menguji.
5. Mas Parjiman, Mas Heru, Mas Kayat, Mas Sigit, Mas Wagiran, Mas Andri, Mas Yuwono, Mas Ottok dan Pak Parlan yang telah memberikan bantuan yang sangat berharga selama pelaksanaan penelitian.
viii
7. Karyawan Merapi Farma atas serbuk bawang putih serta Bu Astuti dan segenap karyawan LPPT Unit I UGM yang telah banyak membantu dalam penelitian skripsi ini.
8. Papa, Mama, Cie Mila serta adik-adikku, Sieling, dan Ilan atas segala dukungan, doa restu, semangat dan cinta kasih yang berlimpah selama ini. 9. Sisil, Cawaz, dan Tami atas kerjasama, canda tawa, keluh kesah, dan
semangat selama penelitian dan penyusunan skripsi.
10.Teman-teman kosku, Avi, Shinta, mbak Melon, Marlin, mbak Ica, Vita, Riska, Tresa dan mbak Desy.
11.Teman-teman kelas FKK angkatan 2004, khususnya kelompok praktikum C atas kebersamaan dan suka-dukanya selama menjalani tahun-tahun kuliah di Farmasi.
12.Semua pihak yang telah banyak membantu penyusunan skripsi ini yang tak dapat disebutkan satu-persatu.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini tak lepas dari segala keterbatasan dan kekurangan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun untuk penyempurnaan skripsi ini. Akhir kata, penulis berharap semoga skripsi ini dapat memberikan sumbangan dalam perkembangan ilmu pengetahuan.
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 29 Mei 2008 Penulis,
x
INTISARI
Polusi timbal merupakan masalah lingkungan serius yang potensial merusak sistem saraf dan otak. Selama ini Na2CaEDTA digunakan sebagai
antiracun timbal. Bawang putih memiliki kemampuan untuk menurunkan kadar timbal darah. Penelitian ini bertujuan untuk mengetahui efektifitas serta lama waktu ekstrak etanol umbi bawang putih (Allium sativum L.) setelah pemberian Na2CaEDTA dalam menurunkan kadar timbal darah tikus.
Antiracun Na2CaEDTA dan ekstrak etanol umbi bawang putih diberikan
selama 10 hari setelah pemejanan timbal asetat 0,5 g/kg BB/oral/hari/tikus selama 30 hari. Besarnya kadar timbal darah sampel dari setiap kelompok perlakuan ditentukan dengan metode spektroskopi serapan atom pada panjang gelombang 283,3 nm. Perbedaan kadar timbal kelompok perlakuan dianalisis dengan taraf kepercayaan 95%. Uji Kruskal-Wallis dilakukan untuk mengetahui perbedaan kadar timbal antarkelompok perlakuan, sedangkan perbedaan kadar timbal darah dalam satu kelompok dianalisis dengan uji Friedman.
Hasil penelitian menunjukkan bahwa Na2CaEDTA dan ekstrak etanol
umbi bawang putih 200 mg/kg BB dapat menurunkan kadar timbal darah. Efektifitas penurunan kadar timbal terlihat setelah pemberian selama 10 hari. Kata kunci: Na2CaEDTA, bawang putih, ekstrak etanol, kadar timbal darah,
xi
ABSTRACT
Lead poisoning is a serious enviromental problem, potentially damages nervous systems and brain. Na2CaEDTA has been use as lead antidote. Allii sativi
Bulbus ethanol extract has ability to decrease blood lead level. The examination is directed to find out the effectiveness and duration of Allii sativi Bulbus ethanol extract after administration of Na2CaEDTA to decrease blood lead level in rat.
Antidote Na2CaEDTA and Allii sativi Bulbus ethanol extract were
administered for 10 days after 30 days lead intoxication. The concentration of blood lead was determined by atomic absorption spectroscopy method at 283,3 nm wavelength. The results were tested with stastitical analysis method with 95% of confidence interval. Kruskal-Wallis and Friedman approach are used to know the effectiveness of administrations.
The results indicated Na2CaEDTA and Allii sativi Bulbus ethanol extract
200 mg/kg body weight have ability to decrease blood lead level. After 10 days, Allii sativi Bulbus ethanol extract and Na2CaEDTA were decrease blood lead level
effectively.
Keywords: Na2CaEDTA, Allii sativi Bulbus, ethanol extract, blood lead level,
xii
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH vi PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI... x
ABSTRACT... xi
DAFTAR ISI ... xii
DAFTAR TABEL... xvi
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN ... xxi
ARTI SINGKATAN DAN ISTILAH ASING... xxiii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan... 2
2. Keaslian penelitian... 3
3. Manfaat penelitian... 4
B. Tujuan Penelitian... 4
xiii
A. Bawang Putih (Allium sativum L.) ... 5
1. Keterangan botani ... 5
2. Nama daerah... 5
3. Deskripsi tanaman... 5
4. Kandungan kimia ... 6
5. Khasiat dan penggunaan... 6
` B. Selenium... 7
C. Timbal ... 10
1. Farmakokinetika timbal... 10
2. Keracunan timbal ... 11
3. Mekanisme keracunan timbal... 11
4. Timbal asetat ... 14
D. Penanganan Keracunan Timbal... 15
1. Terapi suportif ... 15
2. Penyidikan jenis racun penyebab ... 16
3. Terapi antidot ... 16
E. Kalsium Disodium Edatat (Na2CaEDTA)... 17
1. Farmakokinetika Na2CaEDTA... 18
2. Indikasi ... 18
3. Dosis dan cara pemberian ... 18
4. Efek samping... 19
5. Mekanisme aksi Na2CaEDTA... 19
xiv
G. Spektroskopi Serapan Atom (SSA)... 21
1. Prinsip metode spektroskopi serapan atom... 21
2. Instrumentasi spektrometer serapan atom... 23
3. Keunggulan dan kelemahan metode spektroskopi serapan atom. 26 4. Preparasi sampel organik ... 26
H. Validasi Metode ... 27
1. Akurasi ... 28
2. Presisi ... 28
3. Linearitas dan rentang ... 29
4. Spesifisitas... 29
5. Limit of detection (LOD) dan limit of quantitation (LOQ)... 29
I. Landasan Teori... 31
J. Hipotesis ... 32
BAB III METODE PENELITIAN ... 33
A. Jenis dan Rancangan Penelitian ... 33
B. Variabel dan Definisi Operasional ... 33
1. Variabel penelitian ... 33
2. Definisi operasional... 34
C. Bahan atau Materi Penelitian... 35
D. Alat atau Instrumen Penelitian... 35
E. Tatacara Penelitian... 35
xv
2. Preparasi bahan... 36
3. Preparasi dan perlakuan hewan uji... 38
4. Preparasi sampel... 39
5. Pengaturan spektrometer serapan atom... 40
6. Pembuatan kurva baku ... 40
7. Penentuan kadar timbal dalam darah sampel ... 41
E. Ana lisis Hasil ... 41
BAB IV HASIL DAN PEMBAHASAN ... 43
A. Determinasi Tanaman... 43
B. Pengukuran Kadar Timbal Darah... 43
1. Kurva baku timbal... 43
2. Kadar timbal darah akibat penawarracunan menggunakan Na2CaEDTA dan ekstrak etanol bawang putih ... 47
BAB V KESIMPULAN DAN SARAN ... 59
A. Kesimpulan... 59
B. Saran... 59
DAFTAR PUSTAKA ... 60
LAMPIRAN ... 67
xvi
DAFTAR TABEL
Tabel I. Kriteria koefisien variasi (KV) laboratorium yang dapat
diterima... 29 Tabel II. Parameter validasi metode yang dipersyaratkan untuk
setiap kategori ... 30 Tabel III. Syarat karakteristik validasi metode analisis logam berat
dengan spektroskopi... 30 Tabel IV Nilai linearitas kurva baku timbal hasil pengukuran
dengan metode spektrometri serapan atom... 46 Tabel V Nilai koefisien variasi (KV) kontrol dan perlakuan... 46 Tabel VI Nilai rata-rata kadar timbal darah (ppm) hasil pengukuran dengan metode spektrometri serapan atom dan perbedaan
secara statistik terhadap kontrol negatif ... 47 Tabel VII. Hubungan perbedaan kadar timbal secara statistik ... 49 Tabel VIII. Hasil pengujian sensitifitas detektor spektrometer serapan
atom... 68 Tabel IX Hasil pengujian linearitas detektor spektrometer serapan
atom... 69 Tabel X Perbandingan hasil pembacaan dan standar... 69 Tabel XI Kadar timbal darah (ppm) selama 45 hari dan perkiraan
kadar hari ke-30... 75 Tabel XII. Hasil kadar timbal terlarut dengan metode spektroskopi
xvii
Tabel XIII. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-15... 90 Tabel XIV. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-30... 90 Tabel XV. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-35... 91 Tabel XVI. Hasil kadar timbal terlarut dengan metode spektroskopi
xviii
DAFTAR GAMBAR
Gambar 1. Struktur selenometionin dan selenosistein ... 8
Gambar 2. Struktur γ -glutamil-Se- metil- L-selenosistein ... 8
Gambar 3. Skema metabolisme selenometionin menjadi selenosistein 8 Gambar 4. Skema pembentukan dan detoksifikasi ROS ... 9
Gambar 5. Skema penghambatan sintesis heme oleh timbal... 12
Gambar 6. Peran kalsium dalam pelepasan neurotransmitter ... 13
Gambar 7. Pengaruh timbal terhadap proses pembentukan ROS dan aktivitas enzim antioksidan ... 14
Gambar 8. Struktur timbal asetat ... 14
Gambar 9. Struktur kalsium disodium edetat... 17
Gambar 10. Instrumentasi spektrometer serapan atom... 24
Gambar 11. Prinsip metode spektroskopi serapan atom dan instrumentasinya... 24
Gambar 12. Skema proses atomisasi sampel... 25
Gambar 13. Pembagian zona nyala pada pembakar pada spektrometer serapan atom... 25
Gambar 14. Lampu katoda berongga (hallow cathode lamp) pada SSA dan bagian-bagiannya... 26
Gambar 15. Reaksi enzimatis peruraian alliin menjadi allicin ... 36
xix
Gambar 17. Kurva baku pengukuran larutan timbal hari ke-15 setelah pemejanan timbal selama 15 hari... 44
Gambar 18. Kurva baku pengukuran larutan timbal hari ke-30 setelah pemejanan timbal selama 30 hari... 45
Gambar 19. Kurva baku pengukuran larutan timbal hari ke-35 setelah kondisi praperlakuan selama 30 hari dan pemberian
Na2CaEDTA dilanjutkan ekstrak etanol umbi bawang putih
selama 5 hari... 45 Gambar 20 Kurva baku pengukuran larutan timbal hari ke-40 setelah
kondisi praperlakuan selama 30 hari dan pemberian Na2CaEDTA yang dilanjutkan ekstrak etanol umbi bawang
putih selama 10 hari... 45
Gambar 21. Profil farmakokinetika timbal ... 49 Gambar 22. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-0 (kondisi praperlakuan)... 52
Gambar 23. Histogram standar deviasi kadar timbal pada pengukuran hari ke-15 (kondisi praperlakuan)... 53
Gambar 24. Histogram standar deviasi kadar timbal pada pengukuran hari ke-30 setelah kondisi praperlakuan... 54 Gambar 25. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-35 setelah kondisi praperlakuan dan pemberian Na2CaEDTA yang dilanjutkan ekstrak etanol umbi
xx
Gambar 26. Histogram standar deviasi kadar timbal pada pengukuran hari ke-40 setelah kondisi praperlakuan dan pemberian Na2CaEDTA dilanjutkan ekstrak etanol umbi bawang putih
xxi
DAFTAR LAMPIRAN
Lampiran 1. Hasil determinasi Allium sativum L... 67
Lampiran 2. Formulir hasil kalibrasi internal spektrometer serapan
atom Hitachi Z-8000 Polarized Zeeman ... 68 Lampiran 3. Foto tanaman bawang putih ... 71 Lampiran 4. Foto umbi bawang putih... 71 Lampiran 5. Foto maserasi bawang putih... 71 Lampiran 6. Ekstrak etanol bawang putih ... 72 Lampiran 7. Foto larutan ekstrak etanol bawang putih ... 72 Lampiran 8. Foto destruksi sampel darah dengan wet chemical method 72 Lampiran 9. Foto filtrat sampel hasil destruksi ... 73 Lampiran 10. Foto spektrometer serapan atom Hitachi Z-8000 Polarized
Zeeman... 73 Lampiran 11. Perhitungan konsentrasi timbal asetat... 74 Lampiran 12. Perhitungan dosis dan konsentrasi Na2CaEDTA ... 74
Lampiran 13. Perhitungan konsentrasi ekstrak etanol bawang putih .... 75 Lampiran 14. Kadar timbal darah setelah pemejanan timbal hasil
orientasi selama 45 hari... 75 Lampiran 15. Hasil pembacaan serapan spektrometer serapan atom.... 76 Lampiran 16. Hasil kadar timbal dalam darah sampel ... 89 Lampiran 17. Uji distribusi data kadar timbal darah dengan Shapiro-Wilk 93 Lampiran 18. Hasil uji signifikansi kadar timbal dalam darah sampel
xxii
Lampiran 19. Hasil uji signifikansi kadar timbal darah kontrol negatif
dengan metode Friedman ... 101 Lampiran 20. Hasil uji signifikansi kadar timbal darah kontrol positif
dengan metode Friedman ... 105 Lampiran 21. Hasil uji signifikansi kadar timbal darah kontrol
Na2CaEDTA dengan metode Friedmann ... 109
Lampiran 22. Hasil uji signifikansi kadar timbal darah perlakuan
Na2CaEDTA yang dilanjutkan dengan ekstrak etanol umbi
bawang putih dengan metode Friedmann... 113 Lampiran 23. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-0... 117 Lampiran 24. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-15... 117 Lampiran 25. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-30 setelah kondisi praperlakuan... 118 Lampiran 26. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-35 setelah kondisi praperlakuan dan pemberian Na2CaEDTA dilanjutkan ekstrak etanol umbi bawang
putih selama 5 hari ... 118 Lampiran 27. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-35 setelah kondisi praperlakuan dan pemberian Na2CaEDTA dilanjutkan ekstrak etano l umbi bawang
xxiii
ARTI SINGKATAN DAN ISTILAH ASING
BCNU : 1,3-bis-(2-chloroethyl)-1-nitrosourea BSO : L-buthionine-(S,R)-sulfoximine DHEA : dehydroepiandrosterone
ED50 : dosis yang memberikan efek terhadap 50% populasi hewan uji.
GS : glutamyl synthase GSH : Glutation
GSH-PX : glutathione-peroxidase
GSSG : oxidized disulfide glutathione GSSG-RD : glutathione reductase
NADPH : nicotinamide adenine dinucleotide phoshate ROS : Reactive Oxygen Species
SOD : superoxide dismutase
1
BAB I
PENGANTAR
A. Latar Belakang
Timbal merupakan logam berat yang dapat menimbulkan keracunan pada manusia dan lingkungan. Keracunan timbal dari tahun ke tahun terus meningkat, walaupun tahap sosial ekonomi semakin baik. Masyarakat di kota besar dan berdiam di pinggir jalan dengan transportasi kendaraan bermotor padat serta di lingkungan industri merupakan kelompok yang rentan terhadap pencemaran timbal. Pejanan timbal banyak menimbulkan efek negatif, yaitu pada saraf pusat dan saraf tepi, sistem kardiovaskular, sistem hematopoetik, ginjal, pencernaan, sistem reproduksi, dan bersifat karsinogenik (Nordberg, 1998). Keracunan timbal pada anak-anak potensial merusak sistem saraf dan menurunkan intelligence quotient (IQ), menjadi lamban berpikir dan tidak cerdas (Hariono, 2005).
Pengobatan keracunan timbal yaitu dengan menghentikan pejanan timbal pada pasien, serta mengobatinya dengan kalsium disodium edetat (Na2CaEDTA).
Na2CaEDTA mengikat kation timbal dalam tulang dan jaringan lunak, seperti
eritrosit, otot, liver, dan ginjal. Selain menggunakan Na2CaEDTA, terapi
Bawang putih sering dimanfaatkan sebagai obat, selain digunakan sebagai bumbu masak. Bawang putih memiliki khasiat diaforetik, ekspektoran, spasmolitik, antelmintik, antiseptik, antikoagulan, antihistamin, dan bakteriostatik (Soedibyo, 1998). Berdasarkan penelitian Senapati, Dey, Dwivedi, Swarup (2001), ekstrak bawang putih dapat menurunkan konsentrasi timbal sehingga diindikasikan mempunyai aktivitas terapetik potensial melawan timbal. Senyawa yang diduga ikut menurunkan kadar timbal dalam darah adalah mineral selenium. Selenium pada bawang putih terdapat dalam bentuk asam selenoamino, selenometionin, dan selenosistein, yang merupakan komponen esensial sisi aktif enzim antioksidan glutation peroksidase, thioredoxin reductase, dan selenoenzim lainnya (Majeed, Bammi, Badmaev, Prakash, and Nagabhushanam, 2005).
Pada penelitian ini akan diberikan Na2CaEDTA dan ekstrak etanol umbi
bawang putih untuk mengetahui keefektifan dan lama waktu pemberian yang dibutuhkan untuk menurunkan kadar timbal darah.
1. Permasalahan
Berdasarkan latar belakang yang telah dipaparkan, maka dapat dirumuskan permasalahan sebagai berikut:
a. Apakah ekstrak etanol umbi bawang putih dengan dosis 200 mg/kg BB setelah pemberian Na2CaEDTA dapat menurunkan kadar timbal darah pada tikus?
b. Berapakah lama waktu pemejanan ekstrak etanol umbi bawang putih dosis 200 mg/kg BB setelah pemberian Na2CaEDTA yang dapat menurunkan kadar
2. Keaslian penelitian
Penelitian mengenai efek pemberian plumbum (timbah hitam) anorganik pada tikus putih telah dilakukan oleh Hariono (2005). Hasilnya, timbal dalam darah tikus mencapai kadar 0,75 µg/mL dalam waktu 4 minggu. Penelitian sebelumnya, pemejanan timbal selama 45 hari telah mencapai kadar toksik (> 0,7 ppm) (Wahyunengsih, Fedelia, Astoro, Putri, 2007).
Penelitian mengenai bawang putih telah banyak dilakukan, antara lain efek penghambatan ekstrak cair Allii sativi Bulbus terhadap biosintesis kolesterol pada hepatosit tikus, aktivitas antihipertensi Allii sativi Bulbus, efek hipoglikemia Allii sativi Bulbus secara in vivo (Anonim, 2000a), dan efek ekstrak air dan ekstrak etanol umbi bawang putih terhadap aktivitas fagositosis sistem retikuloendotelium mencit BALB/C (Iwo, Andreanus, Debbie, Sukrasno, Mar, 2002). Senapati et al (2001) telah meneliti efek ekstrak bawang putih dengan dosis 100 mg/kg BB, 200 mg/kg BB dan 400 mg/kg BB yang dapat menurunkan kadar timbal darah pada tikus.
Perbedaan dengan penelitian yang pernah dilakukan yaitu pengaruh ekstrak etanol umbi bawang putih setelah pemberian Na2CaEDTA terhadap
3. Manfaat penelitian
Penelitian mengenai pengaruh ekstrak etanol umbi bawang putih setelah pemberian Na2CaEDTA terhadap kadar timbal darah diharapkan memiliki
beberapa manfaat, antara lain:
a. Manfaat teoritis yang diperoleh adalah untuk melengkapi dan memperkaya teori yang telah ada mengenai kegunaan bawang putih dan terapi penawarracunan timbal dengan menggunakan senyawa kimia dan tumbuhan. b. Manfaat metodologis yang diperoleh adalah untuk memperbaiki metode
penelitian mengenai Na2CaEDTA dan ekstrak etanol umbi bawang putih
dalam penawarracunan timbal.
c. Manfaat praktis yang diperoleh ialah untuk mengembangkan pelayanan kefarmasian penawarracunan timbal dengan pemberian Na2CaEDTA dan
ekstrak etanol umbi bawang putih.
B. Tujuan Penelitian
Tujuan penelitian mengenai pengaruh ekstrak etanol umbi bawang putih setelah pemberian Na2CaEDTA terhadap kadar timbal darah ini adalah:
1. Membuktikan apakah ekstrak etanol umbi bawang putih 200 mg/kgBB setelah pemberian Na2CaEDTA dapat menurunkan kadar timbal darah pada tikus.
5
BAB II
PENELAAHAN PUSTAKA
A.Bawang Putih (Allium sativum L.)
1. Keterangan botani
Bawang putih termasuk famili Amaryllidaceae, genus Allium, dan spesies Allium sativum L. (Anonim, 1995a). Simplisia bawang putih terdiri dari umbi segar atau umbi yang dikeringkan dari tanaman bawang putih. Secara organoleptis, bau khas aromatik tajam, rasa agak pedas lama kelamaan menimbulkan rasa agak tebal di bibir, warna kekuningan (Anonim, 2000a).
2. Nama daerah
Sumatera: Lasum, bawang mental, lasuna, palasuna, bawang hong, bawang putieh, bawang handak. Jawa: Bawang bodas, bawang putih, bawang, bhabang pote. Nusa Tenggara: Laisona mabotiek. Sulawesi: Lasuna kebo, lasuna pute. Maluku: Bawa sobudo, bawa iso (Anonim, 1995a). Nama asing untuk tanaman ini adalah garlic (Inggris), ajo (Spanyol), ail, thériaque des pauvres (Prancis) dan da suan (Cina). Bawang putih yang digunakan juga terkenal dengan nama poor man’s treacle, rustic treacle, stinging rose (Anonim, 2004a).
3. Deskripsi tanaman
merah muda dan melekat pada bagian padat dari siung tetapi mudah dikupas; siung bentuk membulat di bagian punggung, bidang samping rata atau agak bersudut (Anonim, 1995a).
4. Kandungan kimia
Terdapat banyak zat kimia yang terkandung dalam bawang putih. Umbi bawang putih mengandung enzim allinase, peroksidase, myrosinase, aliin, alisin (dialil tiosulfinat), alilpropil disulfida, dialil disulfida, dialil trisulfida; ajoene dan vinyldithiines; S-alillmerkaptosistein dan S-metilmerkaptosistein; terpen termasuk
sitral, geraniol, linalool, α- dan β-phellandrene, protein, mineral, vitamin, lipid, asam amino, prostaglandin (A2 dan F1α) (Newall, 1996); dan selenium. Kadar
selenium kurang lebih 0,015 µg tiap gram bawang putih (Izgi, Gucer, Jacimovic, 2005).
5. Khasiat dan penggunaan
Bawang putih membantu detoksifikasi logam berat dari tubuh, termasuk timbal. Bawang putih akan melindungi membran eritrosit terhadap ion logam berat dengan mengkhelat ion logam berat, sehingga mudah untuk diekskresikan (Anonim, 2003).
B.Selenium
Selenium merupakan mikronutrien penting bagi manusia yang dapat berasal dari ikan, kerang, daging merah, biji-bijian, telur, ayam, hati dan bawang putih (Anonim, 2007c). RDA (The Recommended Dietary Allowance) merupakan kadar rata-rata asupan harian yang cukup untuk memenuhi hampir seluruh kebutuhan nutrisi pada individu. Berdasarkan RDA, selenium dibutuhkan individu dewasa yaitu 55 µg per hari, sedangkan asupan optimal harian membutuhkan 200-300µg/ hari. Dosis terapi selenium adalah 200-800µg/ hari. Dosis selenium di atas 1000µg/ hari telah menunjukkan gejala keracunan termasuk berkeringat, letargi, depresi, gelisah, mual, muntah, kerontokan rambut, kerusakan kuk u (Anonim, 2008a). Kadar selenium sebagai suplemen yang direkomendasikan untuk manusia adalah 50-200µg/ hari (Anonim, 2008b).
dimetabolisme menjadi selenosistein yang kemudian berikatan dengan
Gam bar 4 . Sk em a pem bent uk an dan det ok sifik asi ROS ( auf dem Keller, Küm in, Braun, W erner, 2 0 0 8 )
Glutation (GSH) disintesis dari asam amino L- glutamat dan sistein oleh enzim ?-glutamylcysteine synthetase (?-GCS) (Haddad, 2002). Anion superoksida (O2-•) dibentuk oleh NADPH (nicotinamide adenine dinucleotide phosphate)
oksidase. Radikal ini diperantarai oleh SOD (superoxide dismutase), menghasilkan hidrogen peroksida H2O2 dan O2 molekuler. H2O2 adalah substrat
yang akan dikatalisis oleh enzim peroksidase termasuk SeGPx dan PrxVI.
Enzim SeGPx dan PrxVI menggunakan glutation (GSH) sebagai substrat, yang kemudian dioksidasi menjadi GSH disulfida (GSSG) (auf dem Keller et al, 2008). Menurut Skidmore-Roth (2003), enzim glutation peroksidase (GSH-Px) akan mengkatalisis hidrogen peroksida, reaksinya adalah:
O2 + O2 + 2 H SOD H2O2 + O2 (1)
2 GSH + H2O2
GSH-Px
GSSG + 2 H2O
(2)
Selenium dapat mendetoksifikasi ion logam (Kalia and Flora, 2005). Senyawa selenium juga mengkatalisis reaksi metabolime dan menghambat efek toksik logam berat (Pyrzynska, 1998). Menurut Best (2008), senyawa pengkhelat logam dapat menjadi antioksidan dengan mencegah ion logam menghasilkan reaksi radikal bebas. Peraza, Aya la-Fierro, Barber, Casarez, Rael (1998) menyatakan bahwa selenium memiliki efek protektif penghambatan timbal di succinic dehydrogenase, asetilkolin esterase, dan sodium/potasium ATPase.
C.Timbal
Timbal digolongkan sebagai logam berat yang bersifat toksik, lunak, dapat ditempa, berwarna putih kebiruan tapi akan memudar menjadi kelabu jika terkena udara (Anonim, 2007b).
1. Farmakokinetika timbal
2. Keracunan timbal
Kadar timbal normal adalah 0,003 mg/100 cc darah lengkap. Jika kadarnya melebihi 0,10 mg/100 cc darah lengkap serta menunjukkan gejala klinis, dapat dikatakan telah terjadi keracunan (Palar, 1994). Gejala keracunan timbal akut yaitu mulut terasa terbakar, haus, inflamasi saluran gastrointestinal, muntah, dan diare. Gejala keracunan timbal kronik yaitu anoreksia, ‘lead-line’ pada gusi, mual, muntah, sakit perut parah, paralisis, gangguan mental, ga ngguan visual, anemia dan konvulsi (Katrina, 2006). Keracunan timbal lebih sering bersifat kronik dan jarang menunjukkan gejala akut (Anonim, 2005a). Pemejanan timbal atau garamnya dalam jangka panjang menyebabkan nephropathy, dan kolik perut (Anonim, 2007b).
Timbal menyebabkan ensefalopati jika kadarnya dalam darah di atas 80 µg/dl. Pada anak-anak, sindroma klinis terjadi jika kadar Pb darah 70 µg/dl. Sedangkan pada kadar 40-50 µg/dl, anak-anak akan menunjukkan hiperaktivitas, kurangnya perhatian, dan skor IQ menurun (Lu, 1995).
3. Mekanisme keracunan timbal
a. Efek timbal terhadap sintesis heme
dekarboksilase (UROD), dan koproporfirinogen oksidase (COPROD) tidak begitu peka (Goldstein and Kiper, 1994). Anemia klinis tampak jelas bila kadar Pb darah sekitar 50 µg/dl (Lu, 1995).
Ga m ba r 5 . Sk em a pengha m ba t a n sint esis hem e oleh t im ba l ( Sj a m sudin da n Suya t na , 2 0 0 7 )
b. Kompetisi timbal dengan kalsium
Transpor timbal menembus membran eritrosit diperantarai oleh anion exchanger dan pompa Ca-ATPase. Pada jaringan lain, timbal menembus membran sel melalui voltage-dependent atau jenis lain kanal kalsium. Setelah masuk ke sitoplasma, timbal akan menempati tempat ikatan kalsium pada protein yang tergantung kalsium. Timbal berikatan dengan kalmodulin, protein yang berperan sebagai sensor terhadap konsentrasi kalsium bebas dan sebagai mediator pelepasan neurotransmiter (gambar 6).
Ga m ba r 6 . Pera n k a lsium da la m pelepa sa n neurot ra nsm itt er ( Cla rk son, 1 9 8 7 )
Pada otak, timbal terakumulasi dalam sel astroglia, yang melindungi neuron- neuron. Astrosit dapat mati karena efek toksik ion Pb2+. Uptake timbal dalam sel astroglia dan neuron diperantarai oleh kanal kalsium (Anonim, 2007d). c. Pengaruh timbal terhadap enzim antioksidan
meningkatkan aktivitas enzim antioksidan superoksida dismutase (SOD), guaiacol peroksidase (GPX), askorbat peroksidase (APX), dehidroaskorbat reduktase (DHAR) dan NADPH dependen glutation reduktase (GR), tapi akan menurunkan aktivitas katalase (CAT). ROS akan menghasilkan radikal hidroksil (•OH) dari anion superoksida (O2-•) dan H2O2. Enzim antioksidan akan mengkatalisis
penguraian H2O2 menjadi air dan oksigen. Timbal menginduksi aktivitas
peroksidase di dalam membran sel. GR memiliki peranan penting melawan oksidatif yang diinduksi timbal.
Gam bar 7 . Pengaruh t im bal t erhadap proses pem bent uk an ROS dan ak t ivit as enzim a nt iok sida n. Tanda + dan – m enunj uk k an induk si at au inhibisi k arena disebabk an
t im ba l. ( Sha r m a a nd D ube y, 2 0 0 5 )
4. Timbal asetat
Timbal asetat merupakan senyawa berbentuk kristal dengan rasa manis. Timbal asetat sangat beracun seperti semua senyawa timbal lain, larut di dalam air dan gliserin (Anonim, 2008c), sedikit larut dalam etanol (Anonim, 2001).
Menurut Anonim (2008c), reaksi antara timbal asetat dengan air menghasilkan timbal asetat trihidrat (3), suatu senyawa kristal yang umum dikenal sebagai gula timbal, plumbous asetat, atau serbuk Goulard.
Pb(CH3COO)2 + 3 H2O Pb(CH3COO)2 . 3H2O
(3)
Penggunaan timbal asetat yaitu sebagai pewarna tekstil dan pewarna rambut untuk menghasilkan efek warna yang bergradasi (Anonim, 2002), pengering pada cat dan pernis, dan merupakan prekursor untuk membuat senyawa timbal lainnya (Anonim, 2008c). Reaksi timbal asetat sebagai pewarna rambut adalah sebagai berikut:
Pb(CH3COO)2 + 2PbO + 2H2O Pb(CH3COO)2.2Pb(OH)2
(4)
Timbal (II) asetat menembus plasenta, mempengaruhi embrio, bersifat teratogenik dan dapat menyebabkan kematian yang fatal (Anonim, 2008d).
D. Penanganan Keracunan Timbal
Menurut Donatus (1997), penanganan keracunan bahan berbahaya meliputi terapi suportif, penyidikan jenis racun penyebab dan terapi antidot.
1. Terapi suportif
Merupakan tindakan pertolongan pertama, untuk memperbaiki kondis i dan menyelamatkan jiwa penderita. Tindakan ini mempelihara fungsi vital (pernafasan dan peredaran darah) sehingga penderita selamat serta lebih mudah dan kooperatif menjalani terapi antidot berikutnya. Terapi suportif harus dilakukan dengan segera. Tindakan terapi suportif meliputi :
b. Periksa tanda vital dan bersihkan jalan nafas. Bila penderita memakai gigi palsu, harus dilepas.
c. Periksa pulsus dan pupil.
d. Berikan pernafasan buatan dan/ atau oksigen, bila perlu pijit luar jantung dan siapkan infus.
e. Bila penderita kejang diberi antikejang, bila tekanan darahnya turun atau dehidrasi diberi infus elektrolit (Donatus, 1997).
2. Penyidikan jenis racun penyebab
Penyidikan racun penyebab penting untuk menentukan pilihan tindakan terapi antidot. Tindakan ini dapat dilakukan dengan cara :
a. Wawancara dengan penderita atau pengantar
b. Pemeriksaan gejala-gejala keracunan yang ada secara sistematis
c. Pemeriksaan wadah dan sisa bahan penyebab yang dicurigai, muntahan, air kencing, atau darah penderita.
d. Pengiriman bahan pada butir c ke laboratorium (Donatus, 1997).
3. Terapi antidot
Terapi antidot adalah tata cara yang khusus ditujukan untuk membatasi intensitas (kekuatan) efek toksik zat kimia atau menyembuhkan efek toksik yang ditimbulkannya sehingga bermanfaat mencegah timbulnya bahaya lebih lanjut. Sasaran terapi antidot adalah pengurangan intensitas efek toksik (Donatus, 1997).
Strategi penatalaksanaan terapi antidot dapat dilakukan dengan cara : a. Penghambatan keefektifan absorpsi bahan berbaha ya
c. Peningkatan keefektifan metabolisme dan ekskresi (eliminasi) bahan berbahaya (Donatus, 1997).
Pengobatan keracunan timbal anorganik meliputi penghentian paparan dengan segera, terapi suportif, dan penggunaan terapi khelasi secara bijaksana (Katzung, 2004). Agen pengkhelat adalah suatu molekul dengan 2 atau lebih gugus elektronegatif yang dapat membentuk kompleks koordinasi yang stabil dengan kation atom logam multivalen (Trevor, Katzung, Masters, 2002) sehingga menjadi bentuk yang mudah diekskresikan. Agen khelasi digunakan untuk mencegah atau membalik efek toksik logam berat pada enzim atau sasaran seluler lainnya atau untuk mempercepat eliminasinya dari tubuh (Katzung, 2004). Terapi khelasi dapat menggunakan succimer atau kalsium disodium edetat, dengan atau tanpa dimerkaprol.
Khelator diindikasikan untuk dewasa dengan gejala keracunan atau kadar timbal darah >70 mg/dL, serta anak dengan ensefalopati atau kadar timbal darah >45 mg/dL (>2,17 mmol/L) (Ano nim, 2005a).
E.Kalsium Disodium Edetat (Na2CaEDTA)
Na2CaEDTA merupakan garam kompleks kalsium-dinatrium etilen
diamintetraasetat, terutama digunakan untuk terapi keracunan timbal.
1. Farmakokinetika Na2CaEDTA
Absorpsi Na2CaEDTA buruk pada saluran gastrointestinal. Absorpsinya
yang buruk setelah pemberian secara oral karena terjadi peruraian khelat kalsium pada pH lambung yang rendah (Dollery, 1999). Seluruh Na2CaEDTA ditemukan
dalam plasma darah. Na2CaEDTA tidak memenetrasi sel dan terdistribusi
terutama dalam cairan ekstraseluler. Hanya sekitar 5% konsentrasi plasma yang ditemukan dalam cairan spinal (Anonim, 2004b).
Na2CaEDTA tidak dimetabolisme dan akan diekskresi dalam bentuk utuh
dalam urin. Waktu paruh Na2CaEDTA adalah 20-60 menit. Sekitar 50%
terekskresi dalam waktu 1 jam dan lebih dari 95% akan terekskresi dalam 24 jam (Anonim, 2008e).
2. Indikasi
Na2CaEDTA digunakan untuk menurunkan konsentrasi timbal dalam
darah dan meningkatkan ekskresi timbal dalam urin pada individu yang menunjukkan gejala keracunan timbal dan pasien asimptomatik dengan kadar timbal darah yang tinggi (Olson, 2006).
3. Dosis dan cara pemberian
Na2CaEDTA 1500 mg/m2/hari (30 mg/kg/hari) i.v. atau i.m. diberikan
melalui infus kontinu atau dengan dosis terbagi 2 atau 3 selama 5 hari (Katzung, 2004). Dosis Na2CaEDTA yang direkomendasikan pada dewasa dan pediatrik
Na2CaEDTA sama efektifnya jika diberikan secara intravena atau
intramuskular. Pemberian intramuskular digunakan pada pasien keracunan timbal dengan ensefalopati dan untuk pasien pediatrik. Lidokain atau prokain sebaiknya ditambahkan pada injeksi Na2CaEDTA untuk meminimalkan sakit pada tempat
injeksi (Anonim, 2008e).
Oral terapi Na2CaEDTA tidak direkomendasikan untuk preventif atau
pengobatan keracunan timbal karena akan meningkatkan absorpsi timbal dari saluran gastrointestinal (Olson, 2006) dan sifatnya yang memiliki ion polar tinggi sehingga membatasi penyerapannya (Katzung, 2004).
4. Efek samping
a. Sistem saraf pusat: demam, tremor, sakit kepala, malaise, lemas. b. Sistem kardiovaskular: hipotensi, denyut jantung tidak beraturan. c. Gastrointestinal: mual, muntah, anoreksia, haus.
d. Saluran kemih: proteinuria, hematuria, nefrotoksisitas dengan nekrosis tubular ginjal yang dapat menyebabkan nefrosis fatal.
e. Hematologi: supresi sumsum tulang sementara, anemia.
f. Metabolisme: defisiensi seng, hiperkalsemia (Anonim, 2005b). g. Sistem imun: reaksi histamine-like (bersin, hidung tersumbat), ruam.
h. Hepatik: peningkatan SGOT dan SGPT yang akan kembai normal dalam 48 jam setelah penghentian terapi (Anonim, 2008e).
5. Mekanisme aksi Na2CaEDTA
Na2CaEDTA berikatan dengan ion logam polivalen pada pH cairan
(Dollery, 1999). Kalsium pada Na2CaEDTA digantikan oleh timbal dan
membentuk molekul yang lebih stabil, kurang toksik sehingga mudah melalui ginjal (Mutschler, 1991). Khelat yang terbentuk diekskresikan melalui ginjal dan timbal dapat dihilangkan dari plasma, saluran gastrointestinal, jaringan lunak, dan lapisan tulang (Dollery, 1999). Obat ini diberikan sebagai suatu garam kalsium dinatrium untuk mencegah kekurangan kalsium yang secara potensial membahayakan jiwa (Katzung, 2004).
Sumber utama timbal yang akan dikhelat oleh Na2CaEDTA berasal dari
tulang. Timbal pada jaringan lunak akan terdistrib usi kembali ke tulang jika terapi khelasi dihentikan (Anonim, 2008e).
F. Ekstrak
Ekstrak merupakan sediaan pekat yang diperoleh dengan cara mengekstraksi zat aktif simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau ha mpir semua pelarut diuapkan dan massa (serbuk) yang tersisa diperlakukan sehingga memenuhi baku yang ditetapkan (Anonim, 1995b). Cairan penyari yang biasa digunakan adalah air, etanol, campuran etanol dan air atau eter. Penyari untuk obat tradisional masih terbatas menggunakan air dan etanol (Anonim, 1986).
dan panas yang diperlukan untuk pemekatan lebih sedikit. Kelemahan penggunaan etanol sebagai penyari adalah harga yang mahal (Anonim, 1986).
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar) (Anonim, 2000b). Maserasi merupakan cara penyarian dengan merendam serbuk dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena perbedaan konsentrasi larutan zat aktif di dalam dan di luar sel maka larutan terpekat terdesak keluar. Maserasi digunakan untuk penyarian yang zat aktifnya mudah larut dalam cairan penyari dan simplisia yang zat aktifnya akan rusak pada suhu tinggi karena metode ini tidak menggunakan pemanasan. Cairan penyari dapat berupa air, etanol, campuran air dan etanol, atau pelarut lain (Anonim, 1986).
Keuntungan metode maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana serta mudah dilakukan. Pengerjaannya lama dan penyarian yang kurang sempurna menjadi kelemahan metode ini (Anonim, 1986).
G.Spektroskopi Serapan Atom (SSA)
1. Prinsip metode spektroskopi serapan atom
Dengan penyerapan energi, energi yang diperoleh lebih banyak, sehingga suatu atom pada keadaan dasar akan dinaikkan tingkat energinya ke tingkat eksitasi. SSA memiliki sensitifitas tinggi dalam menganalisis unsur, terutama logam, termasuk timbal.
Setiap radiasi yang mengenai bahan mempunyai intensitas tertentu, setelah melewati bahan, intensitas radiasi tersebut berkurang. Pengurangan ini karena sebagian dari radiasi tersebut diserap dan dipantulkan, dan dituliskan:
I I I
Io = a + t + r (5)
Io adalah intensitas radiasi sebelum melewati bahan (W/m2), It adalah
intensitas radiasi sesudah melewati bahan (W/m2), Ia adalah intensitas radiasi yang
diserap bahan (W/m2), dan Ir adalah intensitas radiasi yang dipantulkan bahan
(W/m2). Radiasi yang dipantulkan sangat kecil sehingga persamaannya menjadi:
I I
Io = t + a (6)
Besarnya faktor transmisi adalah kemampuan bahan untuk meneruskan sebagian radiasi yang mengenainya, mengikuti persamaan:
Io It
T= (7)
T merupakan faktor transmisi, sehingga besarnya serapan (A) adalah
Beberapa panjang gelombang unsur akan menghasilkan garis spektrum. Panjang gelombang yang menghasilkan garis spektrum tajam dengan intensitas maksimum dapat dipilih dan disebut garis resonansi. Panjang gelombang yang dipilih untuk menganalisis timbal adalah 283 nm (Khopkar, 1990).
Temperatur mempengaruhi proses atomisasi. Temperatur nyala harus sesuai dengan energi yang dibutuhkan untuk melepas atom dari ikatannya sehingga akan diperoleh atom-atom bebas pada keadaan ground state. Besar pengaruh temperatur terhadap perbandingan jumlah atom pada keadaan eksitasi dan jumlah atom pada keadaan ground state dinyatakan dengan persamaan Boltzman (11).
Nj dan No masing- masing adalah jumlah atom pada keadaan eksitasi dan jumlah
atom pada keadaan ground state. K adalah tetapan Boltzman (1,38 x 10-16 erg/K). T adalah temperatur absolut (Kelvin). Ej adalah perbedaan energi tingkat eksitasi
dan tingkat ground state. Pj dan Po adalah faktor statistik yang ditentukan oleh
banyaknya tingkat yang mempunyai energi setara pada masing- masing tingkat kuantum. Keberhasilan analisis pada SSA tergantung pada proses atomisasi dan serapan oleh atom-atom bebas yang netral (Khopkar, 1990).
2. Instrumentasi spektrometer serapan atom
Gam bar 1 0 . I nst rum ent asi spek t rom et er serapan at om ( Anonim , 2 0 0 6 b) .
Atomisasi adalah proses yang mengubah unsur yang akan dianalisis menjadi uap atom (Price, 1972). Atomisasi dapat dilakukan dengan nyala maupun dengan tungku. Untuk mengubah unsur metalik menjadi uap atau hasil disosiasi diperlukan energi panas. Temperatur pada nyala harus benar-benar sesuai dengan energi yang dibutuhkan untuk melepas atom dari ikatannya sehingga diperoleh atom-atom bebas pada keadaan ground state (Price, 1972).
Ga m ba r 1 1 . Prinsip m et ode spek t rosk opi sera pa n a t om da n inst rum ent a sinya ( Anonim , 2 0 0 6 c)
Atomisasi (gambar 12) dilakukan dengan bantuan gas pembakar. Gas
pembakar terdiri dari propana, asetilena dan hidrogen. Oksidan adalah zat yang digunakan untuk mengoksidasi bahan bakar dalam nyala (Price, 1972). Broekaert (2002) menyebutkan bahwa oksidan terdiri dari N2O atau udara. Campuran udara
Gam bar 1 2 . Sk em a proses at om isasi sam pel. M : logam (m e t a l) ; M * : at om yang t erek sit asi.
Pada SSA yang diuk ur adalah M ’ yait u at om dalam k eadaan ground st at e
( Basset t , Denney, Jeffery, M endham , 1 9 9 4 )
Zona nyala pada SSA yaitu primary combustion zone, interzonal region dan secondary combustion zone (gambar 13). Penyerapan paling baik terjadi pada interzonal region. Pada zona ini, atom dalam keadaan gas segera menyerap energi radiasi yang diemisikan oleh lampu katoda berongga (Skoog, West, Holler, 1994).
Ga m ba r 1 3 . Pe m ba gia n zona nya la pa da pe m ba k a r pa da spek t rom et er sera pa n a t om ( Sk oog, W est , H oller, 1 9 9 4 )
Gam bar 1 4 . Lam pu k at oda be rongga (hollow ca t hode la m p)
pa da SSA da n ba gia n- bagiannya ( Levinson,2 0 0 6 )
Interferensi dalam metode spektroskopi serapan atom meliputi interferensi kimia dan fisika. Interferensi kimia meliputi pembentukan komponen yang stabil dari unsur-unsur yang akan dianalisis. Gangguan ini mengakibatkan depressive effect (penurunan nilai serapan). Interferensi fisika meliputi volatilisasi yang tidak sempurna dari sampel yang juga menyebabkan penurunan nilai serapan karena jumlah atom pada keadaan ground state sedikit (Price, 1972).
3. Keunggulan dan kelemahan metode spektroskopi serapan atom
Keunggulan menggunakan metode SSA untuk analisis adalah tidak perlu adanya pemisahan dari sampel. Unsur yang terdapat dalam sampel dapat dianalisis tanpa memisahkan unsur lain, karena digunakan sumber radiasi khusus yang sesuai dengan unsur analit. Metode ini kurang sensitif untuk analisis sampel bukan logam, sehingga menjadi kelemahannya (Mulja dan Suharman, 1995).
4. Preparasi sampel organik
Preparasi sampel dapat dilakukan dengan me nggunakan reagen solid atau cair pada temperatur tinggi yang menyebabkan reaksi kimia atau melelehnya campuran (Broekaert, 2002). Salah satunya adalah dengan menggunakan metode kimia basah (wet chemical method), yaitu dengan penambahan asam misalnya HCl, HNO3, atau HClO4. Pereaksi asam tersebut akan menghasilkan garam yang
pada penambahan asam dan temperatur maksimal, sesuai titik didih asam yang digunakan.
Penambahan pereaksi HNO3 p dan HClO4 pada sampel darah
menghasilkan garam Pb2+ yang mudah larut dan lepas dari ikatannya dengan protein darah dan menghasilkan gas NO yang berwarna kuning. Reaksinya adalah sebagai berikut:
3 Pb + 8 HNO3 3 Pb2++ 6 NO3 + 2 NO + 4 H2O
(12)
(Vogel, 1979) HNO3 pekat akan melarutkan timbal menjadi timbal nitrat yang dapat
larut. Kekuatan oksidasinya meningkat dengan penambahan perklorat dan peningkatan suhu serta tekanan saat proses digesti.
HClO4 pekat (60-72%) akan menguraikan senyawa organik dalam suhu
tinggi (Walter, Chalk, Kings ton, 1998). Campuran HClO4 dan HNO3 digunakan
untuk mengontrol proses digesti senyawa organik karena reaktivitas HClO4 yang
besar (dapat meledak). Jika dicampur dengan HClO4, HNO3 akan melarutkan
timbal. Jika temperaturnya dinaikkan, HClO4 akan menyempurnakan penguraian
protein yang tidak dapat terurai oleh HNO3.
H. Validasi Metode
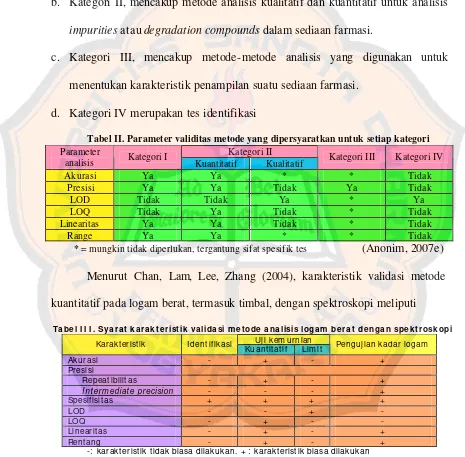
2004). Parameter–parameter validitas metode analisis meliputi akurasi, presisi, linieritas, rentang, spesifisitas, LOD, dan LOQ (Anonim, 2007e).
1. Akurasi
Akurasi merupakan ketelitian metode analisis atau kedekatan nilai yang diukur dengan dengan nilai yang diterima dan ditunjukkan dengan perolehan kembali (recovery). Kriteria perolehan kembali cukup fleksibel, semakin komplek dan semakin sulit metode analisis yang digunakan maka perolehan kembali diperbolehkan semakin rendah atau kisarannya semakin lebar (Rohman, 2007). Akurasi dari suatu metode analisis sebaiknya disajikan dalam rentang. Akurasi dihitung sebagai presentase recovery pengujian sejumlah analit yang diketahui jumlahnya atau sebagai perbedaan antara rata–rata dan nilai sebenarnya yang bisa diterima, bersama dengan taraf kepercayaan (Anonim, 2007e).
2. Presisi
Kriteria seksama diberikan jika metode memberikan simpangan baku relatif atau koefisien variasi 2% atau kurang, tapi sangat fleksibel tergantung kondisi analit yang diperiksa, jumlah sampel dan kondisi laboratorium. Menurut Harmita (2004), koefisien variasi (KV) yang dapat diterima terdapat pada tabel I.
Tabel I. Kriteria koefisien variasi (KV) laboratorium yang dapat diterima
Kadar analit KV ( % )
= 1% 2,5
0,1% 5
1 ppm 16
1ppb 32
3. Linearitas dan rentang
Linearitas merupakan kemampuan untuk mendapatkan hasil uji yang proporsional dengan konsentasi analit (Rohman, 2007). Persyaratan data linearitas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) >0,99 (Christian, 2004). Rentang adalah jarak terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linearitas dan akurasi yang bisa diterima (Anonim, 2007e). Rentang yang digunakan biasanya 20%-175% terhadap kadar analit dalam sampel.
4. Spesifisitas
Spesifisitas didefinisikan sebagai kemampuan untuk mengukur dengan baik komponen lain dalam analit yang mungkin ada seperti pengotor, produk degradasi, dan komponen matriks (Anonim, 2007e).
5. Limit of detection (LOD) dan limit of quantitation (LOQ)
dapat diterima pada kondisi operasional metode yang digunakan (Rohman, 2007). Anonim (2007e) menggolongkan validasi metode analisis menjadi 4 kategori: a. Kategori I, mencakup metode- metode analisis kuantitatif, untuk menetapkan
komponen-komponen utama bahan obat atau zat aktif dalam sediaan farmasi. b. Kategori II, mencakup metode analisis kualitatif dan kuantitatif untuk analisis
impurities atau degradation compounds dalam sediaan farmasi.
c. Kategori III, mencakup metode- metode analisis yang digunakan untuk menentukan karakteristik penampilan suatu sediaan farmasi.
d. Kategori IV merupakan tes identifikasi
Tabel II. Parameter validitas metode yang dipersyaratkan untuk setiap kategori Kategori II
Parameter
analisis Kategori I Kuantitatif Kualitatif Kategori III Kategori IV
Akurasi Ya Ya * * Tidak
Presisi Ya Ya Tidak Ya Tidak
LOD Tidak Tidak Ya * Ya
LOQ Tidak Ya Tidak * Tidak
Linearitas Ya Ya Tidak * Tidak
Range Ya Ya * * Tidak
* = mungkin tidak diperlukan, tergantung sifat spesifik tes (Anonim, 2007e)
Menurut Chan, Lam, Lee, Zhang (2004), karakteristik validasi metode kuantitatif pada logam berat, termasuk timbal, dengan spektroskopi meliputi
Ta bel I I I . Sya ra t k a ra k t erist ik va lida si m et ode a na lisis loga m bera t denga n spek t rosk opi Uj i kem urnian
Karakteristik I dent ifikasi
Kuant it at if Lim it Penguj ian kadar logam
I. Landasan Teori
Penggunaan tanaman sebagai pengobatan alternatif banyak dip ilih karena biaya yang relatif murah, penggunaannya mudah dan sederhana serta efek samping yang ditimbulkan relatif kecil. Bawang putih (Allium sativum L.) telah diteliti dan diketahui dapat mendetoksifikasi logam berat.
Na2CaEDTA biasa digunakan untuk terapi penawarracunan timbal.
Kalsium pada Na2CaEDTA akan berikatan dengan timbal menghasilkan khelat
yang kurang toksik dan lebih polar sehingga lebih mudah diekskresikan. Bawang putih mempunyai aktivitas terapetik potensial untuk mengatasi keracunan timbal. Senyawa pada bawang putih yang diduga dapat mengurangi kadar timbal adalah selenium. Selenium merupakan prekursor enzim antioksidan yaitu glutation peroksidase yang akan menguraikan radikal bebas yang dihasilkan oleh timbal.
Pemejanan timbal asetat sela ma 30 hari, sedangkan Na2CaEDTA yang
dilanjutkan dengan ekstrak etanol umbi bawang putih diberikan selama 10 hari setelah pemejanan timbal. Keefektifan kedua bahan tersebut diketahui dengan mengukur kadar timbal darah tikus dengan spektrometer serapan atom.
J. Hipotesis
Ekstrak etanol umbi bawang putih setelah pemberian Na2CaEDTA
32
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam jenis penelitian eksperimental murni dengan rancangan acak pola satu arah.
B. Variabel dan Definisi Operasional
1. Variabel penelitian
a. Variabel utama
1) Variabel bebas dalam penelitian ini ialah a) Dosis Na2CaEDTA 189 mg/kg BB tikus.
b) Dosis ekstrak etanol umbi bawang putih 200 mg/kg BB tikus.
2) Variabel tergantung dalam penelitian ini ialah kadar timbal darah tikus yang diukur setelah pemejanan timbal serta pemberian Na2CaEDTA dan
ekstrak etanol umbi bawang putih. b. Variabel pengacau
1) Variabel pengacau terkendali dalam penelitian ini adalah
a) Hewan uji yaitu menggunakan tikus putih betina sehat galur Wistar, usia 6 minggu, bobot 100-150 gram.
pertimbangan organ-organnya sudah berfungsi sempurna sehingga absorpsi timbal dapat dikendalikan. Kondisi fisiologis hewan uji yaitu bobot 100-150 gram dikendalikan.
b) Bobot dan jenis pakan yaitu pelet tipe BR2 10 g/hari/ekor supaya kadar timbal yang diabsorpsi hewan uji seragam dan tidak dikacaukan oleh faktor nutrisi.
c) Air minum yaitu menggunakan aquadest yang diganti baru setiap hari sehingga timbal yang berasal dari air minum dan terabsorpsi hewan uji jumlahnya sama.
2) Variabel pengacau tak terkendali dalam penelitian ini adalah a) Perbedaan fungsi organ tiap hewan uji
b) Profil farmakokinetika timbal yang berbeda pada hewan uji
2. Definisi operasional
a. Senyawa toksik yang digunakan adalah timbal asetat dosis 0,5 g/kg BB yang diberikan selama 30 hari.
b. Ekstrak etanol adalah ekstrak etanol umbi bawang putih (Allium sativum L.) hasil ekstraksi dengan metode maserasi menggunakan etanol 45%.
c. Uji daya antidot adalah uji potensi penawarracunan menggunakan antiracun Na2CaEDTA dosis 189 mg/kg BB, setelah 2 jam dilanjutkan dengan ekstrak
etanol umbi bawang putih 200 mg/kg BB untuk menurunkan kadar timbal darah setelah pemberian timbal asetat selama 30 hari.
C. Bahan atau Materi Penelitian
Bahan yang digunakan dalam penelitian ini adalah serbuk umbi bawang putih (Merapi Farma), tikus betina (Laboratorium Farmakologi dan Toksikologi Universitas Sanata Dharma), timbal asetat (Merck), aquadest, etanol 45% (teknis), Na2CaEDTA (Merck), natrium klorida (teknis), asam nitrat 65% (pro analisis,
Merck), asam perklorat 37% (pro analisis, Merck), larutan standar timbal 1000 ppm (Merck), kertas alumunium, kertas saring.
D. Alat atau Instrumen Penelitian
Alat yang digunakan adalah spektrometer serapan atom (Hitachi Z-8000 Polarized Zeeman), timbangan analitik (Mettler Toledo PL303, AB204, GB 3002), heater (Barnstead Thermolyne Cimarec®), hot plate (Heidolph MR2002), alat maserasi (Innova 2100 Plateform Shaker), oven (Memmert), alat-alat gelas (Pyrex), pipet mikro 200-1000µl (GILSON Z 64581D), yellowtip, pipa kapiler tanpa heparin, eppendorf, spuit injeksi oral dan intramuskular.
E. Tata Cara Penelitian
1. Determinasi tanaman
2. Preparasi bahan
a. Pengumpulan, pengeringan dan penyerbukan umbi bawang putih
Pengumpulan, pengeringan dan pembuatan serbuk umbi bawang putih dilakukan oleh petugas di Merapi Farma Kaliurang. Umbi bawang putih berasal dari daerah Brebes, Jawa Tengah yang dipanen pada bulan November 2007 dengan usia panen 6-7 bulan.
Serbuk bawang putih disimpan pada suhu kamar (25ºC) untuk mencegah tumbuhnya kapang dan jamur, kontaminasi mikroba dan rusaknya za t aktif. Alliiin (S-2-propenil- L-sistein sulfoksida) akan terurai menghasilkan allicin oleh enzim allinase. Allicin akan mengalami reaksi enzimatis menghasilkan minyak yang mengandung sulfur (dialil disulfida) dan alil alkohol.
NH2
2-Propenyl prope nethiosu lfinate [= Allic in] S-(2-Propen yl)-L-cystei ne sulfoxide
[= Alliin]
2-Propenyl pr ope nethiosu lfinate [= Alli cin]
Ga m ba r 1 5 . Rea k si enzim a t is perura ia n a lliin m enj a di a llicin ( Schm idt ,2 0 0 6 )
b. Pembuatan ekstrak etanol umbi bawang putih
Umbi bawang putih dibuat dalam bentuk sediaan ekstrak dengan metode maserasi. Ekstrak etanol 20% b/v dibuat dengan memasukkan 20 gram serbuk
penyari sehingga cairan penyari akan membasahi serbuk secara merata. Penggojogan diperlukan untuk meratakan konsentrasi larutan di luar butir serbuk simplisia sehingga derajat perbedaan konsentrasi yang sebesar-besarnya antara larutan di dalam sel dan larutan di luar sel tetap terjaga.
Setelah 5 hari, sari diserkai, ampas diperas untuk memisahkan sari dengan ampas dan zat lain yang tidak diinginkan. Ampas ditambah cairan penyari secukupnya, diaduk dan diserkai, sehingga diperoleh seluruh sari sebanyak 100 ml. Bejana ditutup, dibiarkan ditempat sejuk, terlindung dari cahaya, selama 2 hari. Tujuannya untuk mengendapkan zat-zat yang tidak diperlukan tetapi ikut larut dalam cairan penyari. Proses ini dilakukan dalam wadah yang tertutup untuk menghindari tumbuhnya bakteri dan jamur pada ekstrak. Pemekatan dilakukan dengan cara penguapan pada suhu 50°C hingga diperoleh ekstrak kental (Anonim, 1986). Tujuan pemekatan ekstrak adalah untuk menghilangkan cairan penyari serta mencegah tumbuhnya kapang, jamur dan bakteri pada ekstrak.
c. Pembuatan larutan timbal asetat
Serbuk timbal asetat (Pb(CH3COO)2.3H2O) ditimbang lebih kurang 4,0
gram kemudian ditambah dengan aquadest mendidih (100ºC) hingga volumenya 100,0 ml (Anonim, 1995b). Larutan yang diperoleh adalah larutan timbal asetat dengan konsentrasi 0,04 mg/L.
d. Pembuatan larutan natrium kalsiumedetat
Na2CaEDTA ditimbang lebih kurang 7,56 gram kemudian dilarutkan
2003) hingga 500 ml. Larutan yang diperoleh adalah larutan Na2CaEDTA
dengan konsentrasi 0,01512 mg/L. Larutan saline digunakan sebagai pelarut karena sifatnya yang mirip dengan cairan fisiologis tubuh manusia.
e. Pembuatan larutan ekstrak etanol umbi bawang putih
Ekstrak etanol umbi bawang putih ditimbang lebih kurang 0,8 g kemudian ditambah dengan aquadest hingga volumenya 50 ml. Larutan yang diperoleh adalah larutan ekstrak etanol umbi bawang putih dengan konsentrasi 0,016 mg/L.
3. Preparasi dan perlakuan hewan uji
a. Preparasi hewan uji.
Hewan uji yang digunakan dibagi menjadi 4 kelompok, masing- masing berjumlah 7 ekor. Sebelum diberi perlakuan, hewan uji diberi larutan timbal asetat 0,5 g/kgBB oral selama 30 hari dan disebut kondisi praperlakuan. Kelompok hewan uji dinyatakan sebagai berikut:
Kelompok I = kontrol negatif aquadest 0,5 g/kgBB. Kelompok II = kontrol posit if timbal 0,5 g/kgBB.
Kelompok III = kontrol Na2CaEDTA 189 mg/kgBB selama 10 hari setelah
kondisi praperlakuan.
Kelompok IV = perlakuan Na2CaEDTA 189 mg/kgBB, dilanjutkan dengan
b. Perlakuan hewan uji.
Pada kondisi praperlakuan, larutan timbal asetat 0,5 g/kgBB dipejankan secara oral (Hariono, 2005) selama 30 hari dengan menganalogikan pejanan timbal yang kronis dan akumulatif pada manusia, sedangkan kontrol negatif diberi aquadest 0,5 g/kgBB. Setelah pemejanan timbal asetat selama 30 hari, kadar timbal dalam darah mencapai lebih dari 0,7 ppm (Wahyunengsih et al, 2007, Hariono, 2005) dan membutuhkan terapi khelasi (Anonim, 2005a). Na2CaEDTA 189 mg/kgBB diberikan secara
intramuskular selama 10 hari setelah kondisi praperlakuan yang merupakan hasil konversi dari dosis manusia 30 mg/kg BB/hari (lampiran 12). Ekstrak etanol umbi bawang putih 200 mg/kgBB (Senapati, 2001) diberikan 2 jam setelah pemejanan Na2CaEDTA secara oral.
4. Preparasi sampel
Darah tikus diambil dari sinus orbitalis mata, ditampung dalam eppendrof. Sampel yang diperoleh ditimbang dan beratnya harus lebih dari 0,5 gram karena kadar timbal dalam darah sangat kecil sehingga diperlukan berat sampel yang cukup banyak untuk dapat terukur. Sampel kemudian didestruksi berdasarkan metode kimia basah (wet chemical method) dengan menambahkan HNO3 p sebanyak 10 ml dan HClO4 0,5 ml. Sampel dipanaskan dengan suhu
menghilangkan endapan yang terbentuk selama proses destruksi terjadi. Selain itu, larutan sampel harus dalam keadaan jernih sebab kejernihan menjadi tanda bahwa seluruh material organik sudah terdestruksi. Filtrat kemudian diencerkan dengan aquadest dan volumenya ditepatkan menjadi 10 ml supaya nilai serapannya dapat terbaca oleh spektrometer serapan atom pada panjang gelombang 283,3 nm dan nilai serapan sampel tersebut berada pada rentang serapan seri larutan baku. Pengukuran dilakukan pada hari ke-0, 15, 30, 35, dan 40 untuk mengetahui profil farmakokinetika timbal dalam darah sebelum dan setelah pemberian Na2CaEDTA
dan ekstrak etanol umbi bawang putih.
5. Pengaturan spektrometer serapan atom
Spektrometer serapan atom untuk pengukuran kadar timbal diatur sebagai berikut:
Sumber cahaya : hollow cathode lamp (timbal) Arus lampu : 7,5 mA
Panjang gelombang : 283,3 nm
Oksidan : udara (9,5 liter/menit) Bahan bakar : asetilena (2,3 liter/menit) Tinggi tempat serap : 7,5 mm
6. Pembuatan kurva baku
a. Pembuatan larutan baku timbal
larutan baku dengan konsentrasi 0,5 ppm, 1 ppm, 2 ppm, 4 ppm, 6 ppm, dan 8 ppm. Kurva baku mengandung timbal yang merupakan logam berat dan diukur menggunakan spektrometer serapan atom.
b. Pengukuran kurva baku timbal
Kurva baku dibuat dengan mengukur nilai serapan seri kadar larutan baku timbal pada panjang gelombang 283,3 nm menggunakan spektrometer serapan atom (Subramanian and Meranger, 1981).
7. Penentuan kadar timbal dalam darah sampel
Nilai serapan dan rata-rata konsentrasi yang diperoleh (ppm) dihitung dengan rumus (13) sehingga diperoleh kadar timbal dalam sampel.
(
)(
)
F. Analisis Hasil
Data perlakuan yang diperoleh dibandingkan dengan data kontrol. Pada kondisi praperlakuan, kadar timbal dibandingkan dengan kontrol negatif dan positif untuk mengetahui kadar di dalam darah sebelum diberi perlakuan. Setelah diberi perlakuan, kadar timbal darah perlakuan dibandingkan dengan kontrol Na2CaEDTA. Untuk kepentingan statistik, maka hipotesis nul (H0) dirumuskan
tidak terdapat perbedaan bermakna kadar timbal antara kontrol Na2CaEDTA
42
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman dilakukan untuk memastikan kebenaran tanaman yang digunakan dalam penelitian. Tanaman yang digunakan dalam penelitian ini telah dideterminasi oleh determinator di Laboratorium Farmakognosi Fitokimia, Fakultas Farmasi, Universitas Sanata Dhama, Yogyakarta menggunakan acuan baku (Anonim, 1995a) (lampiran 1).
B. Pengukuran Kadar Timbal Darah
Cara kerja spektrometer serapan atom berdasarkan penguapan larutan sampel dan mengubah logam yang terkandung di dalamnya menjadi atom bebas yang akan menyerap radiasi dari sumber cahaya yang dipancarkan oleh lampu katoda. Spektrometer serapan atom untuk pengukuran kadar timbal menggunakan hollow cathode lamp khusus timbal dengan udara dan asetilen sebagai oksidan dan bahan bakarnya.
1. Kurva baku timbal
mana timbal akan menyerap cahaya yang dipancarkan oleh lampu katoda berongga.
Larutan baku selalu dibuat baru sebab senya wa timbal di dalam larutan kurang stabil sehingga akan mempengaruhi hasil pengukuran. Kurva baku pengukuran kadar timbal darah dengan menggunakan spektrometer serapan atom untuk tiap hari pengukuran seperti berikut:
Ku r va Ba k u Tim ba l H a r i k e - 3 0
Kurva Baku Timbal Hari ke-40
Penelitian ini tidak melakukan validasi metode analisis tapi hanya optimasi pada spektrometer serapan atom yang digunakan (lampiran 2). Kesahihan data berdasarkan linearitas kurva baku yang diperoleh dan nilai koefisien variasi (KV) perlakuan terhadap kontrol. Kurva baku dibuat untuk mengetahui linearitas data yang diukur, dilihat dari nilai koefisien korelasinya (r). Nilai koefisien korelasi yang mendekati 1 menunjukkan data proporsional dengan konsentrasi analit dalam sampel dan menunjukkan bahwa ada hubungan yang kuat antara besarnya kadar dengan besarnya nilai serapan.
Linearitas kurva baku >0,99 menunjukkan linearitas antara absorbasi dan kadar yang diperoleh bagus (Christian, 2004; Skoog, West, Holler, 1994). Linearitas kurva baku yang didapat telah memenuhi syarat yaitu >0,99 (tabel IV).
Tabel I V. N ilai linearit as k urva bak u t im bal hasil penguk uran dengan m et ode
Nilai KV perlakuan menunjukkan perbedaan dibandingkan nilai KV kontrol (tabel V). Hal tersebut karena dipengaruhi kondisi farmakokinetika timbal dalam tubuh dan fungsi masing- masing organ tubuh hewan uji yang tidak dapat dikendalikan. Adanya data outlayer (data yang tidak sesuai dengan modus) yang seharusnya direject juga mempengaruhi nilai KV sehingga nilai KV tidak sesuai dengan yang diharapkan.
Ta be l V. N ila i k oe fisie n va r ia si ( KV) k ont r ol da n pe r la k ua n Koefisien variasi ( KV)
2. Kadar timbal darah akibat penawarracunan menggunakan Na2CaEDTA
dan ekstrak etanol bawang putih
Berdasarkan nilai serapan sampel yang terbaca, akan diperoleh kadar timbal terukur. Kadar timbal darah sebenarnya dapat dihitung dengan rumus (13) dan ditunjukkan pada tabel berikut.
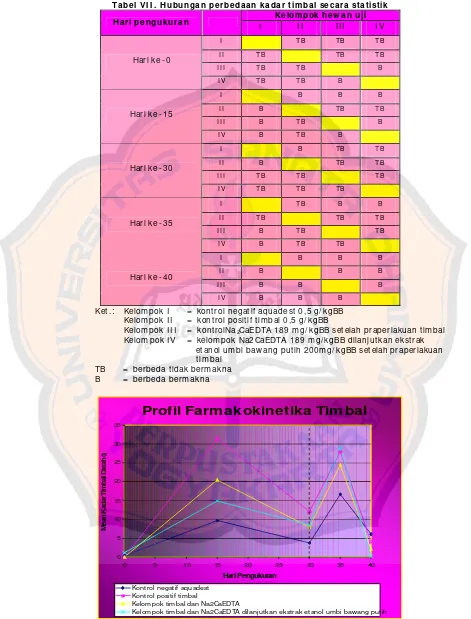
Tabel VI . N ilai rata - rat a k adar t im bal darah ( ppm ) hasil penguk uran denga n m et ode spek t rom et ri serapan at om dan perbedaan secara st at ist ik t erhadap k ont rol negat if
x± SD
Hasil tabel VI menunjukkan standar deviasi yang cukup besar, artinya terdapat perbedaan kadar timbal darah antarhewan uji dalam satu kelompok perlakuan. Adanya perbedaan tersebut dapat disebabkan profil farmakokinetika timbal yang berbeda pada masing- masing hewan uji.
Pada kondisi praperlakuan, kadar timbal darah kontrol Na2CaEDTA dan
perlakuan Na2CaEDTA yang dilanjutkan dengan ekstrak etanol umbi bawang
Pada pengukuran hari ke-15, kadar timbal hewan uji yang diberi timbal menunjukkan perbedaan bermakna jika dibandingkan dengan kontrol negatif, tetapi hasilnya berbeda tidak bermakna terhadap kontrol positif. Pemejanan timbal asetat selama 15 hari menyebabkan akumulasi timbal dalam darah sehingga kadarnya berbeda tidak bermakna pada hewan uji yang diberi timbal asetat.
Kadar timbal darah semua kelompok hewan uji mengalami penurunan setelah pemejanan timbal selama 30 hari. Jika dibandingkan dengan kontrol negatif dan kontrol positif, kadar timbal darah kontrol Na2CaEDTA dan perlakuan
Na2CaEDTA yang dilanjutkan dengan ekstrak etanol umbi bawang putih
menunjukkan perbedaan yang tidak bermakna.
Setelah kondisi praperlakuan dengan pemberian timbal asetat selama 30 hari, kadar timbal darah perlakuan Na2CaEDTA yang dilanjutkan dengan ekstrak
etanol umbi bawang putih dibandingkan dengan kontrol Na2CaEDTA. Kadar
timbal darah setelah pemberian Na2CaEDTA yang dilanjutkan dengan ekstrak
etanol umbi bawang putih selama 5 hari menunjukkan perbedaan yang tidak bermakna terhadap kontrol Na2CaEDTA.
Setelah pemberian Na2CaEDTA yang dilanjutkan dengan ekstrak etanol
umbi bawang putih selama 10 hari, kadar timbal perlakuan menunjukkan perbedaan bermakna terhadap kadar timbal kontrol Na2CaEDTA. Artinya
pemberian Na2CaEDTA yang dilanjutkan dengan ekstrak etanol umbi bawang
putih dapat lebih menurunkan kadar timbal darah dibandingkan pemberian tunggal Na2CaEDTA. Hubungan perbedaan kadar timbal secara statistik