SISTEM PERIODIK UNSUR
Standar Kompetensi1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Kompetensi Dasar
1.1. Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.
Anda akan melakukan kegiatan-kegiatan berikut.
Mengkaji literatur tentang perkembangan tabel periodik unsur dalam kerja kelompok.
Presentasi hasil kajian untuk menyimpulkan dasar pengelompokkan unsur-unsur.
Akhirnya Anda akan mampu :
Membandingkan perkembangan tabel periodik unsur untuk mengidentifikasi kelebihan dan kekurangannya.
Menjelaskan dasar pengelompokan unsur-unsur.
Ringkasan Materi
A. Perkembangan Sistem Periodik
1. Penggolongan berdasarkan sifat kelogaman
Unsur-unsur di alam digolongkan menjadi unsur logam dan unsur non logam.
2. Triade Dabereiner
Pada tahun 1817 Dabereiner menemukan adanya suatu keteraturan hubungan berat atom antara 3 buah unsur yang mempunyai sifat kimia mirip.
Bila ketiga unsur tersebut diurutkan menurut naiknya massa atom maka massa atom unsur ditengah sama dengan setengah dari jumlah massa atom dari dua atom yang dipinggir.
Contoh :
Contoh lain adalah unsur Cl, Br dan I. Coba Anda buktikan sendiri.
Diketahui masa atom Cl = 35,5; I = 126,9, maka tentukanlah massa atom Br.
Namun sifat triade ini hanya terbatas pada beberapa kelompok unsur saja
3. Hukum Oktaf Newland
Gas mulia tidak termasuk dalam pengelompokan unsur-unsur ini karena gas mulia saat itu belum ditemukan.
Pengelompokan unsur-unsur Hukum Oktaf :
Li Be B C N O F Na Mg Al Si P S Cl K Ca 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Berdasarkan pengelompokan di atas, dapat kita simpulkan bahwa yang merupakan unsur segolongan adalah :
- Li, Na, K - Be, Mg, Ca - B, Al
- C, Si, dan seterusnya.
4. Mendeleyev dan Lothar Meyer
Pada tahun 1869 Mendeleyef dan Lothar Meyer secara terpisah menyusun berdasarkan kenaikan massa atom dan kemiripan sifatnya. Dari data tersebut Mendeleyef mengemukakan : “Sifat unsur-unsur adalah merupakan fungsi periodik dari massa atomnya”.
Salah satu kehebatan sistem penyusunan ini adalah dari keperiodikan ini Mendeleyef telah dapat meramalkan sifat unsur-unsur yang pada saat itu belum diketahui orang. Beberapa tahun kemudian ternyata unsur-unsur tersebut diketemukan orang dan sifat-sifatnya yang sesuai dengan ramalan Mendeleyef.
5. Sistem Periodik Panjang/Modern
Walaupun sistem periodi Mendeleyef sudah baik, namun masih banyak kelemahan-kelemahannya. Pada tahun 1913 Hendry G.J. Moseley melihat hubungan antara nomor atom dan muatan inti. Kemudian Moseley mengubah susunan berkala yang tadinya berdasarkan pada massa atom diganti dengan nomor atom. Tabel dibuat dalam bentuk panjang yang disebut Periodik Panjang. Akibat pergantian ini ada beberapa unsur yang berubah letaknya.
Dalam sistem periodik, unsur-unsur dibagi atas periode-periode yang merupakan deret-deret horizontal dan golongan yang merupakan lajur-lajur vertikal.
a. Periode Sistem Periodik
Periode dalam sistem periodik menyatakan banyak kulit atom yang dimiliki oleh unsur yang bersangkutan.
Dalam sistem periodik modern, unsur-unsur terbagi atas 7 periode yang dibedakan lagi atas :
1. Periode pendek, yaitu perode 1, 2, dan 3. 2. Periode panjang, yaitu periode 4 dan 5. 3. periode sangat panjang, yaitu periode 6. 4. Periode belum lengkap, yaitu periode 7. b. Golongan Sistem Periodik
Golongan dalam sistem periodik menyatakan jumlah electron yang terdapat pada kulit terluar (elektron valensi). Unsur-unsur yang terletak pada satu golongan mempunyai sifat-sifat yang mirip.
Dalam sistem periodik modern unsur-unsur terbagi atas 18 golongan yang masing-masing golongan dibagi atas 8 golongan utama (A) dan 8 golongan transisi (B).
Penamaan khusus untuk beberapa golongan adalah sebagai berikut : 1. Golongan IA disebut golongan alkali, kecuali H.
2. Golongan IIA disebut golongan alkali tanah. 3. Golongan VIIA disebut golongan halogen. 4. Golongan VIIIA disebut golongan gas mulia.
5. Golongan IIIA sampai dengan golongan VIA diberi nama sesuai unsur yang ada pada golongan tersebut.
6. Golongan IB sampai dengan golongan VIIIB disebut golongan transisi.
Rangkuman
1. Perkembangan SPU yang kita pakai sekarang secara berurutan disusun berdasarkan sebagai berikut : - Sifat logam dan non logam
- Triade dar Dobereiner - Hukum Oktaf Newland - Sistem periodik Mendeleev - Sistem periodik modern
2. Sifat fisis dan kimia suatu unsur merupakan fungsi periodik
nomor atomnya.
2. Golongan adalah unsur-unsur yang berada pada lajur vertikal dan periode adalah unsur-unsur yang berada lajur horizontal.
TIPS
Teknik menghafal Sistem Periodik Unsur
Golongan IA : HerLiNa Kawin Roby Cs Frustasi
Golongan IIIA : Budi Alias Gali Indonesia Tulen
Golongan IVA : Cahyono Si Gendut Senang sePak bola Golongan VA : NaPAs Sebelum Binasa
Golongan VIA : Om Saya Senang Telo Pohung Golongan VIIA : Fuji Color Baru Itu Antik
Golongan VIIIA : He Nenek Arman Kurus Xena Radon
Cara di atas merupakan salah satu contoh menghapal unsur-unsur dalam Sistem Periodik Unsur, selebihnya dapat dikembangkan sesuai dengan lingkungan setempat.
Tugas Kelompok
Bentuklah kelompok dengan masing-masing kelompok terdiri dari 6 atau 7 siswa. Kemudian jawablah pertanyaan berikut dengan cara berdiskusi.
Kegiatan 1.1 Menemukan Triade Dobereiner
Perhatikan unsur-unsur berikut, unsur-unsur tersebut terletak dimana pada sistem periodik modern. Kemudian amati massa atomnya.
1. Tuliskan massa unsur pada setiap kolom pengolahan data berikut.
K = …………. P = ………….
Rb = …………. As = ………….
Cs = …………. Sb = ………….
2. Bandingkan massa unsur yang ditengah dengan jumlah massa unsur pertama dan ketiga.
3. Buatlah kesimpulan dari data di atas.
4. Jelaskan ketentuan yang ditemukan oleh Doberiener tersebut, yang dikenal dengan Triade Dobereiner.
Kegiatan 1.2. Mengamati keteraturan Hukum Oktaf.
Amati bagan berikut, lengkapi titik-titiknya dan jawab pertanyaannya.
Li Be B C N O F Na Mg Al Si P S Cl 1 … … … … … … … … … … … … …
Pertanyaan:
1. Beri nomor urut dari Li ke K pada deretan unsur-unsur tersebut.
2. Li nomor urut ke-1 mempunyai kesamaan sifat dengan unsur ... nomor urut ke ... dan unsur ... nomor urut ke ...
3.
Be nomor urut ke-2 mempunyai kesamaan sifat dengan unsur ... nomor urut ke ...4. Berdasarkan data tersebut, jelaskan keteraturan yang ditemukan J. Newlands yang dikenal dengan hukum oktaf.
Amati sistem periodik Mendeleef yang terdapat pada buku
reverensi lain. Kemudian jawablah pertanyaaan di bawah ini.
1. Berdasarkan apa Mendeleev mangurutkan unsur-unsur dalam sistem periodiknya?.
2. Mengapa pada sistem peeriodik Mendeleev ada beberapa
tempat kosong?.
Kegiatan 1.4. Mengamati sistem periodi modern.
Amati sistem periodik modern dan lengkapi tabel berikut.
No Pertanyaan Jawaban
1 Letak golongan Lajur………
…………
2 Letak periode Lajur………
………… 3 Jumlah golongan A ………
yakni……… …
4 Jumlah golongan B ………
yakni……… …
5 Jumlah periode ………
6 Jumlah unsur periode 1
………
7 Jumlah unsur periode
2 ………
8 Jumlah unsur periode
3 ………
9 Jumalh unsur periode 4
………
10 Jumlah unsur periode
5 ………
11 Jumlah unsur periode
6 ………
12 Jumlah unsur periode 7
………
13 Unsur no. 57-71 Golongan……… ………
14 Unsur no. 89-103 Golongan……… ………
Tugas Individu
Hapal unsur-unsur yang terdapat dalam golongan IA sampai dengan golongan VIIIA. Kemudian pada pertemuan selanjutnya guru akan menilai
hafalan Anda.
Soal-soal Latihan
Soal Essay
1. Apakah fungsi pengelompokan unsur-unsur ?
2. Apakah yang dimaksud dengan kelompok unsur Triade ? Jelaskan ! 3. Jelaskan mengapa Newland dianggap penemu keperiodikan unsur ? 4. Sebutkan keunggulan Mendeleev dalam menyusun sistem
periodiknya.
5. Apa yang dimaksud dengan periode dan golongan dari sistem periodik modern?
Soal Pilihan Ganda
Silanglah (X) huruf a, b, c, d, atau e di depan jawaban yang tepat! 1. Yang menemukan aturan Triade adalah…
a. Lothar Meyer d. Newland
b. Mendeleev e. J.J Thomson c. Doberiener
2. Susunan berkala unsur menurut Mendeleyev disusun berdasarkan… a. kenaikan massa atom
b. kenaikan nomor atom c. sifat fisik
d. sifat kimia e. sifat logam
3. Pernyataan yang salah mengenai sistem periodik bentuk panjang adalah…
a. periode 1 hanya berisi dua unsur
b. periode 2 dan periode 3 masing-masing berisi 8 unsur c. periode 4 berisi 18 unsur
d. periode 5 dan periode 6 masing-masing berisi 32 unsur e. periode 7 belum terisi penuh
4. Yang pertama kali menemukan adanya hubungan antara sifat-sifat kimia unsur dengan massa atomnya adalah…
a. Dalton b. Dobereiner c. John Newland d. Lothar Meyer e. Mendeleev
5. Dari pernyataan berikut :
1. Keyakinan akan ramalannya tentang unsur yang belum ditemukan
3. Dengan tegas memperbaiki massa atom yang dianggapnya tidak
tepat
4. Unsur-unsur disusun berdasarkan kenaikan nomor atomnya Yang merupakan keunggulan sistem periodic Mendeleev adalah… a. 1 dan 2 d. 2 dan 4
b. 1 dan 3 e. 3 dan 4 c. 2 dan 3
6. Unsur alkali pada sistem periodik unsur terletak pada golongan… a. IA d. VIA
b. IIA e. VIIA c. IIIA
7. Menurut IUPAC, dalam sistem periodik terdapat… a. 6 periode, 8 golongan
b. 6 periode, 8 golongan A, dan 8 golongan B c. 7 periode, 8 golongan A, dan 8 golongan B d. 7 periode, 16 golongan
e. 7 periode, 18 golongan
8. Unsur-unsur yang terdapat pada golongan VIIIA disebut golongan… a. alkali tanah d. halogen
b. alkali e. oksigen c. gas mulia
9. Penggolongan unsur berikut yang benar adalah… a. klor termasuk golongan gas mulia
b. barium termasuk golongan alkali c. kalium termasuk golongan alkali tanah d. helium termasuk golongan karbon e. neon termasuk golongan gas mulia
10. Dari pernyataan tentang golongan B :
1. Disebut golongan transisi 3. Terdapat pada periode 4-7
2. Merupakan unsur logam 4. Terletak antara IIA dan IIIA Pernyataan yang benar adalah…
a. 1, 2, dan 3 d. 3 dan 4 b. 1 dan 3 e. 1, 2, 3, dan 4 c. 2 dan 4
STRUKTUR ATOM
Standar Kompetensi1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Kompetensi Dasar
1.1. Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.
Anda akan melakukan kegiatan-kegiatan berikut.
Mengindentifikasi unsur ke dalam isotop, isobar, dan isoton melalui kerja kelompok.
Akhirnya Anda akan mampu :
Menentukan notasi atom
Menentukan partikel dasar (proton, elektron dan neutron)
Mengklasifikasi unsur ke dalam isotop, isobar dan isoton.
Menentukan konfigurasi elektron dan elektron valensi.
Menentukan golongan dan periode golongan utama dar konfigurasi elektron.
Ringkasan Materi
Notasi Atom
Dalam percobaan menunjukkan bahwa atom mempunyai inti dan kulit atom. Di dalam inti terdapat proton dan neutron yang menentukan besarnya massa sebuah atom. Jumlah proton atau muatan positif yang terdapat dalam inti atom ditunjukkan oleh nomor atom. Untuk atom netral jimlah muatan positif (proton) sama dengan jumlah muatan negatif (elektron). Jumlah total keseluruhan proton dan neutron yang terdapat dalam inti atom ditunjukkan oleh nomor massa.
Notasi atau simbol atom yang dilengkapi dengan nomor massa dan nomor atom dapat ditulis sebagai berikut :
A Z
X
Keterangan : A= nomor massa B= nomor atom C= lambang unsur
Jumlah Proton, Elektron dan Neutron
Atom yang netral memliki jumlah proton sama dengan jumlah elektron.
Z = p = e
Keterangan : p = proton e = elektron
Nomor massa menunjukkan jumlah nukleon (proton dan neutron) yang terdapat dalam inti atom. Jumlah nukleon dalam suatu unsur dinyatakan sebagai nomor massa atom unsur itu. Apabila jumlah neutron dalam inti atom dilambangkan n dan jumlah proton dilambangkan p, nomor massa dapat dirumuskan sebagai berikut :
A = p + n
Oleh karena p sama dengan Z, maka:
A = Z + n atau n = A – Z
Keterangan : A = jumlah proton + jumlah neutron (p + n) Z = jumlah proton
n = jumlah neutron
Nomor atom, jumlah proton dan jumlah elektron merupakan cirri yang khas untuk suatu unsur. Artinya setiap atom suatu unsur yang sama selalu mempunyai nomor atom, jumlah proton dan jumlah electron yang sama pula.
Atom yang netral mempunyai jumlah proton yang sama dengan jumlah elektronnya. Jika suatu atom melepaskan elektron, atom tersebut menjadi bermuatan positif atau disebut
menangkap elektron akan menjadi bermuatan negatif atau disebut anion, sebab mempunyai jumlah elektron yang lebih banyak dari proton. Perubahan tersebut hanya terjadi pada elektron, sedangkan jumlah proton dan neutron tetap sama sebab inti atom tidak berubah.
Contoh :
1. Atom natrium dengan nomor atom 11 dan nomor massa 23. Artinya notasi atom natrium adalah :
23 11Na
Atom terdiri atas : 11 proton, 11 elektron dan 12 neutron. Ion Na+ terdiri atas : 11 proton, 10 elektron dan 12 neutron.
2. Atom belerang dengan nomor atom 16 dan nomor massa 32. Artinya notasi atom belerang adalah :
Atom sejenis yang mempunyai nomor atom yang sama, tetapi mempunyai nomor massa yang berbeda disebut isotop. Perbedaan ini karena adanya perbedaan jumlah neutron dalam inti atom.
Contoh : 3517Cl dan 3717 Cl
Isobar merupakan atom-atom unsur yang mempunyai nomor massa sama, tetapi unsur berbeda (nomor atom berbeda).
Contoh : 146C dan 147N
Isoton merupakan atom-atom unsur yang mempunyai jumlah neutron yang sama, tetapi unsur berbeda (nomor atom berbeda).
Contoh : 31
15P dan 3216S
Konfigurasi Elektron dan elektron Valensi
Elektron-elektron yang mengelilingi inti beredar pada lintasan-lintasan tertentu yang disebut kulit atom. Dalam setiap atom terdapat berbgai macam kulit. Kulit terdekat dengan inti disebut dengan kulit K, dan kulit-kulit selanjutnya dinamai secara berurutan L, M, N dan seterusnya. Semakin jauh dari inti, tingkat energi dari kulit tersebut semakin tinggi.
Konfigurasi elektron adalah susunan elektron pada setiap kulit atom. Sebelum kita menentukan konfigurasi elektron, kita harus mengetahui lebih dahulu nomor atomnya yang menunjukkan jumlah elektron dari atom suatu unsur.
Hal-hal yang harus diperhatikan dalam penyusunan konfigurasi electron sebagai berikut. 1. Dimulai dari kulit yang terdekat dengan inti.
n = 1 disebut kulit K n = 2 disebut kulit L
n = 3 disebut kulit M, dan seterusnya.
2. Jumlah elektron maksimum yang menempati tiap kulit tidak sama. Jumlah maksimum
pengisian elektron pada suatu kulit ditunjukkan dengan rumus sebagai berikut. ∑ = 2n2
4. Pada kulit ke-3 (M), jika sisa elektron lebih dari 8 ditulis 8, jika sisa elektron lebih dari 18 ditulis. Demikian pada kulit ke-4 (N), jika sisa elektron lebih dari 8 ditulis 8, lebih dari 18 ditulis 18, lebih dari 32 ditulis 32.
Contoh :
Unsur 11Na mempunyai konfigurasi elektron sebagai berikut : Kulit ke-1 = 2 elektron
Kulit ke-2 = 8 elektron, karena jumlah elektron 11 tetapi baru terisi 10 elektron dan masih
bersisa 1 elektron lagi dan elektron pada kulit terakhir tidak boleh melebihi dari 8 elektron, maka 1 elektron lagi terisi pada kulit selanjutnya.
Kulit ke-3 = 1 elektron
Dengan demikian, konfigurasi elektron untuk 11Na = 2 . 8 . 1
Elektron yang terdapat pada kulit terluar disebut elektron valensi. Pada contoh di atas maka elektron valensi unsur natrium adalah 1. Elektron valensi sangat menentukan sifat atom. Unsur dengan elektron valensi yang sama mempunyai sifat yang sama pula.
Golongan dan Periode Unsur
Unsur-unsur yang jumlah kulitnya sama ditempatkan pada periode atau baris yang sama. Unsur-unsur yang memiliki jumlah elektron valensi sama ditempatkan pada golongan atau kolom yang sama.
Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron.
1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan satu sma (amu) dan bermuatan +1.
2. Neutron : partikel pembentuk atom yang bermassa satu sma (amu) dan netral. 3. Elektron : partikel pembentuk atom yang tidak mempunyai massa dan
bermuatan -1.
b.Nukleus : Inti atom yang bermuatan positif, terdiri dari proton den neutron.
c.Notasi unsur : zAA dengan X : tanda atom (unsur)
Z : nomor atom = jumlah elektron (e)
= jumlah proton (p) A : bilangan massa = jumlah proton +
neutron Pada atom netral, berlaku: jumlah elektron = jumlah proton.
Contoh :
1. Tentukan jumlah elektron, proton den neutron dari unsur 2656Fe !
Jawab :
Jumlah elektron = jumlah proton = nomor atom = 26
Jumlah neutron = bilangan massa - nomor atom = 56 - 26 = 30
2. Berikan notasi unsur X, jika diketahui jumlah neutron = 14 dan jumlah elektron = 13 !
Jawab :
Nomor atom = jumlah elektron = 13
Jadi notasi unsurnya: 13 27 X
d. Atom tak netral : atom yang bermuatan listrik karena kelebihan atau kekurangan elektron bila dibandingkan dengan atom netralnya.
Atom bermuatan positif bila kekurangan elektron, disebut kation. Atom bermuatan negatif bila kelebihan elektron, disebut anion.
Contoh:
- Na+ : kation dengan kekurangan 1 elektron
- Mg2- : kation dengan kekurangan 2 elektron
- Cl- : anion dengan kelebihan 1 elektron
- O2 : anion dengan kelebihan 2 elektron
e.Isotop : unsur yang nomor atomnya sama, tetapi berbeda bilangan massanya. Contoh: Isotop oksigen: 816 O ; 817 O ; 818 O
f. Isobar : unsur yang bilangan massanya sama, tetapi berbeda nomor atomnya. Contoh: 2759 CO dengan 2859 Ni
g. Isoton : unsur dengan jumlah neutron yang sama. Contoh: 613 C dengan 714 N
h.Iso elektron:atom/ion dengan jumlah elektron yang sama. Contoh: Na+ dengan Mg2+
K+ dengan Ar
MODEL ATOM JOHN DALTON
-
atom adalah bagian terkecil suatu unsur-
atom tidak dapat diciptakan, dimusnahkan, terbagi lagi, atau diubah menjadi zat lain-
atom suatu unsur adalah same dalam segala hal, tetapi berbeda dengan atom-atom dari unsur lain-
reaksi kimia merupakan proses penggabungan atau pemisahan atom dari unsur-unsur yang terlihatKelemahan teori atom Dalton: tidak dapat membedakan pengertian atom den molekul. Dan atom ternyata bukan partikel yang terkecil.
B.
MODEL ATOM J.J. THOMPSON
-
atom merupakan suatu bola bermuatan positif dan di dalamnya tersebar elektron-elektron seperti kismis-
jumlah muatan positif sama dengan muatan negatif, sehingga atom bersifat netralC.MODEL ATOM RUTHERFORD
-
atom terdiri dari inti atom yang sangat kecil dengan muatan positif yang massanya merupakan massa atom tersebut-
elektron-elektron dalam atom bergerak mengelilingi inti tersebut-
banyaknya elektron dalam atom sama dengan banyaknya proton dalam inti dan ini sesuai dengan nomoratomnya
D.MODEL ATOM BOHR
-
elektron-elektron dalam mengelilingi inti berada pada tingkat-tingkat energi (kulit) tertentu tanpamenyerap atau memancarkan energi
-
elektron dapat berpindah dari kulit luar ke kulit yang lebih dalam dengan memancarkan energi, atausebaliknya
TIPS
Nomor periode = jumlah kulit
Nomor golongan = jumlah elektron valensi
Dengan menggunakan konfigurasi elektron berdasarkan kulit atom ini (konfigurasi Niels Bohr), maka hanya efektif untuk golongan utama atau golongan A.
Rangkuman
1. Banyaknya proton dalam inti atom suatu unsur dapat dilihat dari nomor atomnya. Untuk atom netral jumlah proton sama dengan jumlah elektronnya.
2. Nomor massa menunjukkan jumlah nukleon (proton + neutron) yang terdapat dalam inti atom.
3. Suatu atom dapat disimbolkan dengan ZA X.
4. Isotop adalah beberapa atom sejenis yang mempunyai nomor atom yang sama, tetapi nomor massa yang berbeda.
5. Isobar adalah beberapa atom yang berbeda jenis dengan nomor massa sama, tetapi nomor atom berbeda.
6. Isoton adalah beberapa atom yang berbeda jenis dengan nomor atom dan nomor massa berbeda, tetapi jumlah neutron sama.
7. Konfigurasi elektron adalah susunan elektron di dalam kulit atomnya. 8. Elektron valensi adalah elektron yang terdapat pada kulit paling luar.
Tugas Kelompok
Kegiatan 2.1. Menentukan Notasi Atom, Jumlah Proton, Elektron dan Neutron 1. Lengkapi tabel berikut.
Unsu
r
Nomor Atom
Massa Atom
Jumlah Lamban
g Proton Elektron Neutro
n
A 4 9 … … … 9
4A
B 8 … … … 8 ...
...B
C … 35 … 17 … ...
...C
D … … … 39
19D
E 15 31 … … … ...
... E
Unsur/Io
Kegiatan 2.2. Menentukan Isotop, Isobar dan Isoton
Tentukan unsur-unsur yang merupakan isotop, isobar dan isoton dari unsur
Kegiatan 2.3. Menentukan Konfigurasi Elektron dan Elektron Valensi
Buatlah konfigurasi elektron atom unsur dengan melengkapi kolom-kolom
Kegiatan 1.4. Menentukan Golongan dan Periode
N
2. Tuliskan lambang unsur dan nomor atom dari unsur berikut.
N
Kerjakan soal-soal latihan dibawah ini dan dikumpulkan pada pertemuan selanjutnya.
Soal-Soal Latihan
Soal Essay
1. Tentukan jumlah proton, elektron, dan neutron unsur-unsur berikut!
a. 5927Co c. 15062Sm
b. 20481Te d. 19578Pt
2. Tulislah lambang dari :
3. Jelaskan yang dimaksud dengan :
Unsur NomorAtom NomorMassa NeutronJumlah Konfigurasi Elektron a. Tulislah konfigurasi elektronnya dan hitunglah jumlah elektron pada kulit terluarnya!
b. Berapa nomor massa isotop A yang lainnya?
Soal Pilihan Ganda
Silanglah (X) huruf a, b, c, d, atau e di depan jawaban yang tepat!
1. Bila unsur X mempunyai 14 proton, 14 elektron dan 14 neutron, unsur tersebut dilambangkan dengan…
2. Suatu unsur mempunyai lambang 6429Cu. Pernyataan yang tepat tentang unsur tersebut
3. Unsur X mempunyai nomor atom 24 dan massa atom 52. Jumlah elektron, proton, dan
neutron berturut-turut adalah…
a. 24, 28, dan 24 d. 24, 24, dan 52 b. 28, 24, dan 24 e. 24, 52, dan 52 c. 24, 24, dan 28
4. Bilangan massa unsur X adalah 27 dan mempunyai 12 buah elektron. Jumlah neutron unsur
tersebut adalah…
a. 5 d. 12
c. 15
5. Pasangan unsur-unsur di bawah ini yang termasuk isobar adalah… a. 146C dan 2814Si d. 146C dan 158O
b. 14
7N dan 73Li e. 147N dan 2814Si
c. 146C dan 147 N
6. Unsur C mempunyai tiga buah isotop, yaitu 12 6C,
13 6C,
14
6C. Ketiganya berbeda dalam…
a. jumlah elektron d. jumlah proton dan elektron b. nomor massa dan jumlah neutron e. nomor massa
c. nomor atom
7. Susunan elektron pada setiap kulit dari unsur 39
19K adalah…
a. 2. 8. 9 d. 2. 8. 8. 2
b. 2. 7. 10 e. 2. 8. 9. 1
c. 2. 8. 8. 1
8. Jumlah elektron valensi pada unsur 37 Rb adalah…
a. 1 d. 4
b. 2 e. 5
c. 3
9. Unsur-unsur dalam sistem periodik panjang disusun berdasarkan… a. kenaikan massa atom relatif
b. kenaikan nomor atomnya c. kenaikan bilangan massa d. bertambahnya neutron e. bertambahnya proton
10. Unsur Y dengan nomor atom 17, dalam sistem periodik terdapat dalam… a. golongan IA; periode 7 d. golongan IIIA; periode 3 b. golongan VIIA; periode 1 e. golongan IA; periode 3 c. golongan VIIA; periode 3
SIFAT FISIK, SIFAT KIMIA DAN SIFAT KEPERIODIKAN UNSUR
Standar Kompetensi1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Kompetensi Dasar
Anda akan melakukan kegiatan-kegiatan berikut.
Mengamati beberapa unsur untuk membedakan sifat logam, non logam dan metaloid.
Mengkaji keteraturan jari-jari atom, energi ionisasi, afinitas elektron dan keelektronegatifan unsur-unsur seperiode dan segolongan berdasarkan data atau grafik dan nnomor atom melalui diskusi kelompok.
Menghubungkan keteraturan sifat jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan.
Akhirnya Anda akan mampu :
Mengklasifikasikan unsur ke dalam logam, non logam dan metaloid.
Menganalisis tabel, grafik untuk menentukan keteraturan jari-jari atom, energi ionisasi, affinitas elektron dan keelektronegatifan
Ringkasan Materi
Sifat Fisis dan Sifat Kimia Unsur
Sistem periodik mengandung banyak informasi tentang sifat-sifat unsur. Selain nomor atom dan nomor massa, banyak tabel periodik yang mencantumkan data titik cair dan titik didih, wujud pada suhu kamar, serta sifat logam dan non logam. Kita akan membahas beberapa sifat tersebut.
1.Logam dan Nonlogam
Unsur dapat digolongkan ke dalam logam dan nonlogam. Perbandingan sifat antara logam dan
nonlogam secara ringkas diberikan pada tabel dibawah ini. Besi, aluminium, emas, dan raksa
tergolong logam. Sedangkan hydrogen, oksigen, dan belerang tergolong nonlogam. Tergolong apakah
tembaga, perak, silikon, dan karbon?.
Logam Nonlogam
1. Kecuali raksa, berwujud padat pada suhu
kamar
1. Ada berwujud padat, cair atau gas.
2. Dapat ditempa dan dapat diregang 2. Bersifat rapuh, tidak dapat ditempa
3. Mengkilap jika digosok 3. Kecuali intan (karbon), tidak mengkilap jika
digosok
4. Konduktor listrik dan panas 4. Nonkonduktor, kecuali grafit (karbon)
Dalam tabel periodik, logam terdapat pada bagian kiri bawah, sedangkan nonlogam pada bagian
kanan makin berkurang.Logam dan nonlogam dibatasi oleh suatu garis tangga di bagian tengah
sistem periodik.
Unsur-unsur disekitar garis batas tersebut mempunyai dua sifat baik sifat logam maupun sifat
nonlogam. Unsur-unsur itu digolongkan sebagai Metaloid.
2. Titik Leleh dan Titik didih
Bagi unsur logam segolongan, titik leleh dan titik didih makin ke bawah makin rendah. Sedangkan
unsur nonlogam segolongan titik leleh dan titik didih makin ke bawah makin tinggi. 3. Wujud
Wujud zat bergantung pada titik leleh dan titik didihnya. Pada suhu kamar hanya dua unsur yang
berwujud cair, 11 unsur berwujud gas dan sisanya berwujud padat. 4. Kereaktifan
Reaktif artinya mudah bereaksi. Unsur logam pada sistem periodik makin ke bawah makin reaktif,
karena makin mudah melepaskan elektron. Sedangkan unsur nonlogam pada sistem periodik
makin ke bawah makin kurang reaktif, karena makin sukar menangkap elektron. Unsur segolongan bukannya mempunyai sifat yang identik, melainkan hanya mirip. Unsur-unsur
tersebut mungkin mempunyai sifat yang sama, tetapi kadarnya berbeda. Salah satu sifat unsur
logam alkali (golongan IA), yaitu bereaksi dengan air. Akan tetapi, kecepatan reaksinya berbeda,
dari atas ke bawah makin dasyat. Satu hal yang harus disadari bahwa setiap unsur mempunyai
sifat khas yang membedakannya dari unsur lainnya.
Sifat-Sifat Periodik Unsur
Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan. Sifat-sifat periodik yang akan dibahas meliputi jari-jari atom, energi ionisasi, afinitas elektron dan kelektronegatifan.
1. Jari-Jari Atom
Jarak antara inti atom dengan elektron terluar disebut jari-jari atom. Penentuan jari-jari atom, yaitu dengan mengukur jarak antara inti-inti dalam senyawa kovalen menggunakan difraksi sinar-X.
2. Energi Ionisasi
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron terluar dari suatu atom. Apabila suatu atom mempunyai energi ionisasi kecil maka atom tersebut akan mudah melepaskan elektron. Demikian juga sebaliknya, semakin besar energi ionisasi suatu atom akan menyebabkan atom tersebut semakin sukar melepaskan elektron.
3. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dilepaskan jika suatu atom menangkap elektron. Afinitas elektron merupakan ukuran mengenai mudah atau tidaknya suatu atom menjadi ion negatif. Apabila atom menangkap elektron, atom bermuatan negatif. Semakin besar energi yang dilepaskan suatu atom, semakin mudah atom-atom tersaebut menangkap elektron.
4. Keelektronegatifan
Keelektronegatifan adalah kecendrungan suatu atom untuk bermuatan negatif atau
kemampuan suatu atom untuk menangkap/menarik elektron dari atom lain. Harga keelektronegatifan ini bersifat relatif antara atom yang satu dengan atom lain.
TIPS
- Jari-jari atom makin kecil - Energi ionisasi makin besar - Afinitas elektron makin besar - Keelektronegatifan makin besar - Sifat logam makin kecil
Rangkuman
Sifat fisis dan sifat kimia unsur antara lain adalah sifat logam dan nonlogam, titik leleh dan titik didih, wujud dan kerekatifan.
Jarak antara inti atom dengan elektron terluar disebut jari-jari atom.
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron terluar dari suatu atom.
Afinitas elektron adalah besarnya energi yang dilepaskan jika suatu atom menangkap elektron.
Keelektronegatifan adalah kecendrungan suatu atom untuk bermuatan negatif atau
kemampuan suatu atom untuk menangkap/menarik elektron dari atom lain.
Tugas Kelompok
Kegiatan 3.1. Logam dan Nonlogam
Berdasarkan data, unsur-unsur dalam sistem periodic dapat dikelompokkan
menjadi unsur yang bersifat logam dan nonlogam.
1. Berilah warna yang berbeda pada bagan sistem periodic berikut untuk logam,
nonlogam dan metaloid.
2. Tentukan unsur-unsur yang membatasi logam dan nonlogam pada setiap periode
dan tulis unsur metaloidnya.
Periode Antara Golongan Unsur yang Membatasi
Nama metaloid
2 3 4 5
Pada sistem periodik, di dalam satu golongan ada yang mengandung unsur
logam saja, logam dan non logam, serta logam, non logam dan metaloid.
berikut.
Logam saja :
………
Logam dan metaloid :
……… Logam, metalloid, dan nonologam : ………
Nonlogam saja :
………
Kegiatan 3.2. Jari-Jari Atom
Untuk mengetahui keperiodikan jari-jari atom dari unsur-unsur dalam sistem
periodik, amati gambar di bawah ini.
Gambar jari-jari atom???
a. Lengkapi tabel berikut dengan menganalisis diagram jari-jari atom.
Komponen TerbesarUnsur dengan Jari-JariTerkecil Dari seluruh unsur
Unsur golongan IA Unsur golongan IIA Unsur periode 2 Unsur periode 3
b. Jelaskan kepriodikan jari-jari atom :
Dalam satu periode :
……… Dalam satu golongan :
……… c. Mengapa pada satu periode dengan naiknya nomor atom, jari-jari
makin kecil?
……… ……… ………
d. Mengapa pada suatu golongan dari atas kebawah, jari-jari makin besar? ……… ……… ………
Kegiatan 3.3. Energi Ionisasi
Energi ionosasi unsur-unsur dalam satu periode atau dalam satu golongan dapat
kamu pelajari berdasarkan grafik energi ionisasi pertama terhadap nomor atom
berikut ini.
Grafik energi ionisasi ???
Isi tabel pengamatan berikut berdasarkan harga energi ionisasi dari grafik.
Energi Ionisasi Lambang UnsurTertinggi kJ/mol Lambang UnsurTerendah kJ/mol Pada periode 2
Pada periode 3 Pada golongan IA Pada golongan IIA Pada golongan VIIA
Pada golongan VIIIA
Kemudian jawablah pertanyaan di bawah ini.
1.Berdasarkan grafik energi ionisasi, jelaskan
bagaimana
perubahan energi ionisasi pertama dari unsur-unsur dalam satu periode! 2.Berdasarkan grafik energi ionisasi, jelaskan pula perubahan energi ionisasi unsur-unsur dalam satu golongan!
Kegiatan 3.4. Afinitas Elektron
Perhatikan tabel afinitas elektron beberapa unsur berikut ini.
Golongan
Periode IA IIIA IVA VA VIA VIIA
1 -73H
2 -60Li -27B -122C N0 -141O -328F
3 -53Na -44Al -134Si -772P -20S -349Cl
4 -48K -30Ga -120Ge -77As -195Se -235Br
5 -47Rb -30In -121Sn -101Sb -190Te -295I
Pertanyaan:
1.
Berdasarkan tabel di atas, bagaimana kecendrungan harga afinitas elektron unsur-unsur dalam satu golongan?
----2. Mengapa unsur-unsur golongan IIA dan VIIIA tidak tercantum pada tabel afinitas elektron di atas?
----Kegiatan 3.5. Keelektronegatifan
Tebel keelektronegatifan???
Pertanyaan:
1. Berdasarkan data tabel di atas harga keelektronegatifan dalam: a. satu periode
---b. satu golongan
---2. Jika unsur A lebih elektronegatif dari pada unsur B, tentukan ke arah mana pasangan
elektron akan tertarik dalam senyawa AB?.
Tugas Individu
Kerjakan soal-soal latihan dibawah ini dan dikumpulkan pada pertemuan selanjutnya.
Soal –Soal Latihan
Soal Essay
1. Manakah yang lebih banyak jumlahnya, unsur logam atau nonlogam? 2. Jelaskan dengan singkat hubungan antara :
a. jumlah kulit dengan jari-jari atom
b. muatan inti dengan jari-jari atom unsur seperiode c. energi ionisasi dengan jari-jari atom
d. energi ionisasi dengan muatan inti.
3. Ditentukan beberapa unsur sebagai berikut: H(Z = 1); He(Z = 2); Li(Z = 3); Be(Z = 4); F(Z =
9); Ne(Z = 10); Na(Z = 11); dan Ar(Z = 18).
Di antara unsur tersebut, unsur manakah mempunyai: a. jari-jari atom terbesar?
d. titik didih tertinggi?
4. Di antara unsur Li (Z = 3), Be (Z = 4), dan B (Z = 5), unsure manakah yang mempunyai :
a. energi ionisasi tingkat pertama terbesar? b. energi ionisasi tingkat kedua terbesar? Jelaskan jawabanmu!
5. Kereaktifan logam berkaitan dengan kecendrungan melepas elektron, sedangkan kereaktifan
nonlogam berkaitan dengan kecendrungan menarik elektron. Bandingkanlah kereaktifan
antara:
a. Na dengan Mg b. Na dengan Cl c. Cl dengan Ar d. F dengan Br
Soal Pilihan Ganda
1. Unsur dengan nomor atom 14 mempunyai sifat sebagai… a. nonlogam reaktif d. metalloid
b. logam reaktif e. logam kurang reaktif c. unsur transisi
2. Berikut ini merupakan sifat-sifat unsure logam, kecuali… a. titik leleh rendah d. dapat ditempa
b. bersifat magnetis e. mengkilap permukaannya c. merupakan konduktor
3. Di antara unsur-unsur 11Na; 12Mg; 19K; 20Ca; dan 37Rb yang memiliki jari-jari atom terkecil
adalah unsur…
a. 11Na d. 20Ca
b. 12Mg e. 37Rb
c. 19K
4. Jika jari-jari atom unsure Li, Na, K, Be, dan B secara acak (tidak berurutan) dalam angstrom
(A) adalah : 2,01; 1,23; 1,57; 0,80; dan 0,89, maka jari-jari atom litium adalah…
a. 2,03 d. 0,89
b. 1,57 e. 0,80
c. 1,23
5. Tiga unsur yang nomor atomnya berurutan mempunyai energi ionisasi 1681, 2081 dan 496
kJ/mol. Ketiga unsur itu berturut-turut adalah…
6. Di antara pasangan unsur berikut, pasangan manakah yang energi ionisasi unsur yang kedua
lebih kecil daripada unsur yang pertama?
a. Na dan Mg d. Mg dan Al
b. Be dan F e. Cl dan F
c. Mg dan P
7. Diketahui beberapa unsur dengan konfigurasi elektron sebagai berikut:
P : 2 8 8 1 S : 2 8 4
Q : 2 8 T : 2 7
R : 2 8 2
Unsur yang mempunyai afinitas elektron terbesar adalah..
a. P d. S
b. Q e. T
c. R
8. Unsur A dan B mempunyai afinitas elektron berturut-turut 240 kJ/mol dan -328 kJ/mol.
Berarti…
a. unsur A lebih mudah menyerap elektron daripada unsur B b. ion B- lebih stabil daripada atom B
c. ion A- lebih stabil daripada atom A
d. unsur A lebih bersifat nonlogam daripada B
e. unsur A lebih sukar melepas elektron daripada unsure B
9. Pernyataan berikut yang paling benar tentang arti keelektronegatifan adalah… a.energi yang dibebaskan ketika suatu atom dalam wujud gas menyerap elektron membentuk ion negatif
b.energi yang diperlukan untuk melepaskan satu electron dari suatu atom dalam wujud gas
membentuk ion positif
c.energi yang dibebaskan pada pembentukan suatu ikatan kimia
d.bilangan yang menyatakan kecendrungan menarik elektron ke pihaknya dalam suatu
ikatan kimia
e.bilangan yang menyatakan perbandingan energi ionisasi dari suatu unsur dengan unsur
lainnya
10. Unsur yang mempunyai keelektronegatifan terbesar adalah…
a. helium d. klorin
b. hidrogen e. oksigen
PERKEMBANGAN MODEL ATOM
Standar Kompetensi1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Kompetensi Dasar
1.1. Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.
Anda akan melakukan kegiatan-kegiatan berikut.
Mengkaji literatur tentang perkembangan teori atom (di rumah setelah ditugaskan pada pertemuan sebelumnya).
Mempresentasikan dan diskusi hasil kajian.
Menyimpulkan hasil pembelajaran.
Menjelaskan perkembangan teori atom untuk menunjukkan kelemahan dan kelebihan masing-masing teori atom berdasarkan fakta eksperimen.
Ringkasan Materi
Setiap orang pasti pernah merasakan gagal, jatuh, atau berbuat kesalahan. Hal itu adalah sesuatu yang wajar dan manusiawi. Demikian halnya dengan para ilmuwan yang berusaha untuk menemukan teori atom yang sebenarnya. Yang penting adalah kemauan untuk selalu berusaha.
Ilmu pengetahuan yang kita pelajari sekarang ini timbul begitu saja, namun melalui serangkaian percobaan-percobaan yang menghasilkan sebuah hipotesis. Hipotesis tersebut harus dibuktikan terlebih dahulu secara eksperimen. Setelah terbukti kebenarannya, barulah dapat kita sebut teori.
Pada awal perkembangan ilmu kimia, banyak berkembang teori-teori tentang atom. Macam-macam teori tersebut sebagai berikut.
1. Model Atom Dalton
Teori atom yang pertama kali dikemukakan dan dilandasi data ilmiah adalah teori atom Dalton yaitu
pada tahun 1803.
Pokok-pokok teori Dalton sebagai berikut.
a. Atom adalah bagian terkecil dari suatu unsur. b. Atom tidak dapat dibagi lagi.
c. Atom-atom unsur yang sejenis mempunyai sifat yang sama, sedangkan atom-atom unsur tidak
sejenis mempunyai sifat yang berbeda.
d. Reaksi kimia terjadi karena penggabungan dan pemisahan atau pemutusan ikatan antar atom.
Model atom Dalton dapat digambarkan sebagai bola yang berbentuk bulat massif. Kelemahan
model atom ini adalah belum mengemukakan adanya muatan dalam suatu atom.
2. Model Atom Thomson
Model atom Dalton sudah tidak sesuai lagi setelah Thomson menemukan elektron pada tahun
1897 dengan menggunakan tabung sinar katode.
Atom merupakan bola bermuatan positif yang dipermukaannya tersebar elektron. Model atom
Thomson digambarkan sebagai kismis yang tersebar pada seluruh bagian roti sehingga sering
disebut dengan model roti kismis.
Model atom Thomson tidak lama berkembang karena Rutherford meragukan kebenaran model
atom ini. Kelemahan model atom ini adalah belum menggambarkan letak dan lintasan elektron
dalam suatu atom.
3. Model Atom Rutherford
Rutherford (1911) mengadakan percobaan hamburan sinar alfa dari uranium yang disimpan dalam
wadah yang dibuat dari timbal. Sinar alfa yang keluar dari uranium diarahkan pada lempeng tipis
logam emas. Hasil percobaan menunjukkan bahwa sebagian besar sinar alfa dapat menembus
Dari percobaannya, Rutherford menyimpulkan sebagai berikut. Atom mempunyai inti
dalam atom. Inti atom dikelilingi elektron. Atom bersifat netral sehinga muatan positif (inti
atom) sama dengan muatan negatif (elektron).
Kelemahan model atom ini adalah Rutherford tidak mampu menerangkan mengapa electron
tidak jatuh ke inti atom. Menurut teori fisika klasik, jika electron bergerak mengelilingi inti yang
muatannya berlawanan, elektron akan kehilangan energi. Akibatnya, elektron akan jatuh ke
inti.
4. Model Atom Niels Bohr
Pada tahun 1913, Niles Bohr seorang ahli fisika memperbaiki teori atom Rutherford, yaitu dengan
mengadakan percobaan spektrum hidrogen. Hasil percobaan Bohr dapat disimpulkan sebagai
berikut.
a. Atom terdiri atas inti atom bermuatan positif dan dikelilingi elektron bermuatan negatif
menurut lintasan-lintasan tertentu seperti susunan tata surya, tanpa menyerap atau
memancarkan energi. Lintasan-lintasan tersebut dikenal dengan orbit berbentuk lingkaran
Menurut teori dualisme, electron di dalam atom dapat dipandang sebagai pertikel dan gelombang. Dengan dasar ini, Heisenberg mengemukakan teori ketidakpastian.
Teori ketidakpastian menyatakan bahwa kedudukan dan kecepatan gerak elektron
tidak dapat
ditentukan secara pasti, yang dapat ditentukan hanyalah kemungkinan terbesarnya atau
probalitasnya. Dengan demikian, kedudukan dan kecepatan gerakan elektron dalam atom berada
dalam ruang tertentu dalam atom yang disebut orbital. Teori mengenai elektron berada dalam
orbital-orbital di seputar inti atom inilah yang merupakan pokok teori atom modern. Persamaan gelombang untuk menggambarkan bentuk dan tingkat energi orbital berhasil
dirumuskan oleh Erwin Schrodinger, 1926 seorang ahli fisika dari Austria. Model atom
mekanika kuantum berupa orbital, sedangkan tingkat energinya mirip dengan model atom Bohr.
Rangkuman
Perkembangan teori model atom : 1. Pokok-pokok teori atom Dalton :
a. atom merupakan bagian terkecil dari suatu unsur. b. atom tidak dapat dibagi lagi.
c. atom-atom unsur sejenis sifatnya sama, sedangkan atom-atom unsur berlaianan jenis
sifatnya berbeda.
d. reaksi kimia terjadi karena penggabungan dan pemutusan ikatan antar atom. Model ini menggambarkan atom sebagai bola berbentuk bola masif.
2. Model atom Thomson
Model ini menggambarkan atom seperti roti kismis. Atom tersebut berupa bola bermuatan
positif yang dipermukaannya tersebar elektron.
3. Model atom Rutherford
Percoabaannya dengan melakukan hamburan sinar alfa dari uranium yang disimpan dalam
wadah yang terbuat dari timbal.
Atom mempunyai inti bermuatan positif yang sangat kecil dan padat. Di dalam inti terdapat
proton dan massa atom terpusat pada intinya. Inti ataom dikelilingi elektron. Atom bersifat
netral sehingga muatan positif (inti atom) sama dengan muatan negatif (elektron). 4. Model atom Bohr
a. atom terdiri atas inti bermuatan positif yang dikelilingi elektron bermuatan negatif menurut
bahwa kedudukan dan kecepatan gerak elektron tidak dapat ditentukan secara pasti karena
hanya dapat ditentukan kemungkinan terbesarnya atau probalitasnya. Dengan demikian
kedudukan dan kecepatan gerakan elektron dalam atom ditemukan dalam ruang tertentu dalam
atom yang disebut orbital.
Soal-Soal Latihan
Soal Essay
1. Atas dasar apakah J.J Thomson menyusun model atomnya?
2. Jelaskan model atom menurut Rutherford berdasarkan hasil eksperimenya. 3. Mengapa model atom Rutherford akhirnya dianggap gagal?
4. Bagaimana gerak elektron mengelilingi inti berdasarkan model atom Bohr? 5. Apa sebab model atom Bohr dinyatakan gagal?
1. Ilmuwan yang mengadakan percobaan hamburan sinar alfa dari uranium yang
2. Model atom Dalton digambarkan sebagai bola yang berbentuk bulat masif. Kelemahan model
atom ini adalah…
a. belum menggambarkan letak dan lintasan elektron dalam suatu atom b. belum mengemukakan adanya muatan dalam suatu atom
c. Dalton tidak mampu menerangkan mengapa elektron tidak jatuh ke inti d. hanya tepat untuk atom dengan nomor atom kecil
e. atomnya digambarkan sebagai bola yang berbentuk bulat masif
3. Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain sambil menyerap atau
memancarkan energi. Teori ini merupakan penyempurnaan teori atom Rutherford yang dikemukakan oleh…
a. Becquerel d. Rontgen
b. Bohr e. Thomson
c. Dalton
4. Teori atom Thomson menyatakan…
a. semua materi tersusun atas pertikel-pertikel kecil yang tidak dapat dimusnahkan atau
diciptakan
b. benda tersusun atas partikel yang sangat kecil dan disebut atom
c. atom-atom suatu unsur tertentu adalah identik, artinya memiliki berat, ukuran, dan
sifat yang sama
d. atom adalah bola bermuatan positif dan dipermukaannya tersebar elektron yang bermuatan
negatif
e. atom merupakan suatu bola berongga dengan inti yang bermuatan positif dikelilingi elektron
yang bermuatan negatif
5. Kelemahan model atom Bohr adalah… a. belum ada muatan dalam atom
b. hanya tepat untuk atom-atom dengan nomor atom kecil
c. belum menggambarkan lintasan dan letak elektron dalam atom d. elektron akan jatuh ke inti
e. elektron bergerak stasioner pada lintasannya
6. Ilmuwan yang memperbaiki teori atom Rutherford dengan mengadakan percobaan spektrum
hidrogen adalah…
a. Dalton d. Bohr
b. Thomson e. Heisenberg
c. Rutherford
7. Salah satu isi teori atom Dalton yang sudah tidak sesuai lagi adalah… a. atom adalah bagian yang dapat dibagi menjadi lebih kecil lagi b. atom unsur sejenis mempunyai sifat yang sama
c. atom unsur yang sejenis mempunyai sifat yang berbeda
d. reaksi kimia terjadi karena penggabungan dan pemisahan atom e. atom adalah bagian terkecil suatu unsur yang tidak dapat dibagi
8. Pernyataan yang tidak sesuai dengan teori ketidakpastian elektron adalah… a. kedudukan elektron tidak dapat ditentukan secara pasti
d. kecepatan gerak elektron dalam atom ditemukan dalam ruang tertentu e. probalitas kedudukan elektron tidak dapat ditentukan
9. Rutherford mengemukakan bahwa di dalam atom terdapat inti atom yang bermuatan positif.
Hasil tersebut diperoleh setelah melakukan percobaan dengan… a. tabung sinar katode
b. tabung sinar anode
c. hamburan sinar alfa dari uranium d. penembakan gas helium
e. tabung sinar katode yang dimodifikasi
10.Suatu atom terdiri atas inti yang bermuatan positif dengan elektron-elektron yang mengelilinginya. Elektron-elektron tidak akan jatuh ke dalam intinya karena… a. elektron selalu dalam keadaan diam
b. energi tolak menolak partikel positif dan partikel negatif cukup besar
c. elektron bergerak menurut lintasannya yang tertentu dengan gerak tertentu pula dari inti
d. elektron terlalu jauh dari inti sehingga ada efek tarik menarik e. antara inti dan elektron terdapat penghalang
IKATAN KIMIA
Standar Kompetensi1. Memahami struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
Kompetensi Dasar
1.2. Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk
Anda akan melakukan kegiatan-kegiatan berikut.
Menentukan unsur yang dapat melepaskan elektron atau menerima elektron untuk mencapai kestabilan dalam diskusi kelompok
Menggambarkan susunan elektron valensi Lewis melalui diskusi kelas.
Membandingkan proses pembentukan ikatan ion dan ikatan kovalen dalam diskusi kelas
Merancang dan melakukan percobaan untuk menyelidiki kepolaran senyawa di laboratorium.
Mengindentifikasi sifat fisik logam dan menghubungkannya dengan proses pembentukan ikatan logam dalam diskusi kelompok di laboratorium.
Akhirnya Anda akan mampu :
Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya.
Menggambarkan susunan elektron valensi atom gas mulia (duplet dan okted) dan elektron valensi bukan gas mulia (struktur Lewis).
Menjelaskan proses terbentuknya ikatan ion.
Menjelaskan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
Menjelaskan proses terbentuknya ikatan koordinasi pada beberapa senyawa.
Menyelidiki kepolaran beberapa senyawa dan hubungannya dengan keelektronegatifan
melalui percobaan.
Mendeskripsikan proses pembentukan ikatan logam dan hubungannya dengan sifat fisik logam.
Menghubungkan sifat fisis materi dengan jenis ikatannya.
Ringkasan Materi
A. Kestabilan Unsur-Unsur
Unsur-unsur di alam cendrung stabil. Kestabilan unsur bisa diperoleh jika jumlah elektron pada kulit
terluarnya (elektron valensi) sama dengan jumlah yang dimiliki gas mulia (golongan VIIIA), yaitu 2
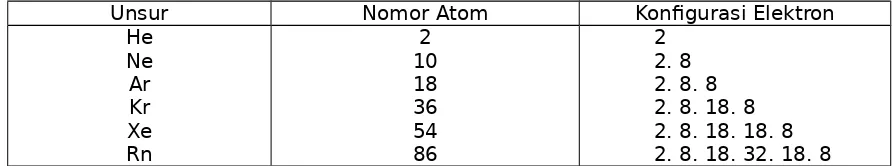
elektron (duplet) dan 8 elektron (oktet). Seperti pada tabel di bawah ini :
Tabel Konfigurasi Elektron Gas Mulia
Kita tahu bahwa gas mulia adalah merupakan unsur yang paling tidak reaktif (kestabilan tinggi).
Agar seperti gas mulia, maka unsur-unsur bekerja sama dengan yang lain sehingga terjadi gaya
tarik menarik antar atom. Gaya tarik menarik antar atom dalam suatu zat itulah yang dinamakan Ikatan Kimia.
Ada tiga cara suatu atom untuk mencapai kestabilan (seperti gas mulia), yaitu:
1. Dengan cara melepaskan elektron, sehingga bermuatan positif sebesar sejumlah elektron
Contoh : 12Mg → 12Mg2+ + 2e
3. Dengan cara menggunakan pasangan elektron bersama.
Ada dua macam pasangan elektron yang digunakan bersama (menurut Lewis) :
G.N. Lewis telah memperkenalkan suatu metode yang simpel, tetapi dapat digunakan untuk
Lambang Lewis digunakan untuk menjelaskan ikatan kimia antaraatom, terutama ikatan
kovalen.
Meskipun demikian, lambang Lewis juga dapat digunakan untuk menggambarkan ikatan ion.
C. Ikatan Ion dan Ikatan Kovalen
Atas dasar cara-cara untuk mencapai keadaan stabil di atas, maka dikenal ada dua jenis ikatan
yang utama yaitu ikatan ion dan ikatan kovalen.
1. Ikatan Ion
Ikatan ion atau ikatan heteropolar (elektrovalen) adalah ikatan kimia yang terjadi dari ion
positif dan ion negatif yang saling berikatan atau ikatan antara logam dan nonlogam.
Terjadinya ikatan ion jika atom suatu unsur melepaskan elektron valensinya (lalu berubah
konfigurasi seperti gas mulia jika melepaskan satu elektron, sedangkan klorin akan mempunyai konfigurasi seperti gas mulia jika menangkap satu elektron. Oleh karena itu,
kedua atom membentuk ion positif dan ion negatif. Secara sederhana, pembentukan ikatan
dijelaskan sebagai berikut :
11Na(2. 8. 1) → 11Na+ (2. 8) + e
17Cl (2. 8. 7) + e- → 17Cl- (2. 8. 8)
_____________________________________ Na+ + Cl- → NaCl (Natrium Klorida)
Lambang Lewis pembentukan NaCl adalah sebagai berikut:
Nax + Cl → Na+[ Cl ]- → NaCl
Atau dapat juga dijelaskan dengan diagram model atom ;
Sifat dan ciri senyawa ion antara lain :
1). Karena ikatan antara ion-ion sangat kuat, maka :
a. Umumnya senyawa ion berupa zat padat berbentuk kristal dengan titik lebur yang
tinggi.
b. Dalam keadaan cair atau larutan dapat menghantarkan listrik.
2). Molekul senyawa ion selalu terdiri atas atom logam dengan satu atau lebih nonlogam,
kecuali pada senyawa-senyawa ammonium (NH4+).
2. Ikatan Kovalen
Ikatan kovalen adalah ikatan antara dua atau lebih atom unsur yang sejenis atau berbeda
didasarkan pada pemakaian elektron valensi bersama, sehingga masing-masing atom
memiliki susunan elektron stabil seperti gas mulia (duplet atau oktet). a. Ikatan Tunggal
Ikatan kovalen tunggal melibatkan sepasang elektron yang digunakan bersama-sama.
Contoh :
1). Pembentukan molekul H2
Pembentukan ikatan kovalen pada molekul H2 terbentuk dari dua buah
atom H.
Setiap atom H memiliki 1 elektron. Untuk mencapai konfigurasi seperti gas mulia
(He), atom H memerlukan 1 elektron. Karena mempunyai daya tarik elektron sama,
antara kedua atom H tidak mungkin terjadi serah terima elektron. Oleh karena itu,
kedua atom memasangkan elektronnya. Masing-masing atom H menyumbang 1
elektron untuk dijadikan milik bersama. Sepasang elektron itu ditarik oleh kedua
inti atom hidrogen hingga kedua atom berikatan.
Secara sederhana, pembentukan ikatan kovalen pada molekul H2 dapat
digambarkan
H0 + xH → H 0x H
Penulisan itu dapat disederhanakan dengan mengganti sepasang elektron yang
digunakan untuk berikatan dengan sepotong garis dan menghilangkan semua
elektron yang tidak digunakan untuk berikatan. Rumus Lewis yang sudah disederhanakan itu disebut rumus bangun atau rumus struktur.
Rumus strukturnya : H – H Rumus kimianya : H2
2). Pembentukan molekul HCl
Atom 1H mempunyai 1 elektron valensi. Atom 17Cl mempunyai konfigurasi
elektron
2.8.7. Berarti baik atom H maupun Cl memerlukan 1 elektron lagi untuk mencapai
susunan elektron stabil. Kedua atom ini saling meminjamkan 1 elektron valensinya.
Rumus Lewis :
xx xx
H0 + xClxx → H 0x Clxx
xx xx
Rumus struktur : H – Cl Rumus kimia : HCl
b. Ikatan Rangkap Dua
Ikatan rangkap dua melibatkan dua pasang elektron yang dipakai bersama oleh dua
atom.
Contoh : Pembentukan molekul O2
Pembentukan molekul O2 dari atom-atom O. Atom 8O mempunyai konfigurasi
elektron
2.6. Untuk mencapai susunan elektron stabil atom O memerlukan 2 elektron lagi.
Sehingga atom-atom saling meminjamkan 2 elektron valensinya. Rumus Lewis :
xx 00 xx 00
Oxx + 00O → O xx 00 O
xx 00 xx 00
Rumus struktur : O = O Rumus kimia : O2 c. Ikatan Rangkap Tiga
Ikatan rangkap tiga melibatkan tiga pasang elektron yang dipakai bersama oleh dua
atom.
Contoh : Pembentukan molekul N2.
Pembentukan molekul N2 dari atom-atom N. Atom 7N mempunyai konfigurasi 2.
5. Untuk
N saling meminjamkan 3 elektron valensinya.
x 0
Nxxx + 000N → xxN x0 N00
x 0
Rumus struktur : N≡N Rumus kimia : N2
d. Ikatan Kovalen Koordinasi
Ikatan kovalen koordianasi adalh ikatan kovalen dimana pasangan elektron yang
digunakan bersama berasal dari salah satu atom.
Contoh : Pembentukan ion NH4+ dari NH3 dan ion H+ yang tidak memiliki
elektron.
Molekul NH3 dengan rumus Lewis :
H 0x
H xo N 00
0x
H
Molekul NH3 seperti pada rumus Lewis di atas, mempunyai sepasang elektron
yang tidak
digunakan (elektron sunyi). Maka molekul NH3 dapat mengikat ion H+.
H H 0x 0x
H xo N 00 + H+ → H xo N oo H
0x ox
H H
Untuk membedakan ikatan kovalen biasa dengan ikatan kovalen koordinasi, maka
pasangan elektron koordinasi digambarkan dengan anak panah dari arah yang memberikan pasangan elektron.
Rumus strukturnya :
H
H N → H
H
D. Kepolaran Ikatan
Suatu ikatan kovalen disebut polar, jika pasangan electron ikatan tertarik lebih kuat ke salah
satu atom.
Contoh : Molekul HCl oo
H xo Cl oo
oo
Pasangan elektron milik bersama akan lebih dekat pada atom Cl, karena Cl mempunyai daya
tarik elektron yang lebih besar dari pada H. Sehingga pada ikatan H-Cl terjadi polarisasi.
Suatu ikatan disebut nonpolar, jika pasangan elektron ikatan tertarik sama kuat ke semua
Contoh : Molekul H2
H xo H
Kepolaran disebabkan oleh perbedaan keelektronegatifan antara atom yang berikatan.
E. Ikatan Logam
Semua sifat logam dapat dipahami dengan cara melihat ikatan antar atom logam. Atom logam
dapat dibayangkan seperti kelereng yang terjejal dalam sebuah kotak yang saling bersentuhan
satu sama lain. Karena tiap atom logam mempunyai kulit elektron yang belum terisi penuh,
elektron valensi dapat bergerak dengan bebas dan dapt berpindah dari satu kulit atom ke kulit
atom yang lainnya. Dengan kata lain, elektron valensi tesebar membaur dengan awan elektron
yang menyelimuti semua logam. Oleh karena itu, semua logam dapat dibayangkan sebagai
ion positif yang diselimuti awan elektron.
TIPS
Jika molekul hanya mengandung dua atom :
Jika kedua atom sejenis, maka ikatan bersifat non polar. Contoh : H2; Cl2; Br2.
Jika kedua atom tidak sejenis, maka ikatan bersifat polar. Contoh : HCl; HBr.
Jika molekul mengandung tiga atau lebih atom, maka yang menentukan adalah pasangan elektron bebas yang dimiliki atom pusat (atom yang berada ditengah molekul).
Jika tidak memiliki pasangan elektron bebas, maka ikatan nonpolar. Contoh : CH4; CO2. Jika memilki pasangan elektron bebas, maka ikatan polar. Contoh : NH3; H2O.
Rangkuman
1. Unsur yang memiliki energi ionisasi rendah mudah melepaskan elektron, sedangkan unsur yang
memiliki afinitas elektron tinggi mudah menangkap elektron.
2. Unsur gas mulia sangat stabil karena konfigurasi elektron di kulit terluarnya telah penuh.
3. konfigurasi electron seperti gas mulia dapt dicapai oleh suatu atom dengan cara melepaskan
elektron menangkap elektron atau menggunakan elektron secara bersama. 4. Ikatan ion adalah ikatan yang terbentuk karena adanya serah terima elektron.
5. Ikatan kovalen adalah ikatan kimia yang melibatkan penggunaan bersama pasangan electron.
6. Ikatan kovalen meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, ikatan kovalen
rangkap tiga dan ikatan kovalen koordinasi.
7. Ukuran kepolaran dinyatakan dengan momendipol (μ).
8. Pada ikatan logam, semua logam dapat dibayangkan sebagai ion-ion positif yang diselimuti awan
Tugas Kelompok
Gambarkan pembentukan ikatan kovalen pada senyawa berikut dan tulis rumus
Lewisnya. F2
F F
Br2
Br Br
HF
H F
HBr
H Br
CH4
H
H C H
H
CCl4
Cl
Cl C Cl
Cl
NH3
H N H
H
C2H5OH
H H
H C C O H
H H
SO3
O O
S
O
H2SO4
O
H O S O H
O
O3
O O
O
HNO3
O
Kegiatan 5.4. Kepolaran Senyawa Kovalen Cara Kerja :
1. Sediakan buret atau pipet tetes panjang. Isi dengan air, HCl. Dan CCl4.
Buat muatan listrik pada penggaris plastik.
2. Keluarkan zat dari buret atau pipet tetes lalu dekatkan pada penggaris
yang sudah bermuatan seperti pada gambar disamping. 3. Amati apa yang terjadi.
Zat Hasil Pengamatan
Air ………
………
……… ………
HCl ………
………
……… ………
CCl4 ………
………
……… ………
Catatan :CCl4 dapat diganti dengan minyak tanah.
Pertanyaan :
1. Apakah ada pengaruh dari muatan listrik pada zat-zat tersebut? 2. Dari percobaan di atas buatlah kesimpulan dari kepolaran senyawa!
Latihan :
Berikan contoh ikatan kovalen nonpolar dan ikatan kovalen polar, masukkan pada
tabel berikut.
Ikatan Kovalen Nonpolar Ikatan Kovalen Polar Rumus
Molekul Rumus Lewis MolekulRumus Rumus Lewis
Kegiatan 5.5. Ikatan Logam
Diamati dari sifat-sifatnya, atom-atom logam pun berikatan satu sama laindi dalam
kristal logamnya. Bagaimana atom-atom pada logam dapat berikatan? Untuk mempelajarinya lakukan kegiatan-kegiatan berikut!
1. Tuliskan beberapa logam dan keguanaannya dalam kehidupan sehari-hari!
No Nama Logam Kegunaan Alasan Penggunaan Logam 1
2
3
4
5
2. Tuliskan sifat-sifat logam!
a. b. c. d. e. 3. Atom-atom logam berikatan dengan membentuk “lautan electron”. Gambarkan terjadinya ikatan logam tersebut.
4. Jelaskan pengertian ikatan logam!
---Kegiatan 5.6. Jenis Ikatan pada Suatu Zat
Untuk mengingat kembali materi ikatan kimia, jawablah pertanyaan ini! Perhatikan zat-zat yang terdapat pada gelas kimia di bawah ini!
Tentukan ikatan kimia yang terdapat pada senyawa di dalam gelas kimia pada gambar
di atas!
Rumus Jenis Ikatan
Soal-Soal Latihan
Soal Essay
1. Tulislah rumus Lewis untuk unsur-unsur berikut : Na, Ca, Al, C, P, S, Cl dan Ar. Bagaimana cara
yang paling mungkin ditempuh oleh masing-masing unsur tersebut untuk mencapai konfigurasi
oktet? Jelaskan!
2. Tuliskan jenis ikatan serta rumus senyawa yang terjadi dari : a. 15A dan 17B
b. 11C dan 17D c. 14E dan 9F d. 12G dan16H
3. Kelompokkan senyawa-senyawa berikut dalam kelompok ionik dan kovalen!
a. HCl e. CaF2
b. SF6 f. K2O
c. CH4 g. NaBr
d. CCl4 h. H2SO4
4. Ramalkan jumlah ikatan dan jenis ikatan yang terjadi serta lukiskan rumus Lewis dari : a. HCl
b. H2CO3
c. HNO3
d. H2SO4
e. H3PO4
5. Unsur X mempunyai massa atom 40 dan inti atomnya mengandung 20 neutron. Inti atom unsur Y
mengandung 17 proton dan 19 neutron. Tentukan : a. Konfigurasi electron masing-masing unsur. b. Elektron valensi X dan Y.
c. Golongan dan periodenya di dalam SPU. d. Jenis ikatan dan rumus senyawa yang terjadi. e. Massa molekul relatif senyawa itu.