7. Ikatan Kimia
Kimia Dasar 1A
Student learning outcome
Setelah mengikuti materi ini, mahasiswa mampu:
menjelaskan kondisi-kondisi pembentukan ikatan
menjelaskan faktor-faktor yang terlibat dalam pembentukan ikatan ion menuliskan simbol Lewis untuk atom dan ion
menerapkan pemahaman tentang ikatan kovalen, aturan oktet dan ikatan rangkap dalam menggambarkan struktur molekul dengan simbol Lewis lengkap dengan muatan formal
menerapkan pemahaman tentang keelektronegatifan untuk mengidenti kasi kepolaran ikatan dan kereaktifan unsur.
menggambar dan menerangkan struktur resonansi
·
·
·
·
·
·
Jenis ikatan kimia
Energetika pembentukan ikatan kimia
Ketika dua atau lebih atom membentuk ikatan, proses ini dapat menyebabkan kenaikan atau penurunan energi potensial.
Molekul yang stabil adalah molekul yang memiliki energi potensial lebih rendah dibanding individu atom-atom penyusunnya.
sering dijadikan sebagai acuan apakah pembentukan senyawa menyebabkan penurunan
ΔH
f∘Latihan
Berdasarkan nilai , manakah senyawa yang paling stabil?
A. , +9.7 kJ/mol B. , -20.6 kJ/mol C. , +94.5 kJ/mol D. , +5.4 kJ/mol E. , -46.4 kJ/mol
Submit Show Hint Show Answer Clear
ΔH
f∘(g)
N
2O
4S(g) H
2(g) N
2H
4(g) PH
3(g)
NH
3Ikatan ion
Ikatan ion
Ikatan ion adalah ikatan yang terjadi akibat gaya tarik-menarik antar partikel bermuatan berlawanan.
Ikatan ion berlangsung antara ion dari unsur logam dan ion dari unsur nonlogam, karena:
·
Unsur logam memiliki energi ionisasi relatif rendah sehingga mudah melepas elektron membentuk ion positif yang stabil.
Unsur non logam memiliki a nitas elektron yang relatif eksoterm sehingga cenderung menerima elektron membentuk ion negatif yang stabil
-
-
Senyawa ionik
Kristal ionik:
merupakan susunan kation-anion dalam kisi 3 dimensi yang disebut struktur kisi.
Energetika pembentukan ikatan ion
Suatu senyawa akan stabil dibentuk dari unsur-unsurnya bila dalam pembentukannya terjadi penurunan energi potensial ( ).
Energi kisi adalah besarnya penurunan energi potensial sistem ketika 1 mol padatan terbentuk dari ion-ionnya dalam fasa gas.
Δ H
f∘< 0
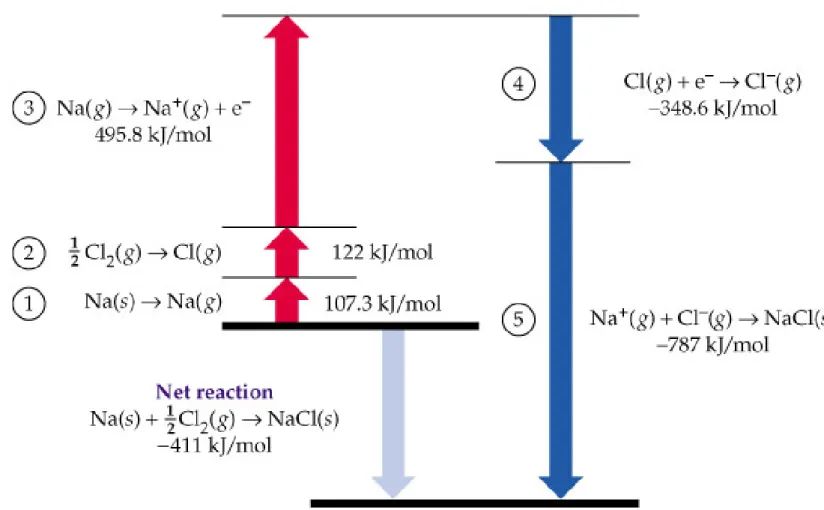
Penentuan energi kisi
Contoh penentuan energi kisi NaCl:
Salah satu pendekatan untuk penentuan energi kisi adalah dengan membagi reaksi termokimia pembentukan standar dari NaCl ke dalam beberapa tahap:
N (g) + C (g) → NaCl(s) a
+l
−E
kisi=?
Na(s) ⟶ Na(g) (g) ⟶ Cl(g)
12
Cl
2Na(g) ⟶ Na
+(g) + e
−Cl(g) + e
−⟶ Cl
−(g)
(g) + (g) ⟶ NaCl(s) Na
+Cl
−Δ (Na, g) H
f∘Δ (Cl, g) H
f∘EI(Na) AE(Cl) E
kisi= +107, 8 kJ/mol
= +121, 3 kJ/mol
= +495, 4 kJ/mol
= −348, 8 kJ/mol
= −787 kJ/mol
Diagram Born-Habber
Energi kisi senyawa ionik
Selain menggunakan diagram Born-Habber, energi kisi juga dapat diperkirakan nilainya dengan hukum Coulomb.
Energi kisi dari dua ion dengan muatan dan yang terpisah dengan jarak berdasarkan hukum Coulomb dapat diperkirakan dengan persamaan berikut:
q
1q
2r
E = q
1q
2k r
, dengan adalah tetapan dielektrik medium.
Berdasarkan persamaan di atas, energi kisi akan bermuatan negatif karena dan berlawanan tanda.
Persamaan di atas menyatakan bahwa energi kisi akan lebih besar bila
·
k = 4πε
0ε
0·
q
1q
2·
yang berinteraksi . Contoh:
-
Energi kisi senyawa ionik
Latihan
Dengan asumsi jarak pisah antara kation dan anion hampir sama, spesi mana yang akan memiliki energi kisi paling besar?
A. Natrium klorida B. Kalsium klorida C. Kalsium nitrida D. Natrium oksida E. Kalsium oksida
Submit Show Hint Show Answer Clear
Latihan
Energi ionisasi pertama cesium adalah +376 kJ/mol dan a nitas elektron brom adalah -325 kJ/mol, tentukan untuk reaksi
A. +376 kJ/mol B. +701kJ/mol C. +51 kJ/mol D. -701 kJ/mol E. -51 kJ/mol
Submit Show Hint Show Answer Clear
ΔE
Cs(g) + Br(g) ⟶ Cs
+(g) + Br
−(g)
Latihan
Litium uorida memiliki energi kisi sebesar -1033 kJ/mol. Padatan ionik AB, ion A memiliki jari-jari hampir sama dengan Li , dan B memiliki jari-jari hampir sama dengan F . Berapakah perkiraan nilai energi kisi untuk AB?
A. sekitar 3 x (-1033 kJ/mol) B. sekitar -1033 kJ/mol
C. sekitar 4 x (-1033 kJ/mol) D. sekitar 2 x (-1033 kJ/mol) E. sekitar 6 x (-1033 kJ/mol)
Submit Show Hint Show Answer Clear
2+
+ 2- -
Latihan
Manakah padatan di bawah ini yang memiliki energi kisi paling eksoterm? A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
LiF NaCl AlCl
3Al
2O
3CaCl
2Perhitungan energi kisi
Untuk dua ion dengan muatan dan yang terpisah dengan jarak , energi potensial dapat ditentukan dengan hukum Coulomb:
Hitung energi yang dilepaskan ketika 1 mol NaCl terbentuk, bila diketahui:
- ,
- dan , dengan
- Jarak terdekat antara ion Na dan Cl adalah 282 pm.
Soal-1 solusi-1A
· ·
q
1q
2r
E = q
1q
2k r
k = 1.11 × 10
−10C
2/J. m
= +e
q
Na+q
Cl−= −e e = 1.602 × 10
−19C
+ -
Konfigurasi elektron ion natrium
Ionisasi pertama dan kedua natrium:
sehingga sukar terbentuk, karena energi yang dikeluarkan tidak bisa terkompensasi oleh energi kisi ketika membentuk garam.
Oleh karena itu, ion natrium ditemukan di alam hanya sampai .
Disamping itu, ion juga telah memiliki kon gurasi elektron gas mulia.
Na(g) ⟶ Na
+(g) + e
−(g) ⟶ (g) + Na
+Na
2 +e
−E = 496 kJ/mol I
1E = 4563 kJ/mol I
2E ≈ 10 × E I
2I
1Na
2+Na
+Na
Na
+: [Ne]3s
1: [Ne]
Na
+Konfigurasi elektron ion kalsium
dan energi yang diperoleh dari energi kisi hanya sekitar 2000 kJ/mol, sehingga ion sukar terbentuk.
Oleh karena itu, ion kalsium ditemukan di alam hanya sampai ion .
Di samping itu, ion juga telah memiliki kon gurasi elektron gas mulia.
Ca(g) ⟶ Ca
+(g) + e
−(g) ⟶ (g) + Ca
+Ca
2 +e
−(g) ⟶ (g) + Ca
2 +Ca
3 +e
−E = 590 kJ/mol I
1E = 1140 kJ/mol I
2E = 4940 kJ/mol I
3E ≈ 4 × E I
3I
2Ca
3+Ca
2+Ca Ca
2+: [Ar]4s
2: [Ar]
Ca
2+Konfigurasi elektron ion dari logam transisi
Elektron yang hilang lebih awal berasal dari n terbesar (kulit terluar), baru kemudian . Contoh:
·
ℓ
·
Fe Fe
2+Fe
3+: [Ar]3 4 d
6s
2: [Ar]3d
6: [Ar]3d
5Pembentukan ion memberikan stabilitas ekstra karena subkulit d menjadi setengah penuh
Karena pada logam transisi yang terlepas adalah elektron pada kulit terluar, maka muatan ion yang umum pada logam transisi adalah +2.
Ion dengan muatan lebih besar dari +2 dihasilkan dari pelepasan elektron d
Perhatikan bahwa baik dan tidak mencapai kon gurasi elektron gas mulia.
·
Fe
3+·
·
·
Fe
2+Fe
3+Konfigurasi elektron ion dari logam post transisi
Contoh:
dapat menjadi dengan mengosongkan elektron pada 5p
juga dapat menjadi dengan mengosongkan elektron pada 5s dan 5p
Perhatikan bahwa baik dan tidak mencapai kon gurasi elektron gas mulia.
Sn : [Kr] 4 d
105 5 s
2p
2Sn Sn
2+: [Kr] 4 5 Sn
2 +d
10s
2Sn Sn
4+: [Kr] 4
Sn
4 +d
10Sn
2+Sn
4+Meramalkan konfigurasi elektron kation
Soal:
Kon gurasi elektron Bi menurut Aufbau: [Xe]6s 4f 5d 6p Tentukan ion dari Bi yang dapat dibentuk?
Jawab:
Ubah penulisan kon gurasi elektron Bi berdasarkan kenaikan bilangan kuantum utama:
Bi: [Xe] 4f 5d 6s 6p
Bi dapat memebentuk ion Bi dengan mengosongkan elektron pada 6p Bi : [Xe] 4f 5d 6s
Bi juga dapat membentuk ion Bi dengan mengosongkan elektron pada 6s dan 6p
2 14 10 3
14 10 2 3
3+
3+ 14 10 2
5+
Konfigurasi elektron anion
Unsur non-logam cenderung menerima elektron untuk mencapai kon gurasi elektron gas mulia:
O: [He] 2s 2p + 2 e O : [He] 2s 2p = [Ne]
N: [He] 2s 2p + 3 e N : [He] 2s 2p = [Ne]
Cl: [Ne] 3s 3p + e Cl : [Ne] 3s 3p = [Ar]
2 4 -
→
2- 2 62 3 -
→
3- 2 62 5 -
→
- 2 6Aturan oktet
Aturan oktet hanya bekerja untuk logam golongan 1A dan 2A, Al, dan unsur non- logam
H dan He tidak dapat memenuhi aturan oktet karena keterbatasan jumlah elektron yang hanya maksimum 2 elektron untuk mengisi kulit n = 1.
Aturan oktet juga tidak berlaku untuk logam golongan transisi dan post-transisi
·
·
·
Latihan
Manakah kon gurasi elektron keadaan dasar yang tepat untuk Cu dan Cu ? A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
2+
[Ar] 3 4 , [Ar] 3 d
9s
2d
9[Ar] 3 d
104 , [Ar] 3 4 s
1d
8s
1[Ar] 3 d
104 , [Ar] 3 s
1d
9[Ar] 3 4 , [Ar] 3 d
9s
2d
104 s
1[Kr] 3 4 , [Ar] 3 d
9s
2d
9Latihan
Manakah ion yang memiliki kon gurasi elektron gas mulia?
A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
Fe
3 +Sn
2 +Ni
2 +Ti
4 +Cr
3 +Simbol Lewis
Simbol Lewis pada ikatan ionik
Latihan
Manakah spesi yang memiliki 8 elektron valensi pada simbol Lewisnya?
A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
Ar
+F
+Mg
+S
2 −Si
Ikatan kovalen
Ikatan kovalen
Ikatan kovalen terbentuk dari hasil pemakaian bersama elektron.
Untuk memahami ikatan kovalen, perhatikan bagaimana ikatan antar H dan H membentuk
(a) Gaya tarik elektron valensi dari atom H oleh inti atom H yang lain membuat kedua atom tersebut bergerak saling mendekat.
(b) Ketika kedua atom H berdekatan, kerapatan elektron berpindah ke tengah seiring
H
2Ikatan kovalen
Ketika inti terus mendekat, akan terjadi tolak-menolak karena kesamaan muatan inti menyebabkan energi potensial interaksi akan naik.
Jarak interaksi akhir antara dua atom yang saling berikatan kovalen berada pada jarak keseimbangan, yaitu jarak dimana terjadi keseimbangan antara gaya tarik dan gaya tolak.
·
·
Ikatan kovalen
Ada dua kuantitas yang mengkarakterisasi ikatan kovalen:
1. Panjang ikatan = jarak antara dua inti ( )
2. Energi ikatan = besarnya energi potensial yang dilepaskan ketika ikatan terbentuk atau jumlah energi yang diperlukan untuk memutus ikatan.
+
r
Ar
BIkatan kovalen nonpolar
Ikatan kovalen nonpolar dibentuk dari dua unsur yang sama yang saling berbagi elektron dengan jumlah yang sama
Ikatan kovalen polar
Ikatan kovalen polar dibentuk dari dua unsur berbeda, dimana salah satu atom menarik elektron lebih kuat dibanding yang lain.
Kepolaran ikatan
Ikatan kovalen polar
Ikatan kovalen polar dibentuk dari dua unsur berbeda, dimana salah satu atom menarik elektron lebih kuat dibanding yang lain.
Kondisi ini menciptakan ketidakseimbangan kerapatan elektron dalam ikatan yang mengarah pada konsep muatan parsial ( ).
δ
Momen dipol
Momen dipol ( ) adalah besaran untuk mengukur tingkat polarisasi pada ikatan kovalen.
Dengan = muatan (Coulomb) dan adalah jarak antar inti atom (meter) dalam ikatan kimia.
Momen dipol ( ) menggunakan satuan Debye (D), dengan ketentuan 1 D = 3,34 x 10 C m.
μ
μ = q × r
q r
μ
-30Perhitungan momen dipol
Pada molekul klor monoksida, klor ( ) memiliki muatan . Bila panjang ikatan adalah 154.6 pm, hitung momen dipol dari molekul ini dalam satuan Debye. Muatan elektron = 1.602 x 10 C.
Soal-2 solusi-2
· ·
Cl−O +0.167 e
−-19
Keelektronegatifan
Keelektronegatifan (EN) adalah tarikan relatif atom terhadap elektron dalam ikatan.
Dalam satu perioda EN naik dari kiri ke kanan seiring kenaikan .
Perbedaan keelektronegatifan ( ) menciptakan kepolaran ikatan.
Z
effΔEN
Non polar:
Tingkat karakter ionik ikatan:
- berkarakter > 50% ionik, dimana atom dengan keelektronegatifan tinggi menguasai elektron.
- hampir kovalen murni
(nonpolar)
- kovalen polar
Beda keelektronegatifan = ukuran karakter ionik
ΔEN = 0
ΔEN > 1.7
ΔEN < 0.5
0.5 < ΔEN < 1.7
Hubungan reaktifitas unsur dan keelektronegatifan
Unsur Logam dengan EN rendah mudah mengalami oksidasi, sementara logam dengan EN tinggi sukar mengalami oksidasi.
Latihan
Ikatan mana yang paling polar?
A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
Al−I Si−I Al−Cl
Si−Cl
Si−P
Latihan
Berdasarkan keelektronegatifannya, tentukan spesi mana yang merupakan oksidator paling kuat?
A.
B.
C.
D.
E.
Submit Show Hint Show Answer Clear
Ne Kr Br
2Cl
2S
Menggambar struktur Lewis
Tidak semua molekul memenuhi aturan oktet
Unsur periode ke-3 (n = 3) dapat diisi lebih dari 8 elektron, karena memiliki subkulit s, p, dan d.
·
Aturan oktet hanya berlaku untuk unsur-unsur perioda 2, seperti C, N, O, dan F Be dan B seringkali memiliki elektron kurang dari oktet, contoh pada molekul
dan
Unsur periode ke-dua tidak mungkin memiliki elektron lebih dari 8, karena pada
hanya ada subkulit s dan p dengan total elektron yang dapat mengisi kedua subkilit adalah 8 elektron.
- -
BeCl
2BCl
3-
n = 2
·
1. Tentukan bagaimana atom-atom terikat Kerangka :
2. Hitung jumlah total elektron valensi
Prosedur menggambar struktur Lewis
Buat kerangka struktur
Tentukan atom pusat. Biasanya dipilih dari atom dengan keelektronegatifan paling rendah.
Contoh:
·
·
·
SiF
4Si adalah atom dengan
keelektronegatifan paling rendah sehingga digunakan sebagai atom pusat
-
SiF
41Si = 1 × 4e
−4F = 4 × 7e
−Total
= 4e
−= 28e
−= 32e
−3. Tempatkan dua elektron pada setiap pasangan atom yang membentuk ikatan, kemudian ganti dengan garis ikatan
4. Lengkapi oktet atom terminal dengan menambahkan pasangan elektron
Prosedur menggambar struktur Lewis
Elektron valensi
Ikatan tunggal = 32e
−= −8e
−sisa pasangan e
−bebas F sisa
= 24e
−= −24e
−= 0
Prosedur menggambar struktur Lewis
5 Tempatkan sisa elektron pada atom pusat
Pada kasus tidak ada elektron yang tersisa setelah ditempatkan pada atom ujung.
6 Bila atom pusat belum oktet, bentuk ikatan rangkap dan bila perlu rangkap tiga.
Pada kasus atom pusat telah oktet. Jadi struktur Lewis telah diselesaikan pada prosedur ke-4.
SiF
4SiF
4SiF
4Distribusi elektron: Kerangaka :
Struktur Lewis :
Tetapi atom C pusat hanya memiliki 6 e sehingga belum oktet. Sementara elektron
Struktur Lewis
Ion adalah ion oksi, sehingga atom C merupakan atom pusat dan atom O mengitarinya. ion terikat pada dua atom O.
H 2 CO 3
CO
2 −3H
+1 C = 1 × 4e
−3 O = 3 × 6e
−2 H = 2 × 1e
−Total
ikatan tunggal sisa
pas elek bebas O sisa
= 4e
−= 18e
−= 2e
−= 24e
−= −10e
−= 14e
−= −14e
−= 0e
−H
2CO
3H
2CO
3-
Karena tidak ada elektron bersisa maka salah satu pasangan elektron bebas pada atom O dikonversi menjadi ikatan kedua.
Hasil transfer elektron bebas O akan menghasilkan ikatan rangkap antara C dan O
Struktur Lewis H 2 CO 3
Struktur Lewis N 2 F 2
Struktur Lewis N 2 F 2
Jumlah elektron valensi tidak mencukupi untuk melengkapi oktet nitrogen.
Pembentukan ikatan rangkap pada kedua nitrogen akan melengkapi kondisi oktet kedua nitrogen di atom pusat.
·
·
Struktur dengan atom pusat lebih dari oktet
Unsur setelah perioda 3 dalam tabel periodik:
Struktur Lewisnya untuk unsur kelompok ini masih mengikuti prosedur yang sama hanya pada atom pusat dapat memiliki tambahan ikatan
Contoh:
·
memiliki ukuran atom lebih besar memiliki orbital d
dapat menerima 18 elektron -
- -
·
·
Struktur dengan atom pusat kurang dari oktet
Boron dan Berilium adalah dua atom ketika menjadi atom pusat tidak dapat mencapai oktet.
Menggambar struktur Lewis
Gambarkan struktur Lewis untuk molekul berikut:
1.
2.
3.
4.
5.
6.
Soal-3 solusi-3
· ·
OF
2N
2O
5COCl
2HCN
CO
NO
2Contoh pada struktur ada dua kemungkinan menggambarkan strukturnya
Bukti eksperimen:
Panjang ikatan (tanpa H) <
mengikat H, mengindikasikan bahwa
tanpa H ada dalam keadaan ikatan rangkap .
Pemilihan struktur Lewis
Ketika suatu molekul dapat digambarkan oleh lebih dari satu kemungkinan struktur Lewis, bagaimana menentukan struktur yang benar?
H
2SO
4S−O S−O
S−O
S=O
Muatan formal (FC) adalah muatan yang diberikan pada atom dengan mengabaikan keelektronegatifan. Oleh karena itu, muatan formal bukanlah muatan real.
Dengan V = jumlah elektron valensi suatu atom, N = jumlah elektron non-ikatan, dan B
= jumlah elektron ikatan.
Struktur stabil:
Struktur dengan muatan formal
Strutkur bawah memiliki muatan formal paling rendah sehingga terpilih sebagai
Muatan formal
FC = V − N − B
2
Struktur
Ada 3 struktur yang mungkin:
Di antara ketiga struktur struktur tengah yang paling sedikit mengemban muatan formal, sehingga struktur kedua adalah stuktur paling stabil dari .
CO 2
CO
2CO
2CO
2Bila dihitung muatan formal (FC) untuk B dan Cl, diperoleh:
Semua FC bernilai 0 sehingga molekul telah berada dalam kondisi struktur terbaik, sehingga tidak diperlukan membentuk ikatan rangkap.
Muatan formal dan kimia Boron
Dalam struktur
BCl
3 mengapa tidak dibentuk ikatan rangkap untuk melengkapi oktet?FC
BFC
Cl= 3 − 0 − 6 = 0 2
= 7 − 6 − 2 = 0
2
Latihan
Berdasarkan struktur Lewis terbaik untuk , tentukan muatan formal nitrogen pada molekul tersebut.
A. -2 B. -1 C. 0 D. +1 E. +2
Submit Show Hint Show Answer Clear
CH
3NO
2Resonansi
Resonansi
Struktur Lewis memiliki satu ikatan rangkap ( ) dan dua ikatan tunggal ( ):
Hasil eksperimen menunjukan panjang ikatan ketiga adalah sama, yaitu rata-rata dari dua ikatan tunggal dan 1 ikatan rangkap.
Untuk menjelaskan masalah di atas, perlu dibuat struktur resonansi, yaitu struktur ekivalen yang dapat menerangkan panjang ikatan rata-rata dari ketiga :
NO
−3N=O N−O
N−O
N−O
Struktur resonansi
Struktur Lewis mengasumsikan bahwa elektron terlokalisasi antara dua atom Dalam struktur resonansi elektron terdelokalisasi sehingga dapat bergerak diseluruh molekul untuk memberikan panjang ikatan ekivalen
Cara lain menggambarkan struktur resonansi adalah dengan membuat struktur hibrida resonansi
·
·
·
Contoh struktur resonansi lainnya
Struktur resonansi :
Struktur resonansi :
CO
2 −3PO
3 −4Bagaimana menentukan struktur terbaik?
1. Oktet harus dipenuhi 2. FC < 1
3. Semua muatan negatif diemban oleh atom yang lebih elektronegatif.
Contoh: resonansi
Struktur resonansi tidak selalu ekivalen
Dua atau lebih struktur Lewis untuk senyawa yang sama tidak selalu memiliki distribusi elektron yang sama.
NCO
−Stabilisasi resonansi
Struktur sebenarnya memiliki kestabilan lebih baik dari salah satu struktur resonansi. Sebagai contoh untuk benzena:
Efek resonansi pada benzena memberikan kestabilan ekstra sebesar 146 kJ/mol.
Struktur resonansi
Gambarkan semua struktur resonansi untuk Soal-4 solusi-4
· ·
SO
3ikatan kovalen koordinasi
Kovalen normal
Contoh pada amoniak, satu elektron dari setiap atom saling berbagi membentuk ikatan kovalen
Kovalen koordinasi
Contoh pada ion amonium, atom N memiliki sepasang elektron bebas yang digunakan untuk membentuk ikatan kovalen dengan ion
yang tidak memiliki elektron.
Ikatan kovalen koordinasi
H
+Ikatan kovalen koordinasi
Khususnya Boron yang kekurangan elektron, mudah menerima pasangan elektron untuk membentuk ikatan kovalen koordinasi.
Ikatan kovalen koordinasi
1. Padatan ketika disublimasi menjadi gas pada 180 C ternyata membentuk . Gambarkan struktur Lewis , tunjukan bahwa molekul ini terbentuk melalui ikatan kovalen koordinasi dari dua molekul
2. Tunjukan kontribusi kovalen koordinasi pada molekul dan Soal-5 solusi-5
· ·