KAJIAN ANTIOKSIDAN EKSTRAK DAUN LIMA SPESIES
DARI FAMILI CUCURBITACEAE
DENGAN METODE FRAP DAN DPPH
TESIS
Karya tulis sebagai salah satu syarat untuk memperoleh gelar Magister dari
Institut Teknologi Bandung
oleh
AGUNG DARMAWATI
NIM : 20712033
(Program Studi Farmasi)
ii
KAJIAN ANTIOKSIDAN EKSTRAK DAUN LIMA SPESIES
DARI FAMILI CUCURBITACEAE
DENGAN METODE FRAP DAN DPPH
oleh
Agung Darmawati
NIM : 20712033
(Program Studi Farmasi)
Institut Teknologi Bandung
Menyetujui
Tim Pembimbing
Maret 2014
Pembimbing Utama
(Dr. Irda Fidrianny, Apt)
Pembimbing Serta
iii ABSTRAK
KAJIAN ANTIOKSIDAN EKSTRAK DAUN LIMA SPESIES
DARI FAMILI CUCURBITACEAE DENGAN METODE FRAP DAN DPPH
oleh
Agung Darmawati NIM : 20712033 (Program Studi Farmasi)
Latar belakang dan tujuan: Antioksidan merupakan zat yang mampu memperlambat atau mencegah terjadinya oksidasi. Cucurbitaceae merupakan sumber antioksidan alami yang banyak tumbuh di Indonesia. Tujuan penelitian ini adalah untuk menguji kapasitas antioksidan ekstrak daun mentimun (CS), labu siam (SE), oyong (LA), labu kuning (CM), paria (MC) menggunakan metode pengujian antioksidan FRAP dan DPPH serta korelasi antara fenol total, flavonoid total dan karotenoid total terhadap kapasitas FRAP dan peredaman DPPH. Metode: Ekstraksi secara sinambung dengan tiga pelarut berbeda kepolaran (heksana, etil asetat dan etanol, sehingga diperoleh ekstrak n-heksana CS1, SE1, LA1, CM1, MC1; ekstrak etil asetat CS2, SE2, LA2, CM2, MC2 dan ekstrak etanol CS3, SE3, LA3, CM3, MC3. Setiap ekstrak dipantau secara kromatografi lapis tipis (KLT), dilakukan uji kapasitas antioksidan dengan metode FRAP, DPPH, EC50 kapasitas FRAP, IC50 peredaman radikal DPPH, penetapan fenol
total, flavonoid total, karotenoid total serta korelasinya dengan kapasitas FRAP dan peredaman DPPH. Hasil: SE2 (ekstrak etil asetat daun labu siam) memiliki EC50
kapasitas FRAP terendah yaitu 759 ppm. LA3 (ekstrak etanol daun oyong) memiliki IC50 peredaman DPPH terendah yaitu 73 ppm. SE2 memiliki fenol total tertinggi (4,01g
GAE/100g), MC1 memiliki flavonoid total tertinggi (14,37 g QE/100g) dan karotenoid total tertinggi (19,53g BET/100g). Fenol total sampel SE mempuyai korelasi positif, tinggi dan bermakna terhadap kapasitas FRAP dan peredaman DPPH. Kesimpulan: Metode uji FRAP dan DPPH memberikan hasil yang linier untuk pengukuran aktivitas antioksidan pada ekstrak daun labu siam. Kapasitas FRAP dan aktivitas peredaman DPPH dalam ekstrak daun labu siam dapat diperkirakan secara tidak langsung dengan penentuan fenol total. Senyawa golongan fenol pada daun labu siam merupakan kontributor utama dalam kapasitas FRAP dan peredaman DPPH
iv ABSTRACT
Background and objectives: Antioxidants are substances that can prevent oxidation. Cucurbitaceae is a source of natural antioxidants that abundant in Indonesia. The purpose of this study was to test the antioxidant capacities of leaves extracts of cucumber (CS), chayote (SE), sponge gourd (LA), pumpkin (CM), bitter melon (MC) using FRAP and DPPH methods and their correlation with total phenol, total flavonoids and carotenoids. Methods: Extraction by Soxhlet using three different polarities solvents (hexane, ethyl acetate, ethanol), so there are CS1, SE1, LA1, CM1, MC1 n-hexane extracts; CS2, SE2, LA2, CM2, MC2 ethyl acetate extracts and CS3, SE3, LA3, CM3, MC3 ethanolic extracts. Each extracts was observed by thin-layer chromatography (TLC), antioxidant capacity by FRAP, DPPH methods, EC50 of FRAP
capacity and IC50 DPPH scavenging activity, determination of total phenol, total
flavonoids, total carotenoids and their correlation with FRAP and DPPH capacity. Results: SE2 (ethyl acetat extract of chayote leaves) had lowest EC50 FRAP capacity
(759 ppm). LA3 (ethanolic extract of sponge gourd leaves) had lowest IC50 DPPH
scavenging activity (73 ppm). SE2 contained the highest total phenolic (4.01 g GAE/100 g), MC1 (n-hexane extract of bitter melon leaves) had highest flavonoid content (14.37 g QE/100 g) and highest carotenoid (19.53 g BET/100 g). Total phenol of SE had positively high correlation with FRAP and DPPH. Conclusion: FRAP capacity of SE leaves extract linier with DPPH scavenging activity. FRAP capacity and DPPH scavenging activity of SE leaves extract can be estimated indirectly by total phenol. Phenolic compounds in chayote leaves were the major contributor in FRAP capacity and DPPH scavenging activity
v
PEDOMAN PENGGUNAAN TESIS
Tesis S2 yang tidak dipublikasikan terdaftar dan tersedia di Perpustakaan Institut Teknologi Bandung, dan terbuka untuk umum dengan ketentuan bahwa hak cipta ada
pada pengarang dengan mengikuti aturan HAKI yang berlaku di Institut Teknologi Bandung. Referensi kepustakaan diperkenankan dicatat, tetapi pengutipan atau
peringkasan hanya dapat dilakukan seizin pengarang dan harus disertai dengan kebiasaan ilmiah untuk menyebutkan sumbernya.
Memperbanyak atau menerbitkan sebagian atau seluruh tesis haruslah seizin Dekan Sekolah Pascasarjana, Institut Teknologi Bandung.
vi Dipersembahkan kepada
Akhmed G. Sjahadat,
Abrisam Al Agha Sjahadat,
vii
KATA PENGANTAR
Bismillahirahmanirrohim,
Segala puji bagi Allah Tuhan semesta alam atas rahmat dan petunjukNya sehingga penulis dapat menyelesaikan laporan penelitian dengan judul “Kajian Antioksidan
Ekstrak Daun Lima Spesies Cucurbitaceae dengan Metode FRAP dan DPPH”. Tujuan
penelitian ini adalah sebagai salah satu syarat untuk mencapai gelar Magister pada Sekolah Farmasi Institut Teknologi Bandung.
Penyusunan laporan penelitian ini dapat diselesaikan bukan semata-mata karena kemampuan penulis secara pribadi tetapi tidak lepas dari bimbingan, bantuan dan dukungan dari semua pihak yang terlibat, oleh karena itu penulis menyampaikan terima kasih kepada:
1. Orang tua yang selalu memberikan doa dan motivasi;
2. Suami terkasih yang memberikan cinta, dukungan dan pengertian tidak terbatas; 3. Dr. Irda Fidrianny, Apt dan Prof. Dr. Sukrasno, Apt sebagai pembimbing yang telah
meluangkan waktu memberikan arahan, pengetahuan selama proses penelitian dan penyusunan laporan penelitian;
4. Prof. Dr. Asep Gana Suganda, Apt sebagai dosen wali yang telah memberikan bimbingan akademik;
5. Prof. Dr. Komar Ruslan Wirasutisna, Apt sebagai penanggungjawab laboratorium kimia bahan alam yang telah memberikan fasilitas demi kelancaran penelitian;
6. Kepala Badan POM RI yang telah memberikan kesempatan untuk melanjutkan pendidikan dan menyediakan alokasi dana pendidikan;
7. Kepala Balai POM di Palu yang telah memberikan kesempatan untuk melanjutkan pendidikan;
viii
9. Rekan-rekan program studi Magister opsi Biologi Farmasi yang telah berbagi ilmu serta pengalaman.
Penulis menyadari bahwa laporan penelitian ini belum sempurna, untuk itu secara terbuka penulis menerima kritik dan saran dari semua pihak. Semoga Allah membalas setiap kebaikan dengan RahmatNya.
Bandung, Maret 2014
ABSTRAK
KAJIAN ANTIOKSIDAN EKSTRAK DAUN LIMA SPESIES
DARI FAMILI CUCURBITACEAE DENGAN METODE FRAP DAN DPPH
oleh
Agung Darmawati NIM : 20712033 (Program Studi Farmasi)
Latar belakang dan tujuan: Antioksidan merupakan zat yang mampu memperlambat atau mencegah terjadinya oksidasi. Cucurbitaceae merupakan sumber antioksidan alami yang banyak tumbuh di Indonesia. Tujuan penelitian ini adalah untuk menguji kapasitas antioksidan ekstrak daun mentimun (CS), labu siam (SE), oyong (LA), labu kuning (CM), paria (MC) menggunakan metode pengujian antioksidan FRAP dan DPPH serta korelasi antara fenol total, flavonoid total dan karotenoid total terhadap kapasitas FRAP dan peredaman DPPH. Metode: Ekstraksi secara sinambung dengan tiga pelarut berbeda kepolaran (heksana, etil asetat dan etanol, sehingga diperoleh ekstrak n-heksana CS1, SE1, LA1, CM1, MC1; ekstrak etil asetat CS2, SE2, LA2, CM2, MC2 dan ekstrak etanol CS3, SE3, LA3, CM3, MC3. Setiap ekstrak dipantau secara kromatografi lapis tipis (KLT), dilakukan uji kapasitas antioksidan dengan metode FRAP, DPPH, EC50 kapasitas FRAP, IC50 peredaman radikal DPPH, penetapan fenol
total, flavonoid total, karotenoid total serta korelasinya dengan kapasitas FRAP dan peredaman DPPH. Hasil: SE2 (ekstrak etil asetat daun labu siam) memiliki EC50
kapasitas FRAP terendah yaitu 759 ppm. LA3 (ekstrak etanol daun oyong) memiliki IC50 peredaman DPPH terendah yaitu 73 ppm. SE2 memiliki fenol total tertinggi (4,01g
GAE/100g), MC1 memiliki flavonoid total tertinggi (14,37 g QE/100g) dan karotenoid total tertinggi (19,53g BET/100g). Fenol total sampel SE mempuyai korelasi positif, tinggi dan bermakna terhadap kapasitas FRAP dan peredaman DPPH. Kesimpulan: Metode uji FRAP dan DPPH memberikan hasil yang linier untuk pengukuran aktivitas antioksidan pada ekstrak daun labu siam. Kapasitas FRAP dan aktivitas peredaman DPPH dalam ekstrak daun labu siam dapat diperkirakan secara tidak langsung dengan penentuan fenol total. Senyawa golongan fenol pada daun labu siam merupakan kontributor utama dalam kapasitas FRAP dan peredaman DPPH
ABSTRACT
Background and objectives: Antioxidants are substances that can prevent oxidation. Cucurbitaceae is a source of natural antioxidants that abundant in Indonesia. The purpose of this study was to test the antioxidant capacities of leaves extracts of cucumber (CS), chayote (SE), sponge gourd (LA), pumpkin (CM), bitter melon (MC) using FRAP and DPPH methods and their correlation with total phenol, total flavonoids and carotenoids. Methods: Extraction by Soxhlet using three different polarities solvents (hexane, ethyl acetate, ethanol), so there are CS1, SE1, LA1, CM1, MC1 n-hexane extracts; CS2, SE2, LA2, CM2, MC2 ethyl acetate extracts and CS3, SE3, LA3, CM3, MC3 ethanolic extracts. Each extracts was observed by thin-layer chromatography (TLC), antioxidant capacity by FRAP, DPPH methods, EC50 of FRAP
capacity and IC50 DPPH scavenging activity, determination of total phenol, total
flavonoids, total carotenoids and their correlation with FRAP and DPPH capacity. Results: SE2 (ethyl acetat extract of chayote leaves) had lowest EC50 FRAP capacity
(759 ppm). LA3 (ethanolic extract of sponge gourd leaves) had lowest IC50 DPPH
scavenging activity (73 ppm). SE2 contained the highest total phenolic (4.01 g GAE/100 g), MC1 (n-hexane extract of bitter melon leaves) had highest flavonoid content (14.37 g QE/100 g) and highest carotenoid (19.53 g BET/100 g). Total phenol of SE had positively high correlation with FRAP and DPPH. Conclusion: FRAP capacity of SE leaves extract linier with DPPH scavenging activity. FRAP capacity and DPPH scavenging activity of SE leaves extract can be estimated indirectly by total phenol. Phenolic compounds in chayote leaves were the major contributor in FRAP capacity and DPPH scavenging activity
ix
II.8 Spektrofotometri UV-sinar tampak ... 11
BAB III Metodologi Penelitian ... 13
BAB IV Percobaan IV.1 Bahan ... 15
IV.2 Alat ... 15
x
IV.4 Karakterisasi Simplisia ... 16
IV.5 Ekstraksi ... 17
IV.6 Penapisan Fitokimia Ekstrak ... 17
IV.7 Penetapan Bobot Jenis Ekstrak ... 17
IV.8 Pemantauan Ekstrak... 17
IV.9 Uji Kualitatif Aktivitas Antioksidan dengan Metode FRAP ... 17
IV.10 Uji Kualitatif Aktivitas Antioksidan dengan Metode Peredaman Radikal Bebas DPPH ... 18
IV.11 Uji Kuantitatif Antioksidan dengan Metode FRAP ... 18
IV.12 Penetapan EC50 Kapasitas FRAP... 19
IV.13 Uji Kuantitatif Aktivitas Antioksidan dengan Metode Peredaman Radikal bebas DPPH... 19
IV.14 Penetapan IC50 Peredaman Radikal Bebas DPPH ... 20
IV.15 Penetapan Fenol Total ... 20
IV.16 Penetapan Flavonoid Total ... 21
IV.17 Penetapan Karotenoid Total ... 21
IV.18 Analisis Statistik ... 22
BAB V Hasil dan Pembahasan V.1 Hasil Determinasi Dan Penyiapan Bahan Uji ... 23
V.2 Karakterisasi Simplisia ... 23
V.3 Uji Kualitatif Aktivitas Antioksidan ... 27
V.4 Uji Kuantitatif Aktivitas Antioksidan ... 29
V.5 Penetapan Fenol Total, Flavonoid Total, dan Karotenoid Total ... 33
V.6 Korelasi Fenol Total, Flavonoid Total, dan Karotenoid Total ... 36
BAB VI Kesimpulan dan Saran VI.1 Kesimpulan ... 40
VI.2 Saran ... 40 DAFTAR PUSTAKA
xi
DAFTAR LAMPIRAN
xii
DAFTAR GAMBAR
Gambar V.1 Pemeriksaan makroskopik simplisia ... 23 Gambar V.2 Kromatogram lapis tipis pemantauan ekstrak ... 26 Gambar V.3 Kromatogram lapis tipis pemantauan ekstrak
dan aktivitas antioksidan ... 28 Gambar V.4 EC50 kapasitas FRAP ... 32
xiii
DAFTAR TABEL
Tabel V.1 Perbandingan Makroskopik Simplisia ... 23
Tabel V.2 Kadar Air, Kadar Abu Total, Kadar Sari Simplisia ... 24
Tabel V.3 Penapisan Fitokimia Simplisia ... 24
Tabel V.4 Rendemen dan Bobot Jenis Ekstrak ... 25
Tabel V.5 Penapisan Fitokimia Ekstrak ... 25
Tabel V.6 Aktivitas Antioksidan Ekstrak n-Heksana ... 30
Tabel V.7 Aktivitas Antioksidan Ekstrak Etil Asetat ... 30
Tabel V.8 Aktivitas Antioksidan Ekstrak Etanol ... 31
Tabel V.9 Fenol Total, Flavonoid Total, Karotenoid Total Ekstrak n-Heksana .... 34
Tabel V.10 Fenol Total, Flavonoid Total, Karotenoid Total Ekstrak Etil Asetat .... 35
Tabel V.11 Fenol Total, Flavonoid Total, Karotenoid Total ekstrak Etanol ... 35
xiv
DAFTAR SINGKATAN DAN LAMBANG
Singkatan Nama Penggunaan pertama kali pada
halaman
CS : Cucumis sativus 3
SE : Sechium edule 3
LA : Luffa acutangula 3
CM : Cucurbita moschata 3
MC : Momordica charantia 3
KLT : Kromatografi Lapis Tipis 10
FRAP : Ferric Reducing Antioxidant Power 2
DPPH : 2.2-difenil-1-pikrilhidrazil 2
TPTZ : 2,4,6-tri (2-piridil)-1,3,5-triazina 9
EC50 : Exhibition Concentration 19
IC50 : Inhibition Concentration 20
GAE : Gallic Acid Equivalent 21
QE : Quercetin Equivalent 21
BET : Beta caroten Equivalent 22
UV : Ultraviolet 11
nm : nanometer 6
SET : Single electron transfer 8
HAT : Hydrogen atom transfer 8
SPSS : Statistical Package for Social Science 22
ANOVA: Analysis of varian 22
LSD : Least Significant Difference 22
λ : Panjang gelombang 6
1
Bab I Pendahuluan
Indonesia merupakan negara yang memiliki sumber daya alam melimpah, salah satunya adalah keanekaragaman hayati. Ribuan spesies tanaman yang tumbuh di Indonesia telah banyak terbukti sebagai sumber bahan obat potensial. Berbagai tanaman tersebut secara empiris banyak digunakan untuk mengobati penyakit.
Perkembangan IPTEK yang semakin maju, meningkatkan kesadaran masyarakat akan arti penting kesehatan. Bahan alam tidak hanya dimanfaatkan menjadi produk obat untuk terapi pada kondisi penyakit tetapi juga digunakan dalam upaya preventif. Produk yang digunakan oleh masyarakat dalam upaya preventif paling banyak adalah antioksidan. Antioksidan banyak diformulasi menjadi suplemen maupun fungsional food yang dapat digunakan sebagai alternatif makanan sehat. Antioksidan juga banyak digunakan sebagai bahan tambahan dalam produk untuk mencegah terjadinya oksidasi zat aktif sehingga kualitas produk tetap terjaga dengan baik. Antioksidan yang sudah dikenal antara lain vitamin E, vitamin C, BHT, beta karoten (Smith, 2011).
Penapisan terhadap potensi antioksidan dari berbagai spesies tanaman telah banyak
dilakukan. Widowati, dkk (2005) serta Souri, dkk (2007) melakukan penapisan terhadap berbagai jenis spesies tanaman termasuk Cucurbitaceae meliputi buah paria, buah
2
kardenolin/bufadienol, dan flavonoid (Marliana, dkk., 2005). Ekstrak etanol dan ekstrak etil asetat daun labu siam menunjukkan aktivitas antioksidan (Riyenni, 2008).
Selain labu siam dan paria, Cucurbitaceae yang banyak tumbuh di Indonesia yaitu labu kuning, oyong, semangka, mentimun dan melon. Biji labu kuning banyak mengandung senyawa steroid/triterpenoid (Novellina, 2007), biji oyong dan daging buah mentimun mengandung senyawa alkaloid, steroid/triterpenoid (Mardianti, 2005; Ikrimah, 2006) dan bagian putih buah semangka mengandung senyawa golongan flavonoid,
steroid/triterpenoid (Listiane, 2008).
Cucurbitaceae umumnya dimanfaatkan oleh masyarakat terutama bagian daging buah, digunakan sebagai sayur, sementara daunnya jarang digunakan, padahal tidak menutup kemungkinan pada bagian inipun berkhasiat antioksidan sehingga berpotensi untuk dikembangkan menjadi fungsional food yang bernilai ekonomis tinggi.
Berdasarkan beberapa hasil telaah kimia dapat diambil garis besar bahwa bagian tanaman berupa daun, daging buah dan biji dari Cucurbitaceae mengandung senyawa golongan flavonoid, alkaloid, dan steroid/triterpenoid, dimana senyawa tersebut diduga bertanggung jawab terhadap aktivitas antioksidan yang dihasilkan. Merujuk pada hal tersebut, maka perlu dilakukan penelitian terhadap daun Cucurbitaceae dengan melakukan ekstraksi menggunakan pelarut dengan polaritas berbeda serta dilakukan pengujian menggunakan metode pengukuran yang berbeda sehingga dapat diketahui korelasi aktivitas antioksidan daun Cucurbitaceae dengan metode yang digunakan.
3
Bab II Tinjauan Pustaka
Tinjauan pustaka meliputi tinjauan botani, tinjauan kimia, tinjauan farmakologi dari tanaman, pengertian radikal bebas, antioksidan, metode ekstraksi, kromatografi dan
prinsip spektofotometri UV-sinar tampak
.
II.1 Tinjauan Botani
Berdasarkan klasifikasi menurut Cronquist (1981) sampel termasuk dalam divisi Magnoliophyta, kelas Magnoliopsida, anak kelas Dillenidae, bangsa Violales, suku Cucurbitaceae, jenis (CS) Cucumis sativus L. Mentimun, (SE) Sechium edule (jacq) swartz. Labu siam, (LA) Luffa acutangula (L) Roxburgh. Oyong, (CM) Cucurbita moschata (Duchesne ex Lamk) Duchesne ex Poiret. Labu kuning, (MC) Momordica charantia L. Paria.
II.2 Tinjauan Kimia
Biji mentimun mengandung minyak lemak, karoten. Daun mengandung kukurbitasin C,
hidroksi-4
7b-metoksikukurbita-5,23,25-trien-19-ol (Juliana, dkk, 2010). Biji mengandung asam lemak butirat, asam palmitat, asam linoleat, asam stearat (Abraham, 2009).
II.3 Tinjauan Farmakologi
Batang mentimun mempunyai aktivitas antibakteri dan anti jamur yang patogen terhadap tanaman (Jing, et al, 2010). Buah labu siam dapat memperbaiki morfologi sel darah merah (Dire, et al, 2009), mempunyai aktivitas antiepilepsi dan antidepresan dengan mekanisme mengurangi durasi fase konvulsi, memperlambat onset konvulsi,
mengurangi aktivitas lokomotor dan koordinasi muskular, mengurangi koordinasi motorik (Firdous, et al, 2012), daun labu siam dapat memperbaiki kerusakan ginjal (Mumtaz, et al., 2013). Buah oyong berkhasiat memperbaiki kerusakan hati (Jadnav, et al, 2010), antimikroba (Ismail, et al, 2010), antioksidan (Sharma, et al, 2012). Buah labu kuning segar dapat mengurangi kelelahan fisik dengan cara meningkatkan glukosa plasma dan glikogen hepatik, menurunkan level plasma laktat dan amonia (Wang, et al, 2012), memperbaiki kerusakan jaringan kulit dengan membentuk kolagen (Noubarani, et al, 2012), antidiabetes (Lai, et al, 2011), biji berkhasiat sebagai antimikroba (Aziz, et al, 2011), daun berkhasiat sebagai antikanker, antidiabetes, dan hepatoprotektor (Saha,et al, 2011). Daun paria berkhasiat sebagai antibakteri (Costa, et al, 2010), antioksidan (Olayede, et al, 2012), antidiabetes (Singh, et al, 2011), biji sebagai antispermatogenik (Patil, et al, 2011), buah sebagai antioksidan (Patel, et al, 2011 dan Lu, et al, 2012), antihiperlipidemia (Nerurkar, et al, 2010), antidiabetes (Jyothsna, et al, 2012), akar sebagai antidiabetes (Sarandan, et al, 2010), hepatoprotektor (Kumar, et al, 2008).
II.4 Radikal Bebas
Radikal bebas adalah suatu atom, atau molekul yang memiliki elektron tidak berpasangan. Umumnya radikal bebas oksigen berasal dari radikal anion superoksida
(O2), hidroksil (OH-), hidroperoksil (OOH), peroksil (ROO), alkoksil (RO), dan non
radikal bebas hidrogen peroksida (H2O2), asam hipoklorat (HOCl), ozon (O3), dan
oksigen singlet (1O2). Bentuk reaktif tersebut digolongkan sebagai reaktif oksigen
5
oksidasi membran sehingga menyebabkan akumulasi lipid peroksida, menghambat mitokondria, berikatan dengan molekul DNA, enzim dan protein sehingga menyebabkan kematian sel (Umamaheswari, et al, 2008).
Pada keadaan normal, radikal bebas dihasilkan oleh sel melalui proses oksidasi. Radikal bebas membantu tubuh kita untuk melawan zat asing yang membahayakan tubuh. Tubuh sebenarnya memproduksi antioksidan tetapi ketidakseimbangan radikal bebas dengan antioksidan yang diproduksi tubuh menyebabkan terjadinya stres oksidatif yang
memicu kerusakan jaringan. Dibutuhkan keseimbangan oksidan-antioksidan untuk mengatur fungsi sistem imun dalam menjaga integritas dan fungsi membran lipid, protein seluler, asam nukleat, serta mengatur ekspresi gen (Rohmatussolihat, 1999).
Interaksi radikal dengan komponen jaringan dapat menghasilkan radikal lain. Proses kerusakan yang ditimbulkan radikal bebas terdiri dari tahap inisiasi (proses terbentuknya radikal bebas), propagasi (radikal bebas yang terbentuk menyebabkan terbentuknya radikal bebas lain), terminasi (tahapan dimana terjadi reaksi antara radikal bebas dengan radikal bebas yang lain atau dengan peredam radikal) (Rohmatussolihat, 1999).
II.5 Antioksidan
Antioksidan merupakan senyawa yang dapat meredam radikal bebas dan mencegah terjadinya kerusakan yang diakibatkan oleh radikal bebas. Antioksidan dapat mengurangi kerusakan akibat oksidasi dengan cara netralisasi radikal bebas sebelum
6
dapat menghentikan atau memutus reaksi berantai dari radikal bebas. Antioksidan berperan dalam menetralkan radikal bebas dengan cara memberikan satu elektron pada radikal bebas sehingga menjadi non radikal (Rohmatussolihat, 1999).
Senyawa fenolik, flavonoid, tanin merupakan sumber antioksidan yang banyak diteliti. Senyawa fenol merupakan senyawa yang memiliki cincin aromatik dan mengandung gugus hidroksil. Kandungan senyawa fenolik total dapat ditetapkan secara spektrofotometri dengan menggunakan pereaksi Folin-Ciocalteu yang berisi natrium
tungstat (Na2WO4.2H2O) dan natrium molibdat (Na2MoO4.2H2O) yang berwarna
kuning intens dalam air. Adanya senyawa-senyawa pereduksi berperan pada pembentukan warna hijau dan penambahan senyawa pengoksidasi seperti bromin dapat mengembalikan warna kuning seperti semula (Prior, et al, 2005).
Metode penetapan kandungan fenolik total dengan pereaksi Folin-Ciocalteu berdasarkan adanya gugus fenol yang akan dioksidasi oleh reagen asam fosfomolibdat-tungstat
menghasilkan produk “molybdenum blue” yang berwarna biru dan dapat diukur
absorbansinya pada panjang gelombang (λ) 750 nm. Adapun reaksinya adalah sebagai berikut:
Na2WO4/Na2MoO4→ (fenol-MoW11O40)-4
Mo(IV) (kuning) + e- → Mo(V) (biru)
Metode ini cepat, sederhana, dan sensitif. Metode ini terjadi dalam suasana basa sehingga dalam penentuan kadar fenolik dengan pereaksi Folin-Ciocalteu digunakan natrium karbonat yang bertujuan untuk membentuk suasana basa (Prior, et al, 2005).
Flavonoid merupakan senyawa antioksidan alami yang ditemukan dalam berbagai makanan yang berasal dari tumbuhan yang memiliki berbagai fungsi termasuk memproduksi zat warna merah, kuning, dan ungu. Flavonoid adalah suatu metabolit
7
C6C3C6. Penamaan subgrup dan klasifikasi berdasarkan pada subsitusi pada bagian
cincin C dan posisi pada cincin B. Sebagian besar subgrup adalah flavonol, flavon, isoflavon, katekin, proantosianidin, dan antosianin.
Penetapan kadar flavonoid menggunakan metode spektrofotometri adalah berdasar pada kemampuan flavonoid untuk membentuk kompleks dengan logam Al menghasilkan warna kuning yang selanjutnya bereaksi dengan basa menjadi merah muda yang dapat diukur absorbansinya pada λ 510 nm (Zou, et al,2004).
Antioksidan dalam tubuh dikelompokkan menjadi tiga, yaitu:
a. Antioksidan Primer
Merupakan antioksidan yang diproduksi tubuh berupa enzim. Antioksidan primer bekerja untuk mencegah pembentukan senyawa radikal bebas yang baru dan mengubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal ini sempat bereaksi. Contoh antioksidan primer adalah superoksida dismutase (SOD), glutation peroksidase, peroksidase, dan katalase. Enzim SOD berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh dan pencegah peradangan karena radikal bebas.
b. Antioksidan Sekunder
Antioksidan sekunder berfungsi menangkap senyawa radikal serta memperlambat laju oksidasi. Contoh antioksidan sekunder adalah vitamin E, vitamin C, betakaroten, asam urat, bilirubin, dan albumin. Antioksidan sekunder yang diperoleh dari luar (sumber makanan), meliputi vitamin (A, C, dan E), mineral (selenium, seng, tembaga dan mangan) dan zat lain termasuk polifenol. Antioksidan sekunder, seperti asam sitrat, asam askorbat, dan esternya, sering ditambahkan pada lemak dan minyak sebagai kombinasi dengan antioksidan primer. Kombinasi tersebut dapat memberi efek sinergis sehingga menambah
8
meregenerasi antioksidan utama, (c) mengkelat atau mendeaktifkan logam prooksidan, (d) menangkap oksigen, dan (e) mengikat singlet oksigen dan mengubahnya ke bentuk yang stabil.
c. Antioksidan Tersier
Antioksidan tersier ini bekerja dengan memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh dari antioksidan tersier adalah enzim yang memperbaiki DNA pada inti sel, yakni metionin sulfoksidase dan
reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk mencegah penyakit kanker.
9
Metode pengukuran aktivitas antioksidan secara invitro pada antara lain: 1) Metode peredaman DPPH
DPPH merupakan radikal bebas yang stabil dan digunakan secara luas dalam pengukuran peredaman radikal. Difenil pikrilhidrazil yang bersifat radikal bebas bereaksi dengan antioksidan yang menyumbangkan satu elektronnya sehingga membentuk difenil pikrilhidrazil non radikal yang lebih stabil sehingga warna DPPH akan menjadi lebih terang. Perubahan warna ini yang akan diukur sebagai
absorbansi oleh spektrofotometer λ 519 nm ( Blois, 1958).
2) Metode FRAP
FRAP dapat mendeteksi senyawa dengan potensial redoks kurang dari 0,7 V. Kemampuan reduksi berhubungan dengan derajat hidroksilasi dan perpanjangan konjugasi dari polifenol. FRAP tidak dapat mendeteksi senyawa yang memiliki mekanisme aksi melalui peredaman radikal (H transfer). Seringkali nilai FRAP tidak memiliki korelasi yang baik dengan antioksidan lainnya. Kemampuan untuk mereduksi zat besi memiliki sedikit hubungan dengan proses peredaman radikal yang dimiliki oleh sebagian besar antioksidan. Mekanisme FRAP hanya berdasarkan pada transfer elektron bukan merupakan gabungan antara SET dan HAT, sehingga kombinasi dengan metode lain sangat berguna dalam membedakan mekanisme utama dari berbagai antioksidan yang berbeda (Prior, et al, 2005). Pada pH rendah, terjadi reduksi besi (III) tripiridil triazina (Fe III TPTZ) menjadi (Fe II TPTZ), yang dapat diamati berupa perubahan warna menjadi biru intens.
Perubahan ini kemudian diukur pada λ 593 nm. Perubahan absorbansi sebanding
dengan aktivitas antioksidan ( Benzie, et al, 1996).
II.6 Ekstraksi
Ekstraksi yaitu proses pemisahan zat aktif dari jaringan tanaman maupun hewan menggunakan pelarut selektif dan prosedur baku. Penggunaan prosedur baku bertujuan untuk memperoleh zat aktif secara maksimum dan mengurangi material inert dari suatu
10
kualitas akhir dari ekstrak. (Handa, 2008). Metode ekstraksi pada penelitian ini yaitu ekstraksi sinambung menggunakan Soxhlet. Simplisia dibungkus menggunakan kertas saring kemudian ditempatkan pada alat Soxhlet. Pelarut ditempatkan pada labu kemudian dipanaskan dan uap akan mengalami kondensasi pada tabung pendingin. Pelarut yang telah mengalami kondensasi akan menetes pada kantung berisi simplisia dan terjadi proses kontak. Ekstrak kemudian akan mengalir pada labu berisi pelarut.
II.7 Kromatografi
Kromatografi merupakan suatu metode yang digunakan untuk memisahkan campuran komponen berdasarkan distribusi komponen tersebut diantara dua fase, yaitu fase diam dan fase gerak. Fase diam berguna untuk mengikat komponen zat, sedangkan fase gerak berguna untuk mengangkut komponen zat lain yang tidak terikat. Oleh karena adanya sistem pengangkutan dan sistem pengikatan ini, maka suatu komponen zat dapat dipisahkan dari komponen lainnya. Pemisahan secara kromatografi melibatkan sifat fisika dari suatu molekul antara lain (1) kecenderungan molekul untuk melarut dalam cairan (kelarutan), (2) kecenderungan molekul untuk melekat pada permukaan adsorben (adsorbsi, penjerapan), (3) kecenderungan molekul untuk menguap atau berubah ke keadaan uap. Berdasarkan jenis fase gerak, kromatografi dibedakan menjadi kromatografi gas dan kromatografi cair. Fase diam yang digunakan antara lain cair, padat dan fase cair yang terikat. Mekanisme yang dikenal saat ini antara lain partisi, adsorbsi, modifikasi partisi, pertukaran ion, dan eksklusi. Teknik yang digunakan dapat berupa kolom maupun bidang datar. Pemisahan dan pemurnian kandungan kimia tumbuhan dapat dilakukan dengan menggunakan salah satu dari metode tersebut maupun gabungannya. Pemilihan metode tergantung pada sifat-sifat senyawa dari bahan yang akan dianalisis ( Gritter,et al, 1991).
Kromatografi lapis tipis (KLT) merupakan metode kromatografi cair yang paling
11
pada KLT antara lain silika gel, alumina, kiselgur, selulosa dan air. Larutan sampel ditotolkan pada lempeng sekitar 5-20 µL kemudian dilakukan pengembangan menggunakan pelarut yang cocok. Pada saat pengembangan terjadi proses adsorbsi atau partisi, tergantung jenis KLT yang digunakan. (Gritter, et al, 1991)
II.8 Spektrofotometri UV-sinar tampak
Spektrofotometri UV-sinar tampak adalah teknik analisis spektroskopik dengan sumber radiasi elektromagnetik (REM) ultraviolet dekat (190-380 nm) dan sinar tampak
(380-780 nm) dengan menggunakan instrumen spektrofotometer. Spektrofotometri UV-sinar tampak melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV-sinar tampak lebih banyak dipakai untuk analisis kuantitatif dibandingkan kualitatif. Absorbsi cahaya UV-sinar tampak mengakibatkan transisi elektronik, yaitu perpindahan elektron-elektron dari orbital keadaan dasar berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Ketika elektron kembali pada keadaan dasar akan melepaskan foton yang akan ditangkap oleh detektor dan terbaca sebagai absorbansi. Inilah yang menjadi dasar dari spektrofotometri UV-sinar tampak. Molekul yang menyerap radiasi dalam daerah UV-UV-sinar tampak akan mengalami transisi elektron, berupa eksitasi ke tingkat energi yang lebih tinggi. Panjang gelombang dimana terjadi eksitasi elektronik yang memberikan absorban maksimum disebut sebagai panjang gelombang maksimum ( λ max). Penentuan panjang gelombang maksimum dapat digunakan untuk identifikasi molekul yang bersifat karakteristik sebagai data sekunder. Molekul-molekul yang memerlukan lebih banyak energi untuk promosi elektron akan menyerap cahaya pada panjang gelombang yang lebih pendek. Molekul yang menyerap energi lebih sedikit akan menyerap cahaya pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam daerah tampak memiliki elektron yang lebih mudah dipromosikan daripada senyawa yang
12
Berdasarkan uraian di atas diketahui bahwa daging buah dan biji Cucurbitaceae mengandung senyawa golongan flavonoid, alkaloid, dan steroid/triterpenoid, dimana senyawa tersebut diduga bertanggung jawab terhadap aktivitas antioksidan. Antioksidan menyebabkan terjadinya reduksi besi (III) tripiridil triazina (Fe III TPTZ) menjadi (Fe II TPTZ), yang dapat diamati berupa perubahan warna menjadi biru intens. Antioksidan akan mendonorkan elektron atau hidrogen pada DPPH sehingga warna DPPH akan menjadi lebih terang. Perubahan warna ini yang akan diukur sebagai absorbansi oleh spektrofotometer. Dengan demikian ekstrak daun Cucurbitaceae diduga mempunyai
13
Bab III Metodologi Penelitian
Tahapan penelitian meliputi penyiapan bahan, karakterisasi simplisia, penapisan fitokimia simplisia, ekstraksi, pemekatan ekstrak, penapisan fitokimia ekstrak, penetapan bobot jenis ekstrak, pemantauan ekstrak, penentuan aktivitas antioksidan dengan metode FRAP dan DPPH, penetapan fenol total, flavonoid total dan karotenoid total dalam ekstrak serta pengolahan data secara statistik.
Penyiapan bahan meliputi pengumpulan bahan, determinasi tanaman, dan pengolahan bahan. Pengolahan bahan meliputi sortasi basah, pencucian, pengeringan dan penggilingan menjadi serbuk simplisia. Pengeringan dilakukan dalam lemari pengering dengan suhu sekitar 45°C. Bahan dikumpulkan dari daerah Soreang Kabupaten Bandung Jawa Barat (CS, LA, MC) dan Garut Jawa Barat (SE, CM) pada Desember 2012 sampai Februari 2013. Determinasi dilakukan di Herbarium Bandungense, Sekolah Ilmu dan Teknologi Hayati, ITB dengan tujuan untuk memastikan kebenaran identitas bahan.
Karakterisasi simplisia meliputi pemeriksaan makroskopik, penapisan fitokimia, penetapan kadar air, penetapan kadar abu total, penetapan kadar sari larut air, dan penetapan kadar sari larut etanol. Penapisan fitokimia dilakukan untuk mengetahui
golongan senyawa yang terkandung dalam simplisia, yaitu meliputi golongan alkaloid, flavonoid, saponin, tanin, kuinon dan steroid/triterpenoid.
Simplisia diekstraksi dengan metode sinambung menggunakan Soxhlet dan menggunakan pelarut dengan kepolaran meningkat, berturut-turut yaitu n-heksana, etil asetat, dan etanol. Ekstrak yang diperoleh kemudian dipekatkan menggunakan rotavapor kemudian dipantau secara KLT menggunakan penampak bercak sinar UV λ
254 nm, sinar UV λ 366 nm, H2SO4 10% dalam metanol, FRAP 0,8% dalam metanol
14
13
Bab III Metodologi Penelitian
Tahapan penelitian meliputi penyiapan bahan, karakterisasi simplisia, penapisan fitokimia simplisia, ekstraksi, pemekatan ekstrak, penapisan fitokimia ekstrak, penetapan bobot jenis ekstrak, pemantauan ekstrak, penentuan aktivitas antioksidan dengan metode FRAP dan DPPH, penetapan fenol total, flavonoid total dan karotenoid total dalam ekstrak serta pengolahan data secara statistik.
Penyiapan bahan meliputi pengumpulan bahan, determinasi tanaman, dan pengolahan bahan. Pengolahan bahan meliputi sortasi basah, pencucian, pengeringan dan penggilingan menjadi serbuk simplisia. Pengeringan dilakukan dalam lemari pengering dengan suhu sekitar 45°C. Bahan dikumpulkan dari daerah Soreang Kabupaten Bandung Jawa Barat (CS, LA, MC) dan Garut Jawa Barat (SE, CM) pada Desember 2012 sampai Februari 2013. Determinasi dilakukan di Herbarium Bandungense, Sekolah Ilmu dan Teknologi Hayati, ITB dengan tujuan untuk memastikan kebenaran
identitas bahan.
Karakterisasi simplisia meliputi pemeriksaan makroskopik, penapisan fitokimia, penetapan kadar air, penetapan kadar abu total, penetapan kadar sari larut air, dan penetapan kadar sari larut etanol. Penapisan fitokimia dilakukan untuk mengetahui golongan senyawa yang terkandung dalam simplisia, yaitu meliputi golongan alkaloid, flavonoid, saponin, tanin, kuinon dan steroid/triterpenoid.
14
254 nm, sinar UV λ 366 nm, H2SO4 10% dalam metanol, FRAP 0,8% dalam metanol
dan DPPH 0,2 % dalam metanol.
15
Bab IV Percobaan
IV.1 Bahan
Simplisia daun mentimun, labu siam, oyong, labu kuning, paria, n-heksana, etil asetat, etanol, metanol, DPPH, 2,4,6-tri (2-piridil)-1,3,5-triazina, asam sulfat, lempeng KLT
silika gel 60 GF254, asam klorida, serbuk magnesium, amil alkohol, anhidrida asetat,
asam nitrat pekat, kloroform, toluena, kertas saring, pereaksi Dragendorff, pereaksi Mayer, aluminium (III) klorida, besi (III) klorida, natrium hidroksida, pereaksi Liebermann-Burchard, natrium asetat, natrium karbonat, asam sitrat, asam borat, asam format, pereaksi Folin-Ciocalteu, asam galat, kuersetin, beta karoten, kalium persulfat, kertas perkamen.
IV.2 Alat
Lemari pengering simplisia, mesin penggiling simplisia, neraca analitik, seperangkat alat Soxhlet, alat gelas, rotavapor, seperangkat alat distilasi, oven, kompor listrik, spatula, cawan penguap, krus, kuvet, lampu UV (Camag), spektrofotometer UV-sinar tampak (Hewlett Packard 8435), tanur.
IV.3 Pengumpulan dan Penyiapan Simplisia
Daun Cucurbitaceae yaitu mentimun (disebut CS), oyong (LA), paria (MC) dikoleksi dari daerah Banjaran Soreang Bandung, sedangkan labu siam (SE) dan labu kuning (CM) dikoleksi dari Garut, Provinsi Jawa Barat. Sampel diambil pada bulan Desember 2012 sampai Februari 2013.
16
Daun yang telah dikumpulkan disortir, dicuci menggunakan air mengalir, ditiriskan kemudian dikeringkan. Simplisia yang telah kering diperkecil ukurannya menggunakan mesin penggiling kemudian disimpan pada wadah tertutup baik.
IV.4 Karakterisasi Simplisia
Karakterisasi simplisia yang dilakukan meliputi karakterisasi makroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar sari dan penapisan fitokimia simplisia.
Pemeriksaan makroskopik meliputi karakterisasi bentuk, warna, dan tekstur daun. Pemeriksaan juga dilakukan dengan membuat foto bagian tanaman yang digunakan dalam penelitian yang dilengkapi dengan skala.
Penetapan kadar air memiliki tujuan untuk memberikan batasan minimal atau rentang besarnya kandungan air dalam bahan.
Kadar abu memiliki hubungan dengan kandungan mineral dalam suatu bahan. Mineral
yang terdapat dalam suatu bahan dapat berupa garam organik dan anorganik. Kadar abu
total menyatakan jumlah abu fisiologis dan nonfisiologis bila simplisia dipijar pada suhu tinggi sampai senyawa organik hilang sehingga abu merupakan residu anorganik hasil pengabuan.
Kadar sari digunakan untuk mengetahui jumlah kandungan senyawa kimia dalam sari simplisia. Parameter kadar sari ditetapkan sebagai parameter uji bahan baku obat tradisional karena jumlah kandungan senyawa kimia dalam sari simplisia akan berkaitan erat dengan reprodusibilitasnya dalam aktivitas farmakologi simplisia tersebut.
17 IV.5 Ekstraksi
Ekstraksi dilakukan secara sinambung menggunakan Soxhlet. Pelarut yang digunakan secara berturut-turut yaitu n-heksana, etil asetat, dan etanol, sehingga diperoleh 5 ekstrak n-heksana (disebut CS1, SE1, LA1, CM1, MC1), 5 ekstrak etil asetat (CS2, SE2, LA2, CM2, MC2) dan 5 ekstrak etanol (CS3, SE3, LA3, CM3, MC3). Ekstrak yang diperoleh diuapkan menggunakan rotavapor sampai diperoleh ekstrak kental.
IV.6 Penapisan Fitokimia Ekstrak
Penapisan fitokimia ekstrak bertujuan untuk mendeteksi kandungan metabolit sekunder golongan alkaloid, flavonoid, fenol, tanin, karotenoid, steroid/triterpenoid, kuinon dan saponin yang terkandung dalam masing-masing ekstrak daun Cucurbitaceae.
IV.7 Penetapan Bobot Jenis Ekstrak
Penetapan bobot jenis ekstrak dilakukan dengan menggunakan vial. Vial kosong ditimbang bobotnya (wo). Kemudian ke dalam vial tersebut dimasukkan air 10 mL,
diberi tanda batas tara. Ke dalam vial tersebut dimasukkan ekstrak 1% sampai tanda batas tara dan ditimbang bobotnya (wE).
IV.8 Pemantauan Ekstrak
Masing-masing ekstrak dipantau secara kromatografi lapis tipis dengan variasi fase gerak. Ekstrak n-heksana dan ekstrak etil asetat menggunakan fase gerak n-heksana-etil asetat (7:3), ekstrak etanol dengan fase gerak etil asetat-metanol-air (19:1:1). Penampak bercak yang digunakan adalah asam sulfat 10% dalam metanol, sinar UV λ 254 nm, λ 366 nm.
IV.9 Uji Kualitatif Aktivitas Antioksidan dengan Metode FRAP
18
mendeteksi adanya komponen antioksidan yang bereaksi positif terhadap penampak bercak FRAP pada masing-masing ekstrak.
Sebanyak 10 L ekstrak dengan konsentrasi 1% ditotolkan pada pelat KLT silika gel 60
GF254 kemudian dikembangkan dengan fase gerak yang sesuai. Pelat disemprot
penampak bercak FRAP 0,8%. Komponen ekstrak yang memiliki aktivitas antioksidan berwarna biru dengan latar belakang putih.
IV.10 Uji Kualitatif Aktivitas Antioksidan dengan Metode Peredaman Radikal Bebas DPPH
Uji kualitatif aktivitas antioksidan dilakukan secara KLT dengan fase gerak yang sesuai untuk setiap ekstrak dan penampak bercak DPPH 0,2% dalam metanol. Hal ini bertujuan untuk mendeteksi adanya komponen antioksidan yang bereaksi positif terhadap penampak bercak DPPH pada masing-masing ekstrak.
Sebanyak 10 L ekstrak dengan konsentrasi 1% ditotolkan pada pelat KLT silika gel 60
GF254 kemudian dikembangkan dengan fase gerak yang sesuai. Pelat disemprot
penampak bercak DPPH 0,2% dalam metanol. Komponen ekstrak yang memiliki aktivitas antioksidan berwarna kuning dengan latar belakang ungu.
IV.11 Uji Kuantitatif Aktivitas Antioksidan dengan Metode FRAP
Pada pH rendah, terjadi reduksi besi (III) tripiridil triazina (Fe III TPTZ) menjadi besi (II) tripiridil triazina (Fe II TPTZ), yang dapat diamati berupa perubahan warna menjadi biru intens. Perubahan ini kemudian diukur pada λ 593 nm. Perubahan absorbansi sebanding dengan aktivitas antioksidan(Benzi, et al, 1996).
Sampel dilarutkan dalam metanol dengan konsentrasi 50 g/mL kemudian ditambah dengan larutan FRAP dengan konsentrasi 50 g/mL (perbandingan volume 1:1).
19
Aktivitas antioksidan diukur sebagai persen kapasitas sampel uji dihitung dengan menggunakan rumus:
% Kapasitas = (1 - TS ) x 100
Keterangan : % kapasitas = % kapasitas FRAP
AS = Absorbansi larutan FRAP setelah penambahan sampel uji
As = - log Ts
IV.12 Penetapan EC50 Kapasitas FRAP
Dibuat lima variasi konsentrasi sampel uji/pembanding, kemudian diambil 2 mL dicampurkan dengan 2 mL FRAP (perbandingan volume 1:1). Campuran tersebut diinkubasi selama 30 menit dan absorbansi diukur pada λ 593 nm. Untuk menentukan EC50 diperlukan persamaan regresi linier dari kurva kalibrasi, dengan persentase
kapasitas sebagai sumbu y dan konsentrasi sampel uji/pembanding sebagai sumbu x. EC50 dihitung dengan cara memasukkan nilai 50% ke dalam persamaan regresi linier
sebagai y, kemudian dihitung nilai x sebagai konsentrasi EC50. Asam askorbat
digunakan sebagai pembanding.
IV.13 Uji Kuantitatif Aktivitas Antioksidan dengan Metode Peredaman Radikal Bebas DPPH
Pengukuran aktivitas antioksidan dengan metode peredaman radikal bebas DPPH bertujuan untuk mengukur kapasitas antioksidan total pada masing-masing ekstrak yaitu ekstrak n-heksana, etil asetat dan etanol secara spektrofotometri UV- sinar tampak (Blois, 1958).
DPPH merupakan radikal bebas yang stabil dan digunakan secara luas dalam
20
Sampel dilarutkan dalam metanol dengan konsentrasi 50 g/mL kemudian ditambah dengan larutan DPPH dengan konsentrasi 50 g/mL (perbandingan volume 1:1).
Campuran tersebut diinkubasi selama 30 menit dan absorbansi diukur pada λ 517 nm.
Aktivitas antioksidan diukur sebagai persen penurunan absorbansi DPPH pada sampel uji dihitung menggunakan rumus:
Keterangan : Q = Persentase penurunan absorbansi DPPH (%) Ao = Absorbansi larutan DPPH
As = Absorbansi larutan DPPH setelah penambahan sampel uji
IV.14 Penetapan IC50 Peredaman Radikal Bebas DPPH
Dibuat lima variasi konsentrasi sampel uji/pembanding, kemudian diambil 2 mL dicampurkan dengan 2 mL DPPH (perbandingan volume 1:1). Campuran tersebut diinkubasi selama 30 menit dan absorbansi diukur pada λ 517 nm. Untuk menentukan IC50 diperlukan persamaan regresi linier dari kurva kalibrasi, dengan persentase
peredaman sebagai sumbu y dan konsentrasi sampel uji/pembanding sebagai sumbu x. IC50 dihitung dengan cara memasukkan nilai 50% ke dalam persamaan regresi linier
sebagai y, kemudian dihitung nilai x sebagai konsentrasi IC50. Asam askorbat digunakan
sebagai pembanding.
IV.15 Penetapan Fenol Total dalam Ekstrak
21 total dihitung dengan menggunakan persamaan regresi linier dari kurva kalibrasi asam galat dan dihitung sebagai asam galat ekuivalen per 100 gram ekstrak (g GAE/100 g).
IV.16 Penetapan Flavonoid Total dalam Ekstrak
Sebanyak 10 mg kuersetin ditimbang dan dilarutkan dalam 100 mL metanol sebagai larutan stok. Kemudian dibuat pengenceran kuersetin dengan konsentrasi 40-160 g/mL
sebagai larutan pembanding. Sebanyak 0,5 mL larutan pembanding ditambah dengan 1,5 mL metanol, 0,1 mL aluminium (III) klorida 10%, 0,1 mL natrium asetat 1M dan 2,8 mL aquadest kemudian diinkubasi selama 30 menit. Absorbansi larutan pembanding diukur dengan spektrofotometer UV- sinar tampak pada λ 415 nm, dibuat kurva kalibrasi sehingga diperoleh persamaan regresi linear (Chang, et al, 2002).
Larutan uji terdiri dari ekstrak n-heksana konsentrasi 1000 g/mL, ekstrak etil asetat 1000 g/mL dan ekstrak etanol 1000-8000 g/mL, dilarutkan dalam metanol. Sebanyak 0,5 mL larutan uji ditambahkan dengan 1,5 mL metanol, 0,1 mL aluminium (III) klorida 10%, 0,1 mL natrium asetat 1 M, dan 2,8 mL aquadest kemudian diinkubasi selama 30 menit. Absorbansi larutan uji diukur dengan spektrometer UV- sinar tampak pada λ 415 nm. Flavonoid total dihitung dengan menggunakan persamaan regresi linier dari kurva kalibrasi kuersetin dan dihitung sebagai kuersetin ekuivalen per 100 gram ekstrak (g QE/100 g).
IV.17 Penetapan Karotenoid Total dalam Ekstrak
Penetapan karotenoid total dilakukan dengan melarutkan sampel uji dan pembanding
beta karoten dalam n-heksana. Larutan beta karoten dibuat dengan konsentrasi 10-40
g/mL. Absorbansi larutan diukur menggunakan spektofotometer UV- sinar tampak
22
Larutan uji dibuat terdiri dari ekstrak n-heksana konsentrasi 100-500 g/mL, ekstrak etil asetat 1000-5000 g/mL dan ekstrak etanol 5000-35000 g/mL, dilarutkan dalam n-heksana.
Sebanyak 2 mL sampel uji diukur absorbansi pada λ 470 nm. Karotenoid total dihitung dengan menggunakan persamaan regresi linier dari kurva kalibrasi beta karoten dan dihitung sebagai beta karoten ekuivalen per 100 gram ekstrak (g BET/100 g).
IV.18 Analisis Statistik
23
Bab V Hasil dan Pembahasan
V.1 Hasil Determinasi dan Penyiapan Bahan Uji
Hasil determinasi dari Herbarium Bandungense Sekolah Ilmu dan Teknologi Hayati, ITB menunjukkan bahwa jenis tumbuhan adalah Cucumis sativus L.(CS), Sechium edule (Jacq) Swartz (SE), Luffa acutangula (L) Roxburgh (LA), Cucurbita moschata (Duchesne ex Lamk) Duchesne ex Poiret (CM), Momordica charantia L (MC). Bahan uji disortasi, dikeringkan dilemari pengering, kemudian digiling menjadi serbuk.
V.2 Karakterisasi Simplisia
Karakterisasi simplisia yang dilakukan meliputi karakterisasi makroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar sari dan penapisan fitokimia simplisia. Hasil karakterisasi dapat dilihat pada Gambar V.1, Tabel V.1, Tabel V.2, Tabel V.3
Gambar V.1. Pemeriksaan makroskopik simplisia CS (mentimun), SE (labu siam), LA (oyong), CM (labu kuning), MC (paria)
Tabel V.1. Perbandingan Makroskopik Simplisia Daun Cucurbitaceae
Sampel Bentuk Warna Ujung Permukaan Tekstur
CS Menyirip Hijau terang Meruncing Rata Kasar
SE Menyirip Hijau terang Meruncing Rata Halus
LA Menyirip Hijau terang Lebar Bergelombang Kasar
CM Menyirip Hijau gelap Lebar Bergelombang Kasar
MC Menjari Hijau terang Meruncing Bergelombang Halus
Keterangan: CS (mentimun), SE (labusiam), LA (oyong), CM (labu kuning), MC (paria)
(CS) (SE) (LA) (CM) (MC)
24
Tabel V.2. Kadar Air, Kadar Abu Total, Kadar Sari Simplisia Daun Cucurbitaceae
Simplisia Kadar air
Keterangan: CS (mentimun), SE (labu siam), LA (oyong), CM (labu kuning), MC (paria)
Tabel V.3. Penapisan Fitokimia Simplisia Daun Cucurbitaceae
Golongan Simplisia
Keterangan: CS (mentimun), SE (labu siam), LA (oyong), CM (labu kuning), MC (paria)
Ekstraksi simplisia dilakukan secara sinambung dengan panas menggunakan Soxhlet. Simplisia dibungkus dengan kertas saring kemudian ditempatkan pada alat Soxhlet. Pelarut ditempatkan pada labu kemudian dipanaskan dan uap akan mengalami kondensasi pada tabung pendingin. Pelarut yang telah mengalami kondensasi akan menetes pada kertas saring berisi simplisia dan terjadi proses kontak. Ekstrak kemudian akan mengalir pada labu berisi pelarut (Handa, 2008).
25
Tabel V.4. Rendemen dan Bobot Jenis Ekstrak Daun Cucurbitaceae
Sampel Rendemen (% v/b) Bobot jenis ekstrak 1% (g/mL)
n-Heksana Etil asetat Etanol n-Heksana Etil asetat Etanol
CS 4,02 2,63 8,17 0,664 0,864 0,754
SE 2,75 0,92 5,64 0,644 0,849 0,753
LA 4,09 1,93 12,23 0,658 0,861 0,750
CM 3,43 1,53 5,64 0,642 0,862 0,789
MC 1,35 4,24 11,16 0,644 0,864 0,771
Keterangan: CS (mentimun), SE (labu siam), LA (oyong), CM (labu kuning), MC (paria)
Tabel V.5. Penapisan Fitokimia Ekstrak Daun Cucurbitaceae
Ekstrak Sampel
Keterangan: CS (mentimun), SE (labusiam), LA (oyong), CM (labu kuning), MC (paria)
26
1 2 3 4 5 5
1 2 3 4 5 1 2 3 4 5
1 2 3 4 5 1 2 3 4 5 1 2 3 4 5
i ii iii
A
i ii iii
A
i ii iii
B
i ii iii
B
i ii iii
C
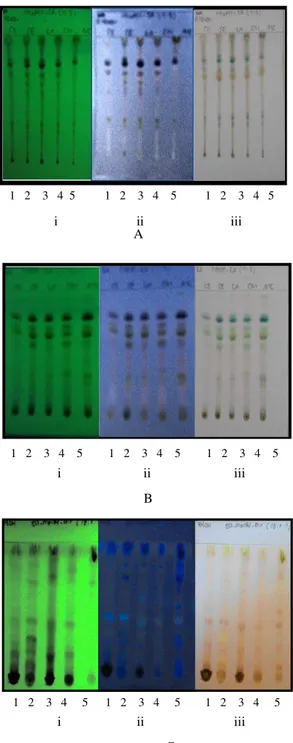
Gambar V.2. Kromatogram lapis tipis pemantauan ekstrak, fase diam silika gel 60 GF254, (A) ekstrak n-heksana, fase gerak n-heksana – etil asetat (7:3), (B) ekstrak etil asetat, fase gerak n-heksana – etil asetat (7:3), (C) ekstrak etanol, fase gerak etil asetat-metanol-air (19 : 1:1) (i) di bawah sinar UV λ 254 nm, (ii) di
bawah sinar UV λ 366 nm, (iii) disemprot dengan H2SO4 10%,
1(CS/mentimun), 2 (SE/labu siam), 3 (LA/oyong), 4 (CM/labu kuning), 5 (MC/paria)
27
V.3 Uji Kualitatif Aktivitas Antioksidan Ekstrak dengan Penampak Bercak DPPH, Besi (III) Klorida, Sitroborat, dan FRAP
Untuk mengetahui peran senyawa golongan flavonoid dan fenolik dalam ekstrak daun Cucurbitaceae terhadap FRAP dan peredaman radikal DPPH, dilakukan uji kualitatif aktivitas antioksidan ekstrak dengan membandingkan hasil KLT menggunakan penampak bercak DPPH 0,2 % dalam metanol, FeCl3 10% dalam metanol, sitroborat,
dan FRAP 0,8%. Komponen antioksidan di dalam ekstrak yang bereaksi positif dengan
DPPH berupa bercak berwarna kuning dengan latar belakang ungu. Komponen antioksidan yang bereaksi positif terhadap FeCl3 10% berupa bercak berwarna dengan
latar belakang kuning. Komponen antioksidan yang bereaksi positif terhadap sitroborat berupa florosensi kebiruan atau kehijauan di bawah sinar UV 366 nm, dan komponen
antioksidan yang bereaksi positif terhadap FRAP 0,8% berupa bercak berwarna biru dengan latar belakang putih. Hasil uji kualitatif aktivitas antioksidan ekstrak dengan penampak bercak DPPH 0,2%, FeCl3 10%, sitroborat dan FRAP 0,8% dapat dilihat
pada Gambar V.3.
Komponen ekstrak n-heksana, etil asetat dan etanol yang berperan pada FRAP belum tentu sama dengan komponen yang berperan peredaman radikal DPPH. Pada ekstrak n-heksana terdeteksi senyawa golongan fenol dan flavonoid. Fenol sampel CS tidak berperan pada FRAP maupun DPPH. Fenol sampel SE, LA, CM, MC tidak berperan pada FRAP tetapi berperan pada DPPH. Flavonoid sampel CS berperan pada FRAP dan pada DPPH. Flavonoid sampel SE, LA, CM, MC tidak berperan pada FRAP tetapi berperan pada DPPH. Dengan demikian pada sampel CS, yang berperan pada FRAP maupun DPPH merupakan senyawa golongan flavonoid. Untuk sampel SE, LA, CM, MC yang berperan pada FRAP bukan golongan fenol maupun flavonoid, sedangkan
28
29
Pada ekstrak etil asetat terdeteksi senyawa golongan fenol dan flavonoid. Kedua senyawa tersebut tidak berperan pada FRAP tetapi berperan dalam peredaman DPPH. Hal ini sesuai dengan penelitian yang dilakukan oleh Patel, et al (2011) yang menyatakan bahwa aktivitas peredaman diduga karena adanya gugus hidroksi yang merupakan komponen utama dalam peredaman radikal.
Pada ekstrak etanol terdeteksi senyawa golongan fenol dalam semua sampel sedangkan flavonoid terdeteksi dalam sampel SE, LA dan CM. Fenol sampel CS, CM dan MC tidak berperan pada FRAP maupun DPPH. Fenol sampel SE tidak berperan pada FRAP tetapi berperan pada DPPH. Fenol sampel LA berperan pada FRAP dan DPPH. Flavonoid sampel SE tidak berperan pada FRAP tetapi berperan pada DPPH. Flavonoid LA berperan pada FRAP dan DPPH. Flavonoid CM dan MC tidak berperan pada FRAP maupun DPPH.
V.4 Uji Kuantitatif Aktivitas Antioksidan Ekstrak n-Heksana, Etil Asetat dan Etanol Daun Cucurbitaceae
FRAP dapat mendeteksi senyawa dengan potensial redoks kurang dari 0,7 V. Kemampuan reduksi berhubungan dengan derajat hidroksilasi dan perpanjangan konjugasi dari polifenol. FRAP tidak dapat mendeteksi senyawa yang memiliki mekanisme aksi melalui peredaman radikal (H transfer). Reaksi pada pH rendah mengurangi potensi ionisasi yang mendorong transfer elektron dan meningkatkan potensi redoks. Mekanisme FRAP hanya berdasarkan pada transfer elektron bukan merupakan gabungan antara single electron transfer (SET) dan hydrogen atom transfer (HAT) (Prior, et al, 2005).
30
Aktivitas antioksidan, EC50, IC50 ekstrak daun Cucurbitaceae menggunakan pereaksi
FRAP dan DPPH dapat dilihat pada Tabel V.6, Tabel V.7, Tabel V.8, Gambar V.4, Gambar V.5.
Tabel V.6 Aktivitas Antioksidan Ekstrak n-Heksana Daun Cucurbitaceae dengan Metode FRAP dan DPPH
Hasil uji aktivitas antioksidan ekstrak n-heksana dapat dilihat bahwa aktivitas antioksidan tertinggi dengan metode FRAP ditunjukkan oleh sampel MC1 (4,15%) dan DPPH tertinggi ditunjukkan oleh sampel CS1 (14,73%). Data aktivitas peredaman DPPH dan FRAP dianalisis secara statistik ANOVA satu arah dengan metode LSD
(Least Significant Difference) untuk mengetahui perbedaan bermakna antar ekstrak pada p<0,05. Hasil pengolahan data secara statistik menunjukkan bahwa pada aktivitas FRAP tidak terdapat perbedaan bermakna antara CS1 dan CM1 tetapi keduanya menunjukkan perbedaan bermakna dengan SE1, LA1, MC, sedangkan pada aktivitas peredaman DPPH terdapat perbedaan bermakna pada sampel CS1, SE1, LA1, CM1, dan MC1 (p<0,05).
Tabel V.7. Aktivitas Antioksidan Ekstrak Etil Asetat Daun Cucurbitaceae dengan Metode FRAP dan DPPH
31
Hasil uji aktivitas antioksidan ekstrak etil asetat dapat dilihat bahwa aktivitas antioksidan tertinggi dengan metode FRAP ditunjukkan oleh sampel SE2 (4,54%) sedangkan DPPH tertinggi ditunjukkan oleh sampel LA2 (39,11%). Data aktivitas FRAP dan peredaman DPPH dianalisis secara statistik ANOVA satu arah dengan metode LSD (Least Significant Difference) untuk mengetahui perbedaan bermakna antar ekstrak pada p<0,05. Hasil pengolahan data secara statistik menunjukkan bahwa
pada aktivitas FRAP tidak terdapat perbedaan bermakna antara CS2 dan CM2 tetapi keduanya menunjukkan perbedaan bermakna dengan SE2, LA2, MC2 sedangkan pada peredaman DPPH terdapat perbedaan bermakna pada sampel CS2, SE2, LA2, CM2, dan MC2 (p<0,05).
Tabel V.8. Aktivitas Antioksidan Ekstrak Etanol Daun Cucurbitaceae dengan Metode FRAP dan DPPH
Hasil uji aktivitas antioksidan ekstrak etanol dapat dilihat bahwa aktivitas antioksidan
32
Kekuatan antioksidan ekstrak dapat dilihat dari EC50 maupun IC50. EC50 kapasitas
FRAP dan IC50 peredaman DPPH setiap ekstrak dibandingkan dengan EC50 dan IC50
senyawa pembanding. Pada penelitian ini pembanding yang digunakan adalah vitamin C. EC50 dan IC50 berbanding terbalik dengan kemampuan ekstrak sebagai antioksidan.
Ekstrak yang memiliki nilai EC50 maupun IC50 rendah berarti mempunyai kapasitas
antioksidan tinggi.
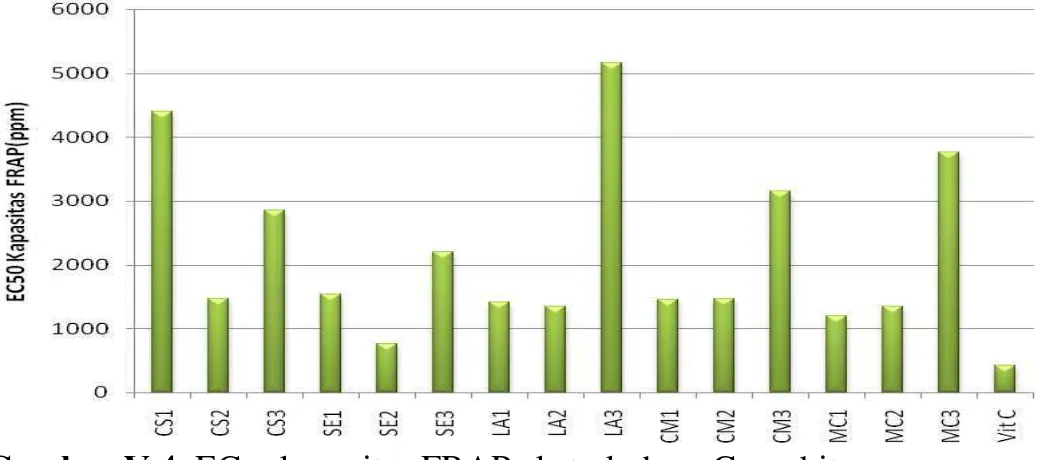
Gambar V.4. EC50 kapasitas FRAP ekstrak daun Cucurbitaceae
EC50 kapasitas FRAP merupakan konsentrasi sampel atau pembanding yang dapat
meningkatkan 50% kapasitas FRAP. SE2 memiliki EC50 kapasitas FRAP paling rendah
yaitu 795 ppm, sedangkan vitamin C memiliki EC50 kapasitas FRAP 418 ppm. Dengan
demikian dapat dilihat bahwa kapasitas antioksidan SE2 dengan metode FRAP adalah setengah dari kapasitas antioksidan vitamin C.
33
IC50 peredaman DPPH merupakan konsentrasi sampel atau pembanding yang dapat
meredam 50% DPPH. IC50 paling kecil adalah sampel LA3 yaitu 73 ppm, merupakan
antioksidan kuat sedangkan IC50 vitamin C 6 ppm. Kekuatan antioksidan LA3 adalah
seperduabelas dari vitamin C sedangkan IC50 paling besar adalah sampel MC3 yaitu
4895 ppm. Hasil ini tidak sejalan dengan penelitian yang dilakukan oleh Lu, et al (2012) terhadap beberapa varietas buah paria dimana ekstrak metanol buah paria yang masih
hijau (kultivar N) memiliki IC50 181 ppm. Sampel yang memiliki EC50 atauIC50 < 50
ppm, merupakan antioksidan yang sangat kuat, 50-100 ppm antioksidan kuat, 101-150 ppm antioksidan sedang, sementara EC50 atau IC50 > 150 ppm antioksidan lemah (Blois,
1958).
V.5 Penetapan Fenol Total, Flavonoid Total dan Karotenoid Total
Penetapan fenol total dilakukan dengan metode Pourmorad. Dalam metode ini, larutan sampel dan pembanding asam galat dilarutkan dalam metanol, kemudian ditambahkan larutan Folin Ciocalteu sebagai pembentuk kompleks dengan senyawa fenolik dan selanjutnya ditambahkan larutan natrium karbonat yang membentuk suasana basa sehingga terjadi reaksi reduksi Folin- Ciocalteu dengan gugus hidroksi dari senyawa yang terdapat dalam sampel uji dan pembanding, kemudian diinkubasi selama 15 menit. Waktu inkubasi selama 15 menit adalah waktu efektif di mana reaksi reduksi berjalan sempurna (Pourmorad, et al, 2006).
Penetapan fenol total dengan menggunakan pereaksi Folin- Ciocalteu berdasarkan pada kemampuan gugus fenolik untuk mereduksi kompleks fosfotungstat-fosfomolibdat dalam pereaksi Folin- Ciocalteu yang terjadi dalam kondisi basa (penambahan natrium karbonat). Proses reduksi ini akan mengakibatkan terjadinya kompleks warna biru yang diukur dengan spektrofotometri UV-sinar tampak(Arbianti, 2007).
34
ditambahkan larutan aluminium klorida sebagai pembentuk kompleks dengan senyawa flavonoid (Chang, et al, 2002).
Pereaksi aluminium klorida digunakan untuk mendeteksi gugus hidroksi dan keton yang bertetangga dan gugus ortho-hidroksi, karena akan terjadi pembentukan kompleks antara aluminium klorida dan kedua gugus tersebut. Perbedaannya adalah kompleks yang terjadi antara aluminium klorida dan gugus hidroksi-keto bersifat tahan asam, sedangkan kompleks antara aluminium klorida dan ortho-hidroksi tidak tahan terhadap
asam (Markham, 1981).
Data kandungan fenol total, flavonoid total dan karotenoid total dianalisis secara statistik ANOVA satu arah dengan metode LSD (Least Significant Difference) untuk mengetahui perbedaan bermakna antar ekstrak pada p<0,05.
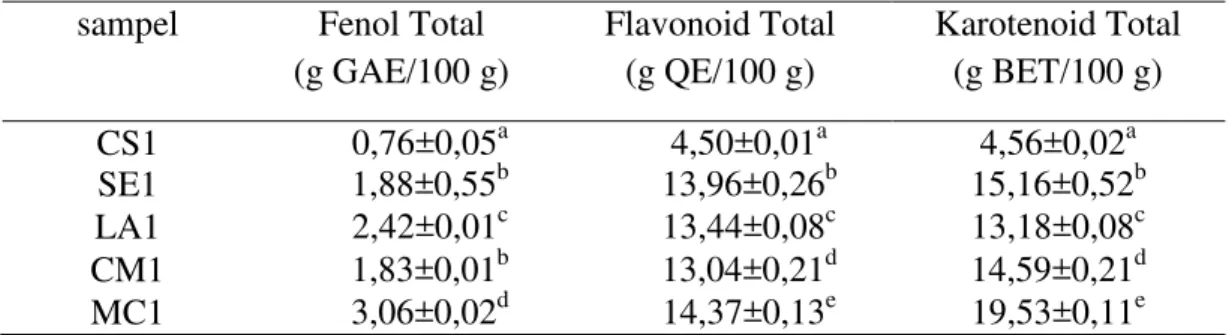
Tabel V.9. Fenol Total, Flavonoid Total, Karotenoid Total Ekstrak n-Heksana Daun Cucurbitaceae
CS1 0,76±0,05a 4,50±0,01a 4,56±0,02a
SE1 1,88±0,55b 13,96±0,26b 15,16±0,52b
LA1 2,42±0,01c 13,44±0,08c 13,18±0,08c
CM1 1,83±0,01b 13,04±0,21d 14,59±0,21d
MC1 3,06±0,02d 14,37±0,13e 19,53±0,11e
Keterangan: a-e = huruf yang sama dalam satu kolom menunjukkan tidak terdapat perbedaan bermakna (p<0,05)
35
Sedangkan fenol total, terdapat perbedaan tidak bermakna antara SE1 dan CM1, tetapi keduanya berbeda bermakna terhadap CS1, LA1, MC1(p<0,05).
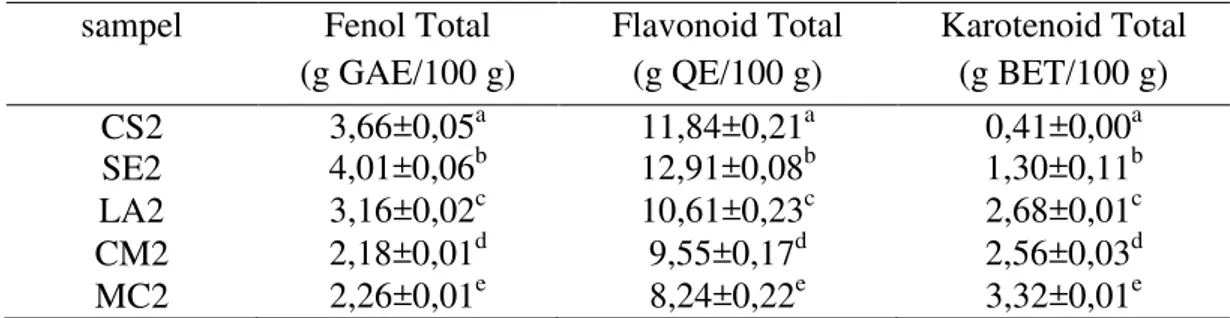
Tabel V.10. Fenol Total, Flavonoid Total, Karotenoid Total Ekstrak Etil Asetat Daun Cucurbitaceae
CS2 3,66±0,05a 11,84±0,21a 0,41±0,00a
SE2 4,01±0,06b 12,91±0,08b 1,30±0,11b
LA2 3,16±0,02c 10,61±0,23c 2,68±0,01c
CM2 2,18±0,01d 9,55±0,17d 2,56±0,03d
MC2 2,26±0,01e 8,24±0,22e 3,32±0,01e
Keterangan: a-e = huruf yang sama dalam satu kolom menunjukkan tidak terdapat perbedaan bermakna (p<0,05)
Hasil penentuan fenol, flavonoid dan karotenoid total pada ekstrak etil asetat daun Cucurbitaceae menunjukkan bahwa fenol total tertinggi ditunjukkan oleh sampel SE2 (4,01%), flavonoid total tertinggi ditunjukkan oleh sampel SE2 (12,91%) dan karotenoid total tertinggi ditunjukkan oleh sampel MC2 (3,32%). Berdasarkan data fenol, flavonoid dan karotenoid total secara statistik ANOVA satu arah dengan metode LSD (Least Significant Difference), menunjukkan bahwa terdapat perbedaan bermakna pada fenol, flavonoid dan karotenoid total antar sampel CS2, SE2, LA2, CM2, MC2 (p<0,05).
Tabel V.11. Fenol Total, Flavonoid Total, Karotenoid Total ekstrak Etanol Daun Cucurbitaceae
CS3 2,47±0,03a 1,70±0,02a 0,04±0,00a
SE3 1,79±0,01b 5,42±0,11b 0,60±0,00b
LA3 2,88±0,09c 2,30±0,02c 0,09±0,00c
CM3 1,43±0,01d 1,59±0,01d 0,07±0,00d
MC3 0,36±0,00e 0,76±0,02e 0,11±0,00e
Keterangan: a-e = huruf yang sama dalam satu kolom menunjukkan tidak terdapat perbedaan bermakna (p<0,05)
36
(2,88%), flavonoid total tertinggi ditunjukkan oleh sampel SE3 (5,42%) dan karotenoid total tertinggi ditunjukkan oleh sampel SE3 (0,60%). Berdasarkan data kadar fenol, flavonoid dan karotenoid total secara statistik ANOVA satu arah dengan metode LSD (Least Significant Difference), menunjukkan bahwa terdapat perbedaan bermakna pada fenol, flavonoid dan karotenoid total antar sampel CS3, SE3, LA3, CM3, MC3 (p<0,05).
V.6 Korelasi Fenol Total, Flavonoid Total dan Karotenoid Total Terhadap Aktivitas Peredaman DPPH dan FRAP
Untuk mengetahui korelasi antara flavonoid total, fenol total dan karotenoid total dalam
ekstrak daun Cucurbitaceae terhadap kapasitas FRAP dan peredaman radikal DPPH, maka dilakukan uji statistik menggunakan metode Pearson. Hasil uji statistik dapat dilihat pada Tabel V.12.
37
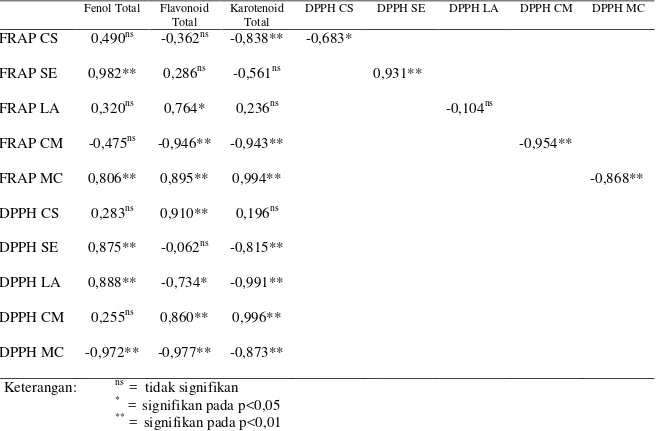
Pada Tabel V.12 dapat dilihat bahwa pada ekstrak daun mentimun tidak terdapat korelasi antara kapasitas FRAP dengan fenol total dan flavonoid total, tetapi memiliki korelasi negatif bermakna dengan karotenoid total (r = -0,838, p<0,01) dan peredaman DPPH (r = -0,683, p<0,01). Semakin tinggi karotenoid total, semakin rendah kapasitas FRAP maupun aktivitas peredaman DPPH. Diduga bahwa senyawa yang berperan dalam aktivitas FRAP pada ekstrak daun mentimun merupakan karotenoid dengan jumlah ikatan rangkap terkonjugasi kurang dari 10. Hal ini sejalan dengan penelitian
Muller, et al (2011) bahwa aktivitas karotenoid asiklik dalam mereduksi besi signifikan apabila karotenoid memiliki minimal 10 ikatan rangkap terkonjugasi. Peredaman DPPH ekstrak daun mentimun memiliki korelasi positif bermakna dengan flavonoid total (r = 0,910, p<0,01). Semakin tinggi flavonoid total dalam ekstrak daun mentimun maka akan semakin tinggi peredaman DPPH. Dengan demikian senyawa yang berperan dalam peredaman DPPH pada ekstrak daun mentimun merupakan senyawa golongan flavonoid. Diduga senyawa flavonoid tersebut merupakan flavonoid yang tidak memiliki gugus hidroksi pada cincin A maupun cincin B karena tidak memiliki korelasi dengan fenol total. Hal ini sejalan dengan penelitian Souri, et al (2008) bahwa tidak ada hubungan yang signifikan antara aktivitas antioksidan dengan fenol total pada ekstrak biji mentimun.
Pada ekstrak daun labu siam memiliki korelasi tinggi, positif, bermakna antara kapasitas FRAP dengan fenol total (r = 0,982, p<0,01) dan aktivitas peredaman DPPH (r = 0,875, p<0,01) tetapi tidak memiliki korelasi dengan flavonoid total dan karotenoid total. Aktivitas peredaman DPPH ekstrak daun labu siam memiliki korelasi tinggi, positif, bermakna dengan fenol total (r = 0,875, p<0,01) dan mempunyai korelasi tinggi, negatif, bermakna dengan karotenoid total (r = -0,815, p<0,01) tetapi tidak memiliki
38
Pada ekstrak daun oyong kapasitas FRAP memiliki korelasi positif, tinggi, bermakna dengan flavonoid total (r = 0,764, p<0,05) tetapi tidak memiliki korelasi dengan fenol total, karotenoid total dan aktivitas peredaman DPPH. Aktivitas peredaman DPPH memiliki korelasi tinggi, positif, bermakna dengan fenol total (r = 0,888, p<0,01) tetapi memiliki korelasi negatif, bermakna dengan flavonoid total (r = -0,734, p<0,05) dan karotenoid total (r = -0,991, p<0,01). Dari data di atas dapat disimpulkan bahwa yang berperan dalam kapasitas FRAP ekstrak daun oyong merupakan senyawa golongan flavonoid, sedangkan yang berperan dalam peredaman DPPH merupakan senyawa
golongan fenol. Hal ini sejalan dengan penelitian Neraraj, et al (2012) bahwa aktivitas peredaman DPPH pada ekstrak Luffa diduga karena ekstrak mengandung senyawa yang mampu mendonorkan hidrogen pada radikal bebas, dimana pendonor hidrogen ini merupakan senyawa fenol.
Sampel labu siam dan oyong, FRAP tidak mempunyai korelasi dengan karotenoid total. Efektivitas karotenoid dalam mereduksi besi dipengaruhi oleh jumlah ikatan rangkap terkonjugasi dan substituen yang terikat.
Pada ekstrak daun labu kuning kapasitas FRAP tidak memiliki korelasi dengan fenol total tetapi memiliki korelasi negatif, tinggi, bermakna dengan flavonoid total (r = -0,946, p<0,01), karotenoid total (r = -0,943, p<0,01), dan peredaman DPPH (r = -0,954, p<0,01). Peredaman DPPH memiliki korelasi positif, tinggi, bermakna dengan flavonoid total (r = 0,860, p<0.01) dan karotenoid total (r = 0,996, p<0,01). Diduga senyawa yang berperan dalam peredaman DPPH ekstrak daun labu kuning merupakan senyawa golongan flavonoid dan senyawa golongan karotenoid.
Pada ekstrak daun paria kapasitas FRAP memiliki korelasi positif, tinggi, bermakna