ABSTRAK
Tumbuhan dapat dimanfaatkan sebagai salah satu sumber antioksidan alami karena kandungan senyawa metabolit sekundernya. Penelitian ini bertujuan untuk mengetahui kandungan metabolit sekunder, kandungan fenolik, dan aktivitas antioksidan yang terdapat pada daun rinu (Piper baccatum BL.). Skrining fitokimia dilakukan dengan uji tabung, uji kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu. Pengujian aktivitas antioksidan dilakukan dengan metode thiobarbituric acid (TBA), ferric thiocyanat (FTC). Metode FTC-TBA dapat menghambat peroksidasi lemak, dimana metode FTC mengukur jumlah hasil peroksida selama tahap awal dari oksidasi lemak dengan ferrous chloride dan bentuk ion ferri dimana dikombinasikan dengan amonium tiosianat yang menghasilkan ferri tiosianat. Metode Folin-Ciocalteu didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Berdasarkan hasil skrining fitokimia dari ekstrak metanol daun rinu mengandung alkaloid, flavonoid, tanin, polifenol, saponin, steroid , dan terpenoid. Ekstrak metanol daun rinu memiliki kandungan fenolik total rata-rata sebesar 149,964 ± 3,545 mg ekivalen asam galat (GAE) per gram ekstrak metanol daun rinu. Pengukuran daya hambat ekstrak metanol daun rinu terhadap peroksidasi lemak dengan metode FTC-TBA menunjukkan dapat memberikan daya penghambatan sebesar 9,606 % ± 0,263 dan (90,909 % ± 0,750) % dengan kontrol positif (BHT) sebesar (10,746 ± 0,277) % dan (83, 217 ± 0,888) %.
Abstract
Plants can be used as a source of natural antioxidants for the content of secondary metabolites. The aim of this study is to determine the secondary metabolites, total phenolic compound, and antioxidant activity of methanolic extracts in Rinu leaf (Piper baccatum BL.). Total phenolic compound assay using Folin-Ciocalteu method was used to assess the presence and level of phenolic compounds in sample. Folin-Ciocalteu method (FC) based on the reduction phosphotungsten acid in alkaline solution becomes blue phosphotungsten. Antioxidant activity was measured by ferric thiocyanate (FTC) assay and thiobarbituric acid (TBA). The FTC method was used to measure the amount of peroxide at the beginning of lipid peroxidation, in which peroxide will react with ferrous chloride and form ferric ions. Ferric ions will then unite with ammonium thiocyanate and produce ferric thiocyanate. The substance is red, and denser color is indicative of higher absorbance. The TBA method measures free radicals present after peroxide oxidation. Phytochemical analysis of extract indicated the presence of major phytocompounds, including alkaloids, flavonoids, tanins and polyphenols, saponins, steroids and terpenoids. Methanolic extracts has a total phenolics compound of 149.964 ± 3.545 mg Gallic Acid Equivalents (GAE). Antioxidant activity of metanolic extract showed as percent inhibition value was (9.606 ± 0.263) % and (90.909 ± 0.750) for FTC and TBA methods with positive control (BHT) showed percent inhibition value was (10.746 ± 0.277) % and (83. 217 ± 0.888) %.
SKRINING FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN EKSTRAK METANOL DAUN RINU (Piper baccatum Bl.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Agatha Herny Sekar Natalia NIM : 128114003
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
SKRINING FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN EKSTRAK METANOL DAUN RINU (Piper baccatum Bl.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Agatha Herny Sekar Natalia NIM : 128114003
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
vi PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa dan Bunda Maria karena kebaikanNya penulis dapat menyelesaikan skripsi dengan baik. Penulisan skripsi ini berjudul SKRINING FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN EKSTRAK METANOL DAUN RINU (Piper baccatum Bl.). Skripsi ini merupakan syarat untuk memperoleh gelar sarjana di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Penulisan skripsi ini mendapat dukungan dan bantuan dari berbagai pihak, sehingga penulis mengucapkan terimakasi kepada :
1. Aris Widayati, M.Si., Ph. D., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Dr. Sri Hartati Yuliani, Apt. selaku Ketua Jurusan dan Wakil Ketua Program Studi Farmasi Universitas Sanata Dharma Yogyakarta.
3. Dr. Yustina Sri Hartini, M.Si., Apt selaku dosen pembimbing yang telah meluangkan waktu, tenaga, dan pikiran untuk memberikan bimbingan, arahan, dan semangat kepada penulis untuk segera menyelesaikan penulisan skripsi ini.
4. Bapak Yohanes Dwiatmaka, M.Si. dan Bu Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji yang telah meluangkan waktu untuk menguji, memberikan saran dan kritik terhadap skripsi ini.
5. Seluruh dosen di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah dengan sabar dan tulus memberikan ilmu serta mengajarkan integritas seorang akademisi kepada penulis.
6. Seluruh civitas akademika Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, yang telah sudi membantu penulis selama kuliah di Fakultas Farmasi USD
vii
8. Adekku tersayang Pelagia Acintya dan Nikodemus Andrian untuk penghiburannya selama menyusun naskah
9. Sahabat-sahabatku terutama team Piper : Maria Indah Rosari, Yuliana Ratih Kamara Dewi, Violeta Jesmile, Clementia Nova atas kerja sama yang luar biasa
10.Seluruh teman-teman Fakultas Farmasi angkatan 2012 yang tidak dapat disebutkan satu persatu atas segala dukungan dan bantuan yang diberikan 11.Untuk semua pihak yang tidak dapat disebutkan satu persatu yang telah
membantu penulis selama ini, terima kasih.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kekurangan, baik dalam kalimat maupun isinya. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk memperbaiki dan menyempurnakan penulisan skripsi ini.
Semoga penulisan ini dapat bermanfaat bagi perkembangan ilmu pengetahuan, khususnya bidang hukum dan semua pihak yang telah membacanya.
Yogyakarta, Juni 2016
viii DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
PENGESAHAN SKRIPSI BERJUDUL ... iii
PERNYATAAN KEASLIAN KARYA ... iv
PERSETUJUAN PUBLIKASI ... v
PRAKATA ... vi
Determinasi tumbuhan ... 3
Pengambilan dan Pengolahan sampel ... 3
Pembuatan ekstrak metanol daun rinu ... 3
Skrining fitokimia ... 3
Uji penetapan kandungan fenolik total ... 4
Uji aktivitas antioksidan dengan metode FTC-TBA ... 5
Analisis data... 6
HASIL DAN PEMBAHASAN ... 7
Skrining fitokimia ... 7
Hasil uji kandungan fenolik total ... 10
Hasil uji aktivitas antioksidan ... 12
KESIMPULAN DAN SARAN ... 16
ix
x
DAFTAR TABEL
xi
DAFTAR GAMBAR
Gambar 1. Reaksi uji Mayer ... 8
Gambar 2. Reaksi uji Dragendorff ... 8
Gambar 3. Reaksi antara tanin dan FeCl3 ... 9
Gambar 4. Reaksi hidrolisis saponin dengan air ... 9
Gambar 5. Kurva baku yang digunakan perhitungan fenolik total ... 11
Gambar 6. Pembentukan oksidasi besi kompleks (Fe3+) ... 13
xii
DAFTAR LAMPIRAN
Lampiran 1. Surat determinasi tanaman ... 20
Lampiran 2. Gambar Piper baccatum BL. ... 21
Lampiran 3. Klasifikasi dari daun Rinu ... 22
Lampiran 4. Contoh perhitungan karakterisasi simplisia ... 23
Lampiran 5. Gambar hasil uji tabung skrining fitokimia ... 24
Lampiran 6. Perhitungan rendemen sampel ... 30
Lampiran 7. Hasil Optimasi Operating Time (OT) Untuk Uji Aktivitas Antioksidan dengan Metode FTC ... 31
Lampiran 8. Hasil Optimasi Panjang Gelombang Maksimum Untuk Uji Aktivitas Antioksidan dengan Metode FTC ... 32
Lampiran 9. Data Penimbangan Untuk Uji Aktivitas Antioksidan Metode FTC-TBA ... 35
Lampiran 10. Hasil pengukuran uji aktivitas antioksidan dengan metode FTC ... 36
Lampiran 11. Hasil pengukuran uji aktivitas antioksidan dengan metode TBA ... 39
Lampiran 12. Data penimbangan uji kandungan fenolik total ... 40
Lampiran 13. Perhitungan konsentrasi asam galat dan ekstrak metanol untuk penetapan kandungan fenolik total ... 41
Lampiran 14. Uji pendahuluan uji fenolik ... 43
Lampiran 15. Hasil optimasi operating time (OT) untuk penetapan kandungan fenolik total ... 44
Lampiran 16. Optimasi panjang gelombang maksimum untuk penetapan kandungan fenolik total ... 46
Lampiran 17. Hasil pengukuran kurva baku untuk penetapan kandungan fenolik total ... 49
Lampiran 18. Perhitungan kandungan fenolik total ekstrak metanol ... 50
xiii ABSTRAK
Tumbuhan dapat dimanfaatkan sebagai salah satu sumber antioksidan alami karena kandungan senyawa metabolit sekundernya. Penelitian ini bertujuan untuk mengetahui kandungan metabolit sekunder, kandungan fenolik, dan aktivitas antioksidan yang terdapat pada daun rinu (Piper baccatum BL.). Skrining fitokimia dilakukan dengan uji tabung, uji kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu. Pengujian aktivitas antioksidan dilakukan dengan metode thiobarbituric acid (TBA), ferric thiocyanat (FTC). Metode FTC-TBA dapat menghambat peroksidasi lemak, dimana metode FTC mengukur jumlah hasil peroksida selama tahap awal dari oksidasi lemak dengan ferrous chloride dan bentuk ion ferri dimana dikombinasikan dengan amonium tiosianat yang menghasilkan ferri tiosianat. Metode Folin-Ciocalteu didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Berdasarkan hasil skrining fitokimia dari ekstrak metanol daun rinu mengandung alkaloid, flavonoid, tanin, polifenol, saponin, steroid , dan terpenoid. Ekstrak metanol daun rinu memiliki kandungan fenolik total rata-rata sebesar 149,964 ± 3,545 mg ekivalen asam galat (GAE) per gram ekstrak metanol daun rinu. Pengukuran daya hambat ekstrak metanol daun rinu terhadap peroksidasi lemak dengan metode FTC-TBA menunjukkan dapat memberikan daya penghambatan sebesar 9,606 % ± 0,263 dan (90,909 % ± 0,750) % dengan kontrol positif (BHT) sebesar (10,746 ± 0,277) % dan (83, 217 ± 0,888) %.
xiv Abstract
Plants can be used as a source of natural antioxidants for the content of secondary metabolites. The aim of this study is to determine the secondary metabolites, total phenolic compound, and antioxidant activity of methanolic extracts in Rinu leaf (Piper baccatum BL.). Total phenolic compound assay using Folin-Ciocalteu method was used to assess the presence and level of phenolic compounds in sample. Folin-Ciocalteu method (FC) based on the reduction phosphotungsten acid in alkaline solution becomes blue phosphotungsten. Antioxidant activity was measured by ferric thiocyanate (FTC) assay and thiobarbituric acid (TBA). The FTC method was used to measure the amount of peroxide at the beginning of lipid peroxidation, in which peroxide will react with ferrous chloride and form ferric ions. Ferric ions will then unite with ammonium thiocyanate and produce ferric thiocyanate. The substance is red, and denser color is indicative of higher absorbance. The TBA method measures free radicals present after peroxide oxidation. Phytochemical analysis of extract indicated the presence of major phytocompounds, including alkaloids, flavonoids, tanins and polyphenols, saponins, steroids and terpenoids. Methanolic extracts has a total phenolics compound of 149.964 ± 3.545 mg Gallic Acid Equivalents (GAE). Antioxidant activity of metanolic extract showed as percent inhibition value was (9.606 ± 0.263) % and (90.909 ± 0.750) for FTC and TBA methods with positive control (BHT) showed percent inhibition value was (10.746 ± 0.277) % and (83. 217 ± 0.888) %.
1
PENDAHULUAN
Radikal bebas secara normal diproduksi oleh tubuh sebagai hasil samping metabolisme aerob (Fang, Yang, and Wu, 2002). Apabila produksi berlebih, maka radikal bebas tersebut dapat menyebabkan kerusakan sel sehingga dapat memicu berbagai penyakit dan mempercepat penuaan dini (Sies , 1997). Selain itu, terdapat akibat merugikan yang ditimbulkan oleh adanya radikal bebas pada tubuh manusia adalah peroksidasi lipid (Fang, Yang, and Wu, 2002). Oleh sebab itu, antioksidan diperlukan sebagai agen pelindung yang dapat mengurangi kerusakan oksidatif pada tubuh manusia (Sies, 1997).
Tumbuhan dapat dimanfaatkan sebagai salah satu sumber antioksidan alami karena kandungan senyawa metabolit sekunder. Salah satu tumbuhan yang saat ini belum diketahui kandungan metabolitnya adalah tumbuhan rinu. Rinu merupakan tumbuhan merambat yang berasal dari Jawa, Borneo dan di Indonesia disebut rinu. Rinu dapat mencapai panjang 30 meter, daunnya berbentuk melingkar-bulat telur, tipis dan terdapat buah seperti berry (Utami and Jansen,1999).
Sejauh penelusuran peneliti, terhadap penelitian senyawa aktif pada daun rinu belum ditemukan publikasi tentang kandungan kimia pada daun rinu. Rinu termasuk dari satu genus Piper dan keluarga Piperaceae. Menurut Parmar et al., (1997), kandungan metabolit sekunder yang terdapat pada Piperaceae adalah fenolik, flavonoid, alkaloid, dan terpenoid. Penelitian ini menguji keberadaan alkaloid, flavonoid, tanin dan polifenol, saponin, dan terpenoid yang dilakukan dengan cara skrining fitokimia yang menggunakan uji tabung. Tiwari et al.(2011) melaporkan bahwa metanol dapat melarutkan beberapa kandungan metabolit sekunder seperti alkaloid, terpenoid, tanin, flavonoid, polifenol. Selain itu metanol dapat menghambat reaksi oksidasi polifenol yang menyebabkan oksidasi fenolat dan kemudahannya saat penguapan di evaporator.
2
sebagai antioksidan alami karena kemampuannya meniadakan radikal bebas dan radikal peroksida sehingga efektif dalam menghambat oksidasi lipid (Kinsella, et al., 1993). Sehingga kandungan fenolik diukur agar mengetahui fenolik memiliki kemampuan sebagai antioksidan.
Dalam penelitian ini dipilih metode FTC, TBA, dan Folin-Ciocalteu (FC).
Metode FTC digunakan untuk mengukur jumlah peroksida awal dari peroksidasi lemak
sedangkan metode TBA untuk mengukur radikal bebas yang dihasilkan setelah
peroksidasi lemak yang dimana peroksidasi lemak merupakan akumulasi produk pada
jaringan tubuh manusia sebagai penyebab utama dari disfungsi seluler pada tubuh (Aqil,
Ahmad, and Mehmood, 2006 ). Secara umum, reaksi yang diperoleh metode FC memberikan hasil yang akurat dan spesifik dari beberapa kandungan fenolik, karena
beberapa kandungan berubah warna. Perubahan warna yang terjadi disebut reaksi
kolorimetri sehingga digunakan spektrofotometri UV/VIS yang mana mudah digunakan,
cepat dan dapat digunakan pada laboratorium, dan harga murah (Pelozo, Cardoso, and Mello, 2008).
ALAT DAN BAHAN PENELITIAN
Pisau stainless steel, neraca analitik, maserator / orbital shaker, corong Buchner, pompa vakum, vacum rotary evaporator, penangas air, spektrofotometer UV-Vis Shimadzu BioSpec-mini, oven, vortex, flakon, mikropipet 200 –1000 l, dan alat-alat yang lazim digunakan di laboratorium analisis (Pyrex).
3
METODE PENELITIAN Determinasi tumbuhan
Tumbuhan rinu (daun, batang, dan buah) yang diteliti dideterminasi di Laboratorium Sistematika Tanaman Fakultas Biologi Universitas Gadjah Mada Yogyakarta.
Pengambilan dan pengolahan sampel
Tumbuhan rinu yang digunakan diambil dari kebun obat “MERAPI FARMA” daerah KM 21,5 , Kaliurang, Cangkringan, Sleman, Yogyakarta. Sampel yang digunakan adalah daun segar yang masih muda dan tidak terlalu tua yaitu 3 lembar dari tiap rantingnya dihitung dari pucuk - pangkal ranting dan daun yang rusak tidak diambil. Daun rinu dicuci dengan dialiri air, dikering anginkan, dipotong dengan lebar 1 cm kemudian dikeringkan dengan oven pada suhu 50oC hingga daun benar-benar kering (mudah dihancurkan dengan sekali remas). Selanjutnya daun rinu yang sudah kering diblender sehingga menjadi serbuk dan diayak dengan nomor mesh 50.
Pembuatan ekstrak metanol daun rinu
Sebanyak 10 mg serbuk diekstraksi maserasi menggunakan 100 mL metanol teknis selama 2x24 jam dengan menggunakan shaker. Setelah 2x24 jam dimaserasi, filtrat disaring dengan corong Buchner dan ampasnya diremaserasi dengan metanol teknis selama 24 jam lalu disaring. Proses remaserasi dihentikan ketika sudah diperoleh filtrat yang bening, yang menandakan bahwa senyawa aktif dalam sampel telah terekstrak dengan sempurna. Pelarut pada filtrat dihilangkan dengan cara diuapkan menggunakan vacum rotary evaporator pada suhu 60oC. Kemudian diuapkan kembali dengan menggunakan waterbath pada suhu 60oC untuk diperoleh ekstrak kental, kemudian dihitung rendemennya. Skrining fitokimia
1. Alkaloid
4
mengidentifikasi adanya alkaloid. Tabung kedua diberi beberapa tetes reagen Dragendroff. Pembentukan warna merah atau orange menunjukan adanya alkaloid (Tiwari et al, 2011).
2. Flavonoid
Sebanyak 5 mg ektrak kental dilarutkan air dan ditambahkan 1 mL larutan tembaga asetat. Produk akan menghasilkan endapan warna kuning yang menunjukan adanya flavonoid (Trease and Evans, 1989).
3. Tanin dan polifenol
Sebanyak 10 mg ekstrak kental di larutkan dalam 15 mL metanol teknis kemudian dibagi ke dalam 3 bagian yaitu tabung A, tabung B, tabung C. Tabung A digunakan sebagai blanko, tabung B direaksikan dengan larutan FeCl3 10%, warna biru tua atau hitam kehijauan menunjukkan adanya tanin dan polifenol, sedangkan pada tabung C hanya ditambahkan gelatin 1%. Apabila terbentuk endapan pada tabung C maka larutan ekstrak mengandung tanin (Marliana dkk, 2005).
4. Saponin
Sebanyak 10 mL larutan ekstrak uji dalam tabung reaksi dikocok vertikal selama 10 detik kemudian dibiarkan selama 10 detik. Pembentukan busa setinggi 1-10 cm menunjukkan adanya saponin kemudian ditetesi 1 tetes HCl 2N busa tidak hilang (Depkes RI, 1995).
5. Steroid dan terpenoid
Sebanyak 100 mg ekstrak di larutkan dengan 2 mL kloroform lalu di kocok setelah itu ditambahkan 2 mL asam sulfat p.a. Pembentukkan cincin berwarna coklat diantara 2 lapisan yang terbentuk. Pada lapisan atas membentuk warna hijau yang menunjukkan adanya steroid dan pada lapisan atas membentuk warna merah pekat akan menunjukkan adanya terpenoid (Joshi, Bhobe, and Saatarkar, 2013).
Uji penetapan kandungan fenolik total
5
2,0 mL labu takar 10 mL dengan metanol : air sehingga diperoleh 200 g/mL. Diambil 0,5 mL pada tabung reaksi ditambahkan dengan 2mL reagen Folin-Ciocalteu, 4 mL NaCO3 1 M, diamkan selama OT (30 menit) dan absorbansi diukur dengan menggunakan spektrofotometer uv-vis pada maks (735 nm) yang ditentukan. Replikasi 3 kali. Kurva standar dibuat dengan pengukuran absorbansi asam galat dengan konsentrasi 40; 50; 60; 70; dan 80 g/mL.
Penentuan OT dibuat konsentrasi asam galat 40; 60; dan 80 g/mL dan direaksikan dengan reagen yang sudah disebutkan diatas. Absorbansi dibaca setiap 5 menit dengan spektrofotometer uv-vis pada 750 nm selama 60 menit. Penentuan maks dibuat konsentrasi asam galat 40; 60; dan 80 g/mL dan direaksikan dengan reagen yang sudah disebutkan diatas dan didiamkan selama OT yang sudah di dapatkan kemudian dibaca pada 600-800 nm.
Uji aktivitas antioksidan dengan metode FTC-TBA
Uji aktivitas antioksidan dengan metode FTC dan TBA menggunakan cara seperti yang dideskripsikan dalam percobaan yang dilakukan oleh Aqil, Ahmad, and Mehmood (2006). Sebelum pengujian sampel, dilakukan optimasi metode untuk mendapatkan panjang gelombang maksimum ( maks) saat pembacaan sampel dan penentuan operating time (OT).
Untuk pembacaan maks dan OT sebanyak 4 mg standar BHT (kontrol positif) dilarutkan dengan 4 mL etanol absolut p.a., kemudian ditambahkan 4,1 mL asam linoleat dalam etanol absolut, 3,9 mL akuades dan ditambahkan dengan 8 mL 0,05 M buffer fosfat (pH 7) pada tabung tertutup. Campuran ini disebut dengan larutan A dan disimpan pada suhu 40oC selama 24 jam. Untuk pembacaan, disiapkan larutan B yang berisi 9,7 etanol 75% v/v dan 0,1 mL ammonium tiosianat 30%. Kemudian 0,1 mL larutan A diambil dan dimasukkan ke tabung reaksi larutan B kemudian ditambahkan 0,1 mL 0,02 M FeCl3 dalam 3,5% HCl. Larutan dibaca pada 500 nm setiap menit ke-1, 3, 5, 7, dan 10 sehingga di dapatkan OT 5 menit. Untuk penetapan maks, dibuat larutan seperti diatas dan
didiamkan selama OT dan dibaca pada rentang 400-600 nm sehingga diperoleh
6
ekstrak metanol dan BHT sebagai kontrol positif, larutan A dan B didiamkan selama OT dan dibaca pada maks. Langkah ini diulang setiap 24 jam sampai larutan kontrol mencapai nilai absorbansi maksimal. Kontrol yang digunakan adalah campuran tanpa sampel dan BHT.
Sedangkan untuk metode TBA adalah 1 mL ekstrak dan kontrol positif (yaitu larutan A FTC pada hari ketujuh) ditambahkan 2 mL larutan asam trikloroasetat 20% dan 2 mL larutan asam tiobarbiturat 0,67%. Sampel dididhkan selama 10 menit lalu didinginkan. Setelah itu dimasukkan tube dan disentrifugasi 3000 rpm selama 30 menit. Ukur absorbansi supernatannya pada maks 532 nm dengan spektrofotometer uv-vis. Besarnya aktivitas antioksidan dinyatakan dengan % inhibisi.
Analisis data
Penetapan kandungan fenolik total dihitung sebagai mg ekivalen asam galat per gram ekstrak (GAE). Penetapan dilakukan melalui persamaan regresi linear dengan memasukkan data absorbansi ekstrak pada konsentrasi tertentu sebagai fungsi (Y) dalam persamaan kurva baku (dengan pembuatan regresi liniar dan dipilih nilai regresi (r) yang paling baik yakni nilai antara -1 < r ≤ 1) yang diperoleh yaitu y = 0,0066x + 0,0974 ; r = 0,9924 sehingga kandungan fenol (X) dapat diketahui.
Kandungan fenolik total =
x = kandungan fenolik (GAE)
v = faktor pengenceran x volume akhir larutan uji m = bobot sampel yang digunakan
(Kusumanto, 2014) Untuk menentukan aktivitas antiradikal dengan metode FTC-TBA adalah dengan menghitung persentase inhibisi dari data absorbansi yang didapat dengan rumus :
% inhibisi = ( A0 – A1)/ A0 x 100% A0 = absorbansi kontrol negatif
7
HASIL DAN PEMBAHASAN
Pembuatan ekstrak metanol daun rinu dilakukan dengan metode maserasi. Maserasi merupakan metode umum yang digunakan untuk mengekstraksi tumbuhan, selain itu juga cocok untuk komponen tumbuhan yang tidak tahan panas (Ncube, Afolayan, and Okoh, 2008). Proses maserasi dilakukan menggunakan pelarut metanol yang merupakan pelarut bersifat polar dibandingkan dengan etanol dan air, selain itu juga dapat melarutkan beberapa kandungan metabolit sekunder seperti alkaloid, terpenoid, tanin, flavonoid, dan polifenol (Tiwari et al., 2011). Setelah maserasi dan penyaringan, selanjutnya adalah pemekatan hasil ekstrak dengan rotary evaporator. Hasil yang diperoleh berupa ekstrak kental berwarna hijau pekat sebanyak 0,8519 g dengan rendemen sebesar 8,4766 % ekstrak inilah yang digunakan untuk skrining fitokimia, uji total fenolik, dan uji antioksidan. Hasil uji menunjukkan bahwa ekstrak metanol daun rinu mengandung senyawa golongan alkaloid, flavonoid, tanin dan polifenol, saponin, steroid dan terpenoid.
Tabel I. Hasil skrining fitokimia pada ekstrak metanol daun rinu
No Uji Fitokimia Hasil Kesimpulan
1. Alkaloid terbentuk endapan putih + terbentuk warna orange +
2. Flavonoid terbentuk endapan kuning dibagian tengah
tabung +
3. Tanin dan polifenol
terbentuk warna hitam kehijauan pada
tabung uji dibanding kontrol +
terbentuk endapan putih pada dasar tabung +
4. Saponin terbentuk busa setinggi 1-10 cm +
5.
Steroid dan terpenoid
terbentuk warna merah kecoklatan pada lapisan bawah dan warna hijau
pekat pada lapisan atas + Keterangan (+) : ada ; (-) : tidak ada
8
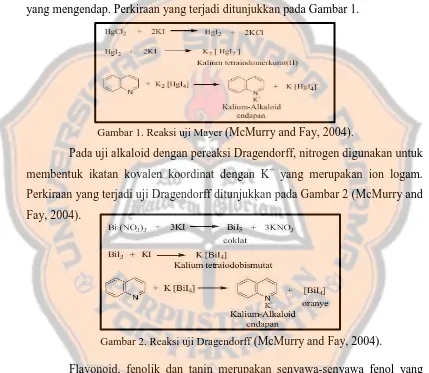
2004). Tujuan penambahan HCl adalah karena alkaloid bersifat basa sehingga biasanya dilarutkan dengan pelarut yang mengandung asam (Harborne, 1996). Hasil positif alkaloid pada uji Mayer ditandai dengan terbentuknya endapan putih. Diperkirakan endapan tersebut adalah kompleks kalium-alkaloid. Diperkirakan nitrogen pada alkaloid akan bereaksi dengan ion logam K+ dari kalium tetraiodomerkurat(II) (pereaksi Mayer) membentuk kompleks kalium-alkaloid yang mengendap. Perkiraan yang terjadi ditunjukkan pada Gambar 1.
Gambar 1. Reaksi uji Mayer (McMurry and Fay, 2004).
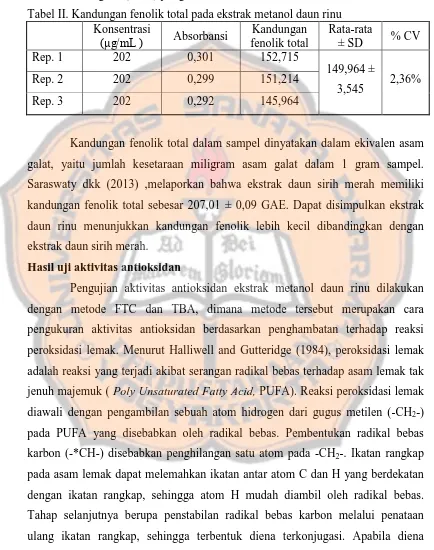
Pada uji alkaloid dengan pereaksi Dragendorff, nitrogen digunakan untuk membentuk ikatan kovalen koordinat dengan K+ yang merupakan ion logam. Perkiraan yang terjadi uji Dragendorff ditunjukkan pada Gambar 2 (McMurry and Fay, 2004).
Gambar 2. Reaksi uji Dragendorff (McMurry and Fay, 2004).
9
Pengujian tanin dilakukan dengan melakukan penambahan FeCl3 yang bereaksi dengan salah satu gugus hidroksil yang ada pada tanin. Fungsi FeCl3 adalah menghidrolisis golongan tanin sehingga akan menghasilkan perubahan warna biru kehitaman dan tanin terkondensasi yang menghasilkan warna hijau kehitaman pada Gambar 3 (Sangi dkk., 2008).
Gambar 3. Reaksi antara tanin dan FeCl3
Pada pengujian saponin, saponin mengandung gugus glikosil yang berperan sebagai gugus polar serta gugus steroid dan triterpenoid yang berfungsi sebagai gugus nonpolar akan bersifat aktif permukaan sehingga saat dikocok dengan air saponin dapat membentuk misel, dimana struktur polar akan menghadap ke luar sedangkan gugus nonpolar akan menghadap ke dalam. Pada kondisi ini akan terbentuk saponin berbentuk seperti busa (Sangi dkk., 2008). Reaksi hidrolisis saponin dengan air sepeti pada Gambar 4.
Gambar 4. Reaksi hidrolisis saponin dengan air
10
golongan senyawa terpenoid/steroid melalui pembentukan ikatan rangkap terkonjugasi. Prinsip reaksi dalam uji terpenoid adalah kondensasi atau pelepasan H2O dan penggabungan karbokation dan menyebabkan adisi elektrofilik diikuti dengan pelepasan hidrogen. Gugus hidrogen beserta elektronnya dilepas sehingga mengalami perpanjangan konjugasi yang memperlihatkan adanya cincin coklat (Siadi, 2012).
Hasil uji kandungan fenolik total
Metode yang digunakan untuk uji kandungan fenolik total adalah metode Folin-Ciocalteu dengan reagen Folin Ciocalteu. Reaksi antara reagen dan sampel terjadi dalam keadaan alkali (basa) oleh natrium karbonat (Na2CO3). Intensitas warna biru dapat menentukan kandungan fenolik yang mana dapat diukur dengan spektrofotometer (Conforti et al., 2006). Absorbansi yang terbentuk akibat molybdeum blue sebanding dengan jumlah senyawa fenolik yang terdapat dalam sampel, sehingga dapat diketahui seberapa besar jumlah kandungan senyawa dengan gugus fenol dalam suatu sampel tanaman yang dinyatakan dengan ekuivalen asam galat (Cindric et al., 2011). Asam galat merupakan senyawa analog dari senyawa-senyawa fenolik dan memiliki aktivitas antioksidan yang memiliki 3 gugus hidroksi fenolat yang membentuk kompleks molybdeum blue (Fiuza, 2004).
Sebelum pengujian sampel,dilakukan uji pendahuluan yang bertujuan untuk mengetahui adanya kandungan fenolik dalam ekstrak metanol daun rinu yang dilakukan secara kualitatif selain itu juga diperlukan penentuan, maks, dan kurva baku. Penentuan OT bertujuan untuk mendapatkan waktu reaksi antara sampel dengan reagen yang ditunjukkan dengan nilai absorbansi yang stabil. Pada saat awal terjadi reaksi, absorbansi senyawa berwarna akan meningkat sampai waktu tertentu hingga diperoleh absorbansi yang stabil tetapi semakin lama waktu pengukuran, ada kemungkinan senyawa berwarna akan mengalami kerusakan sehingga menyebabkan intensitas warnanya menurun dan absorbansinya juga menurun (Gandjar dan Rohman, 2007).
11
absorbansi yang berbeda pada panjang gelombang maksimum teoritis (750 nm), sehingga ketiga konsentrasi tersebut akan merepresentasikan OT pada masing-masing konsentrasi. Absorbansi yang stabil terjadi pada menit ke 30. Penentuan maks. bertujuan untuk menentukan panjang gelombang yang dapat memberikan absorbansi maksimum dari hasil reaksi reagen Folin – Ciocalteu dengan asam galat. Konsentrasi yang digunakan adalah sama seperti konsentrasi penentuan OT. Pembacaan maks dilakukan pada rentang panjang gelombang 600 – 800 nm. Panjang gelombang teoritis asam galat adalah 750 nm tetapi diperoleh maks yang digunakan 735 nm, karena digunakan konsentrasi yang berbeda dan hasil pembacaan menunjukkan terdapat 2 konsentrasi yang absorbansinya terserap pada panjang gelombang yang ini, hal ini berbeda dengan teoritis dapat disebabkan oleh beberapa hal, seperti jenis pelarut yang digunakan, pH larutan, konsentrasi yang digunakan tinggi, dan zat-zat pengganggun (Gandjar dan Rohman, 2007).
Kadar fenolik diperoleh dengan memasukkan absorbansi sebagai Y dalam kurva baku asam galat, sehingga diketahui kandungan fenolik total dalam ekstrak uji (X). Dari percobaan, didapatkan persamaan regresi y = 0,0066x + 0,0974 ; r = 0,9924 (Gambar 5) dengan menggunakan konsentrasi 40 g/mL;50
g/mL;60 g/mL;70 g/mL;80 g/mL.
Gambar 5. Kurva baku yang digunakan perhitungan fenolik total
Hasil uji pendahuluan secara kualitatif menunjukkan hasil positif pada tabung larutan uji yang berubah warna menjadi biru yang menandakan terdapat fenol pada ekstrak. Percobaan pada sampel ekstrak metanol daun rinu (Tabel II) menunjukkan bahwa dengan konsentrasi 202 g/mL (konsentrasi berubah
y = 0,0066x + 0,0974
12
dikarenakan kurang telitinya saat penimbangan) yang dilakukan 3 kali replikasi memiliki nilai kandungan fenolik total rata-rata sebesar 149,964 ± 3,545 mg ekivalen asam galat (GAE) per gram ekstrak metanol daun rinu.
Tabel II. Kandungan fenolik total pada ekstrak metanol daun rinu
Konsentrasi
( g/mL ) Absorbansi fenolik total Kandungan
Rata-rata
Kandungan fenolik total dalam sampel dinyatakan dalam ekivalen asam galat, yaitu jumlah kesetaraan miligram asam galat dalam 1 gram sampel. Saraswaty dkk (2013) ,melaporkan bahwa ekstrak daun sirih merah memiliki kandungan fenolik total sebesar 207,01 ± 0,09 GAE. Dapat disimpulkan ekstrak daun rinu menunjukkan kandungan fenolik lebih kecil dibandingkan dengan ekstrak daun sirih merah.
Hasil uji aktivitas antioksidan
13
Metode FTC digunakan untuk mengukur jumlah peroksida awal dari peroksidasi lemak. Dalam penelitian ini digunakan sumber peroksida atau asam lemak yaitu asam linoleat. Asam linoleat mengandung dua ikatan rangkap terkonjugasi. Menurut Halliwell and Gutteridge (1984), peroksida yang terbentuk bereaksi dengan FeCl2, dimana besi kompleks (Fe2+) membentuk oksidasi besi kompleks (Fe3+) yang bereaksi lebih lambat untuk menghasilkan radikal peroksil. Mekanisme reaksi pembentukan oksidasi besi kompleks (Fe3+) (Gambar 6.)
RH R* + H*
Gambar 6. Pembentukan oksidasi besi kompleks (Fe3+)
Menurut Huda-Faujan et al,, (2009) , ion Fe3+ akan menghasilkan Fe3+(ferric) tiosianat apabila dikombinasi dengan amonium tiosianat sehingga diperoleh warna merah. Merah pekat menunjukkan tingginya absorbansi dan rendahnya aktivitas antioksidan. Sehingga efek penghambatan terbentuknya ion Fe3+ dievaluasi dengan melihat pembentukkan kompleks ferri tiosianat dengan menggunakan spektrofotometer pada panjang gelombang 488,5 nm.
14
Gambar 7. Profil absorbansi kontrol negatif, kontrol positif, dan sampel selama 7 hari dengan metode FTC, Replikasi 1,2,3 : sampel ekstrak daun
rinu
Dari analisis FTC, nilai absorbansi kontrol positif dan sampel pada hari pertama menunjukkan absorbansi terendah yakni 1,450 dan 1,479, sedangkan absorbansi tertinggi pada hari ke enam adalah 1,957 dan 1,982. Absorbansi tersebut akan meningkat dengan seiringnya waktu inkubasi. Pengukuran dengan FTC dihentikan pada hari ke tujuh sebab pada hari ke enam nilai absorbansi kontrol negatif menunjukkan paling tinggi sehingga dapat diindikasikan peroksidasi paling maksimal. Dilakukan hingga hari ke tujuh untuk melihat profil kenaikan absorbansi kontrol negatif dan pada hari ke tujuh nilai absorbansi turun. Pada hari ke delapan dilanjutkan dengan pengukuran TBA.
Dilakukan perhitungan persen inhibisi pada hari keenam karena kontrol negatif menunjukkan absorbansi maksimum dan warna merah larutan akibat pembentukkan kompleks ferri tiosianat terlihat semakin pekat. Besarnya persen inhibisi menunjukkan besarnya aktivitas antioksidan (Emynur et al., 2012). Hal tersebut menandakan bahwa proses peroksidasi lemak asam linoleat sudah berjalan secara maksimal. Persen inhibisi kontrol positif yang berisi BHT menunjukkan nilai persen inhibisi yang lebih besar dibandingkan ekstrak metanol daun rinu, yaitu sebesar 10,746 % ± 0,277 , sementara ekstrak metanol daun rinu memiliki nilai persen inhibisi sebesar 9,606 % ± 0,263. Hal tersebut menunjukkan bahwa ekstrak metanol daun rinu kurang mampu menghambat peroksidasi lemak yang terbentuk dibandingkan BHT yang merupakan antioksidan sinstetis.
0
Profil kenaikan rata-rata absorbansi kontrol negatif, kontrol positif, dan sampel ekstrak
15
Metode TBA digunakan untuk mengukur jumlah peroksida pada tahap kedua peroksidasi lemak dan mengukur radikal bebas yang ada setelah oksidasi peroksida. Pada tahap kedua peroksidasi lemak, asam lemak yang sudah banyak terbentuk menjadi radikal akan terdekomposisi menjadi senyawa yang lebih sederhana dan relatif stabil, yaitu MDA (malonaldehida). Uji aktivitas antioksidan dilakukan setelah pengukuran hidroperoksida yang merupakan produk primer oksidasi asam linoleat dengan metode diena terkonjugasi. Pengukuran potensi antioksidan dengan metode TBA lebih baik dilakukan setelah satu atau beberapa hari dari puncak absorbansi asam linoleat. Harapannya, semua hidroperoksida yang dihasilkan telah mengalami dekomposisi membentuk malonaldehida (Kikuzaki dan Nakatani, 1993). Prinsip dari metode TBA yaitu pengukuran serapan dengan menggunakan spektrofotometer dari reaksi MDA dengan TBA dan TCA yang akan membentuk banyaknya MDA pada panjang gelombang 532 nm.
Tabel III. Aktivitas antioksidan sampel dengan metode TBA
Absorbansi % inhibisi
16
KESIMPULAN DAN SARAN
17
DAFTAR PUSTAKA
Aqil, F., Ahmad, I., and Mehmood, Z., 2006, Antioxidant and Free Radical Scavenging Properties of Twelve Traditionally Used Indian Medicinal Plants, Turk J Biol, Vol.30, pp. 177-183.
Cindric, I.J., Kunstic, M., Zeiner, M., Stingeder, G., and Rusak, G., 2011, Sample Preparation Methods for The Determination of The Antioxidative Capacity of Apple Juice, Croat. Chem. Acta, 84 (3), pp. 142-143.
Conforti, F., Statti, G., Uzunov, D. and Menichini, F., 2006, Comparative chemical composition and antioxidant activities of wild and cultivated Laurus nobilis L. leaves and Foeniculum vulgare subsp. Piperitum (Ucria) coutinho seeds, Biological and Pharmaceutical Bulletin, 29 (10): 2056-2064.
Departemen Kesehatan Republik Indonesia, 1995, Farmakope Indonesia, Edisi IV, Jakarta: Departemen Kesehatan Republik Indonesia.
Emynur Shafekh, S., Catherine, C.C.W., Siti Syakiroh, Z.A., Ummu Habibah, A, Norhayati, A.H., Nor Farhanah, 2012, Total Phenolic content and in vitro Antioxidant Activity of Vigna sinensis, International Food Research Journal, 19(4): 1393-1400.
Fang YZ.., Yang S., Wu G., 2002, Free Radicals, Antioxidant, and Nutrition, Nutrition 18:872-879.
Fiuza, S.M., 2004, Phenolic Acid Derivates with Potential Anticancer Properties, A Structure Activity Relationship Study, Part 1: Methyl, Propyl, and Octyl Esters of Caffeic and Gallic Acids, Elsevier, Bioorganic and Medicinal Chemistry, 12(2004), pp. 3581-3589.
Gandjar, I.B., dan Rohman, A., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta, hal. 220-251, 353-365.
Halliwell, B. & Gutteridge, J.M.C., 1984, Oxygen Toxicity, Oxygen Radicals, Transition Metals and Disease, Biochemical Journal, Vol. 218, pp. 1-14, ISSN: 0264-6021.
Harborne, J., 1996. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Cetakan kedua. Penerjemah: Padmawinata, K. dan I. Soediro. Bandung: Penerbit ITB.
Huda-Faujan, N., Noriham, A., Norrakiah, A. S., and Babji, A. S., 2009, Antioxidant activity of plants methanolic extracts containing phenolic compounds, African Journal of Biotechnology 8 (3): 484-489.
Joshi, A., Bhobe, M., Saatarkar, A., 2013, Phytochemical Investigation of The Roots of Grewia microcos Linn., J. Chem. Pharm. Res., 5:80-87.
18
Kinsella, J.E., et al., 1993, Possible Mechanism for The Protective Role of Antioxidants in Wine and Plants Foods, J Food Technology, Vol. 4, Issue 5, p. 89.
Kusumanto, 2014, Uji Aktivitas Antioksidan Menggunakan Metode Deoksiribosa dan Penetapan Kandungan Fenolik Total pada Fraksi Etil Asetat Ekstrak Etanol Buah Jambu Mete (Annacardium occidentale L.), Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Marliana, S.D., V. Suryanti, Suyono, 2005, Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq. Swartz.) dalam Ekstrak Etanol,Biofarmasi, 3(1):26-31.
McMurry, J. And R.C. Fay, 2004, McMurry Fay Chemistry, 4th Edition, Belmont, CA.: Pearson Education International.
Nahak, G., and Sahu, R.K., 2011, Phytochemical Evaluation and Antioxidant activity of Piper cubeba and Piper nigrum, Journal of Applied Pharmaceutical Science, Vol. 08, pp 153-157.
Ncube NS, Afolayan AJ, Okoh AI., 2008, Assessment Techniques of Antimicrobial Properties of Natural Compounds of Plant Origin: Current Methods and Future Trends, African Journal of Biotechnology, 7 (12): 1797-1806.
Parmar VS, Jain SC, Bisht KS, Jain R, Taneja P, Jha A, Tyagi OD., 1997 Phytochemistry of the genus Piper, Phytochemistry, 46: 597-673.
Pelozo, M.I.G.; Cardoso, M.L.C.; Mello, J.C.P., 2008, Spectrophotometric determination of tannins and caffeine in preparations from Paullinia. cupana var. sorbilis. Braz. Arch. Biol. Technol, 51, 447–451.
Rajanandh, M.G., Kavitha, J., 2010. Quantitative Estimation of Bsitosterol, Total Phenolic and Flavonoid Compounds in The Leaves of Moringa oleifera. Int. J. Pharm Tech Res. 2, 1409–1414.
Saraswaty V., Risdian C., Budiwati T.A., dan Tjandrawati M., 2013, Aktivitas Antioksidan dari Kombinasi Ekstrak Etanol Kulit Manggis, Daun Sirsak, dan Daun Sirih Merah, Pusat Penelitian Kimia LIPI, Bandung, 196-200. Sangi, M., M.R.J. Runtuwene., H.E.I. Simbala., V.M.A. Makang, 2008, Analisis
Fitokimia Tumbuhan Obat Di Kabupaten Minahasa Utara, Chem. Prog., 1(1):47-53.
Siadi. K., 2012, Ekstrak bungkil biji jarak pagar (Jatropa curcas) sebagai biopestisida yang efektif dengan penambahan larutan NaCl, Jurnal Mipa 35(2): 77-83.
19
Svehla, G. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi kelima. Penerjemah: Setiono, L. dan A.H. Pudjaatmaka. Jakarta: PT Kalman Media Pusaka.
Tiwari, P., Kumar, B., Kaur, M., Kaur, G., Kaur, H., 2011, Phytochemical Screening and Extraction: A Review, Internationale Pharmaceutica Sciencia, Vol. 1, India, pp. 98-106.
Trease G.E., and W.C. Evans., 1989, Pharmacognosy, 14th Edition, Brown Publication.
20
21
22
23
Lampiran 3. Klasifikasi dari daun Rinu (Piper baccatum BL.)
Kerajaan : Plantae
Tumbuhan : Magnoliophyta Cronquist Kelas : Magnoliopsida
Bangsa : Piperales Dumortier Suku : Piperaceae Giseka Marga : Piper L
24
Lampiran 4. Contoh Perhitungan Karakterisasi Simplisia Daun Rinu (Piper baccatum)
Perhitungan penetapan kadar air Kadar Air Simplisia =
Keterangan Berat Simplisia (g) Kadar Air (%) Rata-Rata
25
Lampiran 5. Gambar Hasil Uji Tabung Skrining Fitokimia 1. Pemeriksaan Alkaloid dengan Pereaksi Mayer
Blanko Larutan uji (sampel) Foto uji tabung pemeriksaan alkaloid dengan pereaksi mayer Keterangan gambar :
Blanko mayer : HCl + pereaksi Mayer
26
2. Pemeriksaan alkaloid dengan pereaksi Dargendroff
Blanko Larutan uji (sampel ) Foto uji tabung pemeriksaan alkaloid dengan pereaksi Dargendroff Keterangan gambar :
Blanko : HCl 1% dan reagen Dargendroff
27
3. Pemeriksaan flavonoid dengan pereaksi tembaga asetat
Larutan uji Blanko
Keterangan gambar :
Blanko : larutan ekstrak
28
4. Pemeriksaan tanin dan polifenol dengan FeCl3 dan gelatin
Tabung A Tabung B Tabung C Keterangan gambar :
Tabung A : larutan ekstrak metanol
29
5. Pemeriksaan saponin
Keterangan gambar :
30
6. Pemeriksaan terpenoid dan streroid
Larutan uji Blanko Keterangan gambar :
Blanko : larutan ekstrak metanol
31
Lampiran 6. Perhitungan Rendemen Sampel - Rendemen ekstrak metanol
Penimbangan
Bobot serbuk daun sirih rinu yang digunakan 10, 05 gram Bobot beker kosong = 35,0912 g
Bobot beker + serbuk = 45,1412 g Bobot serbuk = 10,05 g
Bobot tetap ekstrak metanol
Bobot cawan kosong = 48,6956 g Bobot cawan + ekstrak = 49,5475 g Bobot ekstrak yang didapat = 0,8519 g
% Rendemen ekstrak metanol =
=
32
Lampiran 7. Hasil Optimasi Operating Time (OT) Untuk Uji Aktivitas Antioksidan dengan Metode FTC
Menit ke - Absorbansi
Pengukuran 1 Pengukuran 2 Pengukuran 3
1 0,985 0,959 0,948
3 0,918 0,907 0,899
5 0,875 0,875 0,874
7 0,864 0,862 0,860
10 0,855 0,853 0,853
OT yang didapatkan adalah 5 menit Penimbangan BHT (kontrol positif)
33
Lampiran 8 . Hasil Optimasi Panjang Gelombang Maksimum Untuk Uji Aktivitas Antioksidan dengan Metode FTC
34
35
36
Lampiran 9. Data Penimbangan Untuk Uji Aktivitas Antioksidan Metode FTC-TBA
1. Penimbangan BHT (kontrol positif)
Bobot (gram)
Berat beker (g) 62,4275
Berat beker + isi (g) 62,4316
Berat asam galat (g) 0,0041
2. Penimbangan sampel ekstrak metanol daun rinu
37
Lampiran 10. Hasil Pengukuran Uji Aktivitas Antioksidan dengan Metode FTC a. Nilai absorbansi kontrol negatif
Hari ke
Absorbansi Kontrol Negatif
Absorbansi Kontrol
Positif Sampel Ekstrak Metanol
R. 1 R. 2 R. 3 R. 1 R. 2 R. 3 R. 1 R. 2 R. 3
Berdasarkan hasil pembacaan selama 7 hari pada pengukuran absorbansi kontrol negatif dengan spektrofotometer UV/Vis maka dapat disimpulkan bahwa pada hari keenam reaksi peroksidasi lipid telah mencapai batas maksimum.
b. Profil absorbansi kontrol negatif, kontrol positif, dan sampel
Hari ke
Rata-rata ± SD
38
c. Grafik rata-rata absorbansi kontrol negatif, kontrol positif, dan sampel ekstrak
d. Perhitungan nilai % inhibisi dengan metode FTC % inhibisi = ( A0 – A1)/ A0 x 100%
Profil kenaikan rata-rata absorbansi kontrol negatif, kontrol positif, dan sampel ekstrak
Kontrol negatif
39
% inhibisi rata-rata yang dihasilkan ekstrak metanol daun rinu adalah 9,606 % dengan CV 2,738 %.
e. Grafik rata-rata % inhibisi kontrol positif dan sampel
0 5 10 15
% inhibisi (%)
Grafik rata-rata % inhibisi kontrol
positif dan sampel
Rata-rata % inhibisi sampel
40
Lampiran 11. Hasil Pengukuran Uji Aktivitas Antioksidan dengan Metode TBA a. Nilai absorbansi kontrol negatif, kontrol positif, dan sampel ekstrak
b. Profil absorbansi kontrol negatif, kontrol positif, dan sampel Rata-rata ± SD
Kontrol Negatif Kontrol Positif Sampel
1,001 ± 0,004 0,168 ± 0,009 0,091 ± 0,008
c. Perhitungan nilai % inhibisi dengan metode TBA % inhibisi = ( A0– A1/ A0 ) x 100%
Positif Sampel Ekstrak Metanol R.1 R.2 R.3 R.1 R.2 R.3 R.1 R.2 R.3
41
Lampiran 12. Data Penimbangan Uji Kandungan Fenolik Total 1. Penimbangan asam galat
Replikasi 1 Replikasi 2 Replikasi 3 Berat beker (g) 63,7284 61,4635 62,1535 Berat beker + isi (g) 63,7385 61,4735 62,1636 Berat asam galat (g) 0,0101 0,01 0,0101 2. Penimbangan ekstrak metanol
42
Lampiran 13. Perhitungan Konsentrasi Asam Galat dan Ekstrak Metanol untuk Penetapan Kandungan Fenolik Total
a. Contoh perhitungan konsentrasi asam galat
Bobot asam galat replikasi 1 = 0,0101 gram = 10,1 mg Konsentrasi larutan stok asam galat =
⁄ ⁄
43
Sehingga diperoleh seri konsentrasi :
Replikasi 1
( g/mL ) Replikasi 2 ( g/mL ) Replikasi 3 ( g/mL )
Seri 1 40,4 40 40,4
Seri 2 50,5 50 50,5
Seri 3 60,6 60 60,6
Seri 4 70,7 70 70,7
Seri 5 80,8 80 80,8
b. Perhitungan konsentrasi ekstrak metanol
Bobot metanol replikasi 1 = 0,0101 gram = 10,1 mg Konsentrasi larutan stok ekstrak =
⁄ ⁄
Pengenceran ekstrak metanol replikasi 1 : V1 . C1 = V2 . C2
2 mL . 1010 ⁄ = 10 mL . C2
C2 = 202 ⁄
Sehingga diperoleh konsentrasi larutan uji ekstrak metanol :
Replikasi 1 Replikasi 2 Replikasi 3
44
Lampiran 14. Uji Pendahuluan Uji Fenolik
Larutan uji Kontrol + Kontrol -
Keterangan :
Kontrol positif : reagen Folin-Ciocalteu, larutan Na2CO3 1 M, asam galat Kontrol negatif : reagen Folin-Ciocalteu dan larutan Na2CO3 1 M
45
Lampiran 15. Hasil Optmasi Operating Time (OT) untuk Penetapan Kandungan Fenolik Total
a. Replikasi 1 Menit
Ke -
Absorbansi pada panjang gelombang 750 nm
40,4 ( g/mL ) 60,6 ( g/mL ) 80,8 ( g/mL )
Pada replikasi 1, OT yang didapat adalah 30 menit b. Replikasi 2
Menit Ke -
Absorbansi pada panjang gelombang 750 nm
40 ( g/mL ) 60 ( g/mL ) 80 ( g/mL )
46
c. Replikasi 3 Menit Ke
-
Absorbansi pada panjang gelombang 750 nm
40,4 ( g/mL ) 60,6 ( g/mL ) 80,8 ( g/mL )
5 0,344 0,408 0,581
10 0,368 0,490 0,610
15 0,377 0,532 0,627
20 0,384 0,544 0,636
25 0,386 0,549 0,640
30 0,386 0,548 0,641
35 0,387 0,548 0,640
40 0,386 0,549 0,640
45 0,386 0,549 0,640
50 0,386 0,550 0,639
55 0,385 0,537 0,638
60 0,385 0,546 0,638
47
Lampiran 16. Optimasi Panjang Gelombang Maksimum untuk Penetapan Kandungan Fenolik Total
48
49
50
Lampiran 17. Hasil Pengukuran Kurva Baku untuk Penetapan Kandungan Fenolik Total
a. Replikasi 1
Seri Konsentrasi ( g/mL ) Absorbansi Persamaan Kurva Baku
1 40,4 0,349
Seri Konsentrasi ( g/mL ) Absorbansi Persamaan Kurva Baku
1 40 0,390
Seri Konsentrasi ( g/mL ) Absorbansi Persamaan Kurva Baku
51
Lampiran 18. Perhitungan Kandungan Fenolik Total Ekstrak Metanol
Konsentrasi
( g/mL ) Absorbansi fenolik total Kandungan
Rata-rata
Contoh perhitungan kandungan fenolik total replikasi 1 y = 0,0066x + 0,0974
0,301 = 0,0066x + 0,0974
x = 30,8485 g/mL = 0,0308485 mg/mL Bobot ekstrak = 0,0101 gram
Volume = faktor pengenceran x volume akhir larutan uji = 5 x 10 mL = 50 mL
Kandungan fenolik total =
= 0,0308485 .
152,715
52
Lampiran 19. Uji Statistika dengan Kurtosis Skewness, One Sample Test
FTC
Uji distribusi normal Kurtosis Skewness
53
TBA
Uji distribusi normal Kurtosis Skewness
54
BIOGRAFI PENULIS