KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
DAUN CINCAU PERDU (Premna oblongifolia Meer.)
DENGAN METODE DPPH
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada fakultas Farmasi
Universitas Sumatera Utara
OLEH:
HENDRA KURNIAWAN
NIM 091524084
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
DAUN CINCAU PERDU (Premna oblongifolia Meer.)
DENGAN METODE DPPH
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada fakultas Farmasi
Universitas Sumatera Utara
OLEH:
HENDRA KURNIAWAN
NIM 091524084
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat
kasih dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini. Adapun tujuan penelitian ini adalah untuk mengetahui
golongan senyawa kimia dan untuk mengetahui kekuatan antioksidan dalam
meredam radikal bebas DPPH srta kapasitas antioksidan dari daun cincau
(Premna oblongifolia Meer.), yang merupakan salah satu syarat memperoleh gelar
Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang
sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku
Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan
fasilitas selama masa pendidikan. Ibu Prof. Dr. Rosidah, M.Si., Apt., dan Bapak
Drs. Suryadi Achmad, M.Sc., Apt., yang membimbing penulis dengan penuh
kesabaran dan tanggung jawab selama penelitian hingga selesainya penyusunan
skripsi ini. Kepala Departemen Ibu Dr. Marline Nainggolan, MS., Apt., yang telah
mengoreksi skripsi dan memberikan arahan, Bapak dan Ibu staf pengajar Fakultas
Farmasi Universitas Sumatera Utara yang telah mendidik selama perkuliahan.
Bapak dan Ibu Kepala Laboratorium Farmakognosi dan Laboratorium Penelitian
yang telah memberikan fasilitas, petunjuk dan membantu selama penelitian. Ibu
Dr. Marline Nainggolan, M.S., Apt., Dra. Aswita Hafni Lubis, M.Si., Apt., Dra.
Erly Sitompul, M.Si., Apt., dan Prof. Dr. Rosidah, M.Si.,Apt., selaku dosen
penguji yang memberikan masukan, kritik, arahan dan saran dalam penyusunan
Penulis juga ingin mempersembahkan rasa terima kasih kepada orang tua
tercinta, abang, kakak, ponakan yang selalu setia memberi doa, dorongan dan
semangat.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, Mei 2015
Penulis,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAUN CINCAU PERDU (Premna oblongifolia Merr.) DENGAN METODE DPPH
ABSTRAK
Daun cincau perdu (Premna oblongifolia Merr.) termasuk suku Verbenaceae, mudah tumbuh dan diperoleh. Secara tradisional digunakan oleh masyarakat sebagai obat sakit perut, demam, penyegar dan penambah stamina. Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, kandungan senyawa kimia, dan aktivitas antioksidan dari ekstrak etanoldaun cincau perdu.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Pengujian aktivitas antioksidan dari ekstrak etanol daun cincau perdu menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) setelah 60 menit pada suhu kamar dengan panjang gelombang 517 nm dan BHT (butyl hydroxytoluene) sebagai pembanding.
Hasil yang diperoleh dari pemeriksaan karakteristik simplisia adalah kadar air 7,22%, kadar sari yang larut air 23,67%, kadar sari yang larut dalam etanol 13,64%, kadar abu total 8,48%, kadar abu yang tidak larut dalam asam 0,51%. Hasil skrining fitokimia, serbuk simplisia mengandung senyawa flavonoid, glikosida, saponin, tanin dan steroida/triterpenoida. Hasil uji aktivitas antioksidan dalam menurunkan radikal bebas DPPH diperoleh nilai Inhibitory Concentration
(IC50) ekstrak etanol daun cincau sebesar 40,575 ppm dan untuk BHT diperoleh
IC50 sebesar 2,902 ppm. Ekstrak etanol daun cincau memiliki aktivitas antioksidan
yang sangat kuat, namun masih lebih rendah dibandingkan dengan BHT.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOX IDANT ACTIVITY ASSAY OF ETHANOL EXTRACT OF
GRASS JELLY LEAVES (Premna oblongifolia Merr.) BY USING DPPH METHOD
ABSTRACT
Grass jelly leaves (Premna oblongifolia Merr.) including Verbenaceae are easy to grow and acquired. Traditionally used by the public as an upset stomach, fever, and toners. The purpose of this study was to determine the characteristics of the simplex, chemical compounds content and the antioxidant activity of ethanol extract of grass jelly leaves.
Simplex characterization including level of water content, level of water-soluble extract, level of ethanol-water-soluble extract, level of total ash, and level of ash not soluble in acid. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tanin, and steroid/triterpenoid. The antioxidant activity assay of ethanol extract of grass jelly leaves by using DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method after 60 minutes at room temperature with wave length 517 nm and BHT (butyl hydroxytoluene) as standard of comparison.
The result obtained from simplex characterization are level of water content 7.22%, level of water-soluble extract 23.67%, level of ethanol-soluble extract 13.64%, level of total ash 8.48%, and level of ash not soluble in acid 0.51%. The result of phytochemical screening, it contained flavonoid, glycoside, saponin, tanin and steroid/triterpenoid. The result of antioxidant activity in reducing DPPH free radical obtained Inhibitory Concentration (IC50) value of
ethanol extract of grass jelly leaves 40.575 ppm and BHT 2.902 ppm. Ethanol extract of grass jelly leaves has a very strong antioxidant activity, but lower than BHT.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2Perumusan Masalah ... 3
1.3Hipotesis ... 3
1.4Tujuan Penelitian ... 3
1.5Manfaat Penelitian ... 4
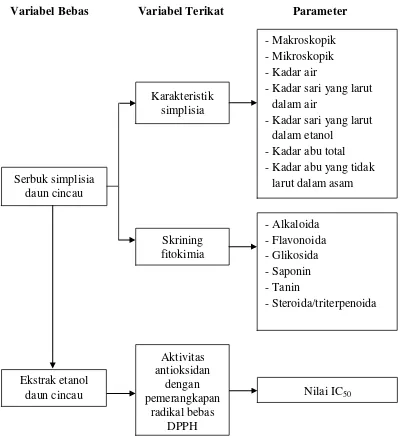
1.6 Kerangka Pikir Penelitian ... 5
BAB IITINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Morfologi tumbuhan ... 7
2.1.2 Sistematika tumbuhan ... 7
2.1.4 Khasiat tumbuhan ... 8
2.1.5 Jenis – jenis cincau ... 8
2.2Ekstrak ... 8
2.3 Radikal Bebas ... 10
2.4 Antioksidan ... 11
2.5 Spektrofotometri UV-Visible ... 13
2.6 Metode Pemerangkapan Radikal ... 14
2.6.1 Pelarut ... 15
2.6.2 Pengukuran absorbansi ... 16
2.6.3Waktu pengukuran ... 16
BAB IIIMETODE PENELITIAN ... 17
3.1 Alat ... 17
3.2 Bahan ... 17
3.3 Penyiapan Bahan Tumbuhan ... 18
3.3.1 Pengumpulan bahan tumbuhan ... 18
3.3.2 Identifikasitumbuhan ... 18
3.3.3 Pengolahan bahan ... 18
3.4 PembuatanPereaksi ... 19
3.4.1 Pereaksi besi ( III ) klorida 1% ... 19
3.4.2 Pereaksi timbal ( II ) asetat 0,4 M ... 19
3.4.3 Pereaksi natrium hidroksida 2 N ... 19
3.4.4 Pereaksi asam klorida 2 N ... 19
3.4.5 Pereaksi asam sulfat 2 N ... 19
3.4.6 Pereaksi kloralhidrat ... 19
3.4.8 PereaksiMolish ... 20
3.4.9 Pereaksi Dragendroff ... 20
3.4.10 Pereaksi Bouchardat ... 20
3.4.11 Pereaksi Lieberman-Burchard ... 20
3.5 Pemeriksaan Karakteristik Simplisia ... 21
3.5.1 Pemeriksaan makroskopik ... 21
3.5.2 Pemeriksaan mikroskopik ... 21
3.5.3 Penetapan kadar Air ... 21
3.5.4 Penetapan kadar sari larut air ... 22
3.5.5 Penetapan kadar sari larut etanol ... 23
3.5.6 Penetapan kadar abu total ... 23
3.5.7 Penetapan kadar abu tidak larut asam ... 23
3.6 Skrining Fitokimia ... 24
3.6.1 Pemeriksaan alkaloid ... 24
3.6.2 Pemeriksaan flavonoid ... 24
3.6.3 Pemeriksaan glikosida ... 25
3.6.4 Pemeriksaan saponin ... 25
3.6.5 Pemeriksa antanin ... 25
3.6.6 Pemeriksaan steroid/triterpenoid ... 26
3.7 PembuatanEkstrak Etanol Daun Cincau ... 26
3.8 Pengujian Aktivitas Antioksi dan Dengan MenggunakanAlat Spektrofotometer UV-Visibel ... 26
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH ... 26
3.8.2 Pembuatan larutan ... 27
3.8.4 Waktu pengukuran ... 28
3.8.5 Analisis persen pemerangkapan radikal bebas ... 29
3.8.6 Analisis nilai IC50 ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Hasil Identifikasi Tumbuhan ... 42
4.2 Hasil Karakterisasi Simplisia ... 43
4.2.1 Hasil pemeriksaan makroskopik ... 44
4.2.2 Hasil pemeriksaan mikroskopik ... 45
4.2.3 Hasil pemeriksaan karakteristik ... 31
4.3 kriningFitokimia ... 32
4.4 Hasil Pengujian Aktivitas Antioksidan ... 33
4.4.1 Hasil penentuan panjang gelombang maksimum ... 33
4.4.2 Hasil analisis aktivitasantioksi dan sampel uji ... 34
4.4.3 Hasil analisis nilai IC50 ... 36
BAB VKESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Halaman
Tabel
4.1 Hasil pemeriksaan karakteristik simplisia daun cincau ... 31
4.2 Hasil skrining fitokimia simplisia daun cincau ... 32
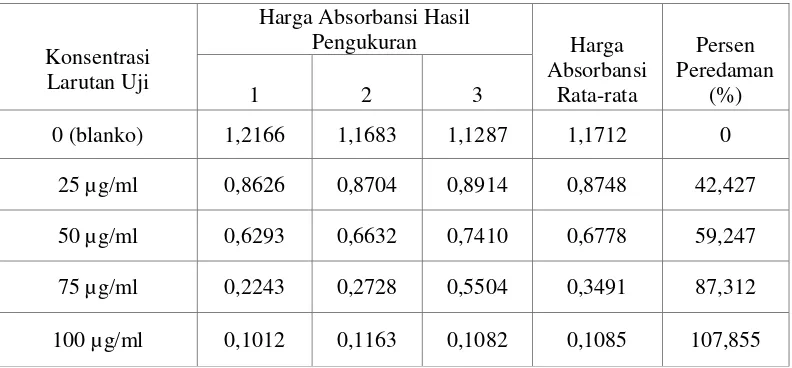
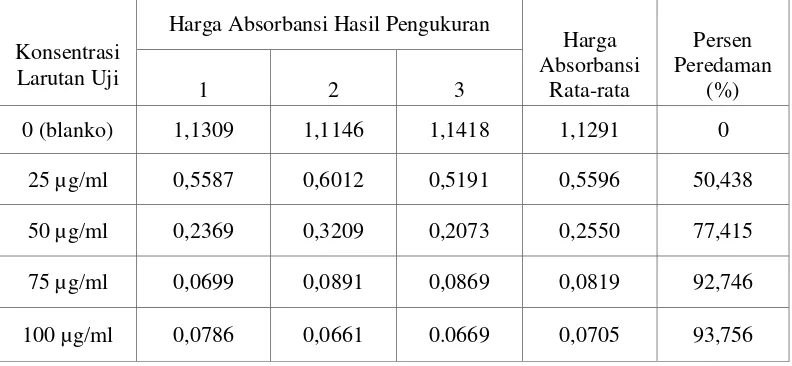
4.3 Data penurunan absorbansi dan persen peredaman DPPH oleh
DAFTAR GAMBAR
Halaman
Gambar
1.1 Skema kerangka pikir penelitian ... 5
4.1 Kurva serapan maksimum DPPH40 ppm dalam metanol
menggunakan spektrofotometer UV-Visibel ... 33
4.2 Grafik uji aktivitas antioksi dan ekstrak etanol daun cincau. ... 36
DAFTAR LAMPIRAN
Halaman
Lampiran
1 Surat hasil identifikasi tumbuhan ... 42
2 Bagan kerja penelitian ... 43
3 Gambar bahan tumbuhan ... 44
4 Gambar simplisia dan hasil mikroskopik daun cincau ... 45
5 Gambar alat spektrofotometer UV-Visibel (Shimadzu) ... 46
6 Perhitungan pemeriksaan karakteristik serbuk simplisia ... 47
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAUN CINCAU PERDU (Premna oblongifolia Merr.) DENGAN METODE DPPH
ABSTRAK
Daun cincau perdu (Premna oblongifolia Merr.) termasuk suku Verbenaceae, mudah tumbuh dan diperoleh. Secara tradisional digunakan oleh masyarakat sebagai obat sakit perut, demam, penyegar dan penambah stamina. Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, kandungan senyawa kimia, dan aktivitas antioksidan dari ekstrak etanoldaun cincau perdu.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Pengujian aktivitas antioksidan dari ekstrak etanol daun cincau perdu menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) setelah 60 menit pada suhu kamar dengan panjang gelombang 517 nm dan BHT (butyl hydroxytoluene) sebagai pembanding.
Hasil yang diperoleh dari pemeriksaan karakteristik simplisia adalah kadar air 7,22%, kadar sari yang larut air 23,67%, kadar sari yang larut dalam etanol 13,64%, kadar abu total 8,48%, kadar abu yang tidak larut dalam asam 0,51%. Hasil skrining fitokimia, serbuk simplisia mengandung senyawa flavonoid, glikosida, saponin, tanin dan steroida/triterpenoida. Hasil uji aktivitas antioksidan dalam menurunkan radikal bebas DPPH diperoleh nilai Inhibitory Concentration
(IC50) ekstrak etanol daun cincau sebesar 40,575 ppm dan untuk BHT diperoleh
IC50 sebesar 2,902 ppm. Ekstrak etanol daun cincau memiliki aktivitas antioksidan
yang sangat kuat, namun masih lebih rendah dibandingkan dengan BHT.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOX IDANT ACTIVITY ASSAY OF ETHANOL EXTRACT OF
GRASS JELLY LEAVES (Premna oblongifolia Merr.) BY USING DPPH METHOD
ABSTRACT
Grass jelly leaves (Premna oblongifolia Merr.) including Verbenaceae are easy to grow and acquired. Traditionally used by the public as an upset stomach, fever, and toners. The purpose of this study was to determine the characteristics of the simplex, chemical compounds content and the antioxidant activity of ethanol extract of grass jelly leaves.
Simplex characterization including level of water content, level of water-soluble extract, level of ethanol-water-soluble extract, level of total ash, and level of ash not soluble in acid. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tanin, and steroid/triterpenoid. The antioxidant activity assay of ethanol extract of grass jelly leaves by using DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method after 60 minutes at room temperature with wave length 517 nm and BHT (butyl hydroxytoluene) as standard of comparison.
The result obtained from simplex characterization are level of water content 7.22%, level of water-soluble extract 23.67%, level of ethanol-soluble extract 13.64%, level of total ash 8.48%, and level of ash not soluble in acid 0.51%. The result of phytochemical screening, it contained flavonoid, glycoside, saponin, tanin and steroid/triterpenoid. The result of antioxidant activity in reducing DPPH free radical obtained Inhibitory Concentration (IC50) value of
ethanol extract of grass jelly leaves 40.575 ppm and BHT 2.902 ppm. Ethanol extract of grass jelly leaves has a very strong antioxidant activity, but lower than BHT.
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia memiliki beragam tanaman yang dapat digunakan sebagai obat.
Seiring dengan kemajuan ilmu teknologi, para ilmuwan terus melakukan
penelitian tentang khasiat tumbuhan. Terdapat empat jenis tumbuhan cincau yang
telah dikenal dan dimanfaatkan masyarakat yaitu cincau hijau bulu rambat
(Cyclea barbata Meer), cincau hitam (Mesona palustris), cincau minyak
(Stephania hermandifolia), cincau perdu (Premna oblongifolia Meer). Secara
tradisional tumbuhan cincau digunakan sebagai bahan baku minuman yang
berkhasiat sebagai penyegar, obat sakit perut dan demam (Anonim, 2009).
Menurut Setijo cincau perdu bermanfaat sebagai bahan pangan
terutama sebagai bahan baku minuman yang telah dikenal sejak lama. Selain itu,
cincau perdu berkhasiat sebagai obat karena mengandung serat alami yang mudah
dicerna oleh tubuh manusia. Serat alami berperan dalam proses pencernaan
makanan dan mencegah timbulnya penyakit kanker usus. Gelatin cincau
bermanfaat untuk mengobati panas dalam dan sakit perut. Tumbuhan cincau perdu
(Premna oblongifolia Meer.) dapat tumbuh di daerah dataran rendah sampai
ketinggian 1500 meter dari permukaan laut, tumbuhan ini tumbuh ditepi hutan,
lereng-lereng jurang, di semak-semak. Namun, ada juga yang di budidayakan di
pekarangan. Tumbuhan ini tersebar di daerah Cina, India, Taiwan, Jepang,
Vietnam, Hawai, Malaysia, Filipina, Jawa Barat, Jawa Tengah (Setijo, 2008).
Cincau adalah gel serupa agar-agar yang diperoleh dari perendaman daun
tumbuhan tersebut mengandung karbohidrat yang mampu mengikat
molekul-molekul air. Kata cincau sendiri berasal dari dialek Hokkian sienchau yang lazim
dilafalkan di kalangan Tianghoa di Asia Tenggara ( Setijo, 2008).
Industri cincau terdapat di Surakarta, Jawa Tengah dan Jakarta. Tumbuhan
cincau yang telah dipanen selanjutnya di keringkan dengan cara
menghamparkannya di atas permukaan tanah, hingga warnanya berubah dari hijau
menjadi cokelat tua. Tumbuhan cincau yang telah kering inilah yang merupakan
bahan baku utama pembuatan cincau perdu. Daun cincau perdu mengandung
senyawa kimia golongan alkaloid, flavonoid, glikosida, saponin, tanin, dan
steroid/triternoid. Salah satu antioksidan alami yang berperan sebagai antioksidan
adalah flavonoid dan tanin. Senyawa ini berperan sebagai penangkap radikal
bebas (Setijo, 2008).
Radikal bebas adalah suatu senyawa atau molekul yang mengandung satu
atau lebih elektron yang tidak berpasangan. Adanya elektron yang tidak
berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan,
dengan cara menyerang dan mengikat elektron molekul yang ada di sekitarnya.
Radikal bebas sangat berbahaya dikarenakan tingginya reaktivitas yang
menyebabkan terbentuknya senyawa radikal baru. Bila radikal baru tersebut
bertemu dengan molekul lain, maka akan terbentuk molekul lagi dan seterusnya
sehingga terjadi reaksi berantai. Radikal bebas dapat di jumpai pada lingkungan,
misalnya asap rokok, polusi udara, obat, bahan beracun, makanan dalam kemasan,
dan sinar ultraviolet matahari yang menyebabkan radiasi ( Kumalaningsih, 2006).
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau
lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat
mampu menghambat terjadinya penyakit degenerasi serta mampu menghambat
peroksidase lipid pada makanan. Dalam tubuh kita terdapat sistem enzim
(misalnya enzim superoksida dismutase) yang dapat berperan sebagai antioksidan.
Enzim ini dapat berperan aktif dalam menanggulangi masalah radikal bebas. Jika
di dalam tubuh jumlah radikal bebas lebih banyak dari enzim yang terdapat di
dalam tubuh, saat itulah tubuh memerlukan tambahan antioksidan dari luar tubuh
(Kumalaningsih, 2006).
Sumber-sumber antioksidan dari luar tubuh dapat berupa antioksidan
sintetik maupun antioksidan alami. Tetapi saat ini penggunaan antioksidan sintetik
mulai dibatasi karena ternyata dari hasil penelitian yang telah dilakukan bahwa
antioksidan sintetik seperti BHT (Butylated Hydroxy Toluena) bersifat
karsinogenik. Oleh karena itu industri makanan dan industri obat-obatan beralih
mengembangkan antioksidan alami dan mencari sumber-sumber antioksidan
alami baru (Zuhra, dkk., 2008).
Berdasarkan uraian di atas, penulis tertarik untuk melakukan uji
karakteristik simplisia, skrining fitokimia serta uji aktivitas antioksidan dengan
metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH) dari
ekstrak etanol daun cincau perdu (Premna oblongifolia Merr).
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan
masalah dalam penelitian ini adalah:
a. Apakah karakteristik simplisia daun cincau perdu hasil penelitian ini dapat
b. Apakah golongan senyawa kimia yang terkandung dalam simplisia daun
cincau perdu?
c. Apakah ekstrak etanol daun cincau perdu mempunyai aktivitas antioksidan?
d. Berapakah nilai IC50 ekstrak etanol daun cincau perdu menggunakan metode
DPPH sebagai antioksidan?
1.3 Hipotesis
a. Simplisia daun cincau perdu mempunyai karakteristik yang dapat digunakan
sebagai pembanding pada penelitian selanjutnya.
b. Kandungan golongan senyawa kimia yang terdapat dalam simplisia daun
cincau perdu adalah golongan alkaloid, flavonoid, glikosida, saponin, tanin
dan steroid/triterpenoid
c. Ekstrak etanol daun cincau perdu mempunyai aktivitas sebagai antioksidan.
d. Nilai IC50 ekstrak etanol daun cincau perdu menggunakan metode DPPH
sebagai antioksidan adalah < 50 ppm.
1.4 Tujuan
a. Untuk memperoleh karakteristik
b. Untuk mengetahui golongan senyawa kimia
c. Mempunyai aktivitas antioksidan
d. untuk mengetahui kekuatan antioksidan dalam meredam radikal bebas DPPH
serta kapasitas antioksidan dari daun cincau perdu
1.5 Manfaat Penelitian
Penelitian ini sebagai informasi tentang aktivitas antioksidan dari
simplisia daun cincau perdu sehingga dapat menjadi acuan untuk peneliti
1.6Kerangka Pikir Penelitian
Kerangka pikir penelitian ini dapat dilihat pada gambar 1.1 dibawah ini:
Gambar 1.1 Skema kerangka pikir penelitian Aktivitas
-Kadar sari yang larut dalam air
-Kadar sari yang larut dalam etanol
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi morfologi tumbuhan, sistematika tumbuhan,
kandungan kimia, khasiat dari tumbuhan dan jenis-jenis cincau.
2.1.1 Morfologi tumbuhan
Tumbuhan cincau perdu mempunyai ciri-ciri morfologi sebagai berikut:
Batang tegak, tinggi 1-3 meter, bulat, berkayu, berwarna hijau berkilat. Daun
bagian atas licin, anak daun berhadapan, panjang 15-20 cm, lebar 13 cm, helaian
daun tipis, ujung dan pangkal lancip, tepi daun rata, tulang daun melengkung
(Setijo, 2008).
2.1.2 Sistematika tumbuhan
Berikut adalah sistematika tumbuhan: (Setijo, 2008)
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Lamiaceae
Suku : Verbenaceae
Spesies : Premna oblongifolia Meer.
Sinonim : Premna oblongifolia var clemensorum Moldenke
Nama Asing : Shao xian cao (Cina), Vietnam (Thach den).
2.1.3 Kandungan kimia
Kandungan kimia primer antara lain: protein, lemak, serat, karbohidrat,
klorofil. Senyawa kimia skunder yang terkandung dalam daun cincau perdu antara
lain: saponin, glikosida, flavonoid, alkaloid, tanin, steroid/triternoid.
Kandungan gizi cincau perdu per 100 gram bahan
Komponen zat gizi Jumlah
Kalori (kal) 122
Protein (gram) 6.0
Lemak(gram) 1.0
Hidrat arang(gram) 26.0
Kalsium (milligram) 100
Fosfor (miligram) 100
Besi (miligram) 3.3
Vitamin A (SI) 107.5
Vitamin B1 (miligram) 80.00
Vitamin C (gram) 17.00
Air (gram) 66.00
Bahan yang dapat dicerna (%) 40.00
Sumber : Direktorat Gizi, Departemen Kesehatan Indonesia, dalam
Pitojo dan Zumiyati (2005).
2.1.4 Khasiat Tumbuhan
Daun cincau perdu telah banyak digunakan untuk antioksidan, gangguan
pencernaan, menyejukkan perut, menurunkan kolesterol, mengontrol gula darah,
2.1.5 Jenis- jenis cincau
Tumbuhan cincau dapat tumbuh di daerah dataran rendah sampai
ketinggian 1500 meter dari permukaan laut. Tumbuhan ini tumbuh ditepi hutan,
lereng-lereng jurang, dan di semak-semak. Terdapat empat jenis tumbuhan cincau
yang telah dikenal dan dimanfaatkan masyarakat yaitu cincau hijau bulu rambat
(Cyclea barbata Meer), cincau hitam (Mesona palustris), cincau minyak
(Stephania hermandifolia ), cincau perdu ( Premna oblongifolia Meer ).
2.2 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Ditjen POM, 1995).
Metode ekstraksi menurut Agoes (2007), Anief (2000), Ditjen POM
(2000) dan Syamsuni (2006) ada beberapa cara, yaitu:
A. Cara Dingin
1. Maserasi
Maserasi adalah suatu cara penyarian simplisia dengan cara merendam
simplisia tersebut dalam pelarut dengan beberapa kali pengocokan atau
pengadukan pada temperatur kamar.
2. Perkolasi
Perkolasi adalah suatu cara penyarian simplisia menggunakan perkolator dimana
simplisianya terendam dalam pelarut yang selalu baru dan umumnya dilakukan pada
antara, tahap perkolasi sebenarnya (penetesan dan penampungan ekstrak) terus-menerus
sampai diperoleh ekstrak (perkolat).
B. Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya
dalam jangka waktu tertentu dimana pelarut akan terkondensasi menuju pendingin
dan kembali ke labu.
2. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana
pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh
membasahi sampel dan mengisi bagian tengah alat soklet. Tabung sifon juga terisi
dengan larutan ekstraksi dan ketika mencapai bagian atas tabung sifon, larutan
tersebut akan kembali ke dalam labu.
3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, umumnya dilakukan pada
suhu 40-60oC.
4. Infludasi
Infludasi adalah ekstraksi dengan pelarut air pada temperatur 90oC selama 15
menit.
5. Dekoktasi
Dekoktasi adalah ekstraksi pada suhu 90oC menggunakan pelarut air
selama 30 menit.
2.3 Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol. Perubahan ini akan menyebabkan proses
penuaan. Radikal bebas juga terlibat dan berperan dalam penyebab dari berbagai
penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner, katarak, dan
penyakit degenerasi saraf seperti parkinson (Silalahi, 2006).
Sifat radikal bebas yang tidak stabil menyebabkan reaksi menerima atau
memberikan elektron dengan molekul sekitarnya. Kebanyakan molekul ini bukan
radikal bebas melainkan makromolekul biologi seperti lipid, protein, asam
nukleat, dan karbohidrat. Dengan reaksi ini timbullah reaksi radikal bebas
beruntun yaitu terbentuknya radikal bebas baru yang bereaksi lagi dengan
makromolekul lain (Kosasih, dkk., 2004).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan
berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya dalam
makhluk hidup antara lain adalah golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), peroksidal (RO-2), peroksinitrit (ONOO-), asam
hipoklorit (HOCl), hydrogen peroksida (H2O2) (Silalahi, 2006).
Secara umum tahapan reaksi pembentukan radikal bebas adalah sebagai
berikut:
a) Inisiasi RH + initiator → R●
b) PropagasiR● + O2 → ROO● ROO●+ RH → ROOH + R●
c) Terminasi R● + R●→ RR ROO● + R●→ ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap
suatu radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap
terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan
radikal bebas yang lain sehingga menjadi tidak reaktif lagi. Ketika proses tersebut
terjadi maka siklus reaksi radikal telah berakhir (Kumalaningsih, 2006).
2.4 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang
dapat memberikan elektronnya kepada molekul radikal bebas tanpa terganggu
sama sekali dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih,
2006).
Menurut Kumalaningsih (2006), terdapat tiga macam antioksidan yaitu:
a. antioksidan yang dibuat oleh tubuh kita sendiri yang berupa enzim pada tubuh
manusia, contohnya: enzim superoksida dismutase.
b. antioksidan alami yang dapat diperoleh dari tanaman atau hewan, yaitu
tokoferol, vitamin C, betakaroten, flavonoid dan senyawa fenolik.
c. antioksidan sintetik, yang dibuat dari bahan-bahan kimia yaitu Butil Hidroksi
Anisol (BHA) dan Butil Hidroksi Toluen (BHT) yang ditambahkan dalam
makanan untuk mencegah kerusakan lemak.
Antioksidan dalam tubuh dibedakan atas tiga kelompok, yaitu (1)
antioksidan primer yang bekerja dengan cara mencegah terbentuknya radikal
bebas yang baru dan mengubah radikal bebas menjadi molekul yang tidak
merugikan (2) antioksidan sekunder yang berfungsi untuk menangkap radikal
bebas dan menghalangi terjadinya reaksi berantai dan (3) antioksidan tertier yang
bermanfaat untuk memperbaiki kerusakan biomolekuler yang disebabkan oleh
polifenol yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam
konfigurasi C6 – C3 – C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan 3
karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Kerangka flavonoid dapat dilihat pada Gambar 2.2 berikut:
Gambar 2.2 Kerangka flavonoid
Flavonoid dalam tumbuhan sebagai campuran dari flavonoid yang berbeda
golongan dan jarang sekali dijumpai hanya flavonoid tunggal. Flavonoid pada
tumbuhan terdapat dalam berbagai bentuk struktur molekul dengan beberapa
bentuk kombinasi glikosida. Untuk menganalisis flavonoid lebih baik memeriksa
aglikon yang telah terhidrolisis daripada dalam bentuk glikosida dengan
strukturnya yang rumit dan kompleks. Flavonoid dapat berkhasiat sebagai
antioksidan, antibakteri dan antiinflamasi (Harborne, 1987).
Struktur dasar dan sistem penomoran untuk turunan flavonoid dapat dilihat pada
Gambar 2.3 berikut:
Gambar 2.3 Struktur dasar flavonoid
2.5 Spektrofotometri UV-Visible
Spektrofotometer pada dasarnya terdiri dari sumber sinar, monokromator,
sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
elektromagnetik pada panjang gelombang tertentu, yang diserap zat (Depkes RI,
1979).
Berdasarkan panjang gelombang spektrofotometri dibagi dua yaitu
spektrofotometri ultraviolet dengan panjang gelombang 200-400 nm, digunakan
untuk senyawa yang tidak berwarna dan spektrofotometri visibel (sinar tampak)
dengan panjang gelombang 400-750 nm, digunakan untuk senyawa yang
berwarna (Gandjar dan Rohman, 2007).
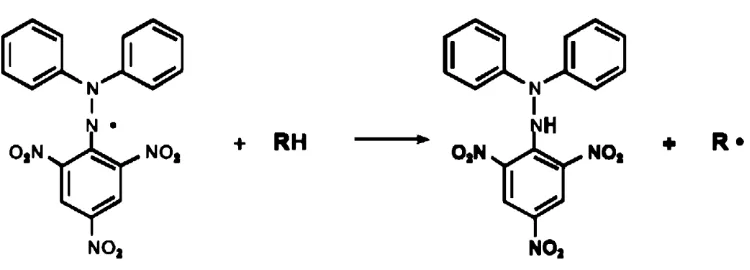
2.6Metode Pemerangkapan Radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH)
1,1-diphenyl-2-picrylhydrazil (DPPH) pertama kali ditemukan pada tahun
1922 oleh Goldschmidt dan Renn. DPPH berwarna ungu pekat seperti KMnO4,
bersifat tidak larut dalam air (Molyneux, 2004).
Struktur kimia DPPH dapat dilihat pada Gambar 2.4 berikut ini:
DPPH (radikal bebas) DPPH (non radikal)
Gambar 2.4 Struktur kimia DPPH
Metode pemerangkapan radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH)
adalah suatu metode sederhana yang dapat digunakan untuk menguji kemampuan
antioksidan yang terkandung dalam makanan. Metode ini dapat digunakan untuk
molekul DPPH memberikan serapan maksimum pada panjang gelombang
tertentu, berwarna ungu (Prakash, 2001).
Resonansi DPPH dapat dilihat pada Gambar 2.5 berikut ini:
Gambar 2.5 Resonansi DPPH
Ketika larutan DPPH dicampurkan dengan senyawa yang dapat
mendonorkan atom hidrogen, akan dihasilkan bentuk tereduksi dari DPPH dan
berkurangnya warna ungu (Molyneux, 2004).
Reaksi antara DPPH dengan atom H dari senyawa antioksidan dapat
dilihat pada Gambar 2.6 berikut:
Gambar 2.6 Reaksi antara DPPH dengan atom H dari senyawa antioksidan
2.6.1 Pelarut
Metode pemerangkapan radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH)
akan memberi hasil yang baik dengan menggunakan pelarut metanol atau etanol
dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai
2.6.2 Pengukuran absorbansi – panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm
dan 520 nm. Apabila pengukuran menghasilkan tinggi puncak maksimum, maka
itulah panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan di
atas. Nilai absorbansi yang mutlak tidaklah penting, karena panjang gelombang
dapat diatur untuk memberikan absorbansi maksimum sesuai dengan alat yang
digunakan (Molyneux, 2004).
2.6.3 Waktu pengukuran
Lamanya pengukuran menurut beberapa literatur yang direkomendasikan
adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan
sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit dan 60 menit. Waktu
reaksi yang tepat adalah ketika reaksi sudah mencapai kesetimbangan. Kecepatan
reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di dalam
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Penelitian meliputi
pengumpulan bahan tumbuhan, pemeriksaan karakteristik, identifikasi bahan
tumbuhan, skrining fitokimia, pembuatan ekstrak, pengujian aktivitas
antioksidan dari ekstrak etanol daun cincau perdu dengan metode aktivitas
pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhidrazyl) yang diukur
dengan menggunakan spektrofotometer sinar tampak. Penelitian ini dilakukan di
Laboratorium Farmakognosi dan Laboratorium Penelitian, Fakultas Farmasi,
Universitas Sumatera Utara.
3.1Alat
Alat-alat yang digunakan pada penelitian ini terdiri dari alat-alat gelas
laboratorium, aluminium foil, blender (Nasional), kertas perkamen, kertas saring,
lemari pengering, mikroskop (Boeco, BM-180, Halogen Lamp), penjepit tabung,
seperangkat alat penetapan kadar air, spatula, neraca digital (Vibra),
spektrofotometer UV-Visible, freeze dryer (Edwards).
3.2Bahan
Bahan yang digunakan adalah daun dari tumbuhan cincau perdu
(Premna oblongifolia Merr.). Bahan-bahan kimia berkualitas pro analisis,
1,1-diphenyl-2-picrylhydrazyl (DPPH), butyl hydroxytoluene (BHT), amil alkohol,
benzen, besi (III) klorida, bismuth (III) nitrat, isopropanol, kloroform, metanol,
n-heksan, natrium hidroksida, raksa (II) klorida, serbuk magnesium (Mg), timbal
(II) asetat, kristal kloral hidrat, toluen, kalium iodida, α-naftol. Bahan kimia
berkualitas teknis: etanol 96% dan air suling.
3.3Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan,
identifikasi tumbuhan, dan pembuatan ekstrak etanol daun cincau perdu.
3.3.1 Pengumpulan bahan tumbuhan
Bahan yang digunakan adalah daun cincau perdu yang masih segar dan
cukup tua. Pengambilan daun cincau dilakukan secara purposif tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan diambil
dari jalan Marelan VII, lingkungan V kelurahan tanah enam ratus, kecamatan
Medan Marelan.
3.3.2 Identifikasi tumbuhan
Identifikasi daun cincau perdu dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi LIPI-Bogor.
3.3.3 Pengolahan bahan
Bahan tumbuhan yang digunakan adalah daun cincau perdu. Daun
dibersihkan dari kotoran yang melekat dan dicuci dengan air hingga bersih, lalu
ditiriskan dan dipotong menjadi beberapa bagian kecil. Selanjutnya dikeringkan
dalam lemari pengering pada temperatur ± 40°C sampai kering (ditandai bila
diremas rapuh), serbuk lalu disimpan dalam kantong plastik untuk mencegah
3.4Pembuatan Pereaksi
3.4.1 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.2 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 ml (Depkes RI, 1995).
3.4.4 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.5 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai
100 ml (Depkes RI, 1995).
3.4.6 Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
3.4.7 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 1 ml
air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.8 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan
dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan
sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan
air suling hingga volume larutan 100 ml (Depkes RI, 1995).
3.4.10 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.11 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian
volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Depkes
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total,
penetapan kadar abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
daun cincau perdu.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun
cincau. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah
mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung
penyambung dan tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
b. Penetapan kadar air simplisia
Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama
dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, kemudian
labu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan
tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi,
kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua
air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada
suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan
air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(WHO, 1992).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam
etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada
suhu 600 ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes
RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam
25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas,
lalu dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu
yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan
3.6 Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan golongan
senyawa alkaloida, flavonoida, glikosida, saponin, tanin, dan
steroida/triterpenoida.
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung
reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau
tiga dari percobaan di atas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoida
Serbuk simplisia ditimbang sebanyak 10 g, ditambahkan 10 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml
amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
3.6.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml
campuran dari 7 bagian etanol 96% dengan 3 bagian air suling (7:3) dan 10 ml
asam klorida 2 N. Kemudian direfluks selama 10 menit, didinginkan, lalu
disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II)
asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml
campuran isopropanol dan kloroform (2:3), perlakuan ini diulangi sebanyak 3
kali. Sari organik dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring,
kemudian diuapkan pada temperatur tidak lebih dari 50ºC, sisanya dilarutkan
dalam 2 ml metanol. Sari air digunakan untuk percobaan berikut, 0,1 larutan
percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas
air. Pada sisa ditambahkan 2 ml air dan 5 tetes larutan pereaksi Molish, lalu
ditambahkan dengan perlahan-lahan 2 ml asam sulfat pekat melalui dinding
tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya
ikatan gula (glikon) atau glikosida (Depkes RI, 1995).
3.6.4 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok
kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang
stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes
asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.6.5 Pemeriksaan tanin
lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan 1 - 2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Farnsworth, 1966).
3.6.6 Pemeriksaan steroida/triterpenoida
Serbuk simplisia ditimbang sebanyak 1 g serbuk simplisia dimaserasi
dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan
penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard.
Timbulnya warna biru atau biru hijau menunjukkan adanya steroida, sedangkan
warna merah, merah muda atau ungu meunjukkan adanya triterpenoida (Harborne,
1984).
3.7 Pembuatan Ekstrak Etanol Daun Cincau perdu
Sebanyak 400 g serbuk simplisia dimaserasi dengan 1500 ml etanol 96%
dalam wadah kaca. Selanjutnya dibiarkan selama 5 hari sambil sesekali diaduk,
setelah 5 hari saring, tampung maserat pada botol gelap dan sisa dimaserasi
kembali dengan 1500 ml etanol. Hasil maserat yang diperoleh di kumpulkan dan
dipekatkan dengan bantuan alat rotary evaporator sehingga di peroleh ekstrak
kental daun cincau (Depkes RI, 1979).
3.8 Pengujian Aktivitas Antioksidan Menggunakan Spektrofotometer UV-Visibel
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
DPPH (1,1 diphenyl-2-picryl-hidrazyl) dalam larutan metanol (sehingga terjadi
perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi
sampel uji yang mampu meredam radikal bebas 50%) digunakan sebagai
parameter menentukan aktivitas antioksidan sampel uji (Molyneux, 2004).
3.8.2 Pembuatan larutan
Larutan DPPH
Sebanyak 10 mg DPPH ditimbang kemudian dimasukkan ke dalam labu
tentukur 50 ml, dicukupkan volumenya dengan metanol sampai garis tanda, dipe
roleh larutan DPPH 0,5 mM (konsentrasi 200 ppm). Larutan DPPH 0,5 mM
dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml,
dicukupkan volumenya dengan metanol sampai garis tanda, diperoleh larutan
blanko DPPH (konsentrasi 40 ppm).
Larutan sampel uji ekstrak etanol daun cincau perdu
Sebanyak 25 mg ekstrak etanol cincau ditimbang kemudian dilarutkan
dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda, diperoleh larutan induk baku sampel (konsentrasi
1000 ppm).
Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan
induk dipipet sebanyak 0,625 ml, 1,25 ml, 1,875 ml, 2,5 ml ke dalam
masing-masing labu tentukur 25 ml untuk mendapatkan konsentrasi larutan uji 50 ppm,
100 ppm, 150 ppm, 200 ppm, kemudian ditambahkan 5 ml larutan DPPH 0,5 mM
tanda. Diamkan di tempat gelap selama 60 menit, lalu diukur serapannya
menggunakan spektrofotometer uv-visibel pada panjang gelombang 517 nm.
Larutan BHT
Sebanyak 25 mg serbuk BHT ditimbang, dimasukkan ke dalam labu
tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda, diperoleh larutan induk baku BHT (konsentrasi 1000
ppm).
Larutan induk dipipet sebanyak 0,625 ml, 1,25 ml, 1,875 ml, 2,5 ml ke
dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 ppm, 4 ppm,
6 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 ml larutan
DPPH 0,5 mM (konsentrasi 200 µg/ml) lalu volumenya dicukupkan dengan
metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit, lalu
diukur serapannya menggunakan spektrofotometer uv-visibel pada panjang
gelombang 517 nm.
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya
pada panjang gelombang 400-800 nm. Gambar seperangkat alat spektrofotometer
uv-visibel (Shimadzu) dapat dilihat pada Lampiran 4, halaman 35.
3.8.4 Waktu pengukuran
Lama pengukuran metode DPPH menurut beberapa literatur yang
direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian
waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit,
3.8.5 Analisis persen pemerangkapan radikal bebas
Menurut Rosidah, et al (2008), penentuan persen pemerangkapan radikal
bebas dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = x 100% kontrol
A
sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
3.8.6 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan
radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap
radikal bebas sebesar 50% (Molyneux, 2004). Hasil perhitungan dimasukkan ke
dalam persamaan regresi dengan konsentrasi sampel (µg/ml) sebagai absis (sumbu
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi LIPI-Bogor adalah sampel daun cincau
perdu yang digunakan sebagai bahan uji termasuk suku Verbenaceae, jenis
Premna oblongifolia Merr. Surat hasil identifikasi tumbuhan dapat dilihat pada
Lampiran 1, halaman 36.
4.2 Hasil Karakterisasi Simplisia
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia daun cincau perdu yang diperoleh
yaitu daun berwarna kecoklatan, ujung daun runcing, tepi daun tidak rata, pangkal
daun tumpul. Gambar daun cincau segar dapat dilihat pada Lampiran 3, halaman
38.
4.2.2 Pemeriksaan mikroskopik
Pemeriksaan dilakukan terhadap serbuk simplisia daun cincau perdu. Hasil
pemeriksaan mikroskopik pada serbuk simplisia terlihat adanya, epidermis atas
stomata anomositik, rambut penutup, mesofil, jaringan bunga karang. Gambar
serbuk simplisia daun cincau perdu dapat dilihat pada Lampiran 4, halaman 42.
4.2.3 Hasil pemeriksaan karakteristik
Hasil pemeriksaan kadar air, kadar sari larut dalam air, kadar sari larut
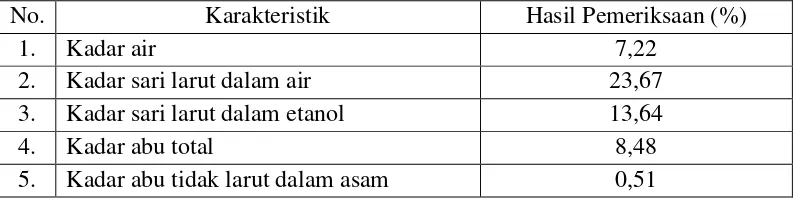
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia daun cincau perdu
No. Karakteristik Hasil Pemeriksaan (%)
1. Kadar air 7,22
2. Kadar sari larut dalam air 23,67 3. Kadar sari larut dalam etanol 13,64 4. Kadar abu total 8,48 5. Kadar abu tidak larut dalam asam 0,51
Dari Tabel 4.1 di atas diperoleh kadar air simplisia daun cincau sebesar
7,22% memenuhi persyaratan umum yaitu di bawah 10%. Kadar air yang
melebihi persyaratan memungkinkan pertumbuhan jamur.
Syarat kadar sari larut dalam air, kadar sari larut dalam etanol, kadar abu
total dan kadar abu tidak larut dalam asam pada umumnya untuk masing-masing
simplisia tidak sama. Pada pemeriksaan ini, karakterisasi simplisia belum tertera
didalam Materia Medika Indonesia (MMI).
Penetapan kadar sari yang larut dalam air untuk mengetahui kadar
senyawa yang bersifat polar dalam simplisia. Senyawa-senyawa yang dapat larut
dalam air adalah garam alkaloid, minyak menguap, glikosida, tanin, gula, gom,
pati, protein, lendir, enzim, lilin, lemak, pektin, zat warna, dan asam organik
(Depkes RI, 1986).
Penetapan kadar sari yang larut dalam etanol untuk mengetahui senyawa
yang bersifat polar dan non polar dalam simplisia. Senyawa-senyawa yang dapat
larut dalam etanol adalah alkaloid basa, minyak menguap, glikosida, antrakinon,
flavonoid, steroid, klorofil, dan dalam jumlah sedikit yang larut lemak, malam,
tanin dan saponin (Depkes RI, 1986).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal yang terdapat di dalam simplisia yang diteliti serta senyawa organik yang
Abu total terbagi dua yang pertama abu fisiologis adalah abu yang berasal
dari jaringan tumbuhan itu sendiri dan abu non fisiologis adalah sisa setelah
pembakaran yang berasal dari bahan-bahan dari luar yang terdapat pada
permukaan simplisia. Kadar abu tidak larut asam untuk menentukan jumlah silika,
khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam
asam klorida (WHO, 1992). Perhitungan pemeriksaan karakteristik serbuk
simplisia daun cincau dapat dilihat pada Lampiran 7, halaman 43.
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia, diketahui bahwa daun
cincau perdu mengandung golongan senyawa-senyawa kimia seperti yang terlihat
pada Tabel 4.2 berikut ini:
Tabel 4.2 Hasil skrining fitokimia simplisia daun cincau perdu
No. Pemeriksaan Hasil
1. Alkaloid -
2. Flavonoida +
3. Glikosida +
4. Tanin +
5. Saponin +
6. Steroida/ triterpenoida +
Keterangan: (+) Positif : mengandung golongan senyawa () Negatif : tidak mengandung golongan senyawa
Hasil yang diperoleh pada Tabel 4.2 menunjukkan bahwa serbuk simplisia
daun cincau perdu mengandung golongan senyawa kimia yaitu flavonoid,
glikosida, saponin dan tanin. Daun cincau memiliki potensi sebagai antioksidan,
yaitu dengan adanya senyawa-senyawa yang mempunyai potensi sebagai
Senyawa flavonoid tersebut bertindak sebagai penangkap radikal bebas
karena gugus hidroksil yang dikandungnya mendonorkan hidrogen kepada radikal
bebas. Senyawa tersebut mampu menetralisir radikal bebas dengan memberikan
elektron kepadanya sehingga atom dengan elektron yang tidak berpasangan
mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi, 2006).
4.4 Hasil Pengujian Aktivitas Antioksidan
Hasil uji aktivitas antioksidan ekstrak etanol daun cincau dengan metode
pemerangkapan 1,1-diphenyl-2-picrylhidrazyl (DPPH) secara spektrofotometri
visibel.
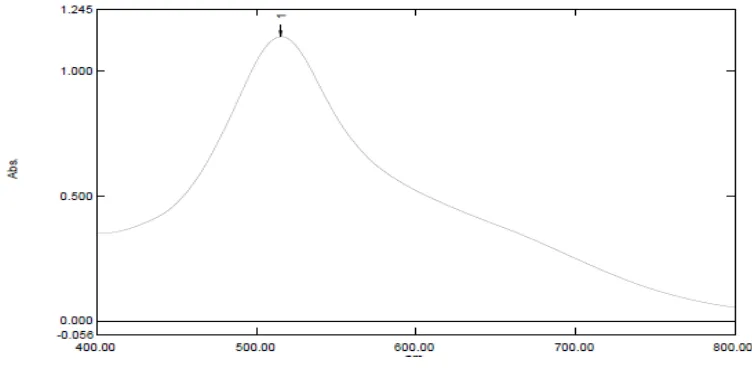
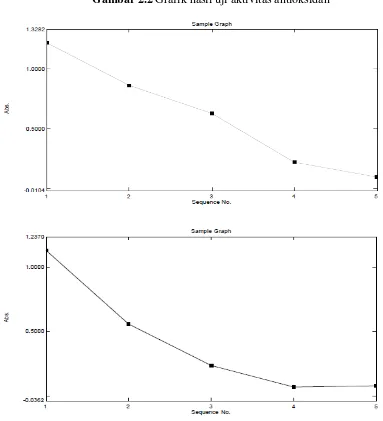
4.4.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum
Pengukuran serapan maksimum larutan DPPH 40 ppm dalam metanol
dengan menggunakan spektrofotometer UV-Visibel. Data hasil pengukuran
panjang gelombang maksimum dapat dilihat pada Gambar 3.1 berikut ini
Hasil pengukuran menunjukkan bahwa larutan DPPH dalam metanol
menghasilkan serapan maksimum pada panjang gelombang 517 nm. Larutan
517 nm, termasuk dalam kisaran panjang gelombang sinar tampak (400-750 nm)
(Rohman, 2007).
4.4.2 Hasil Analisis Aktivitas Antioksidan Sampel Uji
Aktivitas antioksidan ekstrak etanol dari daun cincau diperoleh dari hasil
pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan
larutan uji dengan konsentrasi 25 ppm, 50 ppm, 75 ppm dan 100 ppm yang
dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Penurunan
absorbansi DPPH dan persen peredaman dengan penambahan ekstrak etanol dapat
dilihat pada Tabel 4.3 dan BHT dapat dilihat pada Tabel 4.4 berikut:
Tabel 4.4 Penurunan absorbansi dan persen peredaman DPPH oleh BHT
Pada hasil analisis aktivitas antioksidan ekstrak dapat dilihat adanya
penurunan nilai absorbansi DPPH yang diberi larutan uji terhadap kontrol pada
setiap kenaikan konsentrasi. Tabel 4.3 dan 4.4 dapat dilihat bahwa adanya
penurunan nilai absorbansi DPPH yang diberi ekstrak etanol daun cincau serta
BHT sebagai pembandingnya dalam metanol pada setiap kenaikan konsentrasi.
Penurunan nilai absorbansi menunjukkan aktivitas antioksidan yang semakin
besar. Ekstrak etanol daun cincau menunjukkan nilai penurunan absorbansi
DPPH yang lebih kecil dibandingkan BHT.
Penurunan nilai absorbansi terjadi karena larutan uji memerangkap DPPH
dan pemerangkapan terjadi karena adanya transfer elektron atom hidrogen
antioksidan kepada DPPH. Contoh perhitungan persen pemerangkapan dan nilai
IC50 dapat dilihat pada Lampiran 7, halaman 50.
Gambar 2.2 Grafik hasil uji aktivitas antioksidan
Gambar 2.3 Grafik hasil uji aktivitas antioksidan BHT
4.4.3 Hasil Analisis Nilai IC50 (Inhibitory Concentration)
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi linier yang
diperoleh dengan cara memplot konsentrasi larutan uji dan persen peredaman
DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi sampel (ppm)
sebagai absis (sumbu X) dan nilai % inhibisi sebagai ordinat (sumbu Y).
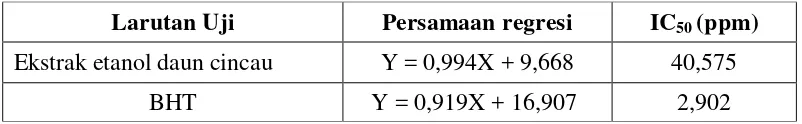
Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh dari
Tabel 4.5 Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh
dari ekstrak etanol daun cincau dan BHT
Larutan Uji Persamaan regresi IC50 (ppm)
Ekstrak etanol daun cincau Y = 0,994X + 9,668 40,575
BHT Y = 0,919X + 16,907 2,902
Tabel 4.5 di atas diketahui bahwa ekstrak etanol daun cincau dan BHT
menunjukkan aktivitas antioksidan dalam kategori sangat kuat. Namun aktivitas
antioksidan BHT masih lebih baik dibandingkan ekstrak etanol daun cincau
dimana nilai IC50 ekstrak daun cincau sebesar 40,575 ppm dan nilai IC50 BHT
sebesar 2,902 ppm.
Kekuatan antioksidan dari ekstrak daun cincau dikarenakan senyawa kimia
yang terkandung salah satunya yaitu flavonoid. Senyawa flavonoid bertindak
sebagai penangkap radikal bebas karna gugus hidroksil mendonorkan hidrogen
kepada radikal bebas yang dikandungnya kepada radikal bebas. Sehingga ekstrak
etanol daun cincau memiliki aktivitas antioksidan dalam kategori sangat kuat
(Kumalaningsih, 2006).
Tabel 4.6 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (ppm)
1. Sangat kuat < 50
2. Kuat 50 - 100
3. Sedang 101 - 150
4. Lemah 151 - 200
(Mardawati, dkk., 2008).
Kemampuan sampel uji dalam merangkap DPPH (
1,1-diphenyl-2-picryhidrazyl) sebagai radikal bebas dalam larutan metanol dengan nilai IC50
(konsentrasi sampel uji yang mampu memerangkap radikal bebas sebesar 50%)
digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Hasil karakterisasi simplisia daun cincau perdu diperoleh kadar air 7,27%,
kadar sari larut air 23,67%, kadar sari larut etanol 13,64%, kadar abu total
8,48%, dan kadar abu tidak larut asam 0,51%.
b. Hasil skrining fitokimia simplisia daun cincau perdu menunjukkan golongan
flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid.
c. Hasil pengukuran aktivitas antioksidan metode DPPH diperoleh aktivitas
antioksidan ekstrak etanol daun cincau perdu dengan konsentrasi 25 ppm =
42,427%, 50 ppm = 59,247%, 75 ppm = 87,312%, dan 100 ppm = 107,855%.
d. Nilai IC50 ekstrak etanol daun cincau menggunakan metode DPPH sebagai
antioksidan sangat kuat yaitu < 50 ppm.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan uji aktivitas
DAFTAR PUSTAKA
Agoes, G. (2007). Teknologi Bahan Alam. Bandung: ITB.Hal 8: 38-39.
Anief, M. (2000). Farmasetika. Yogyakarta: UGM Press. Hal 182.
Anonim. (2009). Cincau Perdu. Diakses 14 Januari 2015. http// www. beritaiptek. Com/tumbuhan-cincau.html
Departemen Kesehatan RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Hal 9-39.
Departemen Kesehatan RI. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan RI. Hal 6-7.
Departemen Kesehatan RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Hal 297-326, 333-337.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal 1, 10-11.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Sciences. 55(3): 263.
Ganjar, H., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal 222.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Terbitan Kedua. Bandung: Penerbit ITB. Hal 147, 259.
Kumalaningsih, S. (2006). Antioksidan Alami. Surabaya: Trubus Agrisarana. Hal 4-5, 16, 21, 24, 43. Pemanfaatan Limbah Kulit Manggis di Kecamatan Puspahiang Kabupaten Tasikmalaya. Laporan Akhir Penelitian Peneliti Muda (LITMUD) UNPAD. Semarang. Hal 17.
Molyneux, P. (2004). The Use of the Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci. Technol. 26(2): 212.
Prakash, A. (2001). Antioxidant Activity. Medallion Laboratories-Analytical Progress. 19(2): 1-4.
Pitojo, S. (2008). Khasiat Daun Cincau. Yogyakarta: Penerbit Kanisius, cetakan ke-2. Hal 1-3.
Rosidah., Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616-625.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Penerbit Kanisius. Hal 40, 47-48.
Syamsuni, H.A (2006). Ilmu Resep. Jakarta:EGC. Hal 249
World Health Organization. (1992). Quality Control Methods For Medicinal Plant Material. Switzerland: WHO. Hal 31-33.
Yuniarti, T. (2008). Ensiklopedia Tanaman Obat Tradisional. Jakarta: Penerbit PT. Buku Kita. Hal 3, 83-85.
Yilidirim, A., Oktay, M., dan Bialoglu, V. (2001). The Antioxidant Activity of The Leaves of Cydonia vulgaris. Turkish J Med Sci.31:23-27.
Wijayakusumah, H. (1995). Tanaman Berkhasiat Obat di Indonesia, Jakarta: Pustaka Kartini, jilid 2. Hal.35.
Zuhra, C.F., Tarigan, J., dan Sihotang, H. (2008). Aktivitas Antioksidan Senyawa
Lampiran 2. Bagan kerja penelitian
Serbuk simplisia Daun cincau perdu
Simplisia
Dicuci, ditiriskan, dan ditimbang sebagai berat basah
Karakterisasi simplisia Skrining Fitokimia Ekstraksi