KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
KULIT BUAH DUKU (Lansium domesticum Correa)
DENGAN METODE DPPH
SKRIPSI
OLEH:
RIZKI ARISMAWATI
131524008
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
KULIT BUAH DUKU (Lansium domesticum Correa)
DENGAN METODE DPPH
SKRIPSI
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
RIZKI ARISMAWATI
131524008
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL KULIT BUAH
DUKU (Lansium domesticum Correa) DENGAN METODE DPPH
OLEH:
RIZKI ARISMAWATI 131524008
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 5 Oktober 2015
Pembimbing I
Drs. Suryadi Achmad, M.Sc., Apt NIP 195109081985031002
Medan, Oktober 2015 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan
Pembimbing II
Prof. Dr. Rosidah, M.Si., Apt NIP 195103261978022001
Panitia Penguji
Dra. Aswita Hafni Lubis, M.Si., Apt NIP 195304031983032001
Drs. Suryadi Achmad, M.Sc., Apt NIP 195109081985031002
Dra. Suwarti Aris, M.Si., Apt NIP 195107231982032001
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah swt yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan skripsi ini dengan
judul “Karakterisasi simplisia, skrining fitokimia dan uji aktivitas antioksidan
ekstrak etanol kulit buah duku (Lansium domesticum Correa) dengan metode
DPPH”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih kepada Ibu Dr. Masfria, M.S., Apt selaku Pejabat Dekan Fakultas
Farmasi USU Medan dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil
Dekan I Fakultas Farmasi USU Medan, yang telah menyediakan fasilitas kepada
penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima
kasih kepada Bapak Suryadi Achmad, M.Sc., Apt., dan Ibu Prof. Dr. Rosidah,
M.Si., Apt yang telah membimbing dan memberikan petunjuk serta saran-saran
selama penelitian hingga selesainya skripsi ini. Ibu Dra. Aswita Hafni Lubis,
M.Si., Apt., Ibu Dra. Suwarti Aris, M.Si., Apt dan Ibu Dra. Herawaty Ginting,
M.Si., Apt selaku dosen penguji yang telah memberikan kritik, saran dan arahan
kepada penulis dalam menyempurnakan skripsi ini. Bapak Dadang Irfan Husori,
SSi., M.Sc., Apt selaku penasehat akademik yang selalu memberikan bimbingan
kepada penulis selama masa perkuliahan serta Bapak dan Ibu staf pengajar
Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan.
Penulis juga mempersembahkan rasa terima kasih yang tiada terhingga
Rizka Tiara Putri dan Reza Febri Putra, atas limpahan kasih sayang, doa dan
dukungan yang tidak ternilai apapun. Penulis tak lupa mengucapkan terimakasih
kepada teman-teman ekstensi farmasi angkatan 2013 dan sahabat-sahabatku yang
telah banyak membantu dan semangat selama penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari
kesempurnaan, oleh karena itu penulis menerima kritik dan saran demi
kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat
memberikan manfaat bagi kita semua.
Medan,2Oktober 2015 Penulis
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL KULIT BUAH DUKU
(Lansium domesticum Correa) DENGAN METODE DPPH
ABSTRAK
Antioksidan merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif. Kulit buah duku biasa digunakan sebagai obat diare dan dilaporkan mengandung senyawa kimia yang terdiri dari alkaloid, saponin, flavonoid, dan polifenol yang merupakan metabolit sekunder yang bersifat antioksidan. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, skrining fitokimia dan uji aktivitas antioksidan dari ekstrak etanol kulit buah duku.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Ekstrak diperoleh secara perkolasi dengan pelarut etanol 96%, lalu dipekatkan dengan alat rotary evaporator hingga didapatkan ekstrak kental. Ekstrak diuji dengan metode pemerangkapan radikal bebas DPPH (1,1-Diphenyl-2-Picrylhydrazyl) dengan mengukur absorbansi DPPH setelah didiamkan selama 60 menit pada suhu kamar menggunakan spekrofotometer uv-visibel pada panjang gelombang 516.
Hasil pemeriksaan karakteristik simplisia kulit buah duku diperoleh kadar air 6,64%, kadar sari yang larut air 11,37%, kadar sari yang larut dalam etanol 17,86%, kadar abu total 8,52%, kadar abu yang tidak larut dalam asam 0,82%. Hasil skrining fitokimia, serbuk simplisia mengandung senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Hasil pengukuran aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH, ekstrak etanol kulit buah duku menunjukkan kekuatan antioksidan dalam kategori lemah dengan nilai IC50180,621 ppm dan vitamin c menunjukkan kekuatan antioksidan
dalam kategori sangat kuat dengan nilai IC503,018 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOXIDANT ACTIVITY TEST OF ETHANOL EXTRACT OF DUKU PEEL (Lansium domesticum Correa) WITH DPPH
METHOD
ABSTRACT
Antioxidants are compounds that can inhibit the oxidation reaction, to scavenge free radicals and highly reactive molecules. Peel of duku fruit is used as medicine for diarrhea and reported to contain a chemical compound consisting of alkaloids, saponins, flavonoids, and polyphenols which are secondary metabolites that are antioxidants. The purpose of this study was to determine the the simplex characterization, phytochemical screening and test the antioxidant activity of ethanol extract of duku fruit peel.
Simplex characterization including macroscopic, microscopic, level of water content, level of water-soluble extract, level of ethanol-soluble extract, level of total ash, and level of ash not soluble in acid. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tanin, and steroid/triterpenoid. The extract obtained by percolation with 96% ethanol, and then concentrated by means of a rotary evaporator to obtain a thick extract. . Extracts were tested by the method of trapping free radicals DPPH (1,1-Diphenyl-2-Picrylhydrazyl) by measuring the absorbance of DPPH after settling for 60 minutes at room temperature using spekrofotometer UV-visible spectrophotometry at a wavelength of 516.
The result of the simplex characterization obtained level of water content 6.64%, level of water-soluble extract 11.37%, level of ethanol-soluble extract 17.86%, level of total ash 8.52%, and level of ash not soluble in acid 0.82%. Phytochemical screening results, simplicia powder containing compounds alkaloids, flavonoids, saponins, tannins, glycosides, and steroid/triterpenoid. Results of measuring the antioxidant activity with DPPH free radical trapping method, the ethanol extract of the fruit peel duku shows the antioxidant power in the weak category with IC50 values 180.621 ppm and vitamin C shows the
antioxidant power in very strong category with IC50values 3.018 ppm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tanaman ... 6
2.1.1 Morfologi tanaman ... 6
2.1.2 Habitat ... 6
2.1.4 Sinonim ... 7
2.1.5 Nama asing ... 9
2.1.6 Nama daerah ... 7
2.1.7 Manfaat ... 8
2.1.8 Kandungan kimia ... 8
2.2 Ekstraksi ... 8
2.2.1 Cara dingin ... 8
2.2.2 Cara panas ... 9
2.3 Radikal Bebas ... 10
2.4 Antioksidan ... 11
2.4.1 Flavonoid ... 13
2.4.2 Vitamin C ... 14
2.5 Spektrofotometri UV-Visible ... 15
2.6 Penentuan Aktivitas Antioksidan dengan Metode DPPH ... 16
2.6.1 Pelarut ... 17
2.6.2 Pengukuran absorbansi-panjang gelombang ... 17
2.6.2 Pengukuran waktu operasional (operating time) ... 17
BAB III METODE PENELITIAN ... 18
3.1 Alat ... 18
3.2 Bahan ... 18
3.3 Penyiapan Bahan Tanaman ... 19
3.3.1 Pengambilan bahan tanaman ... 19
3.3.2 Identifikasi tanaman ... 19
3.4 Pembuatan pereaksi ... 19
3.4.1 Pereaksi besi (III) klorida 1% ... 19
3.4.2 Pereaksi asam klorida 2 N ... 20
3.4.3 Pereaksi timbal (II) asetat 0,4 M ... 20
3.4.4 Pereaksi Mayer ... 20
3.4.5 Pereaksi Molish ... 20
3.4.6 Pereaksi Dragendroff ... 20
3.4.7 Pereaksi kloralhidrat ... 20
3.4.8 Pereaksi asam sulfat 2 N ... 21
3.4.9 Pereaksi Bouchardat ... 21
3.4.10 Pereaksi Liebermann-Burchard ... 21
3.4.11 Larutan pereaksi DPPH 0,5 mM ... 21
3.5 Pemeriksaan Karakterisasi Simplisia ... 21
3.5.1 Pemeriksaan makroskopik ... 21
3.5.2 Pemeriksaan mikroskopik ... 21
3.5.3 Penetapan kadar air ... 22
3.5.4 Penetapan kadar sari yang larut dalam air ... 22
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 23
3.5.6 Penetapan kadar abu total ... 23
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 23
3.6 Skrining Fitokimia ... 24
3.6.1 Pemeriksaan alkaloida ... 24
3.6.2 Pemeriksaan glikosida ... 24
3.6.4 Pemeriksaan flavonoida ... 25
3.6.5 Pemeriksaan tanin ... 26
3.6.6 Pemeriksaan saponin ... 26
3.7 Pembuatan Ekstrak Etanol Kulit Buah Duku ... 26
3.8 Pengujian Kemampuan Aktivitas Antioksidan dengan Spektrofotometer Visibel ... 27
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH... 27
3.8.2 Pembuatan larutan blanko ... 27
3.8.3 Penentuan panjang gelombang serapan maksimum .. 27
3.8.4 Pembuatan larutan induk EEKBD ... 27
3.8.5 Pembuatan larutan uji EEKBD ... 27
3.8.6 Pembuatan larutan induk vitamin C ... 28
3.8.7 Pembuatan larutan uji vitamin C ... 28
3.8.8 Penentuan persen peredaman ... 28
3.8.9 Penentuan nilai IC50 ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Hasil Identifikasi Tanaman ... 30
4.2 Hasil Karakterisasi Simplisia ... 30
4.2.1 Hasil pemeriksaan makroskopik ... 30
4.2.2 Hasil pemeriksaan mikroskopik ... 30
4.2.3 Hasil pemeriksaan karakteristik ... 30
4.3 Hasil Skrining Fitokimia ... 32
4.4 Hasil Analisis Aktivitas Antioksidan ... 33
4.4.2 Hasil penentuan operating time ... 34
4.4.3 Hasil analisis aktivitas antioksidan sampel uji ... 35
4.4.4 Hasil analisis nilai IC50 ... 37
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... ... 40
DAFTAR PUSTAKA ... 41
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia kulit buah duku ... 31
4.2 Hasil skrining fitokimia simplisia kulit buah duku... 32
4.3 Data uji pendahuluan penurunan absorbansi dan persen peredaman
DPPH oleh EEKBD ... 35
4.4 Data penurunan absorbansi dan persen peredaman DPPH oleh EEKBD ... 35
4.5 Data penurunan absorbansi dan persen peredaman DPPH oleh vitamin C ... 36
4.6 Hasil persamaan regresi linier dan hasil analisis IC50 dari EEKBD
dan vitamin C ... 38
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ... 5
2.1 Struktur dasar flavonoid ... 13
2.2 Struktur kimia vitamin C ... 14
2.3 Rumus bangun DPPH ... 15
4.1 Kurva serapan maksimum DPPH 40 ppm dalam metanol menggunakan spektrofotometer UV-Visibel ... 34
4.2 Grafik hasil uji aktivitas antioksidan EEKBD ... 37
DAFTAR LAMPIRAN
Lampiran Halaman
1. Surat hasil identifikasi tumbuhan ... 45
2. Bagan kerja penelitian ... 46
3. Gambar buah duku segar dan kulit buah duku segar ... 47
4. Gambar makroskopik simplisia dan serbuk simplisia kulit buah duku ... 48
5. Gambar mikroskopik serbuk simplisia kulit buah duku ... 49
6. Perhitungan pemeriksaan karakteristik serbuk simplisia kulit buah duku ... 50
7. Hasil uji aktivitas antioksidan ... 53
8. Perhitungan persen peredaman dan nilai IC50EEKBD ... 54
9. Perhitungan persen peredaman dan nilai IC50Vitamin C ... 60
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL KULIT BUAH DUKU
(Lansium domesticum Correa) DENGAN METODE DPPH
ABSTRAK
Antioksidan merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif. Kulit buah duku biasa digunakan sebagai obat diare dan dilaporkan mengandung senyawa kimia yang terdiri dari alkaloid, saponin, flavonoid, dan polifenol yang merupakan metabolit sekunder yang bersifat antioksidan. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, skrining fitokimia dan uji aktivitas antioksidan dari ekstrak etanol kulit buah duku.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Ekstrak diperoleh secara perkolasi dengan pelarut etanol 96%, lalu dipekatkan dengan alat rotary evaporator hingga didapatkan ekstrak kental. Ekstrak diuji dengan metode pemerangkapan radikal bebas DPPH (1,1-Diphenyl-2-Picrylhydrazyl) dengan mengukur absorbansi DPPH setelah didiamkan selama 60 menit pada suhu kamar menggunakan spekrofotometer uv-visibel pada panjang gelombang 516.
Hasil pemeriksaan karakteristik simplisia kulit buah duku diperoleh kadar air 6,64%, kadar sari yang larut air 11,37%, kadar sari yang larut dalam etanol 17,86%, kadar abu total 8,52%, kadar abu yang tidak larut dalam asam 0,82%. Hasil skrining fitokimia, serbuk simplisia mengandung senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Hasil pengukuran aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH, ekstrak etanol kulit buah duku menunjukkan kekuatan antioksidan dalam kategori lemah dengan nilai IC50180,621 ppm dan vitamin c menunjukkan kekuatan antioksidan
dalam kategori sangat kuat dengan nilai IC503,018 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOXIDANT ACTIVITY TEST OF ETHANOL EXTRACT OF DUKU PEEL (Lansium domesticum Correa) WITH DPPH
METHOD
ABSTRACT
Antioxidants are compounds that can inhibit the oxidation reaction, to scavenge free radicals and highly reactive molecules. Peel of duku fruit is used as medicine for diarrhea and reported to contain a chemical compound consisting of alkaloids, saponins, flavonoids, and polyphenols which are secondary metabolites that are antioxidants. The purpose of this study was to determine the the simplex characterization, phytochemical screening and test the antioxidant activity of ethanol extract of duku fruit peel.
Simplex characterization including macroscopic, microscopic, level of water content, level of water-soluble extract, level of ethanol-soluble extract, level of total ash, and level of ash not soluble in acid. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tanin, and steroid/triterpenoid. The extract obtained by percolation with 96% ethanol, and then concentrated by means of a rotary evaporator to obtain a thick extract. . Extracts were tested by the method of trapping free radicals DPPH (1,1-Diphenyl-2-Picrylhydrazyl) by measuring the absorbance of DPPH after settling for 60 minutes at room temperature using spekrofotometer UV-visible spectrophotometry at a wavelength of 516.
The result of the simplex characterization obtained level of water content 6.64%, level of water-soluble extract 11.37%, level of ethanol-soluble extract 17.86%, level of total ash 8.52%, and level of ash not soluble in acid 0.82%. Phytochemical screening results, simplicia powder containing compounds alkaloids, flavonoids, saponins, tannins, glycosides, and steroid/triterpenoid. Results of measuring the antioxidant activity with DPPH free radical trapping method, the ethanol extract of the fruit peel duku shows the antioxidant power in the weak category with IC50 values 180.621 ppm and vitamin C shows the
antioxidant power in very strong category with IC50values 3.018 ppm.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia memiliki sumber daya alam yang sangat melimpah, terutama
dari segi jumlah tanaman khususnya tanaman obat yang sebagian besar belum
dapat dibuktikan secara ilmiah. Salah satu tanaman yang biasa digunakan oleh
masyarakat sebagai obat adalah duku. Tanaman duku (Lansium domesticum
Correa) merupakan salah satu komoditas unggulan dan spesifik daerah Sumatera
Selatan. Duku yang berasal dari Sumatera Selatan yang terkenal dengan nama
Duku Komering yang mempunyai cita rasa khas (Balai Perbenihan Sumsel, 2002).
Duku biasanya digunakan sebagai obat tradisional misalnya biji duku yang
berasa pahit digunakan sebagai obat cacing dan demam yaitu dengan cara
menumbuknya dan mencampurnya dengan air, kulit kayunya digunakan sebagai
obat disentri dan malaria serta dapat digunakan untuk mengobati gigitan
kalajengking. Kulit duku digunakan untuk mengobati penyakit diare dan demam
(Nuraini, 2011).
Kulit buah duku biasanya hanya dibuang saja sebagai limbah, padahal
kulit buah duku memiliki beberapa aktivitas biologi yang didukung oleh beberapa
penelitian yaitu Nishizawa, et al., (1989) menyatakan bahwa kulit buah duku
banyak mengandung seco-onoceranoids, salah satu tipe triterpenoid berupa asam
lansat dan asam lansiolat. Kulit buah duku juga dilaporkan mengandung
lansiosida A, B, dan C yang merupakan salah satu contoh struktur dari
D4 yang menginduksi kontraksi pada usus babi (Nishizawa, et al., 1983).
Senyawa asam 3-okso-24-sikloarten pada Lansium domesticum Correa juga
memiliki aktivitas sebagai penghambat timbulnya tumor kulit (Nishizawa, et al.,
1989). Pemberian ekstrak kulit buah duku memberikan aktivitas antidiare pada
mencit putih jantan (Hura, et al., 2014). Selain itu, Ekstrak kasar buah duku juga
menunjukkan aktivitas antikanker (Manosroi, et al., 2012).
Ekstrak kulit dan daun dari Lansium domesticum Correa dapat mempengaruhi siklus hidup dari Plasmodium falciparum dan berpotensi dalam
melawan infeksi dari Plasmodium falciparum (Yapp dan Yap, 2002). Ekstrak dari
buah duku dapat menghambat produksi melanin dari sel melanoma tanpa
memberikan efek toksik dan berpotensi sebagai kosmetik pemutih kulit (Arung, et
al., 2009) dan menurut Tilaar, et al., (2007) Lansium domesticum Correa memiliki
aktivitas antioksidan dalam melawan radikal bebas. Kulit buah duku juga
mengandung senyawa kimia yang terdiri dari alkaloid, saponin, flavonoid, dan
polifenol (Isfaeni et al., 2012), dimana menurut Yuhernita dan Juniarti (2011)
senyawa alkaloid, flavonoid, fenol, steroid dan terpenoid merupakan metabolit
sekunder yang bersifat antioksidan.
Pengujian antioksidan terhadap kulit buah duku (Lansium domesticum
Correa) yang diduga potensial dalam menghasilkan bahan-bahan antioksidan
dapat dilakukan menggunakan metode DPPH (Diphenyl-picry-hydrazil) yang
prinsipnya adalah penangkapan hidrogen dari antioksidan oleh radikal bebas.
Menurut Prakash (2001), metode ini yang paling sederhana, cepat dan murah
untuk mengukur kemampuan antioksidan yang terdapat pada makanan,
Berdasarkan hal di atas, penulis tertarik untuk mengetahui karakteristik
simplisia, skrining fitokimia dan aktivitas antioksidan dari ekstrak etanol kulit
buah duku (Lansium domesticum Correa) dengan metode DPPH.
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang tersebut, maka perumusan masalah
penelitian adalah:
a. apakah karakteristik simplisia kulit buah duku dapat diketahui dan menjadi
rujukan untuk penelitian selanjutnya.
b. golongan senyawa kimia apa saja yang terkandung dalam kulit buah duku.
c. berapakah nilai IC50ekstrak etanol kulit buah duku dan vitamin C sebagai
pembanding dengan metode pemerangkapan radikal bebas DPPH
1.3 Hipotesis
Berdasarkan perumusan masalah tersebut, maka hipotesis penelitian ini
adalah sebagai berikut:
a. karakteristik simplisia kulit buah duku dapat diketahui dan menjadi
rujukan untuk penelitian selanjutnya.
b. kandungan golongan senyawa kimia yang terdapat dalam kulit buah duku
adalah golongan alkaloid, saponin, flavonoid, tanin dan triterpenoid.
c. nilai IC50 ekstrak etanol kulit buah duku dan vitamin C kurang dari 200
ppm.
1.4 Tujuan Penelitian
a. untuk mengetahui karakteristik simplisia kulit buah duku yang diteliti.
b. untuk mengetahui golongan senyawa kimia yang terkandung dalam kulit
buah duku.
c. untuk mengukur kemampuan antioksidan dari ekstrak etanol kulit buah
duku dan vitamin C dengan metode pemerangkapan radikal bebas DPPH.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah untuk menambah informasi tentang khasiat
kulit buah duku sehingga dapat digunakan sebagai obat.
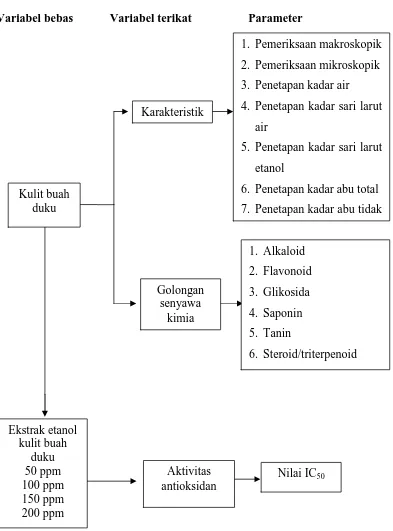
1.6 Kerangka Pikir Penelitian
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Skema kerangka pikir penelitian Aktivitas
3. Penetapan kadar air
4. Penetapan kadar sari larut
air
5. Penetapan kadar sari larut
etanol
6. Penetapan kadar abu total
7. Penetapan kadar abu tidak
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
Uraian tanaman meliputi morfologi tanaman, habitat, sistematika tanaman,
sinonim, nama asing, nama daerah, manfaat dan kandungan kimia.
2.1.1 Morfologi tanaman
Duku merupakan salah satu tanaman dari famili Meliaceae dan merupakan
tanaman bergetah dengan berupa pohon tinggi yang tegak dan menahun. Buahnya
berupa tandan berbentuk bulat atau bulat memanjang. Buah duku yang siap
dipanen biasanya kulit buah berwarna kuning kehijau-hijauan dan bahkan telah
menjadi kuning keputih-putihan serta buah agak lunak. Tanda-tanda lainnya
adalah getah pada kulit buahnya sudah tampak berkurang atau tidak ada getah
sama sekali pada kulit buah duku. Tanaman duku diperbanyak dengan biji,
biasanya mulai berbunga sekaligus berbuah pada umur tanaman 12 tahun bahkan
lebih. Tanaman duku yang pembibitannya secara vegetatif seperti pencangkokan
atau sambungan dapat berbuah lebih cepat yaitu pada umur 8 tahun (Mayanti,
2009).
2.1.2 Habitat
Duku (Lansium domesticum Correa) merupakan tanaman tropis beriklim
basah berupa pohon yang berasal dari Malaysia dan Indonesia kemudian
menyebar ke Vietnam, Myanmar, Thailand dan India. Jenis duku yang banyak
ditanam di Indonesia adalah jenis duku unggul seperti duku komering, duku
Duku dapat tumbuh dan berbuah baik di dataran rendah hingga ketinggian
600 m diatas permukaan laut. Tanaman ini biasanya ditanam di pekarangan atau
tegalan, bersama dengan tanaman tahunan lainnya (Mayanti, 2009).
2.1.3 Sistematika tanaman
Klasifikasi tanaman duku adalah sebagai berikut (Tjitrosoepomo, 2007;
LIPI, 2015) :
Kingdom : Plantae
Divisi : Spermatophyta
Anak Divisi : Angiospermae
Kelas : Dicotyledoneae
Anak Kelas : Dialypetalae
Bangsa : Rutales
Suku : Meliaceae
Marga : Lansium
Spesies : Lansium domesticum Correa
2.1.4 Sinonim
Aglaia dookkoo Griff (Mayanti, 2009). 2.1.5 Nama asing
Langseh, langsep, lansa (Malaysia); lansones, lanzone, buahan (Filipina);
langsad, longkong (Thailand); Ion bon, bon bon (Vietnam), langsak, duku
(Burma); gadu, guda (Srilanka) (Putra, 2013).
2.1.6 Nama daerah
Lansat, lancet (Aceh dan Sumut); lase (Nias); langsek (Minahasa);
lansa, lase, lese (Sulawesi Selatan); lasat, lasate, lasa (Maluku); langsep, duku,
dan dukuh (Jawa) (Putra, 2013).
2.1.7 Manfaat
Duku biasanya digunakan sebagai obat tradisional misalnya biji duku yang
berasa pahit digunakan sebagai obat cacing dan demam yaitu dengan cara
menumbuknya dan mencampurnya dengan air, kulit kayunya digunakan sebagai
obat disentri dan malaria serta dapat digunakan untuk mengobati gigitan
kalajengking. Kulit duku digunakan untuk mengobati penyakit diare dan demam
(Nuraini, 2011).
2.1.8 Kandungan kimia
Tiap 100 g buah duku mengandung : 84 g air; sedikit protein dan lemak;
14,2 g karbohidrat, terutama gula pereduksi seperti glukosa; 0,8 g serat; 19 mg
Ca; 275 mg K; vitamin B1 dan B2; vitamin C, E. (Verheij dan Coronel, 1997).
Kulit buah duku yang segar mengandung 0,2% volatile oil dan resin. Pada kulit
buah yang kering mengandung semi-liquid oleoresin yang terdiri dari 0,17%
volatile oil dan 22% resin (Mayanti, 2009). Kulit buah duku juga mengandung senyawa kimia yang terdiri dari alkaloid, saponin, flavonoid dan polifenol
(Isfaeni, et al., 2012).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Dengan
diketahui senyawa aktif yang dikandung simplisia akan mempermudah pemilihan
2.2.1 Cara dingin
a. Maserasi
Maserasi adalah cara penarikan simplisia dengan cara meredam serbuk
simplisia tersebut dalam cairan penyari dengan beberapa kali pengocokan atau
pengadukan pada temperatur kamar, sedangkan remaserasi merupakan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama
dan seterusnya (Ditjen POM, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi
penyarian sempurna yang umumnya dilakukan pada temperatur ruangan. Proses
ini terdiri dari tahapan pengembangan bahan, tahapan maserasi antara, tahap
perkolasi sebenarnya (Ditjen POM, 2000).
2.2.2 Cara panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dapat dilakukan pengulangan proses pada
residu pertama 3-5 kali sehingga didapat proses ekstraksi sempurna (Ditjen POM,
2000).
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
jumlah pelarut relatif konstan dengan adanya pendingin balik (Ditjen POM,
c. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang
lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-50oC (Ditjen POM, 2000).
d. Infusa
Infusa adalah ekstraksi dengan pelarut air pada temperatur penangas air
dengan menggunakan bejana infus dengan air bersuhu > 90 oC selama waktu
tertentu (15-20 menit) (Ditjen POM, 2000).
e. Dekok
Dekok adalah sediaan cair yang dibuat dengan cara menyari simplisia
dengan air bersuhu > 90oC menggunakan bejana infuse sambil diaduk
berulang-ulang dengan pemanas air selama 30 menit (Voight, 1984).
2.3 Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol, menghasilkan ikatan dengan DNA,
protein, lipida atau kerusakan oksidatif pada gugus fungsional yang penting pada
biomolekul ini. Radikal bebas juga terlibat dan berperan dalam patologi dari
berbagai penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner,
katarak dan penyakit degeneratif lainnya (Silalahi, 2006).
Radikal bebas yang diproduksi dalam jumlah yang normal penting untuk
fungsi biologis tubuh seperti sel darah putih yang menghasilkan H2O2 untuk
namun ia tidak menyerang sasaran spesifik sehingga ia juga akan menyerang asam
lemak tidak jenuh ganda dari membran sel, organel sel atau DNA, sehingga dapat
menyebabkan kerusakan struktur dan fungsi sel (Winarsi, 2007).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan
berlangsung sepanjang hidup sehingga dapat menjadi penyebab utama dari proses
penuaan dan berbagai penyakit degeneratif. Tubuh memiliki mekanisme
pertahanan antioksidan dalam bentuk enzim antioksidan dan zat antioksidan untuk
menetralisir radikal bebas. Perkembangan industri yang pesat serta manusia
berkontak dengan berbagai sumber radikal bebas yang berasal dari lingkungan
dan dari kegiatan fisik yang tinggi menyebabkan sistem pertahanan antioksidan
dalam tubuh tidak memadai (Silalahi,2006).
2.4 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat
memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi
berantai dari radikal bebas (Kumalaningsih, 2006).Antioksidan atau reduktor
berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang
telah teroksidasi dengan cara menyumbangkan hidrogen dan atau electron.
Antioksidan dalam makanan dapat berperan dalam pencegahan berbagai penyakit,
meliputi penyakit kardiovaskuler, sebrovaskuler, sebagian kanker dan penyakit
yang berkaitan dengan proses penuaan (Silalahi, 2006)
Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi 3
kelompok, yaitu antioksidan primer, antioksidan sekunder dan antioksidan tersier
a. Antioksidan primer
Antioksidan primer disebut juga antioksidan endogenus atau antioksidan
enzimatis. Antioksidan primer bekerja dengan cara mencegah pembentukan
senyawa radikal bebas baru, atau mengubah radikal bebas yang telah terbentuk
menjadi molekul yang kurang reaktif. Antioksidan primer meliputi enzim
superoksida dismutase (SOD), katalase dan glutation peroksidase (GSH-Px)
(Winarsi, 2007).
Sebagai antioksidan, enzim-enzim tersebut menghambat pembentukan
radikal bebas, dengan cara memutus reaksi berantai, kemudian mengubahnya
menjadi produk yang lebih stabil. Antioksidan dalam kelompok ini disebut juga
chain-breaking-antioxidant (Winarsi, 2007). b. Antioksidan sekunder
Antioksidan sekunder disebut juga antioksidan eksogenus atau antioksidan
non-enzimatis. Antioksidan non-enzimatis dapat berupa komponen non-nutrisi
dan komponen nutrisi dari sayuran dan buah-buahan. Kerja sistem antioksidan
non-enzimatik yaitu dengan cara memotong reaksi berantai dari radikal bebas atau
dengan cara menangkapnya sehingga radikal bebas tidak akan bereaksi dengan
komponen seluler (Winarsi, 2007).
Antioksidan non-enzimatik dapat berupa antioksidan alami maupun
sintesis. Senyawa antioksidan alami pada umumnya berupa vitamin C, vitamin E,
karotenoid, senyawa fenolik dan polifenolik yang dapat berupa golongan
flavonoid, turunan asam sinamat, kuomarin, tokoferol dan asam-asam organik
polifungsional. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi
c. Antioksidan tersier
Kelompok ant
metionin sulfoksida
biomolekuler yang rusa
Khasiat antioksi
oksidatif akan lebih
buahan yang kaya aka
antioksidan tungggal.
lebih efektif daripada
adanya komponen la
secara positif (Silalahi
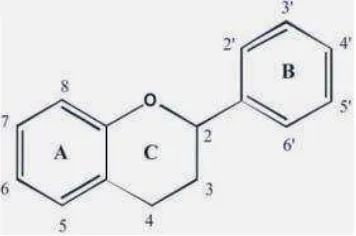
2.4.1 Flavonoid
Senyawa flavonoi
karbon yang tersusun
yang dihubungkan ole
cincin ketiga (Markha
Struktur dasar f sier
antioksidan tersier meliputi sistem enzim D
da reduktase. Enzim-enzim ini berfungsi da
rusak akibat reaktivitas radikal bebas (Winarsi, 2007
ioksidan untuk mencegah berbagai penyakit a
bih efektif jika kita mengkonsumsi sayur-sayur
akan antioksidan dan berbagai jenis daripada
ungggal. Efek antioksidan dari sayur-sayuran dan
pada suplemen antioksidan yang diisolasi dika
n lain dalam sayur-sayuran dan buah-buahan
ahi, 2006).
avonoid adalah senyawa polifenol yang mempun
susun dalam konfigurasi C6 -C3 -C6, yaitu dua c
n oleh 3 atom karbon yang dapat atau tidak dapa
kham, 1988).
sar flavonoid dapat dilihat pada Gambar 2.2 beri
Gambar 2.1 Struktur dasar flavonoid
(
DNA-repair dan dalam perbaikan
si, 2007).
t akibat pengaruh
yuran dan
buah-a cincin buah-arombuah-atik
dapat membentuk
2.2 berikut:
Flavonoid bersifat antioksidan. Senyawa ini berperan sebagai penangkap
radikal bebas karena mengandung gugus hidroksil dan bersifat sebagai reduktor
karena flavonoid dapat bertindak sebagai donor hidrogen terhadap radikal bebas
(Silalahi, 2006).
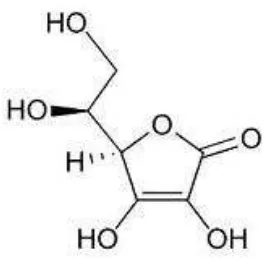
2.4.2 Vitamin C
Vitamin C atau asam askorbat mempunyai rumus molekul C6H8O6, titik
lebur lebih kurang 190OC, berbentuk serbuk hablur bwarnanya putih atau kuning,
oleh pengaruh cahaya lambat laun menjadi gelap. Dalam keadaan kering stabil di
udara dan cepat teroksidasi dalam larutan, mudah larut dalam air, agak sukar larut
dalam etanol, tidak larut dalam kloroform, eter dan benzen. Penyimpanannya
dalam wadah tertutup rapat dan tidak tembus cahaya (Ditjen POM, 1995).
Struktur kimia vitamin C dapat dilihat pada Gambar 2.1.
Gambar 2.2 Struktur kimia vitamin C
(Silalahi, 2006).
Vitamin C merupakan suatu antioksidan penting yang larut dalam air.
Vitamin C mempunyai potensi sebagai antioksidan dengan mendonorkan
hidrogen dari gugus hidroksilnya kepada radikal bebas dan berperan dalam
kekebalan tubuh terhadap infeksi virus dan bakteri dan berperan dalam regenerasi
vitamin E (Silalahi, 2006).
2.5 Spektrofotometri UV-Visible
Prinsip kerja spektrofotometer UV-Vis berdasarkan penyerapan cahaya
atau energi radiasi oleh suatu larutan. Jumlah cahaya atau energi radiasi yang
diserap memungkinkan pengukuran jumlah zat penyerap dalam larutan secara
kuantitatif (Triyati, 1985). Panjang gelombang untuk sinar ultraviolet antara
200-400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 200-400-750
nm (Rohman, 2007).
Metode spektrofotometri ultraviolet dan sinar tampak (visible) telah
banyak diterapkan untuk penetapan senyawa-senyawa organik yang umumnya
dipergunakan untuk penentuan senyawa dalam jumlah yang sangat kecil. Dalam
suatu larutan, gugus molekul yang dapat mengabsorpsi cahaya dinamakan gugus
kromofor. Molekul-molekul yang hanya mengandung satu gugus kromofor dapat
mengalami perubahan pada panjang gelombang. Molekul yang mengandung dua
gugus kromofor atau lebih akan mengabsorpsi cahaya pada panjang gelombang
yang hampir sama dengan molekul yang hanya mempunyai satu gugus kromofor
tertentu, tetapi intensitas absorpsinya adalah sebanding dengan jumlah kromofor
yang ada (Triyati, 1985). Spektrofotometer pada dasarnya terdiri dari sumber
sinar, monokromator, sel untuk zat yang diperiksa, detektor, penguat arus dan alat
ukur atau pencatat. Spektrofotometri serapan merupakan metode pengukuran
serapan radiasi elektromagnetik pada panjang gelombang tertentu yang diserap zat
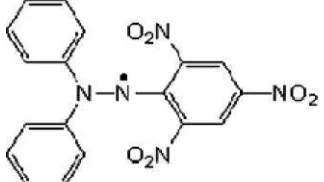
2.6 Penentuan Aktivi
Pada tahun 1922,
ungu radikal bebas sta
tidak larut dalam air (
Metode DPPH
digunakan untuk me
makanan. Metode DP
dalam bentuk larutan.
memberikan serapan m
ungu. Warna ini akan
ganjil tersebut berpasa
antioksidan. Perubah
(Prakash, et.al., 2001)
Parameter yan
harga konsentrasi ef
Concentration (IC50)
menyebabkan 50% D
antioksidan yang me
tivitas Antioksidan dengan Metode DPPH
hun 1922, Goldschmidt dan Renn menemukan sen
s stabil DPPH. DPPH berwarna sangat ungu sepe
ir (Ionita, 2005).
Gambar 2.3 Rumus bangun DPPH
(Praka
PPH adalah sebuah metode yang sederhan
menguji kemampuan antioksidan yang terka
DPPH dapat digunakan untuk sampel yang
utan. Prinsipnya dimana elektron ganjil pada
n maksimum pada panjang gelombang 517 nm
kan berubah dari ungu menjadi kuning lemah a
pasangan dengan atom hidrogen yang disumba
ubahan warna ini berdasarkan reaksi kesetim
, 2001).
yang dipakai untuk menunjukan aktivitas ant
efisien atau efficient concentration (EC50)
50) yaitu konsentrasi suatu zat antioksida
DPPH kehilangan karakter radikal atau konse
memberikan % penghambatan 50%. Zat ya
senyawa berwarna
seperti KMnO4dan
kash, et.al., 2001)
h apabila elektron
bangkan senyawa
setimbangan kimia
antioksidan adalah
) atau Inhibition
oksidan yang dapat
konsentrasi suatu zat
aktivitas antioksidan tinggi, akan mempunyai harga EC50atau IC50 yang rendah
(Molyneux, 2004).
2.6.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji
sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.6.2 Pengukuran absorbansi–panjang gelombang
Panjang gelombang maksimum (λ maks) yang digunakan dalam
pengukuran uji sampel uji sangat bervariasi. Menurut beberapa literatur panjang
gelombang maksimum untuk DPPH antara lain 515-520 nm, bagaimanapun dalam
praktiknya hasil pengukuran yang memberikan peak maksimum itulah panjang
gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas
(Molyneux, 2004).
2.6.3 Pengukuran waktu operasional (operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan
warna.Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu
operasional ditentukan dengan mengukur hubungan antara waktu pengukuran
BAB III
METODE PENELITIAN
Jenis penelitian yang dilakukan adalah penelitian eksperimental yang
meliputi pengumpulan dan preparasi bahan, karakterisasi simplisia, pembuatan
ekstrak etanol, skrining fitokimia, dan uji aktivitas antioksidan dengan metode
aktivitas pemerangkapan radikal bebas DPPH dengan menggunakan alat
spektrofotometer visibel.
3.1 Alat
Alat-alat yang digunakan terdiri dari: Alat alat gelas laboratorium,
desikator, gelas penutup, krus porselin, lemari pengering, mikroskop (Olympus),
neraca analitis (Metller Toledo), rotary evaporator (Haake D), penangas air,
pendingin Liebig, seperangkat alat destilasi, spektrofotometer UV/Vis (shimadzu),
tanur, timbangan dan objek gelas.
3.2 Bahan
Bahan yang digunakan dalam penelitian adalah kulit buah duku (Lansium
domesticum Correa dan etanol. Bahan bahan kimia yang lainnya adalah berkualitas pro analisis: 1,1-diphenyl-2-picrylhydrazyl (DPPH), air suling, asam
nitrat pekat, besi (III) klorida, asam asetat anhidrat, asam klorida pekat, asam
sulfat pekat, amil alkohol. benzen, bismuth (III) nitrat, etanol 96%, isopropanol,
kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, raksa (II)
3.3 Penyiapan Bahan Tanaman
Penyiapan bahan tanaman meliputi pengambilan bahan tanaman
identifikasi tanaman, dan pengolahan bahan tanaman.
3.3.1 Pengambilan bahan tanaman
Pengambilan bahan tanaman dilakukan secara purposif yaitu tanpa
membandingkan dengan daerah lain. Bahan tanaman yang digunakan adalah buah
duku (Lansium domesticum Correa) yang telah masak berwarna kuning diambil
dari kebun duku di Desa Ujan Mas Lamo, Kabupaten Muaraenim, Provinsi
Sumatera Selatan.
3.3.2 Identifikasi tanaman
Identifikasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani,
Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI)
3.3.3 Pengolahan bahan tanaman
Buah duku sebanyak 5 kg dicuci, lalu dipisahkan dengan buahnya, kulit
buah duku yang berwarna kuning kecoklatan dikumpulkan, dibersihkan,
ditiriskan, kemudian dipotong secara membujur. Kulit ini kemudian dikeringkan
di lemari pengering hingga kering dan apabila diremas simplisia akan hancur,
kemudian ditimbang sebagai berat kering.
3.4 Pembuatan Pereaksi
3.4.1 Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 m
3.4.2 Larutan HCl 2N
Sebanyak 17 ml asam klorida diencerkan dengan air suling sampai 100 ml
(Depkes, RI., 1995).
3.4.3 Timbal (II) asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas
CO2hingga 100 ml (Depkes, RI., 1995).
3.4.4 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida, kemudian dilarutkan dalam air suling
hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu
dilarutkan dalam 10 ml air suling. Kedua larutan dicampurkan dan ditambahkan
air suling hingga diperoleh larutan 100 ml. (Depkes, RI., 1995).
3.4.5 Pereaksi Molisch
Sebanyak 3 g α -naftol dilarutkan dalam asam nitrat 0,5 N hingga 100 ml
(Depkes, RI., 1995).
3.4.6 Pereaksi Dragendroff
Sebanyak 0,8 g bismut nitrat dilarutkan dalam asam nitrat pekat 20 ml
kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50
ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih
diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Depkes,
RI., 1995).
3.4.7 Larutan kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
3.4.8 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
diperoleh 100 ml (Depkes, RI., 1995).
3.4.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya
kemudian ditambahkan 2 g iodida sedikit demi sedikit cukupkan dengan air suling
(Depkes, RI., 1995).
3.4.10 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrat dengan 5 ml asam sulfat
pekat tambahkan etanol hingga 50 ml (Depkes, RI., 1995).
3.4.11 Larutan pereaksi DPPH 0,5 mM (konsentrasi 200 ppm)
Sebanyak 20 mg DPPH ditimbang, kemudian dilarutkan dalam metanol
hingga volume 100 ml (Molyneux, 2004).
3.5 Pemeriksaan Karakteristik Simplisia
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dan
dalam dari simplisia kulit buah duku.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia kulit buah
duku. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi dengan
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati dibawah
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari alas bulat 500 ml, alat penampung, pendingin, tabung
penyambung dan tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Kemudian kedalam labu tersebut dimasukkan 5 g serbuk simplisia yang
telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit, setelah
toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian
besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap
detik, setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin pada suhu kamar, setelah air dan toluen memisah sempurna, volume
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air
dihitung dalam persen (WHO, 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml air-kloroform dalam air suling sampai 1 liter) dalam labu
selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di
udara (Depkes, RI., 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam
etanol 96% dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, RI.,
1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada
suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara
(Depkes, RI., 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, RI., 1995).
3.6 Skrining Fitokimia
Skrining fitokimia dilakukan menurut Depkes RI (1995) dan Farnsworth
(1966) untuk mengetahui golongan senyawa alkaloida, glikosida, saponin, tanin,
dan steroida/triterpenoida.
3.6.1 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudiaan ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2
menit, didinginkan dan disaring, filtrat dipakai untuk uji alkaloida sebagai berikut:
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer akan
terbentuk endapan menggumpal berwama putih atau kuning bila terdapat
alkaloida.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat
akan terbentuk endapan berwama coklat sampai kehitaman bila terdapat
alkaloida.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff
akan terbentuk endapan merah atau jingga bila terdapat alkaloida (Depkes, RI.,
1995).
3.6.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 ml
1 ml asam klorida 2 N lalu direfluks selama 10 menit, didinginkan, lalu disaring.
Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat
0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml
campuran 2 bagian isopropanol dan 3 bagian kloroform, perlakuan ini diulangi
sebanyak 3 kali. Kumpulan sari pelarut organik ditambahkan Na2SO4 anhidrat,
disaring, kemudiaan diuapkan pada temperatur tidak lebih dari 500C, sisanya
dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut:
0,1 ml larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di
atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes larutan perekasi
Molish, lalu ditambahkan dengan hati-hati 2 ml asam sulfat pekat, terbentuk
cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon)
(Depkes, RI., 1995).
3.6.3 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan eter 20 ml selama 2 jam,
disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20
tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi
Lieberman-Burchard), diteteskan pada saat akan mereaksikan sampel uji, apabila terbentuk
warna biru atau biru hijau menunjukkan adanya steroida sedangkan warna merah,
merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.6.4 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambah 100 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas. Kedalam 5 ml filtrat
dikocok dan dibiarkan memisah. Flavonoid positif jika pada lapisan amil alkohol
terjadi warna merah kekuningan atau jingga (Farnsworth, 1966).
3.6.5 Pemeriksaaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1% jika
terjadi warna biru atau kehitaman menunjukkan adanya tannin (Farnsworth,
1966).
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok kuat-kuat
selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari
10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2
N buih tidak hilang (Depkes, RI., 1995).
3.7 Pembuatan Ekstrak Etanol Kulit Buah Duku (Lansium domesticum Correa)
Pembuatan ekstrak kulit buah duku dilakukan secara perkolasi. Sebanyak
400 g serbuk simplisia dibasahi dengan etanol 96% dan dibiarkan selama 3 jam
lalu dimasukkan ke dalam alat perkolator, lalu dituang cairan penyari etanol
sampai semua simplisia terendam dan terdapat selapis cairan penyari di atasnya,
bagian atas tabung perkolator ditutup dengan aluminium foil dan dibiarkan selama
24 jam, kemudian kran dibuka dan dibiarkan tetesan ekstrak mengalir dengan
kecepatan perkolat diatur 1 ml/menit, perkolat ditampung. Perkolasi dihentikan
meninggalkan sisa. Perkolat yang diperoleh kemudian dipekatkan dengan alat
rotary evaporator hingga diperoleh ekstrak kental kulit buah duku.
3.8 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel
3.8.1 Prinsip metode aktivitas pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam merangkap 1,1-diphenyl-2-picryhidrazyl
(DPPH) sebagai radikal bebas dalam larutan metanol dengan nilai IC50
(konsentrasi sampel uji yang mampu memerangkap radikal bebas sebesar 50%)
digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji
tersebut.
3.8.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM dipipet sebanyak 5 ml, kemudian dimasukkan ke
dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis
tanda (konsentrasi 40 ppm).
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya
pada panjang gelombang 400-800 nm.
3.8.4 Pembuatan larutan induk ekstrak etanol kulit buah duku (EEKBD)
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu
tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol
sampai garis tanda (konsentrasi 1000 ppm).
3.8.5 Pembuatan larutan uji EEKBD
Larutan induk dipipet sebanyak 1,25 ml; 2,5 ml; 3,75 ml; 5 ml kemudian
ppm, 100 ppm, 150 ppm, 200 ppm), kemudian dalam masing-masing labu
tentukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 ppm) lalu
volume dicukupkan dengan metanol sampai garis tanda. Didiamkan selama 60
menit, lalu diukur serapannya menggunakan spektrofotometer UV-Visibel pada
panjang gelombang 516 nm.
3.8.6 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu
tentukur 50 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 500 ppm).
3.8.7 Pembuatan larutan uji vitamin C
Larutan induk dipipet sebanyak 0,1 ml; 0,2 ml; 0,3 ml; 0,4 ml ke
dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 ppm, 4 ppm,
6 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 ml larutan
DPPH 0,5 mM (konsentrasi 200 ppm) lalu volumenya dicukupkan dengan
metanol sampai garis tanda. Didiamkan selama 60 menit, lalu diukur serapannya
menggunakan spektrofotometer UV-Visibel pada panjang gelombang 516 nm.
3.8.8 Penentuan persen peredaman
% Peredaman = x 100%
Keterangan :
A Kontrol = Absorbansi tidak mengandung sampel A sampel = Absorbansi sampel
Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH
serapan larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut
dihitung sebagai persen peredaman
3.8.9 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
(μ g/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/
meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak memunyai aktivitas
antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu
dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi
aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan
konsentrasi ekstrak (μ g/ml) sebagai absis (sumbu X) dan nilai % peredaman
(antioksidan) sebagai ordinatnya (sumbu Y).
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat
jika nilai IC50 kurang dari 50 μ g/ml, kuat untuk IC50 bernilai 50-100 μ g/ml,
sedang jika IC50 bernilai 100-150 μ g/ml, dan lemah jika IC50 bernilai 151-20
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tanaman
Hasil identifikasi tanaman yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor menunjukkan bahwa sampel
kulit duku termasuk suku Meliaceae, jenis Lansium domesticum Correa. Hasil
identifikasi dapat dilihat pada Lampiran 1, halaman 45.
4.2 Hasil Karakterisasi Simplisia
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia kulit buah duku berwarna coklat
tua, tekstur agak keras, berbau khas, berasa sepat dan pahit. Permukaan dalam
kulit buah agak licin dan berwarna coklat muda, terdapat sekat buah dan sisa
tempat buah terutama pada bagian ujung.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari serbuk simplisia kulit buah duku
menunjukkan terdapat rambut penutup, fragmen serabut sklerenkim, jaringan
parenkim dan terdapat pula fragmen sel batu sklereid. Hasil mikroskopik dapat
dilihat pada lampiran 5 halaman 34.
4.2.3 Hasil pemeriksaan karakteristik serbuk simplisia
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol,
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia kulit buah duku
No Karakteristik Simplisia Hasil
1 Kadar air 6,64 %
2 Kadar abu total 8,52 %
3 Kadar abu tidak larut dalam asam 0,82 %
4 Kadar sari larut dalam air 11,37 %
5 Kadar sari larut dalam etanol 17,86 %
Hasil penetapan kadar air simplisia kulit buah duku memenuhi persyaratan
secara umum simplisia yaitu tidak melebihi 10% (Depkes, RI., 1995). Penetapan
kadar air dilakukan untuk memberi batasan atau rentang besarnya kandungan air
di dalam simplisia, karena tingginya kandungan air dapat mempercepat
pertumbuhan jamur (Ditjen POM, 2000).
Syarat kadar sari larut dalam air, kadar sari larut dalam etanol, kadar abu
total dan kadar abu tidak larut dalam asam pada umumnya untuk masing-masing
simplisia tidak sama. Pada pemeriksaan ini, karakteristik simplisia belum tertera
didalam Materia Medika Indonesia (MMI).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal yang terdapat di dalam simplisia yang diteliti serta senyawa anorganik
yang tersisa selama pembakaran. Abu total terbagi dua yang pertama abu
fisiologis adalah abu yang berasal dari jaringan tanaman itu sendiri dan abu non
fisiologis adalah sisa setelah pembakaran yang berasal dari bahan-bahan dari luar
yang terdapat pada permukaan simplisia. Kadar abu tidak larut asam untuk
menentukan jumlah silika, khususnya pasir yang ada pada simplisia dengan cara
melarutkan abu total dalam asam klorida (WHO, 1998).
Kadar sari larut air dan etanol merupakan pengujian untuk penetapan
kandungan senyawa yang dapat terlarut dalam etanol (kadar sari larut etanol).
(Ditjen POM, 2000).
Penetapan kadar sari yang larut dalam air untuk mengetahui kadar
senyawa yang bersifat polar dalam simplisia. Penetapan kadar sari yang larut
dalam etanol untuk mengetahui senyawa yang bersifat polar dan non polar dalam
simplisia. Senyawa-senyawa yang dapat larut dalam air adalah glikosida, tanin,
gula, enzim, zat warna dan asam organik. Penetapan kadar sari yang larut dalam
etanol untuk mengetahui kadar sari yang larut dalam pelarut polar.
Senyawa-senyawa yang dapat larut dalam etanol adalah glikosida, flavonoid, steroid dan
dalam jumlah sedikit yang larut yaitu lemak, tanin dan saponin (Depkes, RI.,
1986).
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia kulit buah duku diketahui
bahwa kulit buah duku mengandung golongan senyawa-senyawa kimia seperti
yang terlihat pada Tabel 4.2.
Tabel 4.2 Hasil pemeriksaan skrining fitokimia simplisia
No Pemeriksaan Hasil
1 Alkaloid +
2 Glikosida +
3 Steroida/Triterpenoid +
4 Flavonoid +
5 Tanin +
6 Saponin +
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif: tidak mengandung golongan senyawa
Skrining fitokimia bertujuan untuk mendapatkan informasi golongan
dilakukan terhadap golongan senyawa alkaloid, flavonoid, glikosida, saponin,
tanin dan steroid/triterpenoid. Hasil skrining selanjutnya dijadikan acuan untuk
mengidentifikasi golongan senyawa bioaktif yang mempunyai aktivitas
antioksidan.
Hasil di atas menunjukkan bahwa kulit buah duku mengandung alkaloid,
glikosida, steroid/triterpenoid, flavonoid, tanin dan saponin. Kulit buah duku
memiliki potensi sebagai antioksidan karena mengandung metabolit sekunder
yang bersifat antioksidan diantaranya adalah alkaloid, tanin, flavonoid dan
steroid/triterpenoid. Senyawa flavonoid tersebut bertindak sebagai penangkap
radikal bebas karena gugus hidroksil yang dikandungnya mendonorkan hidrogen
kepada radikal bebas. Senyawa tersebut mampu menetralisir radikal bebas dengan
memberikan elektron kepadanya sehingga atom dengan elektron yang tidak
berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi,
2006). Tanin merupakan senyawa dengan jumlah gugus hidroksi fenolik yang
banyak dan dapat berfungsi sebagai antioksidan karena memiliki kemampuan
dalam menstabilkan fraksi lipid (Indrawati dan Razimin, 2013).
4.4 Hasil Analisis Aktivitas Antioksidan
Hasil uji aktivitas antioksidan EEKBD dengan metode pemerangkapan
1,1-diphenyl-2-picrylhidrazyl (DPPH) secara spektrofotometri visibel.
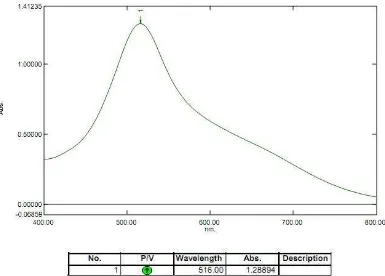
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Hasil pengukuran serapan maksimum larutan DPPH 40 ppm dalam
metanol dengan menggunakan spektrofotometer UV-Visible. Hasil pengukuran
menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan
kisaran panjang gelombang sinar tampak (400-800 nm) (Rohman, 2007). Data
hasil pengukuran dapat diihat pada Gambar 4.1.
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol menggunakan spektrofotometer UV-Visibel
4.4.2 Hasil penentuan operating time
Operating time bertujuan untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu
pengukuran dengan absorbansi larutan (Rohman, 2007). Lama pengukuran
metode DPPH menurut beberapa literatur yang direkomendasikan adalah selama
60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat
bervariasi yaitu dari 1 menit hingga 240 menit (Marinova dan Batchvarov, 2011).
Menurut Rosidah, et al. (2008), pengukuran dilakukan setelah masing-masing
sampel yang telah ditambahkan DPPH lalu didiamkan selama 60 menit pada suhu
4.4.3 Hasil analisis aktivitas antioksidan sampel uji
Uji pendahuluan ekstrak etanol dari kulit buah duku (EEKBD) terhadap
aktivitas antioksidan dilakukan pada konsentrasi 40 ppm, 60 ppm, 80 ppm dan
100 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan
uji). Penurunan absorbansi DPPH dan persen peredaman dengan penambahan
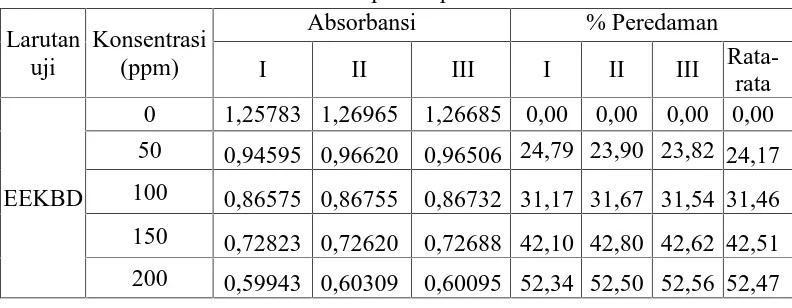
EEKBD dapat dilihat pada Tabel 4.3.
Tabel 4.3 Uji pendahuluan penurunan absorbansi dan persen peredaman DPPH oleh EEKBD
0 1,2580 1,2670 1,2700 0,00 0,00 0,00 0,00 40 0,9870 0,9870 0,9880 21,46 22,09 22,25 21,93
60 0,9510 0,9490 0,9500 24,40 25,09 25,19 24,89
80 0,9200 0,9180 0,9200 26,87 27,55 27,62 27,35
100 0,8750 0,8760 0,8740 30,86 30,45 31,25 30,85
Pada tabel di atas dapat dilihat bahwa pada konsentrasi 100 ppm belum
didapatkan % peredaman hingga 50%, sehingga konsentrasi larutan uji dinaikkan
menjadi 50 ppm, 100 ppm, 150 ppm dan 200 ppm. Penurunan absorbansi DPPH
dan persen peredaman dengan penambahan EEKBD dapat dilihat pada Tabel 4.4
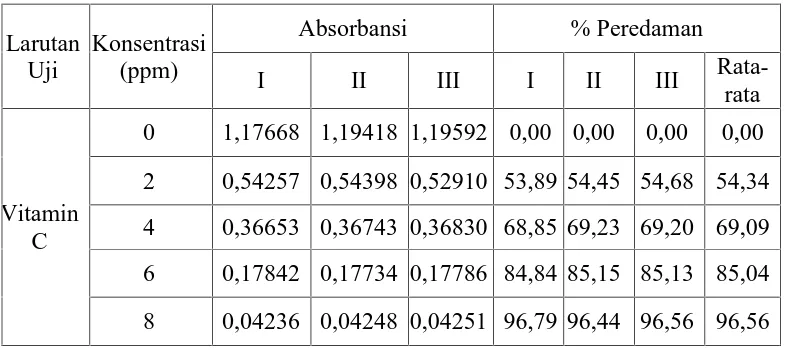
dan vitamin C dapat dilihat pada Tabel 4.5.
Tabel 4.4 Penurunan absorbansi dan persen peredaman DPPH oleh EEKBD
Larutan
0 1,25783 1,26965 1,26685 0,00 0,00 0,00 0,00 50 0,94595 0,96620 0,96506 24,79 23,90 23,82 24,17
100 0,86575 0,86755 0,86732 31,17 31,67 31,54 31,46
150 0,72823 0,72620 0,72688 42,10 42,80 42,62 42,51
Tabel 4.5 Penurunan absorbansi dan persen peredaman DPPH oleh vitamin C
0 1,17668 1,19418 1,19592 0,00 0,00 0,00 0,00
2 0,54257 0,54398 0,52910 53,89 54,45 54,68 54,34
4 0,36653 0,36743 0,36830 68,85 69,23 69,20 69,09
6 0,17842 0,17734 0,17786 84,84 85,15 85,13 85,04
8 0,04236 0,04248 0,04251 96,79 96,44 96,56 96,56
Pada Tabel 4.4 dan 4.5 dapat dilihat bahwa adanya penurunan nilai
absorbansi DPPH yang diberi EEKBD serta vitamin C sebagai pembandingnya
dalam metanol pada setiap kenaikan konsentrasi. Penurunan nilai absorbansi
menunjukkan aktivitas antioksidan yang semakin besar. EEKBD menunjukkan
nilai penurunan absorbansi DPPH yang lebih kecil dibandingkan vitamin C.
Penurunan nilai absorbansi terjadi karena larutan uji memerangkap DPPH
dan pemerangkapan terjadi karena adanya senyawa yang bereaksi sebagai
penangkap radikal yang akan mereduksi DPPH membentuk DPPH-H yang
tereduksi. Reaksi ini diamati dengan adanya perubahan warna DPPH dari ungu
menjadi kuning ketika elektron ganjil dari radikal DPPH telah berpasangan
dengan hidrogen dari senyawa penangkap radikal bebas. Keberadaan antioksidan
dalam ekstrak tumbuhan akan menetralisasi radikal DPPH dengan
menyumbangkan elektron kepada DPPH, menghasilkan perubahan warna dari
ungu menjadi kuning atau intensitas warna ungu larutan jadi berkurang
(Molyneux, 2004).
Penghilangan warna akan sebanding dengan jumlah elektron yang diambil
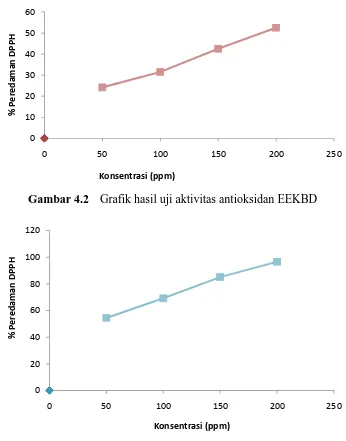
Hubungan antara konsentrasi dengan persentase peredaman radikal bebas
DPPH oleh EEKBD dapat dilihat pada Gambar 4.2 dan untuk vitamin C dapat
dilihat pada Gambar 4.3.
Gambar 4.2 Grafik hasil uji aktivitas antioksidan EEKBD
Gambar 4.3 Grafik hasil uji aktivitas antioksidan vitamin C
4.4.4 Hasil Analisis Nilai IC50(Inhibitory Concentration)
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi yang
diperoleh dengan cara memplot konsentrasi larutan uji dan persen peredaman