KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK AIR
DAN EKSTRAK ETANOL HIDRILLA
(Hydrilla verticillata (L.f.) Royle)
SKRIPSI
OLEH:
MITA JOSELIN
NIM 101501040
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK AIR
DAN EKSTRAK ETANOL HIDRILLA
(Hydrilla verticillata (L.f.) Royle)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MITA JOSELIN
NIM 101501040
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK AIR
DAN EKSTRAK ETANOL HIDRILLA
(Hydrilla verticillata (L.f) Royle)
OLEH: MITA JOSELIN
NIM 101501040
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 13 Juni 2014
Pembimbing I, Panitia Penguji,
Dra. Aswita Hafni Lubis, M.Si., Apt.
Dr. Marline Nainggolan, M.S., Apt.
NIP 195304031983032001 NIP 195709091985112001
Pembimbing II, Dra. Aswita Hafni Lubis, M.Si., Apt.
NIP 195304031983032001
Dra. Suwarti Aris, M.Si., Apt. Drs. Panal Sitorus, M.Si., Apt.
NIP 195107231982032001 NIP 195310301980031002
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi
yang berjudul Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas
Antioksidan Ekstrak Air dan Ekstrak Etanol Hidrilla (Hydrilla verticillata (L.f.)
Royle). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan
fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga
mengucapkan terima kasih kepada Ibu Dra Aswita Hafni Lubis, M.Si., Apt., dan
Ibu Dra. Suwarti Aris, M.Si., Apt., yang telah meluangkan waktu dan tenaga
dalam membimbing penulis dengan penuh kesabaran dan tanggung jawab,
memberikan petunjuk dan saran-saran selama penelitian hingga selesainya skripsi
ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Dr. Marline
Nainggolan, M.S., Apt., selaku ketua penguji, Bapak Drs. Panal Sitorus, M.Si.,
Apt., dan Ibu Dr. Poppy Anjelisa Z. Hasibuan, M.Si., Apt., selaku anggota penguji
yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Ibu
Sumaiyah S.Si., M.Si., Apt., selaku dosen pembimbing akademik yang telah
banyak membimbing penulis selama masa perkuliahan hingga selesai serta Bapak
dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbing
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga
kepada keluarga tercinta, Ayah Joselin dan Ibu Megawati, Kakak Willi Joselin,
Adik Lisa Joselin, serta Silviaty atas limpahan kasih sayang, doa dan dukungan
yang tak ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada
Bang Denny Satria dan Kak Ajeng Paramitha yang telah banyak membantu
penulis serta sahabat terdekat Anddora Michi, Maya Octavia, Cinta Suci
Hasibuan, Novita Sari, Ridha Rahimah, Vivian, Jessica Novia, Fennie dan
teman-teman mahasiswa/i Farmasi Stambuk 2010 yang selalu mendoakan dan memberi
dukungan serta semangat yang tiada henti.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Juni 2014
Penulis,
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Air dan Ekstrak Etanol Hidrilla
(Hydrilla verticillata (L.f.) Royle)
Abstrak
Hidrilla (Hydrilla verticillata (L.f.) Royle) termasuk suku Hydrocharitaceae yang banyak tersebar di perairan tawar Indonesia dan digunakan sebagai tanaman hias di akuarium serta sumber pupuk organik. Tumbuhan ini mengandung beta karoten sebagai senyawa antioksidan yang dapat menangkal radikal bebas dan mencegah berbagai macam penyakit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia, dan kekuatan aktivitas antioksidan dari ekstrak Hydrilla verticillata (L.f.) Royle.
Pengujian aktivitas antioksidan ekstrak air dan ekstrak etanol hidrilla menggunakan metode pemerangkapan radikal bebas DPPH ( 1,1-diphenyl-2-picrylhydrazil) setelah didiamkan selama 60 menit pada suhu kamar dan panjang gelombang 516 nm dengan pembanding vitamin C.
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 8,66%, kadar sari yang larut air 15,03%, kadar sari yang larut etanol 8,28%, kadar abu total 18,42%, kadar abu yang tidak larut dalam asam 2,81%. Hasil skrining fitokimia mengandung senyawa flavonoid, glikosida, saponin dan steroid/triterpenoid. Hasil uji aktivitas antioksidan terhadap radikal bebas DPPH diperoleh nilai Inhibitory Concentration (IC50) ekstrak air 1581,78 ppm, ekstrak etanol 608,45 ppm dan untuk vitamin C diperoleh IC50 sebesar 4,16 ppm. Ekstrak air dan ekstrak etanol
Hydrilla verticillata (L.f.) tidak memiliki aktivitas antioksidan pada pengujian dengan metode pemerangkapan radikal bebas DPPH.
Simplex Characterization and Phytochemical Screening with Antioxidant Activities Test of Ethanol Extract and Water Extract of Hydrilla
(Hydrilla verticillata (L.f.) Royle)
Abstract
Hydrilla (Hydrilla verticillata (L.f.) Royle) plant, family of Hydrocharitaceae scattered in the freshwater of Indonesia and is often used as an ornament plant in the aquarium as well as a source of organic fertilizer. It contains beta carotene which is an antioxidant compound that can counteract free radicals and prevent various disease. The purpose of this study was to determine the characteristics of the simplex, chemical compounds content and the power of the antioxidant activity from Hydrilla verticillata (L.f.) Royle extract.
The antioxidant activity assay of ethanol extract and water extract using the DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method after settling for 60 minutes at room temperature and a wave length of 516 nm with vitamin C as standard of comparison.
The result of the simplex characterization obtained level of water content 8.66%, level of water-soluble extract 15.03%, level of ethanol-soluble extract 8.28%, level of total ash 18.42%, and level of ash not soluble in acid 2.81%. The result of the phytochemical screening contains chemical compounds flavonoids, glycosides, saponins and steroid/triterpenoid. The result of the power antioxidant activity in reducing DPPH free radical obtained Inhibitory Concentration (IC50) values of water extract 1581.78 ppm, ethanol extract 608.45 ppm and vitamin C 4.16 ppm. Ethanol extract and water extract of Hydrilla verticillata (L.f.) Royle have no antioxidant activity by using the DPPH free radical scavenging method.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Habitat tumbuhan ... 6
2.1.2 Morfologi tumbuhan ... 6
2.1.4 Nama asing ... 7
2.1.5 Nama daerah ... 7
2.1.6 Kandungan kimia dan kegunaan ... 7
2.2 Ekstraksi ... 8
2.3 Radikal Bebas ... 8
2.4 Antioksidan ... 10
2.4.1 Vitamin C ... 11
2.4.2 Karotenoid ... 12
2.4.3 Flavonoid ... 13
2.4.4 Klorofil ... 14
2.5 Spektrofotometer UV-visibel ... 15
2.6 Penentuan Aktivitas Antioksidan dengan Metode DPPH ... 15
2.6.1 Pelarut ... 17
2.6.2 Pengukuran absorbansi-panjang gelombang ... 17
2.6.3 Waktu pengukuran ... 17
BAB III METODE PENELITIAN ... 18
3.1 Alat-alat ... 18
3.2 Bahan-bahan ... 18
3.3 Penyiapan Bahan Tumbuhan ... 19
3.3.1 Pengambilan bahan tumbuhan ... 19
3.3.2 Identifikasi tumbuhan ... 19
3.3.3 Pembuatan simplisia Hydrilla verticillata (L.f.) Royle 19
3.4 Pembuatan Pereaksi ... 20
3.4.2 Larutan asam klorida 2 N ... 20
3.4.3 Larutan timbal (II) asetat 0,4 M ... 20
3.4.4 Pereaksi Mayer ... 20
3.4.5 Pereaksi Mollish ... 20
3.4.6 Pereaksi Dragendorff ... 20
3.4.7 Larutan Kloralhidrat ... 21
3.4.8 Larutan asam sulfat 2 N ... 21
3.4.9 Larutan natrium hidroksida 2 N ... 21
3.4. 10 Pereaksi Bouchardat ... 21
3.4.10 Pereaksi Liebermann-Burchard ... 21
3.4.11 Larutan pereaksi DPPH 0,5 mM ... 21
3.5 Pemeriksaan Karakterisasi Simplisia ... 22
3.5.1 Pemeriksaan makroskopik... 22
3.5.2 Pemeriksaan mikroskopik ... 22
3.5.3 Penetapan kadar air ... 22
3.5.4 Penetapan kadar sari yang larut dalam air ... 23
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 24
3.5.6 Penetapan kadar abu total ... 24
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 24
3.6 Skrining Fitokimia ... 25
3.6.1 Pemeriksaan alkaloida ... 25
3.6.2 Pemeriksaan flavonoida ... 25
3.6.3 Pemeriksaan glikosida ... 26
3.6.5 Pemeriksaan saponin ... 27
3.6.6 Pemeriksaan tanin ... 27
3.6.7 Pemeriksaan steroida/triterpenoida ... 27
3.7 Pembuatan Ekstrak Hydrilla verticillata (L.f.) Royle ... 28
3.7.1 Pembuatan ekstrak air Hydrilla verticillata (L.f.) Royle (EAH) ... 28
3.7.2 Pembuatan ekstrak etanol Hydrilla verticillata (L.f.) Royle (EEH) ... 28
3.8 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel ... 29
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH .. 29
3.8.2 Pembuatan larutan blanko ... 29
3.8.3 Penentuan panjang gelombang serapan maksimum ... 29
3.8.4 Pembuatan larutan induk ... 29
4.2 Hasil Karakterisasi Simplisia ... 32
4.3 Hasil Skrining Fitokimia ... 34
4.4.1 Hasil penentuan panjang gelombang serapan
maksimum ... 35
4.4.2 Hasil analisis aktivitas antioksidan sampel uji ... 36
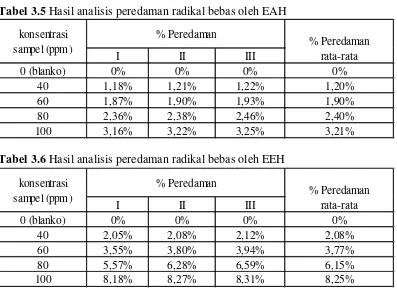
4.4.2 Hasil analisis peredaman radikal bebas DPPH oleh sampel uji ... 38
4.4.3 Analisis nilai IC50 (Inhibitory Concentration) sampel uji ... 41
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Tabel Halaman
3.1 Hasil pemeriksaan skrining fitokimia Hydrilla verticillata (L.f.)
Royle ... 35
3.2 Hasil analisis aktivitas antioksidan EAH ... 37
3.3 Hasil analisis aktivitas antioksidan EEH ... 37
3.4 Hasil analisis aktivitas antioksidan vitamin C ... 37
3.5 Hasil analisis peredaman radikal bebas oleh EAH ... 38
3.6 Hasil analisis peredaman radikal bebas oleh EEH ... 38
3.7 Hasil analisis peredaman radikal bebas oleh vitamin C ... 39
3.8 Hasil persamaan regresi linier yang diperoleh dari EAH, EEH dan vitamin C ... 42
DAFTAR GAMBAR
Gambar Halaman
1.1 Bagan kerangka pikir penelitian ... 5
2.2 Rumus bangun vitamin C ... 11
2.3 Rumus bangun β-karoten ... 12
2.4 Rumus bangun flavonoid ... 13
2.5 Rumus bangun klorofil ... 14
2.6 Rumus bangun DPPH ... 16
2.7 Reaksi radikal bebas DPPH dengan antioksidan ... 16
3.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel ... 36
3.2 Grafik hasil uji aktivitas antioksidan EAH ... 39
3.3 Grafik hasil uji aktivitas antioksidan EEH ... 40
3.4 Grafik hasil uji aktivitas antioksidan vitamin C ... 40
3.5 Diagram aktivitas antioksidan EAH dan EEH ... 41
DAFTAR LAMPIRAN
Lampiran Halaman
1. Surat hasil identifikasi tumbuhan ... 49
2. Gambar tumbuhan Hydrilla verticillata (L.f.) Royle ... 50
3. Hasil mikroskopik Hydrilla verticillata (L.f.) Royle ... 52
4. Bagan kerja penelitian ... 54
5. Bagan ekstraksi simplisia Hydrilla verticillata (L.f.) Royle secara maserasi ... 55
6. Perhitungan karakterisasi serbuk simplisia Hydrilla verticillata (L.f.) Royle ... 57
7. Gambar seperangkat alat spektrofotometer UV/Vis (Shimadzu 1800) ... 62
8. Hasil uji aktivitas antioksidan ... 63
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Air dan Ekstrak Etanol Hidrilla
(Hydrilla verticillata (L.f.) Royle)
Abstrak
Hidrilla (Hydrilla verticillata (L.f.) Royle) termasuk suku Hydrocharitaceae yang banyak tersebar di perairan tawar Indonesia dan digunakan sebagai tanaman hias di akuarium serta sumber pupuk organik. Tumbuhan ini mengandung beta karoten sebagai senyawa antioksidan yang dapat menangkal radikal bebas dan mencegah berbagai macam penyakit. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia, dan kekuatan aktivitas antioksidan dari ekstrak Hydrilla verticillata (L.f.) Royle.
Pengujian aktivitas antioksidan ekstrak air dan ekstrak etanol hidrilla menggunakan metode pemerangkapan radikal bebas DPPH ( 1,1-diphenyl-2-picrylhydrazil) setelah didiamkan selama 60 menit pada suhu kamar dan panjang gelombang 516 nm dengan pembanding vitamin C.
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 8,66%, kadar sari yang larut air 15,03%, kadar sari yang larut etanol 8,28%, kadar abu total 18,42%, kadar abu yang tidak larut dalam asam 2,81%. Hasil skrining fitokimia mengandung senyawa flavonoid, glikosida, saponin dan steroid/triterpenoid. Hasil uji aktivitas antioksidan terhadap radikal bebas DPPH diperoleh nilai Inhibitory Concentration (IC50) ekstrak air 1581,78 ppm, ekstrak etanol 608,45 ppm dan untuk vitamin C diperoleh IC50 sebesar 4,16 ppm. Ekstrak air dan ekstrak etanol
Hydrilla verticillata (L.f.) tidak memiliki aktivitas antioksidan pada pengujian dengan metode pemerangkapan radikal bebas DPPH.
Simplex Characterization and Phytochemical Screening with Antioxidant Activities Test of Ethanol Extract and Water Extract of Hydrilla
(Hydrilla verticillata (L.f.) Royle)
Abstract
Hydrilla (Hydrilla verticillata (L.f.) Royle) plant, family of Hydrocharitaceae scattered in the freshwater of Indonesia and is often used as an ornament plant in the aquarium as well as a source of organic fertilizer. It contains beta carotene which is an antioxidant compound that can counteract free radicals and prevent various disease. The purpose of this study was to determine the characteristics of the simplex, chemical compounds content and the power of the antioxidant activity from Hydrilla verticillata (L.f.) Royle extract.
The antioxidant activity assay of ethanol extract and water extract using the DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method after settling for 60 minutes at room temperature and a wave length of 516 nm with vitamin C as standard of comparison.
The result of the simplex characterization obtained level of water content 8.66%, level of water-soluble extract 15.03%, level of ethanol-soluble extract 8.28%, level of total ash 18.42%, and level of ash not soluble in acid 2.81%. The result of the phytochemical screening contains chemical compounds flavonoids, glycosides, saponins and steroid/triterpenoid. The result of the power antioxidant activity in reducing DPPH free radical obtained Inhibitory Concentration (IC50) values of water extract 1581.78 ppm, ethanol extract 608.45 ppm and vitamin C 4.16 ppm. Ethanol extract and water extract of Hydrilla verticillata (L.f.) Royle have no antioxidant activity by using the DPPH free radical scavenging method.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Berbagai media massa maupun informasi melalui internet banyak
mengungkapkan bahaya-bahaya lingkungan yang tidak sehat antara lain
terbentuknya radikal bebas (Kumalaningsih, 2006). Radikal ini dapat terbentuk
dari berbagai proses penyakit, racun, obat-obatan, logam, asap rokok, asap
knalpot, panas, kekurangan oksigen, bahkan cahaya matahari (Youngson, 2005).
Radikal bebas menyebabkan kerusakan melalui reaksi kimia yang dikenal
sebagai oksidasi. Reaksi ini menyebabkan hilangnya elektron dalam sebuah atom
sehingga terbentuk radikal bebas yang sangat aktif dan dapat merusak struktur
serta fungsi sel (Winarsi, 2011; Youngson, 2005).
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol sehingga menghasilkan ikatan silang
(cross–link) dengan DNA, protein, lipida, atau terjadi kerusakan oksidatif pada
gugus fungsional. Kerusakan oleh radikal bebas pada berbagai jaringan diyakini
sebagai pemicu terjadinya berbagai penyakit degeneratif seperti kanker, penyakit
kardiovaskular, gangguan penglihatan termasuk katarak, penyakit saluran
pernapasan dan lain-lain (Silalahi, 2006).
Reaktivitas radikal bebas dapat dihambat oleh sistem antioksidan yang
melengkapi sistem kekebalan tubuh. Tubuh manusia memiliki sistem antioksidan
oleh tubuh. Bila jumlah senyawa radikal bebas ini melebihi jumlah antioksidan
dalam tubuh, kelebihannya akan menyerang komponen lipid, protein, maupun
DNA sehingga mengakibatkan kerusakan-kerusakan yang disebut dengan stres
oksidatif (Winarsi, 2011). Proses perusakan oleh radikal bebas tersebut dapat
dihambat dengan cara memberikan antioksidan tambahan dari luar (eksogen)
seperti vitamin A, vitamin C, vitamin E, selenium, seng, dan asetilsistein (Tjay
dan Rahardja, 2007).
Penelitian terhadap radikal bebas menegaskan bahwa makanan yang kaya
antioksidan mengambil peran penting dalam pencegahan penyakit kardiovaskular
dan kanker serta penyakit degeneratif lainnya yang disebabkan oleh radikal bebas.
Berdasarkan hal tersebut, maka tumbuhan dengan kandungan antioksidan
mendapat perhatian khusus (Maestri, et al., 2006).
Salah satu tumbuhan yang mengandung antioksidan adalah tumbuhan air
hidrilla (Hydrilla verticillata) dari suku Hydrocharitaceae. Masyarakat
menganggap hidrilla sebagai gulma perairan dan belum dimanfaatkan dalam
bidang farmasi. Di California tumbuhan ini telah dijadikan produk suplemen yang
kaya akan Kalsium, vitamin dan mineral serta kaya akan lisin dengan nama Lotus
Superfood Wildcrafted Hydrilla Powder (Lotus Superfoods, 2013).
Di India, telah dilakukan skrining dan pengujian terhadap aktivitas
antioksidan hidrilla yang diambil dari Sungai Subarnarekha di distrik Mayurbhanj
Orissa oleh Pal dan Nimse (2006), dimana pada analisis kimia awal ditemukan
memiliki kandungan saponin, β-karoten, vitamin, mineral, dan antioksidan. Dari
hasil penelitian tersebut, zat yang diduga memberikan aktivitas antioksidan adalah
Karakteristik simplisia serta kandungan senyawa kimia yang terkandung
dalam hidrilla (Hydrilla verticillata) belum tercantum di dalam buku Materia
Medika Indonesia.
Berdasarkan hal di atas, penulis melakukan penelitian karakterisasi
simplisia, kandungan golongan senyawa kimia yang belum diuji, dan kekuatan
aktivitas antioksidan terhadap ekstrak air dan ekstrak etanol hidrilla.
1.2Perumusan Masalah
Perumusan masalah dari penelitian ini adalah:
a. apakah karakterisasi simplisia dari Hydrilla verticillata (L.f.) Royle dapat
dijadikan sebagai pembanding untuk penelitian selanjutnya?
b. apakah golongan senyawa kimia yang terkandung dalam serbuk simplisia
dan ekstrak Hydrilla verticillata (L.f.) Royle?
c. apakah ekstrak air dan ekstrak etanol Hydrilla verticillata (L.f.) Royle
memiliki aktivitas antioksidan?
d. berapakah nilai IC50 ekstrak air dan ekstrak etanol Hydrilla verticillata
(L.f.) Royle dalam meredam radikal bebas DPPH?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis dari penelitian ini adalah:
a. Karakteristik serbuk simplisia Hydrilla verticillata (L.f.) Royle dapat
b. Golongan senyawa kimia yang terkandung dalam serbuk simplisia dan
ekstrak Hydrilla verticillata (L.f.) Royle adalah glikosida, flavonoid,
saponin dan steroid/triterpenoid.
c. Ekstrak air dan ekstrak etanol dan Hydrilla verticillata (L.f.) Royle
memiliki aktivitas antioksidan.
d. Nilai IC50 Ekstrak air dan ekstrak etanol Hydrilla verticillata (L.f.) Royle
dalam meredam radikal bebas DPPH adalah < 50 ppm.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. untuk mengetahui karakteristik simplisia Hydrilla verticillata (L.f.) Royle.
b. untuk mengetahui golongan senyawa kimia yang terkandung dalam serbuk
simplisia dan ekstrak Hydrilla verticillata (L.f.) Royle.
c. untuk mengetahui kekuatan aktivitas antioksidan ekstrak air dan ekstrak
etanol Hydrilla verticillata (L.f.) Royle dalam meredam radikal bebas.
d. untuk mengukur kemampuan antioksidan dari ekstrak air dan ekstrak
etanol Hydrilla verticillata (L.f.) Royle dalam meredam radikal bebas
dibandingkan dengan vitamin C sebagai kontrol positif.
1.5 Manfaat
Manfaat dari penelitian ini adalah sebagai informasi tentang karakteristik
simplisia, kandungan senyawa kimia dan kekuatan aktivitas antioksidan dari
1.6Kerangka Pikir Penelitian
Kerangka pikir penelitian ini dapat dilihat pada gambar 1.1 dibawah ini :
Gambar 1.1 Bagan kerangka pikir penelitian Ekstrak
-Kadar sari yang larut dalam etanol
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tumbuhan meliputi habitat tumbuhan, morfologi tumbuhan,
sistematika tumbuhan, nama asing, nama daerah dan kandungan tumbuhan dan
kegunaan.
2.1.1 Habitat tumbuhan
Hidrilla berasal dari Uganda dan Tanzania, kemudian tersebar di Asia,
Amerika Utara, Amerika Selatan dan Eropa (Crow dan Hellquist, 2000).
Tumbuhan ini adalah salah satu gulma yang paling mengganggu karena memiliki
berbagai mekanisme reproduksi vegetatif sehingga memungkinkan untuk
menyebar pada habitatnya dengan sangat cepat (Al-Mandeel, 2013). Hidrilla dapat
tumbuh di kedalaman 10-15 m di bawah permukaan air pada habitat air tawar
seperti kolam, danau, sungai dan parit (Marer dan Garvey, 2001).
2.1.2 Morfologi tumbuhan
Hidrilla adalah tumbuhan air yang seluruh bagian tubuhnya tenggelam di
bawah permukaan air. Hidrilla memiliki akar serabut berwarna putih atau merah
kecoklatan jika tumbuh pada sedimen, ataupun berwarna hijau karena adanya
klorofil ketika terpapar sinar matahari (Langeland, 1996). Batang hidrilla
berwarna hijau, tegak, ramping, bercabang dan dapat tumbuh sepanjang 7 m.
Bunganya jarang ada, apabila ada akan tumbuh pada ketiak daun menuju
permukaan air melalui tangkai bunga yang panjang, berwarna putih dengan 3
Daun hidrilla berwarna hijau, tipis, berbentuk lanset dengan tepi bergerigi
dan berduri, lebar 2-4 mm dan panjang 6-20 mm, setiap tiga sampai empat helai
daun tumbuh melingkar dan membentuk ruas-ruas pada batang. Tangkai daun
berdiameter 0,1 mm dan berwarna hijau. Pelepah daun sering berwarna merah dan
memiliki satu duri di bawah permukaannya (Marer dan Garvey, 2001).
2.1.3 Sistematika tumbuhan
Tumbuhan hidrilla memiliki sistematika sebagai berikut (Ramesh, et al.,
2014):
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Hydrocharitales
Suku : Hydrocharitaceae
Genus : Hydrilla
Spesies : Hydrilla verticillata (L.f.) Royle
2.1.4 Nama asing
Hydrilla, water thyme.
2.1.5 Nama daerah
Ganggang, limut (Batak), ganggeng (Jawa).
2.1.6 Kandungan kimia dan kegunaan
Hydrilla verticillata mengandung saponin, β-karoten, vitamin, mineral,
klorofil, protein dan asam lemak esensial (Pal dan Nimse, 2006). Spesies ini juga
kaya akan lisin dan merupakan sumber potensial dari kalsium dan vitamin B12.
memelihara kesehatan kulit menguatkan tulang serta memiliki aktivitas
antibakteri, antioksidan dan antitumor (Ramesh, et al., 2014).
2.2Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat aktif dari
bahan asal (simplisia) dengan menggunakan pelarut (Syamsuni, 2006). Zat aktif
yang terdapat dalam simplisia tersebut dapat digolongkan ke dalam golongan
minyak atsiri, alkaloid, flavonoid dan lain-lain (Ditjen POM, 2000). Tujuan utama
ekstraksi ini adalah untuk mendapatkan atau memisahkan sebanyak mungkin
zat-zat yang memiliki khasiat pengobatan (Syamsuni, 2006).
Ekstraksi dapat dilakukan dengan berbagai cara salah satunya adalah
maserasi. Maserasi adalah suatu proses ekstraksi menggunakan pelarut dengan
beberapa kali pengocokan atau pengadukan pada temperatur ruangan. Maserasi
dilakukan dengan merendam serbuk simplisia dalam cairan penyari, dimana
cairan akan berdifusi dengan dinding sel yang mengandung zat aktif. Pengadukan
dilakukan untuk menjaga adanya derajat perbedaan konsentrasi antara larutan di
luar sel dan di dalam sel, sehingga larutan yang terpekat didesak keluar dinding
sel (Depkes, 1986).
2.3Radikal Bebas
Radikal bebas didefenisikan sebagai molekul yang mempunyai elektron
yang tidak berpasangan pada orbital terluarnya, sangat reaktif dan tidak stabil
(Fang et al, 2002). Radikal bebas dapat terbentuk dari oksigen dan nitrogen
sebagai produk metabolisme sel normal, atau disebut dengan reactive oxygen
reaktif terdiri atas radikal superoksida (O2˙−), hidroksil (OH˙), peroksil (RO2˙),
alkoksil (RO˙) dan hidroperoksil (HO2˙), nitrit oksida (NO˙), nitrogen dioksida
(NO2˙), lipid peroksil (LOO˙) dan kelompok non-radikal yang kurang reaktif
namun masih tergolong radikal bebas seperti hidrogen peroksida (H2O2), asam
hipoklorit (HOCl), ozon (O3), oksigen singlet (1O2), peroksinitrat (ONOO-), asam
nitrit (HNO2), dinitrogen trioksida (N2O3) dan lipid peroksida (LOOH). Radikal
bebas yang berasal dari oksigen merupakan spesies radikal yang lebih banyak
dihasilkan dalam sistem kehidupan. ROS (reactive oxygen species) dan RNS
(reactive nitrogen species) diproduksi pada hewan dan manusia dalam kondisi
fisiologis dan patologis. Oleh karena itu, ROS dan RNS meliputi spesies yang
radikal dan non-radikal (Sen, et al., 2010).
Reaksi berantai radikal bebas (Hamid, et al., 2010):
a. Tahap Inisiasi
(1) RH + initiator→ R˙ + H˙
(2) R˙→ R˙ + O2→ ROO˙
b. Tahap Propagasi
(1) R˙ + O2 → ROO˙
(2) ROO˙ +RH → ROOH + R˙
c. Tahap Terminasi
(1) R˙ + R˙ → RR
(2) R˙ + ROO˙ → ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap
propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara
terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan
radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya
kurang reaktif dari radikal induknya (Kumalaningsih, 2006).
Radikal bebas dapat menyebabkan gangguan fungsi, kerusakan struktur
dan mutasi sel. Hal ini dapat memicu timbulnya berbagai penyakit seperti
aterosklerosis, jantung koroner, stroke dan kanker (Winarsi, 2011).
2.4Antioksidan
Antioksidan adalah zat yang dapat melindungi sel-sel dari kerusakan yang
disebabkan oleh molekul tidak stabil yang dikenal sebagai radikal bebas (Hamid
et al, 2010). Antioksidan dapat menghambat atau mencegah oksidasi dari isi sel
seperti protein, lemak, karbohidrat dan DNA oleh radikal bebas.
Antioksidan bekerja dengan cara memerangkap spesies oksigen reaktif,
menghambat pembentukan radikal, mengikat ion logam transisi, mencegah
terbentuknya radikal hidroksil (OH˙) (Gupta, 2006).
Antioksidan dapat dikelompokkan menjadi:
a. Antioksidan primer
Antioksidan primer adalah antioksidan yang berfungsi untuk mencegah
terbentuknya radikal bebas baru karena dapat merubah radikal bebas menjadi
kurang reaktif sebelum sempat bereaksi. Antioksidan ini berupa enzim yang
diproduksi oleh tubuh, meliputi: SOD (superoksida dismutase), CAT (katalase)
dan GSH.Prx (glutation peroksidase). Enzim SOD berperan dalam mengubah
radikal superoksida (O2˙−) menjadi hidrogen peroksida (H2O2), enzim CAT dan
Kerja enzim-enzim ini sangat dipengaruhi oleh mineral-mineral seperti
mangan (Mn), selenium (Se), zink (Zn) dan tembaga (Cu) (Kumalaningsih, 2006).
b. Antioksidan sekunder atau sintesis
Antioksidan ini adalah senyawa fenol yang berfungsi untuk menangkap
radikal bebas dan menghentikan reaksi berantai, meliputi:
- Antioksidan vitamin, contoh: vitamin A, C, E
- Senyawa fitokimia, contoh: flavonoid, katekin, karotenoid, β-karoten.
- Antioksidan sintetik, contoh: BHA (butylated hydroxyl anisole), BHT
(butylated hydroxyrotoluene), PG (propyl gallate), EDTA (ethylene diamine
tetraacetic acid), TBHQ (tertiary butyl hydroquinone) dan NDGA (nordihydro
guaretic acid) (Hamid, et al., 2010).
2.4.1 Vitamin C
Asam askorbat atau Vitamin C mempunyai berat molekul 176,13 dengan
rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk putih agak
kuning, stabil dalam keadaan kering namun dalam larutan cepat teroksidasi oleh
karena itu harus disimpan dalam wadah tertutup rapat serta terlindung dari cahaya.
Vitamin C mudah larut dalam air, agak sukar larut dalam etanol, tidak larut dalam
kloroform, dalam eter dan dalam benzen (Ditjen POM, 1979). Rumus bangun
vitamin C dapat dilihat pada gambar 2.2 berikut ini:
Vitamin C adalah antioksidan yang ditemukan pada tumbuhan dan hewan
karena manusia tidak mempunyai enzim gulunolactone oxidase untuk
memproduksi senyawa ini sehingga vitamin C harus diperoleh dari luar. Asam
askorbat adalah agen pereduksi sehingga dapat mengurangi spesies oksigen
reaktif (Hamid, et al., 2010).
2.4.2 Karotenoid
Karotenoid adalah suatu kelompok pigmen yang berwarna kuning, jingga
atau merah jingga, mempunyai sifat larut dalam lemak atau pelarut organik tetapi
tidak larut dalam air (kumalaningsih, 2006). Karotenoid terdapat di dalam
kloroplas daun atau batang tumbuhan yang berwarna hijau dan dalam butiran lipid
pada sayuran dan buah-buahan tertentu (Gibney, et al., 2008).
Salah satu senyawa karotenoid adalah β-karoten, yaitu senyawa yang akan
dikonversikan menjadi vitamin A oleh tubuh sehingga sering juga disebut sebagai
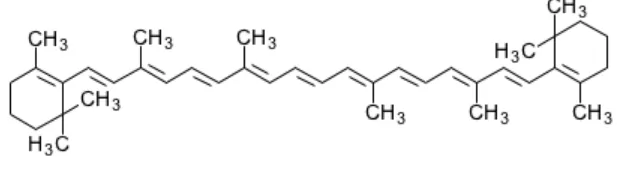
pro-vitamin A (Kumalaningsih, 2006). Rumus bangun β-karoten dapat dilihat
pada gambar 2.3 berikut:
Gambar 2.3Rumus bangun β-karoten.
β-karoten mempunyai berat molekul 536,9 dengan rumus molekul C40H56.
Karakteristik β-karoten adalah hablur atau serbuk berwarna coklat-merah atau
merah kecoklatan, praktis tidak larut dalam air, sedikit larut dalam sikloheksana,
kurang larut dalam etanol. β-karoten peka terhadap udara, panas dan cahaya,
Sebagai antioksidan, β-karoten memperlambat fase inisiasi radikal bebas
sehingga dapat melindungi tubuh terhadap berbagai penyakit, yaitu menghambat
pertumbuhan sel kanker, mencegah serangan jantung, mencegah katarak, serta
meningkatkan fungsi sistem kekebalan tubuh (Silalahi, 2006).
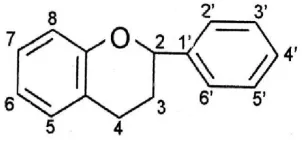
2.4.3 Flavonoid
Senyawa flavonoid termasuk senyawa polifenol yang mengandung 15
atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi (C6-C3-C6)
(Markham, 1998). Golongan terbesar flavonoid mempunyai cincin piran yang
menghubungkan rantai tiga karbon dengan salah satu cincin benzen (Robinson,
1995). Rumus bangun turunan flavonoid dapat dilihat pada gambar 2.4 berikut:
Gambar 2.4 Rumus bangun flavonoid
Flavonoid mengandung sistem aromatik yang terkonjugasi oleh karena itu
menunjukkan pita serapan yang kuat pada daerah spektrum UV dan spektrum
tampak. Flavonoid mencakup banyak pigmen yang terdapat dalam fungus hingga
angiospermae. Umumnya terdapat pada tumbuhan dalam bentuk terikat pada gula
sebagai glikosida sehingga untuk menganalisis flavonoid, lebih baik ekstrak
tumbuhan dihidrolisis terlebih dahulu untuk memecah ikatan gula dengan aglikon
(Harborne, 1987). Senyawa ini adalah senyawa pereduksi yang dapat
menghambat reaksi oksidasi sehingga dapat dijadikan sebagai antioksidan
(Robinson, 1995). Senyawa ini berperan sebagai donor hidrogen terhadap radikal
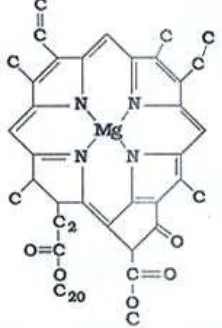
2.4.4 Klorofil
Klorofil adalah pigmen hijau yang ditemukan pada tumbuhan terutama di
dalam kloroplas dan namanya diturunkan dari bahasa Yunani chloros (hijau) dan
phyllon (daun) (Inanç, 2011). Senyawa ini mengandung satu inti porfirin
(tetrapirol) dengan satu atom magnesium terikat secara kelat di tengah, dan satu
rantai samping hidrokarbon panjang tergabung melalui gugus asam karboksilat.
Jenis yang banyak terdapat pada tumbuhan tinggi, paku-pakuan dan lumut adalah
Klorofil a dan b (Harborne, 1987). Perbedaan keduanya terletak pada gugus CH3
yang disubstitusi dengan CH=O pada klorofil b dengan rumus molekul
C55H70O6N4Mg dan berat molekul 907, sedangkan klorofil a mempunyai rumus
molekul C55H72O5N4Mg dengan berat molekul 893 (Riyono, 2007). Gambar
struktur klorofil a dapat dilihat pada gambar 2.5 berikut:
Gambar 2.5 Rumus bangun klorofil a.
Klorofil dapat meningkatkan produksi hemoglobin dalam darah
dikarenakan strukturnya yang mirip dengan struktur hemin dalam sel darah
merah, selain itu juga dapat meningkatkan daya tahan tubuh serta melindungi
kerusakan oksidatif terhadap DNA dengan cara menangkap (scavenge) radikal
2.5Spektrofotometer UV-visibel
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan sinar tampak yang diabsorbsi oleh sampel. Sinar
ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak
berada pada panjang gelombang 400-800 nm. Spektrofotometer UV-Vis pada
umumnya digunakan untuk (Dachriyanus, 2004):
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan
auksokrom dari suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang
maksimum suatu senyawa
3. Menganalisis senyawa organik secara kuantitatif.
Berdasarkan aspek kuantitatif, suatu berkas radiasi dikenakan pada
cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur
besarnya. Radiasi yang diserap oleh cuplikan kemudian ditentukan dengan
membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang
diserap (Rohman, 2007).
2.6Penentuan Aktivitas Antioksidan dengan Metode DPPH
DPPH pertama kali ditemukan pada tahun 1992 oleh Goldschmidt dan
Renn. Senyawa ini sangat berguna dalam berbagai penyelidikan seperti penentuan
antioksidan senyawa fenol atau senyawa alami (vitamin, ekstrak
tumbuh-tumbuhan, obat-obatan) serta untuk menghambat reaksi homolitik. DPPH bersifat
tidak larut dalam air, berwarna ungu pekat seperti KMnO4 dan bentuk
kekuningan (Ionita, 2005). Rumus bangun DPPH dapat dilihat pada gambar 2.6
berikut:
Gambar 2.6 Rumus bangun DPPH
Metode DPPH adalah sebuah metode sederhana yang dapat digunakan
untuk menguji kemampuan antioksidan yang terdapat pada makanan. Metode
DPPH dapat digunakan untuk sampel yang padat dan juga dalam bentuk larutan.
Prinsipnya dimana elektron ganjil pada molekul DPPH memberikan serapan
maksimum pada panjang gelombang 517 nm yang berwarna ungu. Warna ini akan
berubah dari ungu menjadi kuning lemah apabila elektron ganjil tersebut
berpasangan dengan atom hidrogen yang disumbangkan senyawa antioksidan
(Prakash, 2001). Reaksi radikal bebas DPPH dengan atom H netral yang berasal
dari senyawa-senyawa yang bersifat antioksidan dapat dilihat pada gambar 2.7
berikut:
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004).
2.6.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel
uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.6.2 Pengukuran absorbansi – panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur, panjang gelombang
maksimum untuk DPPH antara lain 515-520 nm. Bagaimanapun dalam
prakteknya hasil pengukuran yang memberikan peak maksimum itulah panjang
gelombangnya, yaitu sekitar panjang gelombang yang disebutkan di atas. Nilai
absorbansi yang mutlak tidaklah penting, karena panjang gelombang dapat diatur
untuk memberikan absorbansi maksimum sesuai dengan alat yang digunakan
(Molyneux, 2004).
2.6.3 Waktu pengukuran
Waktu pengukuran digunakan sebagai parameter untuk mengevaluasi
aktivitas antioksidan sampel sebagai rujukan untuk digunakan pada
penelitian-penelitian berikutnya (Molyneux, 2004). Waktu pengukuran bervariasi mulai dari
1, 5, 10, 15, 20, 30, 60, 90, 120 hingga 240 menit, namun yang sering digunakan
BAB III
METODE PENELITIAN
Metode penelitian dilakukan secara eksperimental. Penelitian meliputi
pengumpulan dan pengolahan bahan tumbuhan, karakterisasi simplisia, skrining
fitokimia, pembuatan ekstrak air dan ekstrak etanol serta pengujian aktivitas
antioksidan dengan metode DPPH menggunakan alat spektrofotometer visibel.
3.1Alat-alat
Alat-alat yang digunakan terdiri dari alat-alat gelas (erlenmeyer, gelas
beaker, gelas ukur, labu tentukur, tabung reaksi, corong pisah, gelas arloji, matt
pipet, corong gelas, seperangkat alat PK air, botol bersumbat, cawan berdasar rata,
pipet tetes), kertas saring, aluminium foil, penangas air, spektrofotometer UV/Vis
(Shimadzu), rotary evaporator (Stuart), oven (Memmert), mikroskop (Olympus),
krus porselin, tanur (Nabertherm), neraca analitis (Boeco Germany), freeze dryer
(Virtis Benchtop K), seperangkat alat sand bath, desikator, timbangan, kaca
objek, kaca penutup, stop watch dan krus tang.
3.2Bahan-bahan
Bahan yang digunakan dalam penelitian adalah hidrilla (Hydrilla
verticillata (L.f.) Royle). Bahan-bahan kimia yang lainnya adalah berkualitas pro
analisis poduksi Sigma : 1,1-diphenyl-2-picrylhydrazyl (DPPH); vitamin C
(CSPC Welsheng Pharmaceutical CO., Ltd.); produksi E-Merck: metanol, toluen,
klorida, asam klorida pekat, asam sulfat pekat, timbal (II) asetat, kloralhidrat,
kloroform, isopropanol, benzen, natrium hidroksida, asam asetat anhidrida, dan
amil alkohol. Bahan kimia berkualitas teknis: etanol 96% dan air suling.
3.3Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan,
identifikasi tumbuhan dan pembuatan simplisia.
3.3.1 Pengambilan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan bahan tumbuhan yang sama daerah lain. Bahan
tumbuhan yang digunakan adalah seluruh bagian tumbuhan hidrilla yang diambil
dari sungai di Desa Sinaksak, Kecamatan Tapian Dolok, Kabupaten Simalungun,
Provinsi Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani,
Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Jl.
Raya Jakarta-Bogor. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1,
halaman 48.
3.3.3 Pembuatan simplisia Hydrilla verticillata (L.f.) Royle
Hydrilla verticillata (L.f.) Royle yang telah dikumpulkan, dibersihkan,
dicuci, ditiriskan, kemudian ditimbang sebagai berat basah sebesar 18 kg.
Selanjutnya dikeringkan di lemari pengering hingga kering kemudian ditimbang
sebagai berat kering sebesar 0,9 kg. Bahan lalu diserbuk menggunakan blender.
3.4Pembuatan Pereaksi
3.4.1 Larutan besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.2 Larutan asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.3 Larutan timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.4.4 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml,
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.5 Pereaksi Mollish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Ditjen POM,1995).
3.4.6 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan
dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan
sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan
3.4.7 Larutan Kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
air suling (Ditjen POM, 1995).
3.4.8 Larutan asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai
100 ml (Ditjen POM, 1995).
3.4.9 Larutan natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 ml (Ditjen POM, 1995).
3.4.10 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.11 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian
volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Ditjen
POM, 1995).
3.4.12 Larutan DPPH 0,5 mM
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol
hingga diperoleh volume larutan 100 ml (konsentrasi 200 µg/ml) (Marinova,
3.5Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total,
penetapan kadar abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
simplisia Hydrilla verticillata (L.f.) Royle. Gambar tumbuhan segar dan simplisia
dapat dilihat pada Lampiran 2 halaman 49 -50.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia Hydrilla
verticillata (L.f.) Royle. Serbuk simplisia ditaburkan di atas kaca objek yang telah
ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian
diamati di bawah mikroskop. Hasil mikroskopik dapat dilihat pada Lampiran 3
halaman 51-52.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung
penyambung dan tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
b. Penetapan kadar air simplisia
Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama
dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, kemudian
labu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan
tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi,
kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua
air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada
suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan
air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(WHO, 1998). Perhitungan kadar air dapat dilihat pada Lampiran 6 halaman 56.
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105 ºC sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
(Ditjen POM, 1995). Perhitungan kadar sari yang larut dalam air dapat dilihat
3.5.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam
etanol 96% dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
Perhitungan kadar sari yang larut dalam etanol dapat dilihat pada Lampiran 6
halaman 58.
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan.
Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600
ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot
tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM,
1995). Perhitungan kadar abu total dapat dilihat pada Lampiran 6 halaman 59.
3.5.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu lalu dipijar sampai bobot
tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam
Perhitungan kadar abu yang tidak larut dalam asam dapat dilihat pada Lampiran 6
halaman 60.
3.6Skrining Fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak meliputi pemeriksaan
golongan senyawa alkaloida, flavonoida, glikosida, saponin, tanin, dan
steroida/triterpenoida.
3.6.1 Pemeriksaan alkaloid
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 0,5
g, ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas
penangas air selama 2 menit, didinginkan dan disaring, filtrat dipakai untuk uji
alkaloida. Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi
dimasukkan 0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk
endapan menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga
dari percobaan di atas (Ditjen POM, 1995).
3.6.2 Pemeriksaan flavonoid
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 10 g,
keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1
ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah.
Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan
amil alkohol (Farnsworth, 1966).
3.6.3 Pemeriksaan glikosida
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 3 g,
lalu disari dengan 30 ml campuran dari 7 bagian etanol 96% dengan 3 bagian air
suling (7:3) dan 10 ml asam klorida 2N. Kemudian direfluks selama 10 menit,
didinginkan, lalu disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan
25 ml timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat
disari dengan 20 ml campuran isopropanol dan kloroform (2:3), perlakuan ini
diulangi sebanyak 3 kali. Sari organik dikumpulkan dan ditambahkan Na2SO4
anhidrat, disaring, kemudian diuapkan pada temperatur tidak lebih dari 50ºC,
sisanya dilarutkan dalam 2 ml metanol. Sari air digunakan untuk percobaan
berikut, 0,1 larutan percobaan dimasukkan dalam tabung reaksi, kemudian
diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes larutan
pereaksi Molish, lalu ditambahkan dengan perlahan-lahan 2 ml asam sulfat pekat
melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan,
menunjukkan adanya ikatan gula (glikon) atau glikosida (Ditjen POM, 1995).
3.6.4 Pemeriksaan glikosida antrakuinon
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 0,2
g, ditambahkan 5 ml asam sulfat 2 N, dipanaskan sebentar, setelah dingin
ditambahkan 10 ml benzen, dikocok dan didiamkan. Lapisan benzen dipisahkan
Lapisan air berwarna merah dan lapisan benzen tidak berwarna menunjukkan
adanya antrakuinon (Ditjen POM, 1995).
3.6.5 Pemeriksaan saponin
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 0,5 g
dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas,
didinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa
setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang
dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin
(Ditjen POM, 1995).
3.6.6 Pemeriksaan tanin
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 0,5
g, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air
sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes
pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman
menunjukkan adanya tanin (Farnsworth, 1966).
3.6.7 Pemeriksaan steroida/triterpenoida
Serbuk simplisia, EAH dan EEH masing-masing ditimbang sebanyak 1 g
serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring.
Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan beberapa tetes
pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau
menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu
3.7 Pembuatan Ekstrak Hydrilla verticillata (L.f.) Royle
3.7.1 Pembuatan ekstrak air Hydrilla verticillata (L.f.) Royle (EAH)
Pembuatan ekstrak air Hydrilla verticillata (L.f.) Royle (EAH) dilakukan
secara maserasi. Prosedur pembuatan ekstrak: Sebanyak 300 g serbuk simplisia
dimasukkan ke dalam sebuah bejana, dituangi dengan cairan penyari air suling
sebanyak 2250 ml, ditutup, dibiarkan selama 5 hari dalam lemari pendingin
sambil sering diaduk, lalu serkai, peras dan cuci ampas dengan cairan penyari air
suling secukupnya hingga diperoleh 3 L. Kemudian pindahkan ke bejana tertutup,
biarkan di lemari pendingin selama 2 hari, lalu disaring (Ditjen POM, 1979).
Maserat yang diperoleh kemudian dipekatkan dengan alat sand bath dan
selanjutnya di freeze dryer hingga diperoleh ekstrak kental. Bagan ekstraksi dapat
dilihat pada Lampiran 5 halaman 54.
3.7.2 Pembuatan ekstrak etanol Hydrilla verticillata (L.f.) Royle (EEH)
Pembuatan ekstrak etanol Hydrilla verticillata (L.f.) Royle (EEH)
dilakukan secara maserasi. Prosedur pembuatan ekstrak: Sebanyak 300 g serbuk
simplisia dimasukkan ke dalam sebuah bejana, dituangi dengan cairan penyari
etanol 96% sebanyak 2250 ml, ditutup, dibiarkan selama 5 hari pada tempat yang
terlindung dari cahaya sambil sering diaduk, lalu serkai, peras dan cuci ampas
dengan cairan penyari etanol 96% secukupnya hingga diperoleh 3 L. Kemudian
pindahkan ke bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya
selama 2 hari, lalu disaring (Ditjen POM, 1979). Maserat yang diperoleh
kemudian dipekatkan dengan alat rotary evaporator dan selanjutnya di freeze
dryer hingga diperoleh ekstrak kental. Bagan ekstraksi dapat dilihat pada
3.8 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas
DPPH (1,1 diphenyl-2-picryl-hidrazyl) dalam larutan metanol (sehingga terjadi
perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi
sampel uji yang mampu meredam radikal bebas 50%) digunakan sebagai
parameter menentukan aktivitas antioksidan sampel uji (Molyneux, 2004).
3.8.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml,
kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya
dengan metanol sampai garis tanda (konsentrasi 40 ppm).
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya
pada panjang gelombang 400-800 nm. Gambar alat spektrofotometer dapat dilihat
pada lampiran 7 halaman 61.
3.8.4 Pembuatan larutan induk
3.8.4.1Pembuatan larutan induk sampel uji
Masing-masing sebanyak 25 mg EAH dan EEH ditimbang kemudian
dilarutkan dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan
3.8.4.2Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu
tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 1000 ppm).
3.8.5 Pembuatan larutan uji
3.8.5.1Larutan uji sampel
Larutan induk dipipet sebanyak 1 ml; 1,5 ml; 2 ml; 2,5 ml kemudian
dimasukkan ke dalam labu tentukur 25 ml untuk mendapatkan konsentrasi 40
ppm, 60 ppm, 80 ppm, 100 ppm, kemudian ke dalam masing-masing labu
tentukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 ppm) lalu
volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan di tempat
gelap selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer
UV-Visibel, panjang gelombang 516 nm.
3.8.5.2Larutan uji vitamin C
Larutan induk dipipet sebanyak 0,05 ml ; 0,1 ml ; 0,15 ml ; 0,2 ml ke
dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 ppm, 4 ppm,
6 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 ml larutan
DPPH 0,5 mM (konsentrasi 200 µg/ml) lalu volumenya dicukupkan dengan
metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit, lalu
diukur serapannya menggunakan spektrofotometer UV-Visibel, panjang
gelombang 516 nm.
3.8.6 Penentuan persen peredaman
Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH
serapan larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut
dihitung sebagai persen peredaman dengan rumus sebagai berikut:
% Peredaman=Akontrol−Asampel
Akontrol
x
100%Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel= Absorbansi sampel
3.8.7 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
(µg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat /
meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak mempunyai
aktivitas antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian
perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi
aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan
konsentrasi ekstrak (ppm) sebagai absis (sumbu X) dan nilai % peredaman
(antioksidan) sebagai ordinatnya (sumbu Y). Hasil pengujian aktivitas antioksidan
dapat dilihat pada Lampiran 8 halaman 62- 64 dan perhitungan nilai IC50 dapat
dilihat pada Lampiran 9 halaman 65.
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat
jika nilai IC50 kurang dari 50 ppm, kuat untuk IC50 bernilai 50-100 ppm, sedang
jika IC50 bernilai 101-150 ppm dan lemah jika IC50 bernilai lebih dari 150 ppm
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI) menunjukkan bahwa bahan uji termasuk spesies Hydrilla verticillata (L.f.)
Royle suku Hydrocharitaceae.
4.2 Hasil Karakterisasi Simplisia
Hasil pemeriksaan makroskopik dari Hydrilla verticillata (L.f.) Royle
segar yaitu tumbuhan berwarna hijau dengan batang bercabang banyak serta
memproduksi stolon; daun berbentuk lanset dengan lebar 2-4 mm dan panjang
6-20 mm, memiliki tepi bergerigi dan berduri, 3-4 helai daun tumbuh terkonsentrasi
membentuk ruas-ruas pada batang; akar berbentuk halus, kecil dan berwarna
putih. Simplisia yang diperoleh berwarna coklat kehijauan, berbau khas, dan
tidak berasa.
Hasil pemeriksaan mikroskopik dari akar Hydrilla verticillata (L.f.) Royle
memperlihatkan adanya jaringan gabus dan rambut akar; pada batang terdapat
jaringan gabus, berkas pembuluh, dan aerenkim; pada daun terdapat plastid,
berkas pembuluh, trikoma uniselular, trikoma multiselular; pada simplisia
terdapat kristal kalsium oksalat bentuk drusse, serat libriform, trikoma uniselular,
Sistem akar hidrofit hanya merupakan tempat berpijak di tanah karena
pengambilan air dan garam dilakukan oleh batang dan daun. Oleh karena itu
sistem pembuluhnya sangat tereduksi. Batang tumbuhan hidrofit yang tenggelam
berkas pembuluhnya tersusun pada silinder pusat yang menyempit. Daun
tumbuhan hidrofit yang terbenam dalam air, biasanya tidak memiliki stomata.
Floem pada kebanyakan organ tumbuhan tenggelam tereduksi dibandingkan
dengan organ tumbuhan yang hidup di darat, tetapi relatif lebih berkembang
dibandingkan dengan xilem tumbuhan air tenggelam (Fahn, 1995).
Hasil pemeriksaan karakterisasi serbuk simplisia diperoleh kadar air
sebesar 8,66%, kadar sari yang larut dalam air sebesar 15,03%, kadar sari yang
larut dalam etanol sebesar 8,28%, kadar abu total sebesar 18,42%, kadar abu
yang tidak larut dalam asam sebesar 2,81%.
Hasil penetapan kadar air simplisia dari Hydrilla verticillata (L.f.) Royle
memenuhi persyaratan dari buku Materia Medika Indonesia yaitu tidak melebihi
10%. Kadar air yang melebihi persyaratan memungkinkan terjadinya
pertumbuhan jamur.
Karakterisasi simplisia lain seperti penetapan kadar sari yang larut dalam
etanol, penetapan kadar sari yang larut dalam air, penetapan kadar abu total, dan
penetapan kadar abu yang tidak larut dalam asam khusus untuk simplisia Hydrilla
verticillata (L.f.) Royle belum ada literatur yang mencantumkannya sehingga
tidak mempunyai standarisasi.
Penetapan kadar sari yang larut dalam air untuk mengetahui kadar
senyawa yang bersifat polar dalam simplisia. Senyawa-senyawa yang dapat larut
pati, protein, lendir, enzim, lilin, lemak, pektin, zat warna, dan asam organik
(Depkes, 1986).
Penetapan kadar sari yang larut dalam etanol untuk mengetahui senyawa
yang bersifat polar dan non polar dalam simplisia. Senyawa-senyawa yang dapat
larut dalam etanol adalah alkaloid basa, minyak menguap, glikosida, kurkumin,
kumarin, antrakinon, flavonoid, steroid, damar, klorofil, dan dalam jumlah sedikit
yang larut lemak, malam, tanin dan saponin (Depkes, 1986).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal yang terdapat di dalam simplisia yang diteliti serta senyawa organik yang
tersisa selama pembakaran.
Abu total terbagi dua yang pertama abu fisiologis adalah abu yang berasal
dari jaringan tumbuhan itu sendiri dan abu non fisiologis adalah sisa setelah
pembakaran yang berasal dari bahan-bahan dari luar yang terdapat pada
permukaan simplisia. Kadar abu tidak larut asam untuk menentukan jumlah silika,
khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam
asam klorida (WHO, 1998).
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia, ekstrak air, dan ekstrak etanol
Hydrilla verticillata (L.f.) Royle menunjukkan adanya golongan
Tabel 3.1 Hasil pemeriksaan skrining fitokimia Hydrilla verticillata (L.f.) Royle.
No Pemeriksaan Simplisia Ekstrak Air Ekstrak Etanol
1 Alka loid - -
-2 Flavonoid + + +
3 Tanin - -
-4 Glikos ida + + +
5 Glikosida antrakuinon - -
-6 Saponin + + +
7 Steroid/Triterpenoid + - +
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Pada tabel 3.1 di atas menunjukkan bahwa Hydrilla verticillata (L.f.)
Royle memiliki potensi sebagai antioksidan, yaitu dengan adanya senyawa yang
mempunyai potensi sebagai antioksidan yaitu flavonoid. Hampir 80% dari total
antioksidan dalam tumbuhan berasal dari flavonoid, yang dapat berfungsi sebagai
penangkap radikal bebas (Kosasih, dkk., 2004).
4.4 Hasil Analisis Aktivitas Antioksidan
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
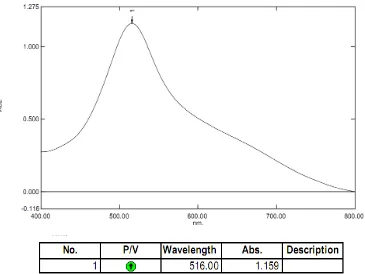
Pengukuran serapan maksimum larutan DPPH 40 ppm dalam metanol
menggunakan spektrofotometer UV-Vis. Hasil pengukuran menunjukkan bahwa
larutan DPPH dalam metanol menghasilkan serapan maksimum pada panjang
gelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar tampak
(400-750 nm) (Rohman, 2007) dan termasuk dalam rentang panjang gelombang
DPPH yang berkisar antara 515 – 520 nm (Molyneux, 2004).
Kurva panjang gelombang maksimum larutan DPPH dalam metanol dapat
Gambar 3.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel.
4.4.2 Hasil analisis aktivitas antioksidan sampel uji
Aktivitas antioksidan EAH dan EEH diperoleh dari hasil
pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan
larutan uji dengan konsentrasi 40 ppm, 60 ppm, 80 ppm, 100 ppm yang
dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Untuk
melihat penurunan absorbansi DPPH dengan penambahan EAH dapat dilihat pada
Tabel 3.2, penurunan absorbansi DPPH dengan penambahan EEH dapat dilihat
pada Tabel 3.3, dan penurunan absorbansi DPPH dengan penambahan vitamin C
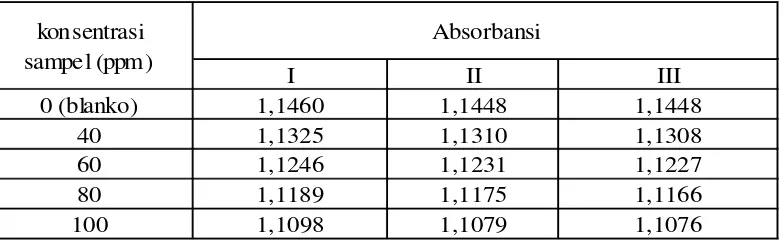
Tabel 3.2 Hasil analisis aktivitas antioksidan EAH
I II III
0 (blanko) 1,1460 1,1448 1,1448
40 1,1325 1,1310 1,1308
Tabel 3.3 Hasil analisis aktivitas antioksidan EEH
I II III
0 (blanko) 1,1579 1,1565 1,1534
40 1,1342 1,1324 1,1289
Tabel 3.4 Hasil analisis aktivitas antioksidan vitamin C
I II III
0 (blanko) 0,9833 0,9881 0,9901
2 0,7581 0,7582 0,7584
Hasil yang diperoleh menunjukkan adanya penurunan absorbansi DPPH
dengan penambahan EAH, EEH dan vitamin C dalam metanol sebagai larutan uji
pada beberapa konsentrasi, menunjukkan adanya aktivitas antioksidan dalam
meredam radikal bebas DPPH.
Penurunan nilai absorbansi terjadi karena adanya peredaman radikal bebas
DPPH oleh larutan uji sehingga menunjukkan adanya aktivitas antioksidan.