KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAN
JUS BUAH SALAK (Salacca sumatrana Becc)
DENGAN METODE DPPH
SKRIPSI
OLEH: ERIDA NOVRIANI
NIM 101524073
\\
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAN
JUS BUAH SALAK (Salacca sumatrana Becc)
DENGAN METODE DPPH
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: ERIDA NOVRIANI
NIM 101524073
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAN
JUS BUAH SALAK (Salacca sumatrana Becc)
DENGAN METODE DPPH
OLEH : ERIDA NOVRIANI
NIM 101524073
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Februari 2014
Pembimbing I, Panitia Penguji,
Dra. Saleha Salbi, M.Si., Apt. Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 194909061980032001 NIP 195304031983032001
Pembimbing II, Dra. Saleha Salbi, M.Si., Apt. NIP 194909061980032001
Dra. Masfria, M.S., Apt. Dra. Suwarti Aris, M.Si., Apt. NIP 195707231986012001 NIP 195107231982032001
Drs. Awaluddin Saragih, M.Si., Apt. NIP 195008221974121002
Medan, Maret 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan
rahmat kasih dan karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini
yang berjudul ”Karakterisasi dan Skrining Fitokimia serta Uji Aktivitas
Antioksidan Ekstrak Etanol dan Jus Daging Buah Salak (Salacca Sumatrana Becc) dengan Metode DPPH. Skripsi ini diajukan sebagai salah satu syarat
untuk memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini, penulis menyampaikan ucapan terimakasih yang
sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku
Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan
fasilitas selama masa pendidikan. Ibu Dra. Saleha Salbi, M.Si., Apt., dan Dra.
Masfria, M.S., Apt., selaku pembimbing yang telah memberikan waktu,
bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan
skripsi ini. Ibu T. Ismanelly Hanum, S.Si., M.Si, Apt., selaku penasehat
akademis yang memberikan bimbingan kepada penulis selama ini. Bapak dan
Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah
mendidik selama perkuliahan. Bapak dan Ibu Kepala Laboratorium Penelitian
dan Farmakognosi yang telah memberikan fasilitas, petunjuk dan membantu
selama penelitian. Ibu Aswita Hafni Lubis, M.Si., Apt., Dra. Suwarti Aris,
M.Si., Apt., dan Bapak Drs. Awaluddin Saragih, M.Si., Apt.,selaku dosen
penguji yang memberikan masukan, kritik, arahan, dan saran dalam
Penulis juga ingin mempersembahkan rasa terima kasih yang tak
terhingga kepada Ayahanda H. Pahri Siregar, S.Sos., Ibunda Dra. Hj.Erlina
Yanti Lubis dan Suami tercinta Hendra Bangsawan Daulay atas doa, semangat
dan pengorbanannya dengan tulus dan ikhlas bagi kesuksesan penulis, untuk
abang dan adik-adikku tersayang, dan teman-teman yang selalu setia memberi
doa, dorongan dan semangat.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya.
Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat
membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis
berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya
bidang farmasi.
Medan, Februari 2014
Penulis,
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAN
JUS BUAH SALAK (Salacca sumatrana Becc) DENGAN METODE DPPH
ABSTRAK
Antioksidan mempunyai aktivitas menetralisir senyawa radikal bebas yang merupakan salah satu penyebab kerusakan sel dan jaringan. Daging buah salak memiliki kandungan kimia yang berpotensi sebagai antioksidan yang dapat menetralkan radikal bebas. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia, skrining fitokimia dan uji aktivitas antioksidan dari ekstrak etanol dan jus daging buah salak.
Ekstrak etanol daging buah salak dapat diperoleh secara maserasi dengan pelarut etanol 96%. Selanjutnya, ekstrak dipekatkan menggunakan alat rotary evaporator dan dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kental. Jus daging buah salak diperoleh dengan memasukkan salak ke dalam juicer hingga diperoleh jus daging buah salak. Uji aktivitas antioksidan terhadap ekstrak etanol dan jus daging buah salak dilakukan dengan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH) setelah didiamkan selama 60 menit pada suhu kamar dan diukur absorbansinya dengan spektrofotometer uv-visibel pada panjang gelombang 516 nm.
Hasil pemeriksaan karakterisasi simplisia daging buah salak diperoleh kadar air 9,83%, kadar sari yang larut dalam air 56,73%, kadar sari yang larut dalam etanol 60,43%, kadar abu total 2,38% dan kadar abu yang tidak larut dalam asam 0,19%. Hasil skrining fitokimia dari simplisia, ekstrak etanol dan jus daging buah salak adalah flavonoid, glikosida, tanin, steroid dan saponin. Hasil pengujian aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa ekstrak etanol daging buah salak memiliki nilai IC50 sebesar 371,61 ppm, jus daging buah salak nilai IC50 sebesar 198,04 ppm dan untuk vitamin C nilai IC50 sebesar 4,17 ppm. Hasil uji aktivitas antioksidan ekstrak etanol dan jus daging buah salak sangat lemah dibandingkan dengan vitamin C.
CHARACTERIZATION AND PHYTOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITIES TEST OF SALAK FLESH ETHANOL
EXTRACT AND JUICE (Salacca sumatrana Becc)
WITH DPPH METHOD
ABSTRACT
Antioxidant can neutralize the free radical formation, one of substances cause cell or tissue damage. Salak flesh contain chemicals that have the potential as an antioxidant that can neutralize free radicals. The purpose of this study was to obserb simplex characterization, phytochemical screening, and the antioxidant activity of salak flesh ethanol extracts and juice.
Salak ethanol extract can be obtained by maceration with ethanol 96%. Subsequently , the extract was concentrated using a rotary evaporator and dried using a freeze dryer to obtain a viscous extract . Salak flesh juice is placed in juicer up to get the salak flesh juice. Antioxidant activity test of the salak flesh ethanol extract and juice fruits is done by the method of trapping of free radical 1,1-diphenyl-2-picrylhydrazil (DPPH) after settling for 60 minutes at room temperature and absorbance was measured with spektrofotometer uv-visible at a wavelength of 516 nm .
The results of the characterization of salak flesh simplex obtained moisture content 9, 83 %, levels of water-soluble extract 56.73%, content of ethanol -soluble extract 60.43%, 2.38% total ash content , and ash content that does not dissolve in 0.19% acid . Results of phytochemical screening of salak flesh simplex, ethanol extract and juice are flavonoids, glycosides, tannins, steroids and saponins. Results of testing antioxidant activity with DPPH free radical method of capture showed that the ethanol extract of fruits flesh had IC50 values of 371.61ppm, salak flesh juice fruits have IC50 value of 198.04ppm and for vitamin C obtained IC50 value of 4.17 ppm. The test results of antioxidant activity of salak flesh ethanol extract and juice are very weak compared to vitamin C.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Umum ... 6
2.1.1 Daerah Tumbuhan ... 6
2.1.2 Morfologi Tumbuhan ... 6
2.1.4 Nama daerah ... 7
2.1.5 Nama Asing ... 8
2.1.6 Kandungan Kimia ... 8
2.1.7 Kegunaan ... 8
2.2 Ekstraksi ... 8
2.3 Radikal Bebas ... 10
2.4 Antioksidan ... 12
2.4.1 Vitamin C ... 12
2.4.1 Flavonoid ... 13
2.5 Metode Pemerangkapan Radikal Bebas DPPH ... 14
2.5.1 Pelarut ... 17
2.5.2 Pengukuran absorbansi panjang-gelombang ... 17
2.5.3 Waktu pengukuran ... 17
2.6 Spektrofotometri UV-Visibel ... 18
BAB III METODE PENELITIAN ... 19
3.1 Tempat dan Waktu Penelitian ... 19
3.2 Alat ... 19
3.3 Bahan ... 19
3.4 Penyiapan Buah Salak ... 20
3.4.1 Pengumpulan buah salak ... 20
3.4.2 Identifikasi buah salak ... 20
3.4.3 Pembuatan simplisia ... 20
3.5 Pembuatan Pereaksi ... 21
3.5.2 Pereaksi Mayer ... 21
3.5.3 Pereaksi Dragendroff ... 21
3.5.4 Pereaksi Molish ... 22
3.5.5 Pereaksi asam klorida 2 N ... 22
3.5.6 Pereaksi asam sulfat 2 N ... 22
3.5.7 Pereaksi natrium hidroksida 2 N ... 22
3.5.8 Pereaksi timbal (II) asetat 0,4 M ... 22
3.5.9 Pereaksi besi (III) klorida 1% ... 22
3.5.10 Pereaksi kloralhidrat ... 22
3.5.11 Pereaksi Liebermann-Burchardat ... 22
3.5.12 Larutan DPPH 0,5 mM ... 23
3.6 Pemeriksaan Karakterisasi Simplisia ... 23
3.6.1 Pemeriksaan makroskopik ... 23
3.6.2 Pemeriksaan mikroskopik ... 23
3.6.3 Penetapan kadar air simplisia ... 23
a. Penjenuhan toluen ... 24
b. Penetapan kadar air simplisia ... 24
3.6.4 Penetapan kadar sari yang larut dalam air ... 24
3.6.5 Penetapan kadar sari yang larut dalam etanol ... 25
3.6.6 Penetapan kadar abu total ... 25
3.6.7 Penetapan kadar abu yang tidak larut dalam asam ... 25
3.7 Pemeriksaan Skrining Fitokimia ... 26
3.7.1 Pemeriksaan alkaloid ... 26
3.7.3 Pemeriksaan Tanin ... 27
3.7.4 Pemeriksaan steroida/triterpenoida ... 27
3.7.5 Pemeriksaan flavonoida ... 27
3.7.6 Pemeriksaan glikosida ... 27
3.7.7 Pemeriksaan glikosida antrakinon ... 28
3.8 Pembuatan Ekstrak Etanol dan Jus Daging Buah Salak ... 28
3.8.1 Pembuatan Ekstrak Etanol Daging Buah Salak ... 28
3.8.2 Pembuatan Jus Daging Buah Salak ... 29
3.9 Pengujian Aktivitas Antioksidan Secara Spektrofotometer UV-visible ... 29
3.9.1 Prinsip metode pemerangkapan radikal bebas DPPH ... 29
3.9.2 Pembuatan larutan blanko ... 30
3.9.3 Pembuatan larutan induk ... 30
3.9.3.1 Pembuatan larutan induk ekstrak etanol daging buah salak ... 30
3.9.3.2 Pembuatan larutan induk jus daging buah salak ... 30
3.9.3.3 Pembuatan larutan induk vitamin C ... 30
3.9.4 Pembuatan larutan uji ... 30
3.9.4.1 Larutan uji ekstrak etanol daging buah salak ... 30
3.9.4.2 Larutan uji jus daging buah salak ... 31
3.9.4.3 Larutan uji vitamin C ... 31
3.9.5 Prosedur Uji Aktivitas Antioksidan ... 31
3.9.5.2 Prosedur uji aktivitas antioksidan jus daging
Buah salak ... 31
3.9.5.3 Prosedur uji aktivitas antioksidan vitamin C ... 32
3.9.6 Analisis persen pemerangkapan radikal bebas DPPH .. 32
3.9.7 Analisis nilai IC50 ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Hasil Identifikasi Tumbuhan ... 33
4.2 Hasil Pemeriksaan Makroskopik dan Mikroskopik Daging Buah Salak ... 33
4.2.1 Hasil Pemeriksaan Makroskopik ... 33
4.2.2 Hasil Pemeriksaan Mikroskopik ... 33
4.3 Hasil Pemeriksaan Karakterisasi Simplisia ... 34
4.4 Hasil Skrining Fitokimia ... 35
4.5 Hasil Analisis Aktivitas Antioksidan Sampel Uji ... 36
4.6 Hasil Analisis Nilai IC50 (Inhibitory Concentration) Sampel Uji ... 38
BAB V KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil pemeriksaan karakterisasi simplisia daging buah
Salak ... 34
Tabel 4.2 Hasil skrining fitokimia ... ... 35
Tabel 4.3 Penurunan absorbansi DPPH dengan Penambahan Ekstrak
Etanol dan Jus Daging Buah Salak ... 37
Tabel 4.4 Penurunan absorbansi DPPH dengan penambahan
vitamin C ... 37
Tabel 4.5Kategori kekuatan aktivitas antioksidan ... 39
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Vitamin C ... 13
Gambar 2.2 Struktur Dasar Flavonoid ... 14
Gambar 2.3 Struktur Kimia DPPH ... 15
Gambar 2.4 Resonansi DPPH ... 16
Gambar 2.5 Reaksi antara DPPH dengan atom H dari senyawa Antioksidan ... 16
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan ... 44
Lampiran 2. Gambar Tumbuhan Salak, Buah Salak, Simplisia,
Serbuk Simplisia dan Jus Daging Buah Salak ... 45
Lampiran 3. Gambar Mikroskopik Serbuk Simplisia Daging Buah
Salak ... 49
Lampiran 4. Bagan Kerja Pembuatan Simplisia ... 50
Lampiran 5. Perhitungan Hasil karakterisasi simplisia daging
Buah salak ... 51
Lampiran 6. Bagan Pembuatan Ekstrak Etanol Daging Buah Salak .. 55
Lampiran 7. Hasil Uji Antioksidan ... 56
KARAKTERISASI DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL DAN
JUS BUAH SALAK (Salacca sumatrana Becc) DENGAN METODE DPPH
ABSTRAK
Antioksidan mempunyai aktivitas menetralisir senyawa radikal bebas yang merupakan salah satu penyebab kerusakan sel dan jaringan. Daging buah salak memiliki kandungan kimia yang berpotensi sebagai antioksidan yang dapat menetralkan radikal bebas. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia, skrining fitokimia dan uji aktivitas antioksidan dari ekstrak etanol dan jus daging buah salak.
Ekstrak etanol daging buah salak dapat diperoleh secara maserasi dengan pelarut etanol 96%. Selanjutnya, ekstrak dipekatkan menggunakan alat rotary evaporator dan dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kental. Jus daging buah salak diperoleh dengan memasukkan salak ke dalam juicer hingga diperoleh jus daging buah salak. Uji aktivitas antioksidan terhadap ekstrak etanol dan jus daging buah salak dilakukan dengan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH) setelah didiamkan selama 60 menit pada suhu kamar dan diukur absorbansinya dengan spektrofotometer uv-visibel pada panjang gelombang 516 nm.
Hasil pemeriksaan karakterisasi simplisia daging buah salak diperoleh kadar air 9,83%, kadar sari yang larut dalam air 56,73%, kadar sari yang larut dalam etanol 60,43%, kadar abu total 2,38% dan kadar abu yang tidak larut dalam asam 0,19%. Hasil skrining fitokimia dari simplisia, ekstrak etanol dan jus daging buah salak adalah flavonoid, glikosida, tanin, steroid dan saponin. Hasil pengujian aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa ekstrak etanol daging buah salak memiliki nilai IC50 sebesar 371,61 ppm, jus daging buah salak nilai IC50 sebesar 198,04 ppm dan untuk vitamin C nilai IC50 sebesar 4,17 ppm. Hasil uji aktivitas antioksidan ekstrak etanol dan jus daging buah salak sangat lemah dibandingkan dengan vitamin C.
CHARACTERIZATION AND PHYTOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITIES TEST OF SALAK FLESH ETHANOL
EXTRACT AND JUICE (Salacca sumatrana Becc)
WITH DPPH METHOD
ABSTRACT
Antioxidant can neutralize the free radical formation, one of substances cause cell or tissue damage. Salak flesh contain chemicals that have the potential as an antioxidant that can neutralize free radicals. The purpose of this study was to obserb simplex characterization, phytochemical screening, and the antioxidant activity of salak flesh ethanol extracts and juice.
Salak ethanol extract can be obtained by maceration with ethanol 96%. Subsequently , the extract was concentrated using a rotary evaporator and dried using a freeze dryer to obtain a viscous extract . Salak flesh juice is placed in juicer up to get the salak flesh juice. Antioxidant activity test of the salak flesh ethanol extract and juice fruits is done by the method of trapping of free radical 1,1-diphenyl-2-picrylhydrazil (DPPH) after settling for 60 minutes at room temperature and absorbance was measured with spektrofotometer uv-visible at a wavelength of 516 nm .
The results of the characterization of salak flesh simplex obtained moisture content 9, 83 %, levels of water-soluble extract 56.73%, content of ethanol -soluble extract 60.43%, 2.38% total ash content , and ash content that does not dissolve in 0.19% acid . Results of phytochemical screening of salak flesh simplex, ethanol extract and juice are flavonoids, glycosides, tannins, steroids and saponins. Results of testing antioxidant activity with DPPH free radical method of capture showed that the ethanol extract of fruits flesh had IC50 values of 371.61ppm, salak flesh juice fruits have IC50 value of 198.04ppm and for vitamin C obtained IC50 value of 4.17 ppm. The test results of antioxidant activity of salak flesh ethanol extract and juice are very weak compared to vitamin C.
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia memiliki sumber daya alam yang sangat melimpah, terutama
dari segi jumlah tanaman obat yang sebagian besar belum dapat dibuktikan
secara ilmiah. Tanaman salak (Salacca sumatrana Becc) merupakan salah satunya. Di Indonesia ada 2 jenis salak, yaitu salak yang termasuk dalam
spesies Salacca sumatrana (Salak Padangsidimpuan) dan Salacca zalacca. Salacca zalacca yang terdiri atas 2 spesies, yaitu varietas Zalacca (Gaertn.) Voss. dan varietas Amboinensis (Salacca edulis Reinw) yang disebutsalak bali (Ashari, 2006).
Salak merupakan buah khas dari Sumatera Utara tepatnya di daerah
Kabupaten Tapanuli Selatan dan Kota Padangsidimpuan. Salak yang tumbuh di
Padangsidimpuan lebih dikenal dengan sebutan salak sibakua. Buah yang
rasanya manis agak sepat ini banyak mengandung vitamin A, vitamin C dan
beta karoten sehingga dapat digunakan sebagai antioksidan (Lingga L, 2012).
Akhir-akhir ini, masyarakat di Padangsidimpuan dan Tapanuli Selatan
telah memproduksi berbagai produk olahan daging buah salak berupa dodol
salak, keripik salak, kurma salak, sirup salak dan bahkan mengkonsumsi jus
salak yang dimaksudkan untuk mengobati penyakit diabetes dan menurunkan
Menurut penelitian Sahputra (2008), salak (Salacca edulis Reinw) daging dan kulit buahnya mengandung senyawa flavonoid, tanin, dan alkaloid,
sedangkan senyawa saponin, steroid, dan triterpenoid tidak terdeteksi.
Antioksidan adalah senyawa kimia yang dapat meredam, menetralisir
atau menghancurkan proses reaksi radikal bebas. Radikal bebas adalah molekul
yang tidak mempunyai pasangan elektron sehingga tidak stabil dan berusaha
mencari pasangan elektronnya (Mc.Murry, 2008).
Antioksidan sangat besar peranannya pada manusia untuk mencegah
terjadinya penyakit. Senyawa antioksidan dapat diperoleh dari sumber alami
yang berasal dari tumbuhan. Senyawa antioksidan alami umumnya senyawa
fenol atau polifenol (Kumalaningsih, 2006).
Karakteristik simplisia daging buah salak belum ada tertera dalam
literatur, maka perlu dilakukan karakterisasi simplisia daging buah salak.
Metode yang digunakan untuk menentukan uji aktivitas antioksidan ini adalah
metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil), metode ini dipilih karena metode ini yang paling sederhana, cepat dan murah
untuk mengukur kemampuan antioksidan yang terdapat pada makanan,
buah-buahan dan sayur-sayuran dalam meredam radikal bebas (Prakash, 2001).
Berdasarkan hal di atas, maka dilakukan penelitian tentang karakterisasi
simplisia, skrining fitokimia dan uji aktivitas antioksidan dengan metode
1.2Perumusan Masalah
Berdasarkan uraian pada latar belakang tersebut, maka perumusan
masalah penelitian adalah:
a. apakah karakterisasi simplisia daging buah salak Padangsidimpuan
memenuhi persyaratan simplisia secara umum.
b. golongan senyawa kimia apa saja yang terkandung dalam simplisia,
eksrtrak etanol dan jus daging buah salak Padangsidimpuan.
c. apakah ekstrak etanol dan jus daging buah salak Padangsidimpuan
memiliki aktivitas sebagai antioksidan.
1.3Hipotesis
Berdasarkan perumusan masalah tersebut, maka hipotesis penelitian ini
adalah sebagai berikut:
a. karakterisasi simplisia daging buah salak Padangsidimpuan memenuhi
persyaratan simplisia secara umum.
b. kandungan golongan senyawa kimia yang terdapat dalam simplisia,
ekstrak etanol dan jus daging buah salak Padangsidimpuan adalah
golongan alkaloid, saponin, tanin, steroid/triterpenoid, flavonoid,
glikosida, dan glikosida antrakinon.
c. ekstrak etanol dan jus daging buah salak Padangsidimpuan memiliki
1.4Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
a. untuk mengetahui karakteristik simplisia daging buah salak
Padangsidimpuan memenuhi persyaratan simplisia secara umum.
b. untuk mengetahui golongan senyawa kimia yang terdapat pada
simplisia, ekstrak etanol dan jus daging buah salak Padangsidimpuan.
c. untuk mengetahui aktivitas antioksidan dari ekstrak etanol dan jus
daging buah salak Padangsidimpuan.
1.5Manfaat Penelitian
Data karakteristik dan hasil skrining fitokimia simplisia daging buah
salak dapat memberikan informasi bagi peneliti selanjutnya. Ekstrak etanol dan
jus daging buah salak dapat menambah inventaris tumbuhan obat yang
1.6Kerangka Pikir Penelitian
Variabel Bebas Variabel Terikat Parameter
Golongan senyawa kimia
1. Alkaloid 2. Saponin 3. Tanin 4. Steroid/ Triterpenoid 5. Flavonoid 6. Glikosida 7. Glikosida Antrakinon
Ekstrak Etanol Daging Buah Salak
Aktivitas antioksidan metode DPPH
Nilai IC50 Simplisia
Daging Buah Salak
Karakteristik 1. Makroskopik 2. Mikroskopik 3. Pk air
4. Pk sari larut air 5. Pk sari larut etanol 6. Pk abu total 7. Pk abu tidak larut asam
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian Tumbuhan meliputi daerah tumbuhan (habitat), morfologi
tumbuhan, sistematika tumbuhan, nama daerah, nama asing, kandungan kimia
dan kegunaan dari tumbuhan.
2.1.1 Daerah Tumbuh
Salak merupakan tumbuhan yang dapat tumbuh di daerah dataran
rendah sampai lebih dari 800 meter diatas permukaan laut. Salak menyukai
tanah yang subur, gembur, dan lembab. Derajat keasaman tanah yang cocok
untuk budidaya salak adalah 4,5 – 7,5. Salak menyukai sinar matahari cukup
tetapi tidak langsung. Cahaya optimal 70% dengan suhu harian rata-rata 20°-
30℃ (Yeni, dkk., 2013; Wardiyono, 2013).
2.1.2 Morfologi Tumbuhan
Tumbuhan Salak berupa palma berbentuk perdu atau hampir tidak
berbatang, berduri banyak tumbuh menjadi rumpun yang rapat dan kuat.
Batang menjalar di bawah atau di atas tanah, membentuk rimpang dan bulat,
sering bercabang, diameter 10 - 15 cm. Daun majemuk menyirip, panjang 3 - 7
m; tangkai daun, pelepah dan anak daun berduri panjang, tipis dan banyak,
warna duri coklat. Anak daun berbentuk lanset dengan ujung meruncing,
berukuran sampai 8 x 85 cm, sisi bawah keputihan oleh lapisan lilin.
Kebanyakan berumah dua (dioesis), karangan bunga terletak dalam tongkol
seludang, yang belakangan mengering dan mengurai menjadi serupa serabut.
Tongkol bunga jantan 50 - 100 cm panjangnya antara 7 - 15 cm, dengan
banyak bunga kemerahan terletak di ketiak sisik-sisik yang tersusun rapat.
Tongkol bunga betina 20 - 30 cm, bertangkai panjang. Buah tipe buah batu
berbentuk segitiga agak bulat atau bulat telur terbalik, runcing di pangkalnya
dan membulat di ujungnya, panjang 2,5 - 10 cm, terbungkus oleh sisik-sisik
berwarna kuning coklat sampai coklat merah mengkilap yang tersusun seperti
genting, kuning krem sampai keputihan; berasa manis, asam, atau sepat. Biji 1
- 3 butir, coklat hingga kehitaman, keras, 2 - 3 cm panjangnya (Widyaningrum,
2011).
2.1.3 Sistematika Tumbuhan
Menurut Herbarium Medanese USU, sistematika tumbuhan salak adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Monocotyledoneae
Bangsa : Arecales
Suku : Arecaceae
Marga : Salacca
Jenis : Salacca sumatrana Becc. 2.1.4 Nama Daerah.
Nama daerah dari buah salak ini adalah Sala (Minangkabau), Salak
(Melayu), Salak (Sunda), Salak (Jawa Tengah), Salak (Makassar), Salak (Bali),
2.1.5 Nama Asing
Menurut Wardiyono (2013), nama asing dari buah salak yaitu salak
atau snake fruit ( Inggris).
2.1.6 Kandungan Kimia
Daging buah salak mengandung tanin, saponin dan flavonoida
(Sahputra, 2008).
2.1.7 Kegunaan
Daging buah salak berkhasiat sebagai antioksidan, menjaga kesehatan
mata, antidiabetes, menurunkan kolesterol dan antidiare. Dapat juga digunakan
sebagai makanan dan minuman olahan sepeti manisan, asinan, dodol, keripik,
sirup dan kurma salak.
2.2 Ekstraksi
Ekstraksi adalah suatu cara menarik kandungan senyawa kimia dari
simplisia nabati atau hewani dengan pelarut yang sesuai sehingga terpisah dari
bahan yang tidak dapat larut. Sebelum ekstraksi dilakukan biasanya bahan-
bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan
tertentu (Harbone, 1987).
Menurut Departemen Kesehatan RI (2000). Beberapa metode ekstraksi
yang sering digunakan dalam berbagai penelitian adalah:
A.Cara dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
ruangan (kamar). Maserasi yang dilakukan pengadukan secara terus menerus
disebut maserasi kinetik. Remaserasi berarti dilakukan pengulangan
penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan
seterusnya.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru
sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
kamar. Proses perkolasi terdiri dari tahapan pengembangan bahan, tahap
perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan
ekstrak) terus menerus sampai diperoleh perkolat yang jumlahnya 1 - 5 kali
bahan.
B.Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas
yang relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40o - 50o C.
3. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu
baru, umumnya dilakukan dengan alat soklet sehingga terjadi ekstraksi kontinu
4. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90o C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90o C selama 30 menit.
2.3 Radikal Bebas
Radikal bebas adalah atom atau senyawa yang kehilangan pasangan
elektronnya. Sebagai contoh, atom oksigen (O2) yang normal mempunyai
empat (4) pasang elektron. Proses metabolisme sehari- hari yang merupakan
proses biokimia yang menyebabkan terbentuknya radikal bebas yang bersifat
sementara karena dengan cepat diubah menjadi senyawa yang tidak berbahaya
bagi tubuh. Tetapi, bila terjadi reaksi dalam tubuh yang berlebihan maka akan
terjadi perampasan elektron oksigen tersebut sehingga menjadi tidak
berpasangan dan atom oksigen menjadi radikal bebas yang berusaha
mengambil elektron dari senyawa lain sehingga terjadi reaksi berantai
(Kumalaningsih, 2006).
Oksidasi lemak oleh spesies oksigen reaktif melibatkan tiga langkah,
yaitu inisiasi, propagasi, dan terminasi. Pada tahap inisiasi terjadi serangan
spesies oksigen reaktif yang mampu melepaskan sebuah atom hidrogen dari
sebuah gugus metilen. Serangan ini menghasilkan radikal bebas dari asam
lemak dan kemudian bereaksi dengan O2 membentuk radikal peroksil (ROO*).
lemak. Reaksi ini merupakan tahapan propagasi. Terminasi terjadi dengan
bereaksinya radikal peroksil dengan antioksidan penangkap radikal. Selain itu
setiap radikal alkil atau radikal pada rantai karbon asam lemak (R*) dapat
bereaksi dengan peroksida lemak (ROO*) menghasilkan produk senyawa
seperti dimer ROOR yang relatiof stabil. Menurut (Kumalaningsih, 2006)
secara sederhana, reaksinya dapat dibuat:
Inisiasi : RH R* + H
Propagasi : R* + O2 ROO*
ROO* + RH ROOH + R*
Terminasi : R* + R* R-R
R* + ROO* ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap
propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi
antara suatu radikal dengan senyawa lain dan menghasilkan radikal baru.
Tahap terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas
dengan radikal bebas yang lain sehingga menjadi tidak reaktif lagi. Ketika
proses tersebut terjadi maka siklus reaksi radikal telah berakhir
(Kumalaningsih, 2006).
Radikal bebas yang sangat berbahaya dalam makhluk hidup antara lain
adalah golongan hidroksil (OH-), superoksida (O2-), nitrogen monooksida
(NO)2, peroksidal (RO-2), peroksinitrit (ONOO-), asam hipoklorit (HOCl),
2.4 Antioksidan
Antioksidan atau reduktor berfungsi untuk mencegah terjadinya
oksidasi atau menetralkan senyawa yang telah teroksidasi dengan cara
menyumbangkan hydrogen atau elektron (Silalahi, 2006).
Menurut Kumalaningsih (2006), terdapat tiga macam antioksidan yaitu:
a. Antioksidan yang dibuat oleh tubuh kita sendiri yang berupa enzim
pada tubuh manusia antara lain: superoksida dismutase, glutathione
peroxidase, perxidasi dan katalase.
b. Antioksidan alami yang diperoleh dari tanaman atau hewan, yaitu
tokoferol, vitamin C, betakaroten, flavonoida dan senyawa fenolik.
c. Antioksidan sintetik dibuat dari bahan-bahan kimia yaitu BHT dan
BHA yang ditambahkan dalam makanan untuk mencegah kerusakan
lemak.
Antioksidan dalam tubuh dibedakan atas tiga kelompok, yaitu (1)
antioksidan primer yang bekerja dengan cara mencegah terbentuknya radikal
bebas yang baru dan mengubah radikal bebas menjadi molekul yang tidak
merugikan, (2) antioksidan sekunder yang berfungsi untuk menangkap radikal
bebas dan menghalangi terjadinya reaksi berantai dan (3) antioksidan tersier
yang bermanfaat untuk memperbaiki kerusakan biomolekuler yang
bdisebabkan oleh radikal bebas (Silalahi, 2006).
2.4.1 Vitamin C
Vitamin C atau asam askorbat mempunyai rumus molekul C6H8O6, titik
kuning, oleh pengaruh cahaya lambat laun menjadi gelap. Dalam keadaan
kering stabil di udara dan cepat teroksidasi dalam larutan, mudah larut dalam
air, agak sukar larut dalam etanol, tidak larut dalam kloroform, eter dan
benzen. Penyimpanannya dalam wadah tertutup rapat dan tidak tembus cahaya
(Ditjen POM, 1995).
Struktur kimia vitamin C dapat dilihat pada Gambar 2.1 berikut:
Gamabar 2.1 Struktur kimia vitamin C
Vitamin C merupakan suatu antioksidan penting yang larut dalam air.
Vitamin C mempunyai potensi sebagai antioksidan dengan mendonorkan
hidrogen dari gugus hidroksilnya kepada radikal bebas. Vitamin C juga dapat
meningkatkan kekebalan tubuh terhadap infeksi dan virus. Aktivitas sistem
kekebalan yang optimum memerlukan keseimbangan antara pembentukan
radikal bebas dan proteksi antioksidan (Silalahi, 2006).
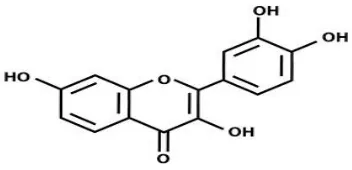
2.4.2 Flavonoid
Flavonoid adalah senyawa yang terdiri dari C6-C3-C6 yang terdapat
pada seluruh bagian tanaman, termasuk pada buah, tepung sari, dan akar
(Sirait, 2007).
Flavonoid terdapat dalam tumbuhan sebagai campuran dari flavonoid
yang berbeda golongan dan jarang sekali dijumpai hanya flavonoid tunggal.
Flavonoid pada tumbuhan terdapat dalam berbagai bentuk struktur molekul
lebih baik memeriksa aglikon yang telah terhidrolisis daripada dalam bentuk
glikosida dengan strukturnya yang rumit dan kompleks. Flavonoid dapat
berkhasiat antioksidan dan antibakteri (Harbone, 1984).
Struktur dasar flavonoid dapat dilihat pada Gambar 2.2 berikut:
Gambar 2.2 Struktur dasar flavonoid
Flavonoid bersifat antioksidan. Senyawa ini berperan sebagai
penangkap radikal bebas karena mengandung gugus hidroksil. Karena bersifat
sebagai reduktor, flavonoid dapat bertindak sebagai donor hidrogen terhadap
radikal bebas (Silalahi, 2006).
2.5 Metode Pemerangkapan Radikal Bebas 1,1-diphenyl-2-picryihydrazyl
(DPPH)
Metode pemerangkapan radikal bebas DPPH ini diikuti oleh penurunan
serapan pada panjang gelombang. Penurunan serapan diikuti dengan elektron
nitrogen ganjil dalam DPPH (1,1-diphenyl-2-picrylhydrazil) yang dapat digunakan sebagai substrat untuk mempelajari sebagai mekanisme
penangkapan radikal pada beberapa fenolik, flavonoid dan polifenol
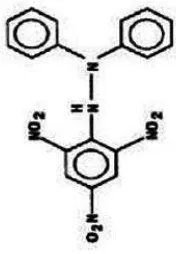
Struktur kimia DPPH dapat dilihat pada Gambar 2.3 berikut ini:
DPPH (radikal bebas) DPPH (non radikal)
Gambar 2.3 Struktur kimia DPPH
Metode pemerangkapan radikal bebas DPPH (1,1-diphenyl -2-picrylhydrazil) adalah suatu metode sederhana yang dapat digunakan untuk menguji kemampuan antioksidan yang terkandung dalam makanan. Metode ini
dapat digunakan untuk sampel yang padat dan bentuk larutan. Prinsipnya
adalah elektron ganjil pada molekul DPPH memberikan serapan maksimum
pada panjang gelombang tertentu, berwarna ungu. Warna akan berubah dari
ungu menjadi kuning lemah pabila elektron ganjil tersebut berpasangan dengan
atom hidrogen yang disumbangkan senyawa antioksidan. Perubahan warna ini
berdasarkan reaksi kesetimbangan kimia (Prakash, 2001).
DPPH merupakan radikal bebas yang stabil karena resonansi yang
dialaminya. Resonansi juga menyebabkan peningkatan kepekatan warna ungu
Resonansi DPPH dapat dilihat pada Gambar 2.4 berikut ini:
Gambar 2.4 Resonansi DPPH
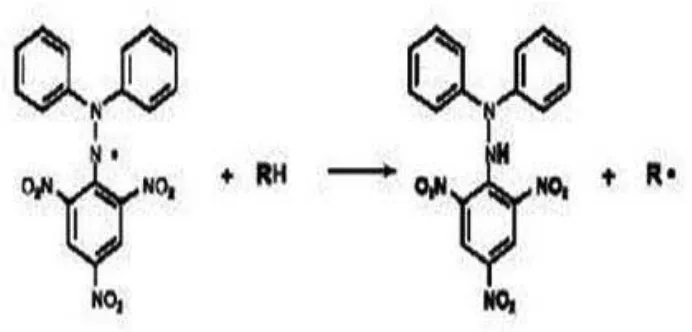
Ketika larutan DPPH dicampurkan dengan senyawa yang dapat
mendonorkan atom hidrogen, akan dihasilkan bentuk tereduksi dari DPPH dan
berkurangnya warna ungu (Molyneux, 2004). Reaksi antara DPPH dengan
atom H dari senyawa antioksidan dapat dilihat pada Gambar 2.5 berikut.
2.5.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol
atau etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara
sampel uji antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.5.2 Pengukuran Absorbansi - Panjang Gelombang
Panjang gelombang maksimum (ƛ����) yang digunakan dalam
pengukuran uji sampel uji sangat bervariasi. Menurut beberapa literatur
panjang gelombang maksimum untuk DPPH antara lain 515 – 520 nm.
Bagaimanapun dalam praktiknya hasil pengukuran yang memberikan peak
maksimum itulah panjang gelombangnya sekitar panjang gelombang yang
disebutkan diatas. Nilai absorbansi mutlak tidaklah penting, karena panjang
gelombang dapat diatur untuk memberikan absorbansi maksimum sesuai
dengan alat yang digunakan (Molyneux, 2004).
2.5.3 Waktu Pengukuran
Pada awalnya lama pengukuran menurut beberapa literatur, yang
direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian
waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30
menit, dan 60 menit. Waktu reaksi yang tepat adalah ketika reaksi sudah
mencapai kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas
antioksidan yang terdapat di dalam sampel (Molyneux, 2004; Rosidah, et al.,
2.6 Spektrofotometri UV-Visibel
Radiasi elektromagnetik, yang mana sinar ultraviolet dan sinar tampak
(visibel) merupakan salah satunya, dapat dianggap sebagai energi yang
merambat dalam bentuk gelombang. Warna sinar visibel dapat dihubungkan
dengan panjang gelombangnya yaitu dengan menggunakan alat untuk
mengukur absorpsi energi radiasi macam-macam zat kimia dan pengukuran
kualitatif dari suatu zat dengan ketelitian yang lebih besar (Rohman, 2007).
Spektrofotometer pada dasarnya terdiri atas sumber sinar
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan
alat ukur atau pencatat. Spektrofotometri serapan adalah pengukuran serapan
radiasi elektromagnetik panjang gelombang tertentu yang sempit, mendekati
monokromotor yang diserap zat. Spektrofotometri yang sering digunakan
dalam dunia industri farmasi salah satu adalah spektrofotometri ultraviolet
dengan panjang gelombang 200 - 400 nm dan visibel (cahaya tampak) dengan
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Farmakognosi dan di
Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada
bulan Juli 2014 – Desember 2014.
3.2 Alat
Alat-alat yang digunakan pada penelitian ini meliputi alat-alat gelas
laboratorium, spektrofotometer UV-Visible (Shimadzu 1800), rotary evaporator (Heidolph VV 2000), oven listrik (Strok), neraca kasar (Ohaus), neraca analitis (Vibra), blender (National), penangas air (Yenaco), lemari
pengering, seperangkat alat penetapan kadar air, desikator, cawan porselin,
mikroskop, object glass, gelas penutup, lemari pengering, krus tang dan pisau, aluminium foil, lemari pengering, stopwatch, kaca objek, kaca penutup,
mikroskop (Boeco, BM-180, Halogen Lamp), juicer (Miyako), dan kamera
digital (Nicon).
3.3 Bahan
Bahan yang digunakan pada penelitian adalah daging buah salak
padangsidimpuan (Salacca sumatrana Becc.). Bahan-bahan kimia lainnya yang berkualitas pro analisis adalah: produksi Sigma 1,1-diphenyl-2-picrylhydrazyl (DPPH), vitamin C, produksi E-Merck: etanol, metanol, toluen, kloroform,
sulfat pekat, raksa (II) klorida, bismut (III) nitrat, besi (III) klorida, timbal (II)
asetat, kalium iodida, kloralhidrat, asam asetat anhidrida, natrium hidroksida,
amil alkohol, natrium sulfat anhidrat, serbuk magnesium. Bahan kimia
berkualitas teknis; etanol 96%.
3.4 Penyiapan Buah Salak
Penyiapan buah salak meliputi pengumpulan buah salak, identifikasi
buah salak, dan pembuatan simplisia daging buah salak.
3.4.1 Pengumpulan Buah Salak
Salak yang digunakan adalah salak Padangsidimpuan yang masih segar,
warna merah, sedikit warna putih dan cukup tua yang berumur 5-6 bulan.
Pengambilan tumbuhan dilakukan secara purposif tanpa membandingkan
dengan tumbuhan yang sama dari daerah lain. Salak diambil dari Desa
Simatorkis, Kecamatan Angkola Barat, Kabupaten Tapanuli Selatan Sumatera
Utara.
3.4.2 Identifikasi Buah Salak
Identifikasi tumbuhan dilakukan di Laboratorium Taksonomi
Tumbuhan, Departemen Biologi-FMIPA Universitas Sumatera Utara.
3.4.3 Pembuatan Simplisia
Buah salak dikumpulkan, dibersihkan dari kotoran yang melekat dan
dicuci dengan air hingga bersih, lalu ditiriskan, salak dikupas kulitnya,
dipisahkan bagian bijinya dan ditimbang sebagai berat basah (5000 g) dipotong
menjadi beberapa bagian kecil dengan ukuran panjang 2,0 – 2,5 cm.
sampai kering (sudah bisa dipatahkan), kemudian ditimbang sebagai berat
kering diperoleh 1050 g. Simplisia yang telah kering diblender menjadi serbuk
lalu disimpan dalam wadah plastik untuk mencegah pengaruh lembab dan
pengotoran lain. Bagan kerja penelitian dapat dilihat pada Lampiran 4, halaman
50.
3.5 Pembuatan Pereaksi
3.5.1 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.5.2 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60
ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan
dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.5.3 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml
asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida,
dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan
didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan
diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM,
3.5.4 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.5.5 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.5.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling
sampai 100 ml (Ditjen POM, 1995).
3.5.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8,8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 ml (Ditjen POM, 1995).
3.5.8 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan
dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.5.9 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam
air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.5.10 Pereaksi kloralhidrat
Sebanyak 8 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 10
ml air suling (Ditjen POM, 1995).
3.5.11 Pereaksi Liebermann-Bouchardat
Sebanyak 20 bagian asam asetat anhidrida dicampur dengan 1 bagian
3.5.12 Larutan DPPH 0,5 mM
Sebanyak 19,7 mg DPPH ditimbang kemudian dilarutkan dalam
metanol hingga diperoleh volume larutan 100 ml (Ditjen POM, 1995).
3.6 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan
penetapan kadar abu tidak larut asam (Ditjen POM, 1995; WHO, 1992).
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan pada buah salak segar dan
simplisia yang meliputi pemeriksaan warna, bau, rasa, dan bentuk daging buah
salak.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia daging buah salak
dilakukan dengan cara meneteskan kloralhidrat di atas kaca objek, kemudian di
atasnya ditaburkan serbuk simplisia, lalu ditutup dengan kaca penutup dan
dilihat di bawah mikroskop.
3.6.3 Penetapan Kadar Air Simplisia
Penetapan kadar air dilakukan dengan metode Azeotropi. Alat terdiri
dari labu alas bulat 500 ml, alat penampung dan pendingin, tabung
a. Penjenuhan toluena
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama,
dimasukkan ke dalam labu yang berisi toluen jenuh tersebut, lalu dipanaskan
hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2
tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian
kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air
terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin
pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca
dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (v/b) (WHO, 1992).
3.6.4 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air kloroform (2,5 ml kloroform dalam air suling 1000 ml) dalam labu
bersumbat sambil sesekali dikocok selama 6 jam pertama, dibiarkan selama 18
jam, kemudian disaring. Diuapkan 20 ml filtrat sampai kering dalam cawan
sampai bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen
terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.6.5 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dengan 100 ml
etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam
pertama, dibiarkan selama 18 jam, kemudian disaring. Diuapkan 20 ml filtrat
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari
yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah
dikeringkan (Depkes RI, 1995).
3.6.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia ditimbang seksama dimasukkan dalam
krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar
perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600°C
selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot
tetap. Kadar abu dihitung (Depkes RI, 1995).
3.6.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan
dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut
dalam asam dikumpulkan, disaring dengan kertas saring, cuci dengan air panas,
dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar
3.7 Skrining Fitokimia
Skrining fitokimia meliputi pemeriksaan senyawa golongan alkaloida,
saponin, tanin, steroida/terpenoida, glikosida dan glikosida antrakinon.
3.7.1 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan lalu disaring.
Filtrat dipakai untuk percobaan berikut:
a. tetes larutan filtrat ditambahkan 2 tetes larutan pereksi Mayer akan
terbentuk endapan berwarna putih atau kuning.
b. 3 tetes larutan filtrat ditambahkan 2 tetes larutan pereksi Bouchardat akan
terbentuk endapan berwarna coklat-hitam.
c. 3 tetes larutan filtrat ditambahkan 2 tetes larutan pereksi Dragendorff
akan terbentuk endapan berwarna merah atau jingga.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua
atau tiga dari percobaan di atas (Depkes RI, 1995).
3.7.2 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi
dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok
kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit
setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak
3.7.3 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, disaring
lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Larutan
diambil sebanyak 2 ml lalu ditambahkan 1-2 tetes pereaksi besi (III) klorida.
Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Farnsworth, 1966).
3.7.4 Pemeriksaan Steroida/Triterpenoida
Sebanyak 1 g serbuk simplisia ditimbang, dimaserasi dengan 20 ml n -heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap.
Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat
pekat (pereaksi Lieberman-Burchard), timbulnya warna biru atau biru hijau
menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu
menunjukkan adanya triterpenoid (Harborne, 1984).
3.7.5 Pemeriksaan Flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas,
dididhkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2
ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika
terjadi warna merah, kuning atau jingga pada lapisan amil alkohol (Farnsworth,
1966).
3.7.6 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml
campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks
ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit
lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform
(2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan
pada temperatur tidak lebih dari 50°C. Sisanya dilarutkan dalam 2 ml metanol.
Larutan metanol digunakan untuk percobaan berikut: 0,1 ml larutan percobaan
dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa
ditambahkan 2 ml air dan 5 tetes pereaksi Molish, kemudian secara
perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung,
terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan
ikatan gula (Depkes RI, 1995).
3.7.7 Pemeriksaan Glikosida Antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, dicampur dengan 5 ml
asam sulfat 2 N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml
benzen, dikocok dan didiamkan. Lapisan benzen dipisahkan dan disaring,
kemudian kocok dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna
merah dan lapisan benzene tidak berwarna menunjukkan adanya antrakinon
(Depkes RI, 1995).
3.8 Pembuatan Ekstrak Etanol dan Jus Daging Buah Salak
3.8.1 Pembuatan Ekstrak Etanol Daging Buah Salak
Pembuatan ekstrak etanol daging buah salak dilakukan dengan metode
maserasi menggunakan pelarut etanol 96%. Caranya 200 g serbuk simplisia
dimasukkan ke dalam sebuah bejana, dituangi dengan 1500 ml etanol 96%
Setelah 5 hari campuran tersebut diserkai. Ampas dicuci dengan etanol 96%
secukupnya hingga diperoleh 2000 ml. Pindahkan ke dalam bejana tertutup,
dibiarkan di tempat sejuk, terlindung dari cahaya, selama 2 hari. Kemudian di
enaptuangkan. Pemekatan ekstrak dilakukan dengan alat rotary evaporator, kemudian ekstrak dikeringkan dengan teknik freeze dryer hingga diperoleh ekstrak kental 40 g (Ditjen POM, 1979; Depkes RI, 1995). Bagan ekstraksi
dapat dilihat pada Lampiran 6, halaman 56.
3.8.2 Pembuatan Jus Daging Buah Salak
Pembuatan jus daging buah salak dilakukan dengan memisahkan daging
buah salak dari biji buah salak. Hasil potongan daging buah salak dimasukkan
ke dalam juicer, ditampung dan disaring akan diperoleh jus daging buah salak
murni. Salak ditimbang 23,9832 g diperoleh 20 ml jus daging buah salak.
3.9 Pengujian aktivitas Antioksidan dengan Spektrofotometer UV-visibel
3.9.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas
DPPH dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari
ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang meredam
radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan
3.9.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml,
kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan
metanol sampai garis tanda (konsentrasi 40 ppm).
3.9.3 Pembuatan larutan induk
3.9.3.1 Pembuatan larutan induk ekstrak etanol daging buah salak
Sebanyak 25 mg sampel uji (ekstrak kental) ditimbang, dimasukkan ke
dalam labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya
dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 ppm).
3.9.3.2 Pembuatan larutan induk jus daging buah salak
Sebanyak 25 mg sampel uji (jus) ditimbang, dimasukkan ke dalam labu
tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 1000 ppm).
3.9.3.3 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam
labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan
dengan metanol sampai garis tanda (konsentrasi 1000 ppm).
3.9.4 Pembuatan larutan uji
3.9.4.1 Larutan uji ekstrak etanol daging buah salak
Larutan induk dipipet sebanyak 2,5 ml; 5 ml; 7,5 ml; 10 ml ke dalam
labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 100 ppm, 200ppm,
3.9.4.2 Larutan uji jus daging buah salak
Larutan induk dipipet sebanyak 2,5 ml; 5 ml; 7,5 ml; 10 ml ke dalam
labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 100 ppm, 200 ppm,
300 ppm dan 400 ppm.
3.9.4.3 Larutan uji vitamin C
Larutan induk dipipet sebanyak 0,05 ml; 0,1 ml; 0,15 ml; 0,2 ml ke
dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 ppm, 4
ppm, 6 ppm dan 8 ppm.
3.9.5. Prosedur Uji Aktivitas Antioksidan
3.9.5.1 Prosedur Uji Aktivitas Antioksidan Ekstrak Etanol Daging Buah Salak
Larutan uji ekstrak etanol daging buah salak (100 ppm, 200 ppm, 300
ppm, 400 ppm) dalam labu ukur 25 ml masing-masing ditambahkan 5 ml
larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volumenya dicukupkan
dengan metanol sampai garis tanda. Diamkan selama 60 menit, lalu diukur
serapannya menggunakan spektrofotometer UV-visibel, panjang gelombang
516 nm.
3.9.5.2 Prosedur Uji Aktivitas Antioksidan Jus Daging Buah Salak
Larutan uji jus daging buah salak (100 ppm, 200 ppm, 300 ppm, 400
ppm) dalam labu ukur 25 ml masing-masing ditambahkan 5 ml larutan DPPH
0,5 mM (konsentrasi 40 ppm) lalu volumenya dicukupkan dengan metanol
sampai garis tanda. Diamkan selama 60 menit, lalu diukur serapannya
3.9.5.3 Prosedur Uji Aktivitas Antioksidan Vitamin C
Larutan uji vitamin C (2 ppm, 4 ppm, 6 ppm, 8 ppm) dalam labu 25 ml
masing-masing ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 40 ppm)
lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan
selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer
UV-visibel, panjang gelombang 516 nm.
3.9.6 Analisis persen pemerangkapan radikal bebas DPPH
Penentuan persen pemerangkapan radikal bebas oleh sampel uji,
ekstrak etanol dan juice daging buah salak dengan vitamin C sebagai kontrol
positif, menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl -2-picrylhydrazil (DPPH), yaitu dihitung dengan rumus:
% inhibisi = x 100%
kontrol A
sampel A -kontrol A
Keterangan: Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
3.9.7 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan
radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap
radikal bebas sebesar 50%. Hasil perhitungan dimasukkan ke dalam persamaan
regresi dengan konsentrasi (ppm) ekstrak sebagai absis (sumbu x) dan nilai %
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi yang dilakukan di Herbarium Medanense (MEDA), Laboratorium Taksonomi Tumbuhan, Departemen Biologi-FMIPA-USU
terhadap tumbuhan Buah Salak dari suku Arecaceae. Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 44.
4.2 Hasil Pemeriksaan Makroskopik dan Mikroskopik Daging Buah Salak
4.2.1 Hasil Pemeriksaan Makroskopik
Hasil pemeriksaan makroskopik daging buah salak segar dicirikan
dengan daging buah berwarna merah dan sedikit warna putih, berupa
potongan-potongan kecil daging buah; panjang kira-kira 2-2,5 cm, lebar 1-1,5
cm dan berbau khas. Gambar daging buah salak segar dapat dilihat pada
Lampiran 2, halaman 45, 46, 47.
4.2.2 Hasil Pemeriksaan Mikroskopik
Hasil pemeriksaan mikroskopik daging buah salak Padangsidimpuan.
Pada serbuk simplisia daging buah salak tampak sel parenkim, serabut, kristal
kalsium oksalat bentuk prisma dan kristal kalsium oksalat bentuk jarum.
Gambar mikroskopik serbuk simplisia daging buah salak dapat dilihat pada
4.3 Hasil Pemeriksaan Karakterisasi Simplisia
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol,
kadar abu total dan kadar abu yang tidak larut asam dapat dilihat pada Tabel
4.1 berikut.
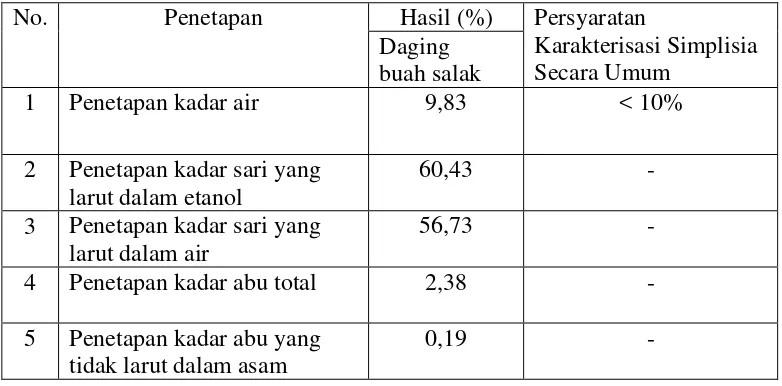
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia daging buah salak
No. Penetapan Hasil (%) Persyaratan
Karakterisasi Simplisia Secara Umum
Daging buah salak
1 Penetapan kadar air 9,83 < 10%
2 Penetapan kadar sari yang larut dalam etanol
60,43 -
3 Penetapan kadar sari yang larut dalam air
56,73 -
4 Penetapan kadar abu total 2,38 -
5 Penetapan kadar abu yang tidak larut dalam asam
0,19 -
Berdasarkan tabel di atas dapat dilihat bahwa karakterisasi simplisia
daging buah salak tidak tertera pada Materia Medika Indonesia namun secara
umum sebagian besar hasil yang diperoleh memenuhi persyaratan karakterisasi
simplisia buah yang tertera pada Materia Medika Indonesia Jilid VI.
Penetapan kadar air dilakukan berhubungan dengan mutu simplisia agar
tidak mudah ditumbuhi mikroorganisme. Kadar air simplisia daging buah salak
yaitu 9,83% memenuhi persyaratan karakterisasi simplisia secara umum di
Materia Medika Indonesia yaitu tidak lebih dari 10% (Depkes RI,1995).
Penetapan kadar sari larut dalam air dilakukan untuk mengetahui
kandungan senyawa metabolit primer misalnya glikosida, karbohidrat, protein,
kandungan senyawa metabolit sekunder seperti flavonoid, steroid, terpenoid.
Penetapan kadar sari ini menyatakan jumlah zat yang tersari dalam air atau
etanol (Depkes RI,1995).
Penetapan kadar abu dilakukan untuk mengetahui kandungan senyawa
anorganik dalam simplisia misalnya Mg, Ca, Na dan K. Kadar abu tidak larut
asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam
misalnya silika (WHO, 1992).
4.4 Hasil Skrining Fitokimia
Hasil skrining fitokimia dari simplisia menunjukkan adanya golongan
senyawa-senyawa kimia dapat dilihat pada Tabel 4.2 berikut ini:
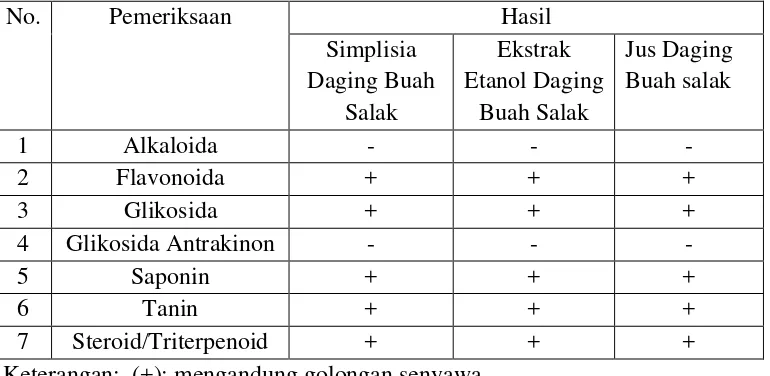
Tabel 4.2 Hasil skrining fitokimia
No. Pemeriksaan Hasil
Simplisia Daging Buah
Salak
Ekstrak Etanol Daging
Buah Salak
Jus Daging Buah salak
1 Alkaloida - - -
2 Flavonoida + + +
3 Glikosida + + +
4 Glikosida Antrakinon - - -
5 Saponin + + +
6 Tanin + + +
7 Steroid/Triterpenoid + + +
Keterangan: (+): mengandung golongan senyawa (-) : tidak mengandung golongan senyawa
Dari Tabel di atas menunjukkan bahwa simplisia, ekstrak etanol, dan
jus daging buah salak memiliki potensi sebagai antioksidan. Senyawa
antioksidan tumbuhan,tersebut adalah flavonoid dan tanin yang merupakan
bertindak sebagai peredam radikal bebas karena adanya gugus fenol yang
dikandungnya dalam hal ini disebut reduktor sehingga dapat mendonorkan
hidrogen kepada radikal bebas (Silalahi, 2006).
4.5 Hasil Analisis Aktivitas Antioksidan Sampel Uji
Pengukuran aktivitas antioksidan terhadap sampel uji dilakukan secara
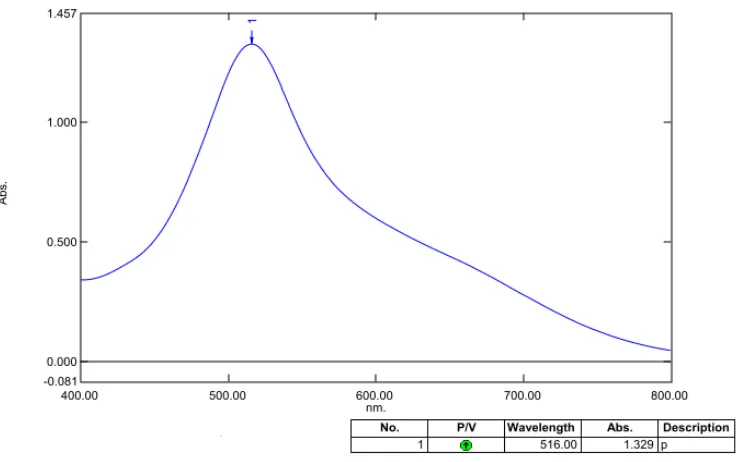
spektrofotometri uv- visibel pada panjang gelombang 516 nm. Larutan DPPH
dalam metanol menghasilkan serapan maksimum pada panjang gelombang 516
nm, termasuk dalam kisaran panjang gelombang sinar tampak (400-750 nm)
(Rohman, 2007).
Data hasil pengukuran panjang gelombang maksimum dapat dilihat
pada gambar berikut ini: (Gambar 4.1).
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visible.
Hasil uji aktivitas antioksidan diperoleh dari hasil pengukuran
200 ppm, 300 ppm, dan 400 ppm yang dibandingkan dengan larutan kontrol
DPPH (tanpa penambahan larutan uji). Pada hasil analisis aktivitas antioksidan
ekstrak etanol dan jus daging buah salak dapat dilihat adanya penurunan nilai
absorbansi DPPH yang diberi larutan uji terhadap kontrol pada setiap kenaikan
konsentrasi. Untuk melihat penurunan absorbansi DPPH dengan penambahan
ekstrak etanol dan jus daging buah salak dapat dilihat pada Gambar 4.3 dan
penurunan absorbansi DPPH dengan penambahan vitamin C dapat dilihat pada
Tabel 4.4 berikut.
Tabel 4.3 Penurunan absorbansi DPPH dengan penambahan ekstrak etanol dan jus daging buah salak
N
Absorbansi % Peredaman
I II III I II III Rata
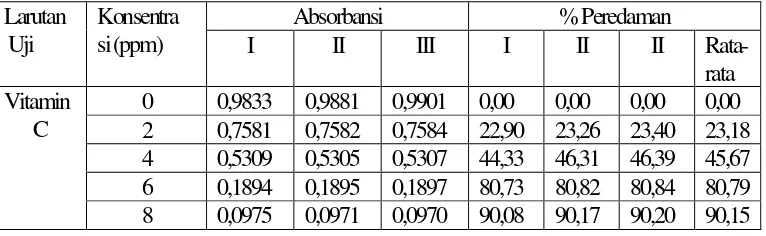
Tabel 4.4 Penurunan absorbansi DPPH dengan penambahan vitamin C
Larutan Uji
Konsentra si (ppm)
Absorbansi % Peredaman
Rata-Berdasarkan data di atas menunjukkan bahwa adanya penurunan
absorbansi DPPH dengan penambahan ekstrak etanol daging buah salak, jus
daging buah salak dan vitamin C dalam metanol sebagai larutan uji pada
beberapa konsentrasi. Penurunan absorbansi yang semakin besar menunjukkan
aktivitas antioksidan yang semakin besar pula. Vitamin C memiliki penurunan
yang paling besar, kemudian jus daging buah salak dan yang paling kecil
adalah ekstrak etanol daging buah salak.
Hal ini menunjukkan adanya aktivitas antioksidan dalam meredam
radikal bebas DPPH. Jika semua elektron pada DPPH menjadi berpasangan,
maka warna larutan berubah dari ungu tua menjadi kuning terang dan
absorbansi pada panjang gelombang maksimumnya akan hilang. Penurunan
nilai absorbansi terjadi karena larutan uji meredam DPPH dan peredaman
terjadi karena adanya transfer elektron atom hidrogen antioksidan kepada
DPPH (Molyneux, 2004).
4.6 Hasil Analisis Nilai IC50 (Inhibitory Concentration) Sampel Uji
Nilai IC50 diperoleh berdasarkan persamaan regresi linier yang
didapatkan dengan cara memplot konsentrasi larutan uji dan persen peredaman
DPPH sebagai parameter aktivitas antioksidan, di mana konsentrasi larutan uji
(ppm) sebagai absis (sumbu X) dan nilai persen peredaman sebagai ordinat
(sumbu Y).
Hasil persamaan regresi linier yang diperoleh untuk ekstrak daging
buah salak memiliki persamaan regresi linier Y = 0,1343X + 0,092 hasil
regresi linier Y = 0,2013X + 10,134, hasil analisis IC50 diperoleh 198,04 ppm,
dan vitamin C mempunyai persamaan regresi linier Y = 11,8955X + 0,376
hasil analisis IC50 diperoleh 4,17 ppm.
Dari hasil di atas diketahui bahwa ekstrak etanol dan jus daging buah
salak memiliki aktivitas antioksidan yang sangat lemah dibandingkan dengan
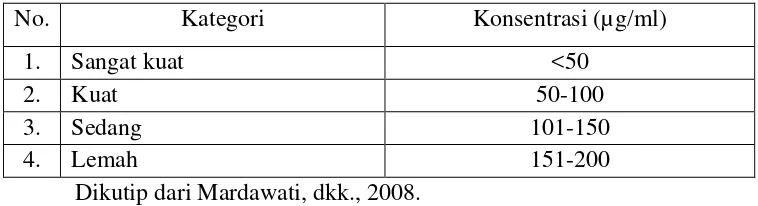
vitamin C sebagai kontrol positif yang termasuk dalam kategori sangat kuat.
Untuk mengetahui kategori kekuatan aktivitas antioksidan dapat dilihat pada
tabel 4.5 berikut.
Tabel 4.5 Kategori kekuatan aktivitas antioksidan
No. Kategori Konsentrasi (µg/ml)
1. Sangat kuat <50
2. Kuat 50-100
3. Sedang 101-150
4. Lemah 151-200
Dikutip dari Mardawati, dkk., 2008.
Kemampuan sampel uji dalam meredam 1,1-diphenyl-2-picrylhidrazyl (DPPH) sebagai radikal bebas dalam larutan metanol dengan nilai IC50
(konsentrasi sampel uji yang mampu meredam radikal bebas sebesar 50%)
digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel
uji tersebut (Prakash, 2001).
Hasil nilai IC50 ekstrak etanol, jus daging buah salak dan vitamin C
dapatdilihat pada Tabel 4.6 berikut.
Tabel 4.6 Nilai IC50 ekstrak etanol sampel uji dan vitamin C
No. Sampel IC50 (ppm)
1 Ekstrak etanol daging buah salak 371,61
2 Juice daging buah salak 198,04
Dari Tabel 4.5 dan Tabel 4.6 menunjukkan bahwa ada perbedaan
aktivitas antioksidan dari ekstrak etanol, jus daging buah salak dan vitamin C.
Dimana jus daging buah salak memiliki aktivitas antioksidan lebih kuat
dibanding ekstrak etanol daging buah salak. Hal ini disebabkan karena semua
zat yang berfungsi sebagai antioksidan seperti flavonoid, vitamin C, glikosida,
saponin, dan tanin lebih banyak terdapat dalam jus daging buah salak.
Sedangkan ekstrak etanol daging buah salak, zat yang berfungsi sebagai
antioksidan pada buah salak kemungkinan tidak semua terdapat di ekstrak
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil pemeriksaan karakterisasi simplisia daging buah salak memenuhi
persyaratan karakterisasi simplisia secara umum. Hasil yang diperoleh
yaitu kadar air 9,83%, kadar sari yang larut dalam air 56,73%, kadar
sari yang larut dalam etanol 60,43%, kadar abu total 2,38%, dan kadar
abu yang tidak larut dalam asam 0,19%.
2. Hasil skrining fitokimia dari simplisia, ekstrak etanol dan juice daging
buah salak adalah flavonoid, glikosida, tanin, saponin dan steroid.
3. Hasil uji aktivitas antioksidan dari ekstrak etanol dan jus daging buah
salak mempunyai aktivitas antioksidan dengan nilai IC50 berturut-turut
371,61 ppm dan 198,04 ppm.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan pengujian
aktivitas antioksidan dari daging buah salak dengan metode selain metode