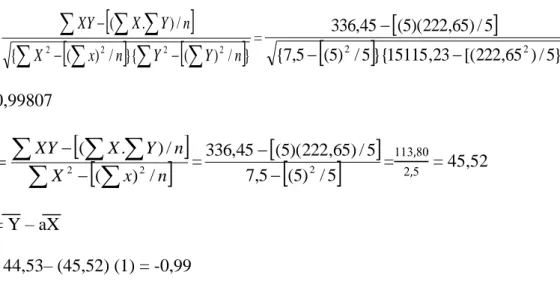UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH KEMLOKO (Phyllanthus emblica
L.) DENGAN METODE DPPH
(1,1-difenil-2-pikrilhidrazil)
SKRIPSI
OLEH:
SAHRIL SIREGAR NIM 151501211
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2019
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH KEMLOKO (Phyllanthus emblica
L.) DENGAN METODE DPPH
(1,1-difenil-2-pikrilhidrazil)
SKRIPSI
OLEH:
SAHRIL SIREGAR NIM 151501211
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahankan rahmat dan karunia-Nya sehingga penulis dapat menjalani masa perkuliahan dan penelitian hingga akhirnya menyelesaikan penyusunan skripsi dengan judul “Uji Aktivitas Antioksidan Ekstrak Etanol Buah Kemloko (Phyllanthus emblica L.) dengan Metode DPPH (1,1-Difenil-2-Pikrilhidrazil)”.
Skripsi ini diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Masfria, M.S., Apt. dan Wakil Dekan I, Dr.
Poppy Anjelisa Zaitun Hasibuan, M.Si., Apt., yang telah memberikan fasilitas selama masa pendidikan dan penelitian.
Rasa hormat dan terimakasih yang sebesar-besarnya saya sampaikan kepada Prof. Dr. Masfria, M.S., Apt., selaku dosen pembimbing yang membimbing penulis dengan motivasi yang luar biasa selama masa penelitian, juga kepada bapak Prof. Dr. Ginda Haro, M.Sc., Apt., dan bapak Drs. Fathur Rahman H., M.Si., Apt., selaku penguji yang telah memberikan kritik, saran, dan nasihat yang membangun demi kesempurnaan skripsi ini, dan penulis juga ingin menyampaikan rasa terima kasih kepada Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., selaku penasihat akademik yang telah membimbing saya selama masa perkuliahan.
Penulis menyampaikan rasa terima kasih serta penghargaan sebesar- besarnya khususnya kepada kedua orang tua Bapak Dahlan Siregar dan Ibu Homsia Sipahutar, dan saudara Ikhsan Siregar, Ira Ariani Siregar dan Riska Elida
Siregar yang senantiasa memberi semangat dan memberikan dukungan penuh, doa, serta materil selama perkuliahan hingga penyelesaian skripsi ini.
Pada kesempatan kali ini penulis juga mengucapkan terimakasih kepada teman-teman terdekat yaitu Franky, Lea Amanda, grup Kedep, Road to 4, ASBO Mantul, Mak Bebek, Penggeser Dispenser Botani, Siti Khalisyah, Bimbingan Venyta, Netizen Alamiah, Pengabdi Spektro, Felix, Wanted, STF 15 yang telah memberikan dukungan selama penelitian dan penyusunan skripsi ini berlangsung.
Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan.
Oleh sebab itu penulis bersedia menerima kritik dan saran yang membangun untuk kesempurnaan skripsi ini pada waktu mendatang. Semoga skripsi ini dapat bermanfaat dan menjadi sumber informasi tambahan bagi kita semua.
Medan, 29 Maret 2019 Penulis,
Sahril Siregar NIM 151501211
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH KEMLOKO (Phyllanthus emblica L.) DENGAN METODE DPPH (1,1-
difenil-2-pikrilhidrazil) ABSTRAK
Latarbelakang:buah kemloko (Phyllanthus emblica L.) secara tradisional digunakan sebagai obat diare dan telah diteliti bahwa buah ini mengandung alkaloid, saponin, flavonoid, yang merupakan metabolit sekunder bersifat antioksidan yang dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif.
Tujuan: untuk menguji aktivitas antioksidan dari ekstrak etanol buah kemloko.
Metode: serbuk simplisia buah kemloko dilakukan pemeriksaan karakteristik dan skrining fitokimia terhadap serbuk simplisia dan ekstrak meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Ekstrak diperoleh secara perkolasi dengan pelarut etanol 96%. Ekstrak etanol buah kemloko dan vitamin C sebagai pembanding diuji aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH (1,1- Diphenyl-2-Picrylhydrazyl) dengan mengukur absorbansi DPPH menggunakan spekrofotometer uv-visibel pada panjang gelombang 515,5 nm.
Hasil: pemeriksaan karakteristik serbuk simplisia buah kemloko diperoleh kadar air 8,0%, kadar sari yang larut air 23,33%, kadar sari yang larut dalam etanol 30%, kadar abu total 6,66%, kadar abu yang tidak larut dalam asam 3,33%. Hasil skrining fitokimia, serbuk simplisia dan ekstrak mengandung senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Hasil pengukuran aktivitas antioksidan yang diperoleh adalah aktivitas antioksidan yang sangat kuat dari vitamin C dengan nilai IC50 sebesar 4,44 µg/ml dan juga aktivitas antioksidan yang sangat kuat dari ekstrak etanol buah kemloko dengan nilai IC50 sebesar 1,12 µg/ml.
Kesimpulan:dari hasil pengujian yang dilakukan dapat disimpulkan bahwa aktivitas antioksidan ekstrak etanol buah kemloko lebih kuat dibandingkan vitamin C yang telah disesuaikan dengan parameter kekuatan antioksidan.
Kata kunci: Antioksidan, ekstrak etanol, Phyllanthus emblica L., DPPH
ANTIOXIDANT ACTIVITY TEST OF ETHANOL EXTRACT OF KEMLOKO FRUIT (Phyllanthus emblica L.) WITH DPPH (1.1-diphenyl-2-
pikrylhydrazyl) METHOD ABSTRACT
Background:kemloko fruit (Phyllanthus emblica L.) traditionally isused as medicine for diarrhea and it has been studied to contain a chemical compound consisting of alkaloids, saponins, flavonoids, which are secondary metabolites that are antioxidants that can inhibit the oxidation reaction, to scavenge free radicals and highly reactive molecules.
Objective: to test the antioxidant activity of ethanol extract of kemloko fruit.
Method: the simplicia powder of kemloko fruit continued for characteristics and phytochemical screening of simplicia powder and extract. The extract obtained by percolation with 96% ethanol. Ethanol extract of the kemloko fruit and vitamin C as a comparison were tested for antioxidant activity by the method of trapping free radicals DPPH (1.1-Diphenyl-2-Picrylhydrazyl) by measuring the absorbance of DPPH using UV-visible spectrophotometer at a wavelength of 515.5 nm.
Results: the result of the simplicia characterization obtained level of water content 8.0%, level of water-soluble extract 23.33%, level of ethanol-soluble extract 30%, level of total ash 6.66%, and level of ash not soluble in acid 3.33%.
Phytochemical screening results, simplicia powder and extract containing compounds alkaloids, flavonoids, saponins, tannins, glycosides, and steroid/triterpenoid. Results of measuring the antioxidant activity is very strong antioxidant activity vitamin C with IC50 values 4.44 µg/ml and also very strong antioxidant activity from the ethanol extract of the kemloko fruit with IC50 values 1.12 µg/ml.
Conclusion:from the results of the tests carried out it can be concluded that the antioxidant activity of ethanol extract of kemloko fruitis stronger than vitamin C which has been adjusted according to the parameters of antioxidant strength.
Keywords: Antioxidants, extracts of ethanol, Phyllanthus emblica L., DPPH
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR GAMBAR DALAM LAMPIRAN ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian. ... 4
1.6Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan... 6
2.1.1 Sistematika tumbuhan ... 6
2.1.2 Nama daerah... 7
2.1.3 Nama asing ... 7
2.1.4 Habitat ... 7
2.1.5 Sinonim ... 8
2.1.6 Morfologi tumbuhan ... 8
2.1.7 Kandungan kimia ... 8
2.1.8 Manfaat ... 8
2.2 Ekstraksi ... 9
2.2.1 Metode ekstraksi ... 10
2.3 Radikal Bebas... 13
2.4 Antioksidan ... 14
2.5 Metode Pengukuran Antioksidan ... 16
2.5.1 Pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picryilhydrazil).... 16
2.5.1.1 Pengukuran absorbansi panjang gelombang ... 18
2.5.1.2 Waktu pengukuran ... 18
2.6 Spektrofotometri UV-Visibel ... 18
BAB III METODOLOGI PENELITIAN... 23
3.1 Alat-alat ... 23
3.2 Bahan-bahan ... 23
3.3 Pembuatan Larutan Pereaksi ... 24
3.3.1 Pereaksi natrium hidroksida 2N ... 24
3.3.2 Pereaksi besi (III) klorida 1% ... 24
3.3.3 Pereaksi asam klorida 2N ... 24
3.3.4 Pereaksi Dragendorff ... 24
3.3.5 Pereaksi Bouchardat ... 24
3.3.6 Pereaksi timbal (II) asetat 0,4 M ... 24
3.3.7 Pereaksi Liebermann-Burchard ... 25
3.3.8 Pereaksi Meyer ... 25
3.3.9 Pereaksi Molisch ... 25
3.3.10 Pereaksi kloralhidrat... 25
3.3.11 Pembuatan pereaksi DPPH ... 25
3.4 Pengumpulan dan Pengolahan Bahan Tanaman ... 25
3.4.1 Pengumpulan bahan tanaman ... 25
3.4.1 Identifikasi tanaman ... 26
3.4.1 Pembuatan simplisia... 26
3.5 Karakterisasi Simplisia... 26
3.5.1 Pemeriksaan makroskopik ... 26
3.5.2 Pemeriksaan mikroskopik ... 26
3.5.3 Penetapan kadar air ... 26
3.5.4 Penetapan kadar sari larut dalam air ... 27
3.5.5 Penetapan kadar sari larut dalam etanol ... 27
3.5.6 Penetapan kadar abu total... 28
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 28
3.6 Skrining Fitokimia ... 28
3.6.1 Pemeriksaan flavonoida ... 28
3.6.2 Pemeriksaan alkaloida ... 29
3.6.3 Pemeriksaan saponin ... 29
3.6.4 Pemeriksaan tanin ... 29
3.6.5 Pemeriksaan glikosida ... 30
3.6.6 Pemeriksaan steroida/triterpenoida ... 30
3.7 Pembuatan Ekstrak ... 31
3.8 Pengujian Aktivitas Antioksidan dengan Spektrofotometer UV-Visibel ... 32
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH ... 32
3.8.2 Pembuatan larutan blanko ... 32
3.8.3 Penentuan panjang gelombang serapan maksimum ... 32
3.8.4 Pembuatan larutan induk ... 32
3.8.4 Pembuatan larutan induk ekstrak etanol buah kemloko (EEBK)... 32
3.8.4 Pembuatan larutan induk vitamin c ... 32
3.8.5 Pembuatan larutan uji ... 33
3.8.5.1 Pembuatan larutan uji ekstrak etanol buah kemloko (EEBK) ... 33
3.8.5.2 Pembuatan larutan uji vitamin c ... 33
3.8.5.3 Analisis persen pemerangkapan radikal bebas DPPH ... 34
3.8.5.4 Analisis nilai IC50 ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Karakterisasi Simplisia ... 35
4.1.1.Hasil pemeriksaan makroskopik ... 35
4.1.2 Hasil pemeriksaan mikroskopik ... 35
4.1.3 Hasil karakterisasi simplisia buah kemloko ... 35
4.1.4 Hasil skrining fitokimia ... 36
4.2 Hasil Identifikasi Tumbuhan ... 38
4.3 Hasil Ekstraksi Buah Kemloko ... 38
4.4 Hasil Analisis Antioksidan ... 38
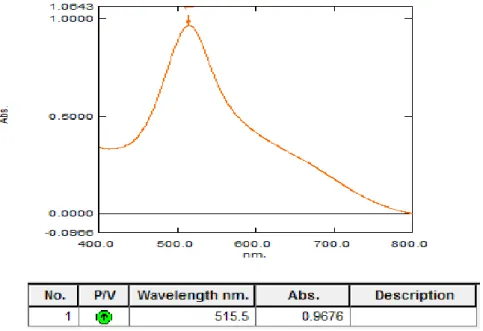
4.4.1.Hasil penentuan panjang gelombang serapan maksimum ... 38
4.4.2 Hasil penentuan operating time ... 39
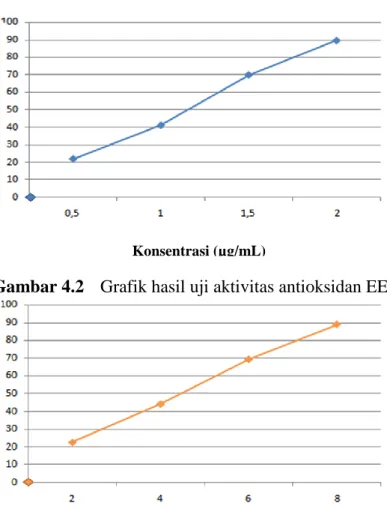
4.4.3 Hasil analisis aktivitas antioksidan sampel uji ... 39
4.4.4 Hasil analisis nilai IC50 (inhibitory concentration)... 41
BAB V KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
LAMPIRAN ... 46
DAFTAR TABEL
4.1 Hasil karakterisasi simplisia buah kemloko
(Phylanthus emblicaL.) ... 35 4.2 Hasil skrining fitokimia simplisia dan ekstrak buah kemloko
(Phylanthus emblicaL.) ... 37 4.3Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh
dari ekstrak etanol buah kemloko (EEBK) dan vitamin c ... 41 4.4 Kategori nilai IC50 sebagai antioksidan ... 41
DAFTAR GAMBAR
1.1 Kerangka Pikir Penelitian ... 5 2.1 Buah Kemloko (Phyllanthus emblica L.) ... 6 2.2 Reaksi DPPH dengan Antioksidan... 17 4.1 Kurva Serapan Maksimum Larutan DPPH 40 µg/ml dalam Metanol
Menggunakan Spektrofotometer UV-Visibel ... 38 4.2 Grafik Hasil Uji Aktivitas Antioksidan EEBK ... 40 4.3 Grafik Hasil Uji Aktivitas Antioksidan Vitamin C ... 41
DAFTAR GAMBAR DALAM LAMPIRAN
1. Buah kemloko ... 48
2. Simplisia buah kemloko ... 48
3. Ekstrak etanol buah kemloko ... 48
4. Spektrofotometer UV-Visibel ... 49
5. Mikroskopik simplisia buah kemloko ... 50
DAFTAR LAMPIRAN
1. Hasil identifikasi tumbuhan ... 46
2. Bagan kerja penelitian ... 47
3. Buah kemloko, simplisia buah kemloko, ekstrak etanol buah kemloko ... 48
4. Alat-alat penelitian ... 49
5. Hasil uji mikroskopik simplisia buah kemloko ... 50
6. Hasil perhitungan karakterisasi simplisia buah kemloko ... 51
7. Hasil operating time ... 54
8. Hasil uji aktivitas antioksidan ... 55
9. Perhitungan persen peredaman dan nilai IC50 EEBK ... 56
10. Perhitungan persen peredaman dan nilai IC50 vitamin c... 61
BAB I PENDAHULUAN
1.1 Latar Belakang
Antioksidan merupakan senyawa yang dapat menetralkan radikal bebas di dalam tubuh manusia. Enzim-enzim seperti superoksida dismutase (SOD), gluthatione dan katalase merupakan antioksidan alami yang terdapat pada tubuh manusia. Pertumbuhan radikal bebas yang melebihi kapasitas antioksidan di dalam tubuh akan meningkatkan resiko timbulnya berbagai penyakit regeneratif seperti kanker, jantung, katarak, penuaan dini dan lain-lain. Oleh karena itu, selain mengandalkan antioksidan dari dalam tubuh, manusia juga membutuhkan antioksidan dari luar tubuh untuk mencapai keseimbangan (Suzery dkk., 2017).
Sistem tubuh manusia setiap saat terpapar radikal bebas baik yang dihasilkandari proses metabolisme normal maupun dari lingkungan, seperti asap rokok dan polusi. Paparan radikal bebas yang berlebih terhadap tubuh dapat berakibat terhadap kerusakan sel dan memicu patogenesis berbagai penyakit seperti penyakit kardiovaskular, hipertensi, hiperlipidemia, diabetes, alzheimer, dan Parkinson. Dalam hal ini antioksidan berperan mencegah terjadinya kerusakan jaringan yang disebabkan radikal bebas dengan cara mengeliminir terbentuknya radikal, meredam, atau meningkatkan penguraiannya (Saefudin dkk., 2013).
Salah satu tanaman yang memiliki aktivitas antioksidan cukup tinggi adalah buah kemloko (Phyllanthus emblica L.). Tanaman ini di India telah digunakan untuk mengobati penyakit kanker, diabetes, hati (liver), gangguan
senyawa-senyawa bioaktif dari metabolit sekunder yang terkandung didalamnya, khususnya senyawa dari golongan fenolat dan flavonoid (Suzery dkk., 2017).
Ada sejumlah besar metode untuk menentukan kapasitas antioksidan berdasarkan prinsip yang berbeda: pengumpulan radikal peroksil (Oxygen Radical Absorbance capacity, ORAC); Total Radical-trapping Antioxidant Power (TRAP); daya pereduksi logam (Ferric Reducing Antioksidant Power, FRAP);
Cupric Reducing Antioksidant Power (CUPRAC); pengumpulan radikal hidroksil (uji deoxiribose); pengumpulan radikal organik (2,2-Azino-bis(3-ethylbenz- thiazoline-6-sulfonic acid, ABTS); 1,1-Diphenyl-2-picrylhydrazyl (DPPH);
kuantifikasi produk yang terbentuk selama peroksidasi lipid (Thiobarbituric Acid Reactive Substances, TRAPS); Low-density Lipoproteins (LDL), dan lain-lain (Marinova dan Batchvarov, 2011).
Penentuan aktivitas antioksidan pada penelitian ini menggunakan metode DPPH. Metode uji aktivitas antioksidan dengan DPPH (1,1-difenil-2- pikrilhidrazil) dipilih karena metode ini adalah metode sederhana, mudah, cepat dan peka serta hanya memerlukan sedikit sampel untuk evaluasi aktivitas antioksidan dari senyawa bahan alam sehingga digunakan secara luas untuk menguji kemampuan senyawa yang berperan sebagai pendonor elektron (Al Ridho dkk., 2013).
Prinsip dari metode uji aktivitas antioksidan ini adalah pengukuran aktivitas antioksidan secara kuantitatif yaitu dengan melakukan pengukuran penangkapan radikal DPPH oleh suatu senyawa yang mempunyai aktivitas antioksidan dengan menggunakan spektrofotometri UV-Vis sehingga dengan demikian akan diketahui nilai aktivitas peredaman radikal bebas yang dinyatakan dengan nilai IC (Inhibitory Concentration). Nilai IC didefinisikan sebagai
besarnya konsentrasi senyawa uji yang dapat meredam radikal bebas sebanyak 50%. Semakin kecil nilai IC50 maka aktivitas peredaman radikal bebas semakin tinggi. Prinsip kerja dari pengukuran ini adalah adanya radikal bebas stabil yaitu DPPH yang dicampurkan dengan senyawa antioksidan yang memiliki kemampuan mendonorkan hidrogen, sehingga radikal bebas dapat diredam (Al Ridho dkk., 2013).
Berdasarkan uraian di atas, maka dilakukan penelitian karakteristik simplisa, skrining fitokimia dan uji antioksidan ekstrak etanol buah kemloko dengan metode DPPH (1,1-difenil-2-pikrilhidrazil) mengukur serapannya dengan spektrofotometer sinar tampak.
1.2 Rumusan Masalah
Rumusan masalah pada penelitian ini adalah:
a. Apakah karakteristik simplisia buah kemloko (Phyllanthus emblica L.) memenuhi persyaratan secara umum.
b. Golongan senyawa kimia apa saja yang terkandung di dalam simplisia dan ekstrak buah kemloko (Phyllanthus emblica L.).
c. Apakah ekstrak etanol buah kemloko (Phyllanthus emblica L.) memiliki aktivitas antioksidan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil)?
1.3 Hipotesis
Dari hasil perumusan masalah diatas maka dapat dibuat hipotesis sebagai berikut:
a. Karakteristik simplisia buah kemloko (Phyllanthus emblica L.) memenuhi
b. Serbuk simplisia dan ekstrak buah kemloko (Phyllanthus emblica L.) mengandung golongan senyawa kimia alkaloida, flavonoida, saponin, tanin, glikosida, dan steroid/triterpenoid.
c. Ekstrak etanol buah kemloko (Phyllanthus emblica L.) memiliki aktivitas antioksidan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil).
1.4 Tujuan Penelitian
Tujuan dari penelitian diatas adalah:
a. Untuk mengetahui karateristik serbuk simplisia buah kemloko (Phyllanthus emblica L.).
b. Untuk mengetahui golongan senyawa kimia yang terkandung pada simplisia dan ekstrak etanol buah kemloko (Phyllanthus emblica L.).
c. Untuk mengetahui aktivitas antioksidan ekstrak etanol buah kemloko (Phyllanthus emblica L.) dengan metode DPPH (1,1-difenil-2- pikrilhidrazil).
1.5 Manfaat Penelitian
Manfaat penelitian diatas adalah:
a. Dapat memberikan informasi karakteristik dan golongan senyawa kimia yang terkandung pada buah kemloko (Phyllanthus emblica L.).
b. Dapat memberikan informasi terkait khasiat antioksidan ekstrak etanol buah kemloko (Phyllanthus emblica L.).
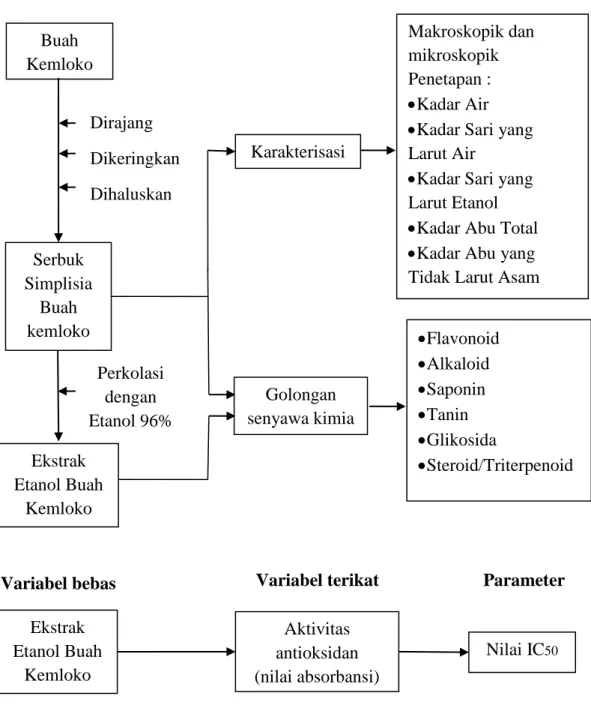
1.6 Kerangka Pikir Penelitian
Penelitian ini melakukan pengujian aktivitas antioksidan ekstrak etanol buah kemloko. Terdapat variabel bebas yaitu ekstrak etanol buah kemloko.
Sementara pada variabel terikat ditentukan aktivitas antioksidan (nilai absorbansi). Kerangka pikir penelitian ini dapat dilihat pada Gambar 1.1.
Gambar 1.1 Kerangka Pikir Penelitian Karakterisasi
Golongan senyawa kimia
•Flavonoid
•Alkaloid
•Saponin
•Tanin
•Glikosida
•Steroid/Triterpenoid Makroskopik dan mikroskopik Penetapan :
•Kadar Air
•Kadar Sari yang Larut Air
•Kadar Sari yang Larut Etanol
•Kadar Abu Total
•Kadar Abu yang Tidak Larut Asam Serbuk
Simplisia Buah kemloko
Aktivitas antioksidan (nilai absorbansi)
Nilai IC50
Ekstrak Etanol Buah
Kemloko
Perkolasi dengan Etanol 96%
Buah Kemloko
Dirajang Dikeringkan Dihaluskan
Ekstrak Etanol Buah
Kemloko
Variabel terikat Parameter Variabel bebas
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian Tumbuhan meliputi sistematika tumbuhan, nama daerah, nama asing, habitat, sinonim, morfologi tumbuhan, kandungan kimia dan manfaat.
2.1.1 Sistematika tumbuhan
Menurut Herbarium Medanesse (MEDA) kemloko memiliki taksonomi sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Malpighiales Famili : Phyllanthaceae Genus : Phyllanthus
Spesies : Phyllanthus emblica L.
Gambar 2.1 Buah Kemloko (Phyllanthus emblica L.)
2.1.2 Nama daerah
Phyllanthus emblica di Indonesia dikenal dengan nama kimalaka.
Masyarakat Sumatera Utara menyebut tumbuhan ini “balakka”, di Ternate dikenal dengan metengo, Sunda (malaka) dan di pulau Jawa dikenal dengan kemloko (Khoiriyah dkk., 2015).
2.1.3 Nama asing
Dalam bahasa Inggris tumbuhan ini disebut sebagai Indian gooseberry, sedangkan di Malaysia disebut dengan popok melaka dan Thailand dikenal dengan ma-kham-pom. Negara India menyebut tumbuhan ini dengan berbagai nama misalnya aonla, nelli, amla, amlika, dhotri, emblica dan usuri (Khoiriyah dkk., 2015).
2.1.4 Habitat
Balakka di Sumatera Utara umumnya dijumpai pada daerah tandus, panas dan gersang, namun belum diketahui secara pasti daerah penyebarannya berdasarkan curah hujan, tutupan lahan, dan jenis tanah di daerah Sumatera bagian Selatan. Balakka (Phylanthus emblica) digolongkan dalam suku Phyllanthaceae yang termasuk salah satu jenis buah-buahan asli Indonesia yang tumbuh liar di kebun dan di hutan. Pohon ini banyak tumbuh di Indonesia yang tersebar di pulau Jawa, Sumatera, Kalimantan, Maluku dan Nusa Tenggara. Phyllanthus emblica umumnya tumbuh di daerah tropis dan subtropis termasuk India, China, Indonesia, Semenanjung Malaysia, Thailand, Pakistan, Uzbekistan, dan Srilanka (Khoiriyah dkk., 2015).
2.1.5 Sinonim
Phyllanthus emblica L. (Khoiriyah dkk., 2015).
2.1.6 Morfologi tumbuhan
Pohon kemloko berukuran kecil hingga sedang. Tingginya sekitar 8-18 m dengan kulit abu-abu tipis, dedaunan kecil, hijau muda, rapat di sepanjang tangkai, terlihat seperti daun menyirip; bunga berwarna kuning kehijauan; buah berbentuk bundar, berdaging, kuning pucat dengan enam alur vertikal yang menunjukkan enam biji (Dasaroju dan Gottumukkala, 2014).
2.1.7 Kandungan kimia
Buah kemloko mengandung senyawa-senyawa fenolat, seperti geraniin, quercetin 3-β-D-glukopiranosida, kaempferol 3-β-D-glukosapiranosida, isokorilagin, quercetin, dan kaempferol. Selain itu, tanaman ini juga mengandung senyawa asam galat, asam ellagat, 1-O-galloyl-beta-D-glukosa, asam-3-etilgalat dan corilagin. Senyawa apeganin dan asam askorbat juga pernah ditemukan dalam tanaman kemloko. Gugus hidroksil yang bersifat asam pada senyawa-senyawa fenolat tersebut diduga sangat berperan dalam reaksi oksidasi-reduksi yang terjadi di dalam tubuh (Suzery dkk., 2017).
2.1.8 Manfaat
Salah satu contoh tanaman yang diduga memiliki aktivitas antioksidan cukup tinggi adalah kemloko (Phyllanthus emblica L.). Tumbuhan ini merupakan bahan yang sering digunakan oleh masyarakat sebagai obat tradisional. Tanaman ini di India telah digunakan untuk mengobati penyakit kanker, diabetes, hati (liver), gangguan jantung dan anemia. Aktivitas biologis tersebut diduga disebabkan oleh adanya senyawa-senyawa bioaktif dari metabolit sekunder yang
terkandung didalamnya, khususnya senyawa dari golongan fenolat dan flavonoid (Suzery dkk., 2017).
2.2 Ekstraksi
Ekstrak adalah suatu produk hasil pengambilan zat aktif melalui proses ekstraksi menggunakan pelarut, dimana pelarut yang digunakan diuapkan kembali sehingga zat aktif ekstrak menjadi pekat. Bentuk dari ekstrak yang dihasilkan dapat berupa ekstrak kental atau ekstrak kering tergantung jumlah pelarut yang diuapkan (Marjoni, 2016).
Menurut Marjoni (2016), pembagian ekstrak :
1) Ekstrak cair adalah ekstrak hasil penyarian bahan alam dan masih mengandung pelarut.
2) Ekstrak kental adalah ekstrak yang telah mengalami proses penguapan dan sudah tidak mengandung cairan pelarut lagi, tetapi konsistensinya tetap cair pada suhu kamar.
3) Ekstrak kering adalah ekstrak yang telah mengalami proses penguapan dan tidak lagi mengandung pelarut dan berbentuk padat (kering).
Proses ekstraksi pada dasarnya adalah proses perpindahan massa dari komponen zat padat yang terdapat pada simplisia ke dalam pelarut organik yang digunakan. Pelarut organik akan menembus dinding sel dan selanjutnya akan masuk ke dalam rongga sel tumbuhan yang mengandung zat aktif. Zat aktif akan terlarut dalam pelarut organik pada bagian luar sel untuk selanjutnya berdifusi masuk ke dalam pelarut. Proses ini terus berulang terus berulang sampai terjadi keseimbangan konsentrasi zat aktif antara di dalam sel dengan konsentrasi zat aktif di luar sel (Marjoni, 2016).
Ekstraksi dapat dilakukan dengan berbagai metode dan cara yang sesuai dengan sifat dan tujuan ekstraksi itu sendiri. Sampel yang akan diekstraksi dapat berbentuk sampel segar ataupun sampel yang telah dikeringkan. Sampel yang umum digunakan adalah sampel segar karena penetrasi pelarut akan berlangsung lebih cepat. Selain itu penggunaan sampel segar dapat mengurangi kemungkinan terbentuknya polimer resin atau artefak lain yang dapat terbentuk selama proses pengeringan. Penggunaan sampel kering juga memiliki kelebihan yaitu dapat mengurangi kadar air yang terdapat di dalam sampel, sehingga dapat mencegah kemungkinan rusaknya senyawa akibat aktivitas anti mikroba (Marjoni, 2016).
2.2.1 Metode ekstraksi
Menurut Marjoni (2016),metode ekstraksi dapat dibagi sebagai berikut : a. Ekstraksi secara dingin
Metode ekstraksi secara dingin bertujuan untuk mengekstrak senyawa- senyawa yang terdapat dalam simplisia yang tidak tahan terhadap panas atau bersifat thermolabil. Ekstraksi secara dingin dapat dilakukan dengan beberapa cara berikut ini :
1) Maserasi
Maserasi adalah proses ekstraksi sederhana yang dilakukan hanya dengan cara merendam simplisia dalam satu atau campuran pelarut selama waktu tertentu pada temperatur kamar dan terlindung dari cahaya.
2) Perkolasi
Perkolasi adalah proses penyarian zat aktif secara dingin dengan cara mengalirkan pelarut secara kontinu pada simplisia selama waktu tertentu.
Prinsip dari perkolasi adalah penyarian zat aktif yang dilakukan dengan cara mengalirkan suatu pelarut melalui serbuk simplisia yang telah terlebih dahulu
dibasahi selama waktu tertentu, kemudian ditempatkan dalam suatu wadah berbentuk silinder yang diberi sekat berpori pada bagian bawahnya. Pelarut dialirkan secara vertikal dari atas ke bawah melalui serbuk simplisia dan pelarut akan melarutkan zat aktif dalam sel-sel simplisia yang dilaluinya sampai mencapai keadaan jenuh.
Gerakan ke bawah disebabkan oleh gaya beratnya sendiri dan berat cairan diatasnya dikurangi gaya kapiler yang cenderung untuk menahan gerakan ke bawah. Faktor-faktor yang berperan penting pada proses perkolasi diantaranya adalah : gaya berat, kekentalan cairan, daya larut zat aktif, tegangan permukaan, difusi, tekanan osmosa, daya adesi, daya kapiler dan daya geseran (friksi).
Keuntungan metode perkolasi :
• Tidak memerlukan langkah tambahan.
• Tidak membutuhkan panas sehingga teknik perkolasi ini sangat cocok untuk substansi yang bersifat termolabil.
• Sampel selalu dialiri oleh pelarut baru.
• Pelarut dialirkan melalui sampel sehingga proses penyarian lebih sempurna.
Kerugian metoda perkolasi :
• Kontak antara sampel padat dengan pelarut tidak merata dan terbatas.
• Pelarut menjadi dingin selama proses perkolasi sehingga tidak melarutkan komponen secara efisien.
• Apabila sampel dalam perkolator tidak homogen maka pelarut akan sulit menjangkau seluruh area.
• Metode ini membutuhkan banyak pelarut dan memakan banyak waktu.
b. Ekstraksi secara Panas
Metode panas digunakan apabila senyawa-senyawa yang terkandung dalam simplisia sudah dipastikan tahan panas. Metode ekstraksi yang membutuhkan panas diantaranya :
1) Seduhan
Merupakan metoda ekstraksi paling sederhana hanya dengan merendam simplisia dengan air panas selama waktu tertentu (5-10 menit).
2) Coque (penggodokan)
Merupakan proses penyarian dengan cara menggodok simplisia menggunakan api langsung dan hasilnya dapat langsung digunakan sebagai obat baik secara keseluruhan termasuk ampasnya atau hanya hasil godokannya saja tanpa ampas.
3) lnfusa
lnfusa merupakan sediaan cair yang dibuat dengan cara menyari simplisia nabati dengan air pada suhu 90°C selama 15 menit. Kecuali dinyatakan lain, infusa dilakukan dengan cara sebagai berikut : “Simplisia dengan derajat kehalusan tertentu dimasukkan ke dalam panci infusa, kemudian ditambahkan air secukupnya. Panaskan campuran di atas penangas air selama 15 menit, dihitung mulai suhu 90°C sambil sekali-sekali diaduk. Serkai selagi panas menggunakan kain flanel, tambahkan air panas secukupnya melalui ampas sehingga diperoleh volume infus yang dikehendaki”.
4) Digestasi
Digestasi adalah proses ekstraksi yang cara kerjanya hampir sama dengan maserasi, hanya saja digesti menggunakan pemanasan rendah pada suhu 30-40°C.
Metoda ini biasanya digunakan untuk simplisia yang tersari baik pada suhu biasa.
5) Dekokta
Proses penyarian secara dekokta hampir sama dengan infusa, perbedaannya hanya terletak pada lamanya waktu pemanasan. Waktu pemanasan pada dekokta lebih lama dibanding metoda infusa, yaitu 30 menit dihitung setelah suhu mencapai 90°C. Metoda ini sudah sangat jarang digunakan karena selain proses penyariannya yang kurang sempurna dan juga tidak dapat digunakan untuk mengekstraksi senyawa yang bersifat yang termolabil.
6) Refluks
Refluks merupakan proses ekstraksi dengan pelarut pada titik didih pelarut selama waktu dan jumlah pelarut tertentu dengan adanya pendingin balik (kondensor). Proses ini umumnya dilakukan 3-5 kali pengulangan pada residu pertama, sehingga termasuk proses ekstraksi yang cukup sempurna.
7) Soxhletasi
Proses soxhletasi merupakan proses ekstraksi panas menggunakan alat khusus berupa esktraktor soxhlet. Suhu yang digunakan lebih rendah dibandingkan dengan suhu pada metoda refluks.
2.3 Radikal Bebas
Radikal bebas adalah molekul yang kehilangan elektron, sehingga molekul tersebut menjadi tidak stabil dan selalu berusaha mengambil elektron dari molekul atau sel lain. Radikal bebas dapat dihasilkan dari hasil metabolisme tubuh seperti pada waktu kita bernapas (hasil samping proses oksidasi atau pembakaran), pada saat terjadi infeksi. Pada saat terjadi infeksi, radikal bebas diperlukan untuk, membunuh mikroorganisme penyebab infeksi. Tetapi paparan radikal bebas yang berlebihan dapat menyebabkan kerusakan sel, dan pada akhirnya dapat
kerusakan sel, mengurangi kemampuan adaptasi sel, bahkan kematian sel sehingga menyebabkan timbulnya penyakit (Ramadhan, 2015).
Sumber-sumber radikal bebas semakin sering dijumpai di masyarakat sekarang ini seiring kemajuan ilmu pengetahuan dan teknologi, misalnya semakin banyaknya kendaraan baru yang beredar di pasaran dan digunakan oleh masyarakat yang nantinya semakin memperbanyak polusi udara akibat penggunaannya, dimana polusi udara merupakan salah satu sumber radikal bebas.
Selain itu, gaya hidup yang semakin berkembang juga dapat berpengaruh terutama di daerah perkotaan. Banyak masyarakat yang lebih suka mengkonsumsi makanan cepat saji, banyak mengandung lemak serta zat-zat kimia berbahaya dan penggunaan rokok, dimana bahan-bahan tersebut merupakan sumber radikal bebas juga. Dengan demikian, semakin meningkatnya sumber radikal bebas yang terpapar pada masyarakat, maka resiko untuk menderita penyakit-penyakit (Ramadhan, 2015).
2.4 Antioksidan
Antioksidan merupakan senyawa yang dapat menetralkan radikal bebas di dalam tubuh manusia. Enzim-enzim seperti superoksida dismutase (SOD), gluthatione dan katalase merupakan antioksidan alami yang terdapat pada tubuh manusia. Pertumbuhan radikal bebas atau spesi reaktif yang melebihi kapasitas antioksidan di dalam tubuh akan meningkatkan resiko timbulnya berbagai penyakit regeneratif seperti kanker, jantung, katarak, penuaan dini dan lain-lain.
Oleh karena itu, selain mengandalkan antioksidan dari dalam tubuh, manusia juga membutuhkan antioksidan dari luar tubuh untuk mencapai keseimbangan.
Sumber-sumber antioksidan dapat berasal dari bahan yang diperoleh dari laut dan tanaman yang tumbuh di darat (Suzery dkk., 2017).
Antioksidan adalah senyawa yang mampu menangkal atau meredam efek negatif oksidan dalam tubuh, bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktifitas senyawa oksidan tersebut dapat dihambat (Ramadhan, 2015).
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya cuma-cuma kepada molekul radikal bebas tanpa terganggu sama sekali fungsinya dan dapat memutus reaksi berantai dari radikal bebas (Ramadhan, 2015).
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam penyakit seperti penyakit kardiovaskuler, jantung koroner, kanker, serta penuaan dini. Penambahan antioksidan ke dalam formulasi makanan, juga efektif mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas, dan destruksi biomolekul yang ada dalam makanan (Ramadhan, 2015).
Asam askorbat adalah vitamin yang larut dalam air. Antioksidan yang terdapat dalam buah jeruk, kentang, tomat dan sayuran yang berwarna hijau.
Manusia tidak mampu mensintesa l-askorbic acid dari d-glukosa karena tidak mempunyai enzim l-gulakolakton oksidase. Oleh sebab itu manusia memperoleh asam askorbat dari diet (Ramadhan, 2015).
Fungsi antioksidan vitamin c adalah kemampuannya sebagai agen pereduksi (donor elektron) radikal bebas. Pemberian satu elektron yang berasal dari asam askorbat membentuk radikal semi-dehidroaskorbat (DHA). Askorbat bereaksi dengan O2- dan OH untuk membentuk DHA. Menurut penelitian Jialal (l990), askorbat mempunyai kemampuan yang lebih kuat daripada tokoferol
dalam menghambat oksidasi LDL. Konsentrasi askorbat yang digunakan untuk menghambat oksidasi LDL adalah sebesar 40-60 ppm (Ramadhan, 2015).
2.5 Metode Pengukuran Antioksidan
Ada sejumlah besar metode untuk menentukan kapasitas antioksidan berdasarkan prinsip yang berbeda: pengumpulan radikal peroksil (Oxygen Radical Absorbance capacity, ORAC); Total Radical-trapping Antioxidant Power (TRAP); daya pereduksi logam (Ferric Reducing Antioksidant Power, FRAP);
Cupric Reducing Antioksidant Power (CUPRAC); pengumpulan radikal hidroksil (uji deoxiribose); pengumpulan radikal organik (2,2-Azino-bis(3-ethylbenz- thiazoline-6-sulfonic acid, ABTS); 1,1-Diphenyl-2-picrylhydrazyl (DPPH);
kuantifikasi produk yang terbentuk selama peroksidasi lipid (Thiobarbituric Acid Reactive Substances, TRAPS); Low-density Lipoproteins (LDL), dan lain-lain (Marinova dan Batchvarov, 2011).
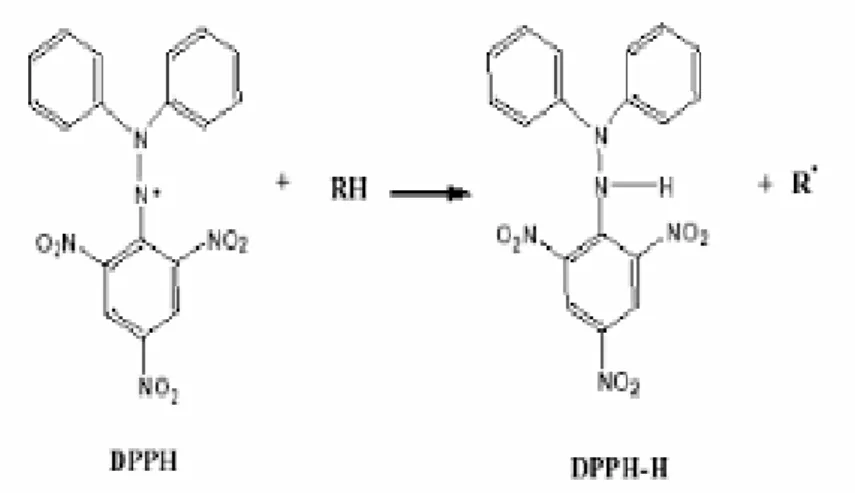
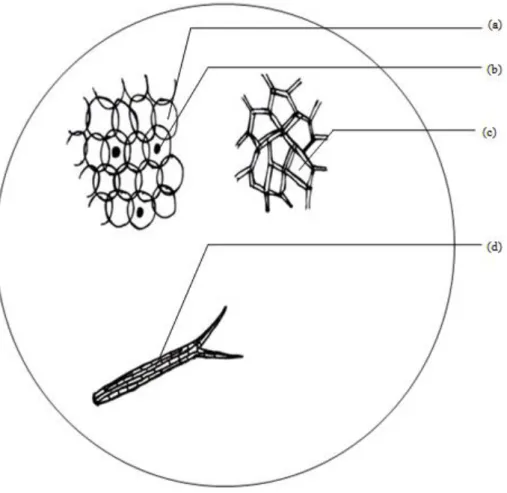
2.5.1 Pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picryilhydrazil) Pengujian aktivtitas antioksidan dalam penelitian ini menggunakan metode DPPH (1,1-diphenyl-2-picrylhydrazyl). Prinsip metode penangkapan radikal adalah pengukuran penangkapan radikal bebas dalam pelarut organik polar seperti etanol atau metanol pada suhu kamar oleh suatu senyawa yang mempunyai aktivitas antioksidan. Senyawa DPPH adalah suatu radikal bebas stabil yang dapat bereaksi dengan radikal lain membentuk senyawa yang lebih stabil dan dapat bereaksi dengan atom hidrogen membentuk DPPH tereduksi yang stabil. Suatu senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya ditandai dengan perubahan warna ungu menjadi kuning pucat (Sapri dkk., 2013).
Mekanisme penangkapan radikal DPPH oleh antioksidan yaitu berupa donasi proton kepada radikal. DPPH dalam bentuk non-radikalakan kehilangan warna ungunya yang mana pemudaran warna ini dapat ditunjukkan dengan penurunan serapandari DPPH pada panjang gelombang maksimum yang diukur menggunakan spektrofotometer Uv-Vis. Pengukuran penurunan serapan DPPH pada larutan uji dihitung terhadap serapan kontrol yakni larutan DPPH dan pelarut tanpa sampel (Sapri dkk., 2013).
Gambar 2.2 Reaksi DPPH dengan Antioksidan(Sapri dkk., 2013)
Proses penangkapan radikal ini melalui mekanisme pengambilan atom hidrogen dari senyawa antioksidan oleh radikal bebas, sehingga radikal bebas menangkap suatu elektron dari antioksidan. Radikal bebas sintetik yang digunakan adalah DPPH. Senyawa DPPH bereaksi dengan senyawa antioksidan melalui pengambilan atom hidogen dari senyawa antioksidan untuk mendapatkan pasangan elektron. Senyawa yang bereaksi sebagai penangkap radikal akan mereduksi DPPH yang dapat diamati dengan adanya perubahan ketika elektron ganjil dari radikal DPPH telah berpasangan dengan hidrogen dari senyawa penangkap radikal bebasyang akan membentuk DPPH-H tereduksi selanjutnya
radikal bebas DPPH akan membentuk senyawa bukan radikal yaitu DPPH yang stabil (Sapri dkk., 2013).
2.5.1.1 Pengukuran absorbansi panjang gelombang
Panjang gelombang maksimum yang digunakan dalam pengukuran sampel uji sangat bervariasi. Menurut beberapa literatur panjang maksimum untuk DPPH antara lain 515-517 nm. Apabila pengukuran menghasilkan tinggi puncak maksimum, maka itu merupakan panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas. Nilai absorbansi yang mutlak tidaklah penting, karena panjang gelombang dapat diatur untuk memberikan absorbansi maksimum sesuai dengan alat yang digunakan (Molyneux, 2004).
2.5.1.2 Waktu pengukuran
Lama pengukuran metode DPPH menurut beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit dan 60 menit (Molyneux, 2004). Waktu reaksi yang tepat adalah ketika reaksi sudah mencapai kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di dalam sampel (Rosidah dkk., 2008).
2.6 Spektrofotometri UV-Visibel
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV- Vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini. Tetapi
spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer. Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar tampak berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004).
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau deuterium untuk pengukuran uv dan lampu tungsten untuk pengukuran pada cahaya tampak. Panjang gelombang dari sumber cahaya akan dibagi oleh pemisah panjang gelombang (wavelength separator) seperti prisma atau monokromator.
Spektrum didapatkan dengan cara scanning oleh wavelength separator sedangkan pengukuran kuantitatif bisa dibuat dari spektrum atau pada panjang gelombang tertentu (Dachriyanus, 2004).
Cahaya tampak hanyalah merupakan bagian kecil dari seluruh radiasi elektromagnetik. Spektrum cahaya tampak terdiri dari komponen-komponen merah, jingga, kuning, hijau, biru dan ungu, dimana masing-masing warna mempunyai panjang gelombang yang berbeda. Satuan yang banyak dipergunakan untuk menyatakan panjang gelombang adalah Angstrom, 1 A = 10-10 meter (Triyati, 1985).
Susunan peralatan Spektrofotometer ultraviolet dan sinar tampak yang meliputi bagian-bagian sebagai berikut: sumber cahaya dipergunakan untuk pengukuran absorpsi. Sumber cahaya ini harus memancarkan sinar dengan kekuatan yang cukup untuk penentuan dan pengukuran, juga harus memancarkan cahaya berkesinambungan yang berarti harus mengandung semua panjang gelombang dari daerah yang dipakai. Kekuatan sinar radiasi harus konstan selama
lampu Wolfram. Sedangkan sumber radiasi ultra-violet biasa dipergunakan lampu Hidrogen atau Deuterium yang terdiri dari tabung kaca dengan jendela dari kwartz yang mengandung Hidrogen dengan tekanan tinggi. Oleh karena kaca menyerap radiasi ultra-violet, maka sistim optik spektrofotometer ultra-violet dan sel harus dibuat dari bahan kwartz (Triyati, 1985).
Monokromator dipergunakan untuk memisahkan radiasi ke dalam komponen-komponen panjang gelombang dan dapat memisahkan bagian spektrum yang diinginkan dari lainnya (Triyati, 1985).
Sel absorpsi dipakai dari bahan silika, kuvet dan plastik banyak dipakai untuk daerah sinar tampak. Kualitas data absorban sangat tergantung pada cara pemakaian dan pemeliharaan sel. Sidik jari, lemak atau pengendapan zat pengotor pada dinding sel akan mengurangi transmisi. Jadi sel-sel itu harus bersih sekali sebelum dipakai (Triyati, 1985).
Detektor dipergunakan untuk menghasilkan signal elektrik. Dimana signal elektrik ini sebanding dengan cahaya yang diserap. Signal elektrik ini kemudian dialirkan ke alat pengukur. Rekorder dipergunakan untuk mencatat data hasil pengukuran dari detektor, yang dinyatakan dengan angka (Triyati, 1985).
Suatu sumber cahaya; dipancarkan melalui monokromator. Monokromator menguraikan sinar yang masuk dari sumber cahaya tersebut menjadi pita-pita panjang gelombang yang diinginkan untuk pengukuran suatu zat tertentu, yang menunjukkan bahwa setiap gugus kromofor mempunyai panjang gelombang maksimum yang berbeda. Dari monokromator tadi cahaya/ energi radiasi diteruskan dan diserap oleh suatu larutan yang akan diperiksa di dalam kuvet.
Kemudian jumlah cahaya yang diserap oleh larutan akan menghasilkan signal elektrik pada detektor, yang mana signal elektrik ini sebanding dengan cahaya
yang diserap oleh larutan tersebut. Besarnya signal elektrik yang dialirkan ke pencatat dapat dilihat sebagai angka (Triyati, 1985).
Menurut Triyati (1985), dalam analisis spektrofotometri ultraviolet dan sinar tampak harus diperhatikan hal-hal sebagai berikut:
1. Kestabilan warna. Sedapat mungkin warna yang dihasilkan stabil untuk beberapa lama.
2. Reaksi warna yang spesifik. Sebaiknya dipakai reaksi warna yang spesifik untuk unsur tertentu, sehingga adanya unsur-unsur lain tidak mengganggu dan pemisahan tidak perlu dilakukan.
3. Sifat zat warna. Kalau zat warna yang terbentuk berada dalam keadaan tertutup dan segera diperiksa karena penguapan akan menyebabkan pemekatan larutan.
4. Sensitif. Sensitif yaitu dengan perubahan konsentrasi yang kecil, akan menyebabkan pemekatan larutan.
5. Larutan homogen. Larutan yang homogen akan mengabsorpsi cahaya di setiap bagian sama.
Kegunaan spektrofotometer ultra-violet dan sinar tampak dalam analisis kimia adalah untuk analisis kualitatif dan kuantitatif. Kelemahan Spektrofotometer ultra-violet dan sinar tampak dalam analisis kualitatif adalah kurang teliti. Hal tersebut disebabkan karena pita-pita absorpsi yang diperoleh melebar, dengan demikian kurang khusus atau terbatas pemakaiannya. Walaupun demikian, berdasarkan spektrum serapan ultra-violet dan sinar tampak, dapat dipakai untuk mengetahui ada atau tidak adanya gugus fungsional tertentu dalam senyawa organik. Alat ini dapat juga dipergunakan untuk menentukan jumlah kecil senyawa berkadar rendah yang dapat mengabsorpsi dalam media non
Menurut Triyati (1985), Pemakaian spektrofotometer ultra-violet dan sinar tampak dalam analisis kuantitatif mempunyai beberapa keuntungan:
- Dapat dipergunakan untuk banyak zat organik dan anorganik. Adakalanya beberapa zat harus diubah dulu menjadi senyawa berwarna sebelum dianalisa.
- Selektif. Pada pemilihan kondisi yang tepat dapat dicari panjang gelombang untuk zat yang dicari.
- Mempunyai ketelitian yang tinggi, dengan kesalahan relatif sebesar 1% — 3%, tetapi kesalahan ini dapat diperkecil lagi.
- Dapat dilakukan dengan cepat dan tepat.
BAB III
METODOLOGI PENELITIAN
Penelitian ini dilakukan dengan menggunakan metode eksperimental di Laboratorium Biologi Farmasi dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara meliputi pengumpulan dan pengolahan bahan tanaman, pemeriksaan karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol buah kemloko. Pengujian aktivitas antioksidan dilakukan dengan menggunakan metode DPPH dari bulan Agustus sampai bulan Oktober 2018.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, aluminium foil (Total Wrap), batang pengaduk, alat tanur (Nabertherm), blender (philips), cawan porselin, Hotplate (Hanna), kertas perkamen, kertas saring, klem, kondensor, koran, krus porselen, lemari pengering, lumpang, neraca analitik (Mettler Toledo), oven (Memmert), penangas air, perkolator, pipet mikro (Eppendorf; 10-100 µL), pipet mikro (Eppendorf; 100-1000 µL), pipet volume (Herma; 1 ml), pipet volume (Herma; 2 ml), pipet volume (Herma; 5 ml), rotary evaporator (Haake D), serbet, spatula, spektrofotometer UV-Vis (Shimadzu), stamfer, statif, sudip, dan tisu.
3.2 Bahan-bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah buah kemloko (Phyllanthus emblica L.), air suling, etanol 96%, bahan-bahan yang berkualitas proanalisa : alfa naftol, amil alkohol, asam nitrat pekat, asam asetat
bismuth nitrat, DPPH (1.1-diphenyl-2-picryl-hydrazil), iodium, isopropanol, kalium iodida, kloroform, metanol, natrium hidroksida, raksa (II) klorida, serbuk magnesium, serbuk seng, timbal (II) asetat dan toluena.
3.3 Pembuatan Larutan Pereaksi 3.3.1 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 mL (Depkes RI., 1995).
3.3.2 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air suling hingga 100 mL, lalu disaring (Marjoni, 2016).
3.3.3 Pereaksi asam klorida 2 N
Sebanyak 17 mL asam klorida pekat diencerkan dengan air suling hingga 100 mL (Marjoni, 2016).
3.3.4 Pereaksi Dragendorff
Sebanyak 8 g bismut nitrat dilarutkan dalam 20 mL HNO3, kemudian dicampur dengan larutan larutan kalium iodida sebanyak 27,2 g dalam 50 mL air suling. Campuran dibiarkan sampai memisah secara sempurna. Ambil larutan jernih dan diencerkan dengan air secukupnya hingga 100 mL (Marjoni, 2016).
3.3.5 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya, lalu ditambahkan sedikit demi sedikit 2 g iodium, lalu dicukupkan dengan air sulinghingga 100 mL (Depkes RI., 1995).
3.3.6 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida hingga 100 mL (Depkes RI., 1995).
3.3.7 Pereaksi Liebermann-Burchard
Sebanyak 5 mL asam asetat anhidrida dicampurkan dengan 5 mL asam sulfat pekat kemudian ditambahkan etanol hingga volume 50 mL (Depkes RI., 1995).
3.3.8 Pereaksi Meyer
5 g kalium iodida dalam 10 mL aquadest, kemudian ditambahkan larutan 1,36 gram merkuri (II) klorida dalam 60 mL air suling. Larutan kemudian dikocok dan ditambahkan aquadest sampai 100 mL (Marjoni, 2016).
3.3.9 Pereaksi Molisch
Sebanyak 3 g alfa naftol dilarutkan dalam asam nitrat 0,5 N secukupnya hingga diperoleh larutan 100 mL (Marjoni, 2016).
3.3.10 Pereaksi kloralhidrat
Larutan kloralhidrat dibuat dengan cara melarutkan kloralhidrat sebanyak 50 g dalam 20 mL air (Depkes RI., 1995).
3.3.11 Pembuatan pereaksi DPPH
Pembuatan pereaksi DPPH 0,5 mM, Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol hingga diperoleh volume larutan 100 mL (konsentrasi 200 µg/mL) (Molyneux, 2004).
3.4 Pengumpulan dan Pengolahan Bahan Tanaman 3.4.1 Pengumpulan bahan tanaman
Pengambilan bahan tanaman dilakukan secara purposif yaitu tanpa membandingkan tanaman yang sama dengan daerah lain. Bahan tanaman yang digunakan adalah buah kemloko. Bahan diambil dari Desa Simardona, Kecamatan Batang Onang, Kabupaten Padang Lawas Utara, Provinsi Sumatera Utara.
3.4.2 Identifikasi tanaman
Identifikasi tanaman dilakukan di Medanesse – Fakultas Matematika dan Ilmu Pengetahuan Alam, Departemen Biologi, Universitas Sumatera Utara.
Hasil identifikasi dapat dilihat pada Lampiran 1 halaman 46.
3.4.3 Pembuatan simplisia
Buah kemloko dicuci bersih dari pengotoran dengan air mengalir sampai bersih dan ditiriskan. Kemudian dikeringkan di lemari pengering dengan suhu 400 – 500C. Buah kemloko dianggap kering apabila sudah rapuh, kemudian simplisia yang telah kering diserbuk menggunakan blender, dan disimpan dalam wadah plastik yang tertutup rapat.
3.5 Karakterisasi Simplisia 3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia buah kemloko dengan mengamati bentuk, bau, rasa, dan warna.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia buah kemloko. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian dimati di bawah mikroskop.
3.5.3 Penetapan kadar air a. Penjenuhan toluen
Sebanyak 200 mL toluen dimasukkan ke dalam labu alas bulat, lalu ditambahkan 2 mL air suling, kemudian alat dipasang dan dilakukan destilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama kurang lebih 30 menit, lalu volume air dalam tabung penerima dibaca dengan ketelitian 0,1 mL.
b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 g simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kemudian toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik dan setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,1 mL. Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998).
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g simplisia dimaserasi selama 24 jam dalam 100 mL air- kloroform (2,5 mL kloroform dalam aquadest sampai 1 L) dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 mL filtrat diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 1050C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 mL etanol 96 % dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak
dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 1050C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2,5 g serbuk simplisia yang telah digerus dan ditimbang seksama, dimasukkan ke dalam krus porselin yang telah dijar dan ditara, kemudian diratakan. Krus porselin bersama isinya dijarkan perlahan hingga arang habis, didinginkan, ditimbang sampai diperoleh bobot yang tetap. kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total didihkan dengan 25 mL asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring dengan kertas saring, lalu cuci dengan air panas. Residu dan kertas saring dipijarkan sampai diperoleh bobot yang tetap, dinginkan dan ditimbang beratnya. Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.6 Skrining Fitokimia
Skrining fitokimia dari serbuk simplisia, ekstrak etanol meliputi pemeriksaan golongan senyawa alkaloida, flavonoida, saponin, tanin, glikosida dan steroida/ triterpenoida.
3.6.1 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 100 mL air panas, didihkan selama lebih kurang 5 menit dan disaring dalam keadaan panas, ke dalam 5 mL filtrat ditambahkan 0,1 g serbuk magnesium dan 1 mL asam klorida pekat dan 2 mL amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi
warna merah, kuning, jingga pada lapisan amil alkohol (Marjoni, 2016).
3.6.2 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit. Didinginkan dan disaring. Filtratnya dipakai untuk percobaan sebagai berikut:
a. Diambil 3 tetes filtrat, lalu ditambahkan dengan 2 tetes larutan pereaksi Meyer, akan terbentuk endapan menggumpal bewarna putih atau kuning.
b. Diambil 3 tetes filtrat, lalu ditambahkan dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan bewarna coklat sampai hitam.
c. Diambil 3 tetes filtrat, lalu ditambahkan dengan 2 tetes larutan pereaksi Dragendorff, akan terbentuk endapan merah atau jingga.
Apabila terdapat endapan putih paling sedikit dengan 2 atau 3 dari pengujian diatas, maka simplisia dinyatakan positif mengandung alkaloid (Marjoni, 2016).
3.6.3 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi, ditambahkan 10 mL air panas, didinginkan kemudian dikocok selama 10 detik, jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Marjoni, 2016).
3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 mL air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
Jika terjadi warna hijau, biru, atau kehitaman menunjukkan adanya tanin (Marjoni, 2016).
3.6.5 Pemeriksaan glikosida
Menurut Depkes RI (1995), pemeriksaan glikosida yaitu sebanyak 3 g serbuk simplisia disari dengan 30 mL campuran etanol 95 % dengan air suling (7:3), ditambahkan asam sulfat pekat sehingga diperoleh pH 2, kemudian direfluks selama 10 menit, didinginkan dan disaring. Sebanyak 20 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan dengan temperatur tidak lebih dari 50 0C. Sisanya dilarutkan dalam 2 mL metanol. Larutan sisa dipakai untuk percobaan berikut:
a. Larutan sisa dimasukkan ke dalan tabung reaksi selanjutnya diuapkan di atas penangas air, pada sisa ditambahkan 2 mL air dan 5 tetes pereaksi Molish. Tambahkan hati-hati 2 mL asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula.
b. Larutan percobaan diuapkan di atas penangas air. Larutkan sisa dalam 5 mL asam asetat anhidrat. Tambahkan 10 tetes asam sulfat pekat, akan terjadi warna biru atau hijau, menunjukkan adanya glikosida.
3.6.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 mL n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu
menunjukkan adanya triterpenoid (Marjoni, 2016).
3.7 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan secara ekstraksi dingin yaitu dengan metode perkolasi. Keuntungan metode perkolasi : tidak membutuhkan panas, sampel selalu dialiri oleh pelarut baru, pelarut dialirkan melalui sampel sehingga proses penyarian lebih sempurna (Marjoni, 2016).
Sebanyak 600 g serbuk simplisia dimasukkan ke dalam bejana bertutup, kemudian direndam dengan cairan penyari etanol selama 3 jam. Kemudian massa dimasukkan ke dalam perkolator, cairan penyari etanol dituang secukupnya sampai terdapat selapis cairan penyari di atas serbuk simplisia, kemudian mulut perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam.
Kemudian, cairan perkolat dibiarkan menetes dengan kecepatan 1 tetes per detik lalu tambahkan berulang-ulang etanol sehingga selalu terdapat selapis cairan penyari diatas simplisia dan ditampung ke dalam botol berwarna bening. Perkolasi dihentikan apabila cairan perkolat terakhir diuapkan diatas penangas air tidak meninggalkan sisa(Ditjen POM Depkes RI, 1979). Penambahan pelarut dilakukan sampai perkolat sudah tidak mengandung senyawa aktif lagi. Hal ini dapat dilakukan dengan pengamatan secara visual dengan cara melihat secara fisik pada tetesan perkolat. Apabila tetesan sudah tidak berwarna, maka penambahan pelarut sudah dapat dihentikan. Sisa pelarut yang masih ada di dalam perkolator dihabiskan dan dikumpulkan dengan perkolat sebelumnya (Marjoni, 2016).Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada suhu tidak lebih dari 40oC, lalu diuapkan sisa pelarut diatas penangas air sampai diperoleh ekstrak kental kemudian disimpan di lemari pendingin (Ditjen POM
3.8 Pengujian Aktivitas Antioksidan dengan Spektrofotometer UV-Visibel 3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas DPPH dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang memerangkap radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan sampel uji tersebut (Sapri dkk., 2013).
3.8.2 Pembuatan larutan blanko
Ditimbang sebanyak 20 mg serbuk DPPH kemudian dilarutkan dalam metanol hingga diperoleh volume larutan 100 mL (konsentrasi 200 µg/mL).
Larutan DPPH (konsentrasi 200 µg/mL) dipipet sebanyak 5 mL, kemudian dimasukkan ke dalam labu tentukur 25 mL, dicukupkan volumenya dengan metanol sampai garis tanda (konsentrasi 40 µg/mL) (Sapri dkk., 2013).
3.8.3. Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 µg/mL dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm (Sapri dkk., 2013).
3.8.4 Pembuatan larutan induk
3.8.4.1 Pembuatan larutan induk ekstrak etanol buah kemloko (EEBK) Sebanyak 25 mg ekstrak etanol buah kemloko (Phyllanthus emblicaL.)ditimbang kemudian dilarutkan dalam labu tentukur 25 mL dengan metanol, lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 µg/mL).
3.8.4.2 Pembuatan larutan induk vitamin c
Sebanyak 25 mg serbuk vitamin c ditimbang, dimasukkan ke dalam labu tentukur 50 mL dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 500 µg/mL).
3.8.5 Pembuatan larutan uji
3.8.5.1 Pembuatan larutan uji ekstrak etanol buah kemloko (EEBK)
Ditimbang sebanyak 25 mg ekstrak etanol buah kemloko kemudian dilarutkan dalam labu tentukur 25 mL dengan metanol, lalu volumenya dicukupkan denganmetanol sampai garis tanda (konsentrasi 1000µg/mL).Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk (konsentrasi 1000 µg/mL)dipipet sebanyak 50µl ke dalam labu tentukur 25mL (konsentrasi 2 µg/mL; LIB II), lalu larutan LIB II dipipet 1,25mL; 2,5 mL;
3,75mL; 5 mL ke dalam labu ukur 5mL(Konsentrasi masing-masing : 0,5 µg/mL, 1µg/mL, 1,5 µg/mL, 2µg/mL). ke dalam masing-masing labu ukur ditambahkan 1mL larutan DPPH 0.5 mM (konsentrasi 200 µg/mL) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit pada suhu kamar, lalu diukur serapannya menggunakan spektrofotometer UV-Visibel pada panjang gelombang serapan maksimum yang diperoleh.
3.8.5.2 Pembuatan larutan vitamin c
Ditimbang sebanyak 25 mg serbuk vitamin c, dimasukkan ke dalam labu tentukur 50 mL, dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 500 µg/mL). Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk (konsentrasi 500 µg/mL) dipipet sebanyak 20 µL; 40 µL; 60 µL; 80 µL ke dalam labu ukur 5 mL untuk mendapatkan konsentrasi larutan uji 2 µg/mL, 4 µg/mL, 6 µg/mL, 8 µg/mL, ke dalam masing-masing labu ukur ditambahkan 1 mL larutan DPPH 0.5 mM (konsentrasi 200 µg/mL) lalu volumenya dicukupkan dengan metanol sampai
menggunakan spektrofotometer UV-Visibel pada panjang gelombang yang diperoleh.
3.8.5.3 Analisis persen pemerangkapan radikal bebas DPPH
Menurut Al Ridho dkk. (2013), Prinsip dari metode uji aktivitas antioksidan ini adalah pengukuran aktivitas antioksidan secara kuantitatif yaitu dengan melakukan pengukuran penangkapan radikal DPPH oleh suatu senyawa yang mempunyai aktivitas antioksidan dengan menggunakan spektrofotometri UV-Vis sehingga dengan demikian akan diketahui nilai aktivitas peredaman radikal bebas yang dinyatakan dengan nilai IC50 (inhibitory concentration), yaitu dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = AKontrol − ASampel
AKontrol 𝑥 100%
Keterangan: Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
3.8.5.4 Analisis nilai IC50
Nilai aktivitas peredaman radikal bebas yang dinyatakan dengan nilai IC50
(inhibitory concentration) didefinisikan sebagai besarnya konsentrasi senyawa uji yang dapat meredam radikal bebas sebanyak 50%. Semakin kecil nilai IC50 maka aktivitas peredaman radikal bebas semakin tinggi. Prinsip kerja dari pengukuran ini adalah adanya radikal bebas stabil yaitu DPPH yang dicampurkan dengan senyawa antioksidan yang memiliki kemampuan mendonorkan hidrogen, sehingga radikal bebas dapat diredam. Koefisien y pada persamaan ini adalah sebagai IC50, sedangkan koefisien x adalah konsentrasi dari ekstrak yang akan dicari nilainya, dimana nilai dari x yang didapat merupakan besarnya konsentrasi yang diperlukan untuk dapat meredam 50% aktivitas radikal DPPH (Al Ridho
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Karakterisasi Simplisia 4.1.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia buah kemloko menunjukkan buah kemloko berbentuk bulat dengan diameter kira-kira 2 cm. Berwarna kuning kehijauan, berbau khas dan berasa masam (kecut) agak getir. Gambar makroskopik simplisia buah kemlokodapat dilihat pada Lampiran 3 halaman 48.
4.1.2 Hasil pemeriksaan mikroskopik
Hasil pemeriksaan makroskopik simplisia buah kemloko menunjukkan terdapat jaringan parenkim, tetes minyak, jaringan gabus dan serat. Hasil mikroskopik dapat dilihat pada Lampiran 5 halaman 50.
4.1.3 Hasil karakterisasi simplisia buah kemloko
Hasil karakteristik simplisia buah kemloko dapat dilihat pada Tabel 4.1 dan perhitungan dapat dilihat pada Lampiran 6 halaman 51.
Tabel 4.1 Hasil karakteristik simplisia buah kemloko (Phylanthus emblica L.)
No Pengujian Hasil Pemeriksaan (%)
1 Kadar air 8,0
2 Kadar sari larut air 23,33
3 Kadar sari larut etanol 30
4 Kadar abu total 6,66
5 Kadar abu tidak larut asam 3,33
Tabel 4.1 menunjukkan kadar air simplisia buah kemloko sebesar 8%