KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK
ETANOL BUAH NAGA (Hylocereus undatus
(Haw.) Britton & Rose)
SKRIPSI
OLEH:
NUR KHAIDAH SIREGAR NIM 091524001
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK
ETANOL BUAH NAGA (Hylocereus undatus
(Haw.) Britton & Rose)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NUR KHAIDAH SIREGAR NIM 091524001
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
LEMBAR PENGESAHAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK
ETANOL BUAH NAGA (Hylocereus undatus
(haw.) Britton & Rose )
OLEH:
NUR KHAIDAH SIREGAR NIM: 091524001
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : Agustus 2011
Pembimbing I Panitia Penguji
Prof. Dr. Rosidah, Apt. Prof. Dr. Sumadio Hadisahputra,Apt. NIP 195103261978022001 NIP. 195311281983031002
Pembimbing II Prof. Dr. Rosidah, Apt. NIP 195103261978022001
Drs. Suwarti Aris, M.Si., Apt. Drs. Suryadi Achmad, M.Sc., Apt. NIP 195107231982022001 NIP. 195109081985031002
Drs. Panal Sitorus, M.Si., Apt. NIP. 195310301980031002
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT, karena limpahan rahmat dan
karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul
”Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan
Ekstrak Etanol Buah Naga (Hylocereus undatus (Haw.) Britton & Rose) ”.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih dan
penghargaan yang tulus kepada Ibunda tercinta Hj. Sa´diah nasution atas doa dan
pengorbanannya dengan tulus dan ikhlas, juga kepada kakak, abang dan adik
tersayang yang selalu setia memberi doa, dorongan dan semangat.
Penulis juga ingin menyampaikan rasa terimakasih yang sebesar-besarnya
kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas
selama masa pendidikan.
2. Ibu Prof. Dr. Rosidah, Apt. dan Drs. Suwarti Aris, M.Si., Apt. selaku
pembimbing yang telah memberikan waktu, bimbingan dan nasehat
selama penelitian dengan penuh kesabaran hingga selesainya penyusunan
skripsi ini.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., Drs. Suryadi Achmad,
M.Sc., Apt., Drs. Panal Sitorus, M.Si., Apt., selaku dosen penguji yang
telah memberikan masukan dan saran selama penelitian hingga selesainya
penyusunan skripsi ini.
4. Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang telah
Apt., selaku penasehat akademis yang telah memberikan bimbingan
kepada penulis selama ini.
5. Ibu dan Bapak Kepala Laboratorium Penelitian dan Laboratorium
Farmakognosi yang telah memberikan fasilitas, petunjuk dan membantu
selama penelitian.
6. Teman-teman dan adik-adik terbaikku di Farmasi Ekstensi 2008-2009
yang namanya tidak dapat ditulis satu persatu, yang telah begitu banyak
membantu dalam proses penelitian hingga selesainya penulisan skripsi ini.
Medan, Agustus 2011
Penulis,
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Buah Naga
(Hylocereus undatus (Haw.) Britton & Rose)
ABSTRAK
Tumbuhan buah naga (Hylocereus undatus (Haw.) Britton & Rose) termasuk suku Cactaceae, telah dibudidayakan di Indonesia dan semakin populer bagi masyarakat. Bentuk buahnya unik dan menarik, kulitnya merah dan bersisik hijau mirip dengan sisik seekor naga, rasanya manis, asam dan segar,
mengandung senyawa kimia seperti vitamin C, vitamin A, vitamin E dan polifenol yang mampu menurunkan tekanan darah, kadar kolesterol, kadar gula darah dan mencegah terjadinya kanker.
Pada penelitian ini, dilakukan pemeriksaan karakteristik simplisia,
skrining fitokimia dan uji aktivitas antioksidan terhadap ekstrak etanol buah naga dan sari buah naga segar dengan metode penangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH). Ekstrak etanol buah naga diperoleh secara maserasi dengan pelarut etanol 96%, sari buah naga segar diperoleh dengan cara
menghaluskan daging buah segar lalu ditambah air, diperas, disaring, dikeringkan menggunakan freeze dryer sehingga diperoleh sari buah kental. Ekstrak etanol buah naga dan sari buah naga segar diuji aktivitas antioksidannya terhadap DPPH sebagai radikal bebas setelah didiamkan selama 60 menit pada suhu kamar dan panjang gelombang 516 nm.
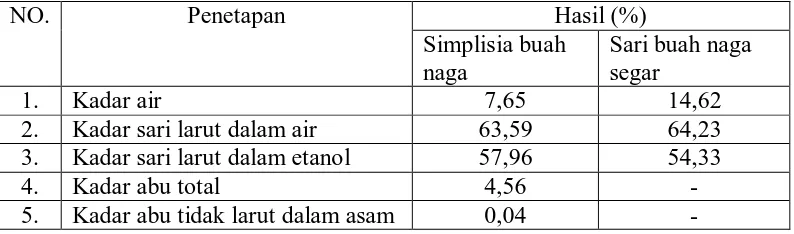
Hasil karakteristik simplisia secara makroskopik berupa potongan-potongan kecil berwarna coklat kehitaman, bau karamel, rasa manis dan asam. Secara mikroskopik yaitu terlihat adanya epidermis, sel parenkim, kristal rapida, butir pati, sistolit, jaringan pengangkut dengan penebalan bentuk tangga dan rambut. Kadar air simplisia dan sari buah naga segar 7,65% dan 14,62%, kadar sari simplisia dan sari buah naga segar yang larut dalam air 63,59% dan 64,23%, kadar sari simplisia dan sari buah naga segar yang larut dalam etanol 57,96% dan 54,33%, kadar abu total 4,56%, dan kadar abu tidak larut dalam asam 0,04%.
Hasil skrining fitokimia dari daging buah naga mengandung senyawa gikosida, steroid/triterpenoid dan flavonoid.
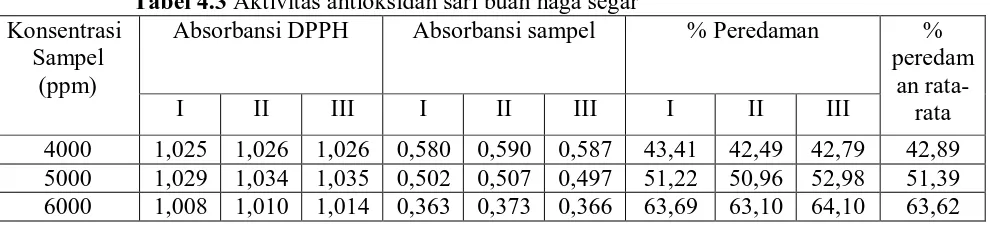
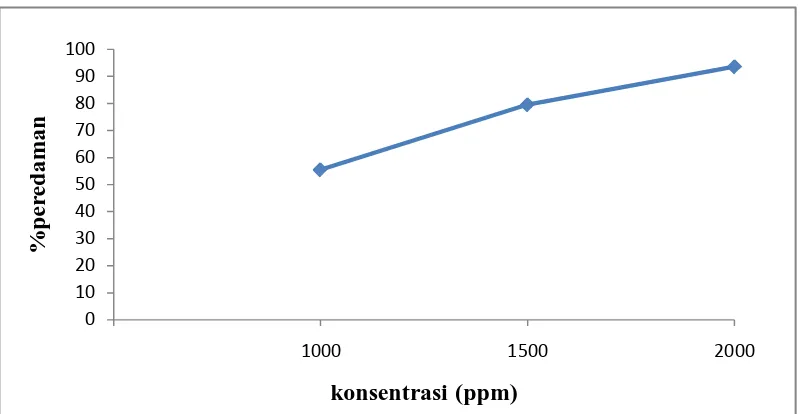
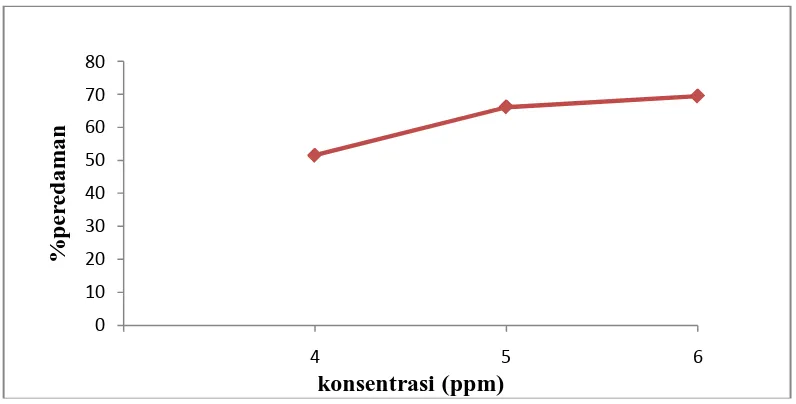
Hasil uji aktivitas antioksidan terhadap radikal bebas DPPH dari sari buah naga segar pada konsentrasi 4000 ppm meredam 42,89%, 5000 ppm meredam 51,39%, 6000 ppm meredam 63,62% sehingga diperoleh IC50 4751,427 ppm. Ekstrak etanol buah naga pada konsentrasi 1000 ppm meredam 55,46%, 1500 ppm meredam 79,56%, 2000 ppm meredam 93,64% sehingga diperoleh IC50 975,501 ppm. Vitamin C pada konsentrasi 4 ppm meredam 51,07%, 5 ppm meredam 65,77%, 6 ppm meredam 69,71% sehingga diperoleh IC50 4,027 ppm. Hasil uji statistik dari data di atas menunjukkan sari buah naga segar, ekstrak etanol buah naga dan vitamin C tidak mempunyai perbedaan aktivitas antioksidan.
Simplicia Characterize and Phytochemical Screening with Antioxidant Activities Test of Ethanol Extract of
Dragon Fruit (Hylocereus undatus (Haw.)Britton & Rose)
ABSTRACT
The dragon fruit plant (Hylocereus undatus (Haw.) Britton & Rose) family of cactaceae has been cultivated at Indonesia and increasingly popular for the community. Unique and interesting fruit shape, red of shell and green turtle similar to the turtle’s of dragon, it was sweet, sour and fresh, contain chemical compounds such as vitamin C, vitamin A vitamin E and polyphenols that can lowered blood pressure, cholesterol and blood glucose level, it also prevent spreading of cancer cell.
In this study, had been done examination of simplicia characteristics, phytochemical screening and test the antioxidant activity for the dragon fruit ethanol extract and the fresh dragon fruit juice by 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method. The dragon fruit ethanol extract obtained by maceration method with 96% ethanol solvent. The fresh dragon fruit juice obtained by refining the flesh dragon fruit, added water, squeezed, filtered, dried use freeze dryer to obtain a viscous juice. The dragon fruit ethanol extract and fresh dragon fruit juice were tested antioxidant activity against DPPH as free radical after incubation for 60 minutes at room temperature and a wavelength of 516 nm.
The result of macroscopic characteristics simplicia was small pieces of brown to blackish, it was caramel smell, sweet and sour. in the visible presence microscopic was epidermis, parenchyimal cells, rapida crystals, sistolit, tissue transporter with a thickening of the stairs, amylum and trachoma. The simplicia and fresh dragon fruit juice have the water content value 7.65% and 14.62%, the water soluble extract value of the simplicia and fresh dragon fruit juice 63.93% and 64.23%. the ethanol soluble extract value of the simplicia and fresh dragon fruit juice 57.96% and 54.33%, the total ash of simplicia value was 4.56%, and the acid insoluble of simplicia ash value was 0.04%.
The result of phytochemical screening of dragon fruit flesh contain glycosides, triterpenoida/steroida and flavonoids.
The result of antioxidant activity test for radical DPPH from the fresh dargon fruit juice at 4000 ppm scavenger 42.89%, 5000 ppm scavenger 51.39%, 6000 ppm scavenger 63.62% and IC50 4751.427 ppm. The dragon fruit ethanol extract at 1000 ppm scavenger 55.46%, 1500 ppm scavenger 79.56%, 2000 ppm scavenger 93.64% and IC50 975.501 ppm.Vitamin C at 4 ppm scavenger 51.07%, 5 ppm scavenger 65.77%, 6 ppm scavenger 69.71% and IC50 4.027 ppm. The results of statistic test from the data above shown fresh dragon fruit juice, dragon fruit ethanol extract and vitamin C have not differences antioxidant activity.
DAFTAR ISI
Halaman
JUDUL ………... i
LEMBAR PENGESAHAN ………... iii
KATA PENGANTAR ……… iv
ABSTRAK ………... vi
ABSTRACT ……….. vii
DAFTAR ISI ……….. viii
DAFTAR TABEL ………. xiii
DAFTAR GAMBAR ………. xiv
DAFTAR LAMPIRAN ……….. xv
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ……… 3
1.3 Hipotesis analisis ... 3
1.4 Tujuan penelitian ... 4
1.5 Manfaat penelitian ... 4
BAB II TINJAUAN PUSTAKA ……….... 5
2.1 Uraian tumbuhan …………... 5
2.1.1 Daerah tumbuh ... …... 5
2.1.2 Sistematika tumbuhan ……….... 6
2.1.3 Nama asing ………... 6
2.1.4 Nama daerah ………. 6
2.1.6 Kandungan kimia ... …... 7
2.1.7 Kegunaan... …... 7
2.2 Ekstraksi ... …... 8
2.3 Radikal bebas ... …... 9
2.4 Antioksidan ... …... 10
2.4.1 Vitamin C ... …... 11
2.4.2 Vitamin A ... …... 12
2.4.3 Polifenol ... …… 13
2.4.4 Flavonoid ……….. 14
2.5 Spektrofotometri UV-Visibel ... …… 14
2.6 Penentuan aktivitas antioksidan dengan metode penangkapan radikal bebas DPPH ... ……. 15
2.6.1 Pelarut ... ……. 16
2.6.2 Pengukuran panjang gelombang serapan maksimum ……. 16
2.6.3 Waktu pengukuran ... ……. 17
BAB III METODE PENELITIAN ... 19
3.1 Alat ... 19
3.2 Bahan ... 19
3.3 Penyiapan bahan tumbuhan ... 20
3.3.1 Pengumpulan bahan tumbuhan ... 20
3.3.2 Identifikasi tumbuhan ... 20
3.3.3 Pembuatan simplisia ... 20
3.4.2 Pereaksi Mayer ... 21
3.4.3 Pereaksi Dragendroff ... 21
3.4.4 Pereaksi Molish ... 21
3.4.5 Pereaksi asam klorida 2 N ... 22
3.4.6 Pereaksi asam sulfat 2 N ... 22
3.4.7 Pereaksi natrium hidroksida 2 N ... 22
3.4.8 Pereaksi timbal (II) asetat 0.4 M ... 22
3.4.9 Pereaksi besi (III) klorida 1% ... 22
3.4.10 Pereaksi kloralhidrat ... 22
3.4.11 Pereaksi Liebermann-Burchard ... 22
3.4.12 Pereaksi DPPH 0,5 mM ……...………... 23
3.5 Pemeriksaan karakteristik simplisia …... 23
3.5.1 Pemeriksaan makroskopik ... 23
3.5.2 Pemeriksaan mikroskopik ... 23
3.5.3 Penetapan kadar air ……..…………...…….……… 24
a. Penjenuhan toluen ... 24
b. Penetapan kadar air simplisia ... 24
3.5.4 Penetapan kadar sari yang Larut dalam air ... 25
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 25
3.5.6 Penetapan kadar abu total ... 26
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 26
3.6 Skrining fitokimia ... 26
3.6.1 Pemeriksaan alkaloid ... 26
3.6.3 Pemeriksaan triterpenoid/steroid …... 27
3.6.4 Pemeriksaan flavonoid ... 28
3.6.5 Pemeriksaan tanin …... 28
3.6.6 Pemeriksaan saponin ... 28
3.6.7 Pemeriksaan antrakinon ... 28
3.7 Pembuatan sari buah naga segar dan ekstrak etanol buah naga ………..………... 29
3.7.1 Pembuatan sari buah naga segar …..…………..…... 29
3.7.2 Pembuatan ekstrak etanol buah naga ….……... 29
3.8 Pengujian kemampuan antioksidan secara spektrofotometer UV-visibel ... 30
3.8.1 Prinsip metode penangkapan radikal bebas DPPH ………... 30
3.8.2 Pembuatan larutan DPPH 0,5 mM ... 30
3.8.3 Pembuatan larutan induk ... 30
3.8.3.1 Pembuatan larutan induk sampel uji ... 30
3.8.3.2 Pembuatan larutan induk vitamin C ... 30
3.8.4 Pembuatan larutan uji ... 30
3.8.4.1 Larutan uji sari buah naga segar …... 30
3.8.4.2 Larutan uji ekstrak etanol buah naga …………. 31
3.8.4.3 Larutan uji vitamin C ………...………….. 31
3.8.5 Penentuan persen peredaman radikal bebas DPPH ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil identifikasi tumbuhan ... 32
4.2 Hasil karakteristik simplisia …….…………..……….………. 32
4.3 Hasil skrining fitokimia …...…... 33
4.4 Hasil analisa aktivitas antioksidan sampel uji ... 34
4.5 Hasil analisa nilai IC50 ... 34
BAB V KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2.Saran ... 42
DAFTAR PUSTAKA ………. 43
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia buah naga dan
sari buah naga segar ... 33
Tabel 4.2 Hasil pemeriksaan skrining fitokimia ... 34
Tabel 4.3 Aktivitas antioksidan sari buah naga segar ... 35
Tabel 4.4 Aktivitas antioksidan ekstrak etanol buah naga ... 35
DAFTAR GAMBAR
Halaman
Gambar 4.1 Hasil analisa aktivitas antioksidan sari buah naga segar ... 37
Gambar 4.2 Hasil analisa aktivitas antioksidan ekstrak etanol buah
naga ... 38
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Surat hasil identifikasi tumbuhan buah naga ... 45
Lampiran 2 Gambar tumbuhan buah naga (Hylocereus undatus (Haw.) Britt ……..………...……… 46
Lampiran 3 Bagan kerja penelitian ... 47
Lampiran 4 Gambar makroskopik simplisia buah naga ...….……... 48
Lampiran 5 Gambar hasil pengamatan mikroskopik ... 49
Lampiran 6 Perhitungan pemeriksaan karakteristik simplisia buah naga dan sari buah naga segar …………...…...……….... 51
Lampiran 7 Bagan pembuatan sari buah naga segar …….…...……...….. 59
Lampiran 8 Bagan ekstraksi simplisia buah naga secara ... 60
maserasi ...……..……….………...………… 61
Lampiran 9 Gambar seperangkat alat spektrofotometer ...…...…...…… 62
Lampiran 10 Hasil uji aktivitas antioksidan ……….…...………... 63
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Buah Naga
(Hylocereus undatus (Haw.) Britton & Rose)
ABSTRAK
Tumbuhan buah naga (Hylocereus undatus (Haw.) Britton & Rose) termasuk suku Cactaceae, telah dibudidayakan di Indonesia dan semakin populer bagi masyarakat. Bentuk buahnya unik dan menarik, kulitnya merah dan bersisik hijau mirip dengan sisik seekor naga, rasanya manis, asam dan segar,
mengandung senyawa kimia seperti vitamin C, vitamin A, vitamin E dan polifenol yang mampu menurunkan tekanan darah, kadar kolesterol, kadar gula darah dan mencegah terjadinya kanker.
Pada penelitian ini, dilakukan pemeriksaan karakteristik simplisia,
skrining fitokimia dan uji aktivitas antioksidan terhadap ekstrak etanol buah naga dan sari buah naga segar dengan metode penangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH). Ekstrak etanol buah naga diperoleh secara maserasi dengan pelarut etanol 96%, sari buah naga segar diperoleh dengan cara
menghaluskan daging buah segar lalu ditambah air, diperas, disaring, dikeringkan menggunakan freeze dryer sehingga diperoleh sari buah kental. Ekstrak etanol buah naga dan sari buah naga segar diuji aktivitas antioksidannya terhadap DPPH sebagai radikal bebas setelah didiamkan selama 60 menit pada suhu kamar dan panjang gelombang 516 nm.
Hasil karakteristik simplisia secara makroskopik berupa potongan-potongan kecil berwarna coklat kehitaman, bau karamel, rasa manis dan asam. Secara mikroskopik yaitu terlihat adanya epidermis, sel parenkim, kristal rapida, butir pati, sistolit, jaringan pengangkut dengan penebalan bentuk tangga dan rambut. Kadar air simplisia dan sari buah naga segar 7,65% dan 14,62%, kadar sari simplisia dan sari buah naga segar yang larut dalam air 63,59% dan 64,23%, kadar sari simplisia dan sari buah naga segar yang larut dalam etanol 57,96% dan 54,33%, kadar abu total 4,56%, dan kadar abu tidak larut dalam asam 0,04%.
Hasil skrining fitokimia dari daging buah naga mengandung senyawa gikosida, steroid/triterpenoid dan flavonoid.
Hasil uji aktivitas antioksidan terhadap radikal bebas DPPH dari sari buah naga segar pada konsentrasi 4000 ppm meredam 42,89%, 5000 ppm meredam 51,39%, 6000 ppm meredam 63,62% sehingga diperoleh IC50 4751,427 ppm. Ekstrak etanol buah naga pada konsentrasi 1000 ppm meredam 55,46%, 1500 ppm meredam 79,56%, 2000 ppm meredam 93,64% sehingga diperoleh IC50 975,501 ppm. Vitamin C pada konsentrasi 4 ppm meredam 51,07%, 5 ppm meredam 65,77%, 6 ppm meredam 69,71% sehingga diperoleh IC50 4,027 ppm. Hasil uji statistik dari data di atas menunjukkan sari buah naga segar, ekstrak etanol buah naga dan vitamin C tidak mempunyai perbedaan aktivitas antioksidan.
Simplicia Characterize and Phytochemical Screening with Antioxidant Activities Test of Ethanol Extract of
Dragon Fruit (Hylocereus undatus (Haw.)Britton & Rose)
ABSTRACT
The dragon fruit plant (Hylocereus undatus (Haw.) Britton & Rose) family of cactaceae has been cultivated at Indonesia and increasingly popular for the community. Unique and interesting fruit shape, red of shell and green turtle similar to the turtle’s of dragon, it was sweet, sour and fresh, contain chemical compounds such as vitamin C, vitamin A vitamin E and polyphenols that can lowered blood pressure, cholesterol and blood glucose level, it also prevent spreading of cancer cell.
In this study, had been done examination of simplicia characteristics, phytochemical screening and test the antioxidant activity for the dragon fruit ethanol extract and the fresh dragon fruit juice by 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method. The dragon fruit ethanol extract obtained by maceration method with 96% ethanol solvent. The fresh dragon fruit juice obtained by refining the flesh dragon fruit, added water, squeezed, filtered, dried use freeze dryer to obtain a viscous juice. The dragon fruit ethanol extract and fresh dragon fruit juice were tested antioxidant activity against DPPH as free radical after incubation for 60 minutes at room temperature and a wavelength of 516 nm.
The result of macroscopic characteristics simplicia was small pieces of brown to blackish, it was caramel smell, sweet and sour. in the visible presence microscopic was epidermis, parenchyimal cells, rapida crystals, sistolit, tissue transporter with a thickening of the stairs, amylum and trachoma. The simplicia and fresh dragon fruit juice have the water content value 7.65% and 14.62%, the water soluble extract value of the simplicia and fresh dragon fruit juice 63.93% and 64.23%. the ethanol soluble extract value of the simplicia and fresh dragon fruit juice 57.96% and 54.33%, the total ash of simplicia value was 4.56%, and the acid insoluble of simplicia ash value was 0.04%.
The result of phytochemical screening of dragon fruit flesh contain glycosides, triterpenoida/steroida and flavonoids.
The result of antioxidant activity test for radical DPPH from the fresh dargon fruit juice at 4000 ppm scavenger 42.89%, 5000 ppm scavenger 51.39%, 6000 ppm scavenger 63.62% and IC50 4751.427 ppm. The dragon fruit ethanol extract at 1000 ppm scavenger 55.46%, 1500 ppm scavenger 79.56%, 2000 ppm scavenger 93.64% and IC50 975.501 ppm.Vitamin C at 4 ppm scavenger 51.07%, 5 ppm scavenger 65.77%, 6 ppm scavenger 69.71% and IC50 4.027 ppm. The results of statistic test from the data above shown fresh dragon fruit juice, dragon fruit ethanol extract and vitamin C have not differences antioxidant activity.
BAB I
PENDAHULUAN
1.1Latar belakang
Masyarakat Indonesia telah menggunakan tumbuhan obat atau bahan alam
sejak dulu. Seiring dengan kemajuan ilmu pengetahuan dan teknologi, para
ilmuwan telah melakukan penelitian tentang khasiat tumbuhan obat dan
mengembangkan istilah kembali ke alam (back to nature). Tumbuhan obat banyak
tersedia di alam, diantaranya berupa buah-buahan dan sayur-sayuran yang
mengandung senyawa kimia sebagai antitoksik, antibakteri, antijamur, antioksidan
dan khasiat lainnya (Wijayakusuma, 2009).
Tumbuhan buah naga merupakan salah satu tumbuhan yang telah
dibudidayakan di pulau Jawa seperti di Jember, Malang, Pasuruan dan daerah
lainnya. Tumbuhan ini termasuk suku Cactaceae, batangnya bercabang banyak,
dapat tumbuh berdiri mengikuti penyangganya lalu menjuntai ke bawah. Pada
cabang tersebut muncul bunga yang akan menjadi buah. Bentuk buahnya unik dan
menarik, kulitnya merah dan bersisik hijau mirip sisik seekor naga sehingga
dinamakan buah naga atau dragon fruit. Jenis buah naga ada empat, yaitu
Hylocereus undatus (buah naga daging putih), Hylocereus costaricensis (buah
naga daging super merah), Hylocereus polyrhizus (buah naga daging merah),
Selenicereus megalanthus (buah naga kulit kuning daging putih). Kandungannya
adalah vitamin C, vitamin E, vitamin A dan polifenol berpotensi sebagai
antioksidan dan mencegah penyebaran sel kanker. Serat dapat menurunkan kadar
kolesterol dalam darah. Protein, karbohidrat, kalsium fosfor, magnesium dan air
Pada awalnya di Indonesia, buah naga hanya dikenal di kalangan
masyarakat Cina yang digunakan dalam upacara keagamaan karena dianggap
sebagai buah pembawa berkah, tetapi seiring dengan meluasnya informasi di
berbagai media televisi, radio, majalah, buku dan lain-lain, yang mempromosikan
buah naga sebagai buah berkhasiat obat, sekarang semakin disukai dan banyak
yang mengkonsumsinya (Anonim, 2009).
Metode untuk menentukan aktivitas antioksidan ada beberapa diantaranya
β-Carotene Bleaching Method (BCB Method) disebut juga Metode Pemutihan β-
karoten, Radical 1,1-diphenyl-2-picrylhydrazil (DPPH) Scavenging Method
(Metode penangkapan radikal DPPH), Thiobarbituric Acid Reactive Species Assay
(TBARS Assay), Induction Period of Lard Oxidation Assay (Rancimat assay).
Pada penelitian ini digunakan metode penangkapan radikal DPPH, merupakan
metode yang paling sederhana, cepat dan murah untuk mengukur kemampuan
antioksidan dalam meredam radikal bebas yang terdapat pada makanan,
buah-buahan dan sayur-sayuran (Prakash, 2001).
Berdasarkan uraian tersebut diatas, maka penulis tertarik untuk melakukan
penelitian terhadap buah naga yang berdaging putih sebagai antioksidan karena
buah ini banyak dibudidayakan di Indonesia dan mudah diperoleh dipasaran.
Penelitian meliputi karakterisasi simplisia, skirining fitokimia dan uji aktivitas
antioksidan terhadap sari buah naga segar dan ekstrak etanol buah naga, karena
sari buah naga segar merupakan minuman yang biasa dikonsumsi masyarakat,
1.2 Perumusan masalah
Berdasarkan latar belakang diatas maka perumusan masalahnya adalah:
a. Apakah karakteristik dan hasil skrining fitokimia simplisia buah naga
(Hylocereus undatus (Haw.) Britton & Rose), hasil penelitian ini dapat
dijadikan sebagai pembanding pada penelitian selanjutnya?
b. Apakah sari buah naga segar dan ekstrak etanol buah naga memiliki
aktivitas antioksidan?
c. Berapakah kemampuan antioksidan dari sari buah naga segar dan ekstrak
etanol buah naga dalam meredam radikal bebas dibandingkan dengan
vitamin C sebagai kontrol positif?
1.3 Hipotesis analisis
Berdasarkan perumusan masalah di atas maka dibuat hipotesis analisis yaitu:
a. Simplisia buah naga (Hylocereus undatus (Haw.) Britton & Rose)
mempunyai karakteristik dan hasil skrining fitokimia yang dapat
digunakan sebagai pembanding dalam melakukan karakterisasi dan
skrining fitokmia.
b. Sari buah naga segar dan ekstrak etanol buah naga mempunyai aktivitas
antioksidan.
c. Sari buah naga segar dan ekstrak etanol buah naga mempunyai aktivitas
antioksidan yang sama dengan baku pembanding vitamin C sebagai
1.4Tujuan penelitian
Tujuan penelitian ini adalah:
a. Untuk mengetahui karakteristik dan golongan senyawa kimia simplisia
buah naga (Hylocereus undatus (Haw.) Britton & Rose).
b. Untuk mengetahui aktivitas antioksidan dari sari buah naga segar dan
ekstrak etanol buah naga dalam meredam radikal bebas.
c. Untuk mengukur kemampuan antioksidan dari sari buah naga segar dan
ekstrak etanol buah naga dalam meredam radikal bebas dibandingkan
dengan vitamin C sebagai kontrol positif.
1.5 Manfaat penelitian
Manfaat yang diharapkan dari penelitian ini adalah:
a. Dapat memberikan informasi mengenai karakteristik dan golongan
senyawa kimia buah naga (Hylocereus undatus (Haw.) Britton & Rose).
b. Dapat menambah data penelitian dalam usaha pemanfaatan tumbuhan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Uraian tumbuhan meliputi daerah tumbuh (habitat), sistematika tumbuhan,
nama asing, nama daerah, morfologi tumbuhan, kandungan kimia dan kegunaan
dari tumbuhan.
2.1.1 Daerah tumbuh (habitat)
Tumbuhan buah naga berasal dari daerah beriklim tropis kering. Habitat
aslinya di Meksiko, Amerika Tengah dan Amerika Selatan bagian Utara, di
lingkungan hutan belantara yang teduh, ia tumbuh mengikuti batang tanaman
yang lain. Sekarang buah naga sudah dibudi dayakan di Indonesia mulai tahun
2000-an yaitu di daerah Mojokerto, Pasuruan, Malang, Jember, Banyuangi,
Ponorogo dan Batam (Cahyono, 2009).
Tumbuhan buah naga dapat tumbuh dan berbuah lebat dengan kualitas
buah yang baik bila ditanam pada daearah yang keadaan lingkungan (iklim dan
tanah) yang sesuai. Suhu udara untuk pertumbuhan buah naga 22°C-35°C,
kelembaban udaranya 40%-60%, ketinggian tempat pada dataran rendah sampai
medium 0-500 m dari permukaan laut, tekstur dan struktur tanah yaitu tanah liat
dan berpasir atau berkrikil, keadaan tanah yang mengandung zat besi berlebihan
dapat mengganggu pertumbuhannya dimana hal ini biasanya terjadi pada tanah
basah, sifat tanah yang baik aabila tanah banyak mengandung bahan orgaik
tanah(humus) dan organisme tanah (mikroba tanah) pengurai bahan organik tanah
2.1.2 Sistematika tumbuhan
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Cactales
Suku : Cactaceae
Genus : Hylocereus
Spesies : Hylocereus undatus (buah naga daging putih), Hylocereus
costaricensis (buah naga daging super merah), Hylocereus
polyrhizus (buah naga daging merah), Seleniceraus
megalanthus (buah naga kulit kuning daging putih)
(Cahyono, 2009).
2.1.3 Nama asing
Indonesia : Buah Naga, Pitaya
Inggris : Dragon Fruit
Vietnam : Thanh Long
Tailand : Kaeo Mangkon
(Anonim, 2009)
2.1.4 Nama daerah
Jawa Tengah : Wijaya kesuma (Depkes RI, 1999).
2.1.5 Morfologi tumbuhan
Batang : Segi tiga, bersayap tiga, berlekuk atau bergerigi, berduri
tajam, menyerupai akar lekat, kaku, hijau.
Bunga : Tunggal, tersebar, di ujung batang atau di batang, panjang
30-40 cm, tangkai silindris, bersegi, dengan seludah
bunga, panjang 14-18 cm, warna hijau kekuningan;
didasar kadang-kadang berwarna merah, bunga berumah
satu, mahkota berlepasan, panjang 13-15 cm, bagian
tengah putih, dipinggir putih atau merah muda.
Buah : Bentuk elips, panjang 7,5-12 cm, diameter 5,5-8 cm,
lunak warna merah dengan sisik kehijauan.
Biji : Bulat, elips, lunak, hijau.
Akar : Serabut, berwarna coklat kemerahan
(Depkes RI, 1999).
2.1.6 Kandungan kimia
Buah naga mengandung senyawa kimia seperti vitamin C, vitamin E,
vitamin A dan polifenol. Selain itu, buah naga juga merupakan sumber protein
dan karbohidrat. Secara lengkap zat-zat gizi yang terkandung dalam buah naga
dan nilai gizinya setiap 100 g bahan yang dapat dimakan adalah sebagai berikut:
protein 0,53 g; karbohidrat 11,50 g; serat 0,71 g; asam 0,139 g;vitamin C dan
beta-karoten 9,4 mg; kalsium 134,50 mg; fosfor 8,7 mg; magnesium 60,40 mg;
dan air 90,20 % (Cahyono, 2009).
2.1.7 Kegunaan buah naga
Adapun kegunaan buah naga dapat digolongkan, sebagai berikut:
Kapasitasnya sebagai bahan makanan, umumnya yang dikonsumsi daging
buah segar yang dipotong-potong sebagai makanan penutup dan kapasitasnya
sebagai bahan minuman, umumnya dikonsumsi dalam bentuk jus dan sari buah
2. Buah naga untuk pengobatan (terapi).
Buah naga mengandung senyawa kimia vitamin C, vitamin E, vitamin A
dan senyawa polifenol dapat berfungsi sebagai antioksidan dalam menangkap
radikal bebas. Kandungan lainnya adalah serat yang mampu menurunkan kadar
kolesterol dalam darah dan di saluran pencernaan mengikat asam empedu untuk
dikeluarkan bersama tinja. Adapun protein, karbohidrat, kalsium fosfor,
magnesium dan air berfungsi sebagai penyeimbang kadar gula darah bagi
penderita kencing manis (Cahyono, 2009).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari
jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya
bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan
tertentu (Harborne, 1987).
Ekstraksi dapat dilakukan dengan berbagai cara salah satunya maserasi.
Maserasi adalah proses ekstraksi menggunakan pelarut dengan beberapa kali
pengocokan atau pengadukan pada temperatur ruangan. Maserasi dilakukan
dengan merendam serbuk simplisia dalam cairan penyari, dimana cairan akan
berdifusi dengan dinding sel yang mengandung zat aktif. Pengadukan dilakukan
untuk menjaga adanya derajat perbedaan konsentrasi antara larutan di luar sel dan
2.3 Radikal bebas
Radikal bebas merupakan atom atau molekul yang sifatnya sangat tidak
stabil. Ketidakstabilan tersebut disebabkan karena atom atau molekul tersebut
memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas berusaha
untuk memiliki pasangan elektron, sehingga sifatnya sangat reaktif. Radikal bebas
cenderung menangkap elektron dari molekul lain dan kemudian membuat
senyawa baru yang tidak normal yang akan menyebabkan reaksi berantai
(Kosasih, 2004).
Radikal bebas meruakan atom yang tidak berpasangan. Zat ini merupakan
zat berbahaya yang sangat reaktif dapat merusak jaringan organ-organ tubuh
hingga menimbulkan berbagai penyakit. Setiap makhluk hidup akan
menghasilkan radikal bebas sebagai produk samping dari proses pembentukan
energi. Energi dihasilkan dari proses metabolisme dengan mengoksidasi zat-zat
makanan, seperti karbohidrat, lemak dan protein. Pada proses oksidasi inilah
radikal bebas ikut terproduksi. Selain dari proses metabolisme, radikal bebas juga
muncul pada setiap proses pembakaran, seperti merokok, memasak, pembakaran
bahan bakar pada mesin dan kenderaan bermotor (Dhani, 2007).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan
berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya dalam
makhluk hidup antara lain adalah golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), peroksidal (RO-2), peroksinitrit (ONOO-), asam
2.4 Antioksidan
Antioksidan adalah zat yang dapat menetralisir radikal bebas sehingga
atom yang tidak berpasangan mendapat pasangan elektron sehingga tidak reaktif
lagi. Antioksidan melumpuhkan radikal bebas dengan memberikan elektron
kepadanya sehingga tidak lagi menjadi radikal bebas pada bagian-bagian tubuh.
Antioksidan memusnahkan radikal bebas. Peran antioksidan adalah membantu
sistem pertahanan tubuh bila ada unsur pembangkit penyakit memasuki dan
menyerang tubuh (Kosasih,2004).
Antioksidan adalah senyawa yang dapat memberikan elektronnya kepada
molekul radikal bebas sehingga dapat memutus reaksi berantai dari radikal bebas.
Menurut sumbernya, terdapat tiga macam antioksidan yaitu (1) Antioksidan yang
diproduksi oleh tubuh; (2) Antioksidan alami yang dapat diperoleh dari tumbuhan
atau hewan; dan (3) Antioksidan sintetik yang dibuat dari bahan-bahan kimia
(Kumalaningsih, 2006).
Zat antioksidan yang alami terdapat pada sayur-sayuran, buah-buahan
segar, dan rempah-rempah, yaitu senyawa fenolik atau polifenol yang dapat
berupa golongan flavonoid, turunan asam sinamat beberapa mineral antara lain:
seng, selenium dan tembaga, beberapa vitamin antara lain: vitamin A, vitamin C,
vitamin E (Anonim, 2008).
Antioksidan juga digunakan untuk melindungi komponen makanan yang
bersifat tidak jenuh (mempunyai ikatan rangkap), terutama lemak dan minyak.
Mekanisme kerja antioksidan secara umum adalah menghambat oksidasi lemak.
I. Inisiasi
RH + initiator → R●
II. Propagasi
R● + O2 → ROO●
R● + RH → ROOH + R●
III. Terminasi
R● + R●→ RR
ROO● + R●→ ROOR (Almatsier, 2004).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik
atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat,
kumarin, tokoferol, dan asam-asam organik. Senyawa antioksidan alami
polifenolik dapat bereaksi sebagai pereduksi, penangkap radikal bebas, pengkelat
logam, dan peredam terbentuknya singlet oksigen (Kumalaningsih, 2006).
2.4.1 Vitamin C
Gambar 2.1 Rumus Bangun Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 178,13 dengan
rumus bangun C6H8O6, dengan titik lebur lebih kurang 190°C. Asam askorbat
mengandung tidak kurang dari 99,0% dan tidak lebih dari 100,5% C6H8O6.
Pemerian: serbuk atau hablur putih atau agak kuning. Oleh pengaruh cahaya
cepat teroksidasi. Kelarutan: mudah larut dalam air, agak sukar larut dalam etanol;
tidak larut dalam kloroform, dalam eter dan dalam benzen. Penyimpanan dalam
wadah tertutup rapat, tidak tembus cahaya (Ditjen POM, 1995).
Vitamin C merupakan suatu antioksidan penting yang larut dalam air. Ada
2 sifat penting vitamin C sebagai antioksidan. Pertama, karena mempunyai
potesial reduksi yang rendah, askorbat dan radikal askorbil mampu bereaksi
dengan radikal biologis dan mereduksi oksidan-oksidan. Kedua, stabilitas dan
reaktivitas radikal askorbil yang rendah. Mekanisme vitamin C bekerja sebagai
antioksidan adalah dengan mendonorkan hidrogen dari gugus hidroksilnya
(Silalahi, 2006).
2.4.2 Vitamin A
Gambar 2.2 Rumus Bangun Vitamin A
Vitamin A mengandung bentuk vitamin A yang sesuai (C20H30O; vitamin
A alkohol) mempunyai aktivitas vitamin A tidak kurang dari 95,0% dari jumlah
yang tertera pada etiket. Pemerian dalam bentuk cair berupa minyak berwarna
kuning muda sampai merah yang dapat memadat pada pendinginan. Dalam bentuk
padat mempunyai penampilan seperti pengencer yang ditambahkan; praktis tidak
berbau atau sedikit berbau ikan, tetapi tidak berasa atau berbau tengik. Tidak
stabil terhadap udara dan cahaya. Dalam bentuk cair tidak larut dalam air dan
dalam gliserin; sangat larut dalam kloroform dan dalam eter; larut dalam etanol
Vitamin A adalah istilah umum untuk suatu kelompok senyawa yang
memiliki aktivitas biologi dari retinol. Sumber utama vitamin A adalah pigmen
karotenoid (α-karoten, β-karoten dan β-kriptoxantin). Diantara semua senyawa
karotenoid, β-karoten yang paling efisien diubah menjadi retinol. α-karoten dan β
-kriptoxantin juga diubah menjadi vitamin A, tetapi tidak seefisien β-karoten
(ODS, 2006).
Vitamin A bersifat sebagai antioksidan karena dapat mendonorkan
elektronnya kepada radikal bebas. Mekanisme kerja vitamin A sebagai
antioksidan adalah dengan pemutusan ikatan rangkap (Silalahi, 2006).
2.4.3 Polifenol
Keterangan: R = -OH
Gambar 2.3 Struktur Dasar Polifenol
Senyawa fenol didefinisikan secara kimia sebagai adanya paling tidak satu
cincin aromatik yang membawa satu (fenol) atau lebih (polifenol) gugus hidroksil.
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan. Zat ini
memiliki tanda khas yakni memiliki banyak gugus fenol dalam molekulnya.
Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas dengan
melengkapi kekurangan elektron yang dimiliki radikal bebas, dan menghambat
terjadinya reaksi berantai dari pembentukan radikal bebas. Mekanisme senyawa
polifenol sebagai antioksidan adalah dengan mendonorkan hidrogen dari gugus
hidroksilnya. Polifenol merupakan komponen yang berperan terhadap aktivitas
2.4.4Senyawa flavonoida
Senyawa flavonoida merupakan senyawa polifenol yang mengandung 15
atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6 – C3 – C6,
yaitu 2 cincin aromatik yang dihubungkan oleh satuan 3 karbon yang dapat atau
tidak dapat membentuk cincin ketiga (Markham, 1988).
Gambar 2.4 Kerangka flavonoida
Flavonoida terdapat dalam tumbuhan sebagai campuran dari flavonoida
yang berbeda golongan dan jarang sekali dijumpai hanya flavonoid tunggal.
Flavonoida pada tumbuhan terdapat dalam berbagai bentuk struktur molekul
dengan beberapa bentuk kombinasi glikosida. Oleh karena itu, dalam
menganalisis flavonoida lebih baik memeriksa aglikon yang telah terhidrolisis
daripada dalam bentuk glikosida dengan strukturnya yang rumit dan kompleks
(Harborne, 1987). Sistem penomoran untuk turunan flavonoida adalah:
Gambar 2.5 Struktur dasar flavonoida
2.5 Spektrofotometri UV-Visibel
Spektrofotometer pada dasarnya terdiri dari sumber sinar, monokromator,
sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
spektrofotometri ultraviolet dengan panjang gelombang 190-380 nm dan visibel
(cahaya tampak) dengan panjang gelombang 380-780 nm (Ditjen POM, 1979).
Ahli kimia telah lama menggunakan warna sebagai bantuan dalam
mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai perluasan suatu
pemeriksaan visual, yaitu dengan menggunakan alat untuk mengukur absorpsi
energi radiasi macam-macam zat kimia dan memungkinkan dilakukannya
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day,
1994).
2.6 Penentuan Aktivitas Antioksidan dengan Metode Penangkapan Radikal
Bebas DPPH
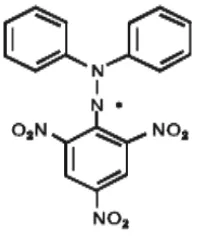
Gambar 2.6 Rumus Bangun DPPH
DPPH pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan
Renn. DPPH berwarna ungu pekat seperti KMnO4 dan bentuk tereduksinya
1,1-diphenyl-2-picrylhydrazine (DPPH-H) berwarna jingga kekuningan. DPPH
bersifat tidak larut dalam air (Ionita, 2005).
Metode DPPH adalah sebuah metode yang sederhana yang dapat
digunakan untuk menguji kemampuan antioksidan yang terkandung dalam
makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan juga
memberikan serapan maksimum pada panjang gelombang 517 nm yang berwarna
ungu. Warna ini akan berubah dari ungu menjadi kuning lemah apabila elektron
ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa
antioksidan. Perubahan warna ini berdasarkan reaksi kesetimbangan kimia
(Prakash, 2001).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004).
2.6.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji
sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.6.2 Pengukuran Absorbansi – Panjang Gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515-520 nm. Bagaimanapun dalam
prakteknya hasil pengukuran yang memberikan peak maksimum maka itulah
panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas.
Nilai absorbansi yang mutlak tidaklah penting, karena panjang gelombang dapat
diatur untuk memberikan absorbansi maksimum sesuai dengan alat yang
2.6.3 Waktu Pengukuran
Pada awalnya lama pengukuran menurut beberapa literatur, yang
direkomendasikan adalah selama 30 menit dan ini telah dilakukan dalam beberapa
penelitian khususnya belakangan ini, waktu pengerjaan terpendek yaitu 5 menit
atau 10 menit. Waktu pengukuran digunakan sebagai parameter untuk
mengevaluasi aktivitas antioksidan sampel sebagai rujukan untuk digunakan pada
penelitian-penelitian berikutnya (Molyneux, 2004).
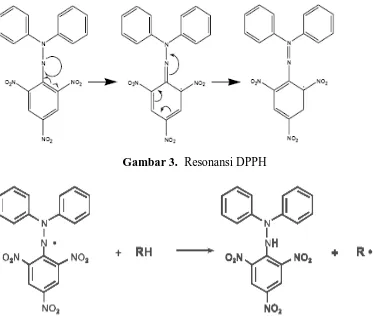
Berikut ini dapat dilihat resonansi DPPH dan reaksi DPPH dengan atom H
netral yang berasal dari senyawa-senyawa yang bersifat antioksidan:
Gambar 3. Resonansi DPPH
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Penelitian meliputi
identifikasi bahan tumbuhan, pengumpulan bahan tumbuhan, pembuatan
simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan sari buah naga
segar dan ekstrak etanol buah naga, pengujian aktivitas antioksidan dari sari buah
naga segar dan ekstrak etanol buah naga dengan metode aktivitas penangkapan
radikal bebas 1,1-Diphenyl-2-Picrylhidrazyl (DPPH) secara spektrofotometri UV-
visibel.
3.1 Alat
Alat-alat yang digunakan terdiri dari alat-alat gelas laboratorium,
spektofotometer UV-Visible (Shimadzu 1800), rotary evaporator (Heidolph VV
2000), freeze dryer (Modulyo/Edwards), oven listrik (Strok), neraca kasar
(Ohaus), neraca analitis (Vibra), blender (National), penangas air (Yenaco),
seperangkat alat penetapan kadar air, desikator, cawan porselin, mikroskop, lemari
pengering, krus tang dan pisau.
3.2 Bahan
Bahan yang digunakan pada penelitian ini adalah buah naga segar yang
sudah matang. Bahan-bahan kimia lainnya yang berkualitas pro analisis adalah
1,1-diphenyl-2-picrylhydrazyl (DPPH)(Sigma), vitamin C (Scharlau), produksi
E-Merck: metanol, toluen, kloroform, isopropanol, benzen, n-heksan, asam nitrat
anhidrida, natrium hidroksida, amil alkohol, natrium sulfat anhidrat, serbuk
magnesium. Bahan kimia berkualitas teknis; etanol 96% dan air suling.
3.3 Penyiapan bahan tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan,
identifikasi tumbuhan, dan pembuatan simplisia buah naga.
3.3.1 Pengumpulan bahan tumbuhan
Metode pengumpulan bahan tumbuhan dilakukan secara purposif yaitu
tanpa membandingkan dengan bahan tumbuhan yang sama dari daerah lain.
Bahan tumbuhan yang digunakan adalah buah naga segar berdaging putih yang
sudah matang, diperoleh dari Pasar Buah Brastagi, Jln. Gatot Subroto, Medan.
3.3.2 Identifikasi tumbuhan
Identifikasi buah naga daging putih dilakukan di Herbarium Bogoriense,
Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Bogor, Jl. Raya Jakarta-Bogor. Hasil identifikasi tumbuhan dapat dilihat
pada Lampiran 1, halaman 43 dan Gambar tumbuhan dapat dilihat pada Lampiran
2, halaman 44.
3.3.3 Pembuatan simplisia
Cara pembuatan simplisia yaitu, buah naga segar dikumpulkan, dicuci
dengan air sampai bersih, dikupas kulitnya, dipotong-potong dengan ukuran
panjang 4-5 cm, lebar 3-4 cm dan tebal 0,2-0,3 cm, lalu ditimbang sebagai berat
basah, dikeringkan dalam lemari pengering pada suhu 40°C, setelah kering bahan
ditimbang sebagai berat kering, selanjutnya diserbuk menggunakan blender.
pada tempat yang terlindung dari cahaya matahari. Bagan kerja penelitian dapat
dilihat pada Lampiran 3, halaman 45.
3.4. Pembuatan larutan pereaksi
3.4.1 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air
suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.2 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml,
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.3 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam
20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium
iodida lalu dilarutkan dalam 50 ml air suling, kemudian kedua larutan
dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih
diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen
POM, 1995).
3.4.4 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, kemudian dilarutkan dalam asam nitrat
3.4.5 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai
100 ml (Ditjen POM, 1995).
3.4.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 ml (Ditjen POM, 1995).
3.4.8 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.4.9 Larutan pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.10 Larutan pereaksi kloralhidrat
Sebanyak 8 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 10
ml air suling (Ditjen POM, 1995).
3.4.11 Larutan pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampur dengan 1 bagian
3.4.12 Larutan DPPH 0,5 mM
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol
hingga diperoleh volume larutan 100 ml (Konsentrasi 200 µg/ml) (Molyneux,
2004).
3.5 Pemeriksaan karakteristik simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut
dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu
total, penetapan kadar abu yang tidak larut dalam asam. Hasil karakteristik
simplisia dan sari buah naga segar dapat dilihat pada Tabel 4.1, halaman 33.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan memperhatikan bentuk,
ukuran, bau, rasa dan warna simplisia buah naga. Gambar makroskopik buah naga
dapat dilihat pada Lampiran 4, halaman 46.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap penampang melintang
jaringan segar dari buah naga dengan cara, 2-3 tetes larutan kloralhidrat diteteskan
di atas kaca objek lalu sayatan jaringan segar diletakkan diatasnya, kemudian
ditutup dengan kaca penutup, lalu diamati di bawah mikroskop. Demikian
dilakukan hal yang sama terhadap serbuk simplisia buah naga. Gambar
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi. Alat terdiri dari
labu alas bulat 500 ml, alat penampung dan pendingin, tabung penyambung dan
penerima 10 ml.
Cara kerja:
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama, dimasukkan
ke dalam labu yang berisi toluen jenuh tersebut, lalu dipanaskan hati-hati selama
15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap
detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi
dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam
pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian
tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen
memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua
volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan
yang diperiksa. Kadar air dihitung dalam persen (v/b), demikian dilakukan hal
yang sama terhadap sari buah segar (WHO, 1998). Hasil perhitungan kadar air
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter)
menggunakan labu bersumbat sambil sesekali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam. Saring, 20 ml filtrat dipipet, diuapkan sampai
kering dalam cawan penguap yang berdasar rata yang telah ditara dan dipanaskan
pada suhu 105ºC sampai bobot tetap. Kadar sari yang larut dalam air dihitung
dalam persen terhadap bahan yang telah dikeringkan di udara, demikian dilakukan
hal yang sama terhadap sari buah segar (Ditjen POM, 1995). Hasil perhitungan
kadar sari yang larut dalam air dapat dilihat pada Lampiran 6, halaman 50-51.
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dengan 100 ml etanol 95% menggunakan labu bersumbat sambil sesekali
dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Saring, 20 ml
filtrat dipipet, diuapkan sampai kering dalam cawan penguap yang berdasar rata
yang telah ditara dan dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar sari
yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah
dikeringkan di udara, demikian dilakukan hal yang sama terhadap sari buah segar
(Ditjen POM, 1995). Hasil perhitungan kadar sari yang larut dalam etanol dapat
dilihat pada Lampiran 6, halaman 52-53.
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan
di udara (Ditjen POM, 1995). Hasil perhitungan kadar abu total dapat dilihat pada
Lampiran 6, halaman 54.
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
Hasil perhitungan karakteristik sampel dapat dilihat pada Lampiran 6, halaman
55.
3.6 Skrining Fitokimia
Skirining fitokimia meliputi pemeriksaan senyawa golongan alkaloida,
glikosida, flavonoid, steroid/triterpenoid, saponin, tannin dan antrakinon.
3.6.1 Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung
reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
Pada tabung III : ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga
dari percobaan di atas (Ditjen POM, 1995).
3.6.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, disari dengan 30 ml campuran
dari 7 bagian etanol 95% dengan 3 bagian air suling (7:3) dan 10 ml asam klorida
2N. Kemudiaan direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20
ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok,
didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol
dan kloroform (2:3), perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan
dan ditambahkan Na2SO4 anhidrat, disaring, kemudiaan diuapkan pada temperatur
tidak lebih dari 500C, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa
digunakan untuk percobaan berikut, 0,1 larutan percobaan dimasukkan dalam
tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2
ml air dan 5 tetes larutan perekasi Molish, lalu ditambahkan dengan
perlahan-lahan 2 ml asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada
batas kedua cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida
(Ditjen POM, 1995).
3.6.3 Pemeriksaan triterpenoid/steroid
Sebanyak 1 g sebuk simplisia ditimbang, dimaserasi dengan 20 ml
n-heksan selama 2 jam, disaring , lalu filtrat diuapkan dalam cawan penguap. Pada
menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu
menunjukkan adanya triterpenoid (Harborne, 1987).
3.6.4 Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia ditimbang, dilarutkan 100 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas. Ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml
amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.5 Pemeriksaaan tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling
lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tannin (Ditjen
POM, 1995)
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan ke dalam tabung
reaksi, ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok
kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang
dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam
klorida 2N buih tidak hilang (Ditjen POM, 1995).
3.6.7 Pemeriksaan antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, dicampur dengan 5 ml asam
sulfat 2N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen,
dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan
benzene menunjukkan adanya antrakinon (Ditjen POM, 1995). Hasil skrining
terdapat pada table 4.2, halaman 34.
3.7 Pembuatan sari buah naga segar dan ekstrak etanol buah naga
3.7.1 Pembuatan sari buah naga segar
Sebanyak 200 g daging buah naga segar dihaluskan menggunakan blender,
ditambah air secukupnya, lalu diperas melalui kain kasa, hasil perasan ditampung
dalam beker gelas, disaring, kemudian diukur volumenya.
Sari buah dibekukan di freezer, selanjutnya dipekatkan di freeze dryer
sampai diperoleh sari buah naga yang kental. Bagan pembuatan sari buah naga
segar dapat dilihat pada Lampiran 7, halaman 57.
3.7.2 Pembuatan ekstrak etanol buah naga
Pembuatan ekstrak dilakukan secara maserasi dengan pelarut etanol 96%,
Caranya, sebanyak 200 g serbuk simplisia dimasukkan ke dalam wadah kaca,
dituangi dengan 1500 ml etanol 96%, ditutup, dibiarkan selama 5 hari terlindung
dari cahaya sambil sesekali diaduk. Setelah 5 hari campuran tersebut diserkai.
Ampas dicuci dengan etanol 96% secukupnya hingga diperoleh 2000 ml.
Pindahkan dalam bejana tertutup dan dibiarkan di tempat sejuk terlindung dari
cahaya selama 2 hari, kemudian dienaptuangkan lalu disaring.
Maserat dipekatkan menggunakan alat rotary evaporator pada suhu 40°C
sampai diperoleh ekstrak pekat kemudian dikeringkan menggunakan freeze dryer
sehingga diperoleh ekstrak kental (Ditjen POM, 1986) Bagan pembuatan ekstrak
3.8 Pengujian kemampuan antioksidan dengan spektrofotometri UV- visibel
3.8.1 Prinsip metode penangkapan radikal bebas (DPPH)
Kemampuan sampel uji dalam meredam proses oksidasi
1,1-diphenyl-2-picrylhydrazil (DPPH) sebagai radikal bebas dalam larutan metanol (sehingga
terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50
(konsentrasi sampel uji yang mampu meredam radikal bebas 50%) digunakan
sebagai parameter untuk menentukan aktivitas antioksidan sampel uji.
3.8.2 Pembuatan larutan DPPH 0,5 mM
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml,
kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan
metanol sampai garis tanda (konsentrasi 40 µg/ml).
3.8.3 Pembuatan larutan induk
3.8.3.1 Pembuatan larutan induk sampel uji
Sebanyak 500 mg sampel uji (ekstrak kental) ditimbang, dimasukkan ke
dalam labu tentukur 50 ml dilarutkan dengan metanol lalu volumenya dicukupkan
dengan metanol sampai garis tanda (konsentrasi 10000 µg/ml).
3.8.3.2 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu
tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 1000 µg/ml).
3.8.4 Pembuatan Larutan Uji
3.8.4.1 Larutan uji sari buah naga segar
Larutan induk dipipet sebanyak 10 ml; 12,5 ml; 15 ml ke dalam labu ukur
µg/ml, kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5
mM (konsentrasi 40 µg/ml) lalu volumenya dicukupkan dengan metanol sampai
garis tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan
spektrofotometer UV-visibel, panjang gelombang 516 nm.
3.8.4.2 Larutan uji ekstrak etanol buah naga
Larutan induk dipipet sebanyak 2,5 ml; 3,8 ml;5 ml ke dalam labu ukur 25
ml untuk mendapatkan konsentrasi larutan uji 1000 µg/ml, 1500 µg/ml, 2000
µg/ml, kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5
mM (konsentrasi 40 µg/ml) lalu volumenya dicukupkan dengan metanol sampai
garis tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan
spektrofotometer UV-visibel, panjang gelombang 516 nm.
3.8.4.3 Larutan uji vitamin C
Larutan induk dipipet sebanyak 0,2 ml; 0,13 ml; 0,15 ml ke dalam labu
ukur 25 ml untuk mendapatkan konsentrasi larutan uji 4 µg/ml, 5 µg/ml, 6 µg/ml,
kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM
(konsentrasi 40 µg/ml) lalu volumenya dicukupkan dengan metanol sampai garis
tanda. Pengukuran dilakukan setelah didiamkan selama 60 menit menggunakan
spektrofotometer UV-visibel, panjang gelombang 516 nm.
3.8.5 Penentuan persen peredaman radikal bebas DPPH
Penentuan aktivitas penangkapan radikal bebas dari sampel uji
menggunakan metode penangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil
(DPPH). Hasil aktivitas penangkap radikal ekstrak etanol serbuk simplisia buah
Besarnya aktivitas penangkap radikal bebas dihitung dengan rumus:
% inhibisi =
Akontrol Asampel
Akontrol )
( −
x 100%
Keterangan: Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
3.8.6 Penentuan Nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas penangkapan
radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
menggambarkan besarnya konsentrasi senyawa uji yang dapat menagkap radikal
bebas sebesar 50%. Hasil perhitungan dimasukkan ke dalam persamaan regresi
dengan konsentrasi (µg/ml) ekstrak sebagai absis (sumbu x) dan nilai % inhibisi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil identifikasi tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Bogor menunjukkan bahwa sampel termasuk spesies Hylocereus undatus
(Haw.) Britton & Rose, suku Cactaceae.
4.2 Hasil karakteristik simplisia
Hasil karakteristik simplisia secara makroskopik adalah berupa
potongan-potongan berwarna coklat kehitaman, bau karamel, rasa manis dan asam.
Karakteristik secara makroskopik dari buah naga yaitu berbentuk elips dan bulat,
panjang 17-20 cm, diameter 12-14 cm, lunak, warna kulitnya merah dengan sisik
hijau, dagingnya berwarna putih, harum, rasa manis, asam dan segar, bijinya
berwarna hitam, bentuk elips dan bulat, lunak.
Hasil pemeriksaan mikroskopik yaitu terlihat adanya epidermis, jaringan
parenkim, kristal rapida, butir pati, sistolit, rambut dan jaringan pengangkut
dengan penebalan bentuk tangga.
Hasil pemeriksaan kadar sari larut air, kadar sari larut etanol, kadar abu
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia buah naga dan sari buah naga
Hasil pada tabel diatas menunjukkan bahwa kadar air pada simplisia buah
naga lebih kecil dibandingkan sari buah naga segar, karena simplisia telah
dikeringkan dan memenuhi syarat kadar air simplisisa dari buah, sedangkan sari
buah naga segar masih mengandung air yang banyak. Hasil penetapan kadar air
simplisia buah naga (7,65%) memenuhi persyaratan simplisia tidak melebihi 10
%. Kadar air yang melebihi persyaratan memungkinkan terjadinya pertumbuhan
jamur atau mikroba (Ditjen POM, 1995).
Kadar sari yang larut dalam air lebih besar daripada kadar sari yang larut
dalam etanol baik pada simplisia buah naga maupun sari buah naga segar, hal ini
menunjukkan senyawa yang bersifat polar lebih banyak larut dalam simplisia dan
sari buah naga segar. Monografi dari simplisia buah naga tidak ditemukan di buku
Materia Medika Indonesia.
Pemeriksaan kadar sari larut dalam air untuk mengetahui kadar senyawa
yang bersifat polar dalam simplisia, kadar sari larut dalam etanol untuk
mengetahui kadar senyawa yang bersifat polar dan non polar dalam simplisia,
pemeriksaan kadar abu total untuk mengetahui kadar senyawa anorganik dalam
simplisia, pemeriksaan kadar abu tidak larut dalam asam untuk mengetahui kadar
4.3 Hasil skrining fitokimia
Hasil skrining fitokimia dari simplisia dan daging buah naga menunjukkan
adanya golongan senyawa-senyawa kimia dapat dilihat pada Tabel 4.2 berikut ini:
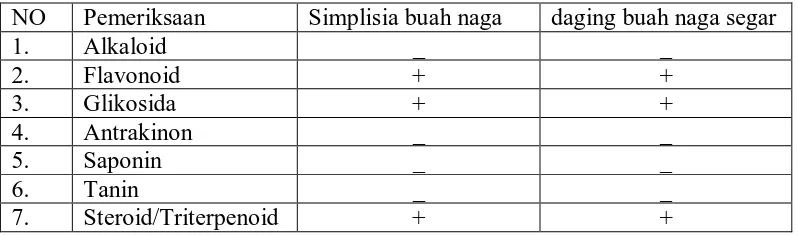
Tabel 4.2 Hasil pemeriksaan skrining fitokimia buah naga
NO Pemeriksaan Simplisia buah naga daging buah naga segar
1. Alkaloid _ _
Keterangan: (+): mengandung golongan senyawa (-): tidak mengandung golongan senyawa
Hasil pada tabel diatas menunjukkan bahwa daging buah naga berwarna
putih mengandung senyawa glikosida, steroid/tritperenoid dan flavonoid.
Senyawa kimia yang memiliki potensi sebagai antioksidan diperoleh dari vitamin
A, vitamin E, vitamin C dan polifenol yang dapat menetralkan radikal bebas.
Senyawa tersebut bertindak sebagai penangkap radikal bebas, Gugus hidroksil
yang dikandungnya mendonorkan hidrogen kepada radikal bebas (Silalahi, 2006).
Senyawa antioksidan alami dari tumbuhan, diantaranya senyawa fenolik
atau polifenol yang dapat berupa golongan flavonoid (Kumalaningsih, 2006).
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan gula
yang terdiri dari satu atau lebih gugus hidroksil fenolik. Flavonoid terdapat pada
seluruh bagian tanaman, termasuk pada buah, tepung sari dan akar. Golongan
flavonoid di antaranya adalah isoflavon yang dapat bekerja sebagai diuretik dan
4.4 Hasil analisis aktivitas antioksidan sampel uji
Pengukuran aktivitas antioksidan terhadap sampel uji dilakukan secara
spektrofotometri pada panjang gelombang 516 nm. Larutan DPPH dalam metanol
menghasilkan serapan maksimum pada panjang gelombang 516 nm, termasuk
dalam kisaran panjang gelombang sinar tampak (400-750 nm) (Rohman, 2007).
Hasil uji aktivitas antioksidan diperoleh dari hasil pengukuran absorbansi
DPPH yaitu adanya penurunan absorbansi DPPH tersebut oleh sampel uji. Untuk
melihat hubungan absorbansi DPPH terhadap konsentrasi larutan uji dalam
menganalisis aktivitas antioksidan yang dapat meredam radikal bebas DPPH dapat
dilihat pada Tabel 4.3, 4.4. dan 4.5 berikut ini:
Tabel 4.3 Aktivitas antioksidan sari buah naga segar
Konsentrasi Sampel
(ppm)
Absorbansi DPPH Absorbansi sampel % Peredaman % peredam
Tabel 4.4 Aktivitas antioksidan ekstrak etanol buah naga
Konsentrasi Sampel
(ppm)
Absorbansi DPPH Absorbansi sampel % Peredaman % peredam
Tabel 4.5 Aktivitas antioksidan vitamin C
Konsentrasi Sampel
(ppm)