KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
BUAH PAPRIKA (Capsicum annum L. cv.group grossum)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
umatera Uta
OLEH:
HELEN SALVIANI
NIM 091501019
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
BUAH PAPRIKA (Capsicum annum L. cv.group grossum)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
jukan untuk mUniversitas Sumatera Uta
OLEH:
HELEN SALVIANI
NIM 091501019
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
BUAH PAPRIKA (Capsicum annum L. cv.group grossum)
OLEH:
HELEN SALVIANI NIM 091501019
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 21 Desember 2013
Pembimbing I, Panitia Penguji,
Prof. Dr. Rosidah, M.Si., Apt.
Prof. Dr. Urip Harahap, Apt. NIP 195103261978022001 NIP 195301011983031004
Pembimbing II, Prof. Dr. Rosidah, M.Si., Apt.
NIP 195103261978022001
Dra. Suwarti Aris, M.Si., Apt. Drs. Rasmadin Mukhtar, M.S., Apt. NIP 195107231982032001 NIP 194909101980031002
Drs. Awaluddin Saragih, M.Si., Apt. NIP 195008221974121002
Medan, Januari 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan karunia yang
berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang
berjudul Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas
Antioksidan Ekstrak Etanol Buah Paprika (Capsicum annum L. cv.group
grossum). Skripsi ini diajukan untuk melengkapi salah satu syarat untuk
memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan
fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga
mengucapkan terima kasih kepada Ibu Prof. Dr. Rosidah, M.Si., Apt., dan Ibu
Dra. Suwarti Aris, M.Si., Apt., yang telah membimbing penulis dengan penuh
kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama
penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis
sampaikan kepada Bapak Prof. Dr. Urip Harahap, Apt., selaku ketua penguji,
Bapak Drs. Rasmadin Mukhtar, M.S., Apt., dan Bapak Drs. Awaluddin Saragih,
M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk
menyempurnakan skripsi ini, dan Bapak Drs. Suryanto, M.Si., Apt., selaku dosen
penasehat akademik yang telah banyak membimbing penulis selama masa
perkuliahan hingga selesai.
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga
Taufik Hidayat, kakakku Indah Mayang Sari, adikku Yohana Permata Sari, yang
telah memberikan semangat dan kasih sayang yang tak ternilai dengan apapun.
Penulis juga mengucapkan terima kasih kepada teman-teman mahasiswa/i
Farmasi Klinis dan Komunitas 2009 yang selalu mendoakan, memberi dukungan,
dan semangat.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Januari 2014 Penulis,
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Buah Paprika
(Capsicum annum L. cv.group grossum)
Abstrak
Buah paprika (Capcisum annum L. cv.group grossum) merupakan salah satu komoditi penting yang berkembang saat ini. Selain digunakan sebagai keperluan bahan pangan karena mengandung zat gizi yang cukup lengkap, seperti protein, lemak, karbohidrat, mineral dan vitamin, paprika juga mengandung senyawa-senyawa yang berkhasiat obat diantaranya untuk meredakan nyeri dan memperlancar aliran darah. Tujuan penelitian adalah untuk mengetahui karakteristik simplisia, skrining fitokimia dan ekstraksi secara perkolasi serta aktivitas antioksidan dari ekstrak etanol buah paprika merah, kuning dan hijau dengan menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2 -picrylhydrazil (DPPH) dan metode β-karoten-asam linoleat.
Pengujian aktivitas antioksidan ekstrak etanol buah paprika (EEBP) dengan menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2 -picrylhydrazil (DPPH). EEBP didiamkan selama 60 menit pada suhu kamar lalu diukur absorbansinya pada panjang gelombang 516 nm dan pembanding yang digunakan adalah vitamin C. Pengujian juga dilakukan dengan menggunakan
metode β-karoten-asam linoleat yaitu diukur pada waktu 0-120 menit dengan
interval waktu 15 menit pada panjang gelombang 470 nm. Sebagai pembanding digunakan butil hidroksitoluena (BHT) dan kuersetin.
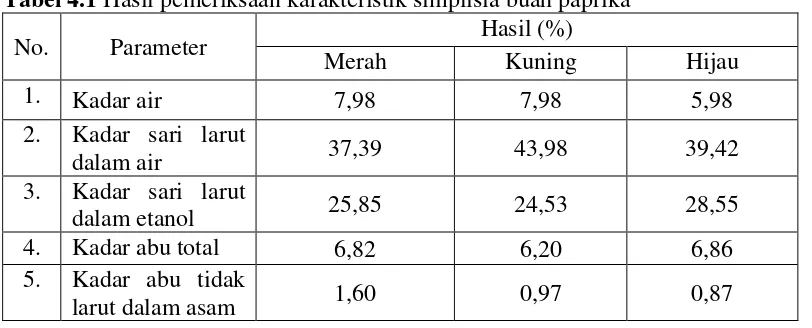
Hasil karakterisasi simplisia buah paprika merah, kuning dan hijau berturut-turut diperoleh kadar air 7,98%; 7,98%; 5,98%, kadar sari yang larut dalam air 37,39%; 43,98%; 39,42%, kadar sari yang larut dalam etanol 25,85%; 24,53%; 28,55%, kadar abu total 6,82%; 6,20%; 6,86% dan kadar abu yang tidak larut dalam asam 1,60%; 0,97%; 0,87%. Hasil karakterisasi ekstrak etanol buah paprika merah, kuning dan hijau berturut-turut diperoleh kadar air 21,29%; 20,52%; 19,24%, kadar abu total 5,44%; 4,72%; 5,04% dan kadar abu yang tidak larut dalam asam 0,54%; 0,45%; 1,60%. Skrining fitokimia diperoleh bahwa buah paprika mengandung senyawa flavonoid, glikosida, dan steroid/triterpenoid.
Hasil pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa EEBP memiliki nilai IC50 sebesar 260,42 ppm (EEBPH), 209,76 ppm (EEBPM) dan 218,77 ppm (EEBPK) serta vitamin C sebesar 4,73 ppm. Hasil pengujian aktivitas antioksidan dengan metode β-karoten-asam linoleat diperoleh aktivitas antioksidan hidroksitoluena (BHT) 100 ppm > kuersetin 100 ppm > EEBPM 3000 ppm > EEBPK 3000 ppm > EEBPH 3000 ppm.
Simplex Characterization and Phytochemicals Screening and Antioxidant Activity of Ethanol Extract of Bell peppers
(Capsicum annum L. cv.group grossum)
Abstract
Bell peppers (Capcisum annuum L. cv.group grossum) are one of the essential developing commodities today. Besides being used as a food purposes because it contains a fairly complete nutrients, such as proteins, fats, carbohydrates, minerals and vitamins, bell peppers also contain medicinal compounds to relieve pain and improving blood flow. The objective of the research was to determine the characteristics, phytochemical screening, percolation extraction and antioxidant activity of ethanol extract of red, yellow and green bell peppers using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavengingmethod and β-carotene-linoleic acid method.
The antioxidant activity tests of the ethanol extract of bell peppers (EEBP) using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavenging method. EEBP was incubated for 60 minutes at room temperature and its absorbance was measured at a wavelength of 516 nm and the results were compared to vitamin C.
Tests were also performed using β-carotene-linoleic acid method which was measured at 0-120 minutes with 15-minute intervals at a wavelength of 470 nm. The results were compared to butyl hydroxytoluena (BHT) and quercetin.
The results of the characterization of simplex red, yellow and green bell peppers water content was 7.98%, 7.98%, 5.98%, water-soluble extract content was 37.39%, 43.98%, 39.42%, ethanol-soluble extract content was 25.85%, 24.53%, 28.55%, total ash content was 6.82%, 6.20%, 6.86% and acid-insoluble ash content was 1.60%, 0.97%, 0.87%. The results of the characterization of ethanol extract red, yellow and green bell peppers water content was 21.29%; 20.52%; 19.24%, total ash content was 5.44%; 4.72%; 5.04% and acid-insoluble ash content was 0.54%; 0.45%; 1.60%. The result of phytochemical screening showed that simplex contained flavonoids, glycosides, and steroids/triterpenoids.
The results of antioxidant activity tests using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavenging method showed that EEBP has IC50 value 260.42 ppm (EEBPH), 209.76 ppm (EEBPM) and 218.77 ppm (EEBPK) and vitamin C 4.73 ppm. The test results of antioxidant activity by the β -carotene-linoleic acid method antioxidant activity obtained butyl hydroxytoluene (BHT) 100 ppm > quercetin 100 ppm > EEBPM 3000 ppm > EEBPK 3000 ppm > EEBPH 3000 ppm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 5
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 6
1.6 Kerangka Pikir Penelitian ... 7
BAB II TINJAUAN PUSTAKA ... 8
2.1 Uraian Tumbuhan ... 8
2.1.1 Morfologi Tumbuhan ... 8
2.1.2 Habitat ... 9
2.1.3 Sistematika Tumbuhan ... 9
2.1.5 Kandungan Kimia ... 9
2.1.6 Kegunaan ... 10
2.2 Ekstraksi ... 11
2.3 Radikal Bebas ... 13
2.4 Antioksidan ... 15
2.4.1 Antioksidan Alami ... 16
2.4.1.1 Flavonoid ... 16
2.4.1.2 Vitamin C ... 18
2.4.1.3 Betakaroten ... 19
2.4.1.4 Kuersetin ... 19
2.4.2 Antioksidan Sintetik ... 20
2.5 Spektrofotometri UV-Visible ... 21
2.6 Metode Pengukuran Antioksidan ... 21
2.6.1 Metode BCB (β-Carotene Bleaching Method) ... 22
2.6.2 Metode Pemerangkapan Radikal Bebas DPPH (1,1-diphenyl-2-picryhydrazyl) ... 23
2.6.2.1 Pengukuran absorbansi-panjang gelombang ... 25
2.6.2.2 Waktu Pengukuran ... 25
BAB III METODE PENELITIAN ... 26
3.1 Alat dan Bahan ... 26
3.1.1 Alat-alat ………... 26
3.1.2 Bahan-bahan ……… 26
3.2 Penyiapan Bahan Tumbuhan ... 27
3.2.1 Pengumpulan Bahan ………. 27
3.2.3 Pembuatan Simplisia ………. . 27
3.3 Pembuatan Pereaksi ... 28
3.3.1 Pereaksi Asam Klorida 2 N ... 28
3.3.2 Pereaksi Natrium Hidroksida 2 N ... 28
3.3.3 Pereaksi Bouchardat ... 28
3.3.4 Pereaksi Mayer ... 28
3.3.5 Pereaksi Dragendorff ... 28
3.3.6 Pereaksi Besi (III) Klorida 1% ... 29
3.3.7 Pereaksi Liebermann-Burchard ... 29
3.3.8 Pereaksi Molish ... 29
3.3.9 Pereaksi Timbal (II) Asetat 0,4 M ... 29
3.3.10 Pereaksi Asam Sulfat 2 N ... 29
3.3.11 Pereaksi Kloralhidrat ... 29
3.4 Pemeriksaan Karakterisasi Simplisia ... 29
3.4.1 Pemeriksaan Makroskopik ... 30
3.4.2 Pemeriksaan Mikroskopik ... 30
3.4.3 Penetapan Kadar Air ... 30
3.4.4 Penetapan Kadar Sari Larut Air ... 31
3.4.5 Penetapan Kadar Sari Larut Etanol ... 31
3.4.6 Penetapan Kadar Abu Total ... 31
3.4.7 Penetapan Kadar Abu Tidak Larut Asam ... 32
3.5 Skrining Fitokimia ... 32
3.5.1 Pemeriksaan Alkaloid ... 32
3.5.2 Pemeriksaan Flavonoid ... 33
3.5.4 Pemeriksaan Glikosida Antrakinon ... 33
3.5.5 Pemeriksaan Saponin ... 34
3.5.6 Pemeriksaan Tanin ... 34
3.5.7 Pemeriksaan Steroid / Triterpenoid ... 34
3.6 Pembuatan Ekstrak Etanol Buah Paprika ... 34
3.7 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel ... ... 35
3.7.1 Penentuan Aktivitas Antioksidan Menggunakan Metode Penangkapan Radikal Bebas DPPH ... 35
3.7.1.1 Prinsip Metode Pemerangkapan Radikal Bebas DPPH ... 35
3.7.1.2 Pembuatan Larutan Blanko ……… .. 36
3.7.1.3 Pembuatan Larutan Induk Ekstrak Etanol Buah Paprika (EEBP) ... 36
3.7.1.4 Pembuatan Larutan Induk Vitamin C ... 36
3.7.1.5 Larutan Uji Ekstrak Etanol Buah Paprika (EEBP) ... 36
3.7.1.6 Larutan Uji Vitamin C ... 36
3.7.1.7 Analisis Persen Pemerangkapan Radikal Bebas DPPH ... 37
3.7.1.8 Analisis Nilai IC50 ... 37
3.7.2 Penentuan Aktivitas Antioksidan Menggunakan Metode β-karoten-asam linoleat ... 37
3.7.2.1 Pembuatan Larutan Blanko ... 37
3.7.2.2 Pembuatan Larutan Stok β-karoten ... 38
3.7.2.3 Pembuatan Larutan Induk Ekstrak Etanol Buah Paprika (EEBP) ... 38
3.7.2.4 Pembuatan Larutan Uji Ekstrak Etanol Buah Paprika (EEBP) ... 38
toluen (BHT), Kuersetin dan Vitamin C ... 38
3.7.2.6 Penentuan Aktivitas Antioksidan Ekstrak Etanol Buah Paprika (Capsicum annum L. var. grossum) menggunakan metode β-karoten- asam linoleat ... 38
BAB IV HASIL DAN PEMBAHASAN ... 40
4.1 Hasil Identifikasi Tumbuhan ... 40
4.2 Hasil Karakterisasi Simplisia ... 40
4.2.1 Pemeriksaan Makroskopik Buah Paprika ... 40
4.2.2 Pemeriksaan Makroskopik Simplisia Buah Paprika ... 40
4.2.3 Pemeriksaan Mikroskopik Serbuk Simplisia Buah Paprika ... 41
4.2.4 Hasil Pemeriksaan Karakterisasi Serbuk Simplisia ... 41
4.3 Hasil Skrining Fitokimia ... 43
4.4 Hasil Analisis Aktivitas Antioksidan EEBP Metode DPPH ... 44
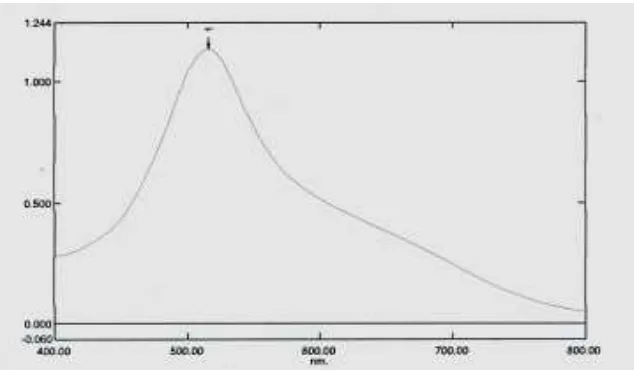
4.4.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum ... 44
4.4.2 Hasil Analisis Aktivitas Antioksidan ... 45
4.4.3 Hasil Analisis Nilai IC50 ... 48
4.5 Hasil Analisis Aktivitas Antioksidan EEBP Metode β-karoten- asam linoleat ... 50
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 58
DAFTAR PUSTAKA ... 59
DAFTAR TABEL
Halaman
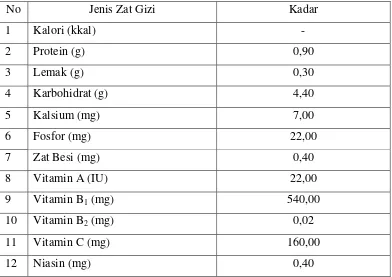
Tabel 2.1 Kandungan gizi buah paprika segar dalam setiap 100 g bahan
yang dapat dimakan ... 10
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia buah paprika ... 41
Tabel 4.2 Hasil pemeriksaan karakteristik ekstrak etanol buah paprika .. 42
Tabel 4.3 Hasil skrining fitokimia simplisia dan estrak etanol buah
paprika merah, kuning dan hijau ... 43
Tabel 4.4 Penurunan absorbansi DPPH dengan penambahan ekstrak etanol buah Paprika Merah (EEBPM) menggunakan metode DPPH ... 45
Tabel 4.5 Penurunan absorbansi DPPH dengan penambahan ekstrak etanol buah Paprika Kuning (EEBPK) menggunakan metode DPPH ... 45
Tabel 4.6 Penurunan absorbansi DPPH dengan penambahan ekstrak etanol buah Paprika Hijau (EEBPH) menggunakan metode DPPH ... 46
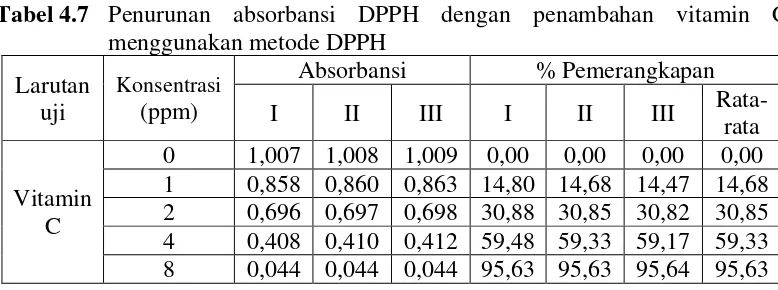
Tabel 4.7 Penurunan absorbansi DPPH dengan penambahan vitamin C
menggunakan metode DPPH ... 46
Tabel 4.8 Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh dari ekstrak etanol buah paprika hijau, paprika merah, paprika kuning dan vitamin C ... 49
Tabel 4.9 Kategori nilai IC50 sebagai antioksidan ... 50
Tabel 4.10 Persentase aktivitas antioksidan ekstrak etanol buah paprika merah (EEBPM) dari berbagai konsentrasi dengan metode β
-karoten-asam linoleat ... 51 Tabel 4.11 Persentase aktivitas antioksidan ekstrak etanol buah paprika
kuning (EEBPK) dari berbagai konsentrasi dengan metode β
-karoten-asam linoleat ... 51
Tabel 4.12 Persentase aktivitas antioksidan ekstrak etanol buah paprika hijau (EEBPH) dari berbagai konsentrasi dengan metode β
-karoten-asam linoleat ... 52
Tabel 4.13 Hasil analisis statistik EEBPM, EEBPK, EEBPH, BHT dan kuersetin ... 55
DAFTAR GAMBAR
Halaman
Gambar 2.1 Kerangka flavonoid ... 17
Gambar 2.2 Struktur dasar flavonoid ... 17
Gambar 2.3 Rumus bangun vitamin C ... 18
Gambar 2.4 Rumus bangun betakaroten ... 19
Gambar 2.5 Struktur kimia kuersetin ... 20
Gambar 2.6 Rumus bangun BHT ... 20
Gambar 2.7 Struktur kimia DPPH ... 23
Gambar 2.8 Reaksi antara DPPH dengan atom H dari senyawa antioksidan ... 24
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel ... 44
Gambar 4.2 Grafik persentase pemerangkapan DPPH versus konsentrasi EEBPM, EEBPK dan EEBPH ... 47
Gambar 4.3 Grafik persentase pemerangkapan DPPH versus konsentrasi vitamin C ... 48
Gambar 4.4 Grafik persentase aktivitas antioksidan versus waktu EEBPM, BHT dan kuersetin ... 53
Gambar 4.5 Grafik persentase aktivitas antioksidan versus waktu EEBPK, BHT dan kuersetin ... 53
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Hasil Identifikasi Tumbuhan ... 63
Lampiran 2 Gambar Buah Paprika Segar ... 64
Lampiran 3 Gambar Makroskopik Buah Paprika ... 65
Lampiran 4 Gambar Makroskopik Simplisia Buah Paprika ... 66
Lampiran 5 Gambar Serbuk Simplisia Buah Paprika . ... 67
Lampiran 6 Hasil Pemeriksaan Mikroskopik Serbuk Simplisia Buah Paprika ….. ... 68
Lampiran 7 Bagan Penelitian ... 69
Lampiran 8 Gambar Alat Spektrofotometer UV-Visibel (Shimadzu 1800) ... 70
Lampiran 9 Perhitungan Pemeriksaan Karakterisasi Simplisia Buah Paprika Merah, Buah Paprika Kuning dan Buah Paprika Hijau ... 71
Lampiran 10 Perhitungan Pemeriksaan Ekstrak Etanol Buah Paprika Merah, Buah Paprika Kuning dan Buah Paprika Hijau ... 79
Lampiran 11 Hasil Uji Aktivitas Antioksidan Metode DPPH ... 84
Lampiran 12 Data Absorbansi dan Hasil Uji Aktivitas Antioksidan Ekstrak Etanol Buah Paprika (EEBP), Butil Hidroksitoluena (BHT) dan Kuersetin Metode β-karoten Asam Linoleat ... 86
Lampiran 13 Contoh Perhitungan Nilai Aktivitas Antioksidan Metode DPPH dan β-karoten Asam Linoleat ... 97
Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Buah Paprika
(Capsicum annum L. cv.group grossum)
Abstrak
Buah paprika (Capcisum annum L. cv.group grossum) merupakan salah satu komoditi penting yang berkembang saat ini. Selain digunakan sebagai keperluan bahan pangan karena mengandung zat gizi yang cukup lengkap, seperti protein, lemak, karbohidrat, mineral dan vitamin, paprika juga mengandung senyawa-senyawa yang berkhasiat obat diantaranya untuk meredakan nyeri dan memperlancar aliran darah. Tujuan penelitian adalah untuk mengetahui karakteristik simplisia, skrining fitokimia dan ekstraksi secara perkolasi serta aktivitas antioksidan dari ekstrak etanol buah paprika merah, kuning dan hijau dengan menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2 -picrylhydrazil (DPPH) dan metode β-karoten-asam linoleat.
Pengujian aktivitas antioksidan ekstrak etanol buah paprika (EEBP) dengan menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2 -picrylhydrazil (DPPH). EEBP didiamkan selama 60 menit pada suhu kamar lalu diukur absorbansinya pada panjang gelombang 516 nm dan pembanding yang digunakan adalah vitamin C. Pengujian juga dilakukan dengan menggunakan
metode β-karoten-asam linoleat yaitu diukur pada waktu 0-120 menit dengan
interval waktu 15 menit pada panjang gelombang 470 nm. Sebagai pembanding digunakan butil hidroksitoluena (BHT) dan kuersetin.
Hasil karakterisasi simplisia buah paprika merah, kuning dan hijau berturut-turut diperoleh kadar air 7,98%; 7,98%; 5,98%, kadar sari yang larut dalam air 37,39%; 43,98%; 39,42%, kadar sari yang larut dalam etanol 25,85%; 24,53%; 28,55%, kadar abu total 6,82%; 6,20%; 6,86% dan kadar abu yang tidak larut dalam asam 1,60%; 0,97%; 0,87%. Hasil karakterisasi ekstrak etanol buah paprika merah, kuning dan hijau berturut-turut diperoleh kadar air 21,29%; 20,52%; 19,24%, kadar abu total 5,44%; 4,72%; 5,04% dan kadar abu yang tidak larut dalam asam 0,54%; 0,45%; 1,60%. Skrining fitokimia diperoleh bahwa buah paprika mengandung senyawa flavonoid, glikosida, dan steroid/triterpenoid.
Hasil pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa EEBP memiliki nilai IC50 sebesar 260,42 ppm (EEBPH), 209,76 ppm (EEBPM) dan 218,77 ppm (EEBPK) serta vitamin C sebesar 4,73 ppm. Hasil pengujian aktivitas antioksidan dengan metode β-karoten-asam linoleat diperoleh aktivitas antioksidan hidroksitoluena (BHT) 100 ppm > kuersetin 100 ppm > EEBPM 3000 ppm > EEBPK 3000 ppm > EEBPH 3000 ppm.
Simplex Characterization and Phytochemicals Screening and Antioxidant Activity of Ethanol Extract of Bell peppers
(Capsicum annum L. cv.group grossum)
Abstract
Bell peppers (Capcisum annuum L. cv.group grossum) are one of the essential developing commodities today. Besides being used as a food purposes because it contains a fairly complete nutrients, such as proteins, fats, carbohydrates, minerals and vitamins, bell peppers also contain medicinal compounds to relieve pain and improving blood flow. The objective of the research was to determine the characteristics, phytochemical screening, percolation extraction and antioxidant activity of ethanol extract of red, yellow and green bell peppers using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavengingmethod and β-carotene-linoleic acid method.
The antioxidant activity tests of the ethanol extract of bell peppers (EEBP) using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavenging method. EEBP was incubated for 60 minutes at room temperature and its absorbance was measured at a wavelength of 516 nm and the results were compared to vitamin C.
Tests were also performed using β-carotene-linoleic acid method which was measured at 0-120 minutes with 15-minute intervals at a wavelength of 470 nm. The results were compared to butyl hydroxytoluena (BHT) and quercetin.
The results of the characterization of simplex red, yellow and green bell peppers water content was 7.98%, 7.98%, 5.98%, water-soluble extract content was 37.39%, 43.98%, 39.42%, ethanol-soluble extract content was 25.85%, 24.53%, 28.55%, total ash content was 6.82%, 6.20%, 6.86% and acid-insoluble ash content was 1.60%, 0.97%, 0.87%. The results of the characterization of ethanol extract red, yellow and green bell peppers water content was 21.29%; 20.52%; 19.24%, total ash content was 5.44%; 4.72%; 5.04% and acid-insoluble ash content was 0.54%; 0.45%; 1.60%. The result of phytochemical screening showed that simplex contained flavonoids, glycosides, and steroids/triterpenoids.
The results of antioxidant activity tests using DPPH (1,1-diphenyl-2- picrylhydrazil) radical scavenging method showed that EEBP has IC50 value 260.42 ppm (EEBPH), 209.76 ppm (EEBPM) and 218.77 ppm (EEBPK) and vitamin C 4.73 ppm. The test results of antioxidant activity by the β -carotene-linoleic acid method antioxidant activity obtained butyl hydroxytoluene (BHT) 100 ppm > quercetin 100 ppm > EEBPM 3000 ppm > EEBPK 3000 ppm > EEBPH 3000 ppm.
BAB I
PENDAHULUAN
1.1Latar Belakang
Kemajuan Ilmu Pengetahuan menemukan banyak faktor penyebab
terjadinya proses penuaan dini antara lain karena faktor genetik, gaya hidup,
lingkungan, mutasi gen, rusaknya sistem kekebalan dan radikal bebas.
Faktor-faktor penyebab tersebut menjadikan radikal bebas merupakan yang paling sering
diungkapkan. Sumber radikal bebas dapat berasal dari polusi, debu maupun
diproduksi secara terus-menerus sebagai konsekuensi dari metabolisme normal
(Zuhra, dkk., 2008).
Selain terjadinya penuaan dini, banyak ditemukan penyakit-penyakit
degeneratif seperti kanker, penyakit jantung koroner (PJK), artritis, diabetes,
kanker hati, dan sebagainya. Salah satu dari penyakit degeneratif yang paling
ditakuti adalah kanker, yang biaya pengobatannya mahal dan tidak ada jaminan
bagi penderita untuk dapat sembuh secara total, atau sewaktu-waktu dapat
kambuh kembali. Sampai saat ini teknik pengobatan kanker yang dilakukan
adalah dengan cara pembedahan, radioterapi dan kemoterapi yang memerlukan
waktu sangat panjang. Penyakit-penyakit degeneratif ini disebabkan karena
antioksidan yang ada di dalam tubuh tidak mampu menetralisir peningkatan
konsentrasi radikal bebas (Soekmanto, 2007).
Radikal bebas adalah molekul yang mempunyai satu atau lebih elektron
tidak berpasangan, sifatnya sangat labil dan sangat reaktif sehingga dapat
menimbulkan kerusakan pada komponen sel seperti DNA, lipid, protein dan
menghancurkan radikal bebas yang dapat menyebabkan kerusakan sel dan juga
merusak biomolekul di dalam tubuh yang akhirnya dapat memicu terjadinya
penyakit degeneratif (Soekmanto, 2007). Untuk menghindari hal tersebut, maka
tubuh memerlukan suatu substansi penting yaitu antioksidan tambahan dari luar
seperti vitamin E, vitamin C maupun berbagai jenis sayuran dan buah-buahan
yang dapat membantu melindungi tubuh dari serangan radikal bebas.
Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas
yang dapat menyebabkan kerusakan asam lemak tak jenuh, membran sel,
pembuluh darah, DNA, dan jaringan lipid sehingga menimbulkan penyakit. Suatu
tanaman dapat memiliki aktivitas antioksidan apabila mengandung senyawa yang
mampu menangkal radikal bebas seperti fenol dan flavonoid (Widyastuti, 2010).
Antioksidan berfungsi mengatasi atau menetralisir radikal bebas sehingga
diharapkan dengan pemberian antioksidan tersebut proses penuaan dihambat dan
dapat mencegah terjadinya kerusakan tubuh dari timbulnya penyakit degeneratif.
Pemilihan antioksidan alami kini mulai menjadi perhatian masyarakat karena telah
ditemukannya efek samping dari penggunaan antioksidan sintetik berupa
keracunan dan bersifat karsinogenik jika digunakan dalam jangka waktu yang
lama dan dalam jumlah yang berlebihan (Zuhra, dkk., 2008).
Sumber-sumber antioksidan dapat berupa antioksidan alami maupun
antioksidan sintetik. Tetapi saat ini penggunaan antioksidan sintetik mulai dibatasi
karena dari hasil penelitian yang telah dilakukan ditemukan bahwa antioksidan
sintetik seperti BHT (butyl hydroxytoluena) ternyata dapat meracuni binatang
percobaan dan bersifat karsinogenik. Oleh karena itu industri makanan dan
obat-obatan mengembangkan antioksidan alami dan mencari sumber-sumber
Secara alami beberapa jenis tumbuhan merupakan sumber antioksidan, hal
ini dapat ditemukan pada beberapa jenis sayuran, buah-buahan segar, beberapa
jenis tumbuhan dan rempah (Kuncahyo, 2007). Salah satu
rempah-rempah yang banyak digunakan adalah buah paprika. Paprika (Capcisum annum
L. cv.group grossum) merupakan salah satu komoditi penting yang berkembang
saat ini, baru dikenal di Indonesia sejak tahun 1990-an yaitu di daerah Dieng
(Jawa Tengah), Puncak dan Lembang (Jawa Barat), serta Brastagi (Sumatera
Utara) dan ditanam dengan sistem hidroponik. Tanaman paprika memiliki ciri-ciri
spesifik yaitu memiliki buah yang besar, berdaging tebal, mempunyai biji dan rasa
buah tidak pedas (Waruwu, 2011).
Buah paprika mengandung zat gizi yang cukup lengkap, antara lain
protein, lemak, karbohidrat, mineral (kalsium, fosfor, besi), vitamin B, vitamin C,
dan serat. Kandungan kimia tanaman paprika adalah oleoresin (capsaicin),
flavonoid, minyak atsiri, karotenoid (capsantin, capsorubin, carotene, dan lutein)
(Cahyono, 2012).
Paprika sering digunakan dalam industri farmasi untuk membuat ramuan
obat-obatan, kosmetik, pewarna bahan makanan, serta bahan campuran pada
berbagai industri pengolahan makanan dan minuman. Selain itu, paprika juga
bermanfaat sebagai obat untuk diare, sakit perut, sakit gigi, polio, pegal-pegal,
influensa, masuk angin, dan mencegah penggumpalan darah (Cahyono, 2012),
sebagai stimulan dan sebagai bumbu masak (Tyler, 1976).
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu
BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β-karoten,
DPPH (1,1-diphenyl-2-picrylhydrazil) Radical Scavenging Method (Metode
(TBARS) Assay, CUPRAC Assay (Cupric Reducing Antioxidant Capacity),
ORAC Assay (Oxygen-Radical Absorbance Capacity), dan FRAP Assay (Ferric
Reducing Antioxidant Power) (Rafi, 2013;Rosidah, et al., 2008).
Berdasarkan uraian diatas, maka penulis melakukan penelitian untuk
mengetahui karakteristik dari simplisia, golongan senyawa kimia dan kekuatan
aktivitas antioksidan dari buah paprika merah, kuning dan hijau (Capsicum annum
L.cv.group grossum) dengan menggunakan metode pemerangkapan radikal bebas
1,1-diphenyl-2-picrylhydrazil (DPPH) dan metode β-karoten-asam linoleat.
Meskipun suatu senyawa uji menunjukkan daya antioksidan yang tinggi dengan
salah satu metode, tidak selalu akan memberikan hasil yang sama baiknya dengan
menggunakan metode lainnya sehingga diperlukan pengukuran daya antioksidan
dengan berbagai macam metode (Rohman, 2005).
1.2Perumusan Masalah
Berdasarkan uraian pada latar belakang tersebut, maka perumusan masalah
penelitian adalah:
a. apakah karakteristik simplisia buah paprika merah, kuning dan hijau dapat
dijadikan pada penelitian selanjutnya?
b. apakah golongan senyawa kimia yang terkandung didalam ketiga macam
simplisia buah paprika?
c. apakah ekstrak etanol ketiga macam buah paprika memiliki aktivitas sebagai
antioksidan dengan metode β-karoten-asam linoleat?
d. apakah ekstrak etanol ketiga macam buah paprika memiliki aktivitas sebagai
antioksidan dengan metode pemerangkapan radikal bebas 1,1-diphenyl
e. berapakah nilai IC50 ekstrak etanol buah paprika menggunakan metode DPPH
sebagai antioksidan?
1.3Hipotesis
Berdasarkan perumusan masalah tersebut, maka hipotesis penelitian ini
adalah sebagai berikut:
a. simplisia buah paprika mempunyai karakteristik yang dapat digunakan pada
penelitian selanjutnya
b. golongan senyawa kimia yang terdapat dalam ketiga macam simplisia buah
paprika adalah golongan alkaloid, flavonoid, saponin, tanin,
steroid/triterpenoid, glikosida dan glikosida antrakinon
c. ekstrak etanol ketiga macam buah paprika memiliki aktivitas sebagai
antioksidan dengan metode β-karoten-asam linoleat
d. ekstrak etanol ketiga macam buah paprika memiliki aktivitas sebagai
antioksidan dengan metode pemerangkapan radikal bebas 1,1-diphenyl
-2-picrylhydrazil (DPPH)
e. nilai IC50 ekstrak etanol ketiga jenis buah paprika menggunakan metode
DPPH sebagai antioksidan adalah > 50 ppm
1.4Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
a. untuk mengetahui karakteristik simplisia ketiga macam buah paprika
b. untuk mengetahui golongan senyawa kimia dari ketiga macam buah paprika
c. untuk mengetahui kekuatan aktivitas antioksidan dengan metode β
d. untuk mengetahui kekuatan aktivitas anktioksidan dengan metode
pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH)
e. untuk mengetahui nilai IC50 dari ekstrak etanol ketiga macam buah paprika
1.5Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah dapat memberikan
informasi mengenai karakteristik dan golongan senyawa kimia ketiga macam
buah paprika, serta dapat menambah data penelitian dalam usaha pemanfaatan
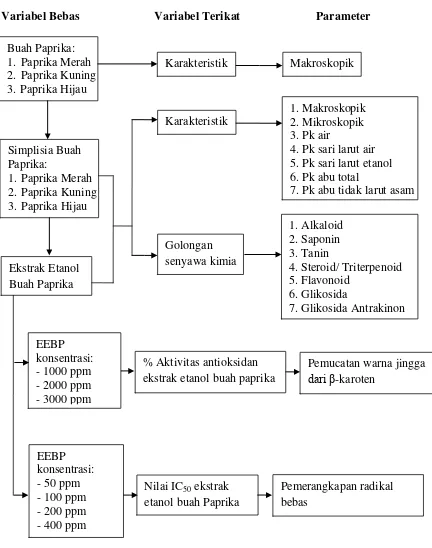
1.6Kerangka Pikir Penelitian
Penelitian ini dilakukan dengan kerangka pikir seperti yang ditunjukkan
pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Skema kerangka pikir penelitian Buah Paprika: 5. Pk sari larut etanol 6. Pk abu total ekstrak etanol buah paprika
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tumbuhan meliputi morfologi tumbuhan, habitat, sistematika
tumbuhan, nama asing, kandungan kimia dan kegunaan dari tumbuhan.
2.1.1Morfologi tumbuhan
Morfologi tumbuhan paprika meliputi bagian-bagian yaitu memiliki
batang yang keras dan berkayu, berbentuk bulat, halus, berwarna hijau gelap, dan
memiliki percabangan dalam jumlah banyak. Cabang tanaman beruas-ruas dan
setiap ruas ditumbuhi daun dan tunas. Daun tersebar atau 2-3 daun yang tak sama
besar bergerombol, berbentuk bulat telur dengan ujung runcing dan tepi daun
tidak bergerigi.
Bunga tanaman paprika merupakan bunga tunggal (soliter) dan berbentuk
bintang, dengan mahkota bunga berwarna putih. Benang sari dengan kepala sari
yang berwarna ungu tetapi kemudian menjadi kehijau-hijauan. Buah paprika
memiliki keanekaragaman bentuk, ukuran, warna, dan rasa. Pada umumnya, buah
paprika berbentuk seperti tomat, tetapi lebih bulat dan pendek, dengan permukaan
bergelombang besar atau bersegi-segi sangat jelas. Buah paprika berongga pada
bagian dalamnya. Ukuran buah bervariasi, ada yang berukuran besar, panjang,
atau pendek dengan ketebalan buah sekitar 0,5 cm.
Biji paprika terdapat dalam jumlah sedikit, berbentuk bulat pipih, dan
berwarna putih kekuning-kuningan. Biji tersusun berkelompok (bergerombol) dan
tumbuh lurus ke pusat bumi dan akar yang tumbuh menyebar ke samping
(horizontal) (Cahyono, 2012; Tjitrosoepomo, 1994).
2.1.2Habitat
Tanaman paprika banyak tumbuh di negara-negara yang memiliki
temperatur rendah seperti Eropa, Mexico, United States (Tyler, 1976). Di
Indonesia, paprika dapat dibudidaya di lahan-lahan kering yaitu Jawa (DKI
Jakarta, Jawa Barat, Jawa Tengah, DIY, dan Jawa Timur), Sumatera (Riau, Aceh,
dan Sumatera Utara) (Cahyono, 2012).
2.1.3Sistematika tumbuhan
Menurut Cahyono (2012), sistematika tumbuhan buah paprika adalah
sebagai berikut:
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Solanales
Suku : Solanaceae
Marga : Capsicum
Jenis : Capsicum annum
Varietas : Capsicum annum L. cv.group grossum
2.1.4Nama asing
Garden Pepper, Paprika, Pimiento, Mexican Chillies, Tabasco Pepper, Bell
Pepper (Tyler, 1976).
2.1.5Kandungan Kimia
Buah paprika mengandung zat gizi yang cukup lengkap, antara lain
Selain itu terdapat juga zat-zat lain yang berkhasiat obat, misalnya oleoresin
(capsaicin), minyak atsiri, flavonoid, karotenoid (capsantin, capsorubin,
carotene, dan lutein). Kandungan gizi (komposisi kimia) buah paprika secara
lengkap ditunjukkan dalam Tabel 2.1.
Tabel 2.1 Kandungan gizi buah paprika segar dalam setiap 100 g
No Jenis Zat Gizi Kadar
Sumber: Table of Representative Value of Food Commonly Used in Tropical Countries (1982) dalam Harjono, 1994.
Selain itu, paprika menyediakan nutrisi lain seperti B6, tiamin dan asam
folat (Dalimartha, 2002). Cabe yang berdaging buah tebal ini memiliki kandungan
vitamin C yang tinggi (Cahyono, 2012).
2.1.6 Kegunaan
Paprika mempunyai efek melindungi mata dari timbulnya katarak, dapat
meningkatkan aliran darah, mencegah pembentukan trombus, mengurangi resiko
serangan jantung dan stroke. Paprika juga bermanfaat mengatasi kadar kolesterol
yang tinggi, membantu memetabolisir alkohol, peluruh dahak (ekspektoran) untuk
Jantung Koroner (PJK), nyeri iskemik (ischemic rest pain), nyeri otot dan rematik
(Dalimartha, 2002).
Paprika merupakan tanaman hortikultura (sayuran) yang dimanfaatkan
untuk keperluan pangan. Selain itu paprika juga digunakan dalam industri farmasi
untuk membuat ramuan obat-obatan, kosmetik, pewarna bahan makanan, serta
bahan campuran pada berbagai industri pengolahan makanan dan minuman.
Selain itu, paprika juga bermanfaat sebagai obat untuk diare, sakit perut, sakit
gigi, pegal-pegal, influensa, masuk angin, mencegah penggumpalan darah
(Cahyono, 2012), sebagai stimulan dan sebagai bumbu masak (Tyler, 1976).
2.2Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari
jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya bahan -
bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan
tertentu (Harborne, 1984).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen
POM, 2000).
Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang
diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian
sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Menurut Depkes RI (2000), ada beberapa metode ekstraksi yang sering
a. Cara dingin
i. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi
kinetik sedangkan yang dilakukan pengulangan panambahan pelarut setelah
dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi.
ii. Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator
dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang
umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak) terus - menerus sampai diperoleh perkolat.
b. Cara panas
i. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperature titik didihnya dalam waktu tertentu dimana pelarut akan
terkondensasi menuju pendingin dan kembali ke labu.
ii. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada
iii. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
selalu baru, dilakukan dengan menggunakan alat soklet dimana pelarut akan
terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel.
iv. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
v. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.2Radikal Bebas
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat
reaktif karena mengandung satu atau lebih elektron tidak berpasangan (unpaired
electron). Untuk mencapai kestabilan atom atau molekul, radikal bebas akan
bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron
disebut oksidan (electron acceptor) yaitu suatu senyawa yang dapat menerima
elektron. Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak
dihentikan akan menimbulkan berbagai penyakit seperti kanker, jantung, katarak,
penuaan dini, serta penyakit degeneratif lainnya (Maulida, 2010; Sudiana, 2008).
Radikal bebas sangat reaktif dan dengan mudah menjurus ke reaksi yang
tidak terkontrol, menghasilkan ikatan silang (cross-link) pada DNA, protein,
lipida, atau kerusakan oksidatif pada gugus fungsional yang penting pada
biomolekul ini. Radikal bebas juga terlibat dan berperan dalam patologi dari
berbagai penyakit degeneratif, yakni kanker, aterosklerosis, rematik, jantung
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan
berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya antara lain
golongan hidroksil (OH-), superoksida (O-2), nitrogen monooksida (NO), nitrogen
dioksida (NO2), peroksidal (RO-2), peroksinitrit (ONOO-), asam hipoklorit
(HOCl), hydrogen peroksida (H2O2), ozon (O3), dinitrogen trioksida (N2O3), lipid
peroksida (LOOH) (Silalahi, 2006; Pham-Huy, et al., 2008).
Secara umum tahapan reaksi pembentukan radikal bebas adalah sebagai berikut:
a. Inisiasi
RH + initiator → R●
b. Propagasi
R● + O2 → ROO●
ROO● + RH → ROOH + R●
c. Terminasi
R● + R●→ RR
ROO● + R●→ ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap
propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara
suatu radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap
terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan
radikal bebas yang lain sehingga menjadi tidak reaktif lagi. Ketika proses tersebut
terjadi maka siklus reaksi radikal telah berakhir (Kumalaningsih, 2006).
Radikal bebas dalam jumlah normal bermanfaat bagi kesehatan misalnya,
mengurangi peradangan dan membunuh bakteri. Sementara dalam jumlah berlebih
mengakibatkan stress oksidatif. Stress oksidatif merupakan bagian utama
mengakibatkan kerusakan kronis, penyakit degeneratif seperti kanker, arthritis,
antioksidan dibutuhkan untuk dapat menunda atau menghambat reaksi oksidasi
oleh radikal bebas (Widyastuti, 2010; Pham-Huy, et al., 2008).
2.3Antioksidan
Menurut Kosasih (2004), definisi antioksidan adalah zat yang dapat
menetralisir radikal bebas sehingga atom dengan elektron yang tidak berpasangan
mendapat pasangan elektron sehingga tidak reaktif lagi.
Berkaitan dengan fungsinya, senyawa antioksidan di klasifikasikan dalam lima
tipe antioksidan, yaitu:
a. Primary antioxidants, yaitu senyawa-senyawa fenol yang mampu memutus
rantai reaksi pembentukan radikal bebas asam lemak. Dalam hal ini
memberikan atom hidrogen yang berasal dari gugus hidroksi senyawa fenol
sehingga terbentuk senyawa yang stabil. Senyawa antioksidan yang termasuk
kelompok ini, misalnya BHA, BHT, PG, TBHQ, dan tokoferol.
b. Oxygen scavengers, yaitu senyawa-senyawa yang berperan sebagai pengikat
oksigen sehingga tidak mendukung reaksi oksidasi. Dalam hal ini, senyawa
tersebut akan bereaksi dengan oksigen yang berada dalam sistem sehingga
jumlah oksigen akan berkurang. Contoh dari senyawa-senyawa kelompok ini
adalah vitamin C (asam askorbat), askorbilpalminat, asam eritorbat, dan sulfit.
c. Secondary antioxidants, yaitu senyawa-senyawa yang mempunyai kemampuan
untuk berdekomposisi hidroperoksida menjadi produk akhir yang stabil. Tipe
antioksidan ini pada umumnya digunakan untuk menstabilkan poliolefin resin.
Contohnya: asam tiodipropionat dan dilauriltiopropionat.
d. Antioxidative Enzime, yaitu enzim yang berperan mencegah terbentuknya
radikal bebas. Contohnya glukose oksidase, superoksidase dismutase (SOD),
e. Chelators sequestrants, yaitu senyawa-senyawa yang mampu mengikat logam
seperti besi dan tembaga yang mampu mengkatalis reaksi oksidasi lemak.
Senyawa yang termasuk didalamnya adalah asam sitrat, asam amino,
ethylenediaminetetra acetid acid (EDTA), dan fosfolipid (Maulida, 2010).
2.4.1 Antioksidan Alami
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang
disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit
degeneratif serta mampu menghambat peroksidase lipid pada makanan.
Meningkatnya minat untuk mendapatkan antioksidan alami terjadi beberapa tahun
terakhir ini. Antioksidan alami umumnya mempunyai gugus hidroksi dalam
struktur molekulnya (Kuncahyo, 2007).
Bahan pangan banyak dijadikan sebagai sumber antioksidan alami,
misalnya rempah rempah, teh, coklat, daun-daunan, biji-bijian dan sayur-sayuran.
Kebanyakan sumber antioksidan alami adalah tumbuhan dan umumnya
merupakan senyawa fenolik yang tersebar di seluruh bagian tumbuhan baik di
kayu, biji, daun, buah, akar, bunga maupun serbuk sari (Zuhra, 2008).
2.4.1.1 Flavonoid
Salah satu antioksidan alami yang berperan sebagai antioksidan adalah
flavonoid. Senyawa ini berperan sebagai penangkap radikal bebas karena
mengandung gugus hidroksil. Karena bersifat sebagai reduktor, flavonoid dapat
bertindak sebagai donor hidrogen terhadap radikal bebas (Silalahi, 2006).
Flavonoid merupakan senyawa polifenol yang terdapat pada teh, buah-buahan,
sayuran, anggur, bir dan kecap (Kuncahyo, 2007).
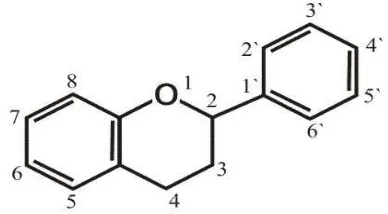
Senyawa flavonoid merupakan salah satu senyawa polifenol yang
konfigurasi C6 – C3 – C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan
3 karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Kerangka flavonoid dapat dilihat pada Gambar 2.1.
Gambar 2.1 Kerangka flavonoid (Markham, 1988)
Flavonoid pada tumbuhan terdapat dalam berbagai bentuk struktur
molekul dengan beberapa bentuk kombinasi glikosida. Untuk menganalisis
flavonoid lebih baik memeriksa aglikon yang telah terhidrolisis daripada dalam
bentuk glikosida dengan strukturnya yang rumit dan kompleks. Flavonoid dapat
berkhasiat sebagai antioksidan, antibakteri dan antiinflamasi (Harborne, 1984).
Struktur dasar dan sistem penomoran untuk turunan flavonoid dapat dilihat pada
Gambar 2.2.
Gambar 2.2 Struktur dasar flavonoid (Widyastuti, 2010)
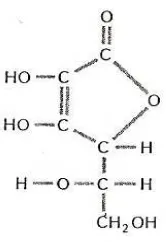
2.4.1.2 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus molekul C6H8O6. Asam askorbat mengandung tidak kurang dari 99,0%
C6H8O6. Pemerian vitamin C adalah hablur atau serbuk putih atau agak kuning.
Oleh pengaruh cahaya lambat laun menjadi berwarna gelap. Dalam keadaan
kering stabil di udara, dalam larutan cepat teroksidasi. Melebur pada suhu lebih
praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Ditjen POM,
1995).
Rumus bangun vitamin C dapat dilihat pada Gambar 2.3.
Gambar 2.3 Rumus Bangun Vitamin C (Ditjen POM, 1995)
Vitamin C merupakan antioksidan kuat dan pengikat radikal bebas.
Vitamin C juga dapat mencegah kerusakan biomolekul seperti DNA, lipid, dan
protein, akibat oksidasi radikal bebas anion superoksida, hidrogen peroksida, dan
radikal hidroksil. Vitamin C sangat dibutuhkan untuk memproduksi kolagen yang
pada gilirannya dapat menghalangi pertumbuhan dan perkembangan sel kanker
(Silalahi, 2006). Vitamin C dapat ditemukan di alam hampir pada semua
tumbuhan terutama sayuran dan buah-buahan, terutama buah-buahan segar.
Karena itu sering disebut Fresh Food Vitamin (Budiyanto, 2004). Vitamin C
antara lain terdapat pada buah-buahan seperti jeruk, apel, sirsak, lemon, stroberi,
melon serta sayuran seperti tomat, sayuran berdaun hijau, brokoli, kembang kol
(Kosasih, 2004).
2.4.1.3 Betakaroten
Betakaroten merupakan salah satu provitamin A yang berperan sebagai
antioksidan dan dipercaya dapat menurunkan resiko penyakit jantung dan kanker.
50 mg betakaroten tiap hari dalam menu makanan dapat mengurangi risiko
terkena penyakit jantung (Kosasih, 2004).
Senyawa ini bekerja sebagai antioksidan dengan cara memperlambat fase
inisiasi. Pemberian vitamin A dalam dosis tinggi dapat bersifat toksis. Akan
tetapi, betakaroten dalam jumlah banyak mampu memenuhi kebutuhan vitamin A
dan selebihnya tetap sebagai betakaroten yang berfungsi sebagai antioksidan
(Silalahi, 2006). Rumus bangun betakaroten dapat dilihat pada Gambar 2.4.
Gambar 2.4 Rumus bangun betakaroten (Almatsier, 2001).
2.4.1.4 Kuersetin
Kuersetin (3,4-dihidroksiflavonol) merupakan senyawa flavonoid dari
kelompok flavonol dan terdapat terutama pada tanaman teh, tomat, apel, kakao,
anggur dan bawang yang memiliki sifat antioksidan yang sangat potensial.
Dengan mengkonsumsi kuersetin dalam jumlah yang cukup (50-200 mg per hari)
maka dapat bermanfaat memberi perlindungan karena berperan sebagai senjata
pemusnah radikal bebas sehingga dapat mencegah penuaan dini. Kuersetin
menunjukkan aktivitasnya dalam menghambat reaksi oksidasi low-density
lipoprotein (LDL) secara in vitro (Kosasih, 2004), mencegah kerusakan oksidatif
dan kematian sel dengan mekanisme menangkap radikal oksigen, memberi efek
farmakologi sebagai antiinflamasi (Herowati, 2008). Struktur kimia kuersetin
Gambar 2.5 Struktur Kimia Kuersetin (Herowati, 2008)
2.4.2 Antioksidan Sintetik
Antioksidan sintetik seperti BHA (butil hidroksianisol), BHT (butil
hidroksitoluena), PG (propil galat), dan TBHQ (tert-butil hidrokuinon) dapat
meningkatkan terjadinya karsinogenesis sehingga penggunaan antioksidan alami
mengalami peningkatan (Rohman, 2005). Antioksidan sintetik dibuat dari
bahan-bahan kimia yang biasanya ditambahkan ke dalam bahan-bahan pangan untuk mencegah
terjadinya reaksi autooksidasi (Kumalaningsih, 2006).
Rumus bangun dari BHT dapat dilihat pada Gambar 2.6.
Gambar 2.6 Rumus bangun BHT
2.4Spektrofotometri UV-Visible
Spektrofotometri merupakan suatu metode pengukuran energi radiasi atau
intensitas sinar yang terserap oleh larutan. Spektrofotometri UV-Visibel adalah
salah satu bentuk spektrofotometri absorbsi. Pada cara ini, cahaya atau gelombang
pengukuran besarnya cahaya (gelombang elektromagnetik) yang diabsorbsi
(Benson, 1987).
Spektrofotometri pada dasarnya terdiri dari sumber sinar, monokromator,
sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
Spektrofotometri serapan merupakan metode pengukuran serapan radiasi
elektromagnetik pada panjang gelombang tertentu, yang diserap zat (Ditjen POM,
1979).
Spektrofotometri UV-Visibel terdiri dari sumber sinar monokromator,
tempat sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau
pencatat. Spektrofotometri yang sering digunakan untuk mengukur serapan
larutan atau zat yang diperiksa adalah spektrofotometri ultraviolet dengan panjang
gelombang antara 200-400 nm dan visibel (cahaya tampak) dengan panjang
gelombang antara 400-750 nm (Rohman, 2007).
2.5Metode Pengukuran Antioksidan
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu:
a. BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β
-karoten,
b. DPPH (1,1-diphenyl-2-picrylhydrazil) Radical Scavenging Method (Metode
Pemerangkapan Radikal Bebas DPPH),
c. TBARS Assay (Thiobarbituric Acid-Reactive Substance),
d. CUPRAC Assay (Cupric Reducing Antioxidant Capacity),
e. ORAC Assay (Oxygen-Radical Absorbance Capacity), dan
f. FRAP Assay (Ferric Reducing Antioxidant Power) (Rafi, 2013; Rosidah, et al.,
Perkiraan aktifitas antioksidan bergantung kepada sistem pengujiannya.
Spesifitas dan sensitifitas satu metode saja tidak dapat menguji seluruh senyawa
fenol yang terdapat pada ekstrak. Oleh karena itu dibutuhkan kombinasi pengujian
aktivitas antioksidan lebih dari satu (Sun dan Ho, 2005).
2.6.1 Metode BCB (β-Carotene Bleaching Method)
Metode carotene bleaching atau sering dikenal metode β-karoten-asam
linoleatmerupakan metode untuk mengevaluasi aktivitas antioksidan berdasarkan
pada kemampuan antioksidan untuk mencegah peluruhan warna jingga karoten
akibat oksidasi dalam sistem emulsi minyak dan karoten. Dalam pengujian
aktivitas antioksidan dengan metode carotene bleaching digunakan bahan-bahan
utama, seperti beta karoten sebagai indikator aktivitas antioksidan, minyak
sebagai sumber radikal bebas, dan senyawa antioksidan sampel sebagai
penghambat reaksi oksidasi (Utami, 2009).
Pada uji aktivitas antioksidan dengan menggunakan metode β
-karoten-asam linoleat, radikal bebas terbentuk dari hidroperoksid yang dihasilkan oleh
asam linoleat. Radikal bebas asam linoleat terbentuk karena pengurangan atom
hidrogen dari satu gugus metilen dialil yang menyerang ikatan rangkap pada beta
karoten sehingga terjadi oksidasi beta karoten yang menyebabkan hilangnya
gugus kromofor yang memberi warna orange (Rosidah, et al., 2008). Perubahan
warna ini dapat diukur secara spektrofotometri.
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
metode β-karoten-asam linoleat menurut literatur adalah 470 nm (Rosidah, et al.,
2008; Sugiastuti, 2002). Lama pengukuran metode β-karoten-asam linoleat
menurut literatur yang direkomendasikan adalah 0 menit sampai 120 menit
2.6.2 Metode Pemerangkapan Radikal Bebas DPPH (1,1-diphenyl-2-
picrylhydrazil)
DPPH pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan
Renn. DPPH berwarna ungu pekat seperti KMnO4, bersifat tidak larut dalam air
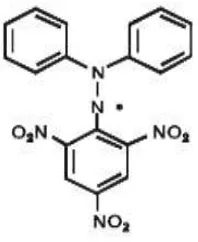
(Ionita, 2005). DPPH (1,1-diphenyl-2-picrylhydrazil) merupakan radikal bebas
yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas
antioksidan beberapa senyawa atau ekstrak bahan alam. DPPH menerima elektron
atau radikal hidrogen akan membentuk molekul diamagnetik yang stabil. Interaksi
antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada
DPPH, akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004).
Struktur kimia DPPH dapat dilihat pada Gambar 2.7.
Gambar 2.7 Struktur Kimia DPPH (Molyneux, 2004)
Metode DPPH (1,1-diphenyl-2-picrylhydrazil) merupakan salah satu uji
untuk menentukan aktivitas antioksidan. Metode DPPH memberikan informasi
reaktivitas senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan
serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap.
Pemerangkapan radikal bebas menyebabkan elektron menjadi berpasangan yang
kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah
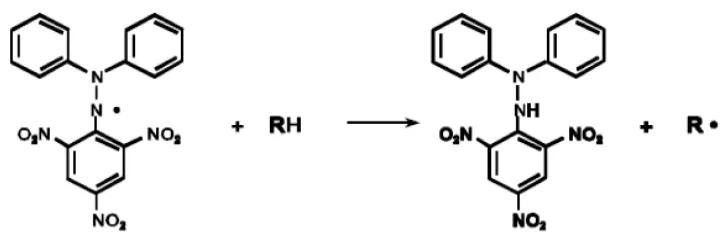
Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari zat
antioksidan dengan reaksi sebagai berikut:
1,1-diphenyl-2-picrylhydrazil 1,1-diphenyl-2-picrylhydrazine
Gambar 2.8 Reaksi antara DPPH dengan atom H dari senyawa antioksidan (Widyastuti, 2010)
Ketika larutan DPPH dicampurkan dengan senyawa yang dapat
mendonorkan atom hidrogen, akan dihasilkan bentuk tereduksi dari DPPH dan
berkurangnya warna ungu (Molyneux, 2004).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan persen penghambatan sebesar 50%. Zat yang
mempunyai aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50
yang rendah. Metode ini akan memberikan hasil yang baik dengan menggunakan
pelarut metanol atau etanol dan kedua pelarut ini tidak mempengaruhi dalam
reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas
(Molyneux, 2004).
2.6.2.1Pengukuran absorbansi – panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm
dan 520 nm. Apabila pengukuran menghasilkan tinggi puncak maksimum, maka
itulah panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan di
atas. Nilai absorbansi yang mutlak tidaklah penting, karena panjang gelombang
dapat diatur untuk memberikan absorbansi maksimum sesuai dengan alat yang
digunakan (Molyneux, 2004).
2.6.2.2 Waktu Pengukuran
Lama pengukuran metode DPPH menurut beberapa literatur yang
direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian
waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30
menit dan 60 menit. Waktu reaksi yang tepat adalah ketika reaksi sudah mencapai
kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental dengan
tahap penelitian meliputi penyiapan bahan tumbuhan yaitu buah paprika merah,
kuning dan hijau, pembuatan simplisia, karakterisasi simplisia dan ekstrak,
skrining fitokimia, serta pembuatan ekstrak. Selanjutnya pengujian aktivitas
antioksidan ekstrak etanol buah paprika merah (EEBPM), ekstrak etanol buah
paprika kuning (EEBPK) dan ekstrak buah paprika hijau (EEBPH) dengan metode
pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH) dan metode
β-karoten-asam linoleat dengan menggunakan alat spektrofotometer UV-Visibel.
Penelitian ini dilakukan di Laboratorium Farmakognosi dan Laboratorium
Penelitian, Fakultas Farmasi, Universitas Sumatera Utara.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas
laboratorium, lemari pengering, blender (National), neraca analitik (Vibra), neraca
kasar (Ohaus), seperangkat alat penetapan kadar air, cawan porselen, tanur,
desikator, mikroskop, object glass dan gelas penutup, penangas air (Yenaco),
oven listrik (Strok), rotary evaporator (Heidolph VV 2000), freeze dryer
(Modulyo/Edwards), spektrofotometer UV-Visibel (Shimadzu 1800).
3.1.2 Bahan-bahan
Bahan yang digunakan untuk penelitian ini adalah buah paprika merah,
kuning dan hijau yang masih segar. Bahan-bahan kimia yang berkualitas pro
hidroksitoluena (BHT), kuersetin, vitamin C, produksi E-Merck: etanol, metanol,
toluena, kloroform, isopropanol, benzen, n-heksana, asam nitrat pekat, asam
klorida pekat, asam sulfat pekat, raksa (II) klorida, bismut (III) nitrat, besi (III)
klorida, timbal (II) asetat, kalium iodida, kloralhidrat, asam asetat anhidrida,
natrium hidroksida, amil alkohol, natrium sulfat anhidrat, serbuk magnesium,
etanol 96% (teknis) dan air suling.
3.2Penyiapan Bahan Tumbuhan
3.2.1 Pengumpulan bahan tumbuhan
Bahan tumbuhan yang digunakan pada penelitian ini adalah buah paprika
merah, kuning dan hijau yang masih segar diperoleh dari Pasar Tradisional Jalan
Setia Budi Kelurahan Tanjung Rejo Kecamatan Medan Sunggal, Medan.
3.2.2Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani
Pusat Penelitian Biologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 63 dan
Gambar tumbuhan dapat dilihat pada Lampiran 2, halaman 64.
3.2.3Pembuatan simplisia
Bahan tumbuhan yang digunakan adalah buah paprika merah, kuning dan
hijau yang masih segar. Buah dibersihkan dari kotoran yang melekat dan dicuci
dengan air hingga bersih, lalu ditiriskan, dipotong menjadi beberapa bagian kecil
dengan ukuran 2,0-2,5 cm dan dipisahkan bagian bijinya, ditimbang berat basah
buah paprika merah, kuning dan hijau secara berturut-turut 4,0 kg, 3,3 kg dan 3,2
kg. Selanjutnya dikeringkan dalam lemari pengering pada temperatur ± 40°C
sampai kering (ditandai bila diremas rapuh), kemudian ditimbang sebagai berat
285 g, 248 g dan 223 g. Simplisia yang telah kering diblender menjadi serbuk lalu
disimpan dalam wadah plastik untuk mencegah pengaruh lembab dan pengotoran
lain. Bagan kerja penelitian dapat dilihat pada Lampiran 7, halaman 69.
3.3Pembuatan Pereaksi
3.3.1 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat ditambahkan dengan air suling hingga
diperoleh 100 ml (Depkes RI, 1995).
3.3.2Pereaksi natrium hidroksida 2 N
Sebanyak 8 g natrium hidroksida dilarutkan dalam air suling hingga 100
ml (Depkes RI, 1995).
3.3.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.4Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml,
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.5Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan
dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan
sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan
3.3.6Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.7Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampur dengan 1 bagian asam
sulfat pekat. Larutan pereaksi ini harus dibuat baru (Harborne, 1984).
3.3.8 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.9 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.3.10Larutan pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat diencerkan dengan air suling
sampai 100 ml (Depkes RI, 1995).
3.3.11Larutan Kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
air suling (Depkes RI, 1995).
3.4Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan
3.4.1Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan pada buah segar dan simplisia yang
meliputi pemeriksaan bentuk, ukuran, warna, bau, dan rasa buah paprika.
3.4.2Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia buah
paprika merah, kuning, dan hijau. Masing-masing serbuk simplisia diletakkan
pada kaca objek yang berbeda yang telah ditetesi larutan kloralhidrat kemudian
ditutup dengan kaca penutup, lalu diamati dibawah mikroskop.
3.4.3Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi. Alat terdiri dari
labu alas bulat 500 ml, alat penampung, dan pendingin, tabung penyambung dan
penerima 10 ml.
Cara kerja:
a. Penjenuhan toluena
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama, dimasukkan
ke dalam labu yang berisi toluena jenuh tersebut, lalu dipanaskan hati-hati selama
15 menit. Setelah toluena mendidih, kecepatan tetesan diatur 2 tetes untuk tiap
detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi
dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam
tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena
memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua
volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan
yang diperiksa. Kadar air dihitung dalam persen (v/b) (WHO, 1992).
3.4.4Penetapan kadar sari larut air
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara dimaserasi
selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1
liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan dangkal berdasar rata yang telah ditara, dan sisa
dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari larut dalam air
dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.5Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara dimaserasi
selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil sesekali
dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring cepat
untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa dipanaskan
pada suhu 105°C sampai bobot tetap. Kadar sari larut dalam etanol dihitung
terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.6Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia ditimbang seksama dimasukkan dalam krus
platina atau krus silikat yang telah dipijar dan ditara, kemudian diratakan. Krus
selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Kadar abu dihitung (Depkes RI, 1995).
3.4.7Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan abu dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring dengan kertas masir atau kertas saring bebas abu, cuci
dengan air panas, dipijarkan sampai bobot tetap, kemudian didinginkan dan
ditimbang. Kadar abu yang tidak larut dalam asam dihitung (Depkes RI, 1995).
3.5Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan alkaloida,
flavonoida, glikosida, antrakinon, saponin, tanin dan steroid / triterpenoid.
3.5.1Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid.
Ke dalam 3 tabung reaksi dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi :
a. ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan berwarna putih
atau kuning.
b. ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk endapan berwarna
coklat atau jingga kecoklatan.
c. ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk endapan berwarna
coklat sampai kehitaman.
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari empat pereaksi