BAB III
METODE PENELITIAN
Metode penelitian yang digunakan adalah metode eksperimental. Tahap penelitian meliputi pengambilan bahan tumbuhan, identifikasi bahan tumbuhan, pembuatan simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol dan fraksi kulit buah sawo manila, kemudian dilakukan uji aktivitas antibakteri menggunakan metode difusi agar dengan cakram kertas. Parameter yang diamati yaitu besarnya diameter daya hambat pertumbuhan bakteri. Penelitian ini dilakukan di Laboratorium Farmakognosi dan Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.1 Alat
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas laboratorium, aluminium foil, autoklaf (Fisons), benang, blender (Panasonic), bola karet, deck glass, desikator, hair dryer (Panasonic), hot plate (Fisons), inkubator (Fiber Scientific), jangka sorong, jarum ose, kamera digital (Canon), kapas (Swallow), karet, kasa (Swallow), kertas label, kertas perkamen, kertas saring, krus porselin, laminar air flow cabinet (Astec HLF 1200L), lampu spiritus, lemari pendingin (Glacio), mikroskop (Olympus), neraca listrik (Mettler Tolledo), objek glass, oven (Memmert), penangas air (Yenaco), perkolator, penjepit tabung, pinset, pipet mikro (Eppendorf), plastik, rotary evaporator (Haake D), spektrofotometer visible (Dinamica), seperangkat alat penetapan kadar air, spatula dan tanur (Nabertherm).
3.2 Bahan
Bahan yang digunakan adalah kulit buah sawo manila (Manilkara zapota (L.) P. Royen), nutrient agar (NA), nutrient broth (NB), bakteri Staphylococcus
aureus dan Escherichia coli, air suling. Bahan kimia yang digunakan berkualitas
pro analisis, kecuali dinyatakan lain yaitu alfa naftol, alkohol 70%, amil alkohol, asam klorida pekat, asam asetat anhidrida, asam nitrat, asam sulfat pekat, besi (III) klorida, bismuth (III) nitrat, dimetilsulfoksida (DMSO), etanol 96%, etilasetat, iodium, isopropanol, kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, natrium klorida, natrium sulfat anhidrida, n-heksana, raksa (II) klorida, serbuk magnesium, serbuk zinkum, timbal (II) asetat dan toluena.
3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan, identifikasi bahan tumbuhan dan pembuatan simplisia kulit buah sawo manila
(Manilkara zapota (L.) P. Royen).
3.3.1 Pengumpulan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan yang diambil adalah buah sawo manila matang yang diperoleh dari pasar buah Setia Budi Tanjung Sari Medan, Provinsi Sumatera Utara. Sampel yang digunakan adalah kulit buah sawo manila (Manilkara zapota (L.) P. Royen).
3.3.2 Identifikasi tumbuhan
Identifikasi bahan tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian dan Pengembangan Biologi-LIPI, Cibinong Bogor. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 45.
3.3.3 Pembuatan simplisia
Pembuatan simplisia dilakukan dengan cara buah sawo manila (segar yang telah dikumpulkan, dibersihkan dari pengotor yang melekat, lalu dicuci dengan air sampai bersih dan ditiriskan. Kulit buah sawo manila dikupas dengan pisau sehingga terpisah antara kulit buah dengan daging buah. Gambar kulit buah sawo manila dapat dilihat pada Lampiran 3, halaman 47. Kulit buah sawo manila kemudian dikeringkan di dalam lemari pengering sampai simplisia rapuh ketika diremas. Gambar simplisia kulit buah sawo manila dapat dilihat pada Lampiran 4, halaman 48. Simplisia yang sudah kering selanjutnya diblender menjadi serbuk dan disimpan dalam wadah plastik yang tertutup rapat. Gambar serbuk simplisia kulit buah sawo manila dapat dilihat pada Lampiran 5, halaman 49.
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Mayer
Larutan raksa (II) klorida P 2,26% b/v sebanyak 60 ml dicampur dengan 10 ml larutan kalium iodida P 50% b/v, kemudian ditambahkan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.2 Pereaksi Dragendorff
Larutan bismuth (III) nitrat P 40% b/v dalam asam nitrat P sebanyak 20 ml dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai memisah sempurna, lalu diambil lapisan jernihnya dan diencerkan dengan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida P dilarutkan dalam air suling secukupnya kemudian ditambahkan 2 g iodida P sedikit demi sedikit, cukupkan dengan air
suling sampai 100 ml (Depkes RI, 1995). 3.4.4 Pereaksi Molish
Sebanyak3 g α-naftol P dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.5 Pereaksi Liebermann-Burchard
Campurkan 5 ml asam sulfat pekat dengan 50 ml etanol. Tambahkan hati-hati 5 ml asam asetat anhidrida ke dalam campuran tersebut dan didinginkan (Depkes RI, 1995).
3.4.6 Pereaksi besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml (Depkes RI, 1995).
3.4.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air suling bebas CO2 hingga 100 ml (Depkes RI, 1995).
3.4.8 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1995).
3.4.10 Larutan asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahan air suling sampai 100 ml (Depkes RI, 1995).
3.4.11 Larutan kloralhidrat
air suling (Depkes RI, 1995).
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksan makroskopik dilakukan dengan mengamati morfologi luar tumbuhan yaitu bentuk, ukuran dan permukaan kulit sedangkan pemeriksaan organoleptis meliputi bau, rasa dan warna dari kulit buah sawo manila.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia kulit buah sawo manila. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutup dengan kaca penutup, kemudian dilihat dibawah mikroskop. Gambar mikroskopik serbuk simplisia dapat dilihat pada Lampiran 6, halaman 50.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml. Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu yang berisi toluen jenuh tersebut, dipanaskan hati-hati selama 15 menit. Kecepatan tetesan
diatur lebih kurang 2 tetes tiap detik setelah toluen mendidih, hingga sebagian air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap detik. Bagian dalam pendingin dibilas dengan toluen setelah semua air tersuling. Penyulingan dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Volume dibaca dengan ketelitian 0,05 ml setelah air dan toluen memisah sempurna. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1998). Perhitungan kadar air dapat dilihat pada Lampiran 8, halaman 55.
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Uapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105°C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar sari yang larut dalam air dapat dilihat pada Lampiran 9, halaman 56.
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam lalu disaring cepat untuk menghindari penguapan etanol. Uapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai diperoleh bobot tetap. Kadar sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar sari
yang larut dalam etanol dapat dilihat pada Lampiran 10, halaman 57. 3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600°C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar abu total dapat dilihat pada Lampiran 11, halaman 58.
3.5.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar abu yang tidak larut dalam asam dapat dilihat pada Lampiran 12, halaman 59.
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida sebagai berikut:
endapan menggumpal berwarna putih atau putih kekuningan.
b. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Bouchardat, maka akan terbentuk endapan berwarna coklat.
c. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Dragendorff, maka akan terbentuk endapan warna merah atau jingga.
Alkaloida disebut positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan diatas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966). 3.6.3 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 ml campuran dari 7 bagian etanol 95% dan 3 bagian air suling, kemudian ditambahkan 10 ml HCl 2 N dan direfluks selama 10 menit, didinginkan, lalu disaring. Sebanyak 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran 2 bagian isopropanol dan 3 bagian kloroform, perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan Na2SO4 anhidrat,
disaring kemudian diuapkan pada temperatur tidak lebih dari 50°C, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut: sepersepuluh ml larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Sisa penguapan ditambahkan 2 ml air dan 5 tetes
larutan pereaksi Molish, lalu ditambahkan dengan hati-hati 2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan (Depkes RI, 1995).
3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %. Terbentuknya warna biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N (Depkes RI, 1995).
3.6.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa pengupan ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard), diteteskan pada saat akan mereaksikan sampel uji. Terbentuknya warna biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak Etanol Kulit Buah Sawo Manila
Sebanyak 300 g serbuk simplisia dimasukkan kedalam wadah kaca yang bertutup, cairan penyari (etanol 96%) dituangi sampai semua simplisia terendam,
biarkan sekurang-kurangnya selama 3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator sambil tiap kali di tekan hati-hati, tuangi cairan penyari secukupnya sampai cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator ditutup dan dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya hingga selalu terdapat selapis cairan penyari diatas simplisia. Perkolasi dihentikan hingga 500 mg perkolat yang keluar terakhir diuapkan tidak meninggalkan sisa. Perkolat yang diperoleh dipekatkan dengan alat penguap rotary evaporator (Depkes RI, a.2000). Bagan pembuatan ekstrak etanol dapat dilihat pada Lampiran 7, halaman 52.
3.7.1 Pembuatan fraksi-fraksi dari ekstrak etanol
Sebanyak 30 g ekstrak etanol dilarutkan dengan 60 ml etanol dan ditambahkan 150 ml air suling, dimasukkan ke dalam corong pisah, ditambahkan 150 ml n-heksana, dikocok, didiamkan sampai lapisan terpisah, pisahkan, diambil lapisan n-heksana dan diuapkan. Lapisan air ditambahkan 150 ml etilasetat, dikocok, didiamkan sampai lapisan terpisah, pisahkan, diambil lapisan etilasetat, diuapkan, selanjutnya diambil fraksi air dan diuapkan. Masing-masing fraksi di uji aktivitas antibakteri. Bagan pembuatan fraksi dapat dilihat pada Lampiran 7, halaman 53.
3.8 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan di dalam oven pada suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15 menit. Jarum ose dan pinset disterilkan dengan lampu bunsen (Lay, 1994).
3.9 Pembuatan Media
3.9.1 Media nutrient agar (NA)
Komposisi: Lab-Lemco Powder 1 g/L Yeast Extract 2 g/L
Peptone 5 g/L
Sodium Chloride 5 g/L
Agar 15 g/L
Cara pembuatan: Sebanyak 28 g nutrien agar (NA) disuspensikan kedalam air suling 1000 ml, lalu dipanaskan sampai bahan larut sempurna dan disterilkan di dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.9.2 Media nutrient broth (NB)
Komposisi: Lab-Lemco Powder 1 g/L Yeast Extract 2 g/L
Peptone 5 g/L
Sodium Chloride 5 g/L
Cara pembuatan : Sebanyak 13 g media nutrient broth (NB) dilarutkan dengan air suling 1000 ml, lalu dipanaskan sampai larut sempurna, kemudian media dimasukkan dalam erlenmeyer steril yang bertutup dan disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.10 Pembuatan Media Agar Miring
Tabung reaksi yang steril dimasukkan 3 ml media nutrient agar steril yang sebelumnya sudah dicairkan, kemudian didiamkan sampai memadat pada posisi miring membentuk sudut 30-45º dan disimpan dalam lemari pendingin pada suhu 5ºC.
3.11 Pembuatan Stok Kultur
Biakan bakteri Staphylococcus aureus diambil dengan jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2°C selama 18-24 jam. Prosedur yang sama juga dilakukan pada biakan bakteri Escherichia coli. Bagan pembuatan stok kultur dapat dilihat pada Lampiran 7, halaman 54.
3.12 Penyiapan Inokulum Bakteri
Koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media
nutrient broth steril lalu diinkubasikan pada suhu 35 ± 2°C sampai didapat
kekeruhan dengan transmitan 25% menggunakan alat spektrofotometer UV panjang gelombang 580 nm (Ditjen POM, 1995). Prosedur yang sama juga dilakukan untuk koloni bakteri Escherichia coli. Bagan pembuatan inokulum bakteri dapat dilihat pada Lampiran 7, halaman 54.
3.13 Pembuatan Larutan Uji Ekstrak Etanol, Fraksi n-Heksana, Fraksi Etilasetat dan Fraksi Air Kulit Buah Sawo Manila dengan Berbagai Konsentrasi
Ekstrak etanol dan fraksi air masing-masing ditimbang sebanyak 1 g, kemudian dilarutkan dalam dimetilsulfoksida (DMSO) sebanyak 2 ml sedangkan fraksi n-heksana dan fraksi etilasetat masing-masing ditimbang sebanyak 0,5 g, kemudian dilarutkan dalam dimetilsulfoksida (DMSO) sebanyak 1 ml. Masing-masing diaduk hingga larut dan didapat konsentrasi 500 mg/ml, kemudian dibuat pengenceran dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml dan 50 mg/ml.
3.14 Pengujian Aktivitas Antibakteri Secara In Vitro
Sebanyak 0,1 ml inokulum (Staphylococcus aureus) dimasukkan ke dalam cawan petri steril, setelah itu dituang media Nutrient Agar (NA) yang telah dicairkan sebanyak 15 ml dengan suhu 45-50°C dihomogenkan sampai media dan bakteri tercampur rata, kemudian dibiarkan sampai media memadat. Cakram kertas yang telah direndam dengan ekstrak/fraksi dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko diletakkan pada media yang telah padat, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2°C selama 18-24 jam. Diameter daerah hambat di sekitar larutan penguji diukur dengan menggunakan jangka sorong (Ditjen POM, 1995). Prosedur yang sama juga dilakukan terhadap
Escherichia coli. Bagan pengujian aktivitas antibakteri dapat dilihat pada
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense Bidang Botani Pusat Penelitian dan Pengembangan Biologi–LIPI Bogor, di Cibinong menunjukkan bahwa bahan tumbuhan adalah buah sawo manila, jenis
Manilkara zapota (L.) P. Royen, suku Sapotaceae.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik morfologi luar kulit buah sawo manila segar yaitu permukaan kulitnya sedikit kasar, panjangnya ± 3 cm dan lebarnya ± 2 cm. Pemeriksaan organoleptis kulit buah sawo manila segar yaitu berwarna coklat muda, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan makroskopik morfologi luar simplisia kulit buah sawo manila yaitu permukaan kulitnya sedikit kasar, panjangnya ± 2,5 cm dan lebarnya ± 1,5 cm. Pemeriksaan organoleptis simplisia kulit buah sawo manila yaitu kulitnya berwarna coklat tua dan berkeriput, rasanya kelat dan agak pahit serta berbau khas.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari serbuk simplisia kulit buah sawo manila (Manilkara zapota (L.) P. Royen) menunjukkan adanya parenkim berisi sel minyak, serabut sklerenkim dan berkas pembuluh berbentuk spiral.
4.2.3 Hasil pemeriksaan karakteristik serbuk simplisia
pada Tabel 4.1 berikut.
Tabel 4.1. Data karakterisasi serbuk simplisia kulit buah sawo manila
Berdasarkan tabel di atas diperoleh kadar air sebesar 2,31 %. Kadar air yang diperoleh telah memenuhi persyaratan MMI yakni tidak melebihi 10%. Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah air yang terkandung dalam simplisia yang digunakan. Kadar air simplisia ditetapkan untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan pertumbuhan jamur/kapang (Depkes RI, b.2000).
Hasil karakterisasi kadar sari larut air diperoleh sebesar 64,48 % dan kadar sari larut dalam etanol diperoleh sebesar 59,60 %. Penetapan kadar sari dapat dilihat bahwa kadar sari yang larut dalam air lebih tinggi daripada kadar sari yang larut dalam etanol, hal ini menunjukkan bahwa senyawa yang terlarut dalam air lebih besar daripada senyawa yang terlarut dalam etanol. Senyawa-senyawa yang dapat larut dalam air adalah glikosida, tanin dan flavonoid sedangkan senyawa-senyawa yang dapat larut dalam etanol adalah glikosida, steroid/triterpenoid dan flavonoid (Depkes RI, b.2000).
Hasil karakterisasi kadar abu total diperoleh sebesar 6,32% dan kadar abu yang tidak larut asam diperoleh sebesar 0,49%. Penetapan kadar abu total dilakukan untuk memberikan gambaran kandungan mineral internal dan eksternal dari proses awal sampai terbentuknya ekstrak sedangkan penetapan kadar abu
No. Jenis karakterisasi Kadar (%)
1. Penetapan kadar air 2,31
2. Penetapan kadar sari larut air 64,48
3. Penetapan kadar sari larut etanol 59,60
4. Penetapan kadar abu 6,32
tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa yang tidak larut dalam asam, misalnya silika dan pasir (Depkes RI, b.2000).
4.3 Hasil Skrining Fitokimia
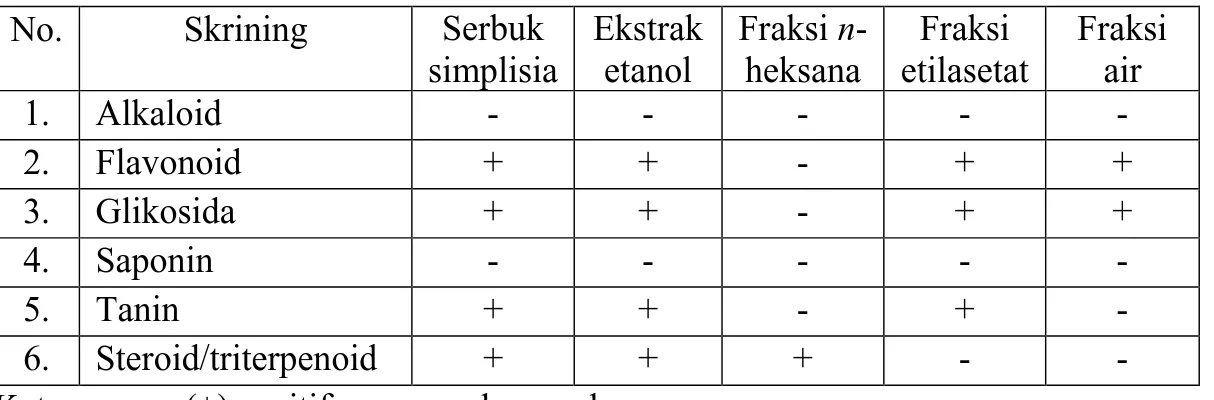
Hasil skrining fitokimia terhadap simplisia, ekstrak etanol, fraksi n -heksana, fraksi etilasetat dan fraksi air kulit buah sawo manila (Manilkara zapota (L.) P. Royen) dapat dilihat pada Tabel 4.2 sebagai berikut.
Tabel 4.2 Hasil skrining fitokimia kulit buah sawo manila No. Skrining Serbuk
simplisia Ekstrak etanol Fraksi n -heksana Fraksi etilasetat Fraksi air 1. Alkaloid - - - - - 2. Flavonoid + + - + + 3. Glikosida + + - + + 4. Saponin - - - - - 5. Tanin + + - + - 6. Steroid/triterpenoid + + + - -
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Serbuk simplisia dan ekstrak etanol kulit buah sawo manila yang ditambahkan pereaksi Molish dan asam sulfat pekat, terbentuk cincin berwarna ungu pada batas cairan hal ini menunjukkan adanya glikosida. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol kemudian dibiarkan memisah memberikan warna kuning jingga hal ini menunjukkan adanya senyawa flavonoid. Penambahan FeCl3 1% memberikan warna hijau kebiruan yang menunjukkan adanya senyawa tanin. Penambahan pereaksi Liebermann-Burchard memberikan warna ungu menunjukkan adanya steroid/triterpenoid. Fraksi n-heksana yang ditambahkan pereaksi Liebermann-Burchard memberikan warna ungu menunjukkan adanya steroid/triterpenoid. Fraksi etilasetat yang ditambahkan pereaksi Molish dan asam sulfat pekat, terbentuk cincin berwarna ungu pada batas
cairan hal ini menunjukkan adanya glikosida. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol kemudian dibiarkan memisah memberikan warna kuning jingga hal ini menunjukkan adanya senyawa flavonoid. Penambahan FeCl3 1% memberikan warna hijau kebiruan yang menunjukkan adanya senyawa tanin. Fraksi air yang ditambahkan pereaksi Molish dan asam sulfat pekat, terbentuk cincin berwarna ungu pada batas cairan hal ini menunjukkan adanya glikosida. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol kemudian dibiarkan memisah memberikan warna kuning jingga hal ini menunjukkan adanya senyawa flavonoid.
4.4 Hasil Ekstraksi Kulit Buah Sawo Manila
Hasil perkolasi 300 g serbuk kulit buah sawo manila (Manilkara zapota (L.) P. Royen) dengan pelarut etanol 96% yaitu sebanyak 85 g, kemudian dilakukan fraksinasi dari 30 g ekstrak etanol diperoleh hasil fraksi n-heksana 0,78 g, fraksi etilasetat 0,92 g dan fraksi air 24,47 g.
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol, Fraksi n-Heksana, Fraksi Etilasetat dan Fraksi Air Kulit Buah Sawo Manila terhadap Bakteri Staphylococcus aureus dan Escherichia coli
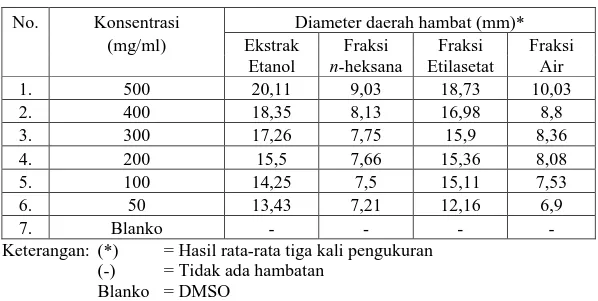
Hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air kulit buah sawo manila dapat menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli. Konsentrasi ekstrak semakin tinggi maka diameter hambat semakin besar, karena semakin banyak zat aktif yang terkandung dalam ekstrak tersebut (Dwijoseputro, 1994). Hasil pengukuran diameter daerah hambat ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air kulit buah sawo manila terhadap bakteri Staphylococcus aureus dan
Escherichia coli dapat dilihat pada Tabel 4.3 dan Tabel 4.4 berikut.
Tabel 4.3 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus
No. Konsentrasi Diameter daerah hambat (mm)*
(mg/ml) Ekstrak Fraksi Fraksi Fraksi
Etanol n-heksana Etilasetat Air
1. 500 20,53 16,46 20,46 19,88 2. 400 19,73 14,76 19,58 18,18 3. 300 18,63 10,93 17,83 16,75 4. 200 17,3 7,78 16,53 15,01 5. 100 16,25 7,31 15,48 13,8 6. 50 14,41 7,05 13,43 12,63 7. Blanko - - - -
Tabel 4.4 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Escherichia coli
No. Konsentrasi Diameter daerah hambat (mm)*
(mg/ml) Ekstrak Fraksi Fraksi Fraksi
Etanol n-heksana Etilasetat Air
1. 500 20,11 9,03 18,73 10,03 2. 400 18,35 8,13 16,98 8,8 3. 300 17,26 7,75 15,9 8,36 4. 200 15,5 7,66 15,36 8,08 5. 100 14,25 7,5 15,11 7,53 6. 50 13,43 7,21 12,16 6,9 7. Blanko - - - -
Keterangan: (*) = Hasil rata-rata tiga kali pengukuran (-) = Tidak ada hambatan
Blanko = DMSO
Berdasarkan Farmakope Indonesia (1995), batas daerah hambatan yang efektif adalah dengan diameter lebih kurang dari 14 mm sampai 16 mm. Tabel 4.3 dan 4.4 di atas menunjukkan bahwa ekstrak etanol memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus yang diperoleh pada konsentrasi 50 mg/ml dengan diameter daerah hambat 14,41 mm sedangkan pada
Escherichia coli diameter daerah hambat yang efektif pada konsentrasi 100 mg/ml
dengan diameter14,25 mm. Fraksi etilasetat memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus yang diperoleh pada konsentrasi 100
mg/ml dengan diameter daerah hambat 15,48 mm sedangkan pada Escherichia
coli diameter daerah hambat yang efektif pada konsentrasi 100 mg/ml dengan
diameter 15,11 mm. Fraksi air memberikan diameter daerah hambat yang efektif terhadap bakteri Staphylococcus aureus pada konsentrasi 200 mg/ml dengan diameter daerah hambat 15,01 mm sedangkan pada Escherichia coli memberikan diameter daerah hambat yang kurang efektif yang diperoleh pada konsentrasi 500 mg/ml dengan diameter 10,03 mm. Fraksi n-heksana memberikan diameter daerah hambat yang efektif pada Staphylococcus aureus yang diperoleh pada konsentrasi 400 mg/ml dengan diameter daerah hambat 14,76 mm sedangkan pada
Escherichia coli memberikan diameter daerah hambat yang kurang efektif yang
diperoleh pada konsentrasi 500 mg/ml dengan diameter 9,03 mm.
Aktivitas antibakteri yang didapatkan dari ekstrak etanol merupakan aktivitas antibakteri terkuat dalam menghambat pertumbuhan bakteri
Staphylococcus aureus dan Escherichia coli karena kandungan senyawa metabolit
sekunder yang terdapat dalam ekstrak etanol kulit buah sawo manila adalah golongan senyawa yang memiliki aktivitas antibakteri yang kuat yaitu flavonoid, glikosida, tanin dan steroid/triterpenoid.
Hasil uji aktivitas antibakteri fraksi n-heksana memberikan aktivitas antibakteri terendah dibandingan ekstrak etanol, fraksi etilasetat dan fraksi air. Hal ini disebabkan karena kandungan golongan senyawa yang terdapat dalam fraksi n -heksana sangat sedikit yaitu hanya steroid/triterpenoid. Menurut Naufalin, dkk., (2005), adanya minyak dan lemak yang terkandung pada ekstrak n-heksana dapat mengganggu aktivitas antibakteri. Minyak dan lemak mengganggu proses difusi dan melindungi bakteri dari senyawa antibakteri sehingga tidak mampu menghambat pertumbuhan bakteri.
Hasil penelitian menunjukkan bahwa pada bakteri Staphylococcus aureus memberikan diameter hambat lebih besar dibandingkan dengan bakteri
Escherichia coli. Menurut Volk (1992), perbedaan diameter daerah hambat pada
bakteri gram positif dengan bakteri gram negatif tersebut terjadi karena kedua bakteri uji tersebut memilki komposisi dan struktur dinding sel yang berbeda sehingga mengakibatkan bakteri gram positif lebih rentan terhadap senyawa-senyawa kimia dibandingkan gram negatif. Struktur dinding sel bakteri gram positif lebih sederhana, yaitu berlapis tunggal dengan kandungan lipid yang rendah (1 - 4%) sehingga memudahkan bahan bioaktif masuk ke dalam sel. Struktur dinding sel bakteri gram negatif lebih kompleks, yaitu berlapis tiga terdiri dari lapisan luar lipoprotein, lapisan tengah lipopolisakarida yang berperan sebagai penghalang masuknya bahan bioaktif antibakteri dan lapisan dalam berupa peptidoglikan dengan kandungan lipid tinggi (11 - 12%).
Aktivitas antibakteri dari ekstrak etanol dan fraksi kulit buah sawo manila disebabkan oleh adanya golongan senyawa kimia berupa flavonoid, glikosida, tanin dan steroid/triterpenoid. Senyawa flavonoid memiliki aktivitas antibakteri karena flavonoid merupakan golongan senyawa fenol. Tanin termasuk dalam golongan senyawa polifenol sehingga tanin memiliki aktivitas antibakteri. Senyawa fenol dan turunannya seperti flavonoid dan tanin merupakan salah satu antibakteri yang bekerja dengan mengganggu fungsi membran sitoplasma. Senyawa fenol pada konsentrasi rendah dapat merusak membran sitoplasma yang menyebabkan bocornya metabolit penting yang menginaktifkan sistem enzim bakteri sedangkan pada konsentrasi tinggi mampu merusak membran sitoplasma dan mengendapkan protein sel. Senyawa steroid/triterpenoid menghambat pertumbuhan bakteri dengan mekanisme penghambatan terhadap sintesis protein
karena terakumulasi dan menyebabkan perubahan komponen-komponen penyusun sel bakteri itu sendiri (Azmi, 2013). Membran sitoplasma bakteri sendiri berfungsi mengatur masuknya bahan-bahan makanan atau nutrisi, apabila membran sitoplasma rusak maka metabolit penting dalam bakteri akan keluar dan bahan makanan untuk menghasilkan energi tidak dapat masuk sehingga terjadi ketidakmampuan sel bakteri untuk tumbuh dan pada akhirnya terjadi kematian (Pelczar dan Chan, 1988).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil pemeriksaan makroskopik morfologi luar kulit buah sawo manila segar yaitu permukaan kulitnya sedikit kasar, panjangnya ± 3 cm dan lebarnya ± 2 cm. Pemeriksaan organoleptis kulit buah sawo manila segar yaitu berwarna coklat muda, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan makroskopik morfologi luar simplisia kulit buah sawo manila yaitu permukaan kulitnya sedikit kasar, panjangnya ± 2,5 cm dan lebarnya ± 1,5 cm. Pemeriksaan organoleptis simplisia kulit buah sawo manila yaitu kulitnya berwarna coklat tua dan berkeriput, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan mikroskopik serbuk simplisia kulit buah sawo manila memperlihatkan adanya parenkim berisi sel minyak, serabut sklerenkim dan berkas pembuluh berbentuk spiral. Hasil karakterisasi simplisia diperoleh kadar air sebesar 2,31%, kadar sari larut air sebesar 64,48%, kadar sari larut etanol sebesar 59,60%, kadar abu total sebesar 6,32% dan kadar abu yang tidak larut asam sebesar 0,49%.
b. Hasil skrining fitokimia menunjukkan bahwa simplisia dan ekstrak etanol kulit buah sawo manila mengandung golongan senyawa kimia flavonoid, glikosida, tanin dan steroid/triterpenoid; fraksi n-heksana mengandung senyawa steroid/triterpenoid; fraksi etilasetat mengandung senyawa flavonoid, glikosida dan tanin; fraksi air mengandung senyawa flavonoid dan glikosida.
c. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol, fraksi n -heksana, fraksi etilasetat dan fraksi air memiliki aktivitas sebagai antibakteri.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut untuk mengisolasi senyawa kimia yang bertanggung jawab terhadap sifat antibakteri yang dimiliki oleh kulit buah sawo manila.