KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
SARANG SEMUT (Myrmecodia tuberosa Jack. var versteegii)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NICE ASRINI MENDROFA
NIM 101501108
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
SARANG SEMUT (Myrmecodia tuberosa Jack. var versteegii)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NICE ASRINI MENDROFA
NIM 101501108
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
SARANG SEMUT (Myrmecodia tuberosa Jack. var versteegii.)
OLEH:
NICE ASRINI MENDROFA NIM 101501108
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 06 Februari 2015
Disetujui oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. Rosidah, M.Si., Apt. Dr. Marline Nainggolan, M.S., Apt. NIP 195103261978022001 NIP 195709091985112001
Prof. Dr. Rosidah, M.Si., Apt.
Pembimbing II, NIP 195103261978022001
Dra. Suwarti Aris, M.Si., Apt. Marianne, S.Si., M.Si., Apt. NIP 195107231982032001 NIP 198005202005012006
Dra. Aswita Hafni lubis, M.Si., Apt. NIP 195304031983032001
Medan, Maret 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa atas karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Sarang semut (Myrmecodia tuberosa Jack. var versteegii). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah memberikan ilmu dan fasilitas kepada penulis selama perkuliahan. Penulis juga mengucapkan terima kasih kepada Ibu Prof. Dr. Rosidah, M.Si., Apt., dan Ibu Dra. Suwarti Aris, M.Si., Apt., yang telah meluangkan waktu dan tenaga dalam membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Dr. Marline Nainggolan, M.S., Apt., selaku ketua penguji, Ibu Marianne, S.Si., M.Si., Apt., dan Ibu Dra. Aswita Hafni lubis, M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Ibu Prof. Dr. Rosidah, M.Si., Apt., selaku dosen pembimbing akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai.
atas limpahan kasih sayang, doa dan dukungan yang tak ternilai dengan apa pun. Penulis juga mengucapkan terima kasih kepada seluruh rekan-rekan yang telah banyak membantu serta teman-teman mahasiswa/i Farmasi Stambuk 2010 yang selalu mendoakan dan memberi semangat yang tiada henti.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Februari 2015 Penulis,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
SARANG SEMUT (Myrmecodia tuberosa Jack. var versteegii)
ABSTRAK
Sarang semut (Myrmecodia tuberosa Jack. var versteegii) merupakan salah satu obat tradisional yang banyak digunakan oleh masyarakat pulau Nias. Sarang semut mengandung senyawa flavonoid, tanin dan tokoferol yang memiliki efek antioksidan. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik simplisia, skrining fitokimia serta aktivitas antioksidan dari ekstrak etanol sarang semut.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut asam. Skrining fitokimia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Pengujian aktivitas antioksidan ekstrak etanol umbi sarang
semut menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) dilakukan dengan didiamkan selama 60 menit
pada suhu kamar lalu diukur absorbansinya pada panjang gelombang 516 nm dan pembanding adalah vitamin c.
Hasil karakterisasi simplisia sarang semut diperoleh kadar air 5,27%, kadar sari yang larut dalam air 16,66%, kadar sari yang larut dalam etanol 10,57%, kadar abu total 6,36% dan kadar abu yang tidak larut asam 0,33%. Skrining fitokimia diperoleh bahwa simplisia sarang semut mengandung senyawa flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid. Hasil pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa ekstrak etanol umbi sarang semut memiliki nilai IC50
44,23 ppm dan vitamin c 4,73 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICALS SCREENING AND ANTIOXIDANT ACTIVITY OF ETHANOL EXTRACT OF ANT PLANTS (Myrmecodia tuberosa Jack. var versteegii)
ABSTRACT
Ant plants (Myrmecodia tuberosa Jack. var versteegii) are one of the traditional’s drug that used by many people in Nias island. Ant plants contains flavonoid, tannin and tokoferol compounds that efficacious as an antioxidant. The purposes of this research was to determine the characteristics, phytochemicals screening and antioxidant activity of ethanol extract of ant plants.
Simplex characterization including level of water content, level of water-soluble extract, level of ethanol-water-soluble extract, level of total ash, and level of acid-insoluble ash. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tannin, and steroid/triterpenoid. The antioxidant activity tests of ethanol extract of ant plant’s tubers were calculated using DPPH (1,1-diphenyl-2-picrylhydrazil) radical scavenging method which has been allowed to stand for 60 minutes at room temperature and then absorbance was measured at a wavelength of 516 nm and the results were compared to vitamin c.
The ant plants simplex characterization results water content 5.27%, water-soluble extract concentration 16.66%, ethanol-water-soluble extract concentration 10.57%, total ash content 6.36%, and acid-insoluble ash 0.33%. The results of phytochemicals screening showed that the ant plants simplex contains flavonoid, tannin, glycoside, saponin and steroid/ triterpenoid. The results of antioxidant activity tests using DPPH radical scavenging method showed that ethanol extract of ant plant’s tubers has got IC50 value of 44.23 ppm and vitamin c 4.73 ppm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL .. ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan penelitian ... 5
1.5 Manfaat penelitian ... 5
1.6 Kerangka penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Uraian tumbuhan ... 7
2.1.1 Habitat ... 7
2.1.2 Morfologi tumbuhan ... 7
2.1.4 Nama daerah ... 8
2.1.5 Nama asing ... 8
2.1.2 Kandungan kimia dan kegunaan ... 8
2.2 Ekstraksi ... 9
2.3 Radikal bebas ... 11
2.4 Antioksidan ... 12
2.4.1 Vitamin c ... 13
2.4.2 Flavonoid ... 14
2.4.3 Vitamin e ... 15
2.5 Spektrofotometer UV-visibel ... 16
2.6 Metode pemerangkapan radikal bebas DPPH ... 16
2.6.1 Pelarut ... 18
2.6.2 Pengukuran panjang gelombang ... 18
2.6.3 Waktu Pengukuran ... 19
BAB III METODE PENELITIAN ... 20
3.1 Alat ... 20
3.2 Bahan .. ... 20
3.3 Penyiapan bahan tumbuhan ... 21
3.3.1 Pengumpulan bahan tumbuhan ... 21
3.3.2 Identifikasi tumbuhan ... 21
3.3.3 Pengolahan bahan tumbuhan ... 21
3.4 Pembuatan pereaksi ... 22
3.4.1 Pereaksi asam klorida 2 N ... 22
3.4.3 Pereaksi Bouchardat ... 22
3.4.4 Pereaksi Mayer ... 22
3.4.5 Pereaksi Dragendorff ... 22
3.4.6 Pereaksi besi (III) klorida 1% ... 23
3.4.7 Pereaksi Liebermann-Burchard ... 23
3.4.8 Pereaksi Molish ... 23
3.4.9 Pereaksi timbal (II) asetat 0,4 M ... 23
3.4.10 Pereaksi asam sulfat 2 N ... 23
3.4.11 Pereaksi kloralhidrat ... 23
3.5 Pemeriksaan karakteristik bahan tumbuhan ... 23
3.5.1 Pemeriksaan makroskopik ... 24
3.5.2 Pemeriksaan mikroskopik ... 24
3.5.3 Penetapan kadar air ... 24
3.5.4 Penetapan kadar sari yang larut dalam air ... 25
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 25
3.5.6 Penetapan kadar abu total ... 25
3.5.7 Penetapan kadar abu yang tidak larut asam ... 26
3.6 Skrining fitokimia ... 26
3.6.1 Pemeriksaan alkaloid ... 26
3.6.2 Pemeriksaan flavonoid ... 27
3.6.3 Pemeriksaan glikosida ... 27
3.6.5 Pemeriksaan saponin ... 27
3.6.6 Pemeriksaan tanin ... 28
3.7 Pembuatan ekstrak etanol umbi sarang semut (EEUSS) ... 28
3.8 Pengujian Aktivitas Antioksidan Menggunakan Metode Pemerangkapan Radikal Bebas DPPH ... ... 29
3.8.1 Prinsip metode pemerangkapan radikal bebas (DPPH) .... 29
3.8.2 Pembuatan larutan blanko ... 29
3.8.3 Pengukuran panjang gelombang serapan maksimum DPPH ... 29
3.8.4 Pembuatan larutan induk ... 29
3.8.4.1 Pembuatan larutan induk sampel uji ... 29
3.8.1.5 Pembuatan larutan induk vitamin c ... 30
3.8.5 Pembuatan larutan uji ... 30
3.8.5.1 Pembuatan larutan uji ekstrak etanol umbi sarang semut ... 30
3.8.5.2 Pembuatan larutan uji vitamin c ... 30
3.8.6 Analisis persen pemerangkapan radikal bebas DPPH ... 30
3.8.7 Waktu pengukuran ... 31
3.8.8 Analisis nilai IC50 ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Identifikasi Tumbuhan ... 32
4.2 Hasil Karakterisasi ... 32
4.2.1 Pemeriksaan makroskopik umbi sarang semut ... 32
4.2.2 Pemeriksaan makroskopik simplisia umbi sarang semut . 32 4.2.3 Pemeriksaan mikroskopik simplisia umbi sarang semut . 32 4.2.4 Hasil pemeriksaan karakteristik simplisia ... 33
4.4 Hasil Analisis Aktivitas Antioksidan Ekstrak Etanol Umbi
Sarang Semut (EEUSS) Metode DPPH ... 35
4.4.1 Hasil penentuan panjang gelombang serapan maksimum ... 35
4.4.2 Hasil analisis aktivitas antioksidan sampel uji ... 36
4.4.3 Hasil analisis nilai IC50 (Inhibitory Concentration) ... 38
BAB V KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia umbi sarang semut dari Desa Fadoroyou, Kecamatan Hiliduho, Kabupaten Nias dan
Kabupaten Mimika, Provinsi Papua ... 33 4.3 Hasil skrining fitokimia serbuk simplisia sarang semut ... 34 4.4 Penurunan absorbansi DPPH dengan penambahan ekstrak etanol
umbi sarang semut (EEUSS) menggunakan metode DPPH ... 37 4.5 Penurunan absorbansi DPPH dengan penambahan vitamin c
menggunakan metode DPPH ... 37 4.6 Hasil persamaan regresi linier dan hasil analisis IC50 yang
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ... 6
2.1 Rumus bangun vitamin c ... 14
2.2 Rumus bangun flavonoid ... 14
2.3 Rumus bangun α-tokoferol ... 15
2.4 Rumus bangun DPPH ... 17
2.5 Reaksi radikal bebas DPPH dengan antioksidan ... 18
4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel ... 35
4.2 Grafik hasil uji aktivitas antioksidan EEUSS ... 38
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan ... 45
2 Gambar tumbuhan sarang semut ... 46
3 Gambar makroskopik simplisia dan serbuk simplisia umbi sarang semut ... 48
4 Hasil pemeriksaan mikroskopik serbuk simplisia umbi sarang semut ... 49
5 Bagan penelitian ... 50
6 Gambar alat spektrofotometer UV-Visibel ... 51
7 Perhitungan hasil karakterisasi serbuk simplisia umbi sarang semut ... 52
8 Hasil orientasi konsentrasi larutan uji ... 56
9 Hasil uji aktivitas antioksidan metode DPPH ... 57
10 Perhitungan nilai aktivitas antioksidan metode DPPH ... 58
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
SARANG SEMUT (Myrmecodia tuberosa Jack. var versteegii)
ABSTRAK
Sarang semut (Myrmecodia tuberosa Jack. var versteegii) merupakan salah satu obat tradisional yang banyak digunakan oleh masyarakat pulau Nias. Sarang semut mengandung senyawa flavonoid, tanin dan tokoferol yang memiliki efek antioksidan. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik simplisia, skrining fitokimia serta aktivitas antioksidan dari ekstrak etanol sarang semut.
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut asam. Skrining fitokimia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Pengujian aktivitas antioksidan ekstrak etanol umbi sarang
semut menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) dilakukan dengan didiamkan selama 60 menit
pada suhu kamar lalu diukur absorbansinya pada panjang gelombang 516 nm dan pembanding adalah vitamin c.
Hasil karakterisasi simplisia sarang semut diperoleh kadar air 5,27%, kadar sari yang larut dalam air 16,66%, kadar sari yang larut dalam etanol 10,57%, kadar abu total 6,36% dan kadar abu yang tidak larut asam 0,33%. Skrining fitokimia diperoleh bahwa simplisia sarang semut mengandung senyawa flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid. Hasil pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa ekstrak etanol umbi sarang semut memiliki nilai IC50
44,23 ppm dan vitamin c 4,73 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICALS SCREENING AND ANTIOXIDANT ACTIVITY OF ETHANOL EXTRACT OF ANT PLANTS (Myrmecodia tuberosa Jack. var versteegii)
ABSTRACT
Ant plants (Myrmecodia tuberosa Jack. var versteegii) are one of the traditional’s drug that used by many people in Nias island. Ant plants contains flavonoid, tannin and tokoferol compounds that efficacious as an antioxidant. The purposes of this research was to determine the characteristics, phytochemicals screening and antioxidant activity of ethanol extract of ant plants.
Simplex characterization including level of water content, level of water-soluble extract, level of ethanol-water-soluble extract, level of total ash, and level of acid-insoluble ash. Phytochemical screening of simplex powder including determination alkaloid, flavonoid, glycoside, saponin, tannin, and steroid/triterpenoid. The antioxidant activity tests of ethanol extract of ant plant’s tubers were calculated using DPPH (1,1-diphenyl-2-picrylhydrazil) radical scavenging method which has been allowed to stand for 60 minutes at room temperature and then absorbance was measured at a wavelength of 516 nm and the results were compared to vitamin c.
The ant plants simplex characterization results water content 5.27%, water-soluble extract concentration 16.66%, ethanol-water-soluble extract concentration 10.57%, total ash content 6.36%, and acid-insoluble ash 0.33%. The results of phytochemicals screening showed that the ant plants simplex contains flavonoid, tannin, glycoside, saponin and steroid/ triterpenoid. The results of antioxidant activity tests using DPPH radical scavenging method showed that ethanol extract of ant plant’s tubers has got IC50 value of 44.23 ppm and vitamin c 4.73 ppm.
BAB I
PENDAHULUAN
1.1.Latar belakang
Pemanfaatan bahan alam sebagai obat tradisional akhir-akhir ini sangat meningkat di Indonesia, bahkan beberapa bahan alam telah diproduksi dalam skala besar. Penggunaan obat tradisional dinilai memiliki efek samping yang lebih kecil dibandingkan dengan obat yang berasal dari bahan kimia. Selain itu, keuntungan lain penggunaan obat tradisional adalah bahan bakunya mudah diperoleh dan juga harganya relatif murah (Roslizawaty, dkk., 2013).
Salah satu tumbuhan berkhasiat yang digunakan sebagai obat adalah tumbuhan sarang semut (Myrmecodia tuberosa), dari suku Rubiaceae. Tumbuhan ini merupakan tumbuhan epifit yang menempel di pohon-pohon besar dan dapat ditemukan di daerah Sumatera, Kalimantan dan Papua (Florentinus, 2012; Roslizawaty, dkk., 2013). Tumbuhan sarang semut banyak ditemukan di hutan tropis dataran rendah dan daerah pertanian terbuka dengan ketinggian 600 m (Florentinus, 2012). Lingkungan tempat tumbuh, keadaan tanah, dan cuaca yang berbeda mempengaruhi pertumbuhan tanaman sehingga mengakibatkan perbedaan kadar kandungan senyawa aktif. Perbedaan jenis tumbuhan juga memberikan perbedaan pada kandungan senyawa aktif, sehingga mutu simplisia yang dihasilkan akan berbeda (Depkes RI, 1985).
kanker, diabetes, dan asam urat. Bagian tumbuhan yang digunakan sebagai obat adalah umbi dari batang yang menggelembung dengan bagian dalamnya berbentuk rongga bersekat-sekat sebagai tempat tinggal koloni semut (Hermawati dan Arumsari, 2014).
Ekstrak rebusan air tumbuhan sarang semut dapat memperlancar air susu ibu (ASI), meningkatkan gairah seksual bagi pria maupun wanita dan berguna untuk memperlancar haid, serta mengatasi keputihan (Subroto dan Saputro, 2006). Tumbuhan ini juga dapat dimanfaatkan sebagai anti kanker (Sujuti, dkk., 2013), menurunkan kadar asam urat (Rosany, dkk., 2012) dan antimikroba (Yuli dan Triana, 2013).
Penelitian dari Noya, dkk., (2013) menunjukkan bahwa fraksi air dan fraksi kloroform dari ekstrak metanol sarang semut dengan metode penambahan H2O2 sebagai penghasil radikal bebas hidroksil memiliki aktivitas antioksidan.
Hasil analisis GC-MS fraksi kloroform ekstrak tersebut mengandung senyawa monoterpen, fenol, dan flovon.
Hasil uji fitokimia menunjukkan tumbuhan sarang semut mengandung senyawa kimia golongan flavonoid dan tanin. Tumbuhan ini juga mengandung 313 ppm tokoferol yang meredam 96% radikal bebas pada konsentrasi 12 ppm (Subroto dan Saputro, 2006) dan mineral penting seperti kalsium, natrium, kalium, seng, besi, fosfor dan magnesium (Hermawati dan Arumsari, 2014).
akan mengakibatkan zat atau senyawa lain tersebut kekurangan elektron, sehingga zat atau senyawa lain tersebut menjadi radikal (Muchtadi, 2013). Kerusakan jaringan oleh radikal bebas merupakan pemicu terjadinya berbagai penyakit degeneratif seperti kanker, penyakit kardiovaskular, gangguan penglihatan termasuk katarak, penyakit saluran pernapasan dan lain-lain (Silalahi, 2006).
Antioksidan merupakan atom atau molekul pemberi elektron yang dapat meredam dampak negatif radikal bebas. Antioksidan mampu menetralkan radikal bebas atau bahan yang dapat mencegah sistem biologi tubuh dari efek yang merugikan yang timbul dari proses ataupun reaksi yang menyebabkan oksidasi yang berlebihan. Apabila ketersediaan antioksidan dalam tubuh tidak memadai, maka daya tahan tubuh akan menurun sehingga terjadi proses penuaan dini, dan timbulnya berbagai penyakit (Noya, dkk., 2013).
1.2.Perumusan masalah
Berdasarkan uraian pada latar belakang di atas, maka perumusan masalah penelitian adalah:
a. Apakah karakteristik simplisia umbi sarang semut yang berasal dari pulau Nias berbeda dengan karakteristik simplisia umbi sarang semut yang berasal dari Papua?
b. Apakah golongan senyawa kimia yang terkandung di dalam simplisia umbi sarang semut?
c. Apakah ekstrak etanol umbi sarang semut memiliki aktivitas sebagai antioksidan?
d. Apakah aktivitas antioksidan dari ekstrak etanol umbi sarang semut lebih kuat dari aktivitas antioksidan vitamin c?
1.3.Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis penelitian ini adalah sebagai berikut:
1. Karakteristik simplisia umbi sarang semut dari pulau Nias berbeda dengan karakteristik simplisia umbi sarang semut yang berasal dari Papua
2. Golongan senyawa kimia yang terkandung di dalam simplisia umbi sarang semut adalah alkaloid, flavonoid, saponin, tanin, steroid/triterpenoid, dan glikosida
3. Ekstrak etanol umbi sarang semut memiliki aktivitas sebagai antioksidan
1.4.Tujuan penelitian
Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, golongan senyawa kimia dan aktivitas antioksidan dengan mengukur kemampuan antioksidan dari ekstrak etanol umbi sarang semut dalam memerangkap radikal bebas DPPH dibandingkan dengan vitamin c sebagai kontrol positif.
1.5. Manfaat penelitian
1.6. Kerangka penelitian
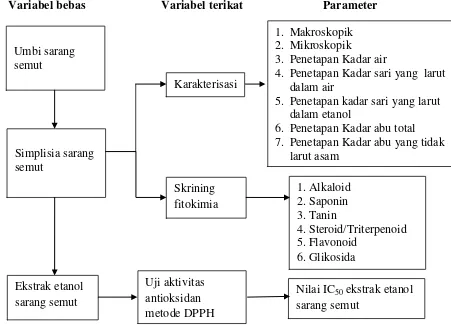
Skema kerangka penelitian ini dapat dilihat pada gambar 1.1 berikut:
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Skema kerangka penelitian Umbi sarang
semut
Karakterisasi
1. Makroskopik 2. Mikroskopik
3. Penetapan Kadar air
4. Penetapan Kadar sari yang larut dalam air
5. Penetapan kadar sari yang larut dalam etanol
6. Penetapan Kadar abu total 7. Penetapan Kadar abu yang tidak
larut asam
Nilai IC50 ekstrak etanol
BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Uraian tumbuhan meliputi habitat, morfologi, sistematika, nama asing, nama daerah, kandungan dan kegunaan dari tumbuhan sarang semut.
2.1.1 Habitat
Sarang semut adalah tumbuhan epifit yang menempel atau mengantung pada tumbuhan inang yang berasal dari Asia Tenggara dan kepulauan besar Queensland di Australia dan kepulauan Solomon di Pasifik. Tumbuhan ini dapat tumbuh mulai dari dataran rendah di tepi pantai hingga daerah dengan ketinggian 2.400 meter di atas permukaan laut (Hermawati dan Arumsari, 2014).
2.1.2 Morfologi tumbuhan
Tumbuhan sarang semut memiliki panjang 30-45 cm dengan batang tebal mengelembung berbentuk silindris berdiameter 10-30 cm, tidak bercabang, berwarna coklat muda hingga abu-abu. Permukaan dipenuhi duri-duri tajam dan bagian dalam berbentuk rongga bersekat-sekat sebagai tempat tinggal koloni semut.
2.1.3 Sistematika tumbuhan
Menurut Herbarium Medanense (2014), sistematika tumbuhan sarang semut adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Rubiales Suku : Rubiaceae Genus : Myrmecodia
Spesies : Myrmecodia tuberosa Jack. var versteegii 2.1.4 Nama daerah
Indonesia mengenal tumbuhan ini dengan sebutan sarang semut. Nama daerah dari tumbuhan sarang semut, yaitu urek-urek polo (Jawa); rumah semut atau kepala beruk (Sumatera); angkis, anggrek sarang semut atau anggrek tengkorak (Kalimantan); nongon, lokon, suhendep (Papua) (Hermawati dan Arumsari, 2014).
2.1.5 Nama asing
Ant plant (Inggris); hua rou ru (Thailand); periok hantu, perutak, sembuku
(Malaysia); ki nan, ki nam gai, ki nam kin (Vietnam) (Hermawati dan Arumsari, 2014).
2.1.6 Kandungan kimia dan kegunaan
mengandung beberapa mineral penting seperti kalsium, natrium, kalium, seng, besi, fosfor dan magnesium. Umbi sarang semut digunakan untuk mengobati penyakit kanker, tumor, asam urat, jantung, tuberkulosis paru, diabetes, melancarkan produksi asi, dan beberapa penyakit lain (Hermawati dan Arumsari, 2014).
2.2 Ekstraksi
Ekstrak yaitu sediaan kental atau cair yang diperoleh dengan cara mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan (Depkes RI, 1995).
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan tertentu (Harborne, 1987). Penarikan zat aktif dari bahan asal (simplisia) dilakukan dengan pelarut yang sesuai. Tujuan utama dari ekstraksi adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan. (Depkes RI, 2000).
Menurut Depkes RI (2000), ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu:
a. Cara dingin Maserasi
Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan panambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh perkolat.
b. Cara panas Refluks
Refluks adalah proses penyarian simplisia menggunakan alat dengan pendingin balik pada temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50°C.
Sokletasi
Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit.
Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
2.3 Radikal bebas
Radikal bebas didefenisikan sebagai suatu atom atau molekul yang mempunyai satu atau lebih elektron tidak berpasangan pada orbital terluarnya, bersifat sangat reaktif dan tidak stabil (Muchtadi, 2013). Untuk mencapai kestabilan, radikal bebas akan bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron dan dapat mengubah suatu molekul menjadi radikal (Winarsi, 2011). Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, jantung koroner, katarak, serta penyakit degeneratif lainnya (Muchtadi, 2013; Sudiana, 2008).
Menurut Kumalaningsih (2006), pembentukan radikal bebas melalui 3 tahapan reaksi, yaitu:
- Tahap inisiasi: tahap awal terbentuknya radikal bebas.
- Tahap propagasi: tahap perpanjangan radikal berantai, dimana terjadi reaksi antara suatu radikal dengan senyawa lain dan menghasilkan radikal baru. - Tahap terminasi: adalah tahap akhir, terjadinya pengikatan suatu radikal bebas
dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya.
Radikal bebas ini antara lain golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), nitrogen dioksida (NO2), peroksidal (RO-2),
peroksinitrit (ONOO-), asam hipoklorit (HOCl), hydrogen peroksida (H2O2), ozon
(O3), dinitrogen trioksida (N2O3), lipid peroksida (LOOH) (Silalahi, 2006;
Pham-Huy, dkk., 2008).
2.4 Antioksidan
Antioksidan merupakan senyawa yang mampu meredam atau menghambat aktivitas senyawa oksidan dalam tubuh dengan cara mendonorkan elektronnya atau disebut reduktan (Winarsi, 2011). Antioksidan dikelompokkan menjadi dua golongan berdasarkan mekanisme kerjanya, yaitu antioksidan primer (enzimatis) dan antioksidan sekunder (non-enzimatis) (Hamid, dkk., 2010).
radikal superoksida (O2˙−) menjadi hidrogen peroksida (H2O2), enzim katalase
dan glutation peroksidase akan mengubah hidrogen peroksida (H2O2) menjadi air
(H2O) (Hamid, dkk., 2010). Kerja enzim-enzim ini sangat dipengaruhi oleh
mineral-mineral seperti mangan (Mn), selenium (Se), zink (Zn) dan tembaga (Cu) (Kumalaningsih, 2006).
Antioksidan sekunder senyawa fenol yang berfungsi untuk menangkap radikal bebas dan menghentikan reaksi berantai. Antioksidan sekunder juga disebut sebagai antioksidan preventif, dimana pembentukan senyawa oksigen reaktif dihambat dengan cara pengkelatan metal. Antioksidan ini meliputi:
- Antioksidan vitamin, contoh: vitamin a, c, e.
- Senyawa fitokimia, contoh: flavonoid, katekin, karotenoid, β-karoten.
- Antioksidan sintetik, contoh: BHA (butylated hydroxyl anisole), BHT (butylated hydroxytoluene), PG (propyl gallate), EDTA (ethylene diamine tetraacetic acid), TBHQ (tertiary butyl hydroquinone) dan NDGA (nordihydro
guaretic acid) (Hamid, dkk., 2010).
2.4.1 Vitamin c
Vitamin c atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Pemerian vitamin c adalah hablur atau serbuk berwarna
Vitamin c bekerja melindungi bagian tubuh dari radikal bebas yang larut dalam air dengan mendonorkan elektronnya ke dalam reaksi biokimia intraseluler dan ekstraseluler. Vitamin c mampu bereaksi dengan radikal bebas dan mengubahnya menjadi radikal askorbil yang kurang reaktif, kemudian membentuk asam monodehidroaskorbat dan atau asam dehidroaskorbat. Bentuk tereduksi ini dapat diubah kembali menjadi asam askorbat oleh enzim monodehidroaskorbat reduktase dan dehidroaskorbat reduktase (Packer, 2002). Rumus bangun vitamin c dapat dilihat pada Gambar 2.1 di bawah ini:
Gambar 2.1 Rumus bangun vitamin c
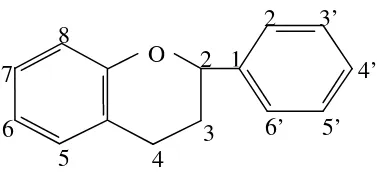
2.4.2 Flavonoid
Senyawa flavonoid merupakan salah satu senyawa polifenol terbesar yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi (C6–C3–C6), yaitu dua cincin aromatik yang dihubungkan oleh satuan
3 karbon (Markham, 1988). Rumus bangun turunan flavonoid dapat dilihat pada Gambar 2.2 berikut:
HO-C-Flavonoid mencakup banyak pigmen yang terdapat dalam fungus hingga angiospermae. Umumnya terdapat pada tumbuhan dalam bentuk terikat pada gula sebagai glikosida sehingga untuk menganalisis flavonoid, lebih baik ekstrak tumbuhan dihidrolisis terlebih dahulu untuk memecah ikatan gula dengan aglikon (Harborne, 1987). Senyawa ini adalah senyawa pereduksi yang dapat menghambat reaksi oksidasi sehingga dapat dijadikan sebagai antioksidan (Robinson, 1991). Senyawa ini berperan sebagai donor hidrogen terhadap radikal bebas karena mengandung gugus hidroksil (Silalahi, 2006).
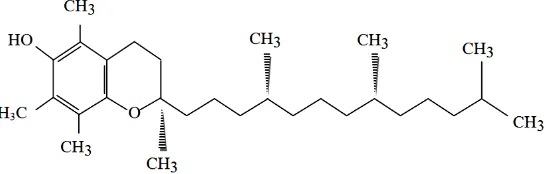
2.4.3 Vitamin e
Vitamin e (tokoferol) merupakan antioksidan primer yang dapat mencegah terjadinya rentetan reaksi radikal bebas. Bersifat tidak larut dalam air tetapi larut dalam lemak atau minyak. Vitamin e (tokoferol) memiliki 8 bentuk, yaitu 4 tokoferol alfa, beta, gamma, dan delta serta 4 tokotrienol. Dari 8 bentuk tersebut yang bermanfaat bagi aktivitas biologis dalam tubuh adalah alfa yang ditemukan dalam darah dan jaringan tubuh (Kumalaningsih, 2006). Rumus bangun α -tokoferol dapat dilihat pada Gambar 2.3 berikut:
2.5 Spektrofotometer UV-visibel
Menurut Dachriyanus (2004), spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan sinar tampak yang diabsorbsi oleh sampel. Sinar ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak berada pada panjang gelombang 400-800 nm. Spektrofotometer UV-Vis pada umumnya digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Menganalisis senyawa organik secara kuantitatif.
Berdasarkan aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan kemudian ditentukan dengan membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang diserap (Gandjar dan Rohman, 2007).
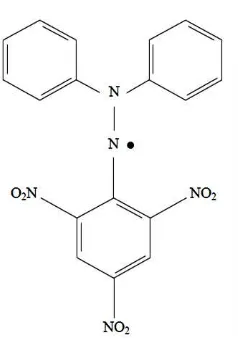
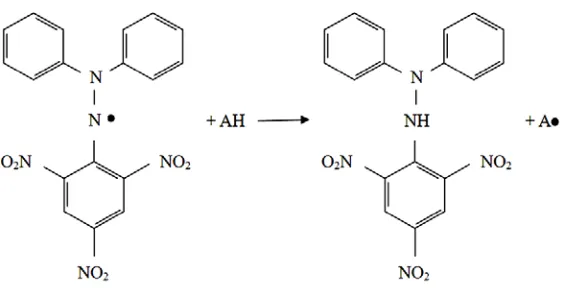
2.6 Metode pemerangkapan radikal bebas DPPH
Metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) merupakan metode yang cepat, sederhana, dan tidak mahal untuk
mengukur kemampuan berbagai senyawa dalam memerangkap radikal bebas serta untuk mengevaluasi aktivitas antioksidan pada bahan makanan dan minuman (Marinova, 2011).
Renn. DPPH berwarna ungu pekat seperti KMnO4 dan bentuk tereduksinya 1,1-diphenyl-2-picrylhydrazine (DPPH-H) berwarna jingga kekuningan, bersifat
tidak larut dalam air (Ionita, 2005). Rumus bangun DPPH dapat dilihat pada Gambar 2.4 berikut:
Gambar 2.4 Rumus bangun DPPH
Gambar 2.5 Reaksi radikal bebas DPPH dengan antioksidan
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004). 2.6.1 Pelarut
Metode DPPH akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.6.2 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Rohman, 2007). Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
2.6.3 Waktu pengukuran
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Penelitian meliputi pengumpulan bahan tumbuhan, identifikasi bahan tumbuhan, skrining fitokimia, pembuatan ekstrak etanol umbi sarang semut (EEUSS) pengujian aktivitas antioksidan dari EEUSS dengan metode aktivitas pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhidrazyl) yang diukur dengan menggunakan spektrofotometer UV-Visible. Penelitian ini dilakukan di Laboratorium Farmakognosi dan Laboratorium Biofarmasetika dan Farmakokinetika, Fakultas Farmasi, Universitas Sumatera Utara. Bagan Penelitian dapat dilihat pada Lampiran 5, halaman 50.
3.1Alat
Alat-alat yang digunakan pada penelitian ini terdiri dari alat-alat gelas laboratorium, lemari pengering, blender, rotary evaporator, freeze dryer, mikroskop, neraca analitik (Boeco Germany), seperangkat alat penetapan kadar air, cawan porselen, oven (Memmert), penangas air, desikator, krus silikat, tanur dan spektrofotometer UV-Visible (UVmini-1240 Shimadzu). Gambar alat spektrofotometer UV-Visibel (UVmini-1240 Shimadzu) dapat dilihat pada Lampiran 6, halaman 51.
3.2Bahan
berkualitas pro analisis (Sigma): 1,1-diphenyl-2-picrylhydrazyl (DPPH) (Aldrich); vitamin c (CSPC Welsheng Pharmaceutical CO., Ltd.); produksi E-Merck: amil alkohol, asam asetat anhidrida, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismuth (III) nitrat, isopropanol, kloroform, metanol, n-heksana, natrium hidroksida, raksa (II) klorida, serbuk magnesium
(Mg), timbal (II) asetat, kristal kloral hidrat, toluen, kalium iodida, α-naftol. Bahan kimia berkualitas teknis: etanol 96% dan air suling.
3.3 Penyiapan bahan tumbuhan
3.3.1 Pengumpulan bahan tumbuhan
Pengumpulan bahan tumbuhan dilakukan dengan metode purposif yaitu tanpa membandingkan dengan bahan tumbuhan yang sama dari daerah lain. Bahan tumbuhan yang digunakan adalah tumbuhan sarang semut (Myrmecodia tuberosa Jack. var versteegii) dari Desa Fadoroyou Kecamatan Hiliduho Kabupaten Nias, Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense (MEDA), Universitas Sumatera Utara.
3.3.3 Pengolahan bahan tumbuhan
ditimbang sebagai berat kering. Umbi yang telah kering diblender menjadi serbuk dan disimpan dalam wadah kering tertutup rapat.
3.4 Pembuatan pereaksi
3.4.1 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat ditambahkan dengan air suling hingga diperoleh 100 ml (Depkes RI, 1995).
3.4.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g natrium hidroksida dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.4 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.5 Pereaksi Dragendorff
3.4.6 Pereaksi besi (III) klorida 10%
Sebanyak 10 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.7 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam sulfat pekat tambahkan etanol hingga 50 ml (Depkes RI, 1995).
3.4.8 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.4.10 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat diencerkan dengan air suling sampai 100 ml (Depkes RI, 1995).
3.4.11 Pereaksi kloralhidrat
Sebanyak 8 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 10 ml air suling (Depkes RI, 1995).
3.5 Pemeriksaan karakteristik bahan tumbuhan
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan pada tumbuhan segar dan simplisia
yang meliputi pemeriksaan bentuk, ukuran, warna, bau, dan rasa. 3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia sarang semut. Serbuk simplisia ditaburkan pada dua kaca objek yang berbeda, yang telah ditetesi larutan kloralhidrat dan aquadest, kemudian ditutup dengan kaca penutup lalu masing-masing diamati di bawah mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, alat penampung, dan pendingin, tabung penyambung dan penerima 10 ml.
Cara kerja :
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (v/b) (WHO, 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara, dan sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600°C selama 3 jam, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung (Depkes RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring dengan kertas masir atau kertas saring bebas abu, cuci dengan air panas, dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung (Depkes RI, 1995).
3.6 Skrining fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. 3.6.1 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid. Ke dalam 3 tabung reaksi dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi :
1. ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan berwarna putih atau kuning.
2. ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk endapan berwarna coklat atau jingga kecoklatan.
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga pereaksi di atas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoid
Sebanyak 1 g serbuk ditambahkan 10 ml air panas, dididihkan selama 5
menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 50°C. Sisanya dilarutkan dalam 2 ml metanol. Larutan metanol digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish, kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes RI, 1995).
3.6.4Pemeriksaan saponin
kuat-kuat selama 10 detik. Terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.6.5Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 0,5 g, disari dengan 10 ml air suling selama 15 menit lalu disaring. Filtrat diencerkan dengan air suling sampai tidak berwarna. Pada filtrat ditambahkan 1-2 tetes peraksi besi (III) klorida 10%, jika terjadi warna biru kehitaman atau hijau kehitaman menunjukan adanya tanin (Farnsworth, 1966).
3.6.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru hijau atau warna merah ungu menunjukkan adanya steroid/triterpenoid (Farnsworth, 1966).
3.7 Pembuatan ekstrak etanol umbi sarang semut (EEUSS)
3.8 Pengujian aktivitas antioksidan menggunakan metode pemerangkapan radikal bebas DPPH
3.8.1Prinsip metode pemerangkapan radikal bebas (DPPH)
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas DPPH dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam
radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan sampel (Molyneux, 2004).
3.8.2Pembuatan larutan blanko
Sebanyak 10 mg DPPH ditimbang kemudian dimasukkan ke dalam labu tentukur 50 ml, dicukupkan volumenya dengan metanol sampai garis tanda, diperoleh larutan DPPH 0,5 mM (konsentrasi 200 ppm).
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan metanol sampai garis tanda (konsentrasi 40 ppm).
3.8.3Pengukuran panjang gelombang serapan maksimum DPPH
Larutan DPPH konsentrasi 40 µg/ml dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm yang merupakan panjang gelombang sinar tampak (Gandjar dan Rohman, 2007).
3.8.4Pembuatan larutan induk
3.8.4.1Pembuatan larutan induk sampel uji
3.8.4.2Pembuatan larutan induk vitamin c
Sebanyak 25 mg serbuk vitamin c ditimbang, dimasukkan ke dalam labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 ppm).
3.8.5Pembuatan larutan uji
3.8.5.1Pembuatan larutan uji ekstrak etanol umbi sarang semut (EEUSS)
Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk dipipet sebanyak 0,625 ml; 1,25 ml; 1,875 ml; 2,5 ml ke dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 25 ppm, 50 ppm, 75 ppm, 100 ppm kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 ppm) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer UV-visible pada panjang gelombang 516 nm. 3.8.5.2Pembuatan larutan uji vitamin c
Larutan induk dipipet sebanyak 0,05 ml; 0,1 ml; 0,2 ml; 0,4 ml ke dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 1 ppm, 2 ppm, 4 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer UV-visible pada panjang gelombang 516 nm.
3.8.6Analisis persen pemerangkapan radikal bebas DPPH
vitamin c sebagai kontrol positif, menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH), yaitu dihitung dengan rumus:
% inhibisi = x 100%
kontrol A
sampel A -kontrol A
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
3.8.7Waktu pengukuran
Lama pengukuran metode DPPH menurut beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit dan 60 menit (Molyneux, 2004; Rosidah, dkk., 2008).
3.8.8Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal bebas adalah nilai IC50 (Inhibitory Concentration). Nilai tersebut
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil identifikasi tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Medanense (MEDA), Universitas Sumatera Utara menunjukkan bahwa tumbuhan termasuk jenis Myrmecodia tuberosa Jack. var versteegii (Sarang Semut), suku Rubiaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 45.
4.2 Hasil karakterisasi
4.2.1 Pemeriksaan makroskopik umbi sarang semut
Hasil pemeriksaan makroskopik umbi sarang semut adalah memiliki bentuk bulat lonjong yang menggelembung membentuk bulatan berdiameter 10-30 cm, berwarna coklat tua, permukaan dipenuhi duri-duri tajam, bagian dalam berbentuk rongga bersekat-sekat sebagai tempat tinggal koloni semut, menempel atau menggantung pada tumbuhan inang. Gambar tumbuhan sarang semut dapat dilihat pada Lampiran 2, halaman 46-47.
4.2.2 Pemeriksaan makroskopik simplisia umbi sarang semut
Hasil pemeriksaan simplisia umbi sarang semut adalah simplisia berwarna coklat tua, memiliki bau yang khas yaitu seperti teh dan memiliki permukaan yang kasar, berasa tawar dan agak sepat. Gambar simplisia dan serbuk simplisia sarang semut dapat dilihat pada Lampiran 3, halaman 48.
4.2.3 Pemeriksaan mikroskopik simplisia umbi sarang semut
fragmen berisi pigmen, serat dan pembuluh kayu. Hasil pemeriksaan mikroskopik serbuk simplisia umbi sarang semut dapat dilihat pada Lampiran 4, halaman 49. 4.2.4 Hasil pemeriksaan karakteristik simplisia
Hasil pemeriksaan karakteristik simplisia umbi sarang semut dari Desa Fadoroyou, Kecamatan Hiliduho, Kabupaten Nias dibandingkan dengan hasil karakterisasi simplisia umbi sarang semut yang berasal dari Kabupaten Mimika, Provinsi Papua, oleh Falna Yati (2014) yang berjudul Karakterisasi dan Skrining Fitokimia serta Uji Efek Antidiare Ekstrak Etanol Umbi Sarang Semut (Myrmecodia tuberosa Jack.) pada tikus putih jantan. Hasil pemeriksaan kadar air, kadar sari yang larut dalam air, kadar sari yang larut dalam etanol, kadar abu total dan kadar abu yang tidak larut asam dapat dilihat pada Tabel 4.1 dan perhitungan hasil karakterisasi simplisia umbi sarang semut dapat dilihat pada Lampiran 7, halaman 52-55.
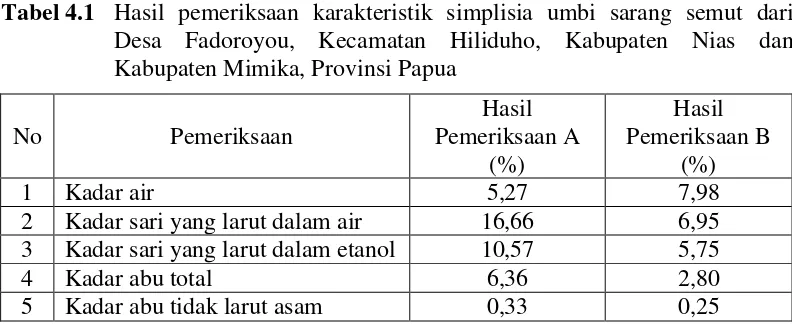
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia umbi sarang semut dari Desa Fadoroyou, Kecamatan Hiliduho, Kabupaten Nias dan Kabupaten Mimika, Provinsi Papua
No Pemeriksaan
A : simplisia umbi sarang semut dari Desa Fadoroyou, Kecamatan Hiliduho, Kabupaten Nias.
B : simplisia umbi sarang semut dari Kabupaten Mimika, Provinsi Papua.
dengan hasil pemeriksaan karakteristik simplisia umbi sarang semut dari Kabupaten Mimika, Provinsi Papua. Hal ini membuktikan bahwa tempat tumbuh mempengaruhi karakteristik tumbuhan sarang semut.
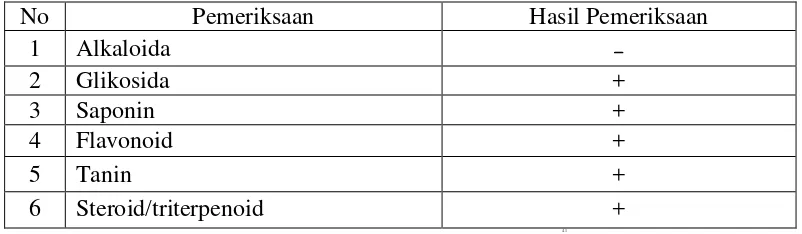
4.3 Hasil skrining fitokimia
Hasil skrining fitokimia terhadap simplisia umbi sarang semut diketahui bahwa tumbuhan mengandung golongan senyawa kimia seperti yang terlihat pada Tabel 4.2 berikut ini:
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia umbi sarang semut
No Pemeriksaan Hasil Pemeriksaan
1 Alkaloida
2 Glikosida +
3 Saponin +
4 Flavonoid +
5 Tanin +
6 Steroid/triterpenoid +
4.1
Keterangan:
+ = mengandung golongan senyawa, – = tidak mengandung golongan senyawa
senyawa steroid/triterpenoid (Farnsworth, 1966). Sarang semut memiliki potensi sebagai antioksidan, yaitu dengan adanya senyawa-senyawa yang mempunyai potensi sebagai antioksidan umumnya merupakan senyawa flavonoid (Kumalaningsih, 2006). Hasil uji fitokimia menunjukkan tumbuhan sarang semut mengandung senyawa kimia golongan flavonoid dan tanin. Flavonoid merupakan antioksidan alam yang mampu bertindak sebagai pereduksi radikal hidroksil, superoksida dan radikal peroksil. Selain itu, tumbuhan ini juga mengandung 313 ppm tokoferol yang meredam 96% radikal bebas pada konsentrasi 12 ppm (Subroto dan Saputro, 2006).
4.4 Hasil analisis aktivitas antioksidan ekstrak etanol umbi sarang semut (EEUSS)
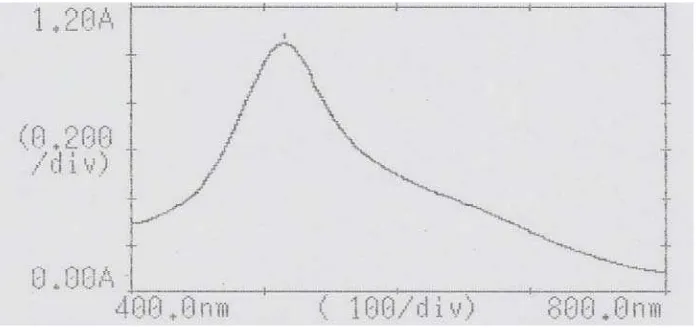
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Kurva panjang gelombang maksimum larutan DPPH dalam metanol dapat dilihat pada Gambar 4.1 berikut ini:
Gambar 4.1 Kurva Serapan Maksimum Larutan DPPH 40 ppm dalam Metanol Menggunakan Spektrofotometri UV-Visible
gelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar tampak (400-800 nm) (Gandjar dan Rohman, 2007) dan termasuk dalam rentang panjang gelombang DPPH yang berkisar antara 515, 516, 517, 518 dan 520 nm (Molyneux, 2004).
4.4.2 Hasil analisis aktivitas antioksidan sampel uji
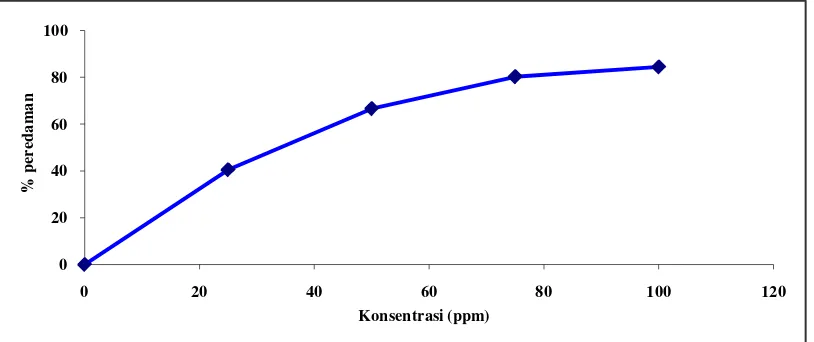
Aktivitas antioksidan ekstrak etanol umbi sarang semut diperoleh dari hasil pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan larutan uji dengan konsentrasi 25 ppm, 50 ppm, 75 ppm dan 100 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Penentuan konsentrasi larutan uji diperoleh dari orientasi konsentrasi larutan uji. Orientasi dilakukan untuk memperoleh konsentrasi larutan uji yang memiliki nilai absorbansi setengah dari nilai absorbansi larutan blanko. Selanjutnya konsentrasi larutan uji dibuat dengan rentang konsentrasi bertingkat untuk dapat mengetahui penurunan nilai absorbansi DPPH pada setiap kenaikan konsentrasi. Pada hasil analisis aktivitas antioksidan EEUSS dapat dilihat adanya penurunan nilai absorbansi DPPH yang diberi larutan uji terhadap kontrol pada setiap kenaikan konsentrasi. Tabel hasil orientasi konsentrasi larutan uji dapat dilihat pada lampiran 8, halaman 56.
Tabel 4.3 Penurunan absorbansi dan persen peredaman DPPH oleh EEUSS Larutan uji Konsentrasi (ppm) Absorbansi % pemerangkapan
EEUSS
Tabel 4.4 Penurunan absorbansi dan persen peredaman DPPH oleh vitamin c
Larutan uji Konsentrasi (ppm) Absorbansi % pemerangkapan
Vitamin c
Tabel hasil uji aktivitas antioksidan ekstrak etanol umbi sarang semut (EEUSS) dapat dilihat pada Lampiran 9, halaman 57, dan contoh perhitungan persen peredaman dapat dilihat pada Lampiran 10, halaman 58-59.
Hasil yang diperoleh menunjukkan bahwa adanya penurunan nilai absorbansi DPPH yang diberi EEUSS serta sebagai pembandingnya vitamin c dalam metanol pada setiap kenaikan konsentrasi. Penurunan absorbansi yang semakin besar menunjukkan aktivitas antioksidan yang semakin besar pula.
dengan warna larutan yang berubah dari ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang maksimumnya akan hilang (Molyneux, 2004).
Hubungan antara konsentrasi dengan persentase pemerangkapan radikal bebas DPPH oleh EEUSS dapat dilihat pada Gambar 4.2 dan untuk vitamin c dapat dilihat pada Gambar 4.3 berikut ini:
Gambar 4.2 Grafik hasil uji aktivitas antioksidan EEUSS
Gambar 4.3 Grafik hasil uji aktivitas antioksidan vitamin c
4.4.3 Hasil analisis nilai IC50 (Inhibitory Concentration)
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi linier yang
DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi sampel (ppm) sebagai absis (sumbu X) dan nilai % inhibisi sebagai ordinat (sumbu Y).
Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh untuk
ekstrak etanol umbi sarang semut dan vitamin c dapat dilihat pada Tabel 4.5 dan perhitungan nilai IC50 dapat dilihat pada Lampiran 11, halaman 60.
Tabel 4.5 Hasil persamaan regresi linier dan hasil analisis IC50 yang diperoleh
dari ekstrak etanol umbi sarang semut dan vitamin c
Larutan Uji Persamaan regresi IC50 (ppm)
EEUSS Y = 0,8345X + 12,625 44,23
Vitamin C Y = 5,7364X + 22,889 4,73
Hasil yang diperoleh menunjukkan bahwa ekstrak etanol umbi sarang semut memiliki aktivitas antioksidan kategori sangat kuat dengan nilai IC50 44,23
ppm, sama dengan vitamin c memiliki aktivitas antioksidan kategori sangat kuat dengan nilai IC50 4,16 ppm, dimana keduanya memiliki nilai IC50 <50 ppm. Hal
ini membuktikan bahwa tumbuhan sarang semut memiliki aktivitas antioksidan yang sangat baik. Namun, aktivitas antioksidan ekstrak etanol umbi sarang semut tidak lebih kuat dari vitamin c. Hal ini dikarenakan bahwa vitamin c merupakan senyawa murni sedangkan ekstrak etanol umbi sarang semut masih berupa campuran beberapa senyawa. Kategori nilai IC50 sebagai antioksidan dapat dilihat
pada Tabel 4.2 berikut:
Tabel 4.6 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (ppm)
1. Sangat kuat <50
2. Kuat 50-100
3. Sedang 101-150
Kemampuan sampel uji dalam memerangkap 1,1-diphenyl-2-picrylhidrazyl (DPPH) sebagai radikal bebas dalam larutan metanol dengan nilai IC50 (konsentrasi sampel uji yang mampu memerangkap radikal bebas sebesar
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan: a. Hasil karakterisasi simplisia umbi sarang semut dari pulau Nias berbeda
dengan hasil karakterisasi simplisia umbi sarang semut dari Papua.
b. Hasil skrining fitokimia serbuk simplisia umbi sarang semut menunjukkan adanya senyawa kimia golongan glikosida, saponin, flavonoid, tanin dan steroid/triterpenoid.
c. Hasil pengukuran aktivitas antioksidan dengan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH), ekstrak etanol umbi sarang semut menunjukkan kekuatan antioksidan dalam kategori sangat kuat.
d. Hasil analisis diperoleh nilai IC50 ekstrak etanol umbi sarang semut 44,23
ppm dan vitamin c 4,73 ppm.
5.2 Saran
DAFTAR PUSTAKA
Dachriyanus. (2004). Analisis Struktur Senyawa Organik secara Spektrofotometri. Padang: Andalas University Press. Halaman 1.
Depkes RI. (1985). Cara Pembuatan Simplisia. Jakarta: Departemen Kesehatan RI. Halaman 2-3, 10.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 299-305, 334-335.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 1.
Depkes RI. (2008). Farmakope Herbal Indonesia. Edisi Pertama. Jakarta: Departemen Kesehatan RI. Halaman 174-175.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 9, 29, 39, 47, dan 1119.
Falna, Y. (2014). Karakterisasi dan Skrining Fitokimia serta Uji Efek Antidiare Ekstrak Etanol Umbi Sarang Semut (Myrmecodia tuberosa Jack.) Pada Tikus Putih Jantan. Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara. Halaman 34-35.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 55(3): 263.
Florentinus, J. (2012). Sarang Semut Berantas Penyakit Maut. Yogyakarta: Gapura Publishing. Halaman 1-5.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 222, 252-256.
Hamid, A.A., Aiyelaagbe, O.O., Usman, L.A., Ameen, O.M., dan Lawal, A. (2010). Antioxidant: Its Medicinal and Pharmacological Applications. African Journal of Pure and Applied Chemistry. 4(8): 142-151.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB. Halaman 147, 259.
Hermawati, R., dan Arumsari, D. (2014). Khasiat Ajaib Sarang Semut Berantas Berbagai Penyakit. Jakarta: Padi. Halaman 5-25.
Kumalaningsih, S. (2006). Antioksidan Alami, Penangkal Radikal Bebas: Sumber, manfaat, cara penyediaan dan pengolahan. Cetakan Pertama. Surabaya: Trubus Agrisarana. Halaman. 4-5, 16, 21, 24, 43.
Mardawati, E., Achyar, C.S., dan Marta, H. (2008). Kajian Aktivitas Antioksidan Ekstrak Kulit Manggis (Garcinia mangostana L) dalam Rangka Pemanfaatan Limbah Kulit Manggis di Kecamatan Puspahiang Kabupaten Tasikmalaya. Laporan Akhir Penelitian Peneliti Muda (LITMUD). Bandung: Universitas Padjajaran. Halaman 17.
Marinova, G., dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH. Bulg. J. Agric. Sci. 17(1): 13-14.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoid. Bandung: Penerbit ITB. Halaman 1.
Molyneux, P. (2004). The Use of The Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin. J. Sci. Technol. 26(2): 212.
Muchtadi, D. (2013). Antioksidan Dan Kiat Sehat Di Usia Produktif. Bandung: Penerbit Alfabeta. Halaman 15, 83.
Noya, E., Buang, Y., dan Cunha T.D. (2013). Isolasi, Identifikasi, dan Uji Aktivitas Senyawa Antioksidan Fraksi Kloroform Ekstrak Metanol Sarang Semut (Myrmecodia pendans). Jurnal Kimia Terapan. 1(1): 6-7.
Packer, L. (2002). The Antioxidant Vitamins C and E. United States of America : AOCS Press. Halaman 9.
Pham-Huy, L.A., Hua He., dan Chuong, P. (2008). Free Radical, Antioxidants in Disease and Health. International Journal of Biomedical Science. 4(2): 89-96.
Prakash, A. (2001). Antioxidant Activity. Analytical Progress. 19(2): 1-4.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi VI. Bandung: Penerbit ITB. Halaman 191-193.
Rosany, T., Vera, A., dan Usmar. (2012). Pengaruh Pemberian Infus Sarang Semut (Myrmecodia pendens) terhadap kadar asam urat darah pada kelinci (Oryctolagus cunilicus). Majalah Farmasi Dan Farmakologi. 16: 31-36. Rosidah., Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant
Roslizawaty., Nita, Y.R., Fakhrurrazi., dan Herrialfian. (2013). Aktivitas Antibakterial Ekstrak Etanol Dan Rebusan Sarang Semut (Myrmecodia sp.) Terhadap Bakteri Escherichia coli. Jurnal Medika Veterinaria. 7(2): 91-94.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Kanisius. Halaman 40-41, 47, 51-52, 54.
Subroto, M.A., dan Saputro, H. (2006). Gempur Penyakit dengan Sarang Semut. Jakarta: Penebar Swadaya.
Sudiana, I.K. (2008). Patobiologi Molekuler Kanker. Jakarta: Penerbit Salemba Medika. Halaman 36.
Sujuti, H., Sarwono, I., dan Qosim, W.P. (2013). Pengaruh Ekstrak Tanaman Sarang Semut (Myrmecodia pendans) terhadap ekspresi p53 pada sel HeLa S3 in vitro. Skripsi. Malang: Jurusan Pendidikan Dokter Universitas Brawijaya. Halaman 3-6.
Tatang, I., Andayana, P., dan Ema, S. (2011). Aktivitas Penangkapan Radikal 2,2-Difenil-1 Pikrilhidrazil Oleh Ekstrak Etanolik Batang Brotowali (Tinospora crispa (L.) Miers) Dan Fraksi-Fraksinya. Majalah Obat Tradisional. 16(3): 138 – 144.
Winarsi, H. (2011). Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius. Halaman 11, 17, 20.
World Health Organization. (1998). Quality Control Methods For Medicinal Plant Material. Switherland: WHO. Halaman 25-28.
Lampiran 2. Gambar tumbuhan sarang semut
Tumbuhan sarang semut menempel di batang pohon
Lampiran 2 (Lanjutan)
Lampiran 3. Gambar makroskopik simplisia dan serbuk simplisia umbi sarang semut
Simplisa umbi sarang semut
Lampiran 4. Hasil pemeriksaan mikroskopik serbuk simplisia umbi sarang semut
Keterangan: (perbesaran 10 x 40) 1. Parenkim
2. Pembuluh kayu 3. Serat
4. Butir pati
5. Fragmen berisi pigmen berwarna coklat
1
2
3
4
Lampiran 5. Bagan penelitian
Diiris, dicuci dan dibersihkan semut-semut di dalammnya, ditiriskan
Dibagi menjadi beberapa bagian kecil
Dikeringkan dalam lemari pengering
dibiarkan selama 5 hari terlindung cahaya sambil sering diaduk
diserkai, diperas, dicuci ampas dengan etanol 96% secukupnya
dipindahkan ke dalam bejana tertutup
dibiarkan di tempat sejuk, terlindung dari cahaya rotaryevaporator
dikeringkan dengan freeze
dryer
Karakterisasi Skrining Fitokimia
Pk sari yang larut dalam air Pk sari yang larut dalam etanol Pk abu total
Pk abu yang tidak larut dalam asam
Lampiran 7. Perhitungan hasil karakterisasi serbuk simplisia umbi sarang semut
I. Perhitungan penetapan kadar air simplisia
% Kadar air = 0,3 ml
5,063 gx 100% = 5,92 %
% Kadar air = 0,25 ml
5,058 g x 100 % = 4,94 %
% Kadar air = 0,25 ml
5,044 g x 100 % = 4,95 %
% Kadar air rata-rata = 5,92 % + 4,94 % + 4,95 %
3 = 5,27 %
II.Perhitungan penetapan kadar sari larut air
No Berat sampel (gram) Berat sari air (gram)
1 5,008 0,161
2 5,011 0,168
3 5,013 0,172
No Berat sampel (gram) Volume air (ml)
1 5,063 g 0,3 ml
2 5,058 g 0,25 ml
3 5,044 g 0,25 ml
% kadar sari larut air = berat sari air berat sampel x
100
20
x
100 % % Kadar air = volume air (ml)Lampiran 7 (lanjutan)
III. Perhitungan penetapan kadar sari larut etanol
Kadar sari larut etanol = 0,110 g
5,014 g x
% Kadar sari larut etanol rata-rata = 10,96% + 10,09%+ 10,67%
3 = 10,57 %
No Berat sampel (gram) Berat sari etanol (gram)
% Kadar abu tidak larut asam = berat abu tidak larut asam
berat sampel x 100 % Lampiran 7 (lanjutan)
IV. Perhitungan penetapan kadar abu total
% Kadar abu total = 0,128
2,040 x 100 % = 6,27 %
% Kadar abu total = 0,135
2,098 x 100 % = 6,43 %
% Kadar abu total = 0,133
2,076 x 100 % = 6,40 %
% Kadar abu total rata-rata = 6,27%+ 6,43%+ 6,40%
3 = 6,36 %
V.Perhitungan penetapan kadar abu tidak larut asam No Berat sampel (gram) Berat abu (gram)
1 2,040 0,128
2 2,098 0,135
3 2,076 0,133
No Berat sampel (gram)
Berat abu tidak larut asam (gram)
1 2,040 0,006
2 2,098 0,008
3 2,076 0,007
% kadar abu total = berat abu
Lampiran 7 (Lanjutan)
% Kadar abu tidak larut asam = 0,006
2,040x 100 % = 0,29 %
% Kadar abu tidak larut asam = 0,008
2,098x 100 % = 0,38 %
% Kadar abu tidak larut asam = 0,007
2,076x 100 % = 0,33 %
% Kadar abu tidak larut asam rata-rata = 0,29% +0,38%+ 0,33%