Lampiran 2.Bagan kerjapenelitian
Serbuk simplisia Benalu kopi
Simplisia
Dicuci, ditiriskandan ditimbang sebagai berat basah
Dikeringkan dalam lemari pengering
Ditimbang berat kering Dihaluskan
Pemeriksaan makroskopik
Pemeriksaan mikroskopik
Penetapan kadar air
Penetapan kadar sari yang larut
dalam air
Penetapan kadar sari yang larut
dalam etanol
Penetapan kadar abu total
Penetapan kadar abu yang tidak larut dalam asam
Pemeriksaan
Karakterisasi simplisia Skrining Fitokimia Ekstraksi
Maserat
Lampiran 3.Gambar tumbuhan segar dan simplisia dari benalu kopi
Benalu kopi segar
Lampiran 5.Hasil pemeriksaan mikroskopik serbuk simplisia benalu kopi
1 2
3
Keterangan: perbesaran 10 x 40
Lampiran 7.Perhitungan pemeriksaan karakteristik serbuk simplisia benalu kopi
1. Perhitungan kadar air serbuk simplisia benalu kopi
% Kadar air simplisia = x 100%
2. Perhitungan kadar sari larut dalam air
% Kadar sari larut air = x 100%
% Kadar sari larut etanol = x 100%
4. Perhitungan kadar abu total simplisia
% Kadar abu total = x 100%
% Kadar abu tidak larut asam = x 100%
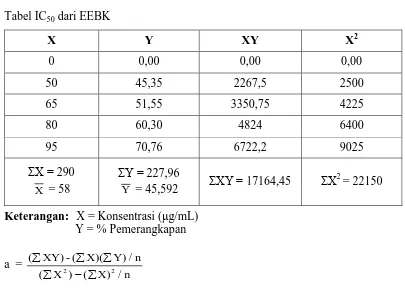
1. Tabel hasil uji aktivitas antioksidan EEBK Larutan
uji
Konsentrasi (μg/mL)
Absorbansi % Pemerangkapan
I II III I II III
Rata-2. Tabel hasil uji aktivitas antioksidan vitamin C Larutan
uji
Konsentrasi (μg/mL)
Absorbansi % Pemerangkapan
Rata-Lampiran 9. Contoh perhitungan persen pemerangkapan dan nilai IC50
• Contoh perhitungan persen pemerangkapan
Tabel data absorbansi DPPH pengukuran I
No. Konsentrasi larutan uji (μg/mL) Absorbansi
1. 0 1,116 (Akontrol)
2. 50 0,610
3. 65 0,544
4. 80 0,445
5. 95 0,326
Aktivitas pemerangkapan radikal bebas (%) = x 100% kontrol
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Perhitungan % pemerangkapan ekstrak etanol benalu kopi
c. Konsentrasi 80 μg/mL
b = Y−aX
= 45,592 – (0,7397)(50) = 2,6894
Jadi, persamaan garis regresi Y = 0,739X + 2,687 Nilai IC50 = Y = 0,739X + 2,687
50 = 0,739X + 2,687 X = 64,02
DAFTAR PUSTAKA
Ameer, O.Z., Salman, I,M., Yam, M.F., AbdAllah, H.H., Abdulla, M.H., Shah, A.M. (2009). Vasorelaxant properties ofLoranthus Ferrugineus Roxb.Methanolic Extract. Internationaljournal of pharmacology. 5: 44-50. Badan Pengawas Obat dan Makan RepublikIndonesia. (2010). Acuan Sediaan
Herbal.Volume kelima. Edisi I. Jakarta: BadanPengawas Obat dan Makan
RepublikIndonesia. Halaman 129-131.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik secara Spektrofotometri. Padang: Andalas University Press. Halaman 1.
Devehat, F.L., Tomasi, S., Fontanel, D., Boustie, J. (2002). Flavonolsfrom
Scurrula ferruginea Danser (Loranthaceae), Z.Naturforsch.,
57c:1092-1095.
Departemen Kesehatan RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta:Departemen Kesehatan RI. Halaman 297-326, 333-340.
Departemen Kesehatan RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta:Departemen Kesehatan RI. Halaman 32.
Departemen Kesehatan RI. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Halaman 796.
Departemen Kesehatan RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan
Obat.Jakarta:Departemen Kesehatan RI. Halaman1, 9-10.
Departemen Kesehatan RI. (1985). Cara Pembuatan Simplisia.
Jakarta:Departemen Kesehatan RI. Halaman 10.
Dillasamola, Dwisari., Dharma, Surya., dan Khaira, N.Q.A. (2015). Perbandingan Pengaruh Pemberian Ekstrak Etanol Defatting Dan Ekstrak Etanol Daun Benalu Kopi Scurrula ferruginea (Jack)Danser Terhadap Kadar Glukosa Darah Mencit Putih Jantan. SCIENTIA 5(2): 109-113.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Sciences. 55(3): 263-264.
Fidrianny, I., Darmawati, A dan Sukrasno. (2014). Antioxidant Capacities from Different Polarities Extracs of Cucurbitaceae leaves Using FRAP, DPPH Assay and Correlation with Phenolic, Flavonoid, Carotenoid Content.
International Journal of Pharmacy and Pharmaceutical Sciences. 6(2):
858-862.
Pustaka Pelajar. Halaman 222.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisa
Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro.
Terbitan Kedua. Bandung: Penerbit ITB. Halaman 147, 259.
Ionita, P. (2005). Is DPPH Stable Free Radical A Good Scavenger for Oxygen Active Species?. Cem. Pap. 59(1): 11.
Kumalaningsih, S. (2006). Antioksidan Alami. Surabaya: Trubus Agrisarana. Halaman 3, 39,53.
Lamid, astuti. (1995). Vitamin E Sebagai Antioksidan. Media Litbangkes (5)1: 14-16.
Litescu, S. C., Eremia, S. and Radu, G. L. (2010). Bio-Farms for Nutraceuticals:
Functional Food and Safety Control by Biosensors. New York:
Springer+Business Media. Halaman 241.
Mardiah., Fransiska, R.Z., dan Lia, A.A. (2006). Makanan Antikanker. Tangerang: Agromedia Pustaka. Halaman 22-23.
Marinova, G. dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH. Bulg. J.
Agric. Sci. 17: 13-14.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoid. Bandung: Penerbit ITB. Halaman 1, 12, 15.
Molyneux, P. (2004). The Use of the Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci.
Technol. 26(2): 211-219.
Muchtadi, D. (2013). Antioksidan dan Kiat Sehat di Usia Produktif. Bandung: Alfabeta. Halaman 15.
Packer, L. (2002). The Antioxidant Vitamins C and E. United States Of America: AOCS Press. Halaman 9.
Prakash, A. (2001). Antioxidant Activity. Medallion Laboratories-Analytical
Progress. 19(2): 2.
Putra, W.,S. (2015). Kitab Herbal Nusantara. Yogyakarta: Katahati. Halaman 67. Redha, Abdi. (2010). Flavonoid: Struktur, Sifat Antioksidatif Dan Peranannya
Dalam Sistem Biologis.Jurnal Belian 9(2): 196 – 202.
Bandung: Penerbit ITB. Halaman 191-193.
Rosidah, Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616-625.
Saifudin, A., Viesa, R., dan Hilwan, Y.T. (2011). Standarisasi Bahan Obat Alam. Yogyakarta: Graha Ilmu. Halaman 4-10.
Sen, S., Chakraborty, R., Sridhar, C., Reddy, Y.S.R., dan Pe, B. (2010). Free Radical Antioxidants, Disease and Phytomedicines: Current Status and Future Prospect. International Journal of Pharmaceutical Sciences Review
and Research. 21(3): 91-100.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta:Kanisius. Halaman 40, 47-48.
Winarsi, H. (2011). Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius.Halaman 12, 17.
Wind, A. (2014). Kitab Obat Tradisional Cina. Terbitan I. Yogyakarta: Media Pressindo. Halaman 343.
World Health Organization. (1998). Quality Control Methods For Medicinal
Plant Material. Switzerland: WHO. Halaman 35-39.
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Penelitian meliputi pengumpulan dan pengolahanbahan tumbuhan, identifikasi bahan tumbuhan, karakterisasi simplisia,skrining fitokimia, pembuatan ekstrak etanol benalu kopi (EEBK) dan pengujian aktivitas antioksidan dari EEBK dengan metode aktivitas pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhidrazyl)yang diukur secara spektrofotometri visibel. Penelitian ini dilakukan di Laboratorium Fitokimia dan Laboratorium Penelitian Fakultas Farmasi, Universitas Sumatera Utara.
3.1Alat
Alat-alat yang digunakan pada penelitian ini terdiri dari alat-alat gelas laboratorium, blender, desikator, krus porselin, lemari pengering, mikroskop (Olympus), neraca analitik (Boeco Germany), oven (Memmert), penangas air,
rotary evaporator (Stuart), spektrofotometer UV-Visible (Shimadzu UV-1800),
stopwatch dan tanur (Nabertherm).
3.2Bahan
metanol, n-heksan, natrium hidroksida, raksa (II) klorida, serbuk magnesium
(Mg), timbal (II) asetat, kristal kloral hidrat, toluen, kalium iodida, α-naftol.
Bahan kimia berkualitas teknis: etanol 96% dan air suling.
3.3Penyiapan bahan tumbuhan
3.3.1 Pengumpulan bahan tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposifyaitu tanpa membandingkan dengan bahan tumbuhan yang sama dari daerah lain. Bahan tanaman yang digunakan adalah benalu kopi yang diperoleh dari: Jalan Dolok Sanggul Sigalingging, Kecamatan Parbubulan, Kabupaten Dairi, Provinsi Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi - Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Proses pembuatan serbuk simplisia
Bahan tumbuhan yang digunakan adalah benalu kopi. Bahan dibersihkan dari kotoran, dicuci, ditiriskan kemudian ditimbang sebagai berat basah. Selanjutnya dikeringkan dalam lemari pengering pada temperatur ± 40°C sampai kering (mudah dipatah-patahkan), kemudian ditimbang sebagai berat kering. Simplisia yang telah kering diblender menjadi serbuk lalu disimpan dalam kantong plastik untuk mencegah pengaruh lembab dan pengotoran lain.
3.4 Pembuatan pereaksi
3.4.1 Pereaksi besi (III) klorida 1%
secukupnyahinggadiperolehlarutan 100 mL(Depkes,RI., 1995).
3.4.2Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 mL (Depkes, RI., 1995).
3.4.3 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 mL (Depkes, RI., 1995).
3.4.4 Pereaksi asam klorida 2 N
Sebanyak 17 mL larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.5 Pereaksi asam sulfat 2 N
Sebanyak 5,5 mL larutan asam sulfat pekat ditambahkan air suling sampai 100 mL (Depkes, RI., 1995).
3.4.6 Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 mL air suling (Depkes, RI., 1995).
3.4.7 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 mL pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 mL air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.8 Pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga
3.4.9 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 mL asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 mL air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 mL (Depkes, RI., 1995).
3.4.10 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 mL (Depkes, RI., 1995).
3.4.11 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50 bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Depkes, RI., 1995).
3.5 Pemeriksaan karakteristik
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari benalu kopi segar dansimplisia benalu kopi.
3.5.2 Pemeriksaan mikroskopik
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 mL, pendingin, tabung penyambung, tabung penerima 5 mL berskala 0,05 mL, alat penampung dan pemanas listrik.
a. Penjenuhan toluen
Sebanyak 200 mL toluen dan 2 mL air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 mL.
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, kemudian labu dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik, setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar, setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO., 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
jam, kemudian disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600 ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Kadar abuyang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.6 Skrining fitokimia
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 mL filtrat. Padatabung I: ditambahkan 2 tetes pereaksi Mayer, jika positif
mengandungalkaloid maka akan terbentuk endapan menggumpal berwarna putih atau kuning.
Padatabung II: ditambahkan 2 tetes pereaksi Dragendorff, jika positif mengandung alkaloid maka akan terbentuk endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III: ditambahkan 2 tetes pereaksi Bourchardat, jika positif mengandung alkaloid maka akan terbentuk endapan berwarna coklat sampai kehitaman (Depkes, RI., 1995).
3.6.2 Pemeriksaan flavonoida
3.6.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 mL campuran dari 7 bagian etanol 96% dengan 3 bagian air suling (7:3) dan 10 mL asam klorida 2 N, kemudian direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran isopropanol dan kloroform (2:3),perlakuan ini diulangi sebanyak 3 kali. Sari organik dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring,kemudian
diuapkan pada temperatur tidak lebih dari 50ºC, sisanya dilarutkan dalam 2 mL metanol. Sari air digunakan untuk percobaan berikut: 0,1 larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2 mL air dan 5 tetes larutan pereaksi Molisch, lalu ditambahkan dengan perlahan-lahan 2 mL asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Depkes, RI., 1995).
3.6.4 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 mL air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes, RI., 1995).
3.6.5 Pemeriksaan tanin
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.6 Pemeriksaan steroida/triterpenoida
Serbuk simplisia ditimbang sebanyak 1 g serbuk simplisia dimaserasi dengan 20 mL n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu meunjukkan adanya triterpenoida (Harborne, 1987).
3.7 Pembuatan ekstrak
Pembuatan ekstrak etanol benalu kopi dilakukan dengan cara maserasi. Sebanyak 200 g serbuk simplisia dimasukkan kedalam botol maserasi, dituangi dengan 75 bagian etanol, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, lalu disaring, ampas dicuci dengan etanol hingga diperoleh 100 bagian, maserat dipindahkan kedalam bejana tertutup, dibiarkan ditempat yang sejuk, terlindung dari cahaya selama 2 hari, lalu dienaptuangkan atau disaring. Maserat yang didapat kemudian di uapkan pada suhu dan tekanan rendah sehingga didapat ekstrak kental (Depkes, RI., 1979).
3.8 Pengujian aktivitas antioksidan
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
sampel uji yang mampu meredam radikal bebas 50%) digunakan sebagai parameter menentukan aktivitas antioksidan sampel uji (Molyneux, 2004).
3.8.2 Pembuatan larutan
a. Larutan DPPH
Sebanyak 10 mg DPPH ditimbang kemudian dilarutkan dengan metanol dalam labu ukur sampai 50 mL sehingga diperoleh larutan DPPH 0,5 mM (konsentrasi 200 μg/mL).
Larutan DPPH 0,5 mM dipipet sebanyak 5 mL, kemudian dimasukkan ke dalam labu ukur 25 mL, dicukupkan volumenya dengan metanol sampai garis tanda, diperoleh larutan blanko DPPH (konsentrasi 40 μg/mL).
b. Larutan sampel uji (EEBK)
Sebanyak 25 mg EEBK ditimbang kemudian dilarutkan dengan metanol dalam labuukur sampai 25 mLsehinngga diperoleh larutan induk baku sampel (konsentrasi 1000 μg/mL).
Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk baku sampel dipipet sebanyak 1,25 mL; 1,6 mL; 2 mL; 2,4 mL ke dalam masing-masing labuukur 25 mL untuk mendapatkan konsentrasi larutan uji 50 μg/mL, 65μg/mL, 80μg/mL, 95 μg/mL, kedalam masing-masing labuukur ditambahkan 5 mL larutan DPPH 0,5 mM (konsentrasi 200μg/mL) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit,lalu diukur serapannya menggunakan spektrofotometer uv–visibel pada panjang
Sebanyak 25 mg serbuk vitamin C ditimbang kemudian dilarutkan dengan metanol dalam labuukur sampai 25 mLsehinngga diperoleh larutan induk baku vitamin C (konsentrasi 1000 μg/mL).
Larutan induk baku vitamin C dipipet sebanyak 0,05 mL; 0,1 mL; 0,15 mL; 0,2 mL ke dalam masing-masing labuukur 25 mL untuk mendapatkan konsentrasi larutan uji 2 μg/mL, 4 μg/mL, 6 μg/mL dan 8 μg/mL, kedalam masing-masing labuukur ditambahkan 5 mL larutan DPPH 0,5 mM (konsentrasi 200μg/mL) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer uv-visibel pada panjang gelombang 516 nm.
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40μg/mL dihomogenkan dan diukur serapannya pada panjang gelombang 400-750 nm.
3.8.4 Waktu pengukuran
Lamapengukuran metode DPPH menurut beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi yaitu dari 1 menit hingga 240 menit (Rosidah, et al., 2008; Molyneux, 2004; Marinova, 2011).
3.8.5 Analisis persen pemerangkapan radikal bebas
Menurut Rosidah, et al., (2008); Marinova (2011), penentuan persen pemerangkapan radikal bebasdihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = x 100% kontrol
Asampel = Absorbansi sampel
3.8.6 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap radikal bebas sebesar 50% (Molyneux, 2004). Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi sampel (μg/mL) sebagai absis (sumbu x) dan nilai % pemerangkapan (antioksidan) sebagai ordinatnya (sumbu y).
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 μg/mL, kuat untuk IC50 bernilai 50-100 μg/mL,
sedang jika IC50bernilai 101-150μg/mLdan lemah jika IC50bernilai lebih dari 150
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil identifikasi tumbuhan
Hasil identifikasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi - Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Sampel yang diperoleh adalah benalu kopi (Scurrula ferruginea (Jack) Danser) famili Loranthaceaedapat dilihat pada Lampiran 1, halaman 41.
4.2 Hasil karakterisasi
4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik terhadap benalu kopi segar, yaitu kayu berbintik-bintik coklat. Bunga majemuk bentuk payung, tangkaipendek. Daun tunggal, ujung agak meruncing,permukaanatas hijau, permukaan bawah coklat dan dipenuhi oleh rambut-rambut daun. Buah berwarna coklat. Biji bulat kecil, berwarna hitam.Gambar benalu kopi segar dapat dilihat pada Lampiran 3, halaman 43.
Hasil pemeriksaan makroskopik terhadap serbuk simplisia benalu kopi, yaitu serbuk kasar, dengan organoleptik warna coklat serta memiliki rasa dan bau yang khas. Gambar serbuk simplisia benalu kopi dapat dilihat pada Lampiran 4, halaman 44.
4.2.2 Hasil pemeriksaan mikroskopik
Hasilpemeriksaan mikroskopik pada benalu kopi segar dan serbuk simplisia diperoleh adanya stomata tipe parasitik, trikhoma berbentuk bintang dan serat kayu. Gambar hasil mikroskopik serbuk simplisia dapat dilihat pada Lampiran 5, halaman 45.
4.2.3 Hasil pemeriksaan karakteristik
Hasil pemeriksaankarakteristik simplisia dapat dilihat pada Tabel 4.1.
Tabel 4.1Hasil pemeriksaan karakteristik simplisia benalu kopi
No. Karakteristik Hasil (%)
1. Kadar air 5,98
2. Kadar sari larut dalam air 5,67 3. Kadar sari larut dalam etanol 8,66
4. Kadar abutotal 7,63
5. Kadar abu tidak larut dalam asam 0,76
Monografi dari simplisia benalu kopi tidak terdapat dalam buku Materia Medika Indonesia (MMI), sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut.
Penetapan kadar sari yang larut dalam air menyatakan jumlah zat yang tersari dalam pelarut air seperti glikosida, gula, sedangkan penetapan kadar sari
yang larut dalam etanol menyatakan jumlah zat yang tersari dalam pelarut etanol seperti glikosida, steroid, flavonoid, saponin, tanin dan yang larut dalam jumlah sedikit yaitu lemak (Depkes, RI., 1995).
Penetapan kadar abu total menyatakan jumlah kandungan senyawa anorganik dalam simplisia misalnya Mg, Ca, Na, Zn dan K. Penetapan kadar abu tidak larut asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam misalnya silikat. Abu total terbagi dua yaitu abu fisiologis dan abu non fisiologis. Abu fisiologis adalah abu yang berasal dari jaringan tumbuhan itu sendiri sedangkan abu non fisiologis adalah sisa setelah pembakaran yang berasal dari bahan-bahan luar yang terdapat pada permukaan simplisia (WHO., 1998).Perhitungan pemeriksaan karakteristik serbuk simplisia benalu kopi dapat dilihat pada Lampiran 7, halaman 47-49.
4.3 Hasil skrining fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia dan EEBK, diketahui bahwa benalu kopi mengandung golongan senyawa-senyawa kimia seperti yang terlihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak benalu kopi
No. Pemeriksaan Hasil Simplisia Hasil Ekstrak
1. Alkaloid - -
2. Flavonoida + +
3. Glikosida + +
4. Tanin + +
5. Saponin - -
Keterangan: (+) Positif : mengandung golongan senyawa (−) Negatif : tidak mengandung golongan senyawa
Tabel 4.2 menunjukkan bahwa serbuk simplisia benalu kopimengandung golongan senyawa kimia yaitu flavonoid, glikosida, tanin dan steroida/triterpenoida.Benalu kopi memiliki potensi sebagai antioksidan, yaitu dengan adanya senyawa-senyawa yang mempunyai potensi sebagai antioksidan umumnya merupakan senyawa flavonoida (Kumalaningsih, 2006).Senyawa flavonoid tersebut bertindak sebagai penangkap radikal bebas karena gugus hidroksil yang dikandungnya mendonorkan hidrogen kepada radikal bebas.Senyawa tersebut mampu menetralisir radikal bebas dengan memberikan elektron kepadanya sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi, 2006).
4.4Hasil pengujian aktivitas antioksidan
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Gambar 4.1Kurva serapan maksimum larutan DPPH 40 μg/mLmenggunakan spektrofotometer uv-visibel
Hasil pengukuran menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan maksimum pada panjang gelombang 516 nm. Panjang gelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar tampak 400-750 nm (Rohman, 2007) serta termasuk dalam rentang panjang gelombang DPPH yang berkisar antara 515-520 nm (Molyneux, 2004).
4.4.2 Hasil analisis waktu pengukuran (operating time)
Waktu pengukuran (operating time) larutan uji dengan konsentrasi 50
μg/mL yang ditambahkan dengan 5 mL larutan DPPH 0,5 mM (konsentrasi 200
μg/mL) dalam metanol diukur selama 80 menit menunjukkan bahwasanya mulai
menit ke 60 larutan uji sudah stabil meredam radikal bebas.
4.4.3 Hasil analisis aktivitas antioksidan EEBK dan vitamin C
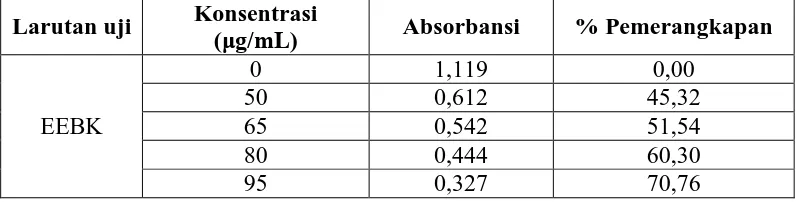
Aktivitas antioksidan EEBK diperoleh dari hasil pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan larutan uji dengan konsentrasi 50 μg/mL, 65μg/mL, 80μg/mL dan 95μg/mL yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Pada hasil analisis aktivitas antioksidan terlihat adanya penurunan nilai absorbansi DPPH sebanding dengan peningkatan konsentrasi larutan uji EEBK. Penurunan absorbansi DPPH dan persen pemerangkapan dengan penambahan EEBK dapat dilihat pada Tabel 4.3.
Tabel 4.3 Penurunan absorbansi dan persen pemerangkapan DPPH oleh EEBK
Larutan uji Konsentrasi
45,32
Konsentrasi (μg/mL)
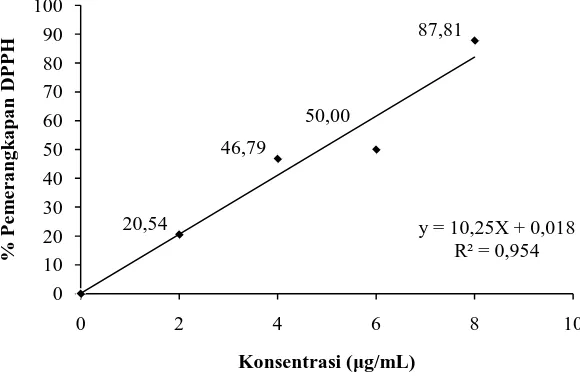
Aktivitas antioksidan vitamin C diperoleh dari hasil pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan larutan vitamin C dengan konsentrasi 2 μg/mL, 4 μg/mL, 6 μg/mL dan 8 μg/mL yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan vitamin C). Pada hasil analisis aktivitas antioksidan terlihat adanya penurunan nilai absorbansi DPPH sebanding dengan peningkatan konsentrasi larutan vitamin C. Penurunan absorbansi DPPH dan persen pemerangkapan dengan penambahan larutan vitamin C dapat dilihat pada Tabel 4.4.
Tabel 4.4 Penurunan absorbansi dan persen pemerangkapan DPPH oleh vit.C
Larutan uji Konsentrasi
(μg/mL) Absorbansi % Pemerangkapan
Penurunan nilai absorbansi menunjukkan peningkatan aktivitas antioksidan. Penurunan nilai absorbansi terjadi karena EEBK dan larutan vitamin C mampu menetralisir DPPH dengan memberikan elektron kepada DPPH sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi, 2006).
20,54
Konsentrasi (μg/mL)
Gambar 4.2Grafik hasil uji aktivitas antioksidan EEBK
Gambar 4.3Grafik hasil uji aktivitas antioksidan vitamin C
Berdasarkan Gambar 4.2 dan 4.3 dapat dilihat bahwa dengan peningkatan konsentrasi larutan sampel uji juga terjadi peningkatan pada persentase pemerangkapan DPPH, sehingga peningkatan konsentrasi berbanding lurus dengan aktivitas pemerangkapan DPPH.
Hasilpersamaan regresi linier dan hasil analisis IC50 yang diperoleh dari
ekstrak etanol benalu kopi dan vitamin C dapat dilihat pada Tabel 4.5.
Tabel 4.5 Hasil persamaan regresi linier dan hasil analisis IC50 yang diperolehdari
ekstrak etanol benalu kopi dan vitamin C
Larutan Uji Persamaan regresi IC50 (μg/mL)
Ekstrak etanol benalu kopi y = 0,739X + 2,687 64,02
Tabel4.5menunjukkan aktivitas antioksidan EEBK dalam kategori kuat dengan nilai IC50 sebesar 64,02 μg/mL, sedangkan vitamin C memiliki aktivitas
antioksidan yang sangat kuat dengan nilai IC50 sebesar 4,87 μg/mL, hal ini
dikarenakan bahwa vitamin C merupakan senyawa murni sedangkan EEBK masih berupa campuran beberapa senyawa. Menurut Fidrianny, dkk., (2014), kategori IC50 sebagai antioksidan dapat dilihat pada Tabel 4.6.
Tabel 4.6 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (μg/mL)
1. Sangat kuat <50
2. Kuat 50 - 100
3. Sedang 101 - 150
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Hasil karakterisasi simplisia benalu kopi, yaitu kadar air 5,98%, kadar sari larut air 5,67% dan kadar sari larut etanol 8,66%, kadar abu total 7,63%dan kadar abu tidak larut asam 0,76%.
b. Hasil skrining fitokimia simplisia dan ekstrakbenalu kopi menunjukkan adanyasenyawa metabolit sekunder flavonoid, glikosida, tanin dan steroida/triterpenoida.
c. Hasil analisis antioksidan menunjukkan bahwa EEBK memiliki aktivitas antioksidan dan nilai IC50 EEBK sebesar64,02μg/mL.
5.2Saran
Dari hasil penelitian, ekstrak etanol benalu kopi memiliki aktivitas antioksidan yang kuat, oleh sebab itu disarankan kepada peneliti selanjutnya untuk melakukan isolasi dengan harapan agar didapat nilai IC50 dari senyawa murni
BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
2.1.1 Habitat
Habitat alami dari benalu kopi terdapat di Malaysia, Sumatera, India, Australia dan Selandia Baru (BPOM, RI., 2010).
2.1.2 Morfologi tumbuhan
MenurutBPOM, RI (2010), tanaman ini berupa terna, parasit obligat dengan batang menggantung dan kayu berbintik-bintik coklat. Akarmenempelpada pohon inang, berfungsi sebagai penghisap, berwarna kuning kecoklatan.Daun tunggal, ujung agak meruncing,pangkal membulat tepi rata, panjang 5-9 cm, lebar 2-4 cm, permukaanatas hijau, permukaan bawah coklat.Bunga majemuk bentuk payungterdiri dari 4-6 bungadi ruas batang, tangkaipendek, kelopak bentuk kerucut terbalik, panjang kurang lebih 3 mm, benang sari panjang 2-3 mm, kepala putik bentuk tombol,mahkota panjang 1-2 cm, taju mahkota melengkung ke dalam, berwarna merah. Buah kerucut terbalik, panjangkurang lebih 8 mm, berwarna coklat. Biji bulat kecil, berwarna hitam.
2.1.3 Klasifikasi tumbuhan
Menurut Putra (2015), klasifikasi dari tumbuhan benalu kopi (herba scurrula) adalah sebagai berikut:
Kingdom : Plantae
Family : Loranthaceae Genus : Scurrula
Spesies : Scurrula ferruginea (Jack) Danser
2.1.4 Nama daerah dan nama asing
Di Indonesia, tumbuhan ini umumnya dikenal dengan sebutan benalu kopi. Nama daerah dari tumbuhan benalu kopi, yaitu kemladean, asilan, benalu, tahi
burung, ambai-ambai(Jawa); kemlandean (Sunda), sang ji sheng (Cina) (Wind,
2014).
2.1.5 Kandungan kimia
Herba scurrula mengandung senyawa asam lemak: asam oleat, asamlinoleat, asam linolenat, asam oktadeka-8-10-dinoat, asam (Z)-oktade-12-ena-810-dioat dan asam oktadeka-8-10-12-trinoat; kuersitrin,kuersetin, rutin, ikarisid B2, avikulin, (+)-katekin, (-)-epikatekin, (-)-epikatekin3-O-galat dan (-) epigalokatekin-3-O-galat (BPOM, RI., 2010).
2.1.6 Efek farmakologi
Benalu kopi digunakan sebagai antikanker atau sitotoksik, vasorelaksan, menurunkan kadar gula darah (Devehat,etal., 2002; Ameer, et al.,2010; Dillasamola, dkk., 2015).
2.2 Ekstraksi
mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan yang terdapat dalam simplisia tersebut (Depkes, RI., 2000).
Menurut Depkes, RI (2000), ada beberapa metode ekstraksi yang sering digunakan yaitu:
2.2.1 Cara dingin
a. Maserasi
Maserasi adalah penyarian simplisia dengan cara perendaman menggunakan pelarut disertai sesekali pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi kinetik sedangkan yang dilakukan penambahan ulang pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
b. Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator dengan pelarut yang selalu baru, umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penampungan perkolat) terus menerus sampai diperoleh ekstrak.
2.2.2 Cara panas
a. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-500C.
b. Infundasi
c. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 900C selama 30 menit.
d. Refluks
Refluks adalah proses penyarian simplisia pada temperatur titik didihnya menggunakan alat dengan pendingin balik dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
e. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat khusus (soklet) dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel.
2.3 Radikal bebas
Radikal bebas didefinisikan sebagai suatu atom atau molekul yang mempunyai satu atau lebih elektron tidak berpasangan, bersifat sangat reaktif dan tidak stabil (Muchtadi, 2013). Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron. Dampak kerja radikal bebas akan terbentuk radikal bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk berpasangan dengan radikal sebelumnya (Winarsi, 2011).
Menurut Kumalaningsih (2006), radikal bebas terbentuk dari 3 tahapan reaksi berantai berikut:
a. Tahap Inisiasi, yaitu tahap awal terbentuknya radikal bebas. (1) RH + initiator R• + H•
b. Tahap Propagasi, yaitu tahap perpanjangan radikal berantai, terjadi reaksi antara radikal bebas dengan senyawa lain dan menghasilkan radikal baru.
(1) R•
+ O
2ROO•(2) ROO• + RH ROOH + R•
c. Tahap Terminasi, yaitu tahap akhir, terjadi pengikatan suatu radikal bebas dengan radikal bebas yang lain seehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya.
(1) R• + R•RR
(2) R• + ROO•ROOR
Radikal bebas ini antara lain radikal superoksida (O2•‾), hidroksil (OH•),
peroksil (RO2•), alkoksil (RO•), hidroperoksil (HO2•), nitrit oksida (NO•), nitrogen
dioksida (NO2•), lipid peroksil (LOO•) dan kelompok non-radikal yang kurang
reaktif namun masih tergolong radikal bebas seperti hidrogen peroksida (H2O2),
asam hipoklorit (HOCl), ozon (O3), oksigen singlet (1O2), peroksinitrat (ONOO‾),
asam nitrit (HNO2) (Sen, dkk., 2010). Reaksi ini akan berlangsung terus menerus
dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, jantung koroner, aterosklerosis serta penyakit degeneratif lainnya. Reaktivitas radikal bebas ini dapat diredam oleh antioksidan (Winarsi, 2011).
2.4 Jenis-jenis antioksidan
Menurut Winarsi (2011) antioksidan merupakan senyawa pemberi elektron (elektron donor) atau reduktan. Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif. Jenis-jenis antioksidan yaitu:
Antioksidan enzimatis merupakan antioksidan endogenus, termasuk didalamnya adalah enzim superoksidan dismutase (SOD), katalase (CAT) serta glutation peroksidase (GSH-PX).
b. Antioksidan non-enzimatis
Antioksidan non-enzimatis banyak ditemukan dalam sayuran dan buah-buahan. Komponen yang bersifat antioksidan dalam sayuran dan buah-buahan meliputi vitamin C, E, β-karoten, flavonoid, isoflavon, flavon, antosianin, katekin dan isokatekin.
Menurut Kumalaningsih (2006) dan Winarsi (2011), antioksidan dapat dikelompokkan menjadi 3 kelompok berdasarkan fungsinya, yaitu:
a. Antioksidan primer
Antioksidan primer adalah antioksidan yang berfungsi untuk mencegah terbentuknya radikal bebas baru atau mengubah radikal bebas yang telah terbentuk menjadi molekul yang kurang reaktif. Antioksidan ini berupa enzim yang diproduksi oleh tubuh, meliputi: SOD (superoksida dismutase), CAT (katalase) dan GSH-Px (glutation peroksidase). Enzim SOD berperan dalam mengubah radikal superoksida (O2•‾) menjadi hidrogen peroksida (H2O2), enzim
CAT dan GSH-Px akan mengubah hidrogen peroksida (H2O2) menjadi air (H2O).
b. Antioksidan sekunder
Antioksidan ini adalah senyawa fenol yang berfungsi untuk menangkap radikal bebas dan menghentikan reaksi berantai, meliputi:
- Antioksidan vitamin, contoh: vitamin A, C, E
- Senyawa fitokimia, contoh: flavonoid, katekin, karotenoid, β-karoten.
c. Antioksidan tersier
Antioksidan tersier merupakan senyawa yang dapat memperbaiki sel-sel jaringan yang rusak akibat radikal bebas. Senyawa yang termasuk dalam jenis ini adalah jenis enzim misalnya metionin sulfoksidan reduktase yang mampu memperbaiki DNA dalam inti sel. Enzim ini sangat bermanfaat untuk perbaikan DNA pada penderita kanker.
2.4.1 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk berwarna
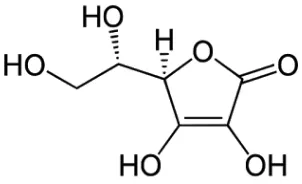
putih atau agak kekuningan. Pengaruh cahaya lambat laun menyebabkan berwarna gelap, dalam keadaan kering stabil di udara namun dalam larutan cepat teroksidasi. Vitamin C mudah larut dalam air, agak sukar larut dalam etanol, praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Depkes, RI., 1979). Rumus bangun vitamin C dapat dilihat pada Gambar 2.1.
Gambar 2.1 Rumus vitamin C (Winarsi, 2011)
tereduksi ini dapat diubah kembali menjadi asam askorbat oleh enzim monodehidroaskorbat reduktase dan dehidroaskorbat reduktase (Packer, 2002).
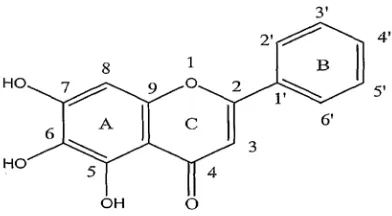
2.4.2 Flavonoid
Senyawa flavonoid merupakan salah satu senyawa polifenol terbesar, mengandung 15 atom karbon, terdiri dari dua cincin benzene yang dihubungkan menjadi satu oleh rantai linier yang terdiri dari 3 atom karbon, tersusun dalam konfigurasi C6-C3-C6 (Robinson, 1995).Rumus bangun turunan flavonoid dapat
dilihat pada Gambar 2.2.
Gambar 2.2 Rumus flavonoid (Redha, 2010)
Senyawa flavonoid terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, bunga, buah dan biji (Markham, 1988). Flavonoid mengandung sistem aromatik terkonjugasi sehingga menunjukkan pita serapan kuat pada spektrum UV dan sinar tampak. Umumnya terdapat dalam bentuk terikat pada gula yang disebut dengan glikosida sehingga untuk menganalisis flavonoid, lebih baik ekstrak tumbuhan dihidrolisis terlebih dahulu untuk memecah ikatan gula dengan aglikon (Harborne, 1987). Senyawa ini berperan sebagai donor hidrogen terhadap radikal bebas karena mengandung gugus hidroksil (Silalahi, 2006).
2.4.3 Vitamin E
Vitamin E tidak larut dalam air, larut dalam etanol, dalam minyak nabati, sangat mudah larut dalam kloroform (Depkes, RI., 1995).Rumus bangun vitamin E dapat dilihat pada Gambar 2.3.
Gambar 2.3 Rumus vitamin E (Lamid, 1995)
Tokoferol secara alami banyak terdapat diberbagai tanaman. Jumlah berlebihan ditemukan dalam minyak kelapa sawit yang diekstrak dari buah kelapa sawit (Winarsi, 2011). Fungsi terpenting vitamin E adalah sebagai antioksidan, adapun fungsi lain yaitu menstimulasi respon imunologi. Vitamin E bekerja sebagai antioksidan karena vitamin E mudah teroksidasi, dengan demikian dapat melindungi senyawa lain dari oksidasi (Lamid, 1995). Vitamin E berfungsi sebagai donor hidrogen yang mampu mengubah radikal peroksil menjadi radikal tokoferol yang kurang reaktif, sehingga tidak mampu merusak rantai asam lemak (Winarsi, 2011).
2.5 Spektrofotometer UV-Visibel
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Menganalisis senyawa organik secara kuantitatif.
Berdasarkan aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan kemudian ditentukan dengan membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang diserap (Gandjar dan Rohman, 2007).
2.6 Metode pemerangkapan radikal bebas DPPH
Metode pemerangkapan radikal bebas DPPH
(1,1-diphenyl-2-picrylhydrazil) merupakan metode yang sederhana untuk mengukur kemampuan
berbagai senyawa dalam memerangkap radikal bebas serta untuk mengevaluasi aktivitas antioksidan pada bahan makanan (Marinova dan Batchvarov, 2011). DPPH pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan Renn. Rumus bangun DPPH dapat dilihat pada Gambar 2.4.
Gambar 2.4 Rumus DPPH (Molyneux, 2004)
berubah menjadi jingga kekuningan setelah tereduksi, hasil tereduksinya yaitu
1,1-diphenyl-2-picrylhydrazine (DPPH-H) (Ionita, 2005). DPPH merupakan
radikal bebas yang stabil pada suhu kamar.
Prinsip metode pemerangkapan radikal bebas DPPH, yaitu elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang 516 nm. Interaksi antioksidan dengan DPPH akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004). Warna ungu larutan DPPH akan berubah menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang dari senyawa antioksidan (Prakash, 2001). Mekanisme reaksi antioksidan dengan radikal bebas DPPH dapat dilihat pada Gambar 2.5.
Gambar 2.5 Mekanisme reaksi antioksidan dengan radikal bebas DPPH
(Molyneux, 2004)
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004).
2.6.1 Pelarut
Metode DPPH akan memberikan hasil yang baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji antioksidan dengan radikal bebas DPPH (Molyneux, 2004).
AH + A• +
2.6.2 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Abdul, 2007). Panjang gelombang maksimum yang digunakan dalam pengukuran sampel uji pada metode pemerangkapan radikal bebas DPPH sangat bervariasi. Menurut beberapa literatur, panjang gelombang maksimum untuk DPPH antara lain 515-520 nm (Molyneux, 2004).
2.6.3 Waktu pengukuran
BAB I
PENDAHULUAN
1.1Latar belakang
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif yang secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron. Dampak reaktivitas senyawa radikal bebas bermacam-macam, mulai dari kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif hingga kanker (Winarsi, 2011). Sumber radikal bebas banyak ditemukan dalam kehidupan sehari-hari, beberapa diantaranya yaitu asap rokok, asap kendaraan bermotor, asap pabrik, air yang tercemar logam berat, makanan berpengawet serta paparan sinar matahari berlebih. Radikal bebas tidak dapat dihindari namun dapat dihambat dengan adanya antioksidan (Youngson, 2005).
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat diredam. Tubuh manusia menghasilkan senyawa antioksidan, tetapi jumlahnya seringkali tidak cukup untuk menetralkan radikal bebas yang masuk kedalam tubuh, sebagai contoh pertahanan dari dalam tubuh seperti enzim superoksida
dismutase, katalase dan glutation peroksidase seringkali kurang akibat pengaruh
hydroxyl anisole), BHT (butyl hydroxytoluena) danPG (propyl gallate) (Winarsi,
2011). Penggunaan antioksidan sintetik mulai dibatasi karena dari hasil penelitian dilaporkan bahwa antioksidan sintetik ternyata dapat meracuni hewan percobaan dan bersifat karsinogenik sehingga industri makanan dan obat-obatan mulai mengembangkan dan mencari sumber-sumber antioksidan alami yang baru (Mardiah, dkk., 2006).
Benalu merupakan parasit yang pada awalnya dianggap tidak bermanfaat, ternyata berpotensi sebagai pengobatan tradisional, salah satunya adalah benalu kopi atau Scurrula ferruginea (Jack) Danser (Dillasamola, dkk., 2015). Menurut Devehat,etal(2002),benalu kopi mengandung flavonoid, tannin, saponindan steroid. Berdasarkan penelitian farmakologi sebelumnya benalu kopi berkhasiat untukpengobatan kanker atau sitotoksik, vasorelaksan dan menurunkan kadar gula darah (Devehat,etal., 2002; Ameer, et al.,2010; Dillasamola, dkk., 2015). Kanker dapat dicegah dengan mengonsumsi antioksidan dalam jumlah memadai. Metabolit sekunder yang berkhasiat sebagai antioksidan adalah golongan flavonoid. Flavonoid memiliki sifat antioksidan sebagai penangkap radikal bebas karena mengandung gugus hidroksil, sifatnya sebagai reduktor, sehingga flavonoid dapat bertindak sebagai donor hidrogen terhadap radikal bebas(Winarsi, 2011).
Berdasarkan uraian di atas, perlu dilakukan uji aktivitas antioksidan dari ekstrak benalu kopi (Scurrula ferruginea (Jack) Danser. Ekstrak dibuat secara maserasi dan penyari yang digunakan adalah etanol. Menurut Saifudin, dkk (2011) penyari etanol memiliki polaritas lebar (mampu menyari senyawa polar sampai non polar) serta mudah diuapkan.
DPPH (1,1 Diphenyl-2-picrylhidrazyl), karena merupakan metode yang banyak digunakan, efektif, efisien dan valid (Litescu, dkk., 2010).
1.2Perumusan masalah
Berdasarkan latar belakang, maka perumusan masalah penelitian adalah: a. Apakah karakteristik simplisia benalu kopi dapat dijadikan sebagai
pembanding pada penelitian selanjutnya?
b. Apa saja senyawa metabolit sekunder yang terkandung didalam simplisia dan ekstrak etanol benalu kopi?
c. Apakah ekstrak etanol benalu kopi memiliki aktivitas antioksidan?
1.3Hipotesis
Berdasarkan perumusan masalah, maka yang menjadi hipotesa penelitian adalah:
a. Karakteristik simplisia benalu kopi dapat dijadikan sebagai pembanding pada penelitian selanjutnya karena belum tercantum dalam Materia Medika Indonesia (MMI).
b. Senyawa metabolit sekunder dari simplisia dan ekstrak etanol benalu kopi adalah alkaloid, flavonoid, glikosida, saponin, tanin dan steroid atau triterpenoid.
c. Ekstrak etanol benalu kopi memiliki aktivitas antioksidan.
1.4Tujuan penelitian
b. Untuk mengetahui senyawa metabolit sekunder yang terkandung dalam simplisia dan ekstrak etanol benalu kopi.
c. Untuk mengetahui aktivitas antioksidan dari ekstrak etanol benalu kopi.
1.5Manfaat penelitian
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDANEKSTRAK ETANOL
BENALU KOPI (Scurrula ferruginea (Jack) Danser) DENGAN METODE DPPH (
1,1 diphenyl-2-picrylhidrazyl)
Abstrak
Benaluawalnya dianggap tidak bermanfaat ternyata berpotensi sebagai terapi kanker. Kanker dapat dicegah dengan mengonsumsi antioksidan dalam jumlah memadai.Salah satu benalu yang memiliki aktivitas antioksidan ialah benalu kopi (Scurrula ferruginea (Jack) Danser). Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, skrining fitokimia dan aktivitas antioksidan dari ekstrak etanol benalu kopi.
Pemeriksaan karakteristik simplisia meliputi penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu totaldan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol benalu kopi meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanindan steroida/triterpenoida. Pengujian aktivitas antioksidan menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) diukur pada panjang gelombang maksimum 516 nm setelah 60 menit pada suhu kamardan vitamin C sebagai pembanding.
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 5,98%, kadar sari yang larut dalam air 5,67%, kadar sari yang larut dalam etanol 8,66%, kadar abu total 7,63%, kadar abu yang tidak larut dalam asam 0,76%. Hasil skrining fitokimia menunjukkan serbuk simplisia dan ekstrak etanol benalu kopi mengandung senyawaflavonoid,glikosida, tanin dan steroida/triterpenoida. Hasil uji aktivitas antioksidan dalam memerangkap radikal bebas DPPH diperoleh nilai
Inhibitory Concentration (IC50) ekstrak etanol benalu kopi sebesar 64,02 μg/mL
menunjukkan aktivitas antioksidan dalam kategori kuat dan untuk vitamin C diperoleh IC50 sebesar 4,87 μg/mL.
Kata kunci: antioksidan, DPPH, benalu kopi (Scurrula ferruginea (Jack) Danser)
SIMPLEX CHARACTERIZATION AND
OFETHANOL EXTRACT OF PARASITE COFFEE (Scurrula ferruginea (Jack) Danser)
WITH DPPH (1,1-DIPHENYL-2-PICRYLHYDRAZYL) METHOD
Abstract
Parasit which initially considered useless turns out as a potential cancer therapy. Cancer can be prevented by consuming adequate amounts of antioxidants. One parasite that have antioxidant activity is parasite coffee (Scurrula ferruginea (Jack) Danser). The purpose of this study was to determine the characteristics of the simplex, phytochemical screening and antioxidant activity of ethanol extract ofparasite coffee.
Simplex characterizationincluding water content, water-soluble extract content, ethanol-soluble extract content, total ash contentand acid-insoluble ash content. Phytochemical screening of simplex powder and ethanol extract, of parasite coffee including determination alkaloid, flavonoid, glycoside, saponin, taninand steroida/triterpenoida. The antioxidant activity assay of extract of parasite coffee used DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method at wave lenght 516 nm after 60 minutes at room temperature and vitamin C as standard of comparison.
The result obtained from simplex characterization were water content 5.98%, water-soluble extract content 5.67%, ethanol-soluble extract 8.66% content, total ash content 7.63%and acid-insoluble ash content 0.76%. The result of phytochemical screening, it containedflavonoid, glycoside, tanin and steroida/triterpenoida. The result of antioxidant activity in scavenging DPPH free radical obtained Inhibitory Concentration (IC50) value of extract of parasite
coffee64.02 μg/mL showed strong category of antioxidantand vitamin C 4.87μg/mL.
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAKETANOL
BENALU KOPI (Scurrula ferruginea (Jack) Danser)
DENGAN METODE DPPH (1,1 diphenyl-2-picrylhidrazyl)
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar
Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NOVA VALENTINA MANURUNG
NIM 131524071
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAKETANOL
BENALU KOPI (Scurrula ferruginea (Jack) Danser)
DENGAN METODE DPPH (1,1 diphenyl-2-picrylhidrazyl)
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar
Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NOVA VALENTINA MANURUNG
NIM 131524071
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING
FITOKIMIASERTAUJIAKTIVITAS ANTIOKSIDAN EKSTRAKETANOL BENALU KOPI (Scurrula ferruginea (Jack) Danser)DENGAN METODE
DPPH (1,1 diphenyl-2-picrylhidrazyl)
OLEH:
NOVA VALENTINA MANURUNG NIM 131524071
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 09 Februari 2016 Disetujui Oleh:
Pembimbing I Panitia Penguji,
Sri Yuliasmi, S.Farm, M.Si., Apt. Dr.Marline Nainggolan, M.S., Apt. NIP.198207032008122002 NIP.195709091985112001
Pembimbing II Sri Yuliasmi, S.Farm, M.Si., Apt. NIP.198207032008122002
Dr. Panal Sitorus, M.Si., Apt. Dr. Poppy Anjelisa Z. Hsb, S.Si.,M.Si., Apt. NIP. 195310301980031002 NIP. 197506102005012003
Dra. Suwarti Aris, M.Si., Apt. NIP.195107231982032001
Medan, April 2016 Fakultas Farmasi,
Universitas Sumatera Utara Pejabat Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan EkstrakEtanol Benalu Kopi (Scurrula ferruginea (Jack) Danser). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pangaribuan dan adik-adikku tercintaatas limpahan kasih sayang, doa dan semangat yang tak ternilai dengan apa pun.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, April 2016 Penulis,
SURAT PENGANTAR
Saya yang bertanda tangan dibawah ini:
Nama : Nova Valentina Manurung
Nomor Induk Mahasiswa : 131524071 Program Studi : Ekstensi Farmasi
Judul Skripsi : Karakterisasi Simplisia Dan Skrining Fitokimia Serta Uji Aktivitas Antioksidan Ekstrak Etanol Benalu Kopi (Scurrula ferruginea (Jack) Danser) Dengan Metode DPPH (1,1 diphenyl-2-
picrylhidrazil)
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan oleh orang lain untuk memperoleh gelar kesarjanaan diperguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya didalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena didalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikianlah surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, April 2016 Yang membuat pernyataan,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDANEKSTRAK ETANOL
BENALU KOPI (Scurrula ferruginea (Jack) Danser) DENGAN METODE DPPH (
1,1 diphenyl-2-picrylhidrazyl)
Abstrak
Benaluawalnya dianggap tidak bermanfaat ternyata berpotensi sebagai terapi kanker. Kanker dapat dicegah dengan mengonsumsi antioksidan dalam jumlah memadai.Salah satu benalu yang memiliki aktivitas antioksidan ialah benalu kopi (Scurrula ferruginea (Jack) Danser). Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, skrining fitokimia dan aktivitas antioksidan dari ekstrak etanol benalu kopi.
Pemeriksaan karakteristik simplisia meliputi penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu totaldan penetapan kadar abu yang tidak larut dalam asam. Skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol benalu kopi meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanindan steroida/triterpenoida. Pengujian aktivitas antioksidan menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) diukur pada panjang gelombang maksimum 516 nm setelah 60 menit pada suhu kamardan vitamin C sebagai pembanding.
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 5,98%, kadar sari yang larut dalam air 5,67%, kadar sari yang larut dalam etanol 8,66%, kadar abu total 7,63%, kadar abu yang tidak larut dalam asam 0,76%. Hasil skrining fitokimia menunjukkan serbuk simplisia dan ekstrak etanol benalu kopi mengandung senyawaflavonoid,glikosida, tanin dan steroida/triterpenoida. Hasil uji aktivitas antioksidan dalam memerangkap radikal bebas DPPH diperoleh nilai
Inhibitory Concentration (IC50) ekstrak etanol benalu kopi sebesar 64,02 μg/mL
menunjukkan aktivitas antioksidan dalam kategori kuat dan untuk vitamin C diperoleh IC50 sebesar 4,87 μg/mL.
Kata kunci: antioksidan, DPPH, benalu kopi (Scurrula ferruginea (Jack) Danser)
SIMPLEX CHARACTERIZATION AND
OFETHANOL EXTRACT OF PARASITE COFFEE (Scurrula ferruginea (Jack) Danser)
WITH DPPH (1,1-DIPHENYL-2-PICRYLHYDRAZYL) METHOD
Abstract
Parasit which initially considered useless turns out as a potential cancer therapy. Cancer can be prevented by consuming adequate amounts of antioxidants. One parasite that have antioxidant activity is parasite coffee (Scurrula ferruginea (Jack) Danser). The purpose of this study was to determine the characteristics of the simplex, phytochemical screening and antioxidant activity of ethanol extract ofparasite coffee.
Simplex characterizationincluding water content, water-soluble extract content, ethanol-soluble extract content, total ash contentand acid-insoluble ash content. Phytochemical screening of simplex powder and ethanol extract, of parasite coffee including determination alkaloid, flavonoid, glycoside, saponin, taninand steroida/triterpenoida. The antioxidant activity assay of extract of parasite coffee used DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method at wave lenght 516 nm after 60 minutes at room temperature and vitamin C as standard of comparison.
The result obtained from simplex characterization were water content 5.98%, water-soluble extract content 5.67%, ethanol-soluble extract 8.66% content, total ash content 7.63%and acid-insoluble ash content 0.76%. The result of phytochemical screening, it containedflavonoid, glycoside, tanin and steroida/triterpenoida. The result of antioxidant activity in scavenging DPPH free radical obtained Inhibitory Concentration (IC50) value of extract of parasite
coffee64.02 μg/mL showed strong category of antioxidantand vitamin C 4.87μg/mL.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PENGANTAR ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan penelitian ... 3
1.5 Manfaat penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian tumbuhan ... 5
2.1.1 Habitat ... 5
2.1.2 Morfologi tumbuhan ... 5
2.1.4 Nama daerah dan nama asing ... 6
2.1.5 Kandungan kimia ... 6
2.1.6 Efek farmakologi ... 6
2.2 Ekstraksi ... 6
2.2.1 Cara dingin ... 7
2.2.2 Cara panas ... 7
2.3 Radikal bebas ... 8
2.4 Jenis-jenis antioksidan ... 9
2.4.1 Vitamin C ... 11
2.4.2 Flavonoid ... 12
2.4.3 Vitamin E ... 12
2.5 Spektrofotometer UV-Visibel ... 13
2.6 Metode pemerangkapan radikal bebas DPPH ... 14
2.6.1 Pelarut ... 15
2.6.2 Pengukuran panjang gelombang ... 16
2.6.3 Waktu pengukuran ... 16
BAB III METODE PENELITIAN... 17
3.1 Alat ... 17
3.2 Bahan... ... 17
3.3 Penyiapan bahan tumbuhan ... 18
3.3.1 Pengumpulan bahan tumbuhan ... 18
3.3.2 Identifikasi tumbuhan ... 18
3.3.3 Proses pembuatan serbuk simplisia ... 18
3.4.1 Pereaksi besi (III) klorida 1% ... 18
3.4.2Pereaksi timbal (II) asetat 0,4 M ... 19
3.4.3 Pereaksi natrium hidroksida 2 N ... 19
3.4.4 Pereaksi asam klorida 2 N ... 19
3.4.5 Pereaksi asam sulfat 2 N ... 19
3.4.6 Pereaksi kloralhidrat ... 19
3.4.7 Pereaksi Mayer ... 19
3.4.8 Pereaksi Molisch ... 19
3.4.9 Pereaksi Dragendorff ... 20
3.4.10 Pereaksi Bouchardat ... 20
3.4.11 Pereaksi Liebermann-Burchard ... 20
3.5 Pemeriksaan karakteristik ... 20
3.5.1 Pemeriksaan makroskopik ... 20
3.5.2 Pemeriksaan mikroskopik ... 20
3.5.3 Penetapan kadar air ... 21
3.5.4 Penetapan kadar sari yang larut dalam air ... 21
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 22
3.5.6 Penetapan kadar abu total ... 22
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ….. 22
3.6 Skrining fitokimia ... 23
3.6.1 Pemeriksaan alkaloida ... 23
3.6.2 Pemeriksaan flavonoida ... 23
3.6.3 Pemeriksaan glikosida ... 24
3.6.5 Pemeriksaan tanin ... 24
3.6.6 Pemeriksaan steroida/triterpenoida ... 25
3.7 Pembuatan ekstrak ... 25
3.8 Pengujian aktivitas antioksidan ... 25
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH ... 25
3.8.2 Pembuatan larutan ... 26
3.8.3 Penentuan panjang gelombang serapan maksimum ... 27 3.8.5 Analisis persen pemerangkapan radikal bebas ... 27
3.8.6Analisis nilai IC50 ... 28
BAB IV HASIL DAN PEMBAHASAN... 29
4.1 Hasil identifikasi tumbuhan ... 29
4.2 Hasil karakterisasi simplisia ... 29
4.2.1 Hasil pemeriksaan makroskopik ... 29
4.2.2 Hasil pemeriksaan mikroskopik ... 30
4.2.3 Hasil pemeriksaan karakteristik ... 30
4.3 Hasil skrining fitokimia ... 31
4.4 Hasil pengujian aktivitas antioksidan ... 32
4.4.1 Hasil penentuan panjang gelombang serapan maksimum ... 32
4.4.2 Hasil analisis waktu pengukuran (operating time) ... 33
4.4.3Hasil analisisaktivitas antioksidan EEBK dan vitamin C ... 33
BAB V KESIMPULAN DAN SARAN ... 37
5.2 Saran... ... 37 DAFTAR PUSTAKA ... 38 LAMPIRAN ... 41
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia benalu kopi ... 30 4.2 Hasil skrining fitokimia simplisia dan ekstrak benalu kopi ... 31 4.3 Penurunan absorbansi dan persen pemerangkapan DPPH
oleh EEBK ... 33 4.4 Penurunan absorbansi dan persen pemerangkapan DPPH
oleh vitamin C ... 34 4.5 Hasil persamaan regresi linier dan hasil analisis IC50 yang
DAFTAR GAMBAR
Gambar Halaman
2.1 Rumus vitamin C ... 11
2.2 Rumus flavonoid ... 12
2.3 Rumus vitamin E ... 13
2.4 Rumus DPPH ... 14
2.5 Mekanisme reaksi antioksidan dengan radikal bebas DPPH ... 15
4.1 Kurva serapan maksimum larutan DPPH 40 μg/mL menggunakan spektrofotometer uv-visibel ... 32
4.2 Grafik hasil uji aktivitas antioksidan EEBK ... 34
DAFTAR LAMPIRAN
Lampiran Halaman
1 Surat hasil identifikasi tumbuhan ... 41
2 Bagan kerja penelitian ... 42
3 Gambar tumbuhan segar dan simplisia dari benalu kopi ... 43
4 Gambar serbuk simplisia benalu kopi ... 44
5 Hasil pemeriksaan mikroskopik serbuk simplisia benalu kopi ... 45
6 Gambaralat spektrofotometer UV-Visibel (UV-Shimadzu) ... 46
7 Perhitungan pemeriksaan karakteristik serbuk simplisia benalu kopi ... 47
8 Hasil uji aktivitas antioksidan ... 50