i
PENENTUAN KADAR GULA TOTAL & PEREDUKSI SERTA
KADAR AIR PADA MADU DENGAN RUJUKAN
SNI 3545:2013
LAPORAN KERJA PRAKTIK
Oleh :
Zakiya Nibras Sausan
(105116020)
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN KOMPUTER
UNIVERSITAS PERTAMINA
ii 2 September 2019
i
KATA PENGANTAR
Segala puji dan syukur dipanjatkan kepada kehadirat Allah SWT yang telah memberikan nikmat iman, sehat dan kesempatan sehingga dapat melaksanakan kerja praktik di Laboratorium sentral Cibitung PT SUCOFINDO, serta kemudahan dalam penyusunan laporan yang berjudul ‘Penentuan Kadar Gula Total & Pereduksi serta Kadar Air pada Madu dengan Rujukan SNI 3545:2013’. Shalawat serta salam senantiasa tercurahkan selalu kepada junjungan kita nabi Muhammad SAW serta keluarga-Nya, sahabat-Nya dan pengikut-Nya hingga akhir jaman.
Kerja praktik ini pun tidak dapat terlaksana dengan sempurna tanpa adanya bimbingan, fasilitas serta ilmu yang diberikan oleh berbagai pihak yang oleh karenanya kerja praktik ini dapat berlangsung dengan sempurna. Saya haturkan rasa terima kasih sebanyak-banyaknya kepada:
1. Bapak Dr. Eng. Haryo Satriyo, selaku Ketua program studi kimia Universitas Pertamina. 2. Bapak Muhidin, S.T., M.M., selaku Manajer Laboratorium Sentral Cibitung PT SUCOFINDO. 3. Ibu Tati Kusmiati, Kak Diny dan Kak Dhila selaku pembimbing dan asisten pembimbing
selama proses pelaksanaan kerja praktik.
4. Ibu Suharti selaku dosen pembimbing di Universitas Pertamina.
5. Jajaran analis laboratorium bagian makanan & minuman dan hasil pertanian. 6. Kedua orang tua atas doa dan dukungannya.
7. Para teman sejawat seperjuangan kerja praktik atas semangat, cerita dan pengalaman selama kerja praktik berlangsung.
Laporan ini tentunya masih banyak mengandung kekurangan oleh karena itu saya sangat menerima segala kritik maupun saran yang membangun sehingga laporan ini bisa lebih bermanfaat dikemudian hari.
Bekasi, Juli 2019 Penulis
ii
DAFTAR ISI
KATA PENGANTAR... i BAB I ...1 BAB II ...3 BAB III ...6 BAB IV ... 10 BAB V... 13 BAB VI ... 19 DAFTAR PUSTAKA ... 20 LAMPIRAN ... 211
BAB I
PENDAHULUAN
1.1 Latar Belakang
Madu merupakan bahan pangan yang umum dikonsumsi manusia sejak jaman dahulu kala. Pada sekitar tahun 2100 sebelum masehi, madu biasa digunakan sebagai bahan tambahan pada olahan makanan hingga sebagai persembahan kepada raja. Seiring berjalannya waktu dan berkembangnya pengetahuan, manusia mulai mengembangkan jenis dan kegunaan madu dengan mencampurkan rempah-rempah herbal sehingga dapat diyakini madu juga bisa sebagai obat.
Menurut web sains.me, madu dihasilkan oleh lebah dengan cara mengambil nektar dari berbagai bunga. Nektar tersebut ditampung dalam kantong lebah yang dapat menampung nektar dari 150-1500 bunga. Setelah kantongnya penuh, lebah akan kembali ke sarangnya dan kemudian diberikan kepada lebah lainnya. Selama proses pemindahan nektar dari lebah ke sarang, nektar mengalami proses kimawi oleh enzim-enzim yang ada di mulut dan perut lebah. Enzim tersebut berfungsi untuk memecah gula yang terkandung dalam nektar menjadi gula yang lebih sederhana. Nektar kemudian diletakkan di sarang dan mengalami proses penurunan kadar air dari sekitar 80% hingga menjadi sekitar 18%. Kepakan sayap lebah serta proses enzimatis merupakan salah satu faktor yang menurunkan kadar air pada nektar. Nektar yang sudah mecapai kadar air tertentu (madu) kemudian dapat dipanen.
Dikutip dari Asosiasi Perlebahan Indonesia pada tahun 2016, Indonesia menghasilkan madu sekitar 15,000 hingga 75,000 ton per tahun didapat dari rata-rata jumlah konsumsi madu masyarakat sekitar 20 gram per kapita per tahun. Sementara rata-rata kebutuhan madu Indonesia sebesar 150,000 ton. Hampir 50% dari jumlah kebutuhan madu kita diimpor dari China.
Oleh karena kurangnya paroduksi madu Indonesia, banyak produsen yang memutar otak untuk mencari cara agar tetap bisa mempertahankan penjualan, salah satu caranya dengan menambahkan gula (sukrosa). Pemalsuan madu merupakan kasus yang cukup sering terjadi sejak dahulu hingga sekarang, baik di dalam negeri maupun luar negeri. Ada beberapa sarat mutu untuk madu, pada kali ini penulis menggunakan SNI 3545 tahun 2013.
1.2 Tujuan
Berdasarkan latar belakang diatas, penulis tertarik untuk menguji sampel madu yang ada di pasaran. Pengujian yang dilakukan adalah kadar gula total, pereduksi, sukrosa serta kadar air yang mengacu pada standar SNI madu 3545 tahun 2013.
2 1.3 Tempat dan Waktu pelaksanaan
Tempat kerja praktik dilaksanakan di Laboratorium Sentral PT SUCOFINDO (PERSERO) yang berada di Cibitung, Kabupaten Bekasi, Jawa Barat dengan jangka waktu pelaksanaan 2 bulan terhitung dari 10 Juni 2019 sampai 10 Agustus 2019.
3
BAB II
PROFIL INSTANSI
PT. SUCOFINDO (PERSERO) didirikan pada tahun 1956, merupakan perusahaan kerjasama antara Negara RI dengan Societe Generale de Surveillance Holding SA (SGS). PT. SUCOFINDO (PERSERO) adalah perusahaan inspeksi yang pertama di Indonesia. Pengalaman di bidang inspeksi, supervisi, pengkajian dan pengujian menjadi modal utama dalam mengembangkan usaha menjadi perusahaan inspeksi nasional terbesar di Indonesia. PT. SUCOFINDO (PERSERO) didukung oleh keanekaragaman jenis jasa dikemas secara terpadu, didukung tenaga ahli, jaringan kerja yang luas serta kemitraan usaha strategis dengan beberapa institusi internasional. Melalui pendekatan manajemen terpadu, PT. SUCOFINDO (PERSERO) bertekad untuk senantiasa meningkatkan kemampuan daya saingnya dalam menghadapi pasar global.
PT SUCOFINDO (PERSERO) memiliki visi menjadi perusahaan kelas dunia yang kompetitif, handal dan terpercaya dibidang inspeksi, pengujian, sertifikasi, konsultasi dan pelatihan. Adapula misi yang ingin dicapai ialah menciptakan nilai ekonomi kepada pemangku kepentingan terutama pelanggan, pemegang saham dan karyawan melalui layanan jasa inspeksi, pengujian dan sertifikasi serta jasa terkait lainnya untuk menjamin kepastian berusaha.
Seiring berkembangnya dunia industri, PT. SUCOFINDO mendirikan laboratorium di Jakarta. Pada tahun 1997 kemudian dipindahkan ke Cibitung. Laboratorium PT SUCOFINDO merupakan salah satu laboratorium terbesar di Indonesia. Dengan fasilitas terlengkap, laboratorium PT SUCOFINDO mampu menangani berbagai pengujian yang berkaitan dengan mutu dalam hubungannya dengan keselamatan, keandalan dan sejenisnya. Didukung oleh sumber daya manusia yang terlatih, peralatan yang mutakhir dan jaringan yang luas serta akreditasi yang sudah diraih dengan selalu menerapkan system mutu ISO/IEC 17025 dan SMK3 dengan baik.
4
Gambar 1. Struktur organisasi PT SUCOFINDO (PERSERO)
Berdasarkan jenis uji, laboratorium PT SUCOFINDO dibagi menjadi 2 yaitu: 1. Laboratorium Kimia
a. Laboratorium Kimia Lingkungan
Laboratorium Pengujian Air Bersih
Laboratorium Pengujian Limbah
Laboratorium Pengujian Udara
b. Laboratorium Kimia Umum & Produk Konsumen
Laboratorium Farmasi
Laboratorium Hasil Pertanian
Laboratorium Makanan Minuman
Laboratorium Produk Konsumen
Laboratorium Mikrobiologi
5
2. Laboratorium Kalibrasi Dan Teknik a. Laboratorium Kalibrasi Kalibrasi Dimensi Kalibrasi Massa Kalibrasi Gaya Kalibrasi Tekanan Kalibrasi Suhu Kalibrasi Kelistrikan
Kalibrasi Volume Dan Aliran b. Laboratorium Teknik
Uji Mekanik Dan Struktur
Uji Elektrik Dan Elektronik
Selama proses pelaksanaan kerja praktik, penulis ditempatkan di laboratorium kimia umum & produk konsumen divisi makanan minuman. Laboratorium makanan dan minuman melakukan uji mutu dan standar bahan baku makanan maupun yang sudah diolah.
6
BAB III
KEGIATAN KERJA PRAKTIK
Selama proses kerja praktik berlangsung, penulis melakukan berbagai macam uji. Berikut daftar kegiatan dan uji-uji yang telah dilakukan penulis:
1. Menentukan kadar gula total dan gula pereduksi
Alat yang digunakan adalah labu takar 100 dan 250 mL, gelas kimia, labu erlenmeyer asah 300 mL, pipet volume 5, 20, 25 dan 50 mL, pipet Mohr, pipet tetes, gelas ukur 25 dan 50 mL, kertas saring Whatman 41, batu didih, buret 50 mL, pendingin tegak, water bath dan hot plate. Sementara bahan-bahan yang dibutuhkan adalah sampel madu, aquabidest, natrium tiosulfat 0,1 N, asam sulfat 25%, kalium iodida 20%, indikator amilum, asam klorida 25% dan 1 N, larutan Carrez I & II, larutan Luff-Schoorl, natrium hidroksida 6 N dan indikator PP.
Cara kerja uji gula total & pereduksi sebagai berikut:
Sampel ditimbang sebanyak 2 gram lalu dilarutkan dengan aquabidest. Larutan ditempatkan ke labu ukur 250 mL lalu ditambahkan larutan CARREZ I & II lalu disetarakan dengan aquadest. Larutan disaring dengan kertas saring whatman 41.
Invert sugar
Filtrat dipipet 5 mL lalu ditempatkan di labu erlenmeyer 250mL kemudian ditambahkan 25 mLlarutan Luff-Schoorl dan aquadest hingga total volume 50 mL, lalu ditambahkan batu didih. Larutan lalu di reflux selama 10 menit dari mulai mendidih. Setelah selesai, larutan di dinginkan kemudian di tambahkan 25 mL H2SO4 25% dan 10 mL KI 20% lalu di titar dengan thiosulfat 0,1 N
hingga berubah warna menjadi kuning pudar. Setelah itu ditambahkan indikator amilum lalu di titar kembali hingga warna menjadi putih susu.
Total sugar
Filtrat dipipet 50 mL ke labu takar 100 mL lalu ditambahkan HCl 25% sebanyak 5 mL. Larutan kemudian di waterbath selama 15 menit di suhu 70˚C. setelah didinginkan, larutan di netralkan dengan NaOH 4 N dan HCl 1 N menggunakan PP sebagai indikator lalu di setarakan dengan aquadest dan disaring dengan kertas saring whatman 41. Filtrat dipipet 5 mL lalu ditempatkan di labu erlenmeyer 250mL kemudian ditambahkan 25 mLlarutan Luff-Schoorl dan aquadest hingga total volume 50 mL, lalu ditambahkan batu didih. Larutan lalu di reflux selama 10 menit dari mulai mendidih. Setelah selesai, larutan di dinginkan kemudian di tambahkan 25
7
mL H2SO4 25% dan 10 mL KI 20% lalu dititar dengan thiosulfat 0,1 N hingga berubah warna
menjadi kuning pudar. Setelah itu ditambahkan indikator amilum lalu di titar kembali hingga warna menjadi putih susu.
2. Menguji kadar air pada madu
Alat refraktometer disiapkan. Sampel diteteskan di tempatnya. Cahaya diatur lalu sesuaikan garis horizontal dengan tanda silang yang ada pada sensor. Setelah itu klik tombol read.
3. Menguji adanya formalin
Formaldehida atau di pasaran umum disebut formalin adalah senyawa yang digunakan untuk mengawetkan mayat atau spesimen sebab adanya sifat antibakteri, sebagai bahan pembersih dan lainnya. Senyawa ini memiliki efek yang sangat buruk bagi manusia apabila dikonsumsi dalam jumlah yang banyak. Dari beberapa standar mutu, formalin hanya boleh memiliki kadar yang sangat kecil dalam makanan mulai dari 0,4 hingga 14mg/hari.
Alat yang dibutuhkan adalah distilasi otomatis, spektrometer UV-VIS, labu takar 50 & 100 mL, labu distilasi buchi, pipet volume 1 dan 4 mL, pipet Mohr, gelas ukur 10 mL dan tabung reaksi. Bahan yang dibutuhkan adalah formaldehida 37%, aquabidest, asam sulfat pekat, asam kromatopat dan asam fosfat.
Cara kerja:
Membuat larutan standar
Formaldehida 37% dipipet 1 mL ke labu takar 100 mL lalu dilarutkan dengan aquadest hingga tera. Setelah itu dipipet kembali 1 mL ke labu takar 100 mL dan dipipet kembali untuk membuat deret standar sebanyak 0,25; 1; 2; 5 mL ke labu takar 50 mL.
Menyiapkan sampel
Sampel ditimbang 50 gram ditempatkan di labu buchi. Ditambahkan aquabidest 50 mL dan 1 mL asam fosfat pekat. Selanjutnya sampel di distilasi selama 13 menit dengan suhu 30C. hasil distilasi ditampung di labu takar 100 mL dengan sebelumnya diberi sedikit aqudest. Distilat kemudian dilarutkan dengan aquadest hingga tera.
Menguji sampel
Deret standar yang sudah disiapkan masing-masing dipipet sebanyak 4 mL ke tabung reaksi, begitu pula sampel yang sudah didistilasi. Kemudian ditambahkan 6 mL asam sulfat pekat dan 1 mL asam kromatopat. Deret standar dan sampel diuji dengan spektrometer UV-VIS di panjang gelombang sekian nm.
8
4. Menguji adanya Histamin
Histamin adalah senyawa yang diproduksi secara alami oleh tubuh apabila mengalami infeksi atau alergi. Histamin berfungsi untuk membantu melawan hal-hal tersebut termasuk menjaga kadar asam lambung serta menjadi neurotransmitter ke otak. Namun apabila jumlah yang diproduksi berlebih, dapat menimbulkan gejala alergi seperti mual, sakit perut, hidung berair dan lainnya. Selain faktor alami tubuh, histamin juga dapat dipicu dari makanan maupun minuman. Makanan yang mengandung histamin didalamnya diantaranya adalah seafood, daging olahan, biji-bijian, susu dan hasil olahannya, dll.
Alat-alat yang dibutuhkan dalam uji ini adalah spektrofluorometer, kolom, resin, labu takar 50 & 100 mL, vortex, magnetic stirrer, gelas kimia, pipet volume dan kertas saring whatman 41. Lalu bahan-bahan yang dibutuhkan adalah histamin klorida, asam klorida, natrium hiroksida, metanol, larutan OPA dalam metanol, asam fosfat.
Menyiapkan sampel
Sampel ditimbang sebanyak 10 gram lalu dilarutkan dalam 50 mL metanol 75% dan di
vortex selama 2 menit. Sampel lalu dimasukkan ke dalam water bath selama 15 menit di suhu 60C. setelah dingin, sampel ditambahkan kembali metanol 75 % 50 mL lalu dihomogenkan, setelah itu disaring dengan whatman 41.
Membuat larutan standar
Histamin klorida ditimbang sebanyak 169 mg lalu dilarutkan dengan asam klorida 0,1 N hingga tera. Larutan dipipet 10 mL ke labu takar 100 mL dan dilarutkan kembali dengan asam klorida 0,1 N (induk kedua). Deret standar dibuat dengan memipet sebanyak 1,2,5 dan 10 mL dari larutan induk kedua ke labu takar 100 mL.
Menyiapkan kolom dan mengaktivasi resin
Resin direndam dalam natrium hidroksida 2N lalu diaduk dengan magnetic stirrer selama 30 menit, setelah itu resin dibilas dengan air hingga bersih. Sebelum resin dimasukkan ke dalam kolom, kolom terlebih dahulu dimasukkan glasswool setelah itu dimasukkan resin. Perlu diperhatikan bahwa resin tidak boleh dalam keadaan kering, sehingga harus diberi air minimal hingga resin terendam semua.
Menguji sampel
Sampel dipipet 1 mL kedalam resin lalu di elusi dengan aqubidest. Hasil ditampung di labu takar 50 mL hingga tera. Sampel yang sudah melewati resin selanjutnya dipipet sebanyak 5 mL ke tabung reaksi, begitu juga deret standar. Setelah itu ditambahkan asam klorida 0,1 N sebanyak 10 mL lalu di vortex. Ditambahkan natrium hirdoksida 1 M sebanyak 3 mL lalu kembali di vortex dan didiamkan selama 5 menit. Larutan OPT ditambahkan ke sampel & standar
9
sebanyak 1 mL lalu di vortex dan didiamkan kembali 4 menit. Setelah itu asam fosfat dipipet sebanyak 3 mL dan ditambahkan ke sampel dan standar lalu di vortex dan didiamkan 15 menit. Sampel dan standar kemudian dibaca di spektrofluorometer di panjang gelombang 350 nm dan 444 nm.
10
BAB IV
HASIL KERJA PRAKTIK
i. Data Pengamatan Uji Gula Total & Pereduksi pada Madu
Gula Total
TABEL 4.1 Data Volume Titrasi Gula Total NO. VOLUME TITRASI
SAMPEL A SAMPEL B BLANKO 24.5 24.6
1 20.1 18.6 2 19.9 18.7
TABEL 4.2 Data Perhitungan Gula Total
A B
1 2 1 2
Konversi massa glukosa dari tabel 11.325 11.850 15.550 15.275 Volume thio penitaran blanko 24.50 24.50 24.60 24.60 Volume thio penitaran sampel 20.1 19.9 18.60 18.70 Volume thio yang sebenarnya* 4.65 4.86 6.34 6.23 Normalitas thio 0.1056 0.1056 0.1056 0.1056 Faktor pengenceran 100 100 100 100 Bobot sampel dalam mg 2021.200 2138.800 2012.7 1990.6 Gula Total % 56.03 55.40 77.26 76.74 Rata-rata Gula total % 55.72 77.00
Gula Pereduksi % 55.34 72.04
Sukrosa % 0.36 4.71 RPD % 1.12 0.68 *Volume thio sebenarnya =
11 Gula Pereduksi
Tabel 4.3 Data Volume Titrasi Gula Pereduksi NO. SAMPEL VOLUME TITRASI
A SAMPEL B BLANKO 24.5 24.6
1 16 13.6 2 15.5 13.9
Tabel 4.4 Data Perhitungan Gula Pereduksi
A B
1 2 1 2
Konversi massa glukosa dari tabel 22.348 23.700 29.274 28.410 Volume thio penitaran blanko 24.50 24.50 24.60 24.60 Volume thio penitaran sampel 16.00 15.50 13.60 13.90 Volume thio yang sebenarnya 8.98 9.50 11.62 11.30 Konsentrasi thio (N) 0.1056 0.1056 0.1056 0.1056 Faktor pengenceran 50 50 50 50 Massa sampel (mg) 2021.2 2138.8 2012.7 1990.6 Kadar Gula Pereduksi* % 55.28 55.40 72.72 71.36 Rata-rata 55.34 72.04
RPD % 0.22 1.89
*
Kadar Air
Tabel 4.5 Data Perhitungan Kadar Air Keterangan Sampel A Sampel B Nilai Indeks Bias 1,4838 1,4960 Suhu 27˚C 27,1˚C Kadar Air 21,1 % 16,3 %
12
Selama pelaksanaan kerja praktik, penulis mendapatkan banyak ilmu baru mulai dari teknik dasar praktikum sampai pengoperasian instrumen. Penulis mendapatkan ilmu tentang teknik pemipetan yang baik, menera, menimbang menggunakan neraca digital, serta penulis juga menggunakan alat baru yang belum pernah dilihat di kampus sebelumnya seperti alat penyaring milipore, alat sonikasi, alat evaporasi nitrogen, alat distilasi otomatis, alat refraktometer dan spektrofluorometer. Alat dan Instrumen yang pernah penulis operasikan ialah KCKT, spektrometer UV-VIS dan pH meter. Selain itu penulis juga mendapat pelatihan tentang instrumen ICP, AAS, HPLC, GC dan LC.
13
BAB V
TINJAUAN TEORITIS
Dalam pengerjaan uji gula total & pereduksi dibutuhkan mata kuliah Dasar-dasar Kimia Analitik. Materi Dasar-Dasar Kimia Analitik yang dibutuhkan adalah titrimetri. Titrimetri atau titrasi adalah suatu teknik analisa kadar atau konsentrasi suatu senyawa, dimana salah satu larutan diketahui konsentrasinya. Larutan yang diketahui ditempatkan di buret (titran) dan ditambahkan ke larutan yang tidak diketahui hingga reaksi selesai. Tanda selesainya reaksi adalah dengan berubahnya warna larutan. Perubahan warna dibantu dengan adanya indikator. Jumlah volume titran yang ditambahkan dicatat untuk menentukan konsentrasi larutan yang tak diketahui.
Pada uji ini titrasi yang digunakan ialah titrasi iodometri. Iodometri merupakan titrasi reduksi-oksidasi dimana kedua reaksi berlangsung bersamaan saat proses titrasi. Reduksi adalah proses kenaikan bilangan oksidasi dengan penambahan elektron, sementara oksidasi memiliki makna sebaliknya. Oksidasi adalah kenaikan bilangan oksidasi dengan melepaskan elektron. Dalam titrasi ini, senyawa yang digunakan pada titrasi ini harus memiliki sifat oksidator dan reduktor. Oksidator adalah senyawa yang mengalami reduksi dan mengoksidasi senyawa lainnya, sedangkan reduktor adalah senyawa yang mengalami oksidasi dan mereduksi senyawa lainnya.
2 S2O32- + I2 ↔ S4O62- + 2 I
-Dalam iodometri dengan standar baku natrium tiosulfat, yang bertindak sebagai reduktor adalah tiosulfat. Sulfur mengalami kenaikan bilangan oksidasi dari +2 menjadi +2,5, sementara iod mengalami reduksi. Iodin mengalami penurunan bilangan oksidasi dari 0 menjadi -1, sehingga dalam kasus ini iodin bertindak sebagai oksidator.
5.1Komposisi gula di madu
Madu terdiri dari berbagai senyawa dimana yang paling dominan ialah karbohidrat. Karbohidrat yang terkandung pun berbagai macam mulai dari karbohidrat sederhana dan berbagai turunannya hingga kompleks. Fruktosa dan glukosa merupakan monosakarida yang memiliki persentase paling banyak sekitar 38% dan 31%. Komponen terbanyak selanjutnya ialah kadar air dengan persentase sekitar 17%. Selain monosakarida, madu juga mengandung disakarida sebanyak 9% yang terdiri dari sukrosa, maltosa dan turunan dari kedua gula tersebut. Komponen-komponen lain yang menyusun madu ialah karbohidrat kompeks, mineral, vitamin, enzim dan sebagainya sebanyak 5%.
14
Gambar 5.1 Diagram komposisi madu
Sumber: http://www.chm.bris.ac.uk/webprojects2001/loveridge/index-page3.html Fruktosa dan glukosa merupakan karbohidrat sederhana yang terdiri dari satu gula (monosakarida). Kedua gula ini juga disebut gula pereduksi. Gula pereduksi adalah gula yang memiliki gugus aldehida sehingga dapat mengalami oksidasi menjadi gugus karboksilat dan mereduksi agen pengoksidasi. Reagen pegoksidasi yang digunakan umumnya mengandung ion Cu2+. Ion ini akan mengalami reduksi menjadi ion Cu+ dan membentuk endapan berwarna
merah. Uji yang biasa dilakukan adalah uji Benedict dan Fehling.
Gambar 5.2 Reaksi oksidasi gula pereduksi
Sumber: http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch25/ch25-2-5.html
Berdasarkan SNI 3545 tahun 2013, uji untuk gula pereduksi (merujuk ke SNI 2892) tidak dapat memisahkan secara spesifik glukosa & fruktosa sehingga hasil yang didapat ialah total dari kedua gula tersebut. Untuk menentukan kadar sukrosa terlebih dahulu ditentukan kadar gula total, sebab sukrosa bukan gula pereduksi ia adalah disakarida yang tidak memiliki gugus hemiasetal sehingga tidak dapat mengalami oksidasi.
15
Gambar 5.3 Struktur glukosa, fruktosa dan sukrosa.
Sumber: https://cdavies.files.wordpress.com/2009/01/glucose-fructose-sucrose.jpg Sukrosa terlebih dahulu mengalami pemecahan menjadi glukosa dan fruktosa. Setelah itu sampel diperlakukan dengan sama sebagaimana metode uji gula pereduksi. Jumlah glukosa dan fruktosa dalam sampel akan bertambah dengan adanya hasil hidrolisis dari sukrosa, sehingga kadar sukrosa dapat dihitung dari selisih gula total dan pereduksi.
Dari hasil pengujian didapat kadar gula total sampel A sebesar 55% dan sampel B sebesar 77%. Bila dijumlahkan dengan kadar air maka didapat 80% untuk sampel A dan 90% untuk sampel B. Menurut SNI 3545 tahun 2013, kadar minimal gula pereduksi dalam madu adalah sebesar 65%. Melihat dari acuan ini, maka sampel A tidak memenuhi syarat mutu SNI 3545. Banyak faktor yang mempengaruhi tidak memenuhinya sampel A dalam sarat mutu, seperti kesalahan pada saat proses pengujian seperti pemipetan yang tidak benar, kebersihan alat yang tidak diperiksa terlebih dahulu sehingga madu terkontaminasi dan penyebab-penyebab lainnya.
5.2Reaksi hidrolisis sukrosa
Sukrosa merupakan disakarida yang terdiri dari glukosa dan fruktosa. Untuk menentukan kadarnya, sukrosa terlebih dahulu dihidrolisis. Proses hidrolisis dibantu dengan adanya asam kuat yang akan memprotonasi sukrosa. Dalam proses ini digunakan HCl 25% dalam air. Asam kuat akan memberikan proton (H+) yang digunakan untuk memutus rantai
asetal dengan cara elektron bebas pada atom oksigen menyerang proton membentuk sukrosa terprotonasi.
16
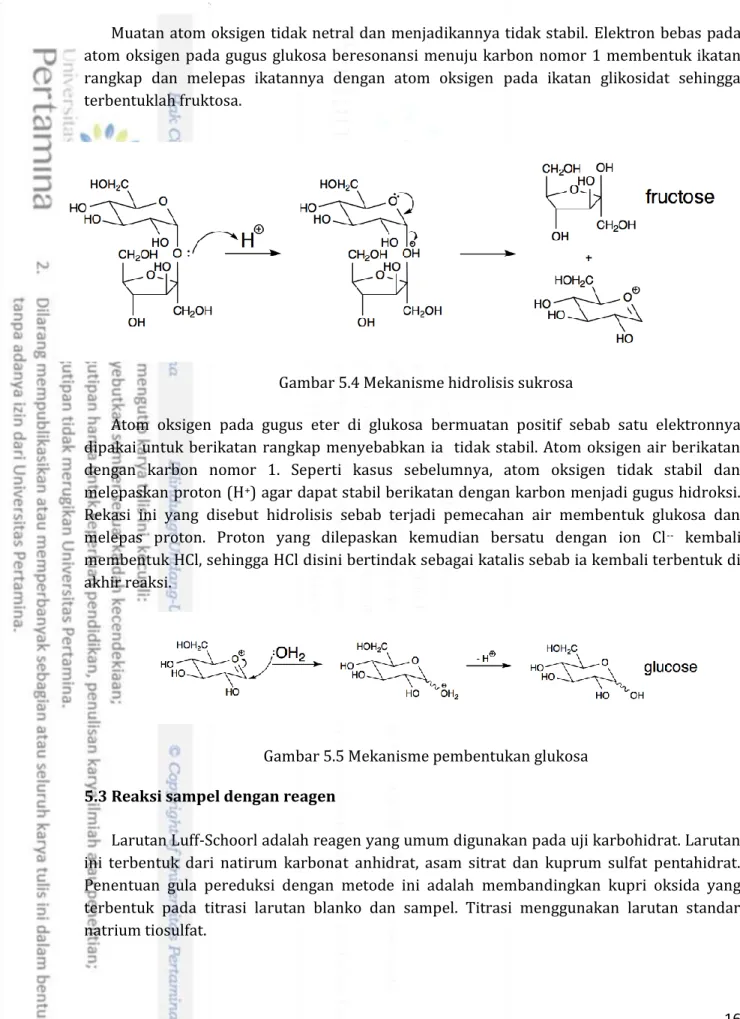
Muatan atom oksigen tidak netral dan menjadikannya tidak stabil. Elektron bebas pada atom oksigen pada gugus glukosa beresonansi menuju karbon nomor 1 membentuk ikatan rangkap dan melepas ikatannya dengan atom oksigen pada ikatan glikosidat sehingga terbentuklah fruktosa.
Gambar 5.4 Mekanisme hidrolisis sukrosa
Atom oksigen pada gugus eter di glukosa bermuatan positif sebab satu elektronnya dipakai untuk berikatan rangkap menyebabkan ia tidak stabil. Atom oksigen air berikatan dengan karbon nomor 1. Seperti kasus sebelumnya, atom oksigen tidak stabil dan melepaskan proton (H+) agar dapat stabil berikatan dengan karbon menjadi gugus hidroksi.
Rekasi ini yang disebut hidrolisis sebab terjadi pemecahan air membentuk glukosa dan melepas proton. Proton yang dilepaskan kemudian bersatu dengan ion Cl-- kembali
membentuk HCl, sehingga HCl disini bertindak sebagai katalis sebab ia kembali terbentuk di akhir reaksi.
Gambar 5.5 Mekanisme pembentukan glukosa
5.3 Reaksi sampel dengan reagen
Larutan Luff-Schoorl adalah reagen yang umum digunakan pada uji karbohidrat. Larutan ini terbentuk dari natirum karbonat anhidrat, asam sitrat dan kuprum sulfat pentahidrat. Penentuan gula pereduksi dengan metode ini adalah membandingkan kupri oksida yang terbentuk pada titrasi larutan blanko dan sampel. Titrasi menggunakan larutan standar natrium tiosulfat.
17
Mulanya kupri oksida (CuO) yang ada pada reagen Luff-Schoorl akan bereaksi dengan gugus aldehida pada gula. Kupri oksida mengoksidasi gugus aldehida menjadi gugus karboksilat dan menghasilkan kupro oksida. Kupro oksida muncul sebagai endapan merah.
R-COH + CuO → Cu2O + R-COOH
Reaksi reagen Luff-Schoorl dengan gula
Reaksi yang terjadi pada saat titrasi adalah natirum tiosulfat akan mereduksi iodin (I2)
menjadi ion iodida (I-) dari kalium iodida (KI). Jumlah ion iodida yang terbentuk setara
dengan banyaknya kupri oksida (CuO). Penambahan amilum dilakukan untuk mengatahui jumlah ion iodida yang telah terbentuk. Amilum akan bereaksi membentuk kompleks dengan iodin menghasilkan warna biru. Amilum tidak bereaksi dengan ion iodida, maka titik akhir titrasi adalah saat warna biru pada larutan menghilang, yang menandakan iodin telah tereduksi menjadi ion iodida. Amilum diberikan saat mendekati titik akhir sebab apabila diberikan diawal titrasi, maka ia akan membentuk senyawa kompleks yang stabil dengan iodin. Hal ini akan mempengaruhi jumlah titran yang diberikan sebab perubahan warna baru terjadi ketika iodin diberi waktu untuk mengalami disosiasi dari kompleks. Apabila konsentrasi iodin tinggi, maka waktu yang dibutuhkan untuk disosiasi semakin lama.
H2SO4 + CuO -> CuSO4 + H2O
CuSO4 + 2 KI -> CuI2 + K2SO4
CuI2 -> Cu2I2 + I2
I2 + Na2S2O3 -> Na2S4O6 + NaI
I2 + amilum -> biru
Reaksi saat titrasi iodometri
5.4Pengujian kadar air
Pengujian kadar air menggunakan alat refraktometer. Kadar air diuji untuk memastikan kesesuaian produk dengan standar mutu. Madu yang masih mentah umumnya mengandung kadar air kurang dari 16%. Semakin besar kadar air maka kualitas madu akan semakin menurun sebab akan terjadinya proses fermentasi oleh bakteri yang ada. Bakteri dapat tumbuh sebab adanya kadar air yang tinggi. Apabila madu mengalami fermentasi maka akan meningkatkan keasaman madu dan menurunkan kualitasnya. Untuk mengukur kadar air, umumnya digunakan instrumen refraktometer.
18
Refraktometer adalah alat yang digunakan untuk mengukur sudut refraksi. Refraksi adalah fenomena ketika cahaya melewati air maka terjadi perubahan arah (pembelokkan). Refraktometer berlandaskan hukum Snell yaitu ketika cahaya memasuki media dengan index refraktif yang lebih rendah, maka kecepatannya akan berkurang. Index refraktif adalah kecepatan cahaya dalam keadaan vakum relatif terhadap kecepatan cahaya pada media tertentu. Semisal air memiliki indeks refraktif 1,33 maka cahaya melaju 1,33 kali lebih cepat dalam keadaan vakum dibandingkan di air.
1
Persamaan hukum Snell
Indeks refraktif dipengaruhi oleh suhu dan panjang gelombang. Semakin tinggi suhu suatu media maka semakin cepat cahaya melaju dan indeks refraktif bernilai semakin kecil. Begitu pun dengan panjang gelombang, semakin pendek panjang gelombang suatu cahaya maka semakin cepat lajunya. Umumnya indeks refraktif diukur pada suhu 20˚C dan menggunakan cahaya natrium dengan panjang gelombang 589.29 nm.
Untuk mengukur index refraktif, refraktometer menggunakan prisma yang memiliki index refraktif lebih besar dari sampel, umumnya terbuat dari kaca atau sapphire buatan. Cara kerja refraktometer adalah cahaya melewati prisma menuju sampel, apabila sudut melewati nilai tertentu maka akan direfleksikan pada prisma. Cahaya yang direfleksikan dideteksi oleh sensor. Apabila indeks refraktif sampel kecil, maka sudut kritis yang terbentuk pun akan kecil dan area sensor yang terang akan semakin luas. Indeks reraktif keudian dapat dihitung menggunakan rasio area yang terang dan gelap pada sensor.
Gambar 6.2 Skema bagian refraktometer. Lampu natrium (1), prisma (2), sampel (3) dan sensor (4)
19
BAB VI
KESIMPULAN & SARAN
Dari serangkaian uji yang telah dilakukan, didapat hasil data kadar gula total sampel A sebesar 55,72% dan sampel B sebesar 77,0 %, sedangkan kadar gula pereduksi sampel A bernilai sebesar 55,34% dan sampel B 72,04% sehingga dari perhitungan didapat kadar sukrosa sampel A 0,36% dan sampel B 4,71%. Sampel A tidak memenuhi standar SNI 3545 pada gula total, hal ini dapat disebabkan oleh beberapa faktor, diantaranya adalah proses hidrolisis yang tidak sempurna atau terjadi kesalahan pada saat pengerjaan oleh praktikan seperti kesalahan tanda baca pada buret dan pipet. Hasil uji kadar air untuk sampel A adalah 21,1% dan sampel B sebesar 16,3%, untuk uji kadar air kedua sampel memenuhi standar mutu SNI 3545.
Adapun saran yang diberikan oleh penulis adalah lebih diperhatikannya Alat Perlindungan Diri (APD) pada saat bekerja untuk mencegah hal-hal yang tidak diinginkan. Untuk pengujian atau penelitian yang lebih lanjut, ada baiknya sampel yang digunakan lebih banyak dan variatif.
20
DAFTAR PUSTAKA
Clarke, M. A., Edye, L. A., & Eggleston, G. (1997). Sucrose Decomposition in Aqueous Solution, and Losses in Sugar Manufacture and Refining. Advances in Carbohydrate Chemistry and
Biochemistry Volume 52, 441–470. doi:10.1016/s0065-2318(08)60095-5 Day, Underwood, (1999). Kimia Analisis Kuantitatif. Jakarta: Erlangga
Soderberg, Tim. (6 Juni 2019). Hemiacetals, hemiketals and hydrate.
https://chem.libretexts.org/Under_Construction/Purgatory/Book%3A_Organic_Chemistry_ with_a_Biological_Emphasis_(Soderberg)/11%3A_Nucleophilic_carbonyl_addition_reactions
/11.3%3A_Hemiacetals%2C_hemiketals%2C_and_hydrates
Hunt, Ian. Chapter 25: Carbohydrates.
http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch25/ch25-2-5.html
Anonim. Chemical Composition of Honey.
http://www.chm.bris.ac.uk/webprojects2001/loveridge/index-page3.html Anonim. What is a Titration?.
https://chemed.chem.purdue.edu/genchem/lab/techniques/titration/what.html GPS Instrument, Ltd. Refractometers-Measuring Principle.
https://www.gpsil.co.uk/our-products/refractometers/measuring-pri/#affixMenu4
Xylem brand. Water-in-honey measuring this aspect of honey quality.
21
LAMPIRAN
22
Daftar hadir kerja praktik
25
Lembar bimbingan kampus kerja praktik
27
Lembar bimbingan instansi kerja praktik
28
Surat keterangan pelaksanaan kerja praktik
29