Mata Kuliah
KIMIA SEKOLAH LANJUT
(Z1601B106)
DOSEN PENGAMPU: Dr.Ramlawati, M.Si
Oleh:
WIWIEK TAMSYANI
NIM: 13B16024
PENDIDIKAN KIMIA
PROGRAM PASCASARJANA
APLIKASI PENGEMBANGAN BERPIKIR KREATIF DAN KRITIS
Materi Pokok : Sifat Koligatif Larutan
Kelas/Semester : XII/ 1
Alokasi Waktu : 20 x 45 menit
Metode : Diskusi, Pratikum, Demonstrasi, Latihan Soal dan Penugasan
Standar Kompetensi : Menjelaskan Sifat-Sifat Koligatif Larutan Nonelektrolit dan Elektrolit.
Kompetensi Dasar :
1. Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku larutan, dan tekanan osmosis termasuk sifat koligatif larutan.
2. Membandingkan antara sifat koligatif larutan nonelektrolit dengan sifat koligatif larutan elektrolit yang konsentrasinya sama berdasarkan data percobaan.
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir
Kritis/Kreatif Kegiatan Pembelajaran Evaluasi
1. Konsentrasi larutan
Konsep Molalitas Zat
Molalitas menyatakan jumlah mol zat terlarut di dalam setiap 1 kg (1000 g) pelarut. Molalitas dapat dirumuskan:
m=n
p
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran dalam menghitung konsentrasi suatu larutan.
Merangsang keingintahuan peserta didik dalam memahami
Kegiatan Pendahuluan
Guru memberikan gambaran mengapa sifat koligatif larutan perlu dipelajari.
Kegiatan Inti (Eksplorasi)
Siswa diminta menjelaskan sifat-sifat larutan.
1. Kristal NaOH dan KOH dengan massa yang sama dilarutkan dalam sejumlah pelarut yang sama pula. Bila Ar K=39 dan
m = molalitas
Konsep Fraksi Mol Zat
XP= a
a+b
Xq= b
a+b
XP+Xq=1
pengunaan persamaan kimia
dalam menghitung
konsentrasi larutan.
Berlatih dalam proses pemecahan masalah dalam suatu cara sistematis berdasarkan informasi yang dimiliki.
Kritis
Mempertimbangkan hasil induksi (mengenarilasasi) tentang perhitungan konsentrasi larutan (molalitas, massa zat terlarut dan Mr jika diketahui molalitasnya serta fraksi mol suatu zat dalam larutan.
Siswa diminta menjelaskan pengertian sifat koligatif.
Siswa diminta menyebutkan sifat-sifat larutan yang termasuk sifat koligatif.
Siswa diminta menentukan kemolaran.
Siswa diminta menjelaskan pengertian dari kemolalan (molalitas) pengertian dari fraksi mol.
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir
Kritis/Kreatif Kegiatan Pembelajaran Evaluasi
2. Pengertian sifat koligatif larutan nonelektrolit dan elektrolit
Konsep Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat yang hanya bergantung pada jumlah partikel zat yang yang konsentrasinya lebih besar (pekat) melalui membrane semipermeabel.
Sifat koligatif larutan terdiri atas larutan nonelektrolit (∆P, ∆Tf, ∂¿ dan larutan
elektrolit.
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran dalam memahami sifat koligatif larutan.
Merangsang keingintahuan peserta didik dalam memahami sifat koligatif larutan
Kritis
Mempertimbangkan hasil induksi (mengenarilasasi) dalam pemahaman sifat koligatif larutan.
Kegiatan Inti (Elaborasi)
Guru memfasilitasi agar pemahaman siswa tentang materi yang tengah dipelajari bertambah baik.
Guru memberikan
kesempatan siswa untuk bertanya hal-hal yang belum diketahui.
Guru meluruskan
kesalahpahaman konsep materi yang disampaikan.
Mengapa pada larutan akan lebih sulit menguap jika dibandingkan dengan pelarut murninya?
3. Tekanan uap jenuh larutan (∆P)
nonelektrolit.
Konsep Sifat Koligatif Larutan Nonelektrolit (∆P)
Tekanan uap jenuh adalah tekanan uap yang
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran dalam memahami sifat koligatif
Kegiatan Inti (Eksplorasi)
Siswa diminta menjelaskan pengertian tekanan uap jenuh.
1. Tekanan uap jenuh air pada suhu 1000C adalah 72 cmHg. Berapa
ditimbulkan pada saat
konsentrasi zat terlarut terhadap penurunan tekanan uap jenuh.
P=Xpelarut. P0
∆ P=P0. Xterlarut
larutan nonelektrolit (penurunan tekanan uap)
Merangsang keingintahuan peserta didik dalam memahami pengaruh zat terlarut yang sulit menguap terhadap tekanan uap pelarut.
Berlatih dalam proses pemecahan masalah yang berkaitan dengan penurunan tekanan uap dalam suatu cara sistematis berdasarkan informasi yang dimiliki.
Kritis
Mempertimbangkan hasil induksi (mengenarilasasi) dalam
Siswa diminta menjelaskan pengaruh zat terlarut terhadap tekanan uap pelarut dan tekanan uap larutan.
Siswa diminta menjelaskan hukum Raoult.
Siswa diminta membaca contoh penggunaan hukum Raoult.
Siswa diminta menjelaskan bagaimana tekanan uap larutan jika zat terlarut sukar menguap.
Siswa dapat menentukan tekanan uap jenuh larutan dengan konsentrasi
pada suhu yang sama, bila diketahui Mr urea=60?
2. Sebanyak 20 g zat A (nonelektrolit) dilarutkan dalam 450 Ml, ternyata tekanan uapnya sebesar 40 cmHg. Bila pada keadaan yang sama tekanan uap jenuh air adalah 40,2 cmHg, tentukan massa molekul relatif (Mr) dari zat A
tersebut?
3. Urea CO(NH2)2 dan glukosa,
C6H12O6 yang massanya sama
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir Kritis/Kreatif
Kegiatan
Pembelajaran Evaluasi
pemahaman sifat koligatif larutan nonelektrolit, yaitu pada penurunan tekanan uap (∆P).
Memperdalam kesadaran
masalah, kesulitan , atau perbedaan informasi
Memelihara keterbukaan (open-endeddness).
Mensejajarkan unsur-unsur yang rupanya tidak relevan.
diketahui.
Kegiatan Inti (Elaborasi)
Guru memfasilitasi agar pemahaman
siswa tentang
penurunan tekanan
uap larutan
bertambah baik.
Guru memberikan kesempatan siswa untuk bertanya hal-hal yang belum diketahui.
Guru meluruskan kesalahpahaman
massanya juga sama. Bila tekanan uap jenuh air pada suhu tertentu adalah P0 mmHg.
konsep materi yang disampaikan.
4. Titik beku dan
titik didih
larutan
nonelektrolit dan larutan
elektrolit.
Konsep kenaikan titik didih zat cair (∆Tb)
Kenaikan titik didih suatu zat cair adalah suhu pada saat tekanan uap jenuh zat cair tersebut sama dengan tekanan luar.
∆ Tb=m . Kb
∆ Tb= g
Mr.
1000
P . Kb
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran dalam proses pengamatan penurunan titik beku suatu zat cair akibat penambahan zat terlarut melalui perocaan.
Pemahaman atas pengetahuan dasar pembelajaran dalam proses Bpengamatan kenaikan
Kegiatan Inti (Eksplorasi)
Siswa diminta menjelaskan perbedaan antara menguap dan mendidih.
Siswa diminta melakukan
eksperimen secara
berkelompok untuk
mengkaji pengaruh zat terlarut pada titik beku sesuai dengan kegiatan pada buku Kimia Michael Purba Jilid 3.
Dari hasil eksperimen siswa diminta
1. Sebanyak 2,4 CO(NH2)2
dilarutkan dalam 50 mL air. Tentukan titik beku larutan! Diketahui Kf air = 1,860C/m; Ar
C=12, N=14, O=16.
2. Sebanyak 36 g glukosa C6H12O6
dilarutkan dalam 250 mL air. Bila Kb = 0,520C/m, tentukan
titik didih larutan!
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir Kritis/Kreatif
Kegiatan
Pembelajaran Evaluasi
∆ Tb=titik didih larutan−titik didih pelarut
Konsep penurunan titik beku zat cair (∆Tf)
Penurunan titik beku terjadi aikbat adanya penambahan zat terlarut pada zat cair sehingga terjadi penurunan titik beku, semakin besar molalitas zat terlarut penurunan titik bekunya juga semakin besar.
titik didih suatu zat cair akibat penambahan zat terlarut melalui perocaan.
Merangsang keingintahuan
peserta didik dalam
memahami penyebab
terjadinya penurunan titik beku dan kenaikan titik didih.
Berlatih dalam proses pemecahan masalah yang
berkaitan dengan
penghitungan penurunan titik beku dan kenaikan titik didih
membandingkan titik beku pelarut murni dengan titik beku beberapa larutan.
Dari hasil
eksperimen siswa diminta
menyimpulkan bagaimana pengaruh kemolalan larutan terhadap titik beku dan penurunan titik beku larutan.
Siswa diminta
membuat laporan praktikum.
dan sukrosa, C12H22O11 sama,
dilarutkan dalam pelarut yang massanya sama, dan Kb adalah
∆ Tf=m. Kf
∆ Tf= g
Mr.
1000
P . Kf
∆ Tf=titik beku pelarut−titik beku larutan
dalam suatu cara sistematis berdasarkan informasi yang dimiliki.
Kritis
Mempertimbangkan hasil induksi (mengenarilasasi) dalam pemahaman sifat koligatif larutan nonelektrolit, yaitu pada penurunan titik beku dan kenaikan titik didih suatu zat cair.
Siswa diminta
menentukan titik didih dan titik beku larutan.
5. Diagram PT penurunan titik
beku dan
kenaikan titik didih.
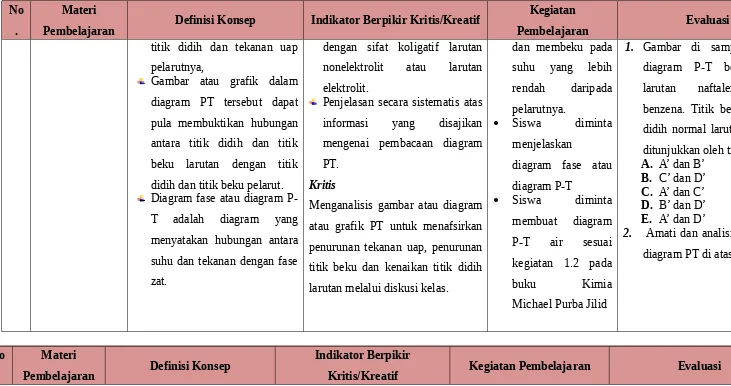
Konsep diagram PT
Gambar atau grafik dalam diagram PT tersebut
membuktikan adanya
hubungan titik didih dan tekanan uap larutan dengan
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran dalam proses pembuatan dan pembacaan diagram atau grafik yang berhubungan
Kegiatan Inti (Eksplorasi)
Siswa diminta
No .
Materi
Pembelajaran Definisi Konsep Indikator Berpikir Kritis/Kreatif
Kegiatan pula membuktikan hubungan antara titik didih dan titik beku larutan dengan titik didih dan titik beku pelarut. Diagram fase atau diagram P-T adalah diagram yang menyatakan hubungan antara suhu dan tekanan dengan fase zat.
dengan sifat koligatif larutan nonelektrolit atau larutan elektrolit.
Penjelasan secara sistematis atas informasi yang disajikan mengenai pembacaan diagram PT.
Kritis
Menganalisis gambar atau diagram atau grafik PT untuk menafsirkan penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih larutan melalui diskusi kelas.
dan membeku pada suhu yang lebih rendah daripada pelarutnya.
Siswa diminta
menjelaskan
diagram fase atau diagram P-T
Siswa diminta
membuat diagram P-T air sesuai kegiatan 1.2 pada
buku Kimia
Michael Purba Jilid
1. Gambar di samping adalah diagram P-T benzena dan larutan naftalena dalam benzena. Titik beku dan titik didih normal larutan naftalena ditunjukkan oleh titik ....
A. A’ dan B’
B. C’ dan D’
C. A’ dan C’
D. B’ dan D’
E. A’ dan D’
2. Amati dan analisislah gambar diagram PT di atas!
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir
nonelektrolit dan larutan
elektrolit.
molekul pelarut dari pelarut murni (larutan yang lebih encer) ke dalam suatu larutan (larutan yang lebih pekat)
melalui selaput
semipermeabel.
Tekanan osmotik adalah besar tekanan yang harus diberikan pada permukaan suatu larutan untuk mencegah terjadinya osmosis.
Di dalam system osmosis, larutan yang memiliki tekanan osmosis sama
pengetahuan dasar
pembelajaran tentang pemahaman materi tekanan osmosis larutan nonelektrolit atau larutan elektrolit.
Menjelaskan pengertian osmosis dan tekanan osmosis serta penerapannya.
Berlatih dalam proses pemecahan masalah yang
berkaitan dengan
penghitungan tekanan osmosis larutan nonelektrolit dan larutan elektrolit dalam suatu cara sistematis berdasarkan informasi yang
menjelaskan apa yang dimaksud dengan osmosis.
Siswa diminta
menjelaskan pengertian tekanan osmotik.
Siswa diminta
menjelaskan hubungan tekanan osmotik dengan konsentrasi larutan.
Siswa memperhatikan penjelasan guru tentang contoh osmosis dalam
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir
Kritis/Kreatif Kegiatan Pembelajaran Evaluasi
disebut isotomik, bila tekanan osmotiknya lebih kecil dibandingkan larutan yang lain disebut hipotonik, sedangkan bila tekanan osmotiknya lebih besar dibandingkan larutan yang lain disebut hipertonik.
∂=M . R .T suatu system tekanan osmosis, yang termasuk isotomik, hipotonik dan hipertonik.
Memperdalam kesadaran masalah, kesulitan , atau perbedaan informasi
Memelihara keterbukaan (open-endeddness).
Mensejajarkan unsur-unsur yang rupanya tidak relevan.
Kegiatan Inti (Elaborasi)
Guru memfasilitasi agar
pemahaman siswa
tentang tekanan osmotik larutan bertambah baik.
Guru memberikan
kesempatan siswa untuk bertanya hal-hal yang belum diketahui.
Guru meluruskan
kesalahpahaman konsep materi yang disampaikan.
1 liter larutan pada suhu yang sama?
7. Perbedaan sifat koligatif larutan nonelektrolit dan
Konsep sifat koligatif larutan nonelektrolit dan larutan elektrolit
Kreatif
Pemahaman atas pengetahuan dasar pembelajaran tentang
Kegiatan Inti (Eksplorasi)
Siswa diminta
menjelaskan
1.
Suatu larutan diperoleh dengan melarutkan 6 g urea (Mr = 60)
larutan elektrolit.
Secara umum dapat disimpulkan bahwa: “untuk konsentrasi yang sama, larutan elektrolit memiliki sifat koligatif larutan yang lebih besar dibandingkan dengan larutan non elektrolit”.
pemahaman sifat koligatif larutan nonelektrolit dan larutan elektrolit.
Menjelaskan penggunaan sifat koligatif larutan dalam kehidupan sehari-hari, ilmu pengetahuan, dan industri.
Kritis
Mampu menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dan nonelektrolit.
perbandingan antara sifat kolegatif larutan elektrolit dan sifat koligatif larutan nonelektrolit.
Siswa diminta
menjelaskan faktor van’t Hoff.
Siswa diminta
menentukan sifat
koligatif larutan seperti titik didih, titik beku, dan tekanan osmotik.
Siswa diminta
mengerjakan latihan soal
lain diperoleh dengan melarutkan 18 g glukosa (Mr =
180) dalam satu liter air. Pada suhu yang sama, berapa tekanan osmotik larutan
pertama dibandingkan
terhadap larutan kedua?
2. Larutan 0,1 molal urea membeku pada -0,18⁰C. Pada saat yang sama, larutan Na2SO4 0,1 molal membeku
pada -0,45⁰C. Faktor van’t Hoff (i) larutan Na2SO4 itu
adalah ....
3. Di antara peristiwa berikut ini
No .
Materi
Pembelajaran Definisi Konsep
Indikator Berpikir
Tertarik pada informasi yang akan dipresentasikan.
Melihat kesamaan informasi dari sudut pandang yang berbeda
“uji kepahaman anda” pada buku Kimia Michael Purba Jilid 3 halaman 30.
Siswa melakukan diskusi perkelompok mengenai penggunaan sifat koligatif larutan dalam kehidupan
sehari-hari, ilmu
pengetahuan, dan industri.
Kegiatan penutup
Guru membimbing siswa menyimpulkan pembahasan
tentang materi yang
disampaikan.
yang tidak ada kaitannya dengan sifat koligatif larutan adalah ....
A. Penggunaan glikol dalam cairan radiator mobil
B. Pencairan salju di jalan raya dengan menaburkan kristal garam
C. Penambahan tawas pada pengolahan air bersih
D. Membunuh lintah dengan menambahkan kristal garam E. Naiknya air tanah ke puncak