Tanaman Tebu
Tanaman tebu (Saccharum officinarum) merupakan tanaman tahunan dari famili Gramineae (keluarga rumput) yang sudah dibudidayakan sejak lama di daerah asalnya di Asia, Papua Nugini. Tanaman tebu memiliki kemiripan bentuk fisik dengan tanaman jagung dan sorgum. Tanaman tebu dikembangkan sebagai salah satu sumber gula komersil sejak tahun 1800an dan menjadi sumber ekonomi utama dari gula bersama gula bit. Tanaman tebu diklasifikasikan dalam divisi Maqnoliophyta, kelas Liliopsida, ordo Cyperales, famili Poaceae (Gramineae) (Barnes, 1973). Tanaman ini dapat tumbuh di daerah beriklim tropik dan subtropik dengan kelembaban tahunan minimum 600 mm. Tanaman tebu termasuk tanaman yang paling efisien dalam berfotosintesis dimana hanya membutuhkan 2% saja dari energi matahari untuk dikonversi menjadi biomassa (Sharpe, 1998).
Lebih dari 100 negara melakukan budidaya tanaman tebu, dengan luas keseluruhan lahan sekitar 130.000 km2. Jumlah tebu yang dipanen oleh 20
negara terbesar penghasil tebu mencapai 1200 juta m3 dalam tahun 2002 untuk
diolah menjadi gula. Hal tersebut berarti 6 kali lebih besar daripada produksi gula bit (Sharpe, 1998). Selama 100 tahun terakhir produksi gula dari tanaman tebu di dunia mengalami peningkatan yang pesat hasil dari perbaikan proses budidaya, penggunaan pupuk, pengontrolan hama dan penyakit tanaman, perbaikan proses di pabrik, mekanisasi produksi dan penggunaan varietas yang menghasilkan rendemen gula tertinggi. Negara yang terbesar dalam memproduksi gula dari tebu ini adalah Brazil, India dan Cina.
Bagian dari tanaman tebu yang diambil untuk pembuatan gula adalah batangnya. Batang tebu diekstrak untuk memperoleh sukrosa. Batang tebu berdiri tegak dengan diameter 3-4 cm dan tinggi 2-5 meter serta tidak bercabang (Soebroto, 1983). Batang terdiri dari ruas-ruas dan dibatasi dengan buku-buku, dimana setiap buku terdapat mata ruas. Gambar tanaman tebu dapat dilihat pada Gambar 1.
Gambar 1 Tanaman tebu (Saccharum officinarum)
Tanaman tebu dipanen pada usia 8-12 bulan. Pemanenan merupakan tahapan yang penting dalam penanganan tebu. Makin mendekati umur panen, kadar sukrosa dalam batang tebu semakin meningkat dan setelah melampaui umur panen terjadi penurunan kadar sukrosa yang diikuti peningkatan kadar glukosa dan frukrosa. Penurunan kadar sukrosa tersebut disebabkan oleh aktifitas enzim invertase dalam batang tebu yang meningkat aktifitasnya. Peningkatan aktifitas invertase dalam jaringan tanaman disebabkan karena adanya signal kebutuhan energi bagi tanaman untuk metabolisme selanjutnya (Foyer et. a/. 1997). Energi tersebut dapat diserap tanaman dalam bentuk gula sederhana (glukosa dan frukrosa) sehingga aktifitas invertase pada sukrosa terpacu untuk bekerja.
Nira Tebu
Nira tebu adalah suatu ekstrak cairan yang berasal dari batang tebu, mengandung kadar gula relatif tinggi, dijadikan bahan baku pembuatan gula kristal. Selain tebu, sumber nira lain yang banyak digunakan dalam pembuatan gula adalah aren, kelapa, lontar dan sugarbeet. Dalam pabrik gula, proses ekstraksi nira tebu dari batangnya dilakukan dengan cara pencacahan dan penggilingan. Nira tebu hasil ekstraksi selain mengandung sukrosa yang akan menjadi bahan baku pembuatan gula kristal, juga mengandung komponen lain seperti gula pereduksi (glukosa dan fruktosa), serat, zat bukan gula dan air.
Komposisi nira tebu tidak akan selalu sama, tergantung pada jenis tebu, kondisi geografis, tingkat kematangan serta cara penanganan selama penebangan dan pengankutan (Reece, 2003). Umumnya nira terdiri atas 73-76% air, 11-16% serat dan 11-16% padatan-padatan terlarut dan tersuspensi (James dan Chen, 1985). Komposisi kimia nira tebu hasil ekstraksi dalam susunan rata-rata disajikan pada Tabel 1.
Tabel 1 Komposisi kimia nira tebu
Komposisi Kimia Jumlah (%)
Sukrosa Gula pereduksi
Zat organik Zat anorganik
Serat
Zat warna, wax, gum Air 11-14 0.5 - 2.0 0.5-2.5 0.15-0.20 10-15 7.5-15 60-80 Sumber : Moerdokusumo (1993)
Beberapa jenis polisakarida lain juga terdapat dalam nira tebu sebagai hasil metabolisme tanaman seperti dextran, levan, pektin, selulosa, hemiselulosa, pati dan gum (Cuddihy et.al., 2000). Semua bahan selain sukrosa dapat memberikan efek negatif terhadap proses pembuatan gula kristal, seperti memberi kesempatan mikroorganisme untuk tumbuh, mempersulit proses pemurnian dan menghambat proses kristalisasi. Keberadaan pati yang relative tinggi nira lebih kental sehingga menyebabkan filtrasi berjalan lambat dan larutan tampak lebih keruh.
Menurut Paine (1953) nira tebu mengandung komponen senyawa nitrogen organik berupa protein tinggi (albumin), protein sederhana (albuminosa dan peptosa), asam amino (glisin, asam aspartat) dan asam amida (asparagin, glutamin). Selain itu nira tebu juga mengandung komponen asam organik lain seperti akonitat, oksalat, suksinat, glikolat dan malat. Kandungan garam organik yang teridentifikasi dalam nira tebu diantaranya adalah fosfat, klorida, sulfat, silikat dan nitrat dari Na, K, Ca, Al dan Fe. Menurut Legaz et. al. (2000), nira tebu dapat mengandung glikoprotein bila nira tersebut dihasilkan dari batang yang mengalami kerusakan atau terserang mikroorganisme pathogen.
Dalam keadaan segar, nira tebu berwarna coklat kehijau-hijauan dengan pH 5,0-6,0 (Goutara dan Wijandi, 1975). Menurut Gillet (1985) zat warna yang
terdapat dalam nira tebu adalah klorofil yang berasosiasi dengan xantofil, karoten, antosianin, tannin dan sakretin. Sedangkan warna coklat timbul akibat reaksi pencoklatan enzimatis dari polifenol.
Proses pengolahan nira tebu menjadi gula terbagi dalam 2 bagian (Pancoast dan W. Ray, 1980). Pertama, proses ekstraksi batang tebu untuk diambil niranya, kemudian dilakukan rafinasi sebagian dan kristalisasi, menghasilkan gula mentah (raw sugar). Bahan selain sukrosa dipisahkan semaksimal mungkin dengan proses-proses defekasi, sulfitasi, karbonatasi, defekasi-sulfitasi serta kombinasi keempat proses tersebut. Kedua, proses purifikasi gula mentah dan kristalisasi lebih lanjut, menghasilkan gula (refine sugar). Proses kerusakan banyak terjadi pada tahap pertama pembuatan gula dimana nira tebu masih memiliki aktivitas enzimatis dan mikrobiologis.
Dalam proses pembuatan gula kristal, degradasi sukrosa (inversi atau hidrolisis) harus dicegah sebesar mungkin. Degradasi sukrosa menghasilkan molekul glukosa dan fruktosa, yang dikenal sebagai gula invert. Glukosa dan fruktosa bersifat tidak dapat dikristalkan dan menghambat proses kristalisasi sukrosa dalam pengolahan gula. Hal tersebut menyebabkan rendemen gula menjadi rendah. Faktor-faktor yang dapat meningkatkan degradasi sukrosa diantaranya adalah peningkatan keasaman, suhu dan lama inkubasi nira tebu pada suhu yang terus meningkat.
Kerusakan pada Nira Tebu Sukrosa dan Degradasinya
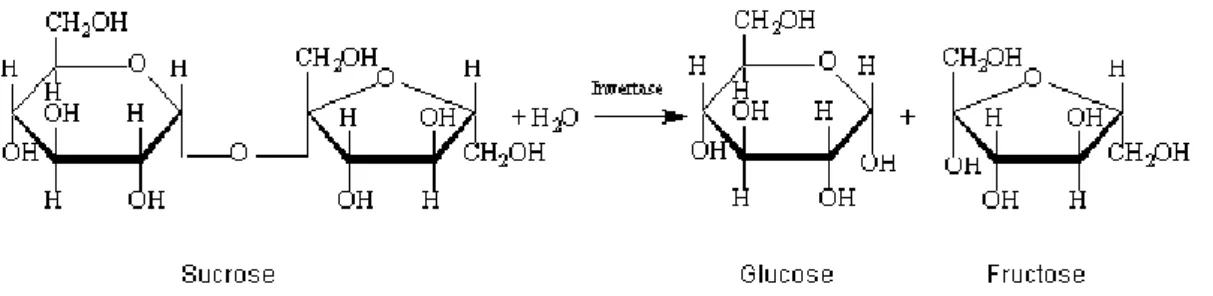
Sukrosa adalah jenis gula disakarida yang dikenal juga sebagai "gula meja", berwarna putih, berbentuk kristal padat dengan rasa manis dan dapat membentuk caramel serta terdekomposisi pada suhu 186°C. Pada saat sukrosa mengalami dekomposisi akan menghasilkan karbondioksida dan air serta menghasilkan warna coklat pada produknya. Rumus empirik sukrosa adalah C12H22O11, sama seperti laktosa dan maltosa tetapi berbeda struktur molekulnya
(lihat Gambar 2).
Dalam molekul sukrosa, molekul penyusunnya (glukosa dan fruktosa) diikat oleh ikatan glikosidik 1→2-α,β-. Dengan demikian secara sistemik sukrosa dinamakan sebagai α-D-glucopyranosyl-(1→2)-β-D-fructofuranoside. Sukrosa memiliki sifat-sifat lainnya sebagai berikut (Chaplin. 2004) :
• Dapat larut dalam air dengan kelarutan 2,1 g dalam 1 g air pada suhu 25°C • Menunjukan indeks refraktif pada larutannya 10%
• Suhu melting pada 186°C • Densitas energi: 17 kJ/g • Berat molekul: 342,3 g/mol
Degradasi sukrosa, khususnya pada nira tebu, terjadi disebabkan oleh reaksi invertasi terhadap molekul sukrosa. Reaksi invertasi merupakan reaksi hidrolisis irreversible dimana satu molekul sukrosa dan satu molekul air menghasilkan satu molekul glukosa dan satu molekul fruktosa. Proses ini dipercepat dengan panas. Invertasi molekul sukrosa murni diproses paling cepat sampai mendekati 5000 kali pada 90°C dibanding pada 20°C. Pada prakteknya reaksi ini terjadi pada pH dibawah 7 dan proses dipercepat dengan penurunan pH. Reaksinya adalah indotermik dengan energi aktivasi 25,9 kilokalori per mol pada 20°C. Reaksi ini dapat juga melalui katalisis biokimia dengan beberapa enzim, khususnya invertase (Pennington dan Charles, 1990 dan Wang, 2004). Proses inversi dapat terjadi secara sempurna selama 48 - 72 jam pada suhu 50°C dengan pH 4,5 (Chaplin. 2004). Reaksi invertasi atau hidrolisis sukrosa selengkapnya disajikan pada Gambar 3.
Gambar 3 Reaksi invertasi atau hidrolisis sukrosa
Invertase
Nama lain dari invertase adalah β-fructofuranosidase yang menunjukan reaksi yang dikatalis enzim ini adalah reaksi hidrolisis pada gugus ujung non-reduksi β-fructofuranoside dalam β-fructofuranosides. Selain itu reaksi tersebut juga dapat menghidrolisis gugus α-D-glucosidase yang merupakan gugus ujung
unit glukosa. Selain oleh invertase, sukrosa juga dapat dihidrolisis dalam kondisi lingkungan yang asam walaupun tanpa adanya enzim (Wang, 2004).
Invertase dapat dihasilkan oleh beberapa jenis mikroorganisme dengan menggunakan substrat sukrosa. Secara komersil invertase dihasilkan dari jenis khamir Saccharomyces cerevisiae atau Saccharomyces carisbergensis.
Walaupun berasal dari kultur yang sama, invertase dapat memiliki bentuk yang berbeda-beda. Sebagai contoh, invertase intraselular mempunyai berat molekul 135.000 dalton sedangkan invertase ekstraselular mempunyai berat molekul 270.000 dalton (Wang, 1999).
Berbeda dengan kebanyakan enzim, invertase memiliki kisaran wilayah pH yang cukup besar yaitu pH 3,5-5,5, dengan pH optimum 4,5. Aktivitas invertase optimum pada suhu sekitar 55°C. Pada beberapa jenis enzim, nilai Michaelis-Mentennya mempunyai kisaran nilai Km antara 2 mM dan 5 mM, namun pada invertase mempunyai nilai Km sekitar 30 mM.
Invertase Dalam Nira Tebu
Dalam tanaman tebu mengandung berbagai jenis enzim, diantaranya adalah enzim invertase yang berperan dalam reaksi invertasi sukrosa menjadi glukosa dan fruktosa. Selain dalam tanaman tebu, invertase juga teridentifikasi dalam buah apel (Qiu Hong PAN, et. a/., 2005), umbi kentang (Ewing et. a/., 1977, Pressey dan Row Shaw, 1966, Ewing et. a/., 1977), buah tomat (Pressey, 1994) dan ubi (Matsushita dan Uritani, 1976).
Tanaman tebu mengandung invertase dalam bentuk yang sama (isoform) dengan keberadaan atau posisi yang berbeda-beda sebagai berikut : invertase netral (neutral invertase), invertase asam vakuola (vacuolar acid invertase),
invertase asam yang terikat pada dinding sel (cell-wall bound acid invertase) dan invertase asam apoplastik terlarut (apoplastic soluble acid invertase) (Vorster dan Botha, 1998). Pengelompokan invertase juga dapat didasarkan pada pH optimum aktifitasnya, yaitu : invertase asam, invertase netral dan invertase alkali. Pengelompokan invertase lainnya adalah berdasarkan lokalisasi terhadap intraseluler yaitu : invertase terlarut dan invertase terikat (Mahbubur et.al. 2004).
Menurut Zhu et.al. (1997), aktifitas invertase asam yang terlarut memiliki korelasi dengan akumulasi sukrosa dalam batang tebu. Sementara itu hal yang sama tidak terjadi pada invertase netral. Menurut Vorster dan Botha (1998), akumulasi sukrosa dan aktifitas spesifik invertase netral dalam batang tebu tidak
menunjukan korelasi yang signifikan. Invertase netral memiliki aktifitas spesifik yang lebih tinggi daripada invertase asam terlarut (apoplastik dan vakuola). Invertase asam yang terikat pada dinding sel teridentifikasi keberadaannya dalam batang tebu sejak sebelum batang tebu matang atau siap panen.
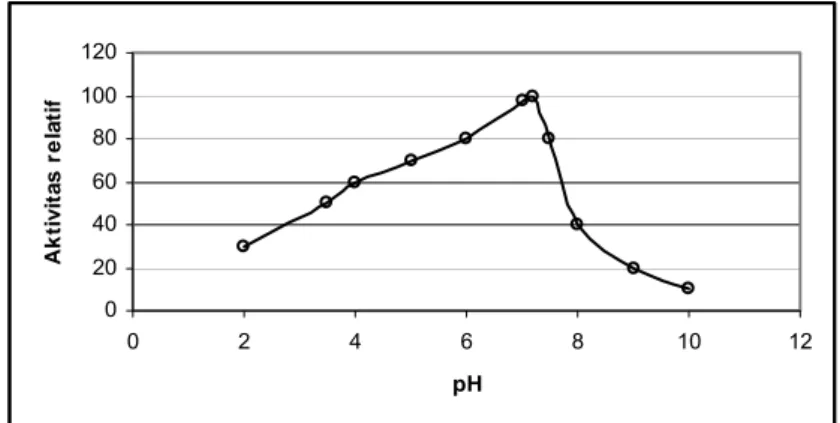
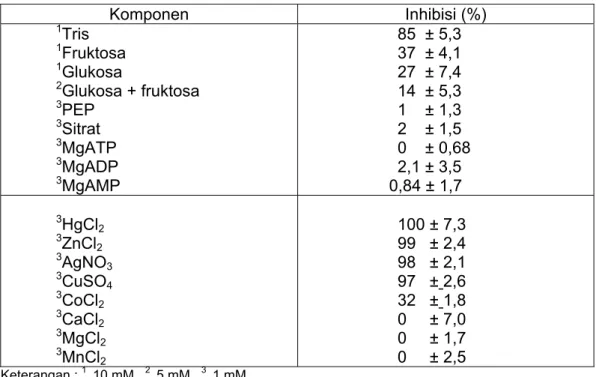
Invertase pada tebu termasuk jenis glikoprotein dengan kadar gula 7,29% dan berat molekul 218 kDa (Mahbubur et. al., 2004). Aktifitas invertase maksimal pada pH 7,2 dan suhu 60°C. Pengaruh pH dan suhu terhadap aktivitas invertase dalam nira tebu selengkapnya disajikan pada Gambar 4 dan Gambar 5. Kemampuan penghambatan aktivitas invertase oleh berbagai produk metabolit dan ion logam disajikan pada Tabel 2.
0 20 40 60 80 100 120 0 2 4 6 8 10 1 pH A k ti v it a s r e la ti f 2
Gambar 4 Pengaruh pH terhadap aktivitas invertase pada tebu (Mahbubur et.al., 2004) 0 20 40 60 80 100 120 0 20 40 60 80 10 Suhu (oC) A k ti v it a s r e la ti f 0
Gambar 5 Pengaruh suhu terhadap aktivitas invertase pada tebu (Mahbubur et.al., 2004)
Tabel 2 Kemampuan penghambatan aktivitas invertase oleh berbagai produk metabolit dan ion logam (Vorster, dan Frederik, 1998)
Komponen Inhibisi (%) 1Tris 1Fruktosa 1Glukosa 2Glukosa + fruktosa 3PEP 3Sitrat 3MgATP 3MgADP 3MgAMP 85 ± 5,3 37 ± 4,1 27 ± 7,4 14 ± 5,3 1 ± 1,3 2 ± 1,5 0 ± 0,68 2,1 ± 3,5 0,84 ± 1,7 3HgCl 2 3ZnCl 2 3AgNO 3 3CuSO 4 3CoCl 2 3CaCl 2 3MgCl 2 3MnCl 2 100 ± 7,3 99 ± 2,4 98 ± 2,1 97 ± 2,6 32 ± 1,8 0 ± 7,0 0 ± 1,7 0 ± 2,5 Keterangan : 1 10 mM, 2 5 mM, 3 1 mM
Mikroorganisme dalam Nira Tebu
Kerusakan pada nira tebu juga dapat disebabkan oleh aktivitas mikroorganisme melalui proses fermentasi. Beberapa jenis mikroba dapat juga memproduksi invertase seperti Cladosporium cladosporioides (Almeida et. a/., 2000) dan kamir methylotropik (Hansenula polymorpha dan Pichia pastoris)
(Niuris et.al., 2000) sehingga kontaminannya dapat meningkatkan konsentrasi invertase dalam nira tebu. Kontaminasi mikroorganisme ke dalam nira tebu dimulai sejak pemanenan hingga berlangsungnya proses pengolahan, termasuk kontaminasi dari peralatan pengolahan.
Salah satu jenis mikroorganisme yang sering teridentifikasi mengkontaminasi nira tebu adalah Leuconostoc mesenteroides yang mempunyai kemampuan menghasilkan enzim untuk mengkonversi sukrosa menjadi fruktosa dan dextran. Dekstran dihasilkan oleh reaksi enzim dextransucrase pada sukrosa. Dekstran memiliki struktur sukrosa dan menghambat kristalisasi sukrosa.
Kerusakan lebih lanjut dari degradasi sukrosa adalah terbentuknya asam-asam organik seperti asam-asam laktat dan asetat (Mathlouthi, 2000). Leuconostoc mesenteroides dapat mengkonsumsi sukrosa dengan sangat cepat (8.05 g/l/jam pada suhu 25 °C and 8.46 g/l/jam pada suhu 30 °C) selama 6 jam (Cerutti de
Guglielmone et. a/., 2000 di dalam Mathlouthi, 2000 ). Proses fermentasi tersebut berarti terjadi kehilangan sukrosa sebanyak 59% pada suhu 25 °C dan 62% pada suhu 30 °C. pada suhu yang lebih tinggi (37 °C and 40 °C) persentase konsumsi sukrosa dapat menurun menjadi 47% dan 27% (Mathlouthi, 2000).
Jenis mikroorganisme lain yang teridentifikasi mengkontaminasi nira tebu adalah Flavobacterium rigenes, Brevibacterium sulferens, Flavobacterium devorans, Candida pulcherrima, Klebsiela azaenae, Chromabacterium lividum, Bactobacillus arabinosus dan Saccharomyces lactis. Mikroba lain yang dapat mengkontaminasi nira tebu adalah Saccharococcus sacchari yang diindikasikan dengan terbentuknya glikoprotein dalam batang tebu (Legaz et. a/., 2000).
Kerusakan nira akibat aktivitas mikroorganisme ditandai dengan rasa asam pada nira, berbuih putih dan berlendir dengan reaksi kimia seperti yang disajikan pada Gambar 6 (Goutara dan Wijandi, 1985). Menurut Legaz et. a/., (2000), adanya glikoprotein juga menjadi indikasi kontaminasi mikroba dalam nira tebu dan telah terjadi kerusakan terlebih dahulu pada batang tebu.
C12H22O11 + H2O C6H12O6 + C6H12O6
sukrosa glukosa fruktosa
C6H12O6 2 C2H5OH + 2 CO2
glukosa/fruktosa etanol C2H5OH + O2 CH3COOH + H2O
etanol asam asetat
Gambar 6 Tahapan reaksi fermentasi pada nira tebu
Pada reaksi pertama terjadi reaksi invertasi pada sukrosa dengan katalis invertase atau reaksi hidrolisis karena adanya asam. Pada reaksi kedua, hasil reaksi invert atau hidrolisis sukrosa dapat dikonsumsi oleh mikroorganisme dan diubah menjadi alkohol dan selanjutnya dioksidasi menjadi asam asetat. Terbentuknya asam menyebabkan reaksi hidrolisis sukrosa terjadi lagi dan nira menjadi asam. Menurut Goutara dan Wijandi (1985), proses degradasi sukrosa diikuti dengan pembentukan warna coklat tua. Semakin tinggi jumlah dekomposisi sukrosa makin nyata warnanya. Selanjutnya komponen glukosa dan fruktosa yang telah terbentuk dari reaksi hidrolisa sukrosa, mengalami proses fermentasi membentuk etil alkohol. Etil alkohol kemudian dioksidasi menjadi asam asetat. Kondisi nira yang asam akan semakin meningkatkan inversi sukrosa di dalam nira tebu.
Pertumbuhan mikroorganisme secara umum mengikuti pola tertentu yang terdiri atas 6 fasa yaitu fasa awal, fasa penyesuaian, fasa eksponensial, fasa pelambatan, fasa stasioner dan fasa penurunan. Perubahan antar fasa merupakan fungsi dari waktu pertumbuhan. Fasa awal adalah masa penyesuaian mikroorganisme sejak mengkontaminasi bahan. Pada fasa ini terjadi sintesis enzim oleh sel yang diperlukan untuk metabolisme metabolit. Setelah fasa awal selesai, mulai terjadi reproduksi sel mikroorganisme. Konsentrasi sel mikroorganisme atau biomassa meningkat, mula-mula perlahan kemudian makin lama makin meningkat. Pada saat laju pertumbuhan sel mikroorganisme mencapai titik maksimal, maka terjadi pertumbuhan secara eksponensial. Pada fasa ini keadaan pertumbuhan mikroorganisme mantap. Penurunan laju pertumbuhan atau fasa pelambatan terjadi pada saat substrat yang diperlukan mikroorganisme untuk pertumbuhan mendekati habis dan terjadi penumpukan produk-produk penghambat pertumbuhan. Fasa pertumbuhan akan terhenti dan terjadi modifikasi struktur biokimiawi sel mikroorganisme pada fasa stasioner. Fasa selanjutnya adalah fasa penurunan , dimana jumlah sel mikroorganisme berkurang akibat terjadi kematian yanbg diikuti autolisis oleh enzim selular.
Penghambatan Kerusakan Nira Tebu Pengaruh Suhu dan pH
Aktivitas enzim sangat dipengaruhi oleh perubahan pH dan suhu. Setiap enzim memiliki pH dan suhu optimum untuk aktivitasnya. Pada saat reaksi berjalan dibawah titik optimum, kecepatan reaksi berlangsung semakin cepat hingga titik optimum. Setelah melampaui titik optimumnya, kecepatan reaksi berlangsung semakin menurun, bahkan pada menjadi inaktif. Perubahan kecepatan aktivitas enzim akibat pengaruh pH dan suhu disebabkan karena perubahan struktur tersier enzim dan ikatan kovalen yang mempengaruhi bentuk enzim (seperti interaksi ion dan ikatan hydrogen). Sebagai contoh, perubahan pH akan mengubah posisi ionisasi asam amino yang akhirnya akan mempengaruhi aktivitas katalitiknya sebagai enzim. Sementara itu ikatan hydrogen juga sangat dipengaruhi oleh peningkatan suhu, dimana pada suhu tinggi ikatan hydrogen akan putus, sehingga struktur enzim akan berubah dan kemampuannya bereaksi dengan substrat akan hilang (Harrow dan Mazur, 1958). Grafik hubungan perubahan pH dan suhu terhadap aktivitas enzim disajikan pada Gambar 7.
Pengaruh suhu dan pH dapat digunakan sebagai faktor untuk mencegah aktifitas enzim yang tidak dikehendaki. Dengan penggunaan suhu yang menyebabkan inaktivasi enzim maka kerusakan enzimatis dapat dicegah. Pada nira tebu, enzim yang sangat berperan dalam kerusakan nira tebu adalah invertase. Enzim ini terdapat secara alami dalam nira tebu dan juga dihasilkan oleh mikroorganisme kontaminan, khususnya Saccharomices cereviceae.
4 6 8 10 12 pH ak ti vi tas en z im Ak tiv itas enz im akt ivi tas en z im Ak tiv itas enz im 10 20 30 40 50 60 suhu (C) pH Suhu (C)
Gambar 7 Grafik hubungan perubahan ph dan suhu terhadap aktivitas enzim Kerusakan pada nira tebu dapat dihambat dengan mengontrol reaksi kerusakan melalui pengaturan pH dan suhu. Kedua parameter tersebut memiliki peran besar mempengaruhi aktivitas enzimatis dan mikrobiologis. Setiap enzim memiliki kondisi pH dan suhu tertentu untuk reaksinya, demikian pula aktifitas mikrobiologi. Enzim invertase dalam tebu memiliki aktivitas maksimal pada pH 7,2 dan suhu 60° C, dan mencapai setengah aktivitas maksimalnya pada pH 6,4 dan 8,2 (Mahbubur et.al., 2004, Vorsterdan Frederik, 1998). Untuk mengurangi kehilangan sukrosa pada tahap pemurnian dan evaporasi, pH harus diatur agar mencapai 6,3-6,4 pada akhir evaporator (Eggleston et.al., 2003). Penggunaan suhu tinggi selain membunuh mikroorganisme dalam nira dapat juga berfungsi menginaktivasi enzim seperti invertase yang aktivitasnya terhenti dengan pemanasan selama 2 menit pada suhu 90° C (Vorster dan Frederik, 1998).
Suhu dan pH juga mempengaruhi aktivitas mikroorganisme. Seperti halnya enzim, mikroorganisme juga memiliki batas optimum agar dapat bertahan hidup. Umumnya mikroorganisme tidak dapat bertahan hidup pada kondisi suhu dan pH yang terlalu rendah atau terlalu tinggi.
Pengaruh Penambahan Bahan Pengawet
Upaya pencegahan kerusakan akibat reaksi enzimatis dan mikrobiologis juga dapat dilakukan dengan penambahan bahan pengawet, baik yang bersifat inhibitor enzim ataupun antimikrobial. Inhibisi enzim atau penghambatan aktifitas enzim merupakan hal penting yang perlu diperhatikan dalam penelitian yang menyangkut kesehatan. Misalnya Pb, Hg dan logam berat lainnya bersifat sangat beracun pada manusia karena kerjanya sebagai penghambat kerja enzim. Meskipun mekanisme penghambatan kerja invertase oleh logam-logam berat berbeda dengan mekanismenya pada enzim lain, namun dapat dipastikan bahwa logam-logam berat tersebut sangat menghambat kerja invertase. Sebagai contoh, ion Ag++ menyerang rantai sisi histidin pada molekul invertase dan
menyebabkan invertase tidak aktif.
Beberapa jenis logam sangat efektif menghambat aktivitas enzim invertase seperti HgCI2, ZnCI2, AgNO3, dan CuSO4 (Vorster dan Frederik, 1998,
Mahbubur et.al., 2004). Natrium benzoat dan larutan amoniak dalam jumlah 0.05% dan 0.32% dapat menghentikan fermentasi pada nira tebu selama 2-3 hari, pada konsentrasi 0.10% dan 1.28% dapat menghentikan fermentasi hingga 6 hari (Bobadilla dan Preston, 1981, Duarte et. al., 1981).
Inhibisi enzim juga dapat dilakukan oleh selektif enzim, pestisida atau herbisida yang cara kerjanya adalah dengan menghambat pertumbuhan atau pertahanan organisme yang menghasilkan invertase. Berbagai perlakuan untuk penyakit juga dapat bersifat penghambat enzim. Jenis inhibitor lainnya adalah substrat dan produk reaksi enzimatis itu sendiri. Pada invertase, sukrosa dan gula invertnya dapat menghambat kerja invertase pada konsentrasi yang tinggi (Wang, 1999).
Aplikasi penambahan pengawet pada pembuatan gula dari nira tebu harus mengikuti aturan pemerintah dan mengikuti standar food grade.
Penggunaan beberapa jenis bahan kimia dalam bahan pangan seperti formalin dan borax kini sangat dilarang karena membahayakan kesehatan. Berbagai bahan alami kini dikembangkan sebagai pengawet seperti yang dilakukan oleh petani-petani nira aren sejak lama, yaitu memanfaatkan akar kawao, kulit dan buah manggis, laru janggut, kulit batang kusambi, remasan daun jambu mete, tangkal dan kulit batang nangka (Sedarnawati et. al,, 1999). Pemanfaatan komponen kimia dari ekstrak tanaman atau komponen fitokimia telah diaplikasikan sejak lama, yang diketahui melalui pengalaman empiris. Pada
masa kini komponen-komponen fitokimia tersebut banyak diteliti untuk diidentifikasi lebih lanjut.
Fitokimia sebagai Bahan Pengawet
Fitokimia adalah segala jenis zat kimia atau nutrien yang diturunkan dari sumber tumbuhan, termasuk sayuran dan buah-buahan. Fitokimia dapat berperan sebagai antimikroba, antivirus, antiimflamantori, perlakuan pengobatan penyakit dan bahan pengawet. Penelitian berbagai fitokimia telah banyak dilakukan dalam rangka pemanfaatan lebih lanjut senyawa tersebut. Beberapa senyawa fitokimia yang banyak dimanfaatkan adalah (Murray, 1996):
• Glikosida, suatu molekul yang dibangun oleh struktur molekul gula (glikon) dan non-gula (aglikon). Biasanya senyawa non-gula (aglikon) penyusun glikosida adalah senyawa fitokimia lain yang akan membebaskan jdiri jika diperlukan. Struktur glikosida dapat pecah disebabkan oleh reaksi hidrolisis dan enzimatis. Pemanfaatan glikosida akan didasarkan oleh kemampuan senyawa aglikonnya. Glikosida juga dapat digunakan sebagai pengikat toksik.
• Flavonoid, termasuk didalamnya adalah isoflavonoid, biasa digunakan sebagai antioksidan. Fitokimia ini juga berperan dalam pigmentasi (merah, kuning dan biru), bersifat antimikroba, antialergik, antiimflamantori, dan antikanker.
• Alkaloid, merupakan turunan senyawa amina, bersifat racun dan dapat membentuk garam dengan asam (asam mineral dan organik). Senyawa ini bersifat anastetik dan analgesik, sering dimanfaatkan sebagai bahan obat-obatan.
• Terpenoid, terdiri atas beberapa unit isopren, berperan dalam menghasilkan aroma, rasa dan warna pada tanaman. Senyawa ini juga bersifat antimikroba dan antineoplastik.
• Tannin, senyawa yang dapat mengendapkan protein, bersifat antidiare, hemostatik dan antihemordial.
Kawao (Millettia sp.)
Kawao (millettia) merupakan tanaman perdu yang memanjat, tegak, panjang 10 - 30 m, tumbuh di hutan hutan dan di tepi-tepi sungai mulai dari dataran rendah sampai ± 1000 m di atas permukaan laut (Menninger, 1970).
Tanaman kawao atau Millettia termasuk dalam famili Fabaceae (sub-famili papillionoidae). Tanaman ini memiliki 200 spesies dengan bentuk pohon, tanaman merambat dan perdu, yang tersebar di daerah tropis Afrika (Irvine, 1961), Asia, Australia, and America (Thulin, 1983). Pada Gambar 8 disajikan salah satu jenis tanaman kawao atau millettia.
Gambar 8 Tanaman kawao (Millettia).
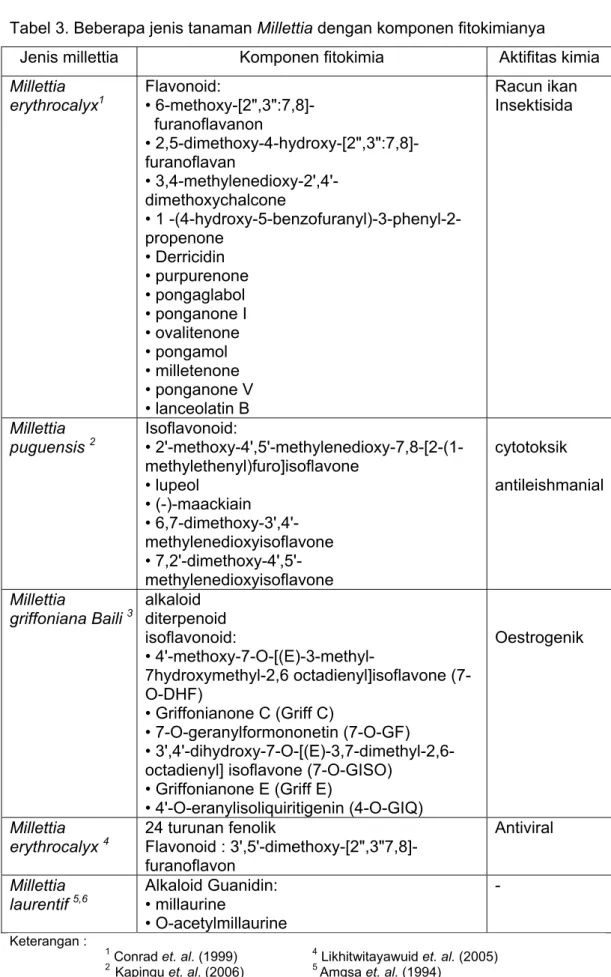
Tanaman kawao (millettia) mengandung komponen fitokimia, diantaranya adalah alkaloid, diterpenoid, coumarin, flavonoid dan isoflavonoid (Amgsa et. a/., 1994; Dewick, 1994; Wanda, 2006). Jenis isoflavon pada millettia yang telah diidentifikasi oleh Yankep et. al., (1997; 1998; 2001) adalah chalcone, a rotenoid, a phenylcoumarine dan beberapa jenis isoflavon lain. Komponen-komponen tersebut diekstraksi dari bagian akar dengan menggunakan heksan. Pada Tabel 3 disajikan beberapa jenis tanaman Millettia dengan komponen fitokimianya.
Tanaman millettia banyak dimanfaatkan sebagai trypanocidal, anti-plasmodial, insektisida, piscisida, molluscicida (Teesdale, 1954; Singhal et al., 1982; Amgsa et. al., 1994). Akar tanaman ini digunakan sebagai obat tradisional oleh sebagian masyarakat Indonesia seperti obat cacing, mata dan luka luar (Menninger, 1970). Menurut Teysmann dalam Menninger (1970), orang Jawa memberikan sepotong akar dalam cairan palem yang masih segar agar cairan tersebut (nira) tidak menjadi asam. Tanaman ini juga dimanfaatkan dalam bidang pengobatan (Gamgsa et. al., 1993;) Millettia conraui, Millettia laurantii and Millettia sanagana digunakan sebagai obat sakit perut yang disebabkan parasit pada anak (Singhal, 1982). Millettia zechiana digunakan sebagai obat bronchial rhinopharyngial. Ekstrak akar dan batang Millettia griffoniana digunakan sebagai obat tradisional, insektisida, mengurangi peradangan yang disebabkan penyakit paru dan asma, infertilitas, smenorrhea dan masalah menopause (Sandberg and Cronlund, 1977). Ekstrak akar Millettia griffoniana mengandung isoflavon Griffonianone D yang bersifat mengurangi peradangan (antiimflamantory) (Yankep et. al., 2003).
Tabel 3. Beberapa jenis tanaman Millettia dengan komponen fitokimianya
Jenis millettia Komponen fitokimia Aktifitas kimia
Millettia
erythrocalyx1 Flavonoid: • 6-methoxy-[2",3":7,8]-
furanoflavanon • 2,5-dimethoxy-4-hydroxy-[2",3":7,8]-furanoflavan • 3,4-methylenedioxy-2',4'-dimethoxychalcone • 1 -(4-hydroxy-5-benzofuranyl)-3-phenyl-2-propenone • Derricidin • purpurenone • pongaglabol • ponganone I • ovalitenone • pongamol • milletenone • ponganone V • lanceolatin B Racun ikan Insektisida Millettia
puguensis 2 Isoflavonoid: •
2'-methoxy-4',5'-methylenedioxy-7,8-[2-(1-methylethenyl)furo]isoflavone • lupeol • (-)-maackiain • 6,7-dimethoxy-3',4'-methylenedioxyisoflavone • 7,2'-dimethoxy-4',5'- methylenedioxyisoflavone cytotoksik antileishmanial Millettia
griffoniana Baili 3 alkaloid diterpenoid
isoflavonoid: • 4'-methoxy-7-O-[(E)-3-methyl-7hydroxymethyl-2,6 octadienyl]isoflavone (7-O-DHF) • Griffonianone C (Griff C) • 7-O-geranylformononetin (7-O-GF) • 3',4'-dihydroxy-7-O-[(E)-3,7-dimethyl-2,6-octadienyl] isoflavone (7-O-GISO)
• Griffonianone E (Griff E)
• 4'-O-eranylisoliquiritigenin (4-O-GIQ)
Oestrogenik
Millettia
erythrocalyx 4 24 turunan fenolik Flavonoid :
3',5'-dimethoxy-[2",3"7,8]-furanoflavon
Antiviral
Millettia
laurentif 5,6 Alkaloid Guanidin: • millaurine
• O-acetylmillaurine - Keterangan : 1 Conrad et. al. (1999) 2 Kapingu et. al. (2006) 3 Wanda (2006)
4 Likhitwitayawuid et. al. (2005) 5 Amgsa et. al. (1994)
Tanaman kawao (millettia) juga mengandung komponen rotenoid yang dikenal sebagai salah satu insektisida alami, termasuk untuk membasmi larva nyamuk Aedes aegypti (Abe et al., 1985). Menurut Yenesew et. al., 2003) rotenoid bersifat larvisida sebagaimana penelitiannya pada jenis millettia : M. dura, M. lasiantha, M. leucantha, M. oblata, M. tanaensis and M. Usaramensis.
Struktur kimia rotenioid dan flavonoid lain yang diisolasi dari spesies Millettia
disajikan pada Gambar 9.
Gambar 9. Struktur kimia rotenoid dan flavonoid lain yang diisolasi dari salah satu spesies millettia (Yenesew et. a/., 2003)
Manggis (Garcinia mangostana L.)
Tanaman manggis (Garcinia mangostana L) termasuk dalam famili Clusiaceae (Guttiferae). Tanaman manggis berbentuk pohon yang selalu hijau dengan tinggi 6-20 m. Batangnya tegak dengan batang pokok yang jelas. Kulit batang berwarna coklat dan memiliki getah kuning. Asal usul tanaman manggis tidak diketahui. Waktu berbunga dimulai pada bulan Mei hingga bulan Januari. Tanaman ini dapat tumbuh di Jawa pada ketinggian 1-1000 m di atas permukaan laut, pada berbagai tipe tanah (pada tanah liat dan lempung yang kaya bahan organik), sering sebagai tanaman buah. Iklim yang diperlukan adalah adanya
kelembaban dan panas dengan curah hujan yang merata (IPTEKnet, 2005). Pada Gambar 10 disajikan bentuk pohon, daun dan buah tanaman manggis
(Garcinia mangostana L).
Gambar 10 Tanaman manggis (Garcinia mangostana)
Kulit kayu, kulit buah dan lateks kering Garcinia mangostana mengandung sejumlah zat warna kuning yang berasal dari dua metabolit yaitu mangostin dan β-mangostin yang berhasil diisolasi. Mangostin merupakan
komponen utama sedangkan β-mangostin merupakan konstituen minor
(IPTEKnet, 2005). Dari hasil suatu penelitian dilaporkan bahwa Mangostin (1,3,6-trihidroksi-7-metoksi-2,8-bis(3metil-2-butenil)-9H-xanten-9-on) hasil isolasi dari kulit buah mempunyai aktivitas antiinflamasi dan antioksidan. Dari hasil studi farmakologi dan biokimia dapat diketahui bahwa mangostin secara kompetitif menghambat tidak hanya reseptor histamin H, mediator kontraksi otot lunak tetapi juga epiramin yang membangun tempat reseptor H1, pada sel otot lunak secara utuh. Mangostin merupakan tipe baru dari histamine (IPTEKnet, 2005).
Dalam penelitian lain ditemukan komponen fitokimia dalam batang manggis adalah tannin (Abbiw, 1990), α-mangostin dan β-mangostin (Sakagami et. al., 2005; linuma et. al., 7996; Dharmaratne et al., 2005; Suksamrarn et. a/., 2002) dan xantonin (Ee et. al., 2006; Nilar e.t al., 2002; Gopalakrishnan et. al., 1997). Menurut Ee et. al., (2006) komponen xantonin pada batang manggis yang telah diidentifikasi adalah
(2,6-dihydroxy-8-methoxy-5-(3-methylbut-2-enyl)-xanthone) dan 6 jenis xantonin prenilat yaitu : α-mangostin, β-mangostin, garcinone D, 1,6-dihydroxy-3,7-dimethoxy-2-(3-methylbut-2-enyl)-xanthone, mangostanol dan 5,9-dihydroxy-8-methoxy-2,2-dimethyl-7-(3-methylbut-2-enyl)-2H,6H-pyrano-[3,2-b]-xanthene-6-one. Komponen xantonin juga terdapat pada lateks batang manggis hingga 75% (Dharmaratne et. al., 2005). Ekstraksi komponen xantonin dilakukan menggunakan heksan (Nilar e.t al., 2002).
Komponen-komponen fitokimia dalam batang manggis memiliki sifat antibacterial, anti-inflammatory, antifungal, larvisida, antiviral, antioksidan dan sejumlah aktifitas biologi lainnya (Dharmaratne et. al., 2005; Sundaram et. al., 2002; Ee et. al., 2006; Perry, 2007). Senyawa α-mangostin telah diteliti bersifat antimikroba, khususnya pada Enterococci and S. aureus, dengan nilai konsentrasi penghambatan minimum atau minimum inhibitory concentration
(MIC) masing-masing 6,25 dan 12,5 microg/ml (Sakagami et. al., 2005; linuma et. al., 1996). Pada Mycobacterium tuberculosis, α- and β-mangostins memiliki nilai konsentrasi penghambatan minimum atau minimum inhibitory concentration
(MIC) 6.25 μg/ml (Suksamrarn et. al., 2002). Beberapa xantonin yang diekstrak dari manggis bersifat antifungal (Geetha et. al., 1997; Gopalakrishnan et. al., 1997). Ekstrak komponen batang manggis juga telah diuji bersifat larvisida, khususnya pada larva nyamuk Aedes aegypti (Ee et. al., 2006). Dalam beberapa penelitian, komponen dalam manggis berupa mangostin dan xantonin bersifat inhibitor terhadap beberapa jenis protein, enzim dan reaksi kimia lain (Chairungsrilerd, 2002; Mahabusarakam et. al., 2002; Furukawa et. al., 2002; Jinsart et. al., 2002). Dengan sifat-sifat yang telah dijelaskan, batang manggis digunakan untuk berbagai keperluan, diantaranya sebagai obat seperti diare, disentri dan penyakit lainnya (Jayaweera, 1981; Quisumbing, 1978; Morton, 1987; Sakagami et. al., 2005).
Gambar 11. Struktur Mangostin (Nilar e.t al., 2002)
α-mangostin R1 = H. R2 = CH3 β-mangostin R1 = H. R2 = H γ-mangostin R1 = H. R2 = H
Tanaman manggis juga digunakan oleh sebagian petani aren untuk mencegah kerusakan niranya, dengan memasukan kulit batang atau buah manggis ke dalam larutan nira. Kulit batang manggis juga digunakan sebagai antioksidan karena mengandung xantones (α dan y-mangostens) dengan kemampuan yang lebih baik daripada antioksidan BHA dan α-tocopherol