Pengaruh Hipoksia Berkelanjutan
terhadap Kadar Malondialdehid, Glutation
Tereduksi dan Aktivitas Katalase
Ginjal Tikus
Enikarmila Asni,* Indriati Pramodo Harahap,** Ani Retno Prijanti,** Septelia Inawati Wanandi,** Sri Widia A. Jusman,** Mohamad Sadikin**
*Departemen Biokimia, Fakultas Kedokteran, Universitas Riau,
**Departemen Biokimia dan Biologi Molekuler, Fakultas Kedokteran Universitas Indonesia
Abstrak: Radical oxygen species (ROS) dibentuk dan dilepaskan dalam kondisi hipoksia, terutama dari mitokondria. Pemantauan aktivitas ROS ini dapat dengan pengukuran variabel yang paling sering digunakan, yaitu kadar malondialdehid (MDA), glutation tereduksi (GSH) dan aktivitas katalase. Pada penelitian ini, variabel-variabel diukur dan diteliti untuk menentukan pengaruh hipoksia berkelanjutan terhadap ginjal tikus. Kondisi hipoksia didapat dengan menggunakan kandang perlakuan hipoksia yang diisi campuran gas oksigen 8% dan nitrogen 92%. Tikus dipelihara pada kondisi ini selama 3 dan 14 hari. Kelompok kontrol dipelihara pada kandang kondisi lingkungan biasa. Kadar protein ginjal ditentukan metode Warburg-Christian. Metode Wills digunakan untuk penentuan kadar malondialdehid (MDA) dan metode Ellman untuk kadar glutation (GSH). Aktivitas enzim katalase dihitung berdasarkan penguraian H2O2 pada panjang gelombang 210 nm. Aktivitas katalase meningkat secara bermakna pada hipoksia 3 dan 14 hari dibandingkan normoksia, namun kadar hipoksia selama 14 lebih rendah dibandingkan hipoksia 3 hari. Sebaliknya, kadar protein MDA dan GSH tidak berbeda bermakna untuk masing-masing kelompok. Pada penelitian ini dapat disimpulkan bahwa hipoksia berkelanjutan dapat mempengaruhi kadar MDA, GSH dan aktivitas katalase secara berbeda pada organ ginjal.
Malondialdehyde, Reduced Glutathione, and Catalase Activity of Rat Kidney Tissues in Chronic Hypoxia
Enikarmila Asni,* Indriati Pramodo Harahap,** Ani Retno Prijanti,** Septelia Inawati Wanandi,** Sri Widia A. Jusman,** Mohamad Sadikin**
*Departemen Biokimia, Fakultas Kedokteran, Universitas Riau,
**Departemen Biokimia dan Biologi Molekuler, Fakultas Kedokteran Universitas Indonesia
Abstract: Radical oxygen species (ROS) are produced and released during hypoxia, especially in mitochondria. Several variables which commonly used to monitor ROS activity in cell are malondialdehyde (MDA), reduced glutathione (GSH) and catalase. In this study, these variables had been measured and studied to evaluate the effects of chronic hypoxia on rat kidneys. Hypoxic condition was created using a hypoxic chamber gassed with a mixture of 8% oxygen and 92% nitrogen. Rats were placed in this condition for 3 and 14 days. A control group is placed in environmental atmosphere. Kidney protein concentrations were measured by Warburg-Christian method. Wills’ method was used for measuring MDA and Ellman’s method for GSH. Catalase activities were measured by measuring hydrogen peroxide (H2O2) decomposition directly by observing the decrease of the extinction at 210 nm. Catalase activities were significantly higher in day 3 and 14, even though day 14 activities were lower than day 3. On the other hand, protein, MDA and GSH concentration showed no significant differences between those groups. From this study, it was concluded that chronic hypoxia might cause different conditions of MDA, GSH and catalase activities in kidney.
Keywords:Hypoxia, malondialdehyde, reduced glutathione, catalase activities, kidney
Pendahuluan
Proses sel menghasilkan energi dapat berlangsung secara aerob maupun anaerob. Energi yang dihasilkan dalam proses aerob jauh lebih besar dibandingkan dengan proses anaerob. Proses glikolisis secara aerob menghasilkan 38 molekul ATP (adenosin trifosfat) untuk 1 molekul glukosa,
sedangkan dalam kondisi anaerob hanya 2 molekul ATP.1,2
Selain gangguan yang disebabkan oleh berkurangnya energi sel, kondisi hipoksia juga mengakibatkan peningkatan pembentukan radikal oksigen. Salah satu sumber radikal oksigen adalah kebocoran elektron yang terjadi di
mito-kondria.3 Radikal oksigen ini merusak molekul-molekul
biologis lain dengan reaksi berantai. Radikal bebas dapat mengakibatkan kerusakan makromolekul seperti protein, asam deoksiribonukleat (DNA), asam ribonukleat (RNA) dan lipid.2,4
Beberapa senyawa yang sering dijadikan petunjuk adanya kerusakan akibat radikal bebas ini adalah malon-dialdehid (MDA), glutation (GSH) dan enzim katalase. MDA merupakan metabolit hasil peroksidasi lipid oleh radikal bebas. GSH memegang peranan dalam reaksi penguraian peroksida menjadi air. Enzim katalase memiliki peranan proses penguraian peroksidase menjadi air dan oksigen. MDA merupakan salah satu senyawa yang dapat menggambarkan
aktivitas oksidan (radikal bebas) dalam sel, sedangkan glutation dan katalase menggambarkan aktivitas anti oksidan
dalam sel.5,6
Aliran darah ke ginjal dalam kondisi istirahat mencapai 20% dari curah jantung menjadikan organ ini seakan-akan
jauh dari kemungkinan mengalami kekurangan oksigen.7-9
Walaupun pada kondisi sebenarnya, pemeriksaan perbedaan tekanan arteri-vena yang menggambarkan konsumsi oksigen jaringan ginjal menunjukkan bahwa aliran darah ke ginjal berhubungan dengan fungsinya sebagai tempat
pemben-tukan urin dibandingkan sistem oksigenasi jaringannya.8,9
Sirkulasi ginjal diatur oleh beberapa sistem seperti sistem vasomotor, persarafan dan autoregulasi. Autoregulasi yaitu kemampuan organ untuk mempertahankan aliran darah relatif konstan terhadap perubahan tekanan perfusi oksigen. Ginjal dan otak merupakan dua organ yang memiliki sistem autoregulasi yang efisien di tubuh. Organ ini berperanan
sebagai sensor terhadap kondisi kekurangan oksigen.9
Sebagai contoh ialah peranan ginjal dalam memproduksi
eritropoetin pada kondisi hipoksia sistemik kronis.10
Kondisi hipoksia atau iskemia akut di ginjal pada umumnya bersifat reversibel dan kerusakan epitel tubulus yang terjadi masih dapat diperbaiki dan akhirnya berfungsi
mempe-ngaruhi metabolisme sel dan pembentukan radikal oksigen di ginjal, seperti yang terjadi di organ lainnya. Kondisi hipoksia yang lama dan berat dapat menyebabkan kerusakan jaringan ginjal, diiringi proses fibrotik yang mengakibatkan
gagal ginjal kronik.11 Penelitian ini bertujuan untuk
mempelajari dan mengamati pengaruh hipoksia berkelanjutan dan lamanya hipoksia terhadap pembentukan radikal oksigen di ginjal dengan mengobservasi beberapa variabel seperti kadar MDA, GSH dan aktivitas enzim katalase.
Metode
Penelitian ini merupakan penelitian laboratorium lanjutan
atas eksperimen in vivo model hipoksia pada tikus Rattus
sp. strain Sprague-Dawley jantan dengan berat badan
200-250 gram. Hipoksia dilakukan dengan memasukkan tikus ke
dalam hypoxic chamber yang dialirkan udara dengan
konsentrasi oksigen 8% dan nitrogen 92%.Tikus diberikan
makanan dan minuman yang mencukupi dan kebersihan kandang dijaga. Sebanyak masing-masing 9 ekor tikus untuk kelompok hipoksia 3 hari dan 14 hari dikorbankan dan diisolasi organ ginjalnya. Sebanyak 9 ekor tikus kelompok kontrol yang tidak mengalami hipoksia juga dikorbankan dan diisolasi
ginjalnya.12 Penatalaksanaan hewan coba ini dilaksanakan
dengan mengikuti kaidah etik penggunaan hewan coba untuk
penelitian. Ginjal disimpan dalam lemari pendingin (deep
freezer) dengan suhu -80°C untuk pemeriksaan selanjutnya. Jaringan ginjal ditimbang dan dibuat homogenat dengan larutan dapar fosfat 0,1 M pH 7,4. Perhitungan kadar protein ginjal dilakukan dengan metode Warburg-Christian berdasarkan kurva standar protein yang diperoleh dari
pro-tein albumin serum sapi (bovine serum albumin/BSA).
Pengukuran kadar MDA dilakukan menurut metode Wills.13
Pengukuran kadar GSH dilakukan menurut metode Ellman.14
Penentuan aktivitas enzim katalase menggunakan adaptasi
metode Aebi.15, 16
Aktivitas enzim katalase dihitung berdasarkan
pe-nguraian H2O2 pada panjang gelombang 210 nm. Satu unit
aktivitas didefinisikan sebagai perbedaan serapan per menit
per miligram protein jaringan.16
Data diolah dengan bantuan program Statistical
Pack-age for Social Science (SPSS) versi 16.0. Uji statistik yang digunakan disesuaikan dengan sebaran data yang di-dapatkan. Jika data berdistribusi normal dan homogen maka digunakan uji parametrik Anova satu arah, sedangkan jika salah satu syaratnya tidak dipenuhi maka digunakan uji non parametrik Kruskal-Wallis dan uji korelasi dengan uji Spearman test. Perbedaan antara variabel dinyatakan bermakna jika p<0,05.
Hasil
Pada penelitian ini didapatkan bahwa kadar protein pada masing-masing kelompok perlakuan tidak berbeda bermakna baik pada kelompok normoksia, hipoksia 3 hari dan hipoksia 14 hari (Gambar 1).
Gambar 1. Diagram Batang Kadar Protein Jaringan Ginjal pada Kelompok Normoksia, Hipoksia 3 Hari dan Hipoksia 14 Hari
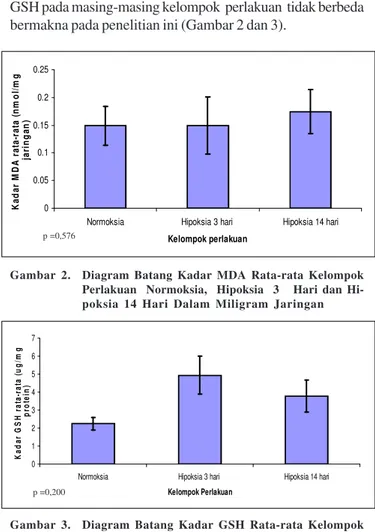
Lama dan beratnya hipoksia dapat mempengaruhi keseimbangan senyawa yang bersifat pro-oksidan dan anti oksidan dalam sel. Namun ditemukan bahwa kadar MDA dan GSH pada masing-masing kelompok perlakuan tidak berbeda bermakna pada penelitian ini (Gambar 2 dan 3).
Gambar 2. Diagram Batang Kadar MDA Rata-rata Kelompok Perlakuan Normoksia, Hipoksia 3 Hari dan Hi-poksia 14 Hari Dalam Miligram Jaringan
Gambar 3. Diagram Batang Kadar GSH Rata-rata Kelompok Perlakuan Normoksia, Hipoksia 3 Hari dan Hi-poksia 14 Hari dalam Miligram Protein
Namun di lain pihak, secara statistik aktivitas enzim katalase berbeda secara bermakna pada setiap kelompok perlakuan (Gambar 4). 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
Normoksia Hipoksia 3 hari Hipoksia 14 hari Kelompok perlakuan K a d a r p ro te in ( m g p ro te in /m g ja ri n g a n ) p = 0,471 0 0.05 0.1 0.15 0.2 0.25
Normoksia Hipoksia 3 hari Hipoksia 14 hari Kelompok perlakuan K a d a r M D A r a ta -r a ta ( n m o l/ m g ja ri n g a n ) p =0,576 p =0,200 0 1 2 3 4 5 6 7
Normoksia Hipoksia 3 hari Hipoksia 14 hari Kelompok Perlakuan K a d a r G S H r a ta -r a ta ( u g /m g p ro te in )
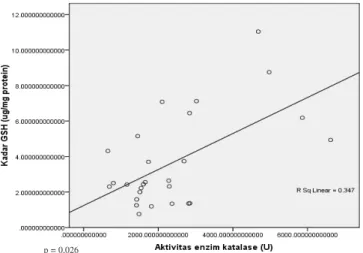
Gambar 3 dan 4 menunjukkan peningkatan kadar rata-rata GSH pada hipoksia 3 hari juga diikuti peningkatan aktivitas enzim katalase. Sesuai dengan kondisi tersebut penelitian menemukan adanya hubungan yang bermakna antara GSH dan aktivitas enzim katalase pada ginjal (Gambar 5).
Gambar 5. Korelasi antara Kadar GSH dan Aktivitas Enzim Katalase
Diskusi
Kondisi hipoksia akan menurunkan kemampuan sel untuk sintesis protein karena proses ini membutuhkan ATP sebagai sumber energi. Tidak ditemukannya perbedaan konsentrasi protein pada ginjal dapat diterangkan teori. Pertama, hal ini dapat disebabkan oleh adanya perbedaan metabolisme sel-sel di ginjal. Beberapa sel, terutama di bagian medulla adalah daerah yang metabolismenya bersifat anaerob. Sehingga pergeseran konsentrasi oksigen dapat tidak mempengaruhi kondisinya. Teori yang kedua yaitu adanya proses adaptasi sel-sel dalam menghadapi
ling-0 500 1000 1500 2000 2500 3000 3500 4000 4500
Normoksia Hipoksia 3 hari Hipoksia 14 hari
Kelompok perlakuan A k ti v it a s k a ta la s e ( U ) p = 0,001
Gambar 4. Diagram Batang Aktivitas Katalase Rata-rata Kelompok Perlakuan Normoksia, Hipoksia 3 hari dan Hipoksia 14 Hari.
p = 0,026
kungan yang hipoksia. Sel-sel menurunkan proses metabolismenya sehingga energi yang ada dapat
diman-faatkan untuk proses bertahan.1,17
Kondisi keseimbangan protein didapat jika sintesis pro-tein yang berkurang juga diikuti pengurangan katabolisme
protein. Storey & Storey (2004)18 menyatakan bahwa proses
katabolisme protein ditekan selama kondisi hipoksia sehingga tidak terjadi pengurangan konsentrasi protein dalam sel. Hewan-hewan yang bersifat adaptif terhadap kondisi hipoksia, proteinnya memiliki waktu paruh yang meningkat pada kondisi hipoksia dibandingkan pada saat kondisi normoksia. Hal ini selain bermanfaat untuk mencegah kebutuhan sintesis protein baru, juga untuk menghindarkan penumpukan metabolit dan energi yang dikeluarkan untuk
pengolahan metabolit katabolik protein di dalam sel.18
Kondisi hipoksia mengakibatkan peningkatan pem-bentukan ROS di dalam sel. Sumber ROS dalam kondisi hipoksia terutama berasal dari mitokondria dan aktivitas enzim NADP(H) oksidase dan xantin oksidase. Peningkatan pembentukan ROS ini tidak langsung menimbulkan kondisi stres oksidatif bagi sel. Sel akan menjaga keseimbangan dengan meningkatkan pembentukan senyawa atau reaksi
yang bersifat anti oksidan.1,5,7,17
Kemampuan sel untuk mengatasi kondisi stres oksidatif ini dapat bergeser. Pada saat sel tidak mampu lagi mengatasi pembentukan berlebihan senyawa yang bersifat pro-oksidan, maka akan terjadi penumpukan senyawa ini yang meng-akibatkan berlanjutnya kerusakan sel ke tahap lebih berat yang irreversibel, bahkan sampai ke tahap nekrotik atau
apoptotik sel.1,5,17
Hasil penelitian ini menggambarkan bahwa pada pembentukan ROS pada kondisi hipoksia sistemik yang terjadi karena rendahnya konsentrasi oksigen lingkungan (oksigen 8%, nitrogen 98%) sampai hari ke-3 dan hari ke-14 masih dapat diatasi oleh ginjal sehingga tetap berada dalam suatu keseimbangan yang sama dengan kondisi normoksia. Hal ini
dapat dilihat dari kadar MDA dan GSH. Sebagai produk hasil oksidasi ROS, MDA memberikan gambaran kerusakan yang terjadi jika antioksidan tubuh tidak dapat mengatasi peningkatan zat-zat oksidan. Jika MDA tidak berbeda berarti antioksidan tubuh masih dapat mengatasi peningkatan ROS. Kadar GSH yang tidak berbeda bermakna juga berarti proses tereduksinya GSSG menjadi GSH masih dapat berlangsung. Jika kadar ROS yang terbentuk sebenarnya meningkat, tetapi kadar GSH tetap sama, maka tetap terjadi ketidakseimbangan kadar hidrogen peroksida di dalam sel.
Enzim katalase ditemukan meningkat secara bermakna. Hal ini dapat menggambarkan adanya kondisi yang harus diatasi oleh katalase dalam sel ginjal yang hipoksia. Kadar GSH dan aktivitas enzim katalase memiliki korelasi yang bermakna dan berbanding lurus di organ ginjal pada penelitian ini. Hal ini berarti peningkatan kadar GSH sejalan dengan peningkatan aktivitas enzim katalase dan juga sebaliknya.
Ginjal merupakan organ yang memiliki konsentrasi enzim glutation peroksidase dan katalase yang cukup tinggi dibandingkan organ-organ lainnya di tubuh. Guzy dan
Schumacker3 menemukan bahwa terjadi pembentukan yang
berlebihan dari enzim katalase sebagai usaha tubuh untuk mengatasi peningkatan senyawa oksidan.
Halliwell dan Gutteridge4 menyatakan bahwa enzim
glutation peroksidase dan katalase berkerjasama dalam mengatasi peningkatan kadar hidrogen peroksida. Pada saat konsentrasi hidrogen peroksida di dalam sel meningkat maka katalase lebih berperanan dalam mengatalisasi penguraian
H2O2.Sebagian peneliti menyatakan bahwa aktivitas
kompensasi ini melindungi PUFA sehingga molekul ini biasanya mengalami oksidasi oleh radikal oksigen pada tahap
hipoksia yang lanjut.4,19
Penelitian yang memfokuskan pada kondisi awal hipoksia menemukan bahwa selain menimbulkan peningkatan terhadap konsentrasi ROS, kondisi hipoksia juga akan meningkatkan pembentukan antioksidan dalam sel. Pada penelitian adaptasi hipoksia, sel yang telah beradaptasi memiliki daya tahan yang lebih baik terhadap serangan iskemia ataupun hipoksia sesudahnya. Hal ini terjadi karena tubuh telah meningkatkan pembentukan senyawa anti oksidan.
Penelitian yang dilakukan Chen et al.20 dengan pola adaptasi
tikus terhadap lingkungan hipoksia hipobarik selama 14 jam sehari menghasilkan kadar MDA yang tidak berbeda bermakna baik pada bagian korteks maupun bagian medula . Sebaliknya kadar enzim SOD meningkat secara bermakna.
Hal inilah yang menjadi masalah jika sel yang mengalami hipoksia belum memiliki kemampuan untuk membentuk senyawa ataupun reaksi kimia yang bersifat anti-oksidan
seperti sel yang masih prematur.21,22
Kadar GSH dan aktivitas enzim katalase rata-rata perkelompok perlakuan pada hipoksia 14 hari menunjukkan penurunan dibandingkan hipoksia 3 hari. Hal ini berbanding
terbalik dengan kadar MDA rata-rata perkelompok pada hari yang sama. Kondisi ini dapat menunjukkan bahwa ke-mungkinan telah terjadi penurunan kemampuan sel dalam mengatasi peningkatan ROS. Hal ini dapat diakibatkan oleh telah terjadinya berbagai kerusakan-kerusakan makromolekul akibat ROS seperti kerusakan membran ataupun protein lainnya yang dapat mengakibatkan peningkatan kebocoran radikal oksigen di mitokondria, gangguan pompa elektron dan gangguan fungsi enzim.
Salah satu kelemahan penelitian ini adalah tidak di-lakukannya pemisahan jaringan ginjal korteks dan medula. Pemisahan jaringan ginjal ini akan memberikan gambaran lebih spesifik pengaruh hipoksia karena adanya perbedaan fungsi dan metabolisme fisiologis antara kedua bagian tersebut.
Penelitian ini juga merupakan salah satu penelitian awal dari kelompok penelitian hipoksia berkelanjutan pada hewan coba yang sedang dilaksanakan di Departemen Biokimia dan Biologi Molekuler, Fakultas Kedokteran Universitas Indone-sia. Pemeriksaan kadar MDA, GSH dan aktivitas katalase merupakan suatu bagian kecil dari kondisi hipoksia sehingga masih dapat dikembangkan dengan pemeriksaan kondisi dan varibel lainnya yang berhubungan dengan hipoksia baik di organ ginjal maupun organ lainnya.
Kesimpulan dan Saran
Pada penelitian ini dapat disimpulkan bahwa pem-bentukan radikal oksigen di ginjal akibat hipoksia berkelanjutan selama 3 dan 14 hari masih dapat dikompensasi oleh peningkatan anti oksidan intraseluler seperti GSH dan enzim katalase. Pada ginjal, kondisi ini dapat disebabkan karena perbedaan kebutuhan oksigen pada metabolisme sel-selnya ataupun karena kemampuan adaptasi terhadap kondisi hipoksia berkelanjutan.
Hasil penelitian ini diharapkan dapat memberikan kontribusi terhadap penelitian hipoksia pada organ ginjal maupun organ lainnya di Bagian Biokimia dan Biologi Molekuler, Fakultas Kedokteran Universitas Indonesia ataupun di tempat lain. Bersama-sama dengan penelitian lainnya, hasil penelitian ini diharapkan dapat dikembangkan dan ditelaah secara komprehensif di masa yang akan datang. Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada dr. Indriati Pramodo, MS dan Prof. Mohamad Sadikin, yang telah memberikan bimbingan selama penelitian. Juga terima kasih kepada dr. Ani Retno Prijanti, MS dan.dr. Septelia Inawati W, Dr.rer.physiol. yang telah memberikan kesempatan dan bantuan pada peneliti untuk ikut menggunakan jaringan ginjal dari penelitian mereka, kepada Departemen Biokimia dan Biologi Molekuler Fakultas Kedokteran Universitas Indone-sia yang telah memberikan kemudahan dan fasilitas, dan semua pihak yang telah membantu selama penelitian ini.
Daftar Pustaka
1. Taylor CT, Pouyssegur JP. Oxygen, Hypoxia, and Stress. Ann NY Acad Sci 2007;1113:87-94.
2. Mayes PA. Glicolysis and piruvat oxidation In: Murray RK, Granner DKM, P.A., Rodwell VW, editors. Harper’s Biochemis-try. 26 ed. New York: McGraw-Hills; 2003.p.136-42.
3. Guzy RD, Schumacker PT. Oxygen sensing by mitochondria at complex III: the paradox of increased reactive oxygen species during hypoxia. Exp Physiol. 2006;91:807-19.
4. Halliwell B, Gutteridge JMC. Free radicals in biology and medi-cine. 3 ed. Oxford: Oxford University; 1999.
5. Weinberg JM. The cell biology of ischemic renal injury. Kidney Int. 1991;39:476-500.
6. Jones RD, Hancock JT, Morice AH. NADPH oxidase: a universal oxygen sensor? Free Radic Biol Med. 2000;29:416-24. 7. O’Connor PM. Renal oxygen delivery:matching delivery to
metabolic demand. Clinical and Experimental Pharmacology and Physiology. 2006;33:961-7.
8. Brenner BM, Zatz R, Ichikawa L. The renal circulations. In: Brenner BM, Rector FC, editors. The kidney. 3 ed. Philadelphia: W. B. Saunders Company; 1986. p. 93-123.
9. Navar LG, Carmines PK, Paul RV. Renal circulation. In: Massry SG, Glassock RJ, editors. Textbook of nephrology. 2 ed. Balti-more: Williams & Wilkins; 1989.p.43-147.
10. Epstein FE, Agmon Y, Brezis M. Physiology of renal hypoxia: Molecular, cellular, and developmental biology of erythropoi-etin and erythropoiesis. Annals of the New York Academy of Sciences 1994;718:72-82.
11. Nangaku M. Chronic hypoxia and tubulointerstitial injury: a fi-nal common pathway to end-stage refi-nal failure. J Am Soc Nephrol. 2006 Jan;17(1):17-25.
12. Srigondo B. Jumlah ulangan dalam percobaan, dalam rancangan percobaan. Semarang: Universitas Diponegoro; 1981. 13. Wills ED. Evaluation of lipid peroxidation in lipids and
biologi-cal membranes. In: Snell K, Mullock B, editors. Biochemical toxicology: A practical approach. Oxford: IRL; 1987.p.127-52. 14. Elmann GI. Tissue sulfhydryl groups. Arch Biochem Biophys.
1959;82:70-7.
15. Aebi H. Catalase. In: Bergmeyer, editor. Methods of enzymatic analysis. New York: Verlag Chemie; 1974.p.673-84.
16. Yokozawa T, Liu ZW, Dong E. A study of ginsenoside-Rd in renal ischemia-reperfusion model. Nephron. 1998;78:201-6. 17. Kerr ME, Bender CM, Monti EJ. An introduction to oxygen free
radicals. Heart Lung. 1996 May-Jun;25(3):200-9; quiz 10-1. 18. Storey KB, Storey JM. Oxygen limitation and metabolic rate
depression. In: Storey KB, editor. Functional metabolism: Regu-lation and adaptation. New Jersey: John-Wiley & Sons; 2004.p.415-42.
19. Hermes-Lima M. Oxygen in biology and biochemistry: Role of free radical. In: Storey KB, editor. Functional metabolism: Regu-lation and adaptation. New Jersey: John Wiley & Sons; 2004.p.319-84.
20. Chen CF, Tsai SY, Ma MC, Wu MS. Hypoxic preconditioning enhances renal superoxide dismutase levels in rats. J Physiol. 2003;552:561-9.
21. Baker JE. Oxidative stress and adaptation of the infant heart to hypoxia and ischemia. Antioxid Redox Signal. 2004 Apr;6(2):423-9.
22. Blomgren K, Hagberg H. Free radicals, mitochondria, and hy-poxia-ischemia in the developing brain. Free Radic Biol Med. 2006 Feb 1;40(3):388-97.