I.
I. JUDUL PERCOBAANJUDUL PERCOBAAN : VOLTAMETRI: VOLTAMETRI II.
II. TUJUAN PERCOBAANTUJUAN PERCOBAAN :: 1.
1. Membuat elektroda Cu untuk analisis K Membuat elektroda Cu untuk analisis K 44Fe(CN)Fe(CN)6.6. 2.
2. Membuat elektroda amalgam CuMembuat elektroda amalgam Cu--Hg untuk analisis K Hg untuk analisis K 44Fe(CN)Fe(CN)6.6. 3.
3. Membuat elektroda pasta karbon untuk analisis K Membuat elektroda pasta karbon untuk analisis K 44Fe(CN)Fe(CN)6.6. III.
III.DASAR TEORIDASAR TEORI
Voltametri merupakan metode analisis menggunakan teknik potensial terkontrol yaitu Voltametri merupakan metode analisis menggunakan teknik potensial terkontrol yaitu pengukuran
pengukuran respon respon dari dari analit analit dengan dengan pemberian pemberian potensial potensial pada pada elektroda. elektroda. Respon Respon arus arus yangyang dihasilkan berasal dari transfer elektron selama proses redoks dari analit. Reaksi yang terjadi dihasilkan berasal dari transfer elektron selama proses redoks dari analit. Reaksi yang terjadi adalah:
adalah:
Oks + ne
Oks + ne--
⇌⇌
redreddimana Oks dan Red merupakan bentuk analit dalam keadaan oksidasi dan reduksi, dan n dimana Oks dan Red merupakan bentuk analit dalam keadaan oksidasi dan reduksi, dan n menunjukkan jumlah elektron yang terlibat. Secara termodinamika potensial elektroda dapat menunjukkan jumlah elektron yang terlibat. Secara termodinamika potensial elektroda dapat digunakan untuk menentukan jenis (analisis kualitatif) dan jumlah (analisis kuantitatif) reaksi digunakan untuk menentukan jenis (analisis kualitatif) dan jumlah (analisis kuantitatif) reaksi yang terjadi berdasarkan persamaan Nerst, sebagai berikut:
yang terjadi berdasarkan persamaan Nerst, sebagai berikut:
= ° +
= ° + 2,303
2,303
dimana Edimana Eoo adalah potensial standar reaksi redoks yang terjadi, R adalah tetapan gas mutlak, Tadalah potensial standar reaksi redoks yang terjadi, R adalah tetapan gas mutlak, T adalah temperatur (K), dan F adalah bilangan Faraday. Arus yang dihasilkan dari reaksi redoks adalah temperatur (K), dan F adalah bilangan Faraday. Arus yang dihasilkan dari reaksi redoks tersebut dinamakan arus Faraday, karena mengikuti hukum Faraday (1 mol bahan memberikan n tersebut dinamakan arus Faraday, karena mengikuti hukum Faraday (1 mol bahan memberikan n x 96478 Coloumb listrik). Hasil plot arus Faraday
x 96478 Coloumb listrik). Hasil plot arus Faraday versusversus potensial dinamakan voltamogram. potensial dinamakan voltamogram. Sel
Sel VVoltametrioltametri
Sel voltametri terdiri dari elektroda kerja, elektroda pembantu, dan elektroda pembanding Sel voltametri terdiri dari elektroda kerja, elektroda pembantu, dan elektroda pembanding dimana ketiganya tercelup dalam sel voltametri yang berisi larutan sampel seperti ditunjukkan dimana ketiganya tercelup dalam sel voltametri yang berisi larutan sampel seperti ditunjukkan pada Gambar 1.
Potensial luar (V), diberikan antara elektroda kerja dan elektroda pembanding. Bila ada reaksi oksidasi maupun reduksi pada elektroda kerja, arus yang dihasilkan dilewatkan ke elektroda pembantu, sehingga reaksi yang terjadi pada elektroda pembantu akan berlawanan dengan reaksi yang terjadi pada elektroda kerja. Untuk mengukur arus yang timbul digunakan amperemeter (A). Antara elektroda kerja dan elektroda pembanding diberikan tahanan (R) yang cukup tinggi agar arus tidak melewati elektroda kerja dan elektroda pembanding, karena bila terjadi reaksi pada elektroda pembanding, potensial elektroda pembanding akan berubah /elektroda rusak.
1. Elektroda Kerja (Working Electrode/WE )
Elektroda kerja adalah tempat terjadinya reaksi redoks. Kualitas elektroda kerja tergantung pada dua faktor yaitu reaksi redoks dari analit dan arus latar pada rentang potensial yang dibutuhkan dalam pengukuran. Elektroda kerja harus memiliki syarat-syarat seperti memiliki respon arus yang reprodusibel, rentang potensial yang lebar, konduktivitas listrik yang baik, dan permukaan elektroda yang reprodusibel. Elektroda yang sering digunakan adalah sebagai berikut:
a) Elektroda Merkuri
Merkuri dipilih sebagai bahan pembuat elektroda sebab merkuri memiliki overpotensial aktivasi yang tinggi untuk evolusi hidrogen, rentang potensial katoda yang lebar (dibandingkan elektroda padat), reprodusibilitas yang tinggi, dan permukaan yang dapat diperbaharui secara kontinyu. Kekurangan elektroda ini yaitu rentang potensial anoda yang terbatas (merkuri teroksidasi) dan bersifat toksik.
b) Elektroda Padatan
Elektroda padat memiliki rentang potensial yang lebih besar dibanding elektroda merkuri. Contoh elektroda padat yaitu karbon, platina dan emas. Elektroda perak, nikel dan tembaga digunakan untuk aplikasi spesifik. Faktor penting dari elektroda padat yaitu respon arus yang sangat tergantung pada permukaan elektroda sehingga permukaan elektroda perlu mendapat perlakuan khusus sebelum digunakan untuk mendapatkan reprodusibilitas yang baik. Perlakuan yang dilakukan tergantung pada bahan elektroda yang digunakan. Elektroda padat cenderung memiliki permukaan yang heterogen dan kasar yang berpengaruh pada aktivitas elektrokimia.
c) Elektroda Termodifikasi Kimia
Elektroda termodifikasi kimia adalah elektroda yang dimodifikasi permukaannya secara kimia, sehingga sifat elektroda tersebut berbeda. Beberapa tujuan dari elektroda ini adalah untuk mempercepat transfer elektron, prekonsentrasi dan selekivitas terhadap analit.
2. Elektroda Pembanding ( Refference Electrode/RE )
Elektroda pembanding merupakan elektroda dengan harga potensial setengah sel yang diketahui, konstan dan tidak bereaksi terhadap komposisi larutan yang sedang diselidiki. Elektroda pembanding memberikan potensial elektroda kerja yang dibandingkan. Elektroda pembanding memberikan potensial yang stabil terhadap elektroda kerja yang dibandingkan. Elektroda pembanding yang biasa digunakan adalah elektroda kalomel dan elektroda perak/perak klorida.
a) Elektroda Kalomel (SCE)
Setengah sel elektroda kalomel dapat ditunjukkan sebagai berikut: || Hg2Cl2 (sat’d), KCl (xM) | Hg
Dimana x menunjukkan konsentrasi KCl di dalam larutan. Reaksi elektroda dapat dituliskan sebagai berikut:
-Potensial sel ini bergantung pada konsentrasi klorida (x), dan harga konsentrasi ini harus dituliskan untuk menjelaskan elektroda. Harga potensial SCE adalah 0,244 V pada 25o C dibandingkan terhadap elektroda hidrogen standar.
(b) Elektroda Perak/Perak Klorida
Setengah sel elektroda perak dapat dituliskan:
|| AgCl (sat’d), KCl (xM) | Ag
Reaksi setengah selnya adalah:
AgCl(s)+ e-
⇌
Ag (s)+ Cl-Biasanya elektroda ini terbuat dari larutan jenuh atau 3,5 M KCl yang harga potensialnya adalah 0,199 V (jenuh) dan 0,205 V (3,5 M) pada 25 oC. Elektroda ini dapat digunakan pada suhu yang lebih tinggi sedangkan elektroda kalomel tidak dapat digunakan
(Hendayana, dkk, 1994).
3. Elektroda Pembantu (Counter Electrode)
Elektroda pembantu dikendalikan oleh potensiostat untuk kesetimbangan arus difusi pada elektroda kerja dengan transfer elektron ke arah sebaliknya. Jika terjadi reduksi pada elektroda kerja maka oksidasi terjadi pada elektroda pembantu. Elektroda pembantu yang digunakan harus bersifat inert seperti kawat platina atau batang karbon yang berfungsi sebagai pembawa arus (Wang, 1994).
Elektroda Pasta Karbon
Elektroda pasta karbon merupakan campuran bubuk grafit dan perekat organik parafin sebagai pengisinya. Berikut merupakan gambar dari elektroda pasta karbon. Elektroda pasta karbon biasanya dibuat dari sejumlah komposisi tertentu bahan kimia yang dicampurkan hingga menjadi cairan pasta. Cairan pasta biasanya memiliki kemampuan ekstraksi yang baik terhadap ion yang terdiri dari spesi lifofilik. Jika dibandingkan dengan elektroda selektif ion yang terbuat dari membran polimer, elektroda pasta karbon memiliki kelebihan diantaranya arus latar belakang yang rendah dan waktu respon yang cepat.
Gambar 2. Elektroda Pasta Karbon
Komposisi pasta sangat berpengaruh terhadap kereaktifan elektroda dan dengan memningkatnya komposisi cairan pasta, dapat mengurangi laju transfer elektron. Telah terbukti bahwa elektroda pasta karbon mampu memberi hasil sebaik elektroda karbon gelas. Selain itu,
elektroda ini mudah dan murah dalam pembuatannya dan tidak adanya resiko dari kerusakan mekanis pada material elektroda akan sangat menguntungkan untuk digunakan dalam analisis.
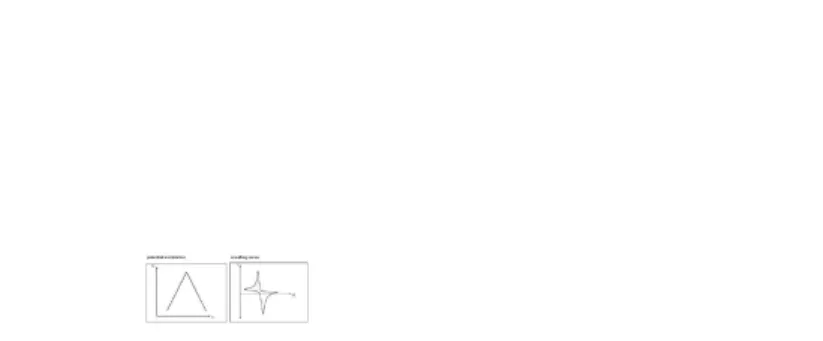
Voltametri Pelucutan ( Stripping Voltammetry)
Analisis voltametri pelucutan merupakan teknik yang sensitif dalam penentuan logam karena adanya proses prekonsentrasi yang dapat menurunkan limit deteksi. Sekitar 4-5 logam dapat ditentukan secara simultan pada beberapa matrik pada konsentrasi hingga 10-10 M dengan menggunakan alat yang relatif murah. Limit deteksi dapat diturunkan karena keberadaan kontaminan dapat diminimalkan. Stripping analysis terdiri dari dua tahap, yaitu deposisi analit pada permukaan elektroda (prekonsentrasi) dan stripping , yaitu pelepasan deposit. Beberapa jenis stripping analysis yaitu:
1. Voltametri Pelucutan Anoda ( Anodic Stripping Voltammetry)
Voltametri pelucutan anoda merupakan metode voltametri pelucutan dengan pemberian potensial awal yang lebih negatif dibanding po tensial reduksi setengah sel larutan analitnya (reduksi analit) kemudian dilucutkan ke potensial yang lebih positif (oksidasi analit). Metode ini efektif digunakan untuk logam yang dapat larut dalam merkuri
membentuk amalgam. Elektroda yang digunakan adalah elektroda tetes air raksa menggantung (HMDE) dan elektroda film-tipis air raksa. Elektroda padat seperti glassy carbon digunakan untuk menganalisa ion-ion logam yang sangat elektropositif seperti Hg(II), Au(III), Ag(I), dan Pt.
Sebagai contoh penentuan logam dengan menggunakan elektroda merkuri. Tahap pertama yaitu deposisi analit dengan pemberian potensial deposisi dimana dipilih potensial yang lebih negatif dari potensial setengah gelombang dari ion atau ion-ion yang akan dianalisis. Selama tahap deposisi umumnya dilakukan pengadukan untuk memaksimalkan kontak antara analit dan elektroda.
Mn+ + ne- + Hg M(Hg)
Untuk analisis yang lebih sensitif maka waktu deposisi ditambah. Setelah tahap deposisi berakhir dibutuhkan waktu sebentar (30-60 detik) untuk kesetimbangan. Pada tahap ini potensial deposisi tetap dipertahankan tetapi pengadukan dihentikan. Hal ini dilakukan untuk meminimalkan arus konveksi dari pengadukan dan membuat amalgam stabil.
Tahap kedua yaitu scan potensial ( stripping ) dan tidak ada lagi pengadukan. Pada tahap ini potensial di scan kearah positif sehingga amalgam (M(Hg)) dioksidasi dan arus yang mengalir diukur. Potensial karakteristik dari ion yang diendapkan akan muncul sebagai puncak arus sebanding dengan analit.
M(Hg)Mn+ + ne-+ Hg
Mekanisme kedua tahapanodic stripping voltammetryditunjukkan pada Gambar 3.
2. Voltametri Pelucutan Katoda (Chatodic Stripping Voltammetry)
Voltametri pelucutan katoda digunakan untuk menganalisis senyawa organik dan anorganik yang tidak dapat membentuk garam dengan merkuri. Prosedur dari metode ini secara garis besar sama dengan langkah-langkah dalam voltametri pelucutan anoda.
Tahap pertama yaitu deposisi analit secara oksidasi dengan pemberian potensial deposisi dimana dipilih potensial yang lebih positif dari potensial setengah gelombang dari ion atau ion-ion yang akan dianalisis.
An- + HgHgA + ne
-Tahap kedua yaitu pelucutan ( stripping ). Pada tahap ini potensial di scan ke arah negatif sehingga HgA direduksi dan arus yang mengalir diukur.
HgA + ne-An-+ Hg
Beberapa anion yang telah dapat ditentukan dengan menggunakan metode ini diantaranya adalah arsenat, klorida, bromida, iodin, kromat, tungstat, molibdat, vanadat, sulfat, oksalat, suksinat, selenat, sulfida, merkaptan, tiosianat dan senyawa-senyawa tio (Skoog, et al., 1998; Wang, 1994).
3. Voltametri Pelucutan Adsorpsi ( Adsorptive Stripping Voltammetry)
Metode ini adalah bagian dari voltametri pelucutan yang merupakan teknik baru dan terdiri dari 4 langkah yaitu pembentukan kompleks antara logam dengan ligan, adsorpsi kompleks pada permukaan elektroda, reduksi logam atau kompleks, dan pengukuran arus dengan scan potensial secara anoda atau katoda. Tujuan dari teknik ini adalah untuk membuat analisis lebih selektif dan menurunkan limit deteksi.
Selektivitas dapat ditingkatkan dengan memilih ligan maupun larutan elektrolit, semakin selektif ligan yang digunakan selektivitas akan semakin baik. Limit deteksi diturunkan dengan meningkatnya konsentrasi analit yang teradsorp pada permukaan elektroda.
Voltametri pelucutan adsorpsi terutama digunakan untuk analisis logam runut. Beberapa logam telah ditentukan dengan metode ini mempunyai limit deteksi yang sangat rendah (10-10–10-11 M). Seluruh prosedur difokuskan pada pemilihan ligan. Selain itu
metode ini sangat cocok digunakan untuk penentuan senyawa organik (seperti obat anti kanker, vitamin dan pestisida) yang menunjukan sifat aktif permukaan. Skema scan
potensial ditunjukkan pada Gambar 4.
Gambar 4.Scan Potensial Teknik Voltametri Pelucutan Adsorpsi
Voltametri Siklis (Cyclic Voltammetry)
Voltametri siklis adalah teknik yang digunakan untuk memperoleh informasi kualitatif tentang reaksi elektrokimia. Voltametri siklis merupakan suatu metode pengukuran elektrokimia potensiodinamik Bentuk gelombang potensial yang digunakan pada analisis elektrokimia
merupakan bentuk gelombang linear, yaitu potensial yang secara kontinyu diubah sebagi fungsi linear terhadap waktu. Hasil pengukuran voltametri siklis dapat digunakan untuk menentukan sifat termodinamika proses redoks, sifat kinetik reaksi transfer elektron dan reaksi adsorpsi. Scan
potensial dan kurva yang dihasilkan pada voltametri siklis ditunjukkan pada Gambar 5.
Gambar 5.ScanPotensial Teknik Voltametri Siklik
Voltametri Pulsa Normal
Voltametri pulsa normal (VPN) terdiri dari rangkaian pulsa yang berasal dari peningkatan amplitudo yang diberikan pada setiap akhir waktu hidup pulsa pada setiap selang waktu tertentu. Cara pemberian pulsa dapat dilihat pada gambar 6. Diantara setiappulsa, potensial elektroda dijaga tetap pada potensial dasar (Ein) agar tidak terjadi reaksi pada analit. Amplitudo pulsa
meningkat secara linear. Arus diukur beberapa saat sebelum pulsa hilang. Waktu pemberian pulsa yang singkat menyebabkan lapis difusi lebih tipis daripada teknik polarografi sehingga arus Faraday, arus yang timbul karena transfer elektron, meningkat. Voltamogram yang dihasilkan dari pengukuran dengan teknik ini berbentuk sigmoidal dengan besarnya arus batas (iL)
dinyatakan lewat persamaan:
=
√
/
Dengan tm merupakan waktu setelah pemberian pulsa pada saat arus diukur dan D adalah
koefisien difusi.
Gambar 6. Cara pemberian pulsa pada teknik VPN
Arus yang dihasilkan pada teknik ini lima hingga sepuluh kali lebih besar dari arus yang dihaslkan oleh teknik polarografi DC.
Voltametri Pulsa Diferensial
Pada teknik voltametri pulsa diferensial (VPD), pulsa diberikan pada elektroda kerja seperti yang ditunjukkan pada gambar 7. Potensial yang diberikan naik secara linear. Arus diukur dua kali, yaitu sebelum pulsa diberikan dan sesaat sebelum pulsa hilang. Oleh instrumen pengukur, arus pertama secara otomatis dikurangkan terhadap arus kedua. Selisih dari kedua arus yang diukur
(∆i = i(t2)-i(t1)) dialurkan terhadap potensial yang diberikan. Voltamogram yang didapat
memberikan gambaran tentang arus puncak. Besarnya arus puncak (i p) sebanding dengan
=
√
/
[1 −
1 + ]
dengan
=
(
∆
)
, yang besarnya antara 0-1. VPD mampu mengukur hingga tingkatkonsentrasi 10-8 M (sekitar 1μgL-1). Teknik ini banyak digunakan untuk analisis senyawa
-senyawa organik dan anorganik pada skala renik. Pemilihan amplitudo pulsa dan kecepatan laju selurus potensial dapat membantu meningkatkan kepekaan, resolusi, dan kecepatan pengukuran.
Gambar 7. Cara pemberian pulsa pada teknik VPD, 1 dan 2 : saat pengukuran arus
Voltametri Gelombang Persegi
Pada teknik voltametri gelombang persegi (VGP), pulsadiberikan pada elektroda kerja dengan bentuk gelombang persegi simetris pada potensial dasar yang menyerupai anak tangga (gambar 8). Arus diukur dua kali setiap satu siklus gelombang persegi, yaitu pada akhir pulsa maju dan pada akhir pulsa balik. Amplitudo modulasi gelombang persegi pada teknik ini sangat besar sehingga saat pulsa balik dapat terjadi reaksi produk kembali menjadi analit.
Voltamogram hasil pengukuran arus terhadap potensial dapat dilihat pada gambar 9. Puncak yang didapat cukup tajam dan simetris di sekitar potensial tengah gelombangnya dan besarnya arus puncak sebanding dengan besarnya konsentrasi analit di dalam larutan.
Tingginya nilai arus bersih dibandingkan dengan arus maju maupun arus balik menunjukkan sensitivitas yang tinggi dari teknik ini. Sensitivitasnya bahkan lebih tinggi dari teknik VPD. Arus yang dihasilkan dari teknik VGP, untuk proses reaksi yang reversibel maupun ireversibel dapat mencapai tiga sampai empat kali lebih besar dibandingkan arus dari teknik VPD.
Kelebihan dari teknik ini adalah kecepatannya. Laju selusur efektif didapat dari f.∆Es,dengan f menyatakan frekuensi gelombang persegi (Hz) dan ∆Es menyatakan tinggi
kenaikan pulsa. Tingginya laju selusur dapat mengurangi waktu analisis karena voltamogram lengkap didapat hanya dalam hitungan detik.
Gambar 9. Voltamogram teknik VGP; kurva A: arus puncak proses ke araah hasil reaksi, kurva B: arus untuk proses kea rah pereaksi, dan kurva C: arus bersih
IV.ALAT DAN BAHAN - Alat Voltametri - Kain bludru - Amplas - Labu ukur 100 ml - Pipet volume - Pipet tetes - Larutan K 4Fe(CN)6 10 ppm - Kawat tembaga - Larutan Hg - Pasta Karbon - Aquades V. CARA KERJA Pembuatan Elektroda : Kawat berdiameter 1,2 mm panjang 15 mm 1 Disiapkan 3 bagian 3 2
Elektroda Cu Elektroda Cu/Hg Elektroda pasta karbon
- Diamplas - Diasah dengan kain bludru - Dicuci dengan aquades - Diamplas - Diasah dengan kain bludru - Dicuci dengan aquades - Dikeringkan - Dicelupkan kedalam larutan Hg - Diamplas - Diasah dengan kain bludru - Dicuci dengan aquades - Dikeringkan - Dicelupkan kedalam pasta karbon
Pengenceran Larutan :
Pengukuran Voltametri :
Larutan induk K4Fe(CN)610 ppm
Larutan K4Fe(CN)65 ppm
- Diambil 50 mL dan dimasukkan dalam labu ukur 100mL - Ditambahkan aquades hingga batas miniskus
- Dicampur hingga merata, diambil 20 mL
Larutan K
4Fe(CN)6 2,5ppm
- Diambil 50 mL dan dimasukkan dalam labu ukur 100mL
- Ditambahkan aquades hingga batas miniskus
- Dicampur hingga merata, diambil 20 mL
Larutan K 4Fe(CN)6 0,5ppm Larutan K
4Fe(CN)6 1 ppm
- Diambil 40 mL dan dimasukkan dalam labu ukur 100mL
- Ditambahkan aquades hingga batas miniskus
- Dicampur hingga merata, diambil 20 mL
- Diambil 50 mL dan dimasukkan dalam labu ukur 100mL
- Ditambahkan aquades hingga batas miniskus
- Dicampur hingga merata, diambil 20 mL
20 mL laruta K 4Fe(CN)6 0,5 ppm
Voltamogram
-
Dimasukkan kedalam tempat larutan analit di voltemeter-
Elektroda Cu dipasangkan-
Dilakukan analisis dengan voltameter-
Analisis dilanjutkan dengan konsentrasi larutan yang lebih tinggi secara berurutan (1 ppm ; 2,5 ppm ; 5 ppm ; 10 ppm)-
Dilakukan pula prosedur diatas dengan menggunakan elektrodaVI.HASIL PENGAMATAN
Prosedur Pengamatan Dugaan / reaksi Kesimpulan
Diameter kabel : 1,2 mm Setelah digosok dengan kain bludru menjadi lebi halus. 1. Elektroda Cu : kekuningan 2. Elektroda Cu/Hg : abu-abu 3. Elektroda pasta karbon : hitam
Larutan K 4Fe(CN)6: kuning jernih. Semakin encer warna larutan semakin pudar atau semakin kuning muda. Didapatkan grafik Voltamogram yang berbeda - beda tiap konsentrasi larutan dan tiap elektroda yang berbeda (data
VII. ANALISIS DAN PEMBAHASAN
VIII. KESIMPULAN
Berdasarkan pada percobaan yang telah dilakukan dapat disimpulkan bahwa :
IX.DAFTAR PUSTAKA
Apriliani, Rini. 2009. Studi Penggunaan Kurkumin Sebagai Modifier Elektroda Pasta Karbon untuk Analisis Timbal (Ii) Secara Stripping Voltammetry.
http://eprints.uns.ac.id /350/1/162292608201007091.pdf, diakses pada 1 Juni 2013. Muhammad. 2007. Tinjauan Pustaka Voltametri. http://digilib.itb.ac.id/files/disk1
/549/jbptitbpp-gdl-muhammadlu-27423-3-2007ta-2.pdf, diakses pada 1 Juni 2013. Rokhmat. 2007. Tinjauan Pustaka Voltametri. http://digilib.itb.ac.id/files/disk1/549
LAMPIRAN
Larutan Hg Pasta karbon
Elektroda dan larutan K4Fe(CN)6 berbagai konsentrasi yang akan dianalisis
Serangkaian alat Voltameter
Contoh voltamogram yang diperoleh dari analisis