BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
Sintesis dan aplikasi material semikonduktor hibrid, suatu bahan semikonduktor yang didoping dengan senyawa kompleks atau ligan organik, sedang populer dikerjakan dengan tujuan untuk memperoleh sifat material baru yang diinginkan. Penggunaan bahan material semikonduktor pada saat sekarang antara lain sebagai permukaan fotokatalis, sel surya, electroluminescense display dan material sensor. Longo dan Paoli (2003) telah melakukan sensitisasi TiO2
dengan senyawa dye, kompleks cis-Ru(dcb)2(NCS)2,
(dcb=2,2-bipyridine-4,4-dicarboxylic acid) untuk keperluan sel surya. de Dood, et al. (2002) telah melakukan Sintesis material luminescence dengan cara mendopingkan logam tanah jarang Er3+, Eu3+, dan Tb3+ pada sistem koloidal SiO2. Identifikasi spektrum
photoluminescense diperoleh lifetime 13,2 ms sehingga sangat prospektif sebagai electroluminescense display. Sayo, et al. (1999) telah melakukan pembuatan katalis Au yang diembankan pada material TiO2 untuk katalis oksidasi CO
menjadi CO2.
1. TiO2
Beberapa semikonduktor oksida mempunyai pita energi yang berada pada daerah energi cahaya UV-Vis, termasuk TiO2, WO3, SrTiO3, ZnO, dan Fe2O3.
Tetapi diantara semikonduktor-semikonduktor tersebut TiO2 telah terbukti paling
baik untuk mengatasi masalah lingkungan dan aman untuk lingkungan. Fotokatalisis menggunakan TiO2 telah dilakukan untuk memecahkan pelbagai
masalah lingkungan antara lain untuk pemurnian air dan udara, destruksi bakteri, degradasi zat warna dan senyawa kimia beracun, serta pembuatan gas hidrogen dari air. TiO2 secara biologi dan kimia bersifat inert, tidak mahal, dan cukup stabil
atau sedikit mengalami fotokorosi. TiO2 merupakan semikonduktor yang paling
stabil, tetapi sifat yang kurang menguntungkan adalah pita energi yang lebar yang hanya aktif dalam daerah cahaya ultraviolet, di mana cahaya ultraviolet tersebut hanya 10 % dari seluruh cahaya matahari (Linsebigler, et al., 1995).
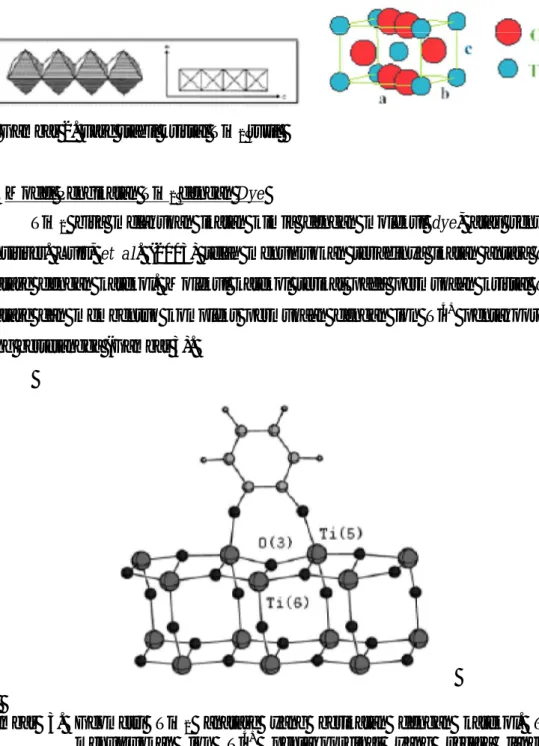
Titanium (IV) Oksida (II) mempunyai satu fase yang stabil, rutil (tetragonal) dan dua fase metastabil polimorf, brukit (orthorhombic) dan anatase (tetragonal). Kedua fase metastabil menjadi rutil (stabil) ketika memaparkan material pada temperature diatas 700ºC (dalam keadaan murni, dan tidak ada zat aditif yang ditambahkan).
a. TiO2 dalam Fase Metastabil Anatase
Polimorf TiO2 anatase adalah salah satu dari dua fase metastabil bersama
dengan fase brukit. Untuk proses kalsinasi diatas 700ºC semua struktur anatase berubah menjadi rutil. Struktur anatase adalah tetragonal, dengan dua unit formula TiO2 (enam atom) per sel. Atom logam (kation Ti4+) berada pada posisi 4(b):
(0, ¼, 3/8) dalam unit sel. Sementara atom oksigen (anion O2-) pada posisi 8(c): (0, ¼, z), dimana parameter internal z, berharga 0,1656 (Cobos, 2001).
Gambar 1. Fase metastabil kristal TiO2 anatase.
b. TiO2 dalam Fase Stabil Rutil
Gambar 2. Fase stabil kristal TiO2 rutil
c. Model Pengikatan TiO2 dengan Dye
TiO2 bisa melakukan ikatan kimia dengan molekul dye, atau senyawa
sensitiser. Luis, et al. (2003) telah menunjukkan terjadinya ikatan antara TiO2
anatase dengan katekol. Molekul katekol terikat pada permukaan kristal TiO2
anatase dan membentuk kompleks permukaan dengan ion Ti4+ pentakoordinat yang bertetangga (Gambar 3).
Gambar 3. Geometri TiO2 anatase yang berikatan dengan katekol. Ti(5)
menunjukkan ion Ti4+ pentakoordinat yang secara langsung mengikat katekol. Ti(6) menunjukkan ion Ti4+ heksakoordinat yang berdekatan dengan katekol.
Ikatan antara dye dan TiO2 anatase bisa juga terjadi pada atom oksigen
gugus hidroksil. Longo dan Paoli (2003), menyatakan bahwa gugus karboksilat pada ligan bpy senyawa dye bereaksi spontan dengan gugus hidroksil permukaan pada permukaan TiO2 membentuk senyawa ester, sehingga terjadi ikatan yang
2. Senyawa Dye sebagai Sensitiser TiO2
Penggunaan dye adalah satu usaha untuk meningkatkan kisaran respon panjang gelombang Vis dari bahan semikonduktor. Peranan senyawa kompleks sebagai dye pada material semikonduktor adalah mempengaruhi/merubah pita energi TiO2. Perubahan mekanisme perpindahan elektron yang terjadi dengan
penambahan dye adalah induksi elektron berasal dari ligan pada proses MLCT dye. Selanjutnya elektron tereksitasi dan lubang (hole) yang terbentuk pada pita valensi dapat mengalami beberapa alternatif mekanisme, misalnya elektron terksitasi tersebut dapat didonorkan untuk mereduksi suatu akseptor, atau dapat didonorkan ke sebuah lubang (hole). Pendistribusian hole maupun elektron pada bahan semikonduktor merupakan fungsi energi. Gambar 1 menunjukkan mekanisme perpindahan elektron yang berasal dari suatu senyawa kompleks [M]. [M]* menggambarkan tingkat energi orbital π* atau σ* dari ligan L pada senyawa kompleks [M]. MLCT menyebabkan perpindahan elektron dari orbital non bonding logam M (orbital t2g pada struktur oktahedral) ke orbital non bonding
ligan L. CB [M] VB [M] hv [M]*
Gambar 4. Skema fotosensitisasi partikel semikonduktor dengan dye senyawa kompleks [M] (Dye sensitized) (CB=pita konduksi, VB=pita valensi).
Vinodgopal, et al. (1995) telah berhasil menunjukkan adanya proses injeksi muatan dari tingkat energi keadaan tereksitasi pada dye ke partikel semikonduktor dengan konstanta laju pada daerah 5,5 x 108 s-1 sampai dengan 1,0 x 108 s-1 pada bahan semikonduktor TiO2 dengan dye Ru(bpy)2-dcbpy)2+
(dcbpy=4-4’-dikarboksi-2,2’-bipiridin).
3. Sensitisasi Semikonduktor
Pengikatan dye senyawa kompleks pada material semikonduktor juga
dapat dilakukan dengan metode adsorpsi pada permukaan nanokristalin TiO2.
Lees, et al. (2001) melakukan pengikatan senyawa kompleks dengan metode adsorpsi senyawa kompleks pada lapisan tipis TiO2 dengan perendaman pada
larutan senyawa kompleks selama 3 jam untuk pengukuran voltametri siklis dan 24 jam untuk pengukuran IPCE.
Keberhasilan pembuatan material semikonduktor hibrid tampaknya sangat bergantung pada disubstitusi senyawa kompleks atau logam yang telah didispersikan pada material semikonduktor. de Dood, et al. (2002) telah menunjukan bahwa doping logam tanah jarang pada material silika dengan katalis asam-basa menghasilkan dispersi logam yang merata dalam ukuran nanometer. Sedangkan sintesis dengan katalis basa tidak berhasil oleh karena adanya fenomena agregasi yang terjadi. Fenomena agregasi dapat ditanggulangi dengan penggunaan silylating agent. Sylilating agent merupakan suatu terobosan yang sangat menjanjikan keberhasilan sintesis semikonduktor rekaan.
Proses sensitisasi TiO2 dengan dye melalui ikatan kimia menggunakan
gugus penggandeng telah dilakukan Longo dan Paoli (2003). Mereka telah
memodifikasi ligan bpy (bipiridin) pada senyawa dye, kompleks cis-Ru(dcb)2(NCS)2 (dcb=2,2-bipyridine-4,4-dicarboxylic acid), dengan gugus
karboksilat menjadi dcb (Gambar 5). Hal itu dilakukan untuk memantapkan penataan dye pada permukaan TiO2. Gugus karboksilat dapat bereaksi secara
spontan dengan gugus hidroksil permukaan pada permukaan TiO2 membentuk
senyawa ester, sehingga terjadi ikatan yang stabil antara dye dan TiO2.
Fung, et al. (2003) juga telah melakukan proses sensitisasi TiO2 dengan
dye melalui ikatan kimia menggunakan gugus penggandeng silil. Dalam penelitian mereka, permukaan TiO2 telah dimodifikasi dengan kompleks Ru(II) polipiridil
Gambar 5. Struktur kompleks cis-Ru(dcb)2(NCS)2 (Longo dan Paoli, 2003).
Fung et al. (2003) juga telah mempelajari model pengikatan gugus penggandeng pada permukaan TiO2, seperti ikatan kovalen, interaksi elektrostatik,
ikatan hidrogen, interaksi hidrofobik, dan penjebakan fisis. Kemampuan gugus karboksil, fosfonat, amino, dan silil telah didemonstrasikan terutama pada pembentukan ikatan kovalen dengan permukaan TiO2 (gambar 6).
Stabilitas ikatan ini bervariasi, dan dalam medium cair beberapa dari ikatan ini yaitu: karboksil dan fosfonat-ester, hanya stabil pada range pH tertentu. Dalam pelarut organik atau campuran pelarut organik, kekuatan ikatan-ikatan ini bahkan lebih lemah. Kecuali gugus penggandeng silil, semua ikatan kovalen konvensional mengalami tingkat dissosiasi tertentu atau penguraian kelatnya. Gugus penggandeng silil tampaknya merupakan bahan modifikasi permukaan yang ideal untuk TiO2 oleh karena afinitasnya yang tinggi terhadap gugus hidroksil pada
permukaan semikonduktor dan sifat inert dari ikatan silil, Si—O. Kajian terhadap kompleks logam dengan ligan polipiridil yang diturunkan dari gugus silil telah memperlihatkan ketahanan ikatan silil pada permukaan silika, SnO2, TiO2 dan
ITO.
4. Agen Penggandeng Silan
Agen penggandeng silan termasuk ke dalam kelas senyawa organosilan yang mempunyai sedikitnya dua gugus reaktif dengan tipe yang berbeda yang terikat pada atom silikon dalam molekul. Salah satu gugus reaktif dengan tipe yang berbeda (contoh: metoksi, etoksi, dan gugus hidroksi silanolik) reaktif dengan material anorganik seperti kaca, logam, pasir silika dan membentuk ikatan kimia dengan permukaan material anorganik sementara gugus reaktif lainnya (contoh: vinil, epoksi, metakril, amino dan gugus merkapto) reaktif dengan pelbagai material organik atau resin sintetis membentuk ikatan kimia. Dengan memiliki dua tipe gugus reaktif ini, agen penggandeng silan mampu membentuk ikatan kimia antara material organik dan material anorganik.
Sifat agen penggandeng silan yang unik ini dimanfaatkan secara luas pada perlakuan produk serat kaca, peningkatan kemampuan plastik yang diperkuat serat dengan pencampuran langsung pada resin sintetis, peningkatan kualitas cat, material adhesif dan sintetis lainnya, modifikasi sifat permukaan bahan pengisi anorganik, cat dasar permukaan pelbagai material substrat, dan sebagainya.
peningkatan kualitas yang luar biasa diperoleh terutama sifat mekanis dan kelistrikan serta efek material ketika digunakan pada kondisi basah dan lembab.
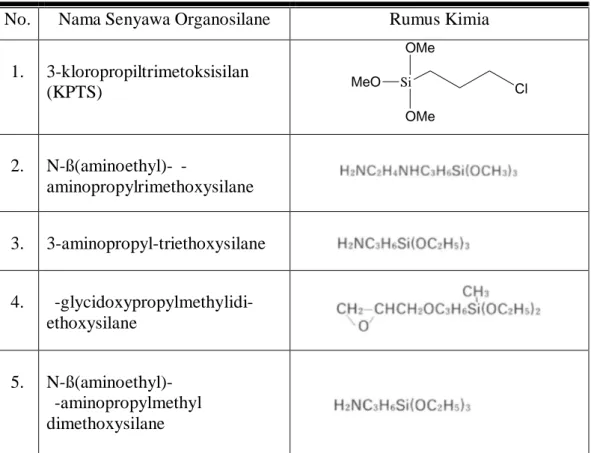
Beberapa contoh senyawa organosilan adalah N-ß(aminoethyl)-γ-aminopropyl-trimethoxysilane, 3-aminopropyl-triethoxysilane, γ-glycidoxypropyl methylidiethoxysilane, N-ß(aminoethyl)-γ-aminopropylmethyldimethoxysilane, 3-kloropropiltrimetoksisilan (KPTS).
KPTS mempunyai bentuk fisik cair dengan berat molekul 198,72 g/mol, massa jenis 1,09 g/ml dengan titik leleh 177 ºC pada tekanan 1 atm. KPTS merupakan senyawa turunan dari tetrametoksisilan (TMOS) yang sudah dikenal luas penggunaannya sebagai material awal pembentuk komposit silika. Senyawa KPTS memiliki satu gugus aktif klor yang mudah terdekomposisi sehingga memungkinkan untuk berikatan dengan senyawa lain dan tiga gugus metoksi yang sangat mudah tersubtitusi oleh gugus hidroksil jika sistem tersedia gugus hidroksil.
Tabel 1. Struktur 3-kloropropiltrimetoksisilan (KPTS) dan senyawa-senyawa organosilan yang lain (anonim).
No. Nama Senyawa Organosilane Rumus Kimia
5. Spektrum Elektronik
Absorpsi cahaya ultraviolet atau cahaya tampak mengakibatkan transisi elektronik, yaitu promosi elektron dari orbital keadaan dasar yang berenergi
rendah ke orbital keadaan transisi berenergi lebih tinggi. Transisi ini memerlukan 40-300 kkal/mol. Energi yang diserap selanjutnya terbuang sebagai kalor, sebagai
cahaya atau tersalurkan dalam reaksi kimia (misalnya isomerisasi atau reaksi-reaksi radikal bebas).
Panjang gelombang cahaya UV atau cahaya tampak bergantung pada mudahnya promosi elektron. Molekul yang memerlukan energi lebih besar untuk promosi elektron akan menyerap pada panjang gelombang yang lebih pendek sedangkan molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam daerah tampak (yakni senyawa berwarna) mempunyai elektron yang lebih mudah di promosikan daripada senyawa yang menyerap pada panjang gelombang UV yang lebih pendek.
Absorbsi radiasi oleh suatu sampel diukur pada pelbagai panjang gelombang dan dialirkan oleh suatu perekam untuk menghasilkan spektrum. Spektrum UV maupun tampak, memiliki radiasi pita absorbsi lebar pada daerah panjang gelombang yang lebar. Ini disebabkan oleh terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Karena pelbagai transisi ini berbeda energi sedikit sekali, maka panjang gelombang absorbsinya juga berbeda sedikit dan menimbulkan pita lebar yang tampak dalam spektrum.
Absorbsi energi direkam sebagai absorban pada suatu panjang gelombang tertentu didefinisikan sebagai :
A=log I Io
...(1)
dimana, A = absorbansi
Absorpsi suatu senyawa pada panjang gelombang tertentu bertambah dengan banyaknya molekul yang mengalami transisi. Oleh karena itu, absorbsi tergantung pada struktur elektronik senyawa dan juga pada kepekatan contoh dan panjangnya sel contoh. Karena itu absorbsi energi dinyatakan sebagai
absorbtivitas molar
ε
(koefisien ekstingsi molar) dan bukan sebagai absorbsi sebenarnya.ε
= cl A...(2)
dimana,
ε
= absorbtivitas molar A = absorbansic = konsentrsi dalam M
l = panjang gelombang dalam cm
(Fessenden dan Fessenden, 1995).
Unsur-unsur blok d mengabsorpsi pada daerah UV dan daerah tampak. Transisi 3d dan 4d mempunyai pita yang lebar dan umumnya terdeteksi dalam daerah tampak, puncak-puncak absorbsi dipengaruhi oleh lingkungan yang mengelilinginya. Sifat spektrum dari logam transisi meliputi transisi elektronik antara tingkat-tingkat energi yang berbeda pada orbital d. Dari teori medan kristal diketahui bahwa orbital t2g (dxy, dyz, dan dxz) dan orbital eg (dx2-y2, dz2) terpecah
sebesar ∆ dengan adanya ligan. Besarnya splitting (∆) oleh ligan dapat disusun dalam suatu deret spektrokimia berikut.
I- < Br- < Cl- < F- < OH- < Oksalat2- < H2O < SCN- < NH3 < en < NO2
< CN
e
gt
2gt
1ue
g*a
1gtransisi
(a)
(b)
(c)
transisi
transisi
Gambar 7. Diagram MO yang disederhanakan dan tipe transisi elektron yang memungkinkan untuk kompleks d1. MLCT ditunjukkan dengan anak panah (b).
Jika ligan termasuk tipe π akseptor, maka jenis transisi kedua kemungkinan bisa terjadi (dari t2g ke tingkat π*, panah (b), pada Gambar 7 diatas).
Transisi ini mengubah distribusi muatan metal-ligan, karena densitas elektron bergeser dari orbital dengan karakter logam yang tinggi ke orbital dengan karakter ligan yang tinggi. Karenanya, transisi ini merupakan pita metal-to-ligand charge transfer. Dan hal itu dperbolehkan oleh aturan seleksi orbital (∆l=1, dengan asumsi bahwa π* mempunyai asal usul tipe-p). Pita seperti itu cenderung kuat (ε=103-104 L/mol.cm), dan selalu ditemukan pada level energi yang lebih tinggi dari transisi d → d.
MLCT memiliki kegunaan besar pada teknologi standpoint, sensitiser pada dye-sensitized photovoltaic cells, sebagai pencatat luminescence pada optik sensor
gas, sensor pH, dan material fotokatalisis (Whittle, et al., 2001). Sehingga Sintesis kompleks logam transisi yang memuat transfer muatan dari logam ke ligan (metal-to-ligan-charge transfer, MLCT) akhir-akhir ini banyak diminati untuk dipelajari karena kemungkinan aplikasi yang sangat tinggi untuk konversi energi cahaya ke energi listrik. MLCT meliputi absorbsi cahaya tampak, photoluminescense, dan long lifetime. Photoluminescense pada kompleks europium dan terbium telah dapat dimanfaatkan untuk optik sensor pH (Blair, et al., 2001). Sedangkan absorpsi cahaya tampak dapat dimanfaatkan untuk photodegradator senyawa organik kromofor (Hoffman, et al. 1995). Tingkat eksitsasi MLCT dapat diklasifikasikan dalam decay non-radiatif, proses transfer elektron, efek pelarut, dan interaksi molekul kecil dengan biopolimer.
Studi MLCT mayoritas difokuskan pada kompleks dengan logam Ru(II)-polipiridin karena absorbsi transfer muatan pada daerah visibel yang intensitasnya sangat tinggi dan reaktivitas redoks yang baik, namun studi MLCT akhirnya meluas untuk kompleks-kompleks dari Os(II), Cu(I), Re(I), Pt(II), Fe(II) dan Ir(III) (Whittle, 2001 dan Islam, 2001). Lees, et al. (2001) telah mempelajari sifat fotoelektrokimia dari nanoporous TiO2 yang dimodifikasi permukaannya
dengan kompleks dinuklear Ru(II)-(bpt)-Os(II) (bpt=3,5-(bis(piridin-2-il)-1,2,4-triazol). Data elektrokimia, data spektroskopi time-resolved transient absorption dan penentuan IPCE (incident-photon-to-current-efficiency) dapat menerangkan adanya transfer elektron dari logam Ru(II) pada Ru(II)-(bpt)-Ru(II) ke material TiO2. Islam, A., (2001) menyebutkan sensitiser MLCT alternatif dari
kompleks-kompleks Fe(III), Re(I), dan Cu(I) pada bahan semikonduktor TiO2 yang telah
dipelajari masih kurang efisien sebagai bahan solar cell dibandingkan dengan sensitiser MLCT dari kompleks-kompleks logam Ru(II) dan Os(II).
Young Min Cho (2001) telah berhasil menunjukkan proses MLCT pada kompleks RuII(bpy-COOH)2)32+. Pita absorpsi maksimum dari metal-to-ligand
Gambar 8. Spektra UV-Vis TiO2 dan TiO2 tersensitisasi dan spektrum
absorbansi RuII(bpy-COOH)2)32+.
James K. Mccusker (2003) telah berhasil menunjukkan proses MLCT pada kompleks [Ru(bpy)3]2+ pada panjang gelombang 450 nm (Gambar 9).
Vinodgopal, et al. (1995) membuktikan adanya injeksi elektron dari dye Ru(bpy)2(dcbpy)2+ tereksitasi ke material TiO2. Keadaan tereksitasi dye
melibatkan metal-to-ligand charge transfer dan sebagai akibatnya konfigurasi elektronik pada keadaan tereksitasi memegang peran penting dalam mengontrol laju penginjeksian. Injeksi muatan dari sensitiser tereksitasi ke dalam pita konduksi semikonduktor dengan band gap besar terjadi dengan waktu yang ultra cepat.
Pada prinsipnya logam yang dapat mengadakan proses MLCT adalah logam yang memiliki densitas elektron yang berlebih yang disebabkan oleh tambahan densitas elektron dari ligan secara ikatan σ. Penggunaan ligan dua jenis yaitu ligan σ-donor dan ligan π-akseptor dapat mengarahkan terjadinya MLCT kepada ligan π-akseptor. Misalnya penggunaan ligan Cp (siklopentadienil), ligan PPh3 atau ligan halida dengan ligan-ligan polipiridin atau turunan piridin. Pada
senyawa kompleks, kontribusi σ-donor maupun π-akseptor secara sinergis memberi kestabilan senyawa kompleks secara keseluruhan.
Logam mengadakan proses MLCT juga dapat didukung oleh tingkat oksidasi logam. Logam pada tingkat oksidasi rendah atau nol memiliki densitas elektron yang lebih besar sehingga kemampuan untuk mengadakan proses MLCT akan meningkat. Faktor elektronegativitas logam juga merupakan salah satu faktor yang mempengaruhi terjadinya MLCT. Logam dengan elektronegativitas relatif rendah akan lebih mudah untuk melepaskan elektronnya sehingga proses MLCT lebih mudah terjadi. Proses MLCT tidak lain adalah proses pembentukan ikatan π-back bonding dari orbital dπ(M) ke orbital π*(L) atau σ*(L) (tergantung orbital anti-bonding yang dimiliki ligan).
6. Konversi Energi Cahaya ke Energi Listrik
Gambar 10. Skema sel surya TiO2 tersensitisasi dye dan proses yang terlibat
dalam konversi energi.
Reaksi-reaksi yang terjadi dalam proses konversi energi terangkum menjadi enam reaksi sederhana. Reaksi (1) menerangkan keadaan tereksitasi dye oleh energi matahari. Injeksi muatan merupakan proses yang sangat cepat, biasanya dalam ukuran femtosekon (reaksi 2). Di sisi lain, rekombinasi, atau reaksi balik elektron (reaksi 3) sangat lambat dan terjadi dalam jangka waktu yang lebih lama (skala mikrosekon atau lebih lama). Laju reaksi regenerasi dye (reaksi 4) sangat penting untuk efesiensi sel, karena mempengaruhi efisiensi pengumpulan elektron yaitu jumlah elektron yang meninggalkan semikonduktor dan menyumbangkan arus foto (photocurrent). Kinetika reaksi pada elektroda konter harus menjamin regenerasi cepat mediator muatan (reaksi 5). Elektron yang diinjeksikan bisa juga bereaksi dengan triodide. Hal ini kemungkinan terjadi melalui penjebakan dan reaksi antara. Reaksi ini juga dinamakan reaksi “dark current” yang merupakan mekanisme kehilangan utama (main loss) dalam DSSC (Dye-Sensitized Solar Cell) (reaksi 6).
Gambar 11. Kurva I-V pada pelbagai intensitas cahaya.
Injeksi elektron dari dye ke material TiO2 memegang peranan penting
dalam konversi energi. Konversi energi yang terjadi pada material TiO2-dye
dipelajari dengan penentuan kurva arus-voltase. Kemudian dari kurva didapat efisiensi konversi energi total, η, dibawah intensitas penerangan yang berbeda dan dihitung dengan persamaan:
) / ( ) . ) / ( . ) ( ( 2 2 cm W P FF cm A I V V in sc oc = η ...(3) Dimana Voc, Isc, FF, Pin masing-masing merupakan voltase open-circuit,
arus short-circuit, filling factor, dan fluks daya sumber sinar. Filling factor didefinisikan sebagai perhitungan daya maksimum, daerah persegi empat dibawah kurva I-V. Filling factor dihitung menggunakan persamaan:
sc oc p p
I
V
I
V
FF
.
.
=
...(4) Vp dan Ip merupakan titik belok kurva I-V dengan daerah segi empat dayamaksimum.
7. Spektrofotometri Inframerah
atom-atom yang terikat itu. Jadi, molekul ini berada dalam keadaan vibrasi tereksitasi. Energi yang terserap akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar.
Tipe ikatan yang berlainan (C-H, C-C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang karakteristik yang berlainan. Banyaknya energi yang diabsorbsi oleh suatu ikatan bergantung pada perubahan dalam momen ikatan. Jadi untuk dapat mengabsorbsi, molekul harus memiliki perubahan momen dipol sebagai akibat dari vibrasi. Berarti radiasi medan listrik yang berubah-ubah akan berinteraksi dengan molekul dan menyebabkan perubahan amplitudo salah satu getaran molekul. Senyawa-senyawa seperti O2,
dan N2 tidak memiliki perubahan momen dipol dalam vibrasi maupun rotasinya
sehingga tidak dapat mengabsorbsi sinar IR.
Skala pada dasar spektra adalah bilangan gelombang (ν). Panjang gelombang atau frekuensi titik minimum suatu pita absorbsi digunakan untuk mengidentifikasi tiap pita. Pita-pita inframerah dalam sebuah spektrum dapat dikelompokkan menurut intensitasnya yaitu kuat (s, strong), medium (m), dan lemah (w,weak). Suatu pita lemah yang bertumpang-tindih dengan suatu pita kuat disebut bahu (sh, shoulder) (Fessenden dan Fessenden, 1995).
8. Differential Thermal Analysis (DTA)
DTA dapat juga mendeteksi gejala–gejala yang lain seperti transisi polimorfis (perubahan bentuk) yang tidak melibatkan perubahan berat. Transisi fase polimorfis biasa dipelajari dengan mudah dan akurat dengan DTA, karena banyak sifat fisika dan kimia pada sample-sampel tertentu dapat dimodifikasikan atau dirubah seluruhnya dengan transisi fase ini, misalnya penambahan material untuk mendapatkan sifat material yang diinginkan.
Gejala-gejala yang terjadi pada DTA dapat digunakan untuk tujuan karakterisasi maupun analisis material, jika suatu sampel tidak diketahui identitasnya tentu tidak mungkin dapat diidentifikasi hanya dengan DTA saja, tetapi DTA sangat bermanfaat untuk mengelompokkan golongan-golongan material. Pola dari kurva DTA juga merupakan finger print sehingga bisa digunakan untuk karakterisasi suatu material jika sudah ada pola standarnya. Disamping itu DTA juga bisa digunakan untuk mengetahui kemurnian material (quality control) secara lebih akurat. Temperatur transisi glass (Tg) menunjukkan temperatur dimana terjadi transformasi padatan atau transisi struktur dari keadaan rigid menjadi fleksibel pada polimer yang disebabkan adanya perubahan kapasitas panas (Dood, et al, 1987). Harry, et al, (1994) mengatakan nilai Tg diatas 200 °C dimiliki material dengan komposisi gugus samping yang beragam. Nilai Tg yang tinggi menunjukkan material tersebut memiliki desain yang kuat.
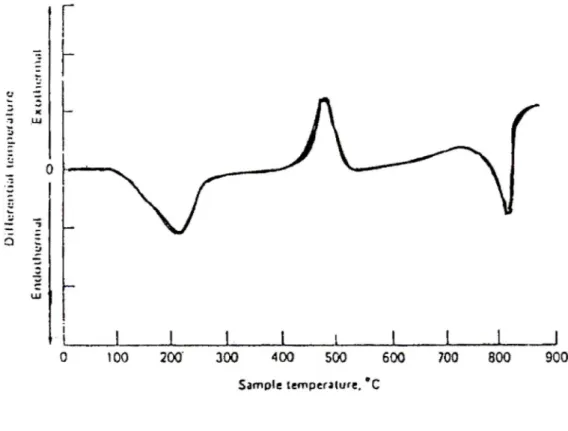
ditandai dengan penurunan temperatur dari sampel sehingga kurva DTA yang diperoleh adalah sebagai puncak minimum. Contoh kurva endotermal dan eksotermal pada material dapat dilihat pada Gambar 12 (Dood, et al, 1987).
Gambar 12. Kurva endotermal dan eksotermal material menggunakan Differential Thermal Analyzer (DTA).
Beberapa fenomena yang terjadi dalam analisis material menggunakan Differential Thermal Analyzer (DTA) (Dood, et al, 1987).
Tabel 2. Fenomena yang terjadi dalam analisis material menggunakan DTA.
Fenomena Eksotermis Endotermis
Tg (transisi glass) x x
Titik Leleh - x
Proses Rekristalisasi - x
Proses Dekomposisi x x
B. Kerangka Pemikiran
TiO2 bersifat stabil secara kimia dan merupakan bahan semikonduktor
maka bisa digunakan sebagai bahan dasar untuk sintesis semikonduktor rekaan. Tetapi ditinjau dari sifat fotoelektrokimianya TiO2 mempunyai sifat yang kurang
menguntungkan yaitu memiliki pita energi lebar yang hanya aktif dalam daerah cahaya ultraviolet, di mana cahaya ultraviolet tersebut hanya 10 % dari seluruh cahaya matahari. Fotosensitisasi merupakan metode untuk memperluas fotorespon pita energi yang lebar material TiO2 ke daerah cahaya tampak, dengan
mendopingkan suatu bahan yang memiliki respon terhadap panjang gelombang tampak. Dye, kompleks Mn(bpy)2Cl2, memiliki aktivitas di daerah tampak
sehingga dapat digunakan sebagai bahan sensitiser dalam fotosensitisasi. Silylating agent 3-kloropropiltrimetoksisilan (KPTS) mempunyai dua gugus aktif yaitu gugus klor dan gugus metoksi yang terletak pada dua ujung yang berbeda dan berlawanan. Jika ditambahkan pada dye, kompleks Mn(bpy)2Cl2, gugus klor
bisa bereaksi dengannya sehingga 3-kloropropiltrimetoksisilan terikat pada kompleks. Selanjutnya bila silylating Agent telah berikatan dengan kompleks tersebut direaksikan dengan material TiO2, gugus metoksi bisa mengadakan reaksi
dengan hidrogen gugus OH pada material TiO2. Sebagai akibat reaksi ini atom Si
menjadi berikatan dengan atom Ti melalui atom oksigen, dan kompleks bisa terikat pada permukaan TiO2. KPTS berperan sebagai gugus penggandeng antara
dye dengan material TiO2 dan bisa dikarakterisasi dari spektra FTIR material
TiO2-dye.
Fotosensitisasi diawali dengan diserapnya energi cahaya tampak oleh dye pada material semikonduktor rekaan TiO2-dye. Akibat penyerapan energi cahaya
ini dye mengalami eksitasi MLCT. Karakteristik MLCT ini bisa diketahui dengan mempelajari spektrum elektronik (UV-Vis) dan observasi back bonding dari dye dan material TiO2-dye. Dalam keadaan tereksitasi ini bisa terjadi penginjeksian
elektron dari kompleks ke material TiO2, karena perbedaan tingkat energi keadaan
kemampuan yang terbatas dalam menghasilkan arus, maka dengan berjalannya waktu arus yang dihasilkan akan semakin menurun. Lamanya material menghasilkan arus selama waktu tertentu bisa dijadikan ukuran stabilitas fotoelektrokimia material. Stabilitas fotoelektrokimia merupakan karakteristik fotoelektrokimia material TiO2-dye dan bisa dipelajari dengan dengan metode
pengukuran arus foton-voltase.
Penginjeksian elektron ini merupakan proses transfer elektron yang terjadi di dalam material TiO2-dye yang disebabkan oleh energi cahaya tampak. Jika
material disusun sedemikian sehingga menjadi sebuah sel elektrokimia, maka transfer elektron ini akan menimbulkan arus dan voltase. Dengan adanya arus dan voltase yang dihasilkan maka material berfungsi sebagai suatu bahan yang dapat mengkonversi energi cahaya ke energi listrik.
C. Hipotesis.
1. Material TiO2-dye dapat disintesis dari TiCl4 sebagai bahan dasar, senyawa
kompleks Mn(bpy)2Cl2 sebagai sensitiser, menggunakan agen penggandeng silan
3-kloropropiltrimetoksisilan (KPTS).
2. Dye dapat mensensitisasi TiO2 sehingga material TiO2-dye memiliki kisaran
respon terhadap panjang gelombang daerah tampak.
3. Material TiO2-dye dapat mengkonversi energi cahaya ke energi listrik yang