Uji Antioksidan dengan Metode DPPH dan Uji Saponin terhadap Ekstrak
Teripang
Holothuria atra
Subhan Haikal Ehsan
1Departemen Biologi, FMIPA UI, Kampus UI Depok 16424
1[email protected], 2[email protected]
Abstrak
Teripang telah diketahui banyak memiliki manfaat biologis, seperti antikanker, antifungal, antivirus, dan antioksidan. Penelitian dilakukan untuk mengetahui aktivitas antioksidan dan mendeteksi keberadaan senyawa saponin pada ekstrak kasar Holothuria atra (Echinodermata) dan fraksi-fraksinya. Senyawa radikal bebas DPPH digunakan untuk pengujian aktivitas antioksidan sedangkan pereaksi Liebermann Burchard digunakan untuk mendeteksi keberadaan senyawa saponin. Hasil penelitian menunjukkan bahwa ekstrak kasar H. atra mengandung saponin dan memiliki aktivitas antioksidan yang lebih rendah dari pembandingnya, Acanthaster sp. (Echinodermata) dengan nilai IC50 masing-masing sebesar 739,194 µg/ml dan 102,946 µg/ml. Fraksi n-heksan, fraksi etil asetat, dan fraksi air memiliki aktivitas antioksidan yang kurang kuat dengan nilai IC50 secara berurutan 511,35 µg/ml, 373,776 µg/ml, dan 491,8 µg/ml. Uji saponin terdeteksi positif pada semua fraksi kecuali fraksi etil asetat.
.
Kata kunci: antioksidan, DPPH, ekstrak kasar, Holothuria atra, saponin.
1. PENDAHULUAN
Penelitian tentang bahan alam dan senyawa bioaktif dari biota laut telah banyak dilakukan dan telah berkembang sejak tahun 1970-an. Lebih dari 15.000 struktur senyawa bioaktif telah ditemukan terdapat pada biota laut. Senyawa bioaktif biota laut dapat diisolasi dari alga, spons, moluska, Echinodermata, Tunicata, Cnidaria, dan ikan (Dewi 2009: 3)[1].
Salah satu biota laut yang telah diketahui memiliki senyawa bioaktif dan dapat dimanfaatkan adalah teripang (Yusron 1991:53)[2]. Teripang (Holothuroidea) sudah sejak lama banyak dimanfaatkan di wilayah Indo-Pasifik bukan hanya untuk dikonsumsi sebagai makanan, tetapi juga dapat dimanfaatkan sebagai obat tradisional khususnya di wilayah Asia Timur. Teripang dapat dimanfaatkan sebagai obat karena memiliki manfaat-manfaat biologis seperti antifungal, antivirus, antitumor, anticoagulant,
anti-angiogenic, neuritogenic, dan immunomodulatory
activities (Husni et al. 2009: 2)[3]. Hasil penelitian Suriyanto (2010: 34)[4] menunjukkan bahwa empat jenis teripang Holothuria spp. dari Pulau Penjaliran Timur (Kep. Seribu, Jakarta) memiliki bioaktivitas yang tinggi atau toksik terhadap Artemia salina
karena memiliki nilai LC50 kurang dari 1000 ppm. Selain memiliki fungsi sebagai obat, senyawa bioaktif teripang juga bermanfaat dari aspek ekologi, seperti antifouling dan antifeedant. Selvin & Lipton (2004: 252)[5] menyimpulkan bahwa ekstrak Holothuria scabra dapat mencegah terjadinya penempelan “kaki” Patella vulgata pada cawan petri yang telah diisi dengan 1 ml ekstrak H.
scabra dan sepertiga bagian lainnya dengan air laut. Tursina (2011: 36)[6] juga telah meneliti potensi
antifeedant ekstrak H.atra dan Bohadschia
marmorata terhadap ikan karang dan
menyimpulkan bahwa ekstrak teripang tersebut dapat berperan sebagai antifeedant terhadap ikan karang.
Senyawa yang banyak diperkirakan berperan dalam manfaat-manfaat ekstrak teripang tersebut adalah triterpen glikosida. Triterpen glikosida adalah senyawa yang termasuk dalam kelompok saponin dan telah umum diketahui sebagai sea cucumber saponins. Senyawa-senyawa bioaktif penting lainnya yang terdapat pada teripang antara lain chondroitin sulfate, eicosapentaenoic acid, dan ganglioside (Kaneko et al. 2003)[7].
Dari sekian banyak penelitian tentang manfaat teripang tersebut, masih sedikit laporan penelitian tentang aktivitas antioksidan pada ekstrak teripang. Baru-baru ini, Cucumaria frondosa, spesies teripang yang umum terdapat di pesisir Samudera Atlantik Utara, dan teripang
Stichopus japonicus telah diteliti dan diketahui memiliki aktivitas antioksidan. Senyawa fenolik diperkirakan adalah senyawa yang paling berperan dalam aktivitas antioksidan ekstrak teripang tersebut (Mamelona et al. 2007: 7)[8]
Indonesia sebagai negara beriklim tropis dengan perairan dangkal yang luas menyediakan habitat yang baik untuk perkembangan berbagai macam jenis teripang, salah satunya adalah teripang
Holothuria atra yang banyak dan umum ditemukan
di perairan Indonesia (Arnold & Birtles 1989: 227)[9]. Penelitian yang dilakukan oleh Suriyanto (2010)[4] dan Tursina (2011)[6] menggunakan H.
atra sebagai bahan penelitian dan dari kedua penelitian tersebut diketahui bahwa ekstrak H. atra
bersifat toksik terhadap Artemia salina dan memiliki potensi antifeedant terhadap ikan karang. Belum adanya penelitian tentang aktivitas antioksidan ekstrak H. atra membuat penelitian ini perlu dilakukan untuk lebih mengetahui potensi manfaat senyawa bioaktif yang terdapat pada ekstrak H. atra.
Teripang dari Suku Holothuriidae banyak terdapat di perairan Indonesia. Teripang yang tergolong ke dalam Suku Holothuriidae adalah
Actinopyga, Bohadschia, Labidodemas, dan
Holothuria (Arnold & Birtles 1989: 227)[9].
Penelitian mengenai senyawa metabolit sekunder teripang pernah dilakukan di Indonesia oleh Suriyanto (2010)[4] dan Tursina (2011)[6]. Suriyanto pada tahun 2010 melakukan penelitian mengenai uji toksisitas ekstrak teripang dari Kepulauan Seribu terhadap larva Artemia salina
menggunakan uji Brine Shrimp Lethality Test
(BSLT). Hasil penelitian Suriyanto (2010: 34)[4] menunjukkan bahwa ekstrak kasar teripang
Holothuria atra di Kepulauan Seribu terbukti
bersifat aktif (toksik) terhadap uji BSLT dengan nilai LC50 sebesar 77, 063 µg/ml. Tursina (2011: 36) telah meneliti potensi antifeedant ekstrak
Holothuria atra terhadap ikan karang dan
menyatakan bahwa ekstrak H. atra dapat berperan sebagai antifeedant terhadap ikan karang. Chairunnisa dan Hakam (2011)[10] juga telah meneliti potensi ekstrak kasar H. atra sebagai senyawa pencegah kanker, dan menyimpulkan bahwa ekstrak H. atra pada dosis 0,33—1,32 g/kg bb memiliki aktivitas pencegahankanker dengan parameter penurunan jumlah mikronukleus pada 2000 sel eritrosit polikromatik mencit (Chairunnisa 2011: 35)[10]. Akan tetapi, penelitian tentang aktivitas antioksidan pada ekstrak H. atra dari Kep. Seribu, Jakarta belum pernah dilakukan. Oleh karena itu, penelitian tentang aktivitas antioksidan ekstrak H. atra perlu dilakukan untuk lebih mengetahui potensi manfaat senyawa bioaktif yang terdapat pada ekstrak H. atra. Selain itu, pemeriksaan fraksi-fraksi ekstrak kasar H. atra
yang diperoleh dengan pelarut-pelarut tertentu perlu juga dilakukan untuk mengetahui fraksi manakah yang paling dominan dalam uji aktivitas antioksidan.
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan yang terdapat pada ekstrak
Holothuria atra dan mengetahui fraksi ekstrak
kasar H. atra manakah yang paling dominan dalam uji aktivitaas antioksidan. Hipotesis penelitian ini adalah terdapat aktivitas antioksidan pada ekstrak
Holothuria atra dan terdapat fraksi ekstrak H. atra
yang dominan dalam uji aktivitas antioksidan.
2. METODE PENELITIAN
Pengambilan sampel teripang Holothuria atra
dilakukan di rataan terumbu Pulau Pari, Kep. Seribu, Jakarta. Sampel diambil sebanyak 28 individu dengan kisaran ukuran 15--17 cm, dikeluarkan organ bagian dalamnya, kemudian ditimbang dan diawetkan dengan metanol dalam botol sampel.
Ekstraksi
Metode ekstraksi yang digunakan adalah maserasi. Sampel yang telah diambil ditiriskan kemudian dihaluskan dengan blender. Sampel yang telah halus kemudian direndam dengan metanol pada
beaker glass 1 liter, dihomogenkan dengan
sonikator, dan didiamkan semalaman. Filtrat yang terbentuk nantinya akan disaring. Proses ekstraksi tersebut diulang hingga filtrat tidak berwarna. Filtrat yang telah dikumpulkan, diuapkan dengan
rotary evaporator dan dikeringkan dalam oven
pada suhu 40 ºC.
Uji kualitatif antioksidan
Ekstrak kering dilarutkan dalam metanol lalu dipipet menggunakan pipa kapiler kemudian ditotolkan pada pelat KLT. Penotolan dilakukan berkali-kali pada titik yang sama hingga terbentuk zona penotolan berdiameter 0,5 cm untuk mendapatkan hasil yang optimum. Larutan DPPH disemprotkan ke pelat KLT secara merata kemudian didiamkan sejenak. Reaksi antara DPPH dan ekstrak pada pelat KLT diamati dan didokumentasikan. Hasil positif aktivitas antioksidan ditunjukkan dengan zona penotolan yang tidak terwarnai ungu oleh larutan DPPH atau terbentuk warna kuning pucat (hampir putih) dengan latar belakang ungu.
Uji kuantitatif antioksidan
Aktivitas antioksidan ekstrak H. atra diukur dengan mereaksikannya dengan senyawa radikal bebas DPPH (1,1 Difenil-2-Pikrilhidrazil) sesuai dengan metode Blois (1958)[11]. Konsentrasi larutan DPPH dalam metanol p.a pada saat pengujian adalah 50 µg/ml. Ekstrak kering teripang dilarutkan juga dengan metanol p.a dan dibuat seri konsentrasi uji sebesar 2,5; 6,25; 12,5; 25; dan 37,5 µg/ml. Seri larutan uji direaksikan dengan larutan DPPH pada tabung reaksi yang berbeda, dikocok hingga homogen, diinkubasi pada suhu 37ºC selama 30 menit dan diukur serapannya pada panjang gelombang 517 nm menggunakan spektrofotometer hingga didapatkan absorbansi DPPH sisa pada setiap konsentrasinya.
Penghitungan % inhibisi dan nilai IC50
Nilai IC50 dihitung berdasarkan persentase inhibisi terhadap radikal DPPH dari masing-masing konsentrasi larutan sampel dengan rumus:
% !"ℎ!"!#!= !"#.!"#$%&−!"#.!"#$%&
!"#$%"&' !"#$%& ! 100 %
Setelah didapatkan persentasi inhibisi (y) dari masing-masing konsentrasi (x), titik-titik (x,y) diplot pada bidang koordinat kemudian ditentukan persamaan y = mx + c dengan perhitungan secara regresi linear dimana m dan c adalah konstanta, x adalah konsentrasi sampel (µg/ml), dan y adalah persentase inhibisi (%). Aktivitas antioksidan dinyatakan dengan Inhibition Concentration 50 (IC50) yaitu konsentrasi sampel (x) yang dapat meredam 50% radikal DPPH (y=50). Jadi, nilai IC50 sama dengan nilai x saat nilai y = 50. Persamaan regresi linear didapat dengan menggunakan program Microsoft Excel 2007 setelah membuat kurva antara % inhibisi dan konsentrasi sampel. Identifikasi saponin
Uji saponin pada penelitian ini dilakukan dengan metode uji busa. Uji busa dilakukan dengan menempatkan 0,5 gram ekstrak ke dalam tabung reaksi yang telah berisikan akuades 10 ml, dikocok dan ditambahkan satu tetes larutan asam klorida 2 N. Tabung reaksi tersebut didiamkan dan diperhatikan ada atau tidaknya busa stabil. Sampel mengandung saponin jika terbentuk busa stabil dengan ketinggian 1--3 cm selama 30 detik. Fraksinasi
Ekstrak metanol Holothuria atra dilarutkan dalam air 400 ml dan dihomogenkan di dalam round flask
kemudian dituang ke corong pisah. N-heksan 400 ml ditambahkan ke corong pisah kemudian dikocok hingga terbentuk emulsi kedua pelarut lalu didiamkan hingga terbentuk dua fraksi nyang dapat diketahui dari perbedaan warna keduanya yaitu fraksi air pada bagian bawah dan fraksi n-heksan pada bagian atas. Klep yang terdapat di bagian bawah corong pisah dibuka hingga semua air keluar dari corong pisah dan ditampung dalam round flask. Fraksi n-heksan yang masih berada di corong pisah dituang ke round flask lainnya. Fraksi air yang telah ditampung dalam round flask dituang ke corong pisah lau ditambahkan n-heksan yang baru. Pengocokan dan proses yang sama dengan sebelumnya dilakukan. Proses tersebut dilakukan hingga fraksi n-heksan yang terbentuk di corong pisah tidak berwarna. Fraksi n-heksan yang telah didapatkan kemudian diuapkan menggunakan evaporator selanjutnya dimasukkan ke oven hingga kering.
Fraksi air yang diperoleh dituangkan ke corong pisah kemudian ditambahkan 400 ml etil asetat. Corong pisah dikocok lalu didiamkan hingga terbentuk dua fraksi yaitu fraksi air pada bagian bawah corong pisah dan fraksi etil asetat pada bagian atas. Klep dibuka hingga fraksi air keluar dari corong pisah kemudian ditampung dalam
round flask dan fraksi etil asetat dituang ke round flask lain. Fraksi air yang telah ditampung dalam
round flask dituang ke corong pisah lalu
ditambahkan etil asetat yang baru kemudian dikocok sama seperti proses sebelumnya. Proses tersebut dilakukan hingga fraksi etil asetat yang
terbentuk di corong pisah tidak berwarna. Fraksi etil asetat dan air yang telah didapatkan kemudian masing-masing diuapkan menggunakan evaporator dan selanjutnya dimasukkan ke oven hingga kering. Uji antioksidan dan uji saponin terhadap fraksi Uji antioksidan dan uji saponin terhadap fraksi n-heksan, etil asetat, dan air dilakukan untuk mengetahui fraksi teraktif yang mengandung saponin di antara ketiganya. Fraksi teraktif adalah fraksi yang memiliki aktivitas antioksidan tertinggi yang ditunjukkan dengan nilai IC50 terkecil. Uji kualitatif dan kuantitatif antioksidan serta uji saponin dilakukan dengan prosedur yang sama dengan prosedur yang dilakukan pada ekstrak kasar teripang.
3. HASIL DAN PEMBAHASAN
Bobot ekstrak kasar Holothuria atra
yang didapat yakni 1,39% dari bobot basah sampel. Proses maserasi yang dilakukan pada penelitian belum sepenuhnya selesai. Ekstrak kasar yang digunakan adalah hasil maserasi sebanyak tiga kali. Maserasi tidak dilakukan hingga selesai karena keterbatasan waktu penelitian yang dimiliki penulis. Walaupun demikian, persentase bobot ekstrak kasar
H. atra masih sesuai dengan penelitian yang
dilakukan Elyakov (1973: 327)[12] yang menyatakan bahwa persentase ekstrak kasar H. atra
berkisar antara 0,5--2,5 % dari berat basahnya.
Acanthaster sp. dijadikan pembanding
pada penelitian karena termasuk ke dalam filum yang sama dengan Holothuria atra, yaitu Echinodermata dan aktivitas antioksidannya telah diteliti sebelumnya oleh Rahim pada tahun 2012. Ekstrak kasar Holothuria atra memiliki aktivitas antioksidan yang lebih rendah daripada pembandingnya. Artinya, Holothuria atra tidak lebih berpotensi dijadikan sumber antioksidan daripada Acanthaster sp..
Total bobot fraksi yang didapat adalah 12,5 gram dengan fraksi n-heksan sebagai fraksi dengan bobot terbanyak yakni 8,5 gram. Hasil uji aktivitas antioksidan secara kualitatif menunjukkan ketiga fraksi memiliki aktivitas antioksidan. Uji kuantitatif juga menunjukkan bahwa ketiga fraksi memiliki aktivitas antioksidan yang nilainya lebih besar dari nilai aktivitas antioksidan ekstrak kasar
Holothuria atra. Nilai aktivitas antioksidan dari ekstrak kasar H. atra dan ketiga fraksinya dapat dikatakan kurang kuat karena menurut Blois (1958)[11], suatu senyawa adalah antioksidan yang kuat jika memiliki nilai IC50 kurang dari 200 µg/ml. Hasil serupa juga didapatkan dari penelitian Althunibat dkk. pada tahun 2009[13]. Althunibat dkk. meneliti tentang aktivitas antioksidan ekstrak tiga jenis teripang di Malaysia yaitu Holothuria scabra, H. leucospilota, dan
Stichopus chloronotus. Hasil penelitian tersebut menunjukkan bahwa nilai IC50 ekstrak kasar ketiga
jenis teripang tersebut berkisar antara 2 mg/ml sampai 10 mg/ml. Penelitian aktivitas antioksidan
H. atra dari Laut Merah juga telah dilakukan oleh Esmat dkk. (2012)[14]. Esmat dkk. menyatakan bahwa aktivitas antioksidan ekstrak H. atra rendah terhadap radikal bebas DPPH dengan nilai 17,01 % pada konsentrasi 600 µg/ml namun tinggi terhadap radikal NO dengan nilai 93,42 % pada konsentrasi 600 µg/ml. Hasil tersebut menunjukkan bahwa nilai aktivitas antioksidan dapat berbeda tergantung dari metode yang dipakai.
Uji saponin juga dilakukan untuk mengetahui apakah senyawa yang berperan sebagai antioksidan didominasi oleh senyawa saponin. Hal tersebut dilakukan karena senyawa metabolit sekunder yang umum dijumpai pada teripang adalah triterpen glikosida (Careaga dkk. 2009: 60)[15] yang merupakan senyawa saponin, sehingga dapat diketahui apakah triterpen glikosida (saponin) atau justru golongan senyawa lain yang berperan dominan dalam aktivitas antioksidan.
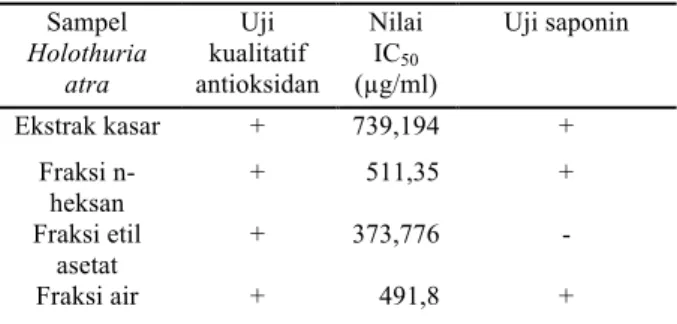
Hasil uji saponin menunjukkan bahwa ekstrak kasar, fraksi n-heksan, dan fraksi air positif mengandung saponin sedangkan fraksi etil asetat negatif. Saponin adalah senyawa polar yang secara teori pada proses fraksinasi akan terbawa ke dalam fraksi yang juga bersifat polar, yaitu fraksi air. Hasil uji saponin fraksi air menunjukkan bahwa hasil tersebut sesuai dengan teori. Penyimpangan terjadi pada uji saponin fraksi n-heksan yang memberikan hasil positif padahal n-heksan adalah senyawa non-polar. Pengocokan pada corong pisah terlalu lama dan pemisahan fraksi air dan n-heksan dinilai terlalu cepat sehingga diduga ada komponen fraksi air yang masih terjebak dalam fraksi n-heksan.
Fraksi air yang positif saponin memiliki nilai aktivitas antioksidan dengan nilai IC50 sebesar 491,8 µg/ml. Nilai tersebut lebih kecil dibandingkan dengan fraksi etil asetat yang negatif saponin, dengan nilai IC50 sebesar 373,776 µg/ml. Hasil tersebut memberikan asumsi bahwa senyawa selain golongan saponin merupakan senyawa yang berperan dominan dalam aktivitas antioksidan. Senyawa selain saponin yang bersifat antioksidan dan juga larut di air (polar) atau pelarut semi polar (etil asetat) adalah fenol, flavonoid, dan alkaloid (Sayeed 2007: 15)[16]. Nilai aktivitas antioksidan tertinggi di antara ketiga fraksi ditunjukkan oleh fraksi etil asetat dan fraksi air, sehingga dapat disimpulkan bahwa senyawa yang berperan dominan dalam aktivitas antioksidan ekstrak H. atra adalah golongan senyawa yang bersifat atau cenderung bersifat polar.
Tabel 1. Uji antioksidan dan uji saponin ekstrak dan fraksi Holothuria atra
Sampel Holothuria atra Uji kualitatif antioksidan Nilai IC50 (µg/ml) Uji saponin Ekstrak kasar + 739,194 + Fraksi n-heksan + 511,35 + Fraksi etil asetat + 373,776 - Fraksi air + 491,8 +
Gambar 1. Persamaan regresi ekstrak kasar
metanol Holothuria atra
Gambar 2.Persamaan regresi fraksi n-heksan Holothuria atra
Gambar 3.Persamaan regresi fraksi etil asetat Holothuria atra y = 0.0678x + 0.474 R² = 0.7226 0 5 10 0 20 40 60 80 100 120 persentase inhibisi ( %)
konsentrasi lar. uji (µg/ml)
ekstrak kasar y = 0.0971x + 0.3991 R² = 0.89033 0 2 4 6 0 10 20 30 40 50 60 persentase inhibisi ( %)
konsentrasi lar. uji (µg/ml)
fraksi n-‐heksan y = 0.1214x + 4.7736 R² = 0.57043 0 5 10 15 0 20 40 60 persentase inhibisi ( %)
konsentrasi lar. uji (µg/ml)
fraksi e;l asetat
Gambar 4.Persamaan regresi fraksi etil air Holothuria atra
4. KESIMPULAN
Hasil penelitian menunjukkan bahwa ekstrak teripang Holothuria atra dan fraksi-fraksinya memiliki aktivitas antioksidan. Fraksi yang memiliki aktivitas antioksidan tertinggi adalah fraksi etil asetat dengan nilai IC50 sebesar 373,776 µg/ml. Hal tersebut mengindikasikan bahwa senyawa yang berperan paling dominan dalam aktivitas antioksidan ekstrak H. atra adalah senyawa yang bersifat polar atau cenderung bersifat polar.
UCAPAN TERIMAKASIH
Terima kasih kepada Bapak Dr.rer.nat Yasman, M. Sc. selaku pembimbing serta Ibu Dra. Setiorini, M. Kes. dan Ibu Nova AnitA, M. Biomed. atas saran dan masukan selama penelitian.
DAFTAR ACUAN
[1] A.S. Dewi. 2009. Biologically active secondary metabolites from tropical marine
invertebrates. Thesis S3 Oseanography-The
faculty of graduate studies The University Of British Columbia, Vancouver: xiv + 104 hlm. [2] E. Yusron. 2004. Sumberdaya teripang di
perairan Tanjung Pai Padaido Biak Numfor Papua. Makara. Sains. 8(3): 123--127.
[3] A. Husni, B. Um & D. Chung. 2009. Isolation
and identification of antioxidants and tyrosinase inhibitors from Stichopus
japonicus. Food Science and Biotechnology
(18): 419--424
[4] Suriyanto. 2010. Uji toksisitas ekstrak teripang (Holothuria spp.) dari Pulau Penjaliran Timur Taman Laut Nasional Kepulauan Seribu Jakarta menggunakan Brine
Shrimp Lethality Test (BSLT). Skripsi Sarjana
S1 Departemen Biologi FMIPA Universitas Indonesia, Depok: xiii + 55 hlm .
[5] J. Selvin & A.P. Lipton. 2004. Antifouling activity of bioactive substances extracted from
Holothuria scabra. Hydrobiologica. (513):
251--253.
[6] L.M. Tursina. 2011. Uji antifeedant ekstrak kasar teripang Holothuria atra dan
Bohadschia marmorata terhadap ikan karang
di perairan Pulau Pramuka Kepulauan Seribu DKI Jakarta. Skripsi Sarjana S1 Departemen Biologi FMIPA Universitas Indonesia, Depok: xii + 48 hlm.
[7] M. Kaneko, F. Kisa, K. Yamada, T.
Miyamoto & R. Higuchi. 2003. Structure of a new neuritogenic-active ganglioside from the sea cucumber Stichopus japonicus. European
Journal of Organic Chemistry (10):
1004--1008.
[8] J. Mamelona, E.M. Pelletier, K. Girard-Lalancette, J. Legault, S. Karbourne & S. Kermasha. 2007. Quantification of phenolic cntents and antioxidant capacity of Atlantic sea cucumber Cucumaria frondosa. Food
Chem. 104: 1040--1047.
[9] P.W. Arnold, & R.W. Birtles. 1989. Soft sediments marine invertebrates of Southeast Asia and Australia: a guide to identification.
Australian Institutes of Marine Science, Australia: xvi + 272 hlm.
[10] N. Chairunnisa. 2011. Uji potensi ekstrak kasar teripang Holothuria atra Jaeger sebagai pencegah kanker melalui uji mikronukleus pada susmsum tulang mencit (Mus musculus) jantan galur DDY. Skripsi Sarjana S1 Departemen Biologi FMIPA Universitas Indonesia, Depok: xi + 51 hlm.
[11] M.S. Blois. 1958. Antioxidant determinations by the use of a stable free radical.
Biochemistry 181: 1199--1200.
[12] G.B. Elyakov, V.A Stonik, E.V. Levina, V.P Slanke, T.A. Kuznetsova & V.S. Levin. 1973. A comparative study of the glycoside fractions of Pacific sea cucumbers. Perg. Press. 44B: 325--336.
[13] O.Y. Althunibat, R. bin Hashim, M. Taher, J.M. Daud, M.A. Ikeda & B.I. Zali. 2009. In vitro antioxidant and proliferative activities of three Malaysian sea cucumber species.
European Journal of Scientific Research
37(3): 376--387
[14] A.Y. Esmat, M.M. Said, A.A. Soliman, K.S.H. El-Masry & E.A. Badiea. 2012. Bioactive compounds, antioxidant potential, and hepatoprotective activity of sea cucumber
(Holothuria atra) against thioacetamide
intoxication in rats. Nutrition. 30: 1--10
[15] V.P. Careaga, C. Bueno, C. Munianin, L.
Alche & M.S. Maier. 2009. Antiproliferative, cytotoxic and hemolytic activities of a triterpene glycoside from Psolus patagonicus
y = 0.1002x + 0.82 R² = 0.86626 0 5 10 0 10 20 30 40 50 60 persentase inhibisi ( %)
konsentrasi lar. uji (µg/ml)
fraksi air
and its desulfated analog. Chemotherapy.
(55): 60--68
[16] A. Sayeed. 2007. Introduction of plant
constituents and their tests . New Delhi
University, New Delhi: 40 hlm