UJI ANTIOKSIDAN FRAKSI ETIL ASETAT DAN FRAKSI AIR EKSTRAK ETANOL TEH HIJAU
MELALUI PENANGKAPAN RADIKAL HIDROKSIL DENGAN METODE DEOKSIRIBOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Sarjana Farmasi
Oleh : Dedy NIM : 018114027
Oleh :
Aprilliana Sari Dewi NIM : 028114176
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
UJI ANTIOKSIDAN FRAKSI ETIL ASETAT DAN FRAKSI AIR EKSTRAK ETANOL TEH HIJAU
MELALUI PENANGKAPAN RADIKAL HIDROKSIL DENGAN METODE DEOKSIRIBOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Sarjana Farmasi
Oleh : Dedy NIM : 018114027
Oleh :
Aprilliana Sari Dewi NIM : 028114176
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
UJI ANTIOKSIDAN FRAKSI ETIL ASETAT DAN FRAKSI AIR EKSTRAK ETANOL TEH HIJAU
MELALUI PENANGKAPAN RADIKAL HIDROKSIL DENGAN METODE DEOKSIRIBOSA
Yang diajukan oleh :
Aprilliana Sari Dewi
NIM : 028114176
Skripsi ini telah disetujui oleh:
Pembimbing
Dra. A. Nora Iska Harnita, M.Si., Apt.
v
Kupersembahkan skripsi ini untuk:
Tuhan Yesus
yang selalu memberiku kasih, kekuatan, dan penghiburanBapak dan Ibuku
yang sangat aku sayangiAdikku Daniel
yang selalu mendukungkuvi PRAKATA
Puji syukur kepada Tuhan Yang Maha Kuasa atas segala kasih dan
rahmatNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji
Antioksidan Fraksi Etil Asetat dan Fraksi Air Ekstrak Etanol Teh Hijau Melalui
Penangkapan Radikal Hidroksil dengan Metode Deoksiribosa” sebagai salah satu
syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm.) di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
Selama perkuliahan, penelitian, dan penyusunan skripsi ini, penulis telah
banyak mendapat bantuan dari berbagai pihak berupa bimbingan, nasehat,
dorongan, pengarahan, kritik, saran, dan sarana. Pada kesempatan ini penulis ingin
menyampaiakan penghargaan dan ucapan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Dra. A. Nora Iska Harnita, M.Si., Apt. selaku Dosen Pembimbing Skripsi
atas segala masukan, kritik, semangat, dan sarannya.
3. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen Penguji atas
bimbingan, saran, dan pengarahannya baik selama penelitian dan dalam
penyusunan skripsi ini.
4. Erna Tri Wulandari, M.Si., Apt. selaku dosen Penguji atas bimbingan,
saran, dan pengarahannya baik selama penelitian dan dalam penyusunan
vii
5. Enade Istyastono, S.F., Apt. atas dukungan, perhatian, waktu, semangat,
saran dan kritiknya.
6. Romo Drs. P. Sunu H. S.J., atas bimbingan, nasehat, semangat, waktu,
saran, dan bantuannya.
7. Segenap dosen atas kesabarannya dalam membimbing penulis selama
perkuliahan di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Segenap laboran dan karyawan atas bantuan dan kerjasamanya selama
penulis menempuh perkuliahan di Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
9. PT. Pagilaran Yogyakarta atas informasi yang diberikan tentang proses
pembuatan teh.
10. Bapak, Ibu, dan adikku Daniel yang sangat aku sayangi.
11. Teman-teman “Skripsi Ceria” (Riri, Leny, Vini, dan Ardhyan), atas
persahabatan, semangat, bantuan, dan kerjasamanya.
12. Teman-teman kost Davita dan almamaternya (Mbak Yanti, Mbak Siska,
Mbak Utin, Mbak Wulan, Aris, Clara, Yosi, I’ie), Bapak & Ibu kost, dik
Ana dan dik Anik, atas cinta dan kasih sayang kalian.
13. Teman-teman KKN-ku (Mbak Ade, Kak Enzo, Mas Chandra, Tisa, Ndus,
Reni, Ika, Wida, Lambok) atas waktu sejenak yang berarti buatku.
14. Arya, Kristian, Danang, Heri, Mas Made, Mas Sam, Mas Hendri, Yuni,
Duma, Rinta, Santi, Mas Koko, Bang Agus, Ponco, Duta, Mas Christ, Mas
Rocky, Nono, Yon, Mas Pras, Kak Sani, Dik Kus, dan Ina atas bantuan
viii
15. Teman-teman kelas C terutama kelompok F angkatan 2002, atas
persahabatan, kebersamaan, dan kerjasama kita selama ini.
16. Semua pihak yang telah memberi bantuan, semangat, dan dukungan yang
tidak dapat disebutkan satu persatu.
Akhir kata, penulis menyadari bahwa penyusunan skripsi ini masih jauh
dari sempurna mengingat keterbatasan kemampuan dan pengalaman yang
dimiliki. Oleh sebab itu, kritik dan saran yang membangun sangat diperlukan oleh
penulis demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi
perkembangan ilmu pengetahuan.
Yogyakarta, 13 Februari 2007
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 13 Februari 2007
Penulis
x
INTISARI
Teh hijau mengandung kira-kira 30 % senyawa polifenol terutama dari golongan flavonoid. Komponen flavonoid dalam teh hijau dengan gugus hidroksi fenoliknya, memungkinkan teh hijau mempunyai aktivitas antioksidan dengan mekanisme penangkapan radikal hidroksil. Tujuan dari penelitian ini adalah untuk mengetahui aktivitas dan nilai aktivitas antioksidan fraksi etil asetat dan fraksi air ekstrak etanol teh hijau melalui penangkapan radikal hidroksil dengan metode deoksiribosa.
Penelitian ini merupakan penelitian eksperimental karena subyek uji diberi perlakuan. Metode yang digunakan adalah metode deoksiribosa, dengan reagen Fenton untuk menghasilkan radikal hidroksil. Penyerangan radikal hidroksil terhadap deoksiribosa menghasilkan malondialdehid (MDA), yang kemudian direaksikan dengan asam tiobarbiturat (TBA) dalam suasana asam dan dengan pemanasan membentuk kromogen berwarna merah muda. Absorbansi dari kromogen ini kemudian diukur pada panjang gelombang 532 nm. Aktivitas antioksidan melalui penangkapan radikal hidroksil dari fraksi etil asetat dan fraksi air diketahui dari nilai % scavenging. Nilai aktivitas antioksidan kedua fraksi tersebut diketahui dengan cara menetapkan ES50 (penangkapan efektif radikal hidroksil sebesar 50 %) melalui analisis regresi linier yang menyatakan hubungan antara konsentrasi fraksi etil asetat dan konsentrasi fraksi air dengan %
scavenging.
Hasil penelitian menunjukkan bahwa fraksi etil asetat dan fraksi air mempunyai aktivitas antioksidan melalui penangkapan radikal hidroksil dengan metode deoksiribosa. Aktivitas antioksidan fraksi etil asetat berbeda tidak bermakna dibanding aktivitas antioksidan fraksi air dengan nilai ES50 fraksi etil asetat sebesar 0,22 (mg/ml) (hasil ekstrapolasi) dan nilai ES50fraksi air sebesar 0,23 (mg/ml) (hasil ekstrapolasi).
xi
ABSTRACT
Green tea contains approximately 30 % polyphenols especially from the flavonoid compound. Hydroxy phenolic group of flavonoid component in green tea makes green tea have antioxidant activity by hydroxyl radical scavenging mechanism. The aim of this research is to know antioxidant activity and value of the activity of ethyl acetate fraction and water fraction of green tea ethanolic extract by hydroxyl radical scavenging with deoxyribose method..
This research is an experimental research since the subject tested was given treatment. Method used is deoxyribose method, with Fenton’s reagent to produce hydroxyl radical that attack deoxyribose produce malondialdehid (MDA) then reacts with thiobarbituric acid (TBA) in acid condition and with heating produce pink chromogen. The absorbance of this chromogen measured at 532 nm. Antioxidant activity by hydroxyl radical scavenging from ethyl acetate and water fraction expressed as% scavengingvalue. The antioxidant activity value is known by count ES50 (50 % hydroxyl radical effective scavenging) through linear regression analysis from relation between ethyl acetate and water fraction concentration and %scavenging.
The result of this research revealed that ethyl acetate and water fraction has the antioxidant activity by hydroxyl radical scavenging with deoxyribose method. Antioxidant activity of ethyl acetate fraction has insignificant difference in comparison with water fraction, ES50 value of ethyl acetate fraction is 0.22 (mg/ml) (extrapolation result) and ES50 value of water fraction is 0.23 (mg/ml) (extrapolation result).
xii
DAFTAR ISI
HALAMAN JUDUL...ii
HALAMAN PERSETUJUAN PEMBIMBING ...iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ...ix
INTISARI... x
ABSTRACT...xi
DAFTAR ISI ...xii
DAFTAR TABEL ...xvi
DAFTAR GAMBAR ...xvii
DAFTAR LAMPIRAN ...xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 5
C. Keaslian Penelitian ... 5
D. Manfaat Penelitian ... 6
E. Tujuan Penelitian ... 6
BAB II PENELAAHAN PUSTAKA... 7
xiii
1. Klasifikasi teh dan proses pengolahannya ... 7
2. Kandungan kimia teh hijau ... 7
3. Khasiat teh hijau... 8
B. Flavonoid ... 8
1. Pengertian flavonoid ... 8
2. Flavonoid dalam teh hijau ... 9
3. Sifat antioksidan flavonoid ... 10
4. Penyarian flavonoid ... 11
C. Metode Penyarian ... 11
1. Maserasi dan remaserasi ... 11
2. Perkolasi ... 12
3. Infundasi... 12
4. Penyarian berkesinambungan... 13
D. Radikal Hidroksil (HO)... 13
1. Pengertian radikal hidroksil ... 13
2. Pembentukan radikal hidroksil... 13
3. Metode deteksi radikal hidroksil... 14
E. Metode Deoksiribosa ... 15
F. Antioksidan ... 17
G. Spektrofotometri Sinar Tampak ... 20
H. Landasan Teori ... 22
I. Hipotesis ... 24
xiv
A. Jenis dan Rancangan Penelitian ... 25
B. Variabel Penelitian ... 25
C. Definisi Operasional... 25
D. Bahan... 26
E. Alat ... 27
F. Tata Cara Penelitian ... 27
1. Pengambilan sampel………... 27
2. Pembuatan serbuk teh hijau………. ... 27
3. Preparasi sampel………... 28
a. Pembuatan ekstak etanol teh hijau ... 28
b. Pembuatan fraksi etil asetat dan fraksi air... 28
4. Persiapan uji penangkapan radikal hidroksil... 30
a. Pembuatan larutan bufer fosfat pH 7,4... 30
b. Pembuatan larutan deoksiribosa 2,5 mM ... 30
c. Pembuatan reagen Fenton ... 30
d. Pembuatan larutan TCA 5 % ... 31
e. Pembuatan larutan TBA 1 %... 31
f. Pembuatan larutan uji fraksi etil asetat 1 mg/ml... 32
g. Pembuatan larutan uji fraksi air 1 mg/ml ... 32
5. PenentuanOperatingTime(OT)... 32
6. Penentuan panjang gelombang maksimum (maks) ... 33
7. Pembuatan larutan kontrol ... 33
xv
9. Uji penangkapan radikal hidroksil oleh fraksi air ... 34
G. Analisis Data ... 35
BAB IV HASIL DAN PEMBAHASAN ... 36
A. Pengambilan Sampel ... 36
B. Pembuatan Serbuk Teh Hijau ... 37
C. Preparasi Sampel ... 37
1. Pembuatan ekstrak etanol teh hijau ... 37
2. Fraksinasi ekstrak etanol teh hijau ... 38
D. PenentuanOperating Time(OT)... 39
E. Penentuan Panjang Gelombang Maksimum (maks) ... 41
F. Uji Penangkapan Radikal Hidroksil oleh Fraksi Etil Asetat dan Fraksi Air Teh Hijau... 45
BAB V KESIMPULAN DAN SARAN... 53
A. Kesimpulan ... 53
B. Saran... 53
DAFTAR PUSTAKA ... 54
DAFTAR LAMPIRAN ... 58
xvi
DAFTAR TABEL
Hal
Tabel I. Metode dan prinsip deteksi radikal hidroksil... 14
Tabel II. Absorbansi kromogen MDA-TBA pada penambahan sampel
fraksi etil asetat dengan berbagai konsentrasi ... 46
Tabel III. Absorbansi kromogen MDA-TBA pada penambahan sampel
fraksi air dengan berbagai konsentrasi ... 46
Tabel IV. Nilai persentase penangkapan radikal hidroksil oleh
xvii
DAFTAR GAMBAR
Hal
Gambar 1. Kerangka dasar flavonoid beserta penomorannya ... 8
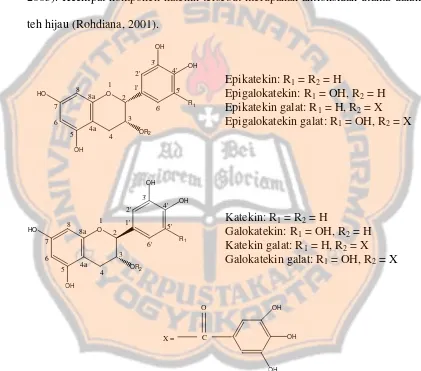
Gambar 2. Struktur kimia katekin teh dan epimernya ... 9
Gambar 3. Struktur flavonol teh... 10
Gambar 4. Struktur deoksiribosa... 15
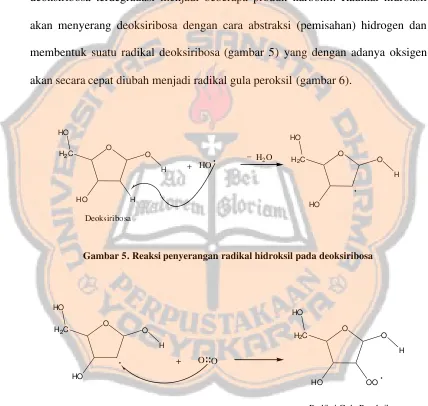
Gambar 5. Reaksi penyerangan radikal hidroksil pada deoksiribosa ... 16
Gambar 6. Reaksi pembentukan radikal gula peroksil ... 16
Gambar 7. Struktur malondialdehid (MDA) ... 17
Gambar 8. Tingkat energi elektron molekul ... 21
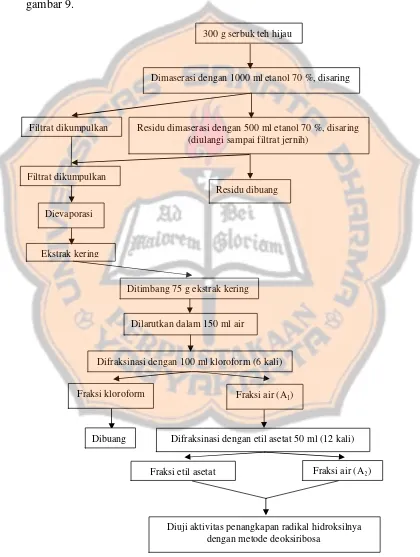
Gambar 9. Skema tata cara preparasi sampel (ekstraksi dan fraksinasi) ... 29
Gambar 10. Kurva hubungan waktu vs absorbansi pada pengukuran operating time(OT) ... 40
Gambar 11. Kurva panjang gelombang maksimum kromogen MDA-TBA ... 41
Gambar 12. Reaksi pembentukan gugus enol pada TBA ... 43
Gambar 13. Usulan reaksi pembentukan kromogen MDA-TBA... 44
Gambar 14. Struktur kromogen MDA-TBA ... 45
Gambar 15. Kurva hubungan konsentrasi fraksi etil asetat dengan %scavenging... 48
Gambar 16. Kurva hubungan konsentrasi fraksi air dengan %scavenging... 48
Gambar 17. Kurva regresi fraksi etil asetat teh hijau (hasil konversi) ... 49
Gambar 18. Kurva regresi fraksi air teh hijau (hasil konversi) ... 49
Gambar 19. Reaksi penangkapan radikal hidroksil oleh senyawa flavonoid... 51
xviii
DAFTAR LAMPIRAN
Lampiran 1. Pembuatan larutan bufer fosfat pH 7,4...58
Lampiran 2. Pembuatan larutan deoksiribosa 2,5 mM. ...59
Lampiran 3. Pembuatan reagen Fenton...60
Lampiran 4. Pembuatan larutan TCA 5 % dan TBA 1 %. ...65
Lampiran 5. Perhitungan persentase penangkapan radikal hidroksil oleh senyawa uji(% scavenging). ...66
Lampiran 6. Perhitungan penangkapan efektif radikal hidroksil sebesar 50 % (Effective Scavenging 50(ES50)) ...67
Lampiran 7. Tabel koefisien korelasi (r)...70
1
BAB I
PENGANTAR
A. Latar Belakang
Radikal bebas terutama spesies oksigen reaktif (Reactive Oxygen Species
, ROS) merupakan radikal bebas yang umum dihasilkan dalam sistem biologi,
baik melalui proses fisiologi maupun patologi. ROS dapat juga dihasilkan dari
sumber eksogen misalnya dari komponen makanan, dan radiasi ultraviolet. ROS
terdiri dari radikal superoksid (O2•-), radikal peroksil (ROO•), radikal alkoksil
(RO•), radikal oksida nitrit (NO•), dan radikal hidroksil (HO•) (Ames et al., 1993
cit Siswono, 2003). ROS bersifat reaktif karena adanya elektron yang tidak
berpasangan pada orbital terluarnya. Diantara beberapa jenis ROS tersebut,
radikal hidroksil merupakan radikal yang paling reaktif (Halliwell dan Gutteridge,
1999). Karena alasan itulah dalam penelitian ini digunakan radikal hidroksil
sebagai model radikal bebas yang berbahaya.
Secara normal radikal bebas-radikal bebas tersebut dapat diatasi oleh
antioksidan endogen (misalnya enzim superoksida dismutase, katalase, dan
glutation peroksidase). Apabila radikal bebas yang dihasilkan melebihi
kemampuan antioksidan endogen, maka akan terjadi akumulasi radikal bebas
dalam tubuh. Hal tersebut dapat menimbulkan stres oksidatif yang diketahui
berperan dalam penuaan dini dan timbulnya penyakit degeneratif seperti
artherosklerosis, penyakit jantung, dan kanker. Selama ini upaya pengobatan
dan perawatan seringkali terbatas hanya pada penghilangan gejala daripada ke
arah pencegahan penyebab penyakit (Cutler and Cutler, 2000). Berdasarkan hal
tersebut, akhir-akhir ini radikal bebas mendapat perhatian cukup besar dalam
bidang gizi, farmasi, dan kedokteran (Mulihal, 1991).
Untuk mencegah terjadinya stress oksidatif tersebut diperlukan
antioksidan eksogen yang efektif dan aman untuk membantu kerja antioksidan
endogen dalam menangkap radikal bebas. Antioksidan eksogen dapat berupa
antioksidan alami maupun antioksidan sintetik. Akhir-akhir ini diketahui bahwa
beberapa senyawa antioksidan sintetik seperti butylated hydroxy anisole (BHA)
dan butylated hydroxy toluene (BHT) telah diragukan keamanannya karena
memiliki efek samping yang besar misalnya menyebabkan kerusakan hati. Hal
tersebut mendorong tahap pengembangan antioksidan ke arah bahan-bahan alami
yang diyakini mempunyai jaminan keamanan yang lebih tinggi karena memiliki
efek samping yang minimal (Kikuzaki and Nakatani, 1993 cit Hertiani et al.,
2001).
Salah satu sumber antioksidan alami adalah teh hijau, yang merupakan
bahan minuman hasil pengolahan tanaman teh (Camellia sinensisL.). Ekstrak teh
mempunyai kemampuan yang kuat dalam menangkap ROS (Rohdiana, 2001).
Kandungan zat kimia yang paling banyak dalam teh hijau adalah senyawa
polifenol yaitu sekitar 30 % (Oki, 1996 cit Handajani, 2002). Aktivitas
antioksidan teh hijau disebabkan oleh senyawa polifenol tersebut, terutama
golongan flavonoid tipe flavanol (komponen katekin yang terdiri dari:
epikatekin (EC)) dan tipe flavonol (kuersetin, kemferol, dan mirisetin).
Berdasarkan hal tersebut, dalam penelitian ini ekstraksi dititikberatkan pada
penyarian senyawa flavonoid dalam teh hijau. Aktivitas antioksidan flavonoid teh
hijau disebabkan oleh adanya gugus hidroksi fenolik dalam struktur molekulnya.
Saat bereaksi dengan radikal bebas (dalam hal ini radikal hidroksil), flavonoid
akan membentuk radikal bebas baru yang lebih stabil, sehingga fase propagasi
dari radikal hidroksil dapat dihambat (Cuvelieret al., 1991citRohdiana, 2001).
Pada penelitian ini teh hijau diekstraksi dengan alkohol (etanol 70 %)
untuk menyari flavonoid secara optimal. Ekstrak etanol yang didapat kemudian
difraksinasi dengan kloroform untuk menghilangkan lemak dan klorofil yang
dapat mengganggu analisis (Markham, 1988). Fraksinasi berikutnya dilakukan
menggunakan etil asetat untuk memisahkan flavonoid yang berbentuk aglikon dan
flavonoid yang terikat dengan gula (bentuk glikosida) (Robinson, 1995). Proses
fraksinasi tersebut menghasilkan fraksi etil asetat dan fraksi air. Berdasarkan sifat
kelarutan sesuai dengan strukturnya, flavonoid dalam bentuk aglikon
dimungkinkan terdistribusi ke dalam fraksi etil asetat dan flavonoid dalam bentuk
glikosida terdistribusi ke dalam fraksi air. Kandungan polifenol terutama
flavonoid dalam kedua fraksi tersebut akan memberikan aktivitas penangkapan
radikal hidroksil.
Penelitian ini difokuskan untuk mengetahui aktivitas penangkapan
radikal hidroksil oleh masing-masing fraksi. Belum dapat diketahui dengan pasti
tidak dilakukan uji kualitatif secara lengkap maupun pemisahan menjadi senyawa
tunggal terhadap fraksi etil asetat dan fraksi air tersebut.
Metode yang digunakan dalam penelitian ini adalah metode deoksiribosa.
Metode ini dipilih dengan alasan menggunakan deoksiribosa sebagai substrat
yang akan diserang radikal hidroksil. Diketahui bahwa deoksiribosa merupakan
gugus gula penyusun Deoxyribo Nucleic Acid (DNA) sehingga dapat memberi
gambaran penyerangan radikal hidroksil di dalam tubuh. Selain itu, metode
tersebut telah divalidasi untuk menguji aktivitas penangkapan radikal hidroksil
oleh suatu senyawa antioksidan, seperti vitamin C (Purwantoko, 2006). Dalam
metode tersebut, deoksiribosa diserang oleh radikal hidroksil menghasilkan
produk degradasi yang apabila direaksikan dengan asam tiobarbiturat dalam
suasana asam dan dengan pemanasan akan menjadi suatu kromogen berwarna
merah muda (pink). Kromogen ini dapat diukur absorbansinya menggunakan
spektrofotometri visibel pada panjang gelombang 532 nm (Halliwellet al., 1987).
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan fraksi etil
asetat dan fraksi air ekstrak etanol teh hijau melalui uji penangkapan radikal
hidroksil dengan metode deoksiribosa, dan untuk mengetahui nilai aktivitas
penangkapannya. Aktivitas antioksidan yaitu kemampuan masing-masing fraksi
dalam menangkap radikal hidroksil dinyatakan dalam % scavenging. Nilai
aktivitas antioksidan dinyatakan sebagai konsentrasi yang diperlukan untuk
B. Perumusan Masalah
1. Apakah fraksi etil asetat dan fraksi air ekstrak etanol teh hijau mempunyai
aktivitas antioksidan melalui uji penangkapan radikal hidroksil dengan metode
deoksiribosa yang dinyatakan dengan %scavenging?
2. Berapakah nilai aktivitas antioksidan fraksi etil asetat dan fraksi air ekstrak
etanol teh hijau melalui uji penangkapan radikal hidroksil dengan metode
deoksiribosa, yang dinyatakan sebagaieffective scavenging50 (ES5 0)?
C. Keaslian Penelitian
Telah dilakukan beberapa penelitian tentang uji penangkapan radikal
hidroksil dengan metode deoksiribosa yaitu validasi metode deoksiribosa sebagai
uji penangkapan radikal hidroksil oleh vitamin C secara in vitro (Purwantoko,
2006); uji penangkapan radikal hidroksil oleh fraksi etil asetat dan fraksi air
ekstrak teh hitam dengan metode deoksiribosa (Setyawati, 2007).
Uji antioksidan melalui penangkapan radikal hidroksil dengan metode
deoksiribosa yang dilakukan berbeda dengan penelitian sebelumnya.
Perbedaannya terletak pada sampel yang digunakan, yaitu fraksi etil asetat dan
fraksi air ekstrak etanol teh hijau. Berdasarkan hal tersebut sejauh pengamatan
penulis, uji antioksidan fraksi etil asetat dan fraksi air ekstrak etanol teh hijau
melalui penangkapan radikal hidroksil dengan metode deoksiribosa belum pernah
D. Manfaat Penelitian 1. Manfaat teoritis
Melengkapi bukti-bukti ilmiah tentang aktivitas antioksidan ekstrak etanol teh
hijau terutama dari fraksi etil asetat dan fraksi air.
2. Manfaat metodologis
Memberikan informasi mengenai aplikasi penggunaan metode deoksiribosa
sebagai uji antioksidan untuk bahan-bahan alam yang mengandung banyak
senyawa.
3. Manfaat praktis
Memberikan tambahan informasi kepada masyarakat mengenai penggunaan
teh hijau sebagai sumber antioksidan alami.
E. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan yang ada, maka penelitian
ini bertujuan untuk:
1. Mengetahui aktivitas antioksidan fraksi etil asetat dan fraksi air ekstrak etanol
teh hijau melalui uji penangkapan radikal hidroksil dengan metode
deoksiribosa yang dinyatakan dengan %scavenging.
2. Mengetahui nilai aktivitas antioksidan fraksi etil asetat dan fraksi air ekstrak
etanol teh hijau melalui uji penangkapan radikal hidroksil dengan metode
7 BAB II
PENELAAHAN PUSTAKA
A. Teh Hijau
1. Klasifikasi teh dan proses pengolahannya
Teh hijau berasal dari tanaman teh yaitu dari suku Theacheae dengan
nama ilmiah Camellia sinensis L. (Syamsuhidayat dan Hutapea, 1991).
Komoditas teh dihasilkan dari pucuk daun tanaman teh melalui proses pengolahan
tertentu. Secara umum berdasarkan cara/proses pengolahannya, teh dapat
diklasifikasikan menjadi tiga jenis, yaitu teh hijau, teh oolong, dan teh hitam. Teh
hijau dibuat dengan cara menginaktivasi enzim oksidase/fenolase yang ada dalam
pucuk daun teh segar, dengan cara pemanasan atau penguapan, sehingga oksidasi
enzimatik terhadap katekin dapat dicegah. Teh hitam dibuat dengan cara
memanfaatkan terjadinya oksidasi enzimatis terhadap kandungan katekin teh. Teh
oolong dihasilkan melalui proses pemanasan yang dilakukan segera setelah proses
rolling/penggulungan daun, dengan tujuan untuk menghentikan proses fermentasi
(Hartoyo, 2003).
2. Kandungan kimia teh hijau
Zat kimia yang terkandung dalam teh hijau adalah polifenol 30 %
(katekin 0,10 %; epikatekin 0,54 %; epigalokatekin 6,35 %; epikatekin galat 1,08
O
16 %, lemak 8 %, klorofil dan pigmen 1,5 %, pati 0,5 %, serat kasar, lignin, dan
lain-lain 22% (Indrawati dan Devijanti, 1996citHandajani, 2002).
3. Khasiat teh hijau
Teh hijau berkhasiat sebagai antioksidan, antimutagenik, antibakteri,
hipokolesterolemik, dan pencegah kanker (Hartoyo, 2003).
B. Flavonoid 1. Pengertian flavonoid
Flavonoid adalah senyawa polifenol yang mengandung 15 atom karbon
dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6 yaitu dua cincin
aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat
membentuk cincin ketiga. Untuk mempermudah, cincin diberi tanda A, B, dan C
(gambar 1). Atom karbon dinomori menurut sistem penomoran yang
menggunakan angka biasa untuk cincin A dan C, serta angka beraksen untuk
cincin B, tetapi khusus untuk khalkon, sistem penomorannya dimodifikasi
(Markham, 1988).
O 2. Flavonoid dalam teh hijau
Zat bioaktif yang ada dalam teh, terutama merupakan polifenol golongan
flavonoid yaitu flavanol tipe katekin dan flavonol (Hartoyo, 2003). Komponen
katekin teh yang utama (gambar 2) adalah epigalokatekin galat (EGCG),
epikatekin galat (ECG), epigalokatekin (EGC), dan epikatekin (EC) (Hartoyo,
2003). Keempat komponen katekin tersebut merupakan antioksidan utama dalam
teh hijau (Rohdiana, 2001).
Epikatekin: R1= R2= H
Gambar 2 . Struktur kimia katekin teh dan epimernya
Flavonol utama yang ada dalam teh adalah kuersetin, kemferol, dan
O
(berikatan dengan molekul gula) dan sedikit dalam bentuk aglikonnya (Hartoyo,
2003).
Mirisetin : R1= R2= R3= OH Kuersetin : R1= R2= OH, R3= H Kemferol : R1= OH, R2= R3= H
Gambar 3. Struktur flavonol teh
3. Sifat antioksidan flavonoid
Flavonoid merupakan senyawa pereduksi yang baik dan banyak
menghambat reaksi oksidasi dan bertindak sebagai penangkap radikal yang baik
dari radikal hidroksil dan superoksida (Robinson, 1995). Flavonoid memiliki
potensial reduksi rendah (0,23 < E7 < 0,75) sehingga dapat mereduksi secara
termodinamik radikal bebas dengan potensial oksidasi sebesar 2,13-1,0 V
(Siswono, 2003).
Aktivitas sebagai antioksidan dimiliki oleh sebagian besar flavonoid
disebabkan oleh adanya gugus hidroksi fenolik dalam struktur molekulnya. Ketika
bereaksi dengan radikal bebas, flavonoid membentuk radikal baru yang
distabilisasi oleh efek resonansi inti aromatik. Hal ini menyebabkan fase
propagasi pada reaksi radikal bebas tersebut dapat dihambat (Cuvelieret al., 1991
4. Penyarian Flavonoid
Pelarut-pelarut alkoholik umumnya merupakan pelarut pilihan untuk
mengekstraksi semua golongan flavonoid. Biasanya digunakan metanol, etanol,
dan propanol. Bahan-bahan segar dapat diekstraksi dengan pelarut alkohol
absolut. Bahan-bahan kering dan berkayu dapat digunakan alkohol berair
(Harborne, 1987).
Glikosida flavonoid kurang larut dalam pelarut organik dan lebih mudah
larut dalam air dibanding bentuk aglikonnya. Pengekstraksian kembali larutan
dalam air dengan pelarut organik yang tidak bercampur dengan air tetapi agak
polar sering kali bermanfaat untuk memisahkan bentuk aglikon dari senyawa yang
lebih polar. Etil asetat merupakan pelarut yang baik untuk menangani katekin dan
proantosianidin dengan cara ini (Robinson, 1995).
C. Metode Penyarian
Metode penyarian ada beberapa macam:
1. Maserasi dan remaserasi
Maserasi merupakan cara penyarian yang sederhana, dilakukan dengan
cara merendam serbuk simplisia dalam cairan penyari. Pada saat proses maserasi,
cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaaan
konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka
larutan yang pekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi
umumnya digunakan untuk simplisia yang tidak keras, dan tidak kompak
(Anonim, 1986).
Remaserasi adalah modifikasi cara penyarian maserasi. Pada proses
remaserasi cairan penyari dibagi 2. Seluruh serbuk simplisia dimaserasi dengan
cairan penyari pertama, sesudah dienap tuangkan dan diperas, ampas dimaserasi
lagi dengan cairan penyari yang kedua (Anonim, 1986).
2. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan
cairan penyari melalui serbuk simplisia yang telah dibasahi. Aliran cairan penyari
menyebabkan adanya pergantian larutan yang mempunyai konsentrasi tinggi
dengan larutan yang konsentrasinya lebih rendah sehingga akan meningkatkan
derajat konsentrasi. Perkolasi umumnya digunakan untuk menyari simplisia keras
dan kompak (Anonim, 1986).
3. Infundasi
Infundasi adalah metode penyarian yang menggunakan penyari air
dengan pemanasan pada suhu 90 ºC selama 15 menit. Metode ini digunakan untuk
menyari simplisia yang larut dalam air dan tahan terhadap pemanasan (Anonim,
4. Penyarian berkesinambungan
Pada metode penyarian ini cairan penyari dididihkan sehingga akan
menguap dan mengembun karena adanya pendingin. Cairan penyari yang
mengembun akan turun membasahi simplisia, demikian seterusnya. Metode
penyarian ini sesuai untuk simplisia yang bahan aktifnya tahan terhadap
pemanasan (Anonim, 1986).
D. Radikal Hidroksil (HO•) 1. Pengertian radikal hidroksil
Radikal hidroksil (HO•) adalah radikal oksigen yang diketahui paling
reaktif. Radikal hidroksil memilki standar potensial reduksi positif yang tinggi
yaitu 2,31 V. Radikal hidroksil bereaksi sangat cepat dengan hampir semua tipe
molekul yang ditemukan dalam sel hidup seperti gula, asam amino, fosfolipid,
basa Deoxyribose Nucleic Acid (DNA), dan asam organik (Halliwell dan
Gutteridge, 1999). Karena sangat reaktif, efek radikal ini hanya berlangsung di
daerah yang dekat dengan tempat terbentuknya, dan dalam kondisi fisiologik
normal tidak ditemukan radikal hidroksil dalam kadar yang besar (Gitawati,
1995).
2. Pembentukan radikal hidroksil
Radikal hidroksil dapat dihasilkan dari reaksi fisi homolitik ikatan O-O
pada H2O2 yang dapat terjadi karena pengaruh panas atau radiasi ionisasi. Selain
itu, radikal hidroksil juga dapat terbentuk dari H2O2 dengan adanya ion-ion logam
Reaksi Fenton merupakan reaksi yang penting untuk menghasilkan
radikal bebas hidroksil. Dalam reaksi Fenton ion ferro (Fe2+) akan bereaksi
dengan hidrogen peroksida (H2O2) menghasilkan radikal hidroksil. Kecepatan
reaksi Fe2+ dengan H2O2 adalah rendah yaitu kurang dari 100 M-1s-1, oleh karena
itu untuk meningkatkan kecepatan reaksinya perlu ditambah dengan suatu ligan.
EDTA merupakan ligan yang baik untuk digunakan dalam reagen Fenton
(Halliwell dan Gutteridge, 1999).
3. Metode deteksi radikal hidroksil
Macam-macam metode dan prinsip deteksi radikal hidroksil dapat
dilihat pada tabel I di bawah ini:
Tabel I. Metode dan prinsip deteksi radikal hidroksil (Borset al., 1979)
No Metode Prinsip Metode
1. Metode pemucatan
p
-nitrosodimetilanilin (p-NDA)
p-nitrosodimetilanilin bereaksi cepat dengan radikal hidroksil (HO•) tetapi tidak bereaksi dengan O2- atau
singlet oksigen. Reaksi ini akan diikuti pengurangan warna kuning (pemucatan).
2. Metode deoksiribosa
Reaksi antara radikal hidroksil dengan deoksiribosa menghasilkan produk senyawa tertentu, lalu dipanaskan dengan tiobarbiturat pada pH rendah akan menghasilkan warna.
3. Metode triptofan Reaksi antara radikal hidroksil dengan triptofan menghasilkan satu set produk yang khas.
4. Metode
dimetilsulfoksida (DMSO)
Radikal hidroksil bereaksi dengan dimetilsulfoksida (DMSO) menghasilkan senyawa:
H3C S C H3
O O H
E. Metode Deoksiribosa
Deoksiribosa (2-deoksi-D-ribosa) merupakan unsur gula lima karbon
yang terdapat dalam DNA (Page, 1989). Deoksiribosa dapat didegradasi oleh
radikal hidroksil baik yang dihasilkan oleh radiasi maupun oleh reaksi Fenton
(Halliwellet al., 1987). Struktur deoksiribosa dapat dilihat pada gambar 4 berikut:
Gambar 4. Struktur deoksiribosa
Metode deoksiribosa terdiri dari dua tahap, yaitu (Halliwellet al., 1987):
1. Tahap pembentukan radikal hidroksil.
Radikal hidroksil dihasilkan dari reaksi Fenton dengan inkubasi pada 37
º
C selama 30 menit. Reagen Fenton terdiri dari FeCl3, EDTA, H2O2, dan asamaskorbat (vitamin C). Reaksi pembentukan radikal hidroksil digambarkan sebagai
berikut:
Fe3+- EDTA + vitamin C→ Fe2+- EDTA + vitamin Cteroksidasi
Fe2+- EDTA + H2O2→Fe3+- EDTA + OH¯ + HO•
Penambahan EDTA (sebagai ligan) berfungsi untuk meningkatkan
1999). Vitamin C (asam askorbat) berfungsi untuk mempercepat proses reduksi
Fe3+menjadi Fe2+sehingga akan mempercepat terbentuknya radikal hidroksil.
2. Tahap degradasi deoksiribosa
Penyerangan radikal hidroksil terhadap deoksiribosa akan menyebabkan
deoksiribosa terdegradasi menjadi beberapa produk karbonil. Radikal hidroksil
akan menyerang deoksiribosa dengan cara abstraksi (pemisahan) hidrogen dan
membentuk suatu radikal deoksiribosa (gambar 5) yang dengan adanya oksigen
akan secara cepat diubah menjadi radikal gula peroksil (gambar 6).
O
Gambar 5. Reaksi penyerangan radikal hidroksil pada deoksiribosa
O
Gambar 6. Reaksi pembentukan radikal gula peroksil
Selanjutnya, radikal gula peroksil ini akan mengalami serangkaian reaksi
ikatan C–C sehingga menghasilkan beberapa macam produk karbonil. Produk
karbonil yang dihasilkan jika dipanaskan di bawah kondisi asam akan membentuk
malondialdehid (MDA) (gambar 7).
O O
H H
Gambar 7 . Struktur malondialdehid (MDA)
MDA dapat dideteksi melalui kemampuannya untuk bereaksi dengan
asam tiobarbiturat (TBA) membentuk suatu kromogen berwarna merah muda
(pink) yang absorbansinya dapat diukur pada panjang gelombang 532 nm
(Halliwellet al., 1987).
Molekul lain yang memiliki kemampuan untuk bereaksi dengan
radikal hidroksil dapat ditambahkan ke dalam campuran tersebut. Molekul ini
dapat berkompetisi dengan deoksiribosa supaya dapat bereaksi dengan radikal
hidroksil. Hal ini sangat bergantung dari konstante kecepatan reaksinya dengan
radikal hidroksil dan juga konsentrasi relatif deoksiribosa. Jika kecepatan reaksi
molekul ini lebih cepat dibandingkan kecepatan reaksi deoksiribosa dengan
radikal hidroksil, maka molekul ini dapat berfungsi untuk menurunkan kecepatan
degradasi deoksiribosa (Halliwellet al., 1987).
F. Antioksidan
Dalam bidang kimia yang dimaksud dengan antioksidan adalah suatu
senyawa atau bahan kimia yang dapat menghambat proses oksidasi. Pada
umumnya senyawa-senyawa tersebut merupakan suatu reduktan, yakni atom atau
Dalam bidang kedokteran, pengertian antioksidan atau peredam radikal
bebas adalah senyawa-senyawa yang dapat melindungi sistem biologis terhadap
efek yang merusak dari proses-proses atau reaksi-reaksi yang dapat menyebabkan
oksidasi berlebihan (Krinsky, 1992 cit Himawati, 2001). Oleh karena itu,
pembagian antioksidan biologis tidak hanya meliputi senyawa-senyawa reduktan,
melainkan bisa meliputi pengikat logam dan enzim-enzim tertentu yang
mengkatalisis peredaman senyawa oksidan atau radikal bebas.
Antioksidan dan peredam radikal bebas biologis dapat digolongkan
sebagai berikut (Grieb, 1992citHimawati, 2001):
1. Berdasarkan sasaran
a. Antioksidan pencegah, yaitu antioksidan yang dapat mencegah
terbentuknya oksidan atau mencegah tertimbunnya oksidan. Misalnya:
superoksida dismutase (SOD), katalase, bermacam-macam enzim
peroksidase (misalnya glutation peroksidase), dan senyawa yang
mengandung gugusan sulfidril (glutation, sistein, dan kaptopril).
b. Antioksidan pemutus reaksi rantai, misalnya: vitamin E (tokoferol),
vitamin C (asam askorbat), danβ-karoten.
2. Berdasarkan mekanisme kerja
a. Antioksidan enzimatik, misalnya: katalase (CAT), superoksida dismutase
(SOD), dan glutation peroksidase (GSH-Px).
b. Antioksidan non-enzimatik, misalnya: vitamin E (α-tokoferol), vitamin C
3. Berdasarkan sifat-sifat fisiko-kimia
a. Antioksidan hidrofilik
Antioksidan hidrofilik bekerja dalam sitosol dan cairan ekstrasel, misalnya:
vitamin C, asam urat, glutation, sistein, kreatinin.
b. Antioksidan lipofilik
Antioksidan lipofilik bekerja pada membran sel (terlarut dalam lipid
membran), misalnya: vitamin E, β-karoten, ubikuinol, bilirubin, protein
pengikat logam (transferin, laktoferin, seruloplasmin, dan albumin).
4. Berdasarkan sumbernya
a. Antioksidan endogen
Beberapa antioksidan endogen yang dikenal antara lain: sitokrom oksidase
(mitokondria), superoksida dismutase, katalase, glutation peroksidase.
b. Antioksidan eksogen
Antioksidan eksogen yang telah dikenal dan beredar di pasaran
diantaranya: vitamin E, vitamin C,β-karoten.
Penangkapan radikal bebas oleh enzim dan senyawa antioksidan dapat
dilakukan melalui empat cara, yaitu (Aruoma, 2000):
1. Reaksi pemecahan ikatan.
2. Mengurangi konsentrasi ROS, sebagai contoh adalah glutation.
3. Menangkap radikal bebas, contohnya adalah enzim superoksida dismutase
menangkap radikal bebas superoksid.
G. Spektrofotometri Sinar Tampak
Spektrofotometri adalah metode analisis yang mengamati interaksi
radiasi elektromagnetik dengan materi. Spektrofotometri memiliki beberapa
ciri-ciri, yaitu dapat digunakan pada sistem organik dan anorganik, memiliki
selektivitas sedang sampai tinggi, akurasinya baik, dan mudah dilakukan (Skoog
et al., 1998). Spektrofotometri yang menggunakan radiasi dengan panjang
gelombang 380 nm sampai 780 nm disebut spektrofotometri cahaya tampak
(Anonim, 1995).
Pada umumnya prinsip kerja spektrofotometri adalah berdasarkan atas
interaksi antara radiasi elektromagnetik dengan materi (dapat berupa atom, ion,
atau molekul), sedangkan radiasi elektromagnetik merupakan salah satu jenis
energi yang ditransmisikan dalam ruang kecepatan tinggi (Khopkar, 1990).
Interaksi radiasi elektromagnetik dengan materi yaitu bila cahaya jatuh pada
senyawa maka sebagian dari cahaya diserap oleh molekul-molekul sesuai struktur
molekul (Sastrohamidjojo, 1991).
Absorbsi cahaya ultraviolet atau cahaya tampak mengakibatkan
transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar
yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi
(Fessenden dan Fessenden, 1994). Transisi elektronik senyawa organik yang
dapat terjadi yaitu transisi dari orbitalσ→σ*, π→π*, n→ σ*, dan n→π* yang
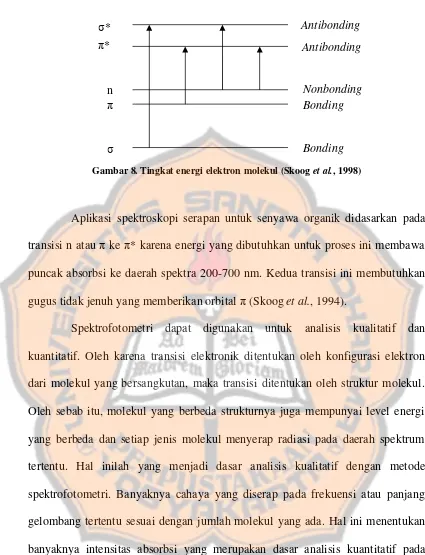
Gambar 8. Tingkat energi elektron molekul (Skooget al., 1998)
Aplikasi spektroskopi serapan untuk senyawa organik didasarkan pada
transisi n atauπ ke π* karena energi yang dibutuhkan untuk proses ini membawa
puncak absorbsi ke daerah spektra 200-700 nm. Kedua transisi ini membutuhkan
gugus tidak jenuh yang memberikan orbitalπ(Skooget al., 1994).
Spektrofotometri dapat digunakan untuk analisis kualitatif dan
kuantitatif. Oleh karena transisi elektronik ditentukan oleh konfigurasi elektron
dari molekul yang bersangkutan, maka transisi ditentukan oleh struktur molekul.
Oleh sebab itu, molekul yang berbeda strukturnya juga mempunyai level energi
yang berbeda dan setiap jenis molekul menyerap radiasi pada daerah spektrum
tertentu. Hal inilah yang menjadi dasar analisis kualitatif dengan metode
spektrofotometri. Banyaknya cahaya yang diserap pada frekuensi atau panjang
gelombang tertentu sesuai dengan jumlah molekul yang ada. Hal ini menentukan
banyaknya intensitas absorbsi yang merupakan dasar analisis kuantitatif pada
analisis dengan metode spektrofotometri (Willardet al., 1988).
Intensitas serapan dapat dinyatakan sebagai transmitan (T) yang
didefinisikan sebagai berikut:
o
II T
π* Antibonding
n Nonbonding
π Bonding
I0 adalah intensitas dari energi pancaran yang mengenai cuplikan dan I
adalah intensitas pancaran yang keluar dari cuplikan. Rumusan yang lebih tepat
untuk intensitas serapan adalah yang diturunkan dari hukum Lambert dan hukum
Beer yang dikenal dengan hukum Lambert-Beer. Hukum ini menyatakan
hubungan antara transmitan dengan tebalnya cuplikan dan konsentrasi bahan
penyerap.
Hubungan tersebut dinyatakan sebagai berikut:
b
T = persen transmitan
I0= intensitas radiasi yang datang
I = intensitas radiasi yang diteruskan ε= absorptivitas molar (L.mol-1.cm-1) c = konsentrasi larutan (mol. L-1) b = tebal larutan (cm)
A= absorbansi
(Silverstein, 1991)
H. Landasan Teori
Teh hijau diketahui mengandung sekitar 30 % polifenol terutama
golongan flavonoid tipe flavanol dan flavonol. Polifenol golongan flavonoid
tersebut menyebabkan teh hijau mempunyai aktivitas antioksidan melalui
mekanisme penangkapan radikal bebas.
Secara umum aktivitas antioksidan flavonoid disebabkan oleh adanya
hidroksil, senyawa ini akan membentuk molekul air yang stabil dan radikal baru
yang distabilisasi oleh efek resonansi inti aromatik yaitu radikal fenoksil yang
lebih stabil, sehingga fase propagasi radikal hidroksil tersebut dapat dihambat.
Selain itu, flavonoid mempunyai potensial reduksi yang sangat rendah yaitu 0,23
-0,75, sedangkan radikal hidroksil mempunyai potensial reduksi yang sangat
tinggi, yaitu 2,31 V. Hal ini menyebabkan flavonoid dapat mereduksi radikal
hidroksil menjadi bentuk yang lebih stabil dengan mudah.
Ekstraksi teh hijau menggunakan etanol akan menyari flavonoid secara
efektif, sehingga ekstrak etanol yang didapat akan mengandung flavonoid dalam
jumlah yang optimal. Fraksinasi dengan kloroform akan menghilangkan lemak
dan klorofil yang akan mengganggu analisis serta mengurangi jumlah senyawa
lain seperti alkaloid, terpena, dan xantofil, sedangkan fraksinasi menggunakan etil
asetat akan memisahkan flavonoid yang berbentuk aglikon dan flavonoid yang
terikat dengan gula (bentuk glikosida).
Berdasarkan uji polifenol pada uji tabung yang dilakukan oleh Pertiwi
(2006) diketahui bahwa fraksi etil asetat dan fraksi air menunjukkan hasil yang
positif. Hal ini mengindikasikan bahwa kedua fraksi tersebut mengandung
polifenol. Telah disebutkan bahwa polifenol utama dalam teh hijau adalah dari
golongan flavonoid. Dengan demikian, kedua fraksi tersebut mungkin
mengandung flavonoid. Berdasarkan sifat kelarutannya, flavonoid dalam bentuk
aglikon (seperti senyawa flavanol terutama komponen katekin) akan lebih
terdistribusi ke dalam fraksi etil asetat, sedangkan flavonoid bentuk glikosida
dalam fraksi air. Diketahui bahwa aktivitas antioksidan utama teh hijau berasal
dari kelas flavanol yaitu dari komponen katekin yang pada fraksinasi akan lebih
terdistribusi ke dalam fraksi etil asetat. Hal ini memungkinkan aktivitas
antioksidan fraksi etil asetat akan lebih besar dari fraksi air.
Dalam metode deoksiribosa digunakan gula deoksiribosa sebagai
substrat yang ditargetkan akan diserang oleh radikal hidroksil. Jika ada senyawa
lain yang bersifat sebagai antioksidan dan mempunyai kemampuan dalam
menangkap radikal hidroksil (seperti flavonoid) dimasukkan ke dalam sistem,
maka senyawa tersebut akan mengurangi produk degradasi deoksiribosa. Hal ini
dikarenakan senyawa tersebut akan menangkap sebagian radikal hidroksil yang
akan menyerang deoksiribosa. Efek penangkapan radikal hidroksil oleh senyawa
tersebut diperlihatkan dengan berkurangnya absorbansi kromogen MDA-TBA
yang terbentuk.
I. Hipotesis
Berdasarkan landasan teori di atas, dapat dihipotesiskan bahwa:
1. Fraksi etil asetat dan fraksi air ekstrak etanol teh hijau mempunyai
aktivitas antioksidan melalui uji penangkapan radikal hidroksil
menggunakan metode deoksiribosa.
2. Aktivitas antioksidan melalui penangkapan radikal hidroksil dengan
25 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental karena subyek uji
diberi perlakuan.
B. Variabel Penelitian
1. Variabel bebas berupa konsentrasi fraksi etil asetat dan fraksi air dari
ekstrak etanol teh hijau.
2. Variabel tergantung berupa persen penangkapan radikal hidroksil (%
scavenging).
3. Variabel pengacau terkendali berupa proses ekstraksi dan fraksinasi, suhu,
waktu inkubasi, dan merk sampel.
4. Variabel pengacau tidak terkendali berupa proses pembuatan teh hijau.
C. Definisi Operasional
1. Fraksi etil asetat adalah fase etil asetat yang diperoleh dari fraksinasi (dengan
corong pisah) ekstrak etanol teh hijau menggunakan larutan penyari etil asetat
dan air sampai fraksi etil asetat jernih.
2. Fraksi air adalah fase air yang diperoleh dari fraksinasi (dengan corong pisah)
ekstrak etanol teh hijau menggunakan larutan penyari etil asetat dan air
3. Ekstrak etanol teh hijau adalah ekstrak yang diperoleh dari remaserasi serbuk
teh hijau menggunakan etanol 70 %.
4. Larutan kontrol adalah larutan yang mengandung reagen Fenton, larutan
deoksiribosa, bufer fosfat, asam trikloroasetat, dan asam tiobarbiturat.
5. Larutan sampel adalah larutan kontrol yang diberi fraksi etil asetat dan fraksi
air dari ekstrak etanol teh hijau sebagai senyawa antioksidan.
6. Persen scavenging adalah persentase yang menyatakan kemampuan suatu
senyawa dalam menangkap radikal bebas.
% Scavenging=
7. Effective Scavenging 50 (ES50) merupakan nilai konsentrasi sampel yang
menghasilkan 50 % penangkapan radikal hidroksil.
D. Bahan
Bahan-bahan berikut berkualitas p.a. Merck: kloroform; etil asetat; ferri
klorida heksahidrat (FeCl3. 6H2O); dinatrium etilendiamin tetraasetat dihidrat
(C10H14N2Na2O8. 2H2O); L (+) asam askorbat.; asam 2-tiobarbiturat (TBA)
(C4H4N2O2S); asam trikloroasetat (TCA) (CCl3COOH); dinatrium hidrogen fosfat
(Na2HPO4); kalium dihidrogen fosfat (KH2PO4). Bahan-bahan yang lain: teh hijau
merk X; etanol 96 % kualitas farmasetis (Brataco); 2-deoksi-D-ribosa (C5H10O4)
p.a., Sigma USA; larutan hidrogen peroksida 30 % kualitas farmasetis, ph. Eur,
BP, USP; dan akuades (Laboratorium Kimia Organik Fakultas Farmasi
E. Alat
Spektrofotometer UV-Vis Perkin Elmer Lamda 20; pH meter Metrohm
632; timbangan BP 160 P, scaltec SBC 22, dan precision balance model GB-3002
(Mettler Toledo); mikropipet 10-100 l, 100-1000 l (Acura 825, Socorex);
mikropipet 0,5-5,0 ml (Socorex); tabung reaksi bertutup (Pyrex-Germany);
vaccum rotaevaporator (Buchi rotaevaporator); waterbath (Abo-Tech); blender,
dan alat-alat gelas yang lazim.
F. Tata Cara Penelitian 1. Pengambilan sampel
Diambil 100 bungkus sampel teh hijau merk X dari satu perusahaan teh
di Yogyakarta dengan nomor batch yang sama. Seluruh sampel kemudian diambil
80 % (80 bungkus) berdasarkan tabel Krecjie (Sugiyono, 2005). Pengambilan
sampel dilakukan secara acak menggunakanrandom numbers table(lampiran 8).
2. Pembuatan serbuk teh hijau
Diambil 20 bungkus (1800 g) teh hijau, dihomogenkan, digiling dan
dihaluskan menggunakan blender. Serbuk yang didapat kemudian diayak dengan
ayakan nomor mesh 12 sampai 50 (derajat halus serbuk 4/18). Serbuk yang
digunakan adalah serbuk yang berada di atas ayakan nomor mesh 50 dan di bawah
3. Preparasi sampel
a. Pembuatan ekstrak etanol teh hijau
Pembuatan fraksi etil asetat dan fraksi air diawali dengan pembuatan
ekstrak etanol teh hijau menggunakan metode penyarian remaserasi (Anonim,
1986). Serbuk teh hijau sebanyak 300 g dimaserasi dengan cara direndam dalam 1
liter etanol 70 % selama 24 jam di dalam bejana bertutup. Maserat yang didapat
disaring, filtrat dikumpulkan. Ampas dimaserasi lagi dengan 500 ml etanol 70 %
selama 24 jam, kemudian disaring, filtrat dikumpulkan, ampas dimaserasi lagi,
demikian seterusnya sampai filtrat hasil penyaringan jernih. Seluruh filtrat hasil
remaserasi dicampur dan diuapkan pelarutnya dengan rotaevaporator sampai
kental. Ekstrak kental yang didapat diuapkan di atas penangas air hingga
diperoleh ekstrak kering.
b. Pembuatan fraksi etil asetat dan fraksi air
Ekstrak etanol kering hasil remaserasi ditimbang sebanyak 75 g dan
dilarutkan dalam 150 ml air, kemudian difraksinasi dengan 100 ml kloroform
menggunakan corong pisah, dengan pengulangan 6 kali. Fraksi air (A1) yang
didapat kemudian dikumpulkan dan difraksinasi dengan 50 ml etil asetat
menggunakan corong pisah dengan pengulangan 12 kali sampai fraksi etil asetat
jernih untuk mendapatkan jumlah senyawa terlarut dalam fraksi etil asetat yang
optimum. Fraksi etil asetat dan fraksi air (A2) yang diperoleh kemudian
dikumpulkan, lalu diuapkan menggunakan rotaevaporator hingga kental. Sisa
desikator. Serbuk yang diperoleh kemudian ditimbang, dihitung rendemennya,
dan digunakan sebagai sampel untuk uji penangkapan radikal hidroksil
menggunakan metode deoksiribosa. Proses preparasi sampel dapat dilihat pada
gambar 9.
Filtrat dikumpulkan Filtrat dikumpulkan
300 g serbuk teh hijau
Ekstrak kering
Fraksi air (A2)
Dimaserasi dengan 1000 ml etanol 70 %, disaring
Residu dimaserasi dengan 500 ml etanol 70 %, disaring (diulangi sampai filtrat jernih)
Residu dibuang
Dievaporasi
Dilarutkan dalam 150 ml air
Difraksinasi dengan 100 ml kloroform (6 kali)
Fraksi kloroform Fraksi air (A1)
Ditimbang 75 g ekstrak kering
Difraksinasi dengan etil asetat 50 ml (12 kali)
Fraksi etil asetat
Diuji aktivitas penangkapan radikal hidroksilnya dengan metode deoksiribosa
Dibuang
4. Persiapan uji penangkapan radikal hidroksil a. Pembuatan larutan bufer fosfat pH 7,4
Ditimbang seksama sebanyak 1,4196 g Na2HPO4 kemudian dilarutkan
dalam akuades sampai 500,0 ml sehingga dicapai kadar 20 mM. Ditimbang
seksama lebih kurang sebanyak 0,6805 g KH2PO4 kemudian dilarutkan dalam
akuades sampai 250,0 ml sehingga dicapai kadar 20 mM. Kedua larutan tersebut
dicampur sampai didapat larutan bufer fosfat dengan pH 7,4.
b. Pembuatan larutan deoksiribosa 2,5 mM
Ditimbang seksama lebih kurang sebanyak 0,02012 g 2-deoksi-D-ribosa,
kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai kadar 15
mM. Dari larutan tersebut diambil 4,2 ml dan dilarutkan dalam akuades sampai
25,0 ml, sehingga didapat kadar 2,5 mM.
c. Pembuatan reagen Fenton
Reagen Fenton yang digunakan terdiri dari FeCl3 1 mM, EDTA 1 mM,
H2O2 20 mM, dan Vitamin C 1 mM.
1). Larutan FeCl31 mM
Ditimbang seksama lebih kurang sebanyak 0,01352 g FeCl3. 6 H2O,
kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai kadar 5
mM. Dari larutan tersebut diambil 2,0 ml dan dilarutkan dalam akuades sampai
2). Larutan EDTA 1 mM
Ditimbang seksama lebih kurang sebanyak 0,01861 g Na2EDTA. 2 H2O,
kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai kadar 5
mM. Dari larutan tersebut diambil 2,0 ml dan dilarutkan dalam akuades sampai
10,0 ml, sehingga diperoleh kadar 1 mM.
3). Larutan H2O2 20 mM
Diambil 0,091 ml H2O2 30 %, kemudian dilarutkan dalam akuades
sampai 10,0 ml sehingga dicapai kadar 80 mM. Dari larutan tersebut diambil 2,5
ml dan dilarutkan dalam akuades sampai 10,0 ml, sehingga diperoleh kadar 20
mM.
4). Larutan Vitamin C 1 mM
Ditimbang seksama lebih kurang sebanyak 0,01761 g vitamin C,
kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai kadar 10
mM. Dari larutan tersebut diambil 1,0 ml dan dilarutkan dalam akuades sampai
10,0 ml, sehingga diperoleh kadar 1 mM.
d. Pembuatan larutan TCA 5 %
Ditimbang seksama lebih kurang sebanyak 1,25 g TCA, kemudian
dilarutkan dalam akuades sampai 25,0 ml sehingga dicapai kadar 5 % b/v.
e. Pembuatan larutan TBA 1 %
Ditimbang seksama lebih kurang sebanyak 0,25 g TBA, dimasukkan ke
dipanaskan di atas hot plate hingga seluruh TBA larut. Setelah itu, dilarutkan
dalam akuades sampai 25,0 ml sehingga dicapai kadar 1 % b/v.
f. Pembuatan larutan uji fraksi etil asetat 1 mg/ml
Ditimbang seksama lebih kurang sebanyak 10 mg serbuk fraksi etil
asetat, kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai
konsentrasi 1 mg/ml.
g. Pembuatan larutan uji fraksi air 1 mg/ml
Ditimbang seksama lebih kurang sebanyak 10 mg serbuk fraksi air,
kemudian dilarutkan dalam akuades sampai 10,0 ml sehingga dicapai konsentrasi
1 mg/ml.
5. Penentuanoperating time(OT)
Diambil 600 l larutan deoksiribosa 2,5 mM, dimasukkan dalam tabung
reaksi bertutup, kemudian ditambah dengan 300 l FeCl31 mM, 300 l EDTA 1
mM, 300l H2O220 mM, 4,2 ml bufer fosfat pH 7,4, dan 300l vitamin C 1 mM.
Campuran tersebut kemudian diinkubasi pada suhu 37 C selama 30 menit.
Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %, dipanaskan dalam
waterbath pada suhu 80 C selama 30 menit sampai terbentuk kromogen
MDA-TBA yang berwarna merah muda, kemudian didinginkan, dan dibaca
absorbansinya pada panjang gelombang maksimum teoritis (maksteoritis) 532 nm
6. Penentuan panjang gelombang maksimum (maks)
Diambil 100, 300, dan 600 l larutan deoksiribosa 2,5 mM, dimasukkan
dalam tabung reaksi bertutup, kemudian masing-masing ditambah dengan 300 l
FeCl3 1 mM, 300 l EDTA 1 mM, 300 l H2O2 20 mM, bufer fosfat pH 7,4
(penambahan bufer fosfat disesuaikan dengan volume larutan deoksiribosa yang
ditambahkan sehingga volume akhir campuran adalah 6 ml), dan 300l vitamin C
1 mM. Campuran tersebut kemudian diinkubasi pada suhu 37C selama 30 menit.
Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %, dipanaskan dalam
waterbathpada suhu 80 C selama 30 menit, sampai terbentuk kromogen
MDA-TBA yang berwarna merah muda, kemudian didinginkan, dan dibaca
absorbansinya pada panjang gelombang 400-600 nm selamaoperating time.
7. Pembuatan larutan kontrol
Diambil 600 l deoksiribosa 2,5 mM, dimasukkan dalam tabung reaksi
bertutup, kemudian ditambah dengan 300 l FeCl31 mM, 300 l EDTA 1 mM,
300 l H2O2 20 mM, 4,2 ml bufer fosfat pH 7,4, dan 300 l vitamin C 1 mM.
Campuran tersebut kemudian diinkubasi pada suhu 37 C selama 30 menit.
Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %, dipanaskan dalam
waterbath pada suhu 80 C selama 30 menit sampai terbentuk kromogen
MDA-TBA yang berwarna merah muda, kemudian didinginkan, dan dibaca
absorbansinya pada panjang gelombang maksimum hasil optimasi selama
8. Uji penangkapan radikal hidroksil oleh fraksi etil asetat
Diambil fraksi etil asetat 1 mg/ml dengan volume 200, 400, 600, 800,
dan 1000 l, masing-masing dimasukkan ke dalam tabung reaksi bertutup. Ke
dalam tiap-tiap tabung tersebut kemudian ditambah dengan 600l deoksiribosa
2,5 mM, 300 l FeCl31 mM, 300 l EDTA 1 mM, 300 l H2O2 20 mM, bufer
fosfat pH 7,4 (penambahan bufer fosfat disesuaikan dengan volume larutan fraksi
etil asetat yang ditambahkan sehingga volume akhir campuran adalah 6 ml), dan
300l vitamin C 1 mM. Campuran tersebut kemudian diinkubasi pada suhu 37C
selama 30 menit. Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %,
dipanaskan dalamwaterbath pada suhu 80C selama 30 menit, sampai terbentuk
kromogen MDA-TBA yang berwarna merah muda, kemudian didinginkan, dan
dibaca absorbansinya pada panjang gelombang maksimum hasil optimasi selama
operating time.
9. Uji penangkapan radikal hidroksil oleh fraksi air
Diambil fraksi air 1 mg/ml dengan volume 200, 400, 600, 800, dan 1000
l, masing-masing dimasukkan ke dalam tabung reaksi bertutup. Kemudian ke
dalam tiap-tiap tabung tersebut ditambah dengan 600 l deoksiribosa 2,5 mM,
300 l FeCl31 mM, 300 l EDTA 1 mM, 300 l H2O2 20 mM, bufer fosfat pH
7,4 (penambahan bufer fosfat disesuaikan dengan volume larutan fraksi air yang
ditambahkan sehingga volume akhir campuran adalah 6 ml), dan 300l vitamin C
1 mM. Campuran tersebut kemudian diinkubasi pada suhu 37C selama 30 menit.
waterbathpada suhu 80 C selama 30 menit, sampai terbentuk kromogen
MDA-TBA yang berwarna merah muda, kemudian didinginkan, dan dibaca
absorbansinya pada panjang gelombang maksimum hasil optimasi selama
operating time.
G. Analisis Data
Data yang diperoleh adalah absorbansi senyawa berwarna merah muda
hasil reaksi antara produk degradasi deoksiribosa yaitu malondialdehid dengan
asam tiobarbiturat (kromogen MDA-TBA). Data absorbansi tersebut kemudian
digunakan untuk menghitung persen penangkapan radikal hidroksil (%
scavenging), dengan rumus:
% Scavenging=
kontrol larutan
Absorbansi
sampel larutan
Absorbansi
-kontrol larutan
Absorbansi
x100 %
Efektivitas penangkapan radikal hidroksil sebesar 50 % (ES50) ditentukan
dengan menggunakan persamaan garis regresi linier antara konsentrasi fraksi etil
36 BAB IV
HASIL DAN PEMBAHASAN
A. Pengambilan Sampel
Sampel dalam penelitian ini diambil dari satu merk teh hijau (merk X)
yang berasal dari satu perusahaan teh di Yogyakarta. Pengambilan sampel dari
satu merk ini bertujuan untuk mengendalikan kualitas dan kadar senyawa kimia
dalam sampel, sehingga variasi kandungan kimia dalam sampel kecil. Selain itu,
pengambilan sampel dari satu perusahaan tersebut dimaksudkan untuk
memudahkan penelusuran asal-usul sampel dan cara pengolahannya secara jelas
sehingga dapat digunakan sebagai penunjang informasi penelitian lebih lanjut.
Pengambilan sampel dalam penelitian ini dilakukan secara acak, sehingga
setiap bungkus teh hijau mempunyai kesempatan yang sama untuk diambil
sebagai sampel. Pengambilan sampel secara acak didasarkan pada random
numbers table (lampiran 8) dan mengacu pada tabel Krecjie (Sugiyono, 2005).
Jumlah teh hijau yang digunakan adalah 100 bungkus dengan nomor batch yang
sama. Berdasarkan tabel Krecjie, pengambilan sampel dari 100 populasi adalah 80
%-nya. Hal ini berarti jika digunakan 100 bungkus teh hijau maka yang diambil
sebagai sampel adalah 80 bungkus. Sampel hasil sampling tersebut kemudian
dicampur dan secara acak diambil sesuai yang diperlukan (20 bungkus) untuk
B. Pembuatan Serbuk Teh Hijau
Pembuatan serbuk bertujuan untuk meningkatkan luas permukaan
simplisia sehingga akan mengoptimalkan proses penyarian. Sampel teh hijau yang
sudah dipilih diserbuk dengan menggunakan blender, kemudian diayak dengan
derajat halus serbuk 4/18 menggunakan ayakan dengan nomor mesh 12 sampai
50. Derajat halus serbuk tersebut dipilih berdasarkan ketentuan umum Materia
Medika Indonesia (1989) jilid V, yang menyatakan jika tidak dinyatakan lain
maka simplisia harus dihaluskan menjadi serbuk 4/18. Nilai 4/18 ini menunjukkan
jumlah lubang tiap cm dihitung searah panjang kawat. Konversi derajat halus
serbuk ke nomor ayakan dilakukan dengan mengalikannya dengan 1 inci (2,54
cm). Dalam penelitian ini seharusnya digunakan ayakan dengan nomor mesh 10
sampai 45, namun karena keterbatasan alat maka nomor mesh yang digunakan
adalah nomor mesh yang mendekati yaitu 12 sampai 50.
C. Preparasi Sampel 1. Pembuatan ekstrak etanol teh hijau
Pembuatan fraksi etil asetat dan fraksi air didahului dengan proses
penyarian yang dilakukan dengan metode remaserasi (Anonim, 1986). Metode
remaserasi dipilih sebagai metode penyarian pada penelitian ini dengan alasan
simplisia yang digunakan (dalam hal ini teh hijau) tidak keras, disamping itu
metode remaserasi relatif mudah dikerjakan dan membutuhkan peralatan yang
Pada penelitian ini penyarian ditujukan untuk mengambil flavonoid dari
serbuk teh hijau, karena diketahui bahwa senyawa aktif yang berperan sebagai
antioksidan dalam teh hijau adalah flavonoid (Hartoyo, 2003). Digunakan etanol
70 % sebagai pelarut untuk menyari flavonoid dalam serbuk teh hijau, dengan
alasan flavonoid teh hijau berada dalam vakuola sel sehingga diperlukan penyari
yang bersifat relatif hidrofilik untuk menyarinya. Pelarut alkoholik terutama
etanol merupakan pelarut pilihan untuk mengekstraksi flavonoid secara optimal,
selain itu etanol tidak beracun, netral, kapang dan kuman sulit tumbuh dalam
etanol dengan kadar lebih dari 20 %.
Selama proses maserasi, zat aktif dalam serbuk teh hijau akan berdifusi
keluar dari sel karena adanya perbedaan konsentrasi zat aktif di dalam sel dan di
luar sel. Difusi ini terus berlangsung sampai terjadi keseimbangan konsentrasi zat
aktif dalam sel dengan penyari di luar sel. Maserasi yang berulang (remaserasi)
akan mengambil flavonoid secara bertahap sehingga penyarian menjadi lebih
optimal. Dari hasil ekstraksi menggunakan etanol 70 % didapatkan ekstrak etanol
dengan berat ekstrak kering sebesar 108,39 g dan rendemen sebesar 36,13 %.
2. Fraksinasi ekstrak etanol teh hijau
Etanol merupakan pelarut universal yang dapat menyari banyak senyawa
dalam tumbuhan, sehingga dimungkinkan selain flavonoid terdapat senyawa lain
yang ikut tersari walaupun mungkin hanya dalam jumlah yang kecil. Zat-zat
pengotor seperti lemak dan klorofil dinilai akan mengganggu analisis
terutama lemak dan klorofil tersebut dilakukan fraksinasi menggunakan kloroform
yang bersifat non polar.
Fraksinasi dengan kloroform menghasilkan fraksi berair yang bebas
lemak dan klorofil. Selain itu kloroform juga akan menyari senyawa selain
flavonoid seperti alkaloid, terpena, dan xantofil. Fraksi air (A1) yang didapat
dimungkinkan berisi flavonoid baik dalam bentuk aglikon maupun dalam bentuk
glikosida (terikat dengan gula). Fraksinasi dengan etil asetat terhadap fraksi air
(A1) akan memisahkan dua jenis flavonoid tersebut. Masing-masing jenis
flavonoid tersebut akan terdistribusi ke dalam salah satu pelarut sesuai dengan
sifat kelarutan dan polaritasnya. Etil asetat mempunyai polaritas yang lebih
rendah dari air, dengan demikian pada saat fraksinasi flavonoid yang berbentuk
aglikon akan lebih terdistribusi ke dalam fraksi etil asetat, sedangkan flavonoid
yang terikat dengan gula akan lebih terdistribusi ke dalam fraksi air. Hal ini
dikarenakan flavonoid yang berbentuk aglikon bersifat kurang polar dibandingkan
flavonoid yang terikat gula.
Berat serbuk kering fraksi etil asetat yang diperoleh adalah 11,52 g
dengan rendemen sebesar 5,54 %, sedangkan berat serbuk kering fraksi air adalah
21,83 g dengan rendemen sebesar 10,5 %.
D. PenentuanOperating Time(OT)
Penentuan OT bertujuan untuk mengetahui rentang waktu yang tepat
yang dapat digunakan untuk melakukan pengukuran absorbansi suatu senyawa.
yang ditunjukkan dengan nilai absorbansi yang relatif stabil juga. Dengan
demikian diharapkan pengukuran absorbansi yang dilakukan pada OT akan
meminimalkan terjadinya kesalahan analisis yang disebabkan oleh kesalahan
pengukuran. Hasil penentuan OT ini dapat dilihat pada kurva hubungan waktu vs
absorbansi yang tersaji pada gambar 10.
Gambar 10. Kurva hubungan waktuvsabsorbansi kromogen MDA-TBA pada pengukuranOperating Time(OT)
Dalam penelitian ini pengukuran absorbansi ditujukan pada senyawa
kromogen MDA-TBA yang merupakan senyawa hasil reaksi yang berwarna
merah muda (pink). Pengukuran OT dimulai dari menit ke-0 sampai menit ke-60
pada panjang gelombang maksimal teoritis 532 nm. Menit ke-0 dihitung 5 menit
setelah campuran reaksi dipanaskan pada suhu 80C dan didinginkan dengan air
mengalir untuk menghambat reaksi pembentukan kromogen MDA-TBA.
Kurva pada gambar 10 memperlihatkan nilai absorbansi kromogen
MDA-TBA yang stabil dari menit ke-0 sampai menit ke-60 dengan absorbansi
MDA-TBA berada dalam keadaan yang stabil sehingga pengukuran absorbansi yang
dilakukan selama waktu tersebut mempunyai reprodusibilitas yang tinggi.
E. Penentuan Panjang Gelombang Maksimum (maks)
Panjang gelombang maksimum merupakan panjang gelombang dari
suatu senyawa yang menghasilkan absorbansi maksimum. Pengukuran absorbansi
pada maks bertujuan untuk menghasilkan kepekaan dan keakuratan yang tinggi
karena pada panjang gelombang tersebut perubahan absorbansi yang disebabkan
oleh konsentrasi juga maksimum. Gambar 11 menyajikan data kurva panjang
gelombang maksimum yang digunakan.
Gambar 11.Kurva panjang gelombang maksimum kromogen MDA-TBA
Pada penelitian ini scanning dilakukan terhadap kromogen MDA-TBA
pada panjang gelombang antara 400-600 nm. Pengukuran panjang gelombang
125,00, dan 250,00 μM untuk memberikan gambaran yang jelas tentang
perubahan absorbansinya. Ketiga konsentrasi tersebut secara berturut-turut
menghasilkan nilai panjang gelombang maksimum 531,7, 531,7, dan 531,8 nm.
Panjang gelombang maksimum yang kemudian digunakan adalah 531,8 nm,
dengan alasan nilai inilah yang paling mendekati nilai panjang gelombang
maksimum secara teoritis (532 nm).
MDA dihasilkan saat proses inkubasi pada suhu 37 C selama 30 menit.
Digunakan suhu 37 C dengan alasan untuk menyamakan kondisi seperti pada
tubuh manusia normal. Pada inkubasi ini terjadi reaksi antara deoksiribosa dengan
radikal hidroksil yang dihasilkan dari reaksi Fenton. Radikal hidroksil akan
menyerang deoksiribosa sehingga deoksiribosa akan mengalami degradasi atau
kerusakan. Produk degradasi tersebut adalah malondialdehid (MDA) (gambar 7).
MDA merupakan senyawa yang tidak berwarna, maka perlu dilakukan
reaksi pengkoplingan yang akan memperpanjang gugus kromofor dan menambah
gugus auksokrom, sehingga menjadi senyawa yang berwarna dan dapat dideteksi
di daerah panjang gelombang sinar tampak menggunakan spektrofotometer
visibel. Dalam penelitian ini digunakan asam tiobarbiturat (TBA) sebagai
senyawa pengkopling.
Reaksi antara MDA dan TBA dilakukan dalam suasana asam dan
dengan pemanasan pada suhu 80 C. Suasana asam diperoleh dengan
menambahkan asam trikloroasetat (TCA) ke dalam campuran reaksi. Dalam hal
ini TCA mempunyai fungsi menurunkan kecepatan reaksi degradasi deoksiribosa.
radikal hidroksil juga akan terhambat. Hal ini mengakibatkan kecepatan reaksi
degadrasi deoksiribosa akan menurun, sehingga kestabilan kromogen MDA-TBA
dapat dikendalikan. Fungsi TCA yang kedua adalah sebagai katalis reaksi
pembentukan kromogen MDA-TBA.
Dalam suasana asam, gugus keton dari TBA akan berubah menjadi suatu
gugus enol (gambar 12). Dengan adanya gugus enol tersebut TBA menjadi lebih
reaktif sehingga dapat bereaksi dengan MDA melalui reaksi pengkoplingan
membentuk kromogen MDA-TBA. MDA sendiri merupakan senyawa yang tidak
berwarna, namun setelah direaksikan dengan TBA akan terjadi reaksi
pengkoplingan yang memperpanjang gugus kromofor dan menambah gugus
auksokrom sehingga menjadi berwarna merah muda. Keseluruhan reaksi tersebut
dapat dilihat pada gambar 13, sedangkan struktur kromogen MDA-TBA dapat
dilihat pada gambar 14.
N
N