SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Andy Kurniawan
NIM : 078114076
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Andy Kurniawan
NIM : 078114076
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
HALAMAN PERSEMBAHAN
I will lift up my eyes to the hills; From whence comes my help? My help comes from The Lord,
Who made heaven and earth. He will not allow your foot to be
moved;
He who keeps you will not slumber.
Prevailing prayer is almost an impossibility
where there is neglect of the study of the Word of God (Reuben Archer Torrey)
(Psalms 121 : 1-3)
Karya ini Kupersembahkan untuk :
Mama, Papa, dan kakakku tercinta
Para sahabat yang kusayangi
PRAKATA
Puji syukur Penulis panjatkan kepada Tuhan Yesus Kristus karena atas
segala berkat yang dianugerahkan-Nya, sehingga Penulis dapat menyelesaikan
skripsi berjudul “Uji Aktivitas Antioksidan Menggunakan Radikal 1,1-Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanolik Herba Seledri (Apium graveolens L.)”. Skripsi ini disusun untuk memenuhi salah satu syarat yang diwajibkan untuk memperoleh
gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Dalam membuat skripsi ini, Penulis menyadari telah mendapat banyak
bantuan, bimbingan, dukungan, dan semangat dari berbagai pihak, baik secara
langsung maupun tidak langsung. Pada kesempatan ini, dengan segala kerendahan
hati Penulis menyampaikan rasa terima kasih kepada :
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta
2. Bapak Dr. C.J. Soegihardjo, Apt., selaku Dosen Pembimbing yang telah
banyak memberikan bimbingan dan pengarahan kepada Penulis mulai
saat penyusunan proposal penelitian hingga penyelesaian skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah
memberikan kritik dan saran yang membangun dalam penyusunan skripsi
ini.
4. Ibu Lucia Wiwid Wijayanti, M.Si., selaku Dosen Penguji yang telah
5. Ibu Christine Patramurti, M.Si., Apt., dan Ibu Phebe Hendra, M.Si.,
Ph.D., Apt., yang telah berkenan meluangkan waktu untuk berdiskusi dan
memberikan masukan kepada Penulis.
6. Segenap staf pengajar, laboran, dan karyawan Fakultas Farmasi, terima
kasih atas bantuan, dukungan, dan motivasi yang diberikan kepada
Penulis serta kerja sama yang terjalin baik selama ini.
7. Rekan seperjuanganku, Damianus Listyanta Edhi Sambada dan Yosafat
Rubbyanto Widodo yang telah berjuang bersama dengan Penulis
melakukan penelitian di laboratorium menyelesaikan skripsi ini, terima
kasih untuk kebersamaan yang indah selama ini.
8. Sahabat-sahabatku, Fandri Astika Maranantan, Ardi Prasetyo, Petrus
Wicaksono, serta Anggun Aji Mukti, terima kasih atas dukungan,
semangat, dan kebersamaan kita selama ini serta suka duka yang kita
lewati bersama.
9. Teman-teman kelompok praktikum B1 FST 2007 yang dikenal dengan
“Team Fun”, terima kasih untuk kebersamaan dan keakraban kita saat
praktikum selama ini.
10. Rekan-rekan mahasiswa Fakultas Farmasi angkatan 2007 terutama kelas
FST, terima kasih untuk kebersamaan dan canda tawa yang telah kita
rasakan bersama selama ini.
11. Teman-teman KKN angkatan XL pedukuhan Destan, terima kasih untuk
kebersamaan kita dan kerjasama yang baik, walaupun hanya dalam
12. Semua pihak yang tidak dapat Penulis sebutkan satu persatu yang telah
memberikan dukungan dan bantuan sehingga skripsi ini dapat
terselesaikan.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih terdapat
banyak kekurangan. Oleh karena itu, dengan segenap kerendahan hati Penulis
memohon maaf apabila terdapat hal-hal yang kurang berkenan serta Penulis
mengharapkan saran dan kritik yang membangun.
Akhir kata, Penulis berharap semoga skripsi ini bermanfaat bagi
pihak-pihak yang membutuhkan dan dapat memberikan sumbangan bagi kemajuan ilmu
pengetahuan terutama di bidang kefarmasian.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 4
C. Keaslian Penelitian ... 4
D. Manfaat ... 5
E. Tujuan ... 6
BAB II. PENELAAHAN PUSTAKA... 7
A. Seledri ... 7
C. Antioksidan ... 10
D. Metode DPPH ... 15
E. Metode Folin-Ciocalteu ... 16
F. Ekstraksi ... 17
G. Kesahihan Metode Analisis ... 19
H. Kesalahan dalam Metode Analisis ... 22
I. Landasan Teori ... 23
J. Hipotesis ... 24
BAB III. METODE PENELITIAN ... 25
A. Jenis dan Rancangan Penelitian ... 25
B. Variabel ... 25
C. Definisi Operasional ... 25
D. Bahan dan Alat Penelitian ... 26
E. Tatacara Penelitian ... 27
1. Determinasi tanaman ... 27
2. Pengumpulan bahan ... 27
3. Preparasi sampel ... 27
4. Pembuatan larutan DPPH, pembanding, dan uji ... 28
5. Uji pendahuluan ... 29
6. Optimasi metode uji aktivitas antioksidan... 30
7. Uji aktivitas antioksidan ... 31
8. Optimasi penetapan kandungan fenolik total ... 32
F. Analisis Hasil ... 33
BAB IV. HASIL DAN PEMBAHASAN ... 36
A. Hasil Determinasi Tanaman ... 36
B. Hasil Pengumpulan Bahan ... 36
C. Hasil Pembuatan Ekstrak ... 37
D. Hasil Uji Pendahuluan ... 40
E. Optimasi Metode ... 42
1. Penentuan OT ... 42
2. Penentuan Panjang Gelombang Serapan Maksimum ... 44
F. Validasi Metode Analisis ... 47
1. Uji aktivitas antioksidan ... 47
2. Penetapan kandungan fenolik total ... 54
G. Hasil Uji Aktivitas Antioksidan dengan Metode DPPH ... 57
H. Hasil Uji Penetapan Kandungan Fenolik Total ... 63
I. Hasil Analisis Statistik ... 67
BAB V. KESIMPULAN DAN SARAN ... 69
A. Kesimpulan ... 69
B. Saran ... 69
DAFTAR PUSTAKA ... 70
LAMPIRAN ... 75
DAFTAR TABEL
Halaman
Tabel I. Rentang akurasi yang masih dapat diterima ... 20
Tabel II. Rentang KV yang masih dapat diterima... 21
Tabel III. Data recovery larutan pembanding rutin ... 49
Tabel IV. Data recovery larutan uji... 50
Tabel V. Data Coefficient of Variation (CV) larutan pembanding rutin... 51
Tabel VI. Data Coefficient of Variation (CV) larutan uji ... 52
Tabel VII. Data recovery asam galat... 55
Tabel VIII. Data Coefficient of Variation (CV) larutan asam galat ... 56
Tabel IX. Data aktivitas antioksidan rutin dengan metode DPPH ... 59
Tabel X. Data aktivitas antioksidan fraksi etil asetat ekstrak etanolik herba seledri dengan metode DPPH ... 61
Tabel XI. Tingkat kekuatan antioksidan senyawa uji dengan metode penangkapan radikal DPPH ... 63
Tabel XII. Konsentrasi asam galat dan absorbansinya setelah ditambah pereaksi Folin-Ciocalteu dan natrium karbonat yang diukur secara spektrofotometri pada panjang gelombang 750 nm... 64
DAFTAR GAMBAR
Halaman
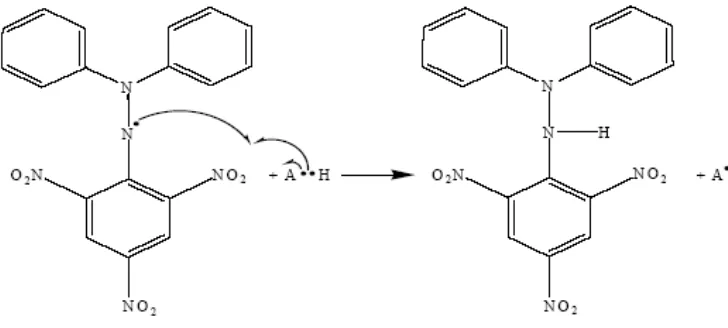
Gambar 1. Reaksi penangkapan radikal DPPH oleh antioksidan ... 14
Gambar 2. Reaksi antara karotenoid dengan oksigen reaktif ... 15
Gambar 3. Reaksi Radikal DPPH dengan antioksidan ... 16
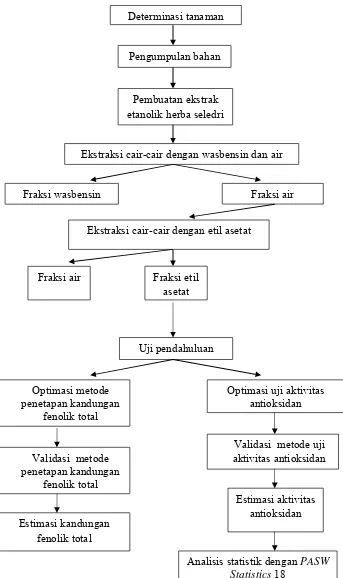
Gambar 4. Skema jalannya penelitian ... 35
Gambar 5. Uji pendahuluan senyawa fenolik ... 41
Gambar 6. Uji pendahuluan aktivitas antioksidan ... 42
Gambar 7. Kurva penentuan Operating Time (OT) uji aktivitas antioksidan ... 43
Gambar 8. Kurva penentuan Operating Time (OT) penetapan kandungan fenolik total ... 44
Gambar 9. Scanning panjang gelombang maksimum larutan DPPH ... 45
Gambar 10. Scanning panjang gelombang maksimum asam galat + pereaksi Folin-Ciocalteu + natrium karbonat ... 46
Gambar 11. Kurva regresi linier antara konsentrasi rutin dengan aktivitas antioksidannya menggunakan metode DPPH ... 48
Gambar 12. Kurva regresi linier antara konsentrasi fraksi dengan aktivitas antioksidannya menggunakan metode DPPH ... 48
Gambar 13. Kurva hubungan antara konsentrasi asam galat dengan absorbansinya setelah ditambahkan pereaksi ... 54
Gambar 14. Reaksi terbentuknya warna kuning oleh adanya antioksidan .. 58
Gambar 16. Struktur asam galat ... 63
Gambar 17. Oksidasi fenol dalam suasana basa ... 65
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat keterangan determinasi tanaman ... 75
Lampiran 2. Foto tanaman seledri ... 76
Lampiran 3. Foto percobaan ... 77
Lampiran 4. Perhitungan rendemen ... 78
Lampiran 5. Perhitungan pembuatan larutan stok DPPH ... 78
Lampiran 6. Perhitungan pembuatan larutan stok rutin ... 79
Lampiran 7. Spektra pelarut metanol ... 79
Lampiran 8. Penentuan OT rutin ... 80
Lampiran 9. Spektra larutan pembanding rutin ... 80
Lampiran 10. Perhitungan pembuatan stok larutan uji ... 81
Lampiran 11. Penentuan OT fraksi etil asetat ekstrak etanolik herba seledri ... 81
Lampiran 12. Spektra larutan uji ... 82
Lampiran 13. Perhitungan pembuatan stok asam galat ... 83
Lampiran 14. Spektra asam galat ... 83
Lampiran 15. Penimbangan larutan uji untuk penetapan kandungan fenolik total ... 84
Lampiran 16. Penentuan OT untuk penetapan kandungan fenolik total ... 84
Lampiran 17. Perhitungan kandungan fenolik total ... 84
INTISARI
Antioksidan merupakan suatu senyawa yang dapat menetralkan efek buruk dari radikal bebas di dalam tubuh. Senyawa fenolik dan flavonoid merupakan sumber antioksidan alami yang biasanya terdapat dalam tumbuhan. Herba seledri merupakan salah satu tumbuhan yang berkhasiat dalam pengobatan dan memiliki kandungan flavonoid serta senyawa golongan fenol. Hal tersebut mendorong untuk melakukan pengujian aktivitas antioksidan serta kandungan fenolik total dalam herba seledri. Pengujian aktivitas antioksidan herba seledri (Apium graveolens L.) dilakukan secara kualitatif (uji pendahuluan) maupun kuantitatif menggunakan radikal 1,1-difenil-2-pikrilhidrazil (DPPH). Prinsip metode ini adalah penurunan intensitas warna atau absorbansi larutan DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan. Hasilnya dinyatakan dengan nilai Inhibition Concentration 50 (IC50) yang menunjukkan
konsentrasi suatu senyawa antioksidan yang menghasilkan penangkapan 50% radikal DPPH. Kandungan fenolik total ditentukan dengan metode Folin-Ciocalteu. Prinsip metode ini adalah oksidasi senyawa fenol dalam suasana basa oleh pereaksi Folin-Ciocalteu menghasilkan larutan berwarna biru. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik herba seledri memiliki aktivitas antioksidan yang lemah dengan nilai IC50 sebesar 316,294
µg/mL. Kandungan fenolik totalnya sebesar 3,27 mg ekivalen asam galat per g fraksi etil asetat.
ABSTRACT
Antioxidants are compounds that can counteract the bad effects of free radicals in the body. Phenolic and flavonoid compounds is a source of natural antioxidants that are usually present in plants. Celery herb is one efficacious plant in the treatment and have the content of flavonoids and phenolic group compound. It is encouraging to test the antioxidant activity and total phenolic content in celery herb. Testing the antioxidant activity of celery herb (Apium graveolens L.) was qualitative (preliminary test) and quantitatively using 1,1-diphenyl-2-picryl hydrazyl (DPPH) radical. The principle of this method is the reduction of color intensity or absorbance of DPPH solution that proportional to the increase in the concentration of antioxidant compounds. The result is expressed with a value of Inhibition Concentration 50 (IC50) which indicates the concentration of an
antioxidant compound that produces the arrest of 50% DPPH radical. The content of total phenolic determined by the Folin-Ciocalteu method. The principle of this method is the oxidation of phenolic compounds under alkaline conditions by the Folin-Ciocalteu reagent produces a blue solution. The results showed that the ethyl acetate fraction ethanolic extract of celery herb has a weak antioxidant activity with IC50 value of 316,294 µg/mL. Total phenolic content is 3,27 mg
gallic acid equivalent per g ethyl acetate fraction.
BAB I PENGANTAR
A. Latar Belakang
Antioksidan merupakan suatu senyawa yang dapat menetralkan efek
buruk dari radikal bebas di dalam tubuh. Berdasarkan sumbernya, terdapat dua
macam antioksidan yaitu antioksidan alami dan antioksidan sintetik (buatan)
(Dalimartha dan Sudibyo, 1999). Suatu antioksidan umumnya memiliki kelebihan
pasangan elektron bebas sehingga dapat menyumbangkan elektronnya kepada
suatu radikal dan dapat menstabilkan radikal tersebut sehingga tidak lagi reaktif.
Saat ini antioksidan alami lebih diminati dibandingkan antioksidan
sintetik karena dianggap lebih aman. Antioksidan sintetik seperti BHT (butylated
hidroxy toluene) dan BHA (butylated hidroxy anisole) telah diragukan
keamanannya karena memiliki efek samping yang besar dan dapat menyebabkan
kerusakan hati. Hal ini menyebabkan antioksidan alami menjadi alternatif yang
sangat dibutuhkan oleh masyarakat saat ini (Rohdiana, 2001; Sunarni, 2005).
Antioksidan alami mampu melindungi tubuh dari kerusakan akibat
oksidasi oleh reactive oxygen species (ROS), menghambat terjadinya penyakit
degeneratif serta menghambat terjadinya peroksidasi lipid pada makanan
(Sunarni, 2005).
Radikal bebas adalah suatu spesies yang sangat reaktif karena terdapat
elektron yang tidak berpasangan pada bagian terluarnya. Hal ini mengakibatkan
memerlukan elektron yang berasal dari elektron molekul disekitarnya, sehingga
terjadi perpindahan elektron dari molekul donor ke molekul radikal bebas untuk
menjadikan molekul radikal bebas tersebut stabil. Beberapa contoh radikal bebas
antara lain: radikal hidroksil (OH·), nitrit oksida (NO·), hidrogen peroksida
(H2O2), dan sebagainya (Windono, Soediman, Yudawati, Ermawati, Srielita, dan
Erowati, 2001).
Sebenarnya dalam tubuh sendiri secara alami terdapat antioksidan
endogen seperti enzim SOD (superoxyde dismutase), glutation, dan katalase yang
dapat menetralkan radikal bebas yang masuk, akan tetapi jumlahnya terbatas
sehingga membutuhkan suplai antioksidan dari luar tubuh untuk mengatasi
paparan radikal bebas dalam jumlah yang berlebih.
Antioksidan alami dapat diperoleh dari buah-buahan maupun sayuran.
Salah satu sumber antioksidan alami dapat berasal dari herba seledri (Apium
graveolens L.). Pada seledri terdapat kandungan flavonoid seperti graveobiosid A dan B serta senyawa golongan fenol yang diketahui memiliki aktivitas
antioksidan. Selain itu pada herba seledri terdapat pula glikosida apiin (glikosida
flavon), isokuersetin, dan umbelliferon (Sudarsono dkk., 1996).
Seledri memiliki banyak manfaat untuk kesehatan, di antaranya sebagai
antihipertensi, penambah nafsu makan, peluruh air seni, mengurangi rasa sakit
pada rematik dan gout. Seledri juga sering ditambahkan sebagai sayur dan lalap
untuk penyedap masakan (Sudarsono dkk., 1996).
Etil asetat merupakan pelarut yang paling baik untuk aglikon flavonoid
tentang antioksidan herba ketul (Bidens pilosa L.), didapatkan fraksi etil asetat
memiliki aktivitas antioksidan yang paling tinggi dibandingkan rutin, fraksi
kloroform, dan ekstrak metanoliknya (Nusarini, 2007; Wiyatsih, 2007)
Metode yang digunakan untuk pengujian antioksidan pada penelitian ini
adalah metode DPPH (1,1 difenil-2-pikrilhidrazil). Berdasarkan metode ini,
kemampuan antioksidan suatu senyawa dinyatakan oleh nilai IC50. Metode DPPH
memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil.
DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna
violet gelap. Penangkap radikal bebas menyebabkan elektron menjadi
berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding
dengan jumlah elektron yang diambil (Sunarni, 2005).
Penentuan kandungan fenolik total dalam herba seledri pada penelitian
ini menggunakan metode Folin-Ciocalteu. Prinsip metode ini adalah reaksi
oksidasi senyawa fenol dalam suasana basa oleh pereaksi Folin-Ciocalteu
menghasilkan kompleks berwarna biru yang memberikan serapan kuat pada
panjang gelombang 750 nm. Intensitas warna biru yang terbentuk meningkat
sebanding dengan jumlah senyawa fenolik yang ada dalam sampel. Kandungan
B. Perumusan Masalah
Berdasarkan latar belakang di atas, permasalahan penelitian dapat
dirumuskan sebagai berikut.
1. Berapakah nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik herba
seledri dengan menggunakan radikal bebas DPPH yang dinyatakan dengan
IC50?
2. Berapakah kandungan fenolik total fraksi etil asetat ekstrak etanolik herba
seledri yang dinyatakan dengan massa ekivalen asam galat?
C. Keaslian Penelitian
Beberapa penelitian mengenai aktivitas antioksidan yang telah dilakukan
dengan menggunakan bahan tanaman seledri antara lain :
1. Penelitian mengenai aktivitas antioksidan ekstrak air beberapa tanaman.
Bahan yang digunakan adalah 25 macam tanaman, termasuk daun seledri
yang dikeringkan kemudian diblender dan diekstraksi menggunakan air
deionisasi. Metode uji aktivitas antioksidan yang digunakan adalah metode DPPH
serta Ferric reducing antioxidant potential assay. Selain itu dilakukan pula
penetapan kandungan fenolik total menggunakan metode Folin-Ciocalteu (Wong,
Leong, dan Koh, 2005).
2. Penelitian mengenai perbedaan metode untuk mengontrol dan membandingkan
aktivitas antioksidan sayur-sayuran.
Bahan yang digunakan adalah bermacam sayuran, termasuk daun seledri
format 0,2%. Metode uji aktivitas antioksidan yang digunakan adalah metode
TRAP, ORAC, dan HORAC. Dilakukan pula penetapan kandungan polifenol total
menggunakan metode Folin-Ciocalteu (Ciz et al., 2010).
3. Penelitian mengenai peningkatan aktivitas antioksidan setelah perlukaan,
tergantung jenis jaringan pada buah dan sayuran.
Bahan yang digunakan adalah bermacam buah dan sayur, termasuk
seledri yang dilukai menggunakan pisau dan disimpan pada suhu 15°C untuk
meningkatkan respon jaringan. Metode uji aktivitas antioksidan yang digunakan
adalah metode DPPH, sedangkan kandungan fenolik total ditetapkan dengan
metode Folin-Ciocalteu (Reyes, Villarreal, dan Cisneros-Zevallos, 2007).
Uji aktivitas antioksidan yang dilakukan pada penelitian ini berbeda
dengan penelitian sebelumnya. Perbedaannya terletak pada sampel yang
digunakan, yaitu fraksi etil asetat ekstrak etanol herba seledri. Berdasarkan
pengamatan penulis, uji aktivitas antioksidan dengan metode DPPH serta
penetapan kandungan fenolik total fraksi etil asetat ekstrak etanolik herba seledri
belum pernah dilakukan.
D. Manfaat 1. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan pengetahuan dan bukti
ilmiah mengenai aktivitas antioksidan fraksi etil asetat ekstrak etanolik herba
2. Manfaat metodologis
Penelitian ini dapat dijadikan acuan metode uji aktivitas antioksidan
menggunakan radikal bebas DPPH dan penentuan kandungan fenolik total pada
suatu bahan tumbuhan.
3. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi tentang aktivitas
antioksidan herba seledri, sehingga bisa dimanfaatkan sebagai salah satu alternatif
pemeliharaan kesehatan manusia.
E. Tujuan 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan serta
menetapkan kandungan fenolik total fraksi etil asetat ekstrak etanolik herba
seledri.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik
herba seledri dengan menggunakan radikal bebas DPPH yang dinyatakan
dengan IC50.
b. Mengetahui kandungan fenolik total fraksi etil asetat ekstrak etanolik herba
BAB II
PENELAAHAN PUSTAKA
A. Seledri 1. Keterangan botani
Seledri (Apium graveolens L.) termasuk dalam familia Apiaceae.
2. Nama tumbuhan
Nama latin: Apium graveolens Linn. (Anonim, 2005).
Nama Indonesia: seledri (Anonim, 2005).
Nama daerah: Jawa: sledri. Sunda: saledri (Dalimartha, 2000).
Common name: Inggris: celery. Perancis: celeri. Italia: seleri. Jerman: selinon;
parsley (Anonim, 2005).
3. Morfologi tanaman
Batang : Tidak berkayu, beralur, beruas, bercabang, tegak, hijau pucat.
Daun : Tipis majemuk, daun muda melebar atau meluas dari dasar,
hijau mengkilat, segmen dengan hijau pucat, tangkai di semua
atau kebayakan daun merupakan sarung.
Daun bunga : Putih kehijauan atau putih kekuningan ½ - ¾ mm panjangnya.
Bunga : Tunggal, dengan tangkai yang jelas, sisi kelopak yang
tersembunyi, daun bunga putih kehijauan atau merah jambu
pucat dengan ujung yang bengkok. Bunga betina majemuk yang
mempunyai daun berhadapan atau berbatasan dengan tirai
bunga.
Tirai bunga : Tidak bertangkai atau dengan tangkai bunga tidak lebih dari 2
cm panjangnya.
Buah : Panjangnya sekitar 3 mm, batang angular, berlekuk, sangat
aromatik.
Akar : Tebal (Iqbal dan Endang, 2008).
4. Kandungan kimia seledri
Seluruh herba seledri mengandung glikosida apiin (glikosida flavon),
isoquersetin, dan umbeliferon. Juga mengandung manitol, inositol, asparagina,
glutamina, choline, linamarose, pro vitamin A, vitamin C, dan B. Kandungan
asam-asam dalam minyak atsiri pada biji antara lain asam-asam lemak
terutama palmitat, oleat, linoleat, dan petroselinat. Senyawa kumarin lain
ditemukan dalam biji, yaitu bergapten, seselin, isomperatorin, osthenol, dan
isopimpinelin (Sudarsono dkk., 1996).
5. Kegunaan seledri
Secara tradisional tanaman seledri digunakan sebagai pemacu enzim
pencernaan atau sebagai penambah nafsu makan, peluruh air seni, dan penurun
tekanan darah. Di samping itu digunakan pula untuk memperlancar keluarnya
air seni, mengurangi rasa sakit pada rematik dan gout. Selebihnya daun dan
batang seledri digunakan sebagai sayur dan lalap untuk penyedap masakan
B. Senyawa Fenolik
Senyawa fenolik adalah substansi organik dimana terdiri dari senyawa
aromatik yang terikat dengan satu atau lebih substituen hidroksil (OH). Senyawa
induk adalah fenol tetapi kebanyakan senyawa fenolik merupakan polifenol.
Sumber senyawa fenolik sangat sedikit pada sumber hewani akan tetapi sangat
melimpah pada sumber tumbuhan. Diantara 8000 senyawa polifenol tumbuhan
yang diketahui, golongan yang terbanyak adalah flavonoid (Mann, Davidson,
Hobbs, Banthorpe, dan Harborne, 1994).
Senyawa fenolik merupakan sumber antioksidan alami yang aman
digunakan sehingga menjadi senyawa bioaktif dari suatu tumbuhan. Oleh karena
itu, pada perkembangan penelitian akhir-akhir ini, perhatian peneliti telah tertuju
pada identifikasi tumbuhan yang memiliki aktivitas antioksidan yang dapat
digunakan untuk konsumsi manusia sehari-hari (Ebrahimzadeh, Pourmorad,
Hafezi, 2007).
Aktivitas antioksidan dari senyawa fenolik didapatkan dengan cara
mereduksi radikal untuk tidak terjadinya reaksi samping yang merugikan. Untuk
transfer atom hidrogen, senyawa fenolik mampu mengikat radikal bebas dengan
mendonasikan atom hidrogen dalam transfer elektron tunggal dari senyawa
fenolik kepada elektron tunggal dari radikal bebas (Marxen et al., 2007).
Kandungan fenolik total dalam suatu sampel dapat diukur secara
kolorimetri dengan metode Folin-Ciocalteu. Prinsip metode ini adalah adanya
reduksi kimia reagen fenol yaitu campuran asam fosfomolibdat-fosfotungstat oleh
serapan kuat pada panjang gelombang 750 nm. Intensitas serapan pada panjang
gelombang tersebut proporsional dengan jumlah senyawa fenolik dalam sampel
(Waterhouse, 2002).
C. Antioksidan
Definisi antioksidan secara umum adalah senyawa yang melawan
oksidasi atau menghambat reaksi yang dipicu oleh oksigen atau peroksida.
Kebanyakan senyawa ini (misalnya tokoferol) digunakan sebagai pengawet dalam
berbagai produk (misalnya dalam lemak, minyak dan produk makanan untuk
menunda ketengikan dan perubahan-perubahan yang tidak diinginkan, dalam karet
untuk menunda oksidasi) (Huang, Ou, dan Prior, 2005).
Antioksidan juga dapat didefinisikan sebagai senyawa yang apabila
dalam konsentrasi rendah berada bersama substrat yang dapat teroksidasi, dapat
menunda atau menghambat oksidasi senyawa tersebut (Halliwell, 1994).
Secara garis besar, mekanisme penangkapan radikal bebas dapat
dibedakan menjadi dua macam, yaitu secara enzimatik dan non-enzimatik. Enzim
yang dapat berperan sebagai antioksidan adalah superoxyde dismutase (SOD);
glutation peroksidase, katalase, tioredoksin reduktase dan peroksiredoksin
(Masella, Di Benedeto, Vari, Filesi, dan Giovannini, 2005). Secara non-enzimatik,
senyawa antioksidan bekerja melalui empat cara, yaitu sebagai :
a. Penangkap radikal bebas, misalnya vitamin C dan vitamin E.
c. Inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen.
d. Kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
peroksidase (Huang et al., 2005).
Aktivitas senyawa polifenol (flavonoid) sebagai antioksidan meliputi tiga
mekanisme sebagai berikut.
a. Aktivitas penangkapan radikal seperti reactive oxygen species (ROS) ataupun
radikal yang dihasilkan dari peroksidasi lipid seperti R·, RO·, dan ROO·
dengan proses transfer elektron melalui atom hidrogen.
b. Mencegah spesies senyawa reaktif produksi katalisis transisi metal seperti
reaksi melalui khelasi metal.
c. Interaksi dengan antioksidan lainnya, seperti lokalisasi dan penggabungan
dengan antioksidan lainnya (Niki dan Noguchi, 2000).
Antioksidan dan peredam radikal bebas biologis dapat digolongkan
sebagai berikut (Grieb, 1992 dan Himawati, 2001).
a. Berdasarkan sasaran
1) Preventative antioxidant, yaitu antioksidan yang dapat mencegah
terbentuknya oksidan dan mencegah tertimbunnya oksidan. Misalnya :
superoksida dismutase (SOD), katalase, bermacam-macam enzim
peroksidase (misalnya glutation peroksidase), dan senyawa yang
mengandung gugusan sulfidril (glutation, sistein, dan kaptopril).
2) Chain-breaking antioxidant, mekanismenya sebagai berikut.
L· + AH → LH + A·
LOO· + AH → LOOH + A·
Antioksidan (AH) akan mencegah dua tahapan meliputi tahapan inisiasi
terjadi ketika radikal beraksi dengan Lipid (L) dan proses propagasi
(beraksi dengan alkoksi (LO·) ataupun peroksil (LOO·) (Madhavi et al.,
1996).
b. Berdasarkan mekanisme kerja
1) Antioksidan enzimatik, misalnya : katalase (CAT), superoxyde dismutase
(SOD), dan glutation peroksidase (GSH-Px).
2) Antioksidan non-enzimatik, misalnya: vitamin E (α-tokoferol), vitamin C
(asam askorbat), dan β-karoten.
c. Berdasarkan sifat-sifat fisiko-kimia
1) Antioksidan hidrofilik, yaitu antioksidan yang bekerja dalam sitosol dan
cairan ekstrasel, misalnya: vitamin C, asam urat, glutation, sistein,
kreatinin.
2) Antioksidan lipofilik, yaitu antioksidan yang bekerja pada membran sel
(terlarut dalam lipid membran), misalnya: vitamin E, β-karoten, ubikuinon,
bilirubin, protein pengikat logam (transferin, laktoferin, seruloplasmin, dan
albumin).
Terdapat beberapa metode pengujian aktivitas antioksidan baik secara
kualitatif maupun secara kuantitatif. Uji kualitatif untuk mengetahui apakah suatu
senyawa memiliki aktivitas antioksidan dapat dilakukan dengan metode
kromatografi baik kromatografi lapis tipis atau kromatografi kertas. Metode ini
Pereaksi semprot yang digunakan untuk deteksi dapat dibedakan menjadi empat
kelompok, yaitu :
a. senyawa-senyawa yang dapat membentuk warna ketika tereduksi (kalium
permanganat, ferri-sianida, ferri-dipiridil, dan asam fosfomolibdat);
b. senyawa yang dapat berikatan dengan senyawa fenol, seperti senyawa diazo,
pereaksi diazo, magnesium sulfat, anisaldehid, vanillin dan pereaksi Gibbs
yang membentuk indofenol (akan membentuk garam berwarna dalam kondisi
basa);
c. radikal bebas stabil yang menerima radikal hydrogen dari antioksidan
(1,1-difenil-2-pikrilhidrazil);
d. senyawa-senyawa yang membentuk senyawa adisi yang berwarna (paladium
klorida) (Davidek, 1997).
Uji aktivitas antioksidan dapat dilakukan secara spektrofotometri.
Beberapa uji kuantitatif untuk mengetahui aktivitas suatu antioksidan adalah
sebagai berikut.
1. Pengujian penangkapan radikal (radical scavenging test)
Uji ini dilakukan dengan cara mengukur penangkapan radikal sintetik dalam
pelarut organik polar seperti metanol atau etanol dalam suhu kamar. Radikal
sintetik yang sering digunakan adalah DPPH (1,1-difenil-2-pikrilhidrazil).
Dasarnya adalah kemampuan suatu senyawa untuk menangkap radikal DPPH.
DPPH memberikan warna violet pada panjang gelombang 517 nm.
kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah
elektron yang diambil.
Gambar 1. Reaksi penangkapan radikal DPPH oleh antioksidan
2. Pengujian aktivitas antioksidan dengan sistem linoleat tiosianat
Prinsip : pengukuran intensitas warna kompleks feritiosianat yang terbentuk
dari reaksi ion feri dengan amonium tiosianat. Ion feri terbentuk dari oksidasi
ion fero oleh peroksida yang berasal dari oksidasi asam linoleat. Kompleks
feritiosianat yang berwarna merah diukur absorbansinya pada panjang
gelombang 490 nm. Semakin tinggi absorbansinya (warna merah yang
terbentuk semakin pekat) menunjukkan semakin banyak peroksida yang
terbentuk. Dengan adanya senyawa yang berperan sebagai antioksidan
intensitas warna yang terbentuk semakin rendah.
3. Pengujian dengan asam tiobarbiturat,
Prinsip uji ini adalah reaksi malondialdehid dengan asam tiobarbiturat
menghasilkan kromogen merah muda yang dapat diukur absorbansinya pada
panjang gelombang 532 nm. Malondialdehid terbentuk dari asam lemak bebas
tidak jenuh dengan paling sedikit mempunyai tiga ikatan rangkap. Adanya
senyawa yang bersifat antioksidan akan menghambat terbentuknya
4. Pengujian dengan sistem β-karoten-linoleat
Pengujian ini dilakukan dengan mengamati kecepatan pemucatan warna β
-karoten. Karotenoid dapat meredam oksigen yang reaktif menghasilkan
oksigen yang lebih stabil. Energi dari oksigen tersebut dipindahkan ke senyawa
karotenoid. Energi tersebut dilepaskan melalui interaksi rotasional dan
vibrasional antara karotenoid dengan pelarut untuk mengembalikan karotenoid
ke ground state.
Gambar 2. Reaksi antara karotenoid dengan oksigen reaktif
D. Metode DPPH
Radikal bebas yang umumnya digunakan sebagai model dalam penelitian
antioksidan atau peredam radikal bebas adalah 1,1-difenil-2-pikrilhidrazil (DPPH)
(Windono et al., 2001).
DPPH merupakan radikal bebas yang stabil (dengan atom N di tengah)
serta dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen,
dapat berguna untuk pengujian aktivitas antioksidan komponen tertentu dalam
suatu ekstrak (Dinis, Maderia, dan Almeida, 1994).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh
keberadaan penangkap radikal bebas, maka absorbansinya menurun secara
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning
(Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Perubahan absorbansi akibat reaksi ini telah digunakan secara luas untuk
menguji kemampuan beberapa molekul sebagai penangkap radikal bebas (Dinis,
et al., 1994). DPPH merupakan metode yang mudah, cepat, dan sensitif untuk
pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman (Koleva,
van Beek, Linssen, de Groot, dan Evstatieva, 2002).
Gambar 3. Reaksi Radikal DPPH dengan antioksidan (Windono et al., 2001).
E. Metode Folin-Ciocalteu
Metode Folin-Ciocalteu merupakan oksidasi atau reduksi kolorimetrik
untuk mengukur semua senyawa fenolik. Pereaksi Folin-Ciocalteu merupakan
larutan kompleks ion polimerik yang dibentuk dari asam fosfomolibdat dan asam
heteropolifosfotungstat. Pereaksi ini terbuat dari air, natrium tungstat, natrium
molibdat, asam fosfat, asam klorida, litium sulfat, dan bromin (Folin dan
yang memiliki bentukan umum dengan pusat unit tetrahedral fosfat (PO4)3- yang
dikelilingi oleh beberapa unit oktahedral asam-oksi molibdenum. Struktur
tungsten dapat dengan bebas bersubstitusi dengan molibdenum (Singleton dan
Rossi, 1965).
Menurut Waterman dan Mole (cit. Khadambi, 2007), dasar metode
Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Pereaksi ini mengoksidasi
fenolat (garam alkali), mereduksi asam heteropoli menjadi suatu kompleks
molibdenum-tungsten (Mo-W). Fenolat hanya terdapat pada larutan basa, tetapi
pereaksi Folin-Ciocalteu dan produknya tidak stabil pada kondisi basa. Selama
reaksi belangsung, gugus fenolik-hidroksil bereaksi dengan pereaksi
Folin-Ciocalteu, membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru
dengan struktur yang belum diketahui dan dapat dideteksi dengan
spektrofotometer (Jansoon, 2005). Warna biru yang terbentuk akan semakin pekat
setara dengan konsentrasi ion fenolat yang terbentuk, artinya semakin besar
konsentrasi senyawa fenolik maka semakin banyak ion fenolat yang akan
mereduksi asam heteropoli sehingga warna biru yang dihasilkan semakin pekat
(Box, 1983; Singleton dan Rossi, 1965).
F. Ekstraksi
Penyarian atau ekstraksi merupakan suatu peristiwa perpindahan massa
zat aktif yang semula berada di dalam sel kemudian ditarik oleh cairan penyari
bertambah baik jika permukaan simplisia yang bersentuhan dengan penyari
semakin luas (Harborne, 1987).
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi
zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
selanjutnya pelarut diuapkan sampai semua atau hampir semua pelarut menguap
(Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
Dalam memilih cairan penyari, seseorang harus mempertimbangkan
banyak faktor. Cairan penyari yang baik harus memenuhi kriteria berikut ini.
(1) Murah dan mudah diperoleh,
(2) stabil secara fisika dan kimia,
(3) bereaksi netral,
(4) tidak mudah menguap dan tidak mudah terbakar,
(5) selektif,
(6) tidak mempengaruhi zat berkhasiat, dan
(7) diperbolehkan oleh peraturan yang berlaku
(Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
Metode penyarian yang digunakan tergantung dari wujud dan kandungan
zat dari bahan yang akan disari. Cara penyarian dapat dibedakan menjadi :
infundasi, maserasi, perkolasi, dan penyarian berkesinambungan (Direktorat
Jenderal Pengawasan Obat dan Makanan RI, 1986).
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan
dengan cara merendam serbuk simplisia dalam cairan penyari sehingga cairan
mengandung zat aktif di dalam sel dengan yang di luar sel mengakibatkan
pendesakan larutan terpekat dari dalam sel ke luar sel. Peristiwa tersebut berulang
sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam
sel. Dapat dilakukan modifikasi terhadap teknik maserasi, misalnya teknik
remaserasi. Pada teknik ini, cairan dibagi menjadi dua kemudian seluruh serbuk
simplisia dimaserasi dengan cairan penyari pertama, sesudah dienaptuangkan dan
diperas, ampas dimaserasi lagi dengan cairan penyari kedua (Direktorat Jenderal
Pengawasan Obat dan Makanan RI, 1986).
G. Kesahihan Metode Analisis
Kesahihan metode analisis diartikan sebagai suatu prosedur yang
digunakan untuk membuktikan bahwa metode analisis tersebut dapat memberikan
hasil seperti yang diharapkan dengan kecermatan dan ketelitian yang memadai.
Metode analisis instrumen merupakan metode yang terpilih dan memadai untuk
mengantisipasi persoalan analisis yaitu sangat kecilnya kadar senyawa yang
dianalisis dan kompleksnya matriks sampel yang dianalisis (Mulja dan Suharman,
1995). Untuk itu diperlukan suatu pedoman mengenai kesahihan metode analisis
yang didukung oleh parameter-parameter di bawah ini.
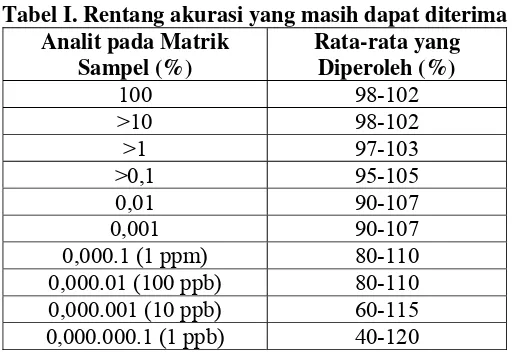
1. Akurasi
Akurasi metode analisis adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan
Kriteria kecermatan sangat bergantung kepada konsentrasi analit dalam matriks
sampel dan pada keseksamaan metode (RSD) (Harmita, 2004).
Tabel I. Rentang akurasi yang masih dapat diterima Analit pada Matrik
Presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil
uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari
campuran yang homogen (Harmita, 2004).
Presisi dari suatu metode analisa meliputi repeatabilitas, presisi antara,
dan reproduksibilitas. Repeatabilitas menyatakan presisi metode analisis yang
dilakukan dalam kondisi yang sama dalam interval waktu yang singkat. Dengan
kata lain uji repeatabilitas dilakukan untuk mengetahui variabilitas data yang
dihasilkan pada dua pengujian berurutan pada kondisi yang sama. Perbedaan
absolut kedua data hasil uji diharapkan berada pada kisaran tingkat kepercayaan
(konfidensi) 95%. Presisi antara menyatakan variasi dalam yang sama baik hari,
Reproduksibilitas adalah uji yang dilakukan untuk mengetahui
variabilitas yang dihasilkan pada dua pengujian contoh identik pada kondisi
berbeda. Perbedaan absolut dari masing-masing data hasil uji diharapkan berada
dalam kisaran tingkat kepercayaan (konfidensi) 95% (Anonim, 2008).
Tabel II. Rentang KV yang masih dapat diterima Analit pada Matrik Sampel (%) KV (%)
>1 2,5 0,001 5
0,000.1 (1 ppm) 16
0,000.000.1 (1 ppb) 32
(Harmita, 2004).
3. Linearitas
Linearitas dari suatu prosedur analisis merupakan kemampuannya (pada
rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional
dengan konsentrasi (jumlah) analit di dalam sampel (Mulja dan Hanwar, 2003).
Persyaratan data linearitas yang dapat diterima jika memenuhi nilai koefisien
korelasi (r) yang diperoleh dari hasil analisis > 0,999 (Anonim, 2004).
4. Range (Kisaran)
Range adalah interval antara kadar terendah sampai kadar tertinggi dari
suatu analit yang masih dapat diukur secara kuantitatif menggunakan metode
tertentu yang masih dapat menghasilkan akurasi, presisi, dan linearitas yang
mencukupi. Biasanya range memiliki satuan yang sama dengan satuan yang
digunakan pada metode analisis, misalnya persen atau ppm (United States
H. Kesalahan dalam Metode Analisis
Kesalahan dalam metode analisis sangat sukar untuk dihilangkan namun
sumber kesalahan tetap harus ditekan seminimal mungkin. Kesalahan dalam
analisis kimia dapat dikategorikan menjadi dua kelas utama, yaitu:
1. Kesalahan sistemik.
Kesalahan sistemik adalah hasil analisis yang menyimpang secara tetap
dari harga kadar yang sebenarnya karena proses pelaksanaan prosedur analisis,
sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja dan Suharman,
1995). Kesalahan sistematik dapat disebabkan oleh beberapa faktor, antara lain:
a. Kesalahan personil dan operasi. Kesalahan ini disebabkan oleh cara
pelaksanaan analisis, bukan karena metode. Kesalahan operasi umumnya bersifat
fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir
titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Jadi kesalahan ini
bersifat individual dan sangat dipengaruhi oleh ketrampilan analis dalam
melakukan pekerjaan analisis.
b. Kesalahan alat dan pereaksi. Kesalahan ini disebabkan oleh pereaksi yang
kurang murni, alat yang kurang valid atau pemakaian alat yang kurang tepat
walaupun alatnya sendiri baik, contohnya pengambilan volume tepat dengan pipet
ukur atau gelas ukur, penggunaan buret 50 mL (buret makro) untuk analisis
mikro, dan sebagainya.
c. Kesalahan metode analisis. Kesalahan ini dapat disebabkan oleh kesalahan
pengambilan sampel, kesalahan akibat reaksi kimia yang tidak sempurna, atau
Kesalahan sistematik dapat dihindari atau diperkecil dengan cara sebagai
berikut.
(a) Mengkalibrasi instrumen dan melakukan koreksi secara berkala (biasanya
tiap bulan atau disesuaikan dengan frekuensi pemakaian alat).
(b) Memilih metode dan prosedur standar dari badan resmi.
(c) Mamakai bahan kimia dengan derajat untuk analisis.
(d) Meningkatkan pengetahuan dan ketrampilan para analis.
(e) Melakukan penetapan blangko atau kontrol dengan zat baku.
(f) Melakukan penetapan paralel (in duplo atau in triplo) (Mulja dan Suharman,
1995).
2. Kesalahan tidak sistemik
Kesalahan tidak sistematik adalah penyimpangan yang tidak tetap dari
hasil penentuan kadar dengan instrumen yang disebabkan fluktuasi dari
instrument yang dipakai. Penyebab kesalahan ini tidak dapat ditentukan dan tidak
dapat dikontrol maka kesalahan ini disebut juga kesalahan acak (Mulja dan
Suharman, 1995).
I. Landasan Teori
Herba Seledri (Apium graveolens L.) memiliki kandungan flavonoid
seperti graveobiosid A dan B serta senyawa golongan fenol yang diketahui
memiliki aktivitas sebagai antioksidan. Antioksidan adalah senyawa yang dapat
menangkal efek buruk dari radikal bebas, hal ini dikarenakan pada senyawa
untuk menetralkan radikal bebas sehingga menjadi tidak reaktif. Hal tersebut
mendorong untuk dilakukan penelitian terhadap herba seledri terutama untuk
mengetahui aktivitas antioksidan yang dimilikinya.
Metode pengujian antioksidan yang umum digunakan terutama untuk
senyawa dari bahan alam adalah metode DPPH. Metode ini menggunakan sumber
radikal bebas berupa senyawa 1,1-difenil-2-pikrilhidrazil (DPPH). Metode ini
memiliki kelebihan yaitu mudah, cepat, dan sensitif untuk pengujian aktivitas
antioksidan senyawa tertentu atau ekstrak tanaman.
Kandungan fenolik total dapat ditentukan dengan metode
Folin-Ciocalteu. Adanya senyawa fenolik dalam sampel uji akan mereduksi reagen asam
fosfomolibdat-fosfotungstat menjadi produk berwarna biru. Intensitas warna biru
yang dihasilkan sebanding dengan kandungan fenolik yang terdapat dalam sampel
uji.
J. Hipotesis
Fraksi etil asetat ekstrak etanolik herba seledri mempunyai aktivitas
antioksidan melalui pengujian dengan metode DPPH dan dapat digunakan sebagai
sumber baru senyawa antioksidan alami. Kandungan fenolik dalam fraksi etil
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena subjek uji
diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi etil asetat ekstrak etanolik herba
seledri.
2. Variabel tergantung berupa aktivitas antioksidan dan kandungan fenolik total
fraksi etil asetat ekstrak etanolik herba seledri.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
pemanenan,umur tanaman, dan cara panen.
4. Variabel pengacau tidak terkendali berupa cahaya matahari dan cuaca.
C. Definisi Operasional
1. Ekstrak etanolik herba seledri adalah sari hasil proses maserasi herba seledri
dengan penyari etanol.
2. Fraksi etil asetat adalah hasil fraksinasi ekstrak etanolik herba seledri dengan
menggunakan etil asetat.
3. Persen inhibition concentration (%IC) adalah persen yang menyatakan
kemampuan fraksi etil asetat ekstrak etanolik herba seledri untuk menangkap
4. Inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil asetat
ekstrak etanolik herba seledri yang menghasilkan penangkapan 50% radikal
DPPH.
D. Bahan dan Alat Penelitian 1. Bahan
Bahan yang digunakan dalam penelitian ini adalah: herba seledri
(Apium graveolens L.) yang diambil dari daerah Banyuroto di Muntilan;
akuades (Laboratorium Kimia Analisis Instrumental Fakultas Farmasi
Universitas Sanata Dharma); bahan kualitas p.a. E. Merck yaitu: methanol,
asam galat; bahan kualitas p.a. Sigma Chem. Co., USA, yaitu: DPPH
(1,1-difenil-2-pikrilhidrazil), reagen Folin-Ciocalteu dan rutin; bahan kualitas teknis
Brataco Chemica, yaitu: wasbensin dan etil asetat; bahan kualitas teknis CV.
General Labora, yaitu: metanol; dan aluminium foil.
2. Alat
Alat yang digunakan dalam penelitian ini adalah: blender, neraca
analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Janke &
Kunkel), waterbath (labo-tech, Heraeus), vortex (Janke & Kunkel),
spektrofotometer UV-Vis (Perkin Elmer Lamda 20), corong Buchner, oven,
mikropipet 10-1000µL; 1-10mL (Acura 825, Socorex), tabung reaksi bertutup,
dan alat-alat gelas yang lazim digunakan di laboratorium analisis
E. Tatacara Penelitian 1. Determinasi tanaman
Determinasi tanaman seledri dilakukan di Laboratorium Biologi Farmasi,
Fakultas Farmasi USD menurut Backer dan Bakhuizen van den Brink (1963) serta
Backer dan Bakhuizen van den Brink (1965).
2. Pengumpulan bahan
Tanaman seledri diperoleh dari daerah Banyuroto di Muntilan.
Pengumpulan pada musim kemarau bulan September. Pemanenan dilakukan pada
tanaman yang menjelang berbunga saat pagi hari, dipilih herba seledri yang masih
segar, berwarna hijau, serta tidak layu.
3. Preparasi sampel
Sebanyak 1 kg herba seledri segar, dibersihkan, kemudian dihaluskan
dengan blender. Ketika dihaluskan, herba tersebut ditambahkan sedikit cairan
penyari (etanol). Simplisia yang telah dihaluskan dituang ke dalam bejana
maserasi, ditambah etanol sampai terendam sempurna, dan dicampur homogen.
Campuran dimaserasi pada suhu ruangan selama dua hari. Filtrat diperoleh
melalui penyaringan menggunakan kertas saring kasar dengan bantuan corong
Buchner dan pompa vakum. Ampas penyaringan diremaserasi dengan etanol
secukupnya selama dua hari. Kemudian filtratnya dicampurkan dengan filtrat
terdahulu. Keseluruhan filtrat yang diperoleh diuapkan pelarutnya hingga
diperoleh ekstrak etanol herba seledri.
Ekstrak etanol herba seledri ditambah 300 mL air hangat dan dilakukan
wasbensin (1:1 v/v), kemudian didiamkan sampai terpisah sempurna. Fase air
akan berada pada bagian bawah, sedangkan fase wasbensin berada pada bagian
atas.
Dari hasil ekstraksi cair-cair tersebut diperoleh dua fraksi, yaitu fraksi
wasbensin dan fraksi air. Selanjutnya fraksi air diekstraksi lagi menggunakan etil
asetat dengan perbandingan larutan fraksi air : etil asetat (1:1 v/v) sehingga
didapatkan fraksi air dan etil asetat. Setelah dipisahkan fraksi etil asetat diuapkan
dengan vacuum rotary evaporator. Lalu fraksi yang telah kering digunakan untuk
dianalisis lebih lanjut.
4. Pembuatan larutan DPPH, pembanding, dan uji
a. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh
larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan
alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok rutin
Sebanyak 2,5 mg stok rutin ditambahkan metanol p.a sampai 10,0 mL.
c. Pembuatan larutan pembanding
Diambil sebanyak 0,5; 1,0; 1,5; 2,0, dan 2,5 mL larutan stok rutin,
kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh
d. Pembuatan larutan uji
1) Larutan uji untuk uji aktivitas antioksidan
Sebanyak 100 mg ekstrak ditimbang, lalu ditambahkan metanol p.a
sampai 25,0 mL. Dari larutan tersebut kemudian diambil 1,0; 2,0; 3,0; 4,0; dan 5,0
mL untuk kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga
diperoleh larutan uji dengan konsentrasi 400; 800; 1200; 1600; dan 2000 µg/mL.
2) Larutan uji untuk penetapan kandungan fenolik total
Sebanyak 20 mg hasil fraksi etil asetat pada preparasi sampel ditimbang,
lalu ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi
larutan uji sebesar 2000,0 µg/mL.
e. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsentrasi 500 µg/mL dalam akuades
: metanol p.a. (1:1). Diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL larutan
tersebut, kemudian ditambahkan akuades : metanol p.a. (1:1) sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125;
dan 150 µg/mL.
5. Uji pendahuluan
a. Uji fenolik
Sebanyak 0,5 mL metanol p.a, larutan pembanding asam galat 150,0
µg/mL, dan larutan uji 2000,0 µg/mL dimasukkan ke dalam tiga tabung reaksi.
Lalu ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan
dengan akuades (1:10; v/v). Larutan tersebut selanjutnya ditambahkan dengan 4,0
b. Uji aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukkan ke dalam masing-masing tiga
labu takar 5 mL. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan
pembanding rutin 37,5 µg/mL, dan larutan uji 1200,0 µg/mL. Selanjutnya larutan
tersebut ditambahkan dengan metanol p.a hingga tanda batas. Larutan tersebut
kemudian divortek selama 30 detik. Setelah 30 menit, amati warna pada larutan
tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuan operating time (OT)
Sebanyak 1,0 mL larutan DPPH 0,4 mM dimasukkan ke dalam
masing-masing tiga labu takar 5,0 mL, ditambahkan masing-masing-masing-masing dengan 1,0 mL
larutan pembanding rutin 12,5; 37,5; dan 62,5 µg/mL kemudian tambahkan
metanol p.a hingga tanda batas. Larutan tersebut kemudian divortek selama 30
detik. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada
panjang gelombang 517 nm selama 1 jam. Dilakukan demikian juga untuk larutan
uji 400; 1200; dan 2000 µg/mL.
b. Penentuan panjang gelombang serapan maksimum
Pada tiga labu takar 5,0 mL, dimasukkan masing-masing 0,2; 0,6; dan 1,0
mL larutan DPPH 0,4 mM. Masing-masing larutan tersebut ditambahkan metanol
p.a hingga tanda batas sehingga konsentrasi larutan DPPH menjadi 0,016; 0,048;
dan 0,080 mM. Larutan tersebut kemudian divortek selama 30 detik. Diamkan
selama OT. Lalu dilakukan scanning absorbansinya dengan spektrofotometer
7. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode
spektrofotometri sesuai dengan penelitian Armala (2009).
a. Pengukuran absorbansi larutan kontrol
Pada labu takar 5,0 mL, dimasukkan sebanyak 1,0 mL larutan DPPH 0,4
mM kemudian ditambahkan metanol p.a hingga tanda batas. Larutan tersebut
dibaca absorbansinya pada saat OT dan panjang gelombang serapan maksimum.
Pengerjaan dilakukan sebanyak tiga kali. Larutan ini digunakan sebagai larutan
kontrol untuk menguji larutan pembanding dan larutan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 1,0 mL larutan DPPH 0,4 mM dimasukkan ke dalam
masing-masing labu takar 5,0 mL kemudian ditambah dengan 1,0 mL larutan pembanding
dan uji pada berbagai seri konsentrasi larutan yang telah dibuat. Selanjutnya
tambahkan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortek
selama 30 detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum. Pengerjaan
dilakukan sebanyak tiga kali.
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b divalidasi berdasarkan parameter akurasi
(%recovery), presisi (%CV), linearitas (nilai r) serta spesifisitas (spektra kontrol).
% Recovery =
d. Estimasi aktivitas antioksidan
Hasil dari prosedur 7 a dan b, dihitung nilai %IC dan IC50 untuk rutin dan
fraksi etil asetat ekstrak etanolik herba seledri.
8. Optimasi penetapan kandungan fenolik total
a. Penentuan operating time (OT)
Dibuat larutan baku asam galat dengan konsentrasi 50; 100; dan 150
µg/mL dalam metanol p.a. Masing-masing diambil sebanyak 0,5 mL dan
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan
air (1:10; v/v) serta 4,0 mL larutan natrium karbonat (Na2CO3) 1M. Ukur
absorbansinya pada panjang gelombang maksimum teroritis 750 nm selama 30
menit. Operating Time diperoleh saat nilai absorbansi larutan tersebut telah stabil.
b. Penentuan panjang gelombang serapan maksimum
Dibuat larutan baku asam galat dengan konsentrasi 50; 100; dan 150
µg/mL dalam metanol p.a. Masing-masing diambil sebanyak 0,5 mL dan
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan
air (1:10; v/v) serta 4,0 mL larutan natrium karbonat (Na2CO3) 1M. Diamkan
selama OT, lalu dilakukan scanning absorbansinya dengan spektrofotometer
visibel pada panjang gelombang 600-800 nm.
9. Penetapan kandungan fenolik total
Kandungan fenolik total ditentukan dengan menggunakan metode
spektrofotometri sesuai dengan penelitian Veeru, Kishor, dan Meenakshi (2009).
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 µg/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan
air (1:10; v/v). Larutan selanjutnya ditambah dengan 4,0 mL Na2CO3 1M. Setelah
10 menit, absorbansinya dibaca pada panjang gelombang 750 nm terhadap blanko
yang terdiri atas akuades : metanol p.a. (1:1), reagen Folin-Ciocalteu, dan larutan
Na2CO3 1M.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 9 a divalidasi berdasarkan parameter akurasi
(%recovery), presisi (%CV), linearitas (nilai r) serta spesifisitas (spektra kontrol).
c. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 2000 µg/mL, lalu dimasukkan ke dalam
tabung reaksi, dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva
baku asam galat. Kandungan fenolik total dinyatakan sebagai massa ekivalen
asam galat (mg ekivalen asam galat per g fraksi etil asetat).
F. Analisis Hasil
Uji aktivitas antioksidan menghasilkan aktivitas penangkapan radikal
DPPH yang dilaporkan sebagai %IC dihitung dengan rumus:
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
program PASW Statistics 18 untuk menentukan apakah rutin memiliki aktivitas
antioksidan yang lebih besar dibanding fraksi uji.
Kandungan fenolik total dalam fraksi etil asetat ekstrak etanolik herba
seledri dihitung sebagai massa ekivalen asam galat. Caranya dengan memasukkan
nilai absorbansi larutan uji ke dalam persamaan kurva baku asam galat sehingga
diperoleh nilai ekivalensi larutan uji terhadap asam galat. Nilai tersebut kemudian
dikalikan volume larutan uji yang diambil kemudian dibagi dengan massa fraksi
uji yang ditimbang.
Kandungan fenolik total =
Ekstraksi cair-cair dengan wasbensin dan air
Fraksi wasbensin Fraksi air
Ekstraksi cair-cair dengan etil asetat
Fraksi etil asetat
Uji pendahuluan
Gambar 4. Skema jalannya penelitian
Optimasi metode
Validasi metode uji aktivitas antioksidan
Estimasi kandungan fenolik total
Estimasi aktivitas antioksidan
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman merupakan langkah awal yang harus dilakukan
apabila ingin menggunakan tanaman sebagai sampel penelitian. Determinasi
bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang
akan digunakan dalam penelitian untuk menghindari terjadinya kesalahan dalam
pengambilan sampel untuk analisis fitokimia. Determinasi tanaman seledri (Apium
graveolens L.) dilakukan di Laboratorium Biologi Farmasi Fakultas Farmasi
Sanata Dharma menurut Backer dan Bakhuizen van den Brink (1963) serta Backer
dan Bakhuizen van den Brink (1965). Hasil determinasi didapatkan bahwa sampel
tanaman yang digunakan dalam penelitian adalah benar herba seledri (Apium
graveolens L.).
B. Hasil Pengumpulan Bahan
Herba seledri yang akan digunakan dalam penelitian diperoleh dari
daerah Banyuroto, Dusun Banyuroto, Kecamatan Sawangan, Kabupaten
Magelang, Jawa Tengah. Waktu panen suatu tanaman bergantung pada bagian
tanaman yang hendak digunakan, tujuannya agar didapat kandungan aktif yang
optimal.
Herba seledri yang digunakan pada penelitian ini dipilih berdasarkan tiga
berbunga. Alasan herba seledri dipanen pada musim kemarau adalah supaya
kandungan lembab tidak terlalu tinggi sehingga meminimalkan pertumbuhan
mikroorganisme seperti jamur dan bakteri yang dapat menurunkan kualitas
tanaman. Dipanen pada pagi hari tujuannya agar didapatkan bahan yang masih
segar serta kandungan aktifnya masih banyak tersimpan dalam tanaman karena
belum mengalami metabolisme. Selain itu, dipilih herba seledri yang menjelang
berbunga karena konsentrasi kandungan aktifnya akan lebih besar terdapat pada
daun dan batangnya apabila tanaman tersebut belum berbunga, karena pada
penelitian ini digunakan daun dan batang tanaman seledri.
Herba seledri dipilih yang masih segar, berwarna hijau serta tidak layu.
Sebelum digunakan untuk penelitian, herba seledri dicuci dan dibersihkan dahulu
menggunakan air mengalir untuk menghilangkan pengotor atau kontaminan
berupa partikel debu maupun tanah yang masih menempel pada tanaman. Herba
seledri dikumpulkan sebanyak 1 kg basah. Herba seledri segar harus segera diolah
untuk menghindari terjadinya fenomena phenolic browning, yaitu warna tanaman
berubah menjadi kecoklatan bahkan menghitam, hal ini terjadi karena oksidasi
senyawa fenolik yang terdapat dalam tanaman (Galati, Angie., McKay, Allan.,
dan Tan, Soon Chye., 2005).
C. Hasil Pembuatan Ekstrak
Ekstrak dibuat dari herba seledri segar tanpa melalui proses pengeringan
terlebih dahulu. Alasan digunakan bahan segar dalam penelitian ini karena banyak
kimianya sehingga dikhawatirkan akan mengalami perubahan apabila dikeringkan
dahulu (Markham, 1988). Selain itu, selama proses pengeringan dapat terjadi
reaksi oksidasi enzimatis karena kandungan air yang masih cukup tinggi sehingga
senyawa fenolik dan flavonoid dalam herba seledri menjadi terurai dan aktivitas
antioksidannya menurun (Harborne, 1987). Seledri biasa dikonsumsi dalam
keadaan segar sehingga akan lebih sesuai bila menggunakan bahan herba seledri
yang masih segar untuk penelitian ini.
Herba seledri yang telah dicuci dan dibersihkan kemudian dihaluskan
menggunakan blender sambil ditambahkan sedikit cairan penyari, yaitu etanol
96%. Simplisia tersebut diblender agar ukuran partikel tanaman menjadi lebih
kecil sehingga kontak dengan cairan penyari lebih efektif dan semakin banyak
kandungan aktif dalam tanaman yang dapat tersari. Pemilihan etanol sebagai
cairan penyari dikarenakan etanol dapat bercampur dengan air sehingga
diharapkan dapat menyari sebagian besar kandungan kimia dalam bahan segar
yang memiliki kandungan air cukup tinggi.
Penyarian kandungan aktif dilakukan dengan maserasi karena umumnya
kandungan aktif dalam tanaman tidak tahan terhadap pemanasan sehingga lebih
dipilih ekstraksi cara dingin serta proses maserasi dianggap lebih sederhana dan
mudah dilakukan dibanding cara ekstraksi yang lain seperti perkolasi. Perkolasi
memerlukan banyak pelarut serta proses ekstraksinya cukup lama sehingga kurang
efisien untuk penelitian ini. Selain itu, penelitian ini menggunakan bahan segar
sehingga tidak memungkinkan untuk dilakukan ekstraksi dengan cara lain seperti
oleh pelarut (susunannya harus kompak). Maserasi dilakukan terhadap campuran
bahan dan cairan penyari selama dua hari dan dilanjutkan tahap remaserasi ampas
selama dua hari. Selama proses maserasi dilakukan penggojogan dengan bantuan
shaker sehingga meningkatkan kontak simplisia dengan cairan penyari. Hal ini
dilakukan untuk memaksimalkan jumlah kandungan aktif yang dapat tersari dari
simplisia tersebut. Filtrat dari kedua tahapan tesebut dikumpulkan lalu disaring
menggunakan bantuan corong Buchner yang dilapisi kertas saring serta pompa
vakum sehingga prosesnya lebih cepat. Hasil penyaringan filtrat tersebut
kemudian diuapkan pelarutnya sehingga diperoleh ekstrak etanol herba seledri.
Ekstrak etanol yang diperoleh sebanyak 27,3421 g.
Ekstrak kental yang telah diperoleh kemudian difraksinasi. Sebelum
difraksinasi maka ekstrak kental tersebut ditambahkan 300 mL air hangat terlebih
dahulu karena dengan air dingin ekstrak etanolik sukar larut. Fraksinasi dilakukan
dengan pelarut wasbensin yang bersifat non polar dengan perbandingan 1:1 v/v.
Bagian yang polar seperti polifenol dan flavonoid akan tersari ke air sedangkan
bagian non polar seperti lipid dan klorofil akan tersari ke wasbensin. Fraksi air
akan berada pada bagian bawah sedangkan fraksi wasbensin akan berada di
bagian atas. Hal tersebut dikarenakan bobot jenis (bj) air (1 g/mL) lebih besar
daripada bj wasbensin (0,730 g/mL). Selanjutnya, fraksi air yang telah dipisahkan
dari fraksi wasbensin difraksinasi menggunakan etil asetat yang kepolarannya
berada diantara air dan wasbensin dengan perbandingan 1:1 v/v. Tahapan
fraksinasi menggunakan etil asetat-air sama seperti tahapan fraksinasi
bawah karena bj air (1 g/mL) lebih besar dibandingkan etil asetat (0,903 g/mL).
Setelah proses fraksinasi selesai, didapatkan fraksi air dan fraksi etil asetat. Fraksi
etil asetat selanjutnya diuapkan menggunakan bantuan vacuum rotary evaporator
untuk menghilangkan pelarutnya. Pada saat hampir semua pelarut telah menguap,
fraksi tersebut diletakkan dalam cawan porselen yang telah ditara sebelumnya
kemudian dipanaskan di atas waterbath sambil diaduk agar terbentuk ekstrak yang
benar-benar kental. Setelah kental, fraksi etil asetat yang berwarna kehijauan
ditimbang dan diperoleh 0,5446 g.
D. Hasil Uji Pendahuluan
Uji pendahuluan ini dilakukan untuk mengetahui apakah dalam fraksi etil
asetat ekstrak etanolik herba seledri terdapat kandungan senyawa fenolik serta
apakah fraksi tersebut memiliki aktivitas antioksidan. Pada uji pendahuluan
keberadaan senyawa fenolik, senyawa uji ditambahkan pereaksi fenol
Folin-Ciocalteu, didiamkan selama dua menit kemudian ditambahkan larutan natrium
karbonat 1M. Pembanding yang digunakan untuk uji ini adalah asam galat yang
Gambar 5. Uji pendahuluan senyawa fenolik
Keterangan : 1 : Pereaksi Folin-Ciocalteu + Na2CO3 sebagai kontrol;
2 : Asam galat; 3 : Fraksi uji
Adanya senyawa fenolik dalam fraksi uji akan mengubah warna larutan
menjadi biru. Perubahan warna tersebut terjadi karena oksidasi senyawa fenol
dalam fraksi uji oleh pereaksi Folin-Ciocalteu. Hasil pengujian pada fraksi etil
asetat ekstrak etanolik herba seledri menunjukkan positif terdapat kandungan
fenolik karena terbentuk warna biru, hal tersebut terjadi pula pada senyawa
pembanding asam galat.
Pada uji pendahuluan aktivitas antioksidan, baik senyawa uji maupun
senyawa pembanding, yaitu rutin ditambahkan pada larutan DPPH dalam metanol.
Adanya aktivitas antioksidan akan mengubah warna larutan DPPH yang semula
berwarna ungu menjadi kekuningan. Hasil pengujian baik untuk senyawa uji
maupun senyawa pembanding kesemuanya positif karena terjadi perubahan warna
pada larutan DPPH dalam metanol menjadi kekuningan, dibandingkan dengan
kontrol berupa larutan DPPH dalam metanol yang berwarna ungu.
1 2 1
Gambar 6. Uji pendahuluan aktivitas antioksidan
Keterangan : 1 : Larutan DPPH sebagai kontrol; 2 : Rutin; 3 : Fraksi uji
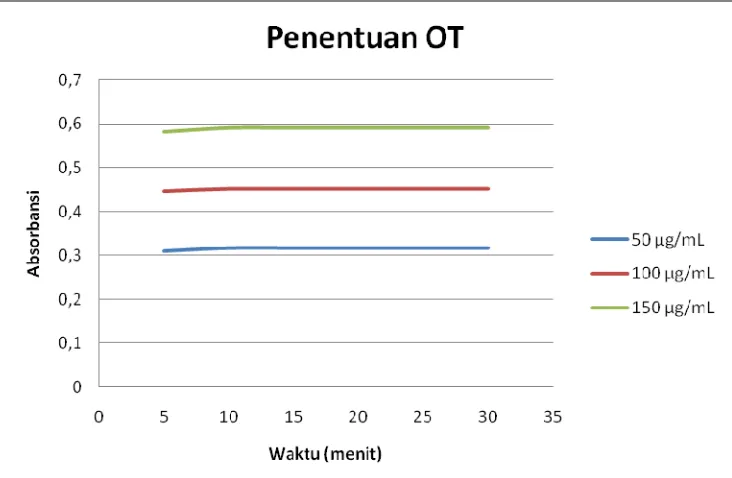
E. Optimasi Metode 1. Penentuan Operating Time (OT)
Penetuan operating time dimaksudkan untuk memperoleh waktu
pengukuran absorbansi dengan nilai yang stabil. Waktu pengukuran absorbansi
ditentukan saat warna yang terbentuk stabil, ditandai dengan nilai absorbansi yang
stabil dari senyawa yang diukur.
a. Uji aktivitas antioksidan
Penentuan operating time dilakukan dengan mengukur serapan larutan
DPPH yang telah ditambahkan senyawa uji maupun senyawa pembanding rutin
pada tiga konsentrasi berbeda (low, med, dan high). Larutan divorteks dahulu
selama 30 detik sebelum diukur untuk menghomogenkan campuran tersebut agar
bereaksi optimal. Pembacaan absorbansi dilakukan menggunakan
spektrofotometer visibel pada panjang gelombang teoritis dari DPPH yaitu 517
nm selama 1 jam. Pengukuran absorbansi dilakukan tiap 5 menit dikarenakan
instrumen yang digunakan tidak dapat digunakan untuk mengukur OT secara
otomatis. Waktu operasi (OT) yang diperoleh untuk larutan pembanding rutin
maupun larutan uji adalah 30 menit, ditandai dengan nilai absorbansi yang tetap.
Gambar 7. Kurva penentuan Operating Time (OT) uji aktivitas antioksidan
b. Penetapan kandungan fenolik total
Penentuan operating time dilakukan dengan mengukur serapan kompleks
molybdenum blue yang terbentuk oleh reaksi antara senyawa fenolik yaitu asam
galat dengan pereaksi Folin-Ciocalteu dalam suasana basa. Pembacaan absorbansi
dilakukan menggunakan spektrofotometer visibel pada panjang gelombang teoritis
kompleks molybdenum blue yaitu 750 nm selama 30 menit. Pengukuran
absorbansi dilakukan tiap 5 menit dikarenakan instrumen yang digunakan tidak
dapat digunakan untuk mengukur OT secara otomatis. Waktu operasi (OT) yang
diperoleh untuk larutan asam galat adalah 10 menit, ditandai dengan nilai