UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI ETIL ASETAT SARI BUAH APEL BLUDRU (Diospyros blancoi A. DC.)
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Johanes Baptista Yunio Rahmawan NIM : 098114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2013
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI ETIL ASETAT SARI BUAH APEL BLUDRU (Diospyros blancoi A. DC.)
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Johanes Baptista Yunio Rahmawan NIM : 098114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
iv
vi
HALAMAN PERSEMBAHAN
“Sumeh, ngrepepeh, loma,
seneng-seneng dinggo nggoleki sing disenengi”
Kerto Wiharjo (alm.)
“Memperbaiki masa lalu bukanlah kemajuan,
mengambil langkah pasti kedepan,
itulah kemajuan”
(Kahlil Gibran)
Kupersembahkan Skripsi ini untuk :
Tuhan Yesus Kristus, Sang Terang
yang telah membimbing hidupku hingga saat ini.
Ibu dan Ayah yang telah mengajarkan nilai-nilai kehidupan.
Keluarga besar Eyang Mpu Kromo Sentono, kerabat Singo Yudho
Terimakasih atas dukungannya baik moril maupun materil.
vii PRAKATA
Puji Syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada
penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI
AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI ETIL ASETAT SARI BUAH APEL BLUDRU
(Diospyros blancoi A. DC.)” ini dengan baik. Laporan akhir ini disusun untuk
memenuhi salah satu persyaratan utnuk memperoleh gelar Sarjana Strata 1
Program Studi Ilmu Farmasi (S.Farm).
Penulis banyak mengalami kesulitan dan masalah dalam menyelesaikan
laporan ini. Tetapi dengan adanya bantuan dari berbagai pihak, akhirnya penulis
dapat menyelesaikan laporan akhir ini. Oleh karena itu dengan segala kerendahan
hati penulis ingin mengucapkan terima kasih atas segala bantuan yang telah
diberikan kepada:
1. Ipang Djunarko,M.Sc.,Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Yohanes Dwiatmaka,M.Si., selaku Dosen Pembimbing yang telah memberikan
bantuan dan bimbingan selama rancangan, pengusulan skripsi, saat dilakukan
penelitian dan selama penulisan skripsi dengan kesabaran dan penuh perhatian.
3. Prof.Dr.C.J. Soegihardjo,Apt., selaku Dosen Penguji yang menguji sekaligus
memberi arahan, kritik, dan saran yang membangun bagi penulis.
4. Jeffry Julianus, M.Si., selaku Dosen Penguji yang menguji sekaligus memberi
viii
5. Keluarga (Ibu, Ayah, kakak tercinta) dan keluarga besar Eyang Mpu Kromo
Sentono atas kasih sayang dan dukungan yang telah diberikan kepada penulis,
baik itu secara moral maupun materil.
6. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Mas Wagiran) dan
Farmasi Fisika (Om Agung) atas segala bantuan selama penulis melakukan
penelitian di laboratorium Laboratorium Farmakognosi-Fitokimia dan Farmasi
Fisika.
7. Yulio Nur Aji Surya dan Theresia Nindyati, tim DPPH yang kompak, saling
mengisi kekurangan dan memperjuangkan tujuan. Tanpa kalian skripsi ini tidak
akan selesai.
8. Teman-teman FST 2009, atas kerjasama, doa, semangat, kritik, saran, kegilaan,
canda tawa, segala kritik dan masukannya.
9. Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat
disebut satu per satu.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan
dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis.
Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua
pihak. Akhir kata semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta, Juli 2013
Penulis
ix DAFTAR ISI
Halaman
HALAMAN JUDUL……….. i
HALAMAN PERSETUJUAN PEMBIMBING………. ii
HALAMAN PENGESAHAN……… iii
PERNYATAAN KEASLIAN KARYA………. iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA... v
HALAMAN PERSEMBAHAN...……. vi
PRAKATA………. vii
DAFTAR ISI……….. ix
DAFTAR TABEL……….. xiii
DAFTAR GAMBAR……….. xiv
DAFTAR LAMPIRAN………... xvi
INTISARI……….... xvii
ABSTRACT……….... xiii
BAB I PENGANTAR………. 1
A. Latar Belakang……… 1
B. Permasalahan………... 3
C. Keaslian penelitian………... 3
D. Manfaat penelitian………... 4
E. Tujuan umum dan khusus ... 4
BAB II PENELAAHAN PUSTAKA……….. 5
A. Tanaman Apel Beludru……… 5
x
2. Nama ain…..………... 5
3. Gambaran umum apel beludru……….. 5
4. Penyebaran tanaman………... 6
5. Kandungan kimia apel beludru ………. 6
B. Senyawa Fenolik………... 7
C. Metode Folin-Ciocalteu……….... 9
D. Radikal Bebas ….……..……… 10
E. Antioksidan . ... 11
F. Metode DPPH ……….. 12
G. Ekstraksi ………... 13
H. Spektrofotometri ……… .………. 14
I. Landasan Teori ………. 15
J. Hipotesis ………... 16
BAB III METODE PENELITIAN………... 17
A. Jenis dan Rancangan Penelitian………. 17
B. Variabel……….. 17
1. Variabel bebas………... 17
2. Variabel tergantung……… 17
3. Variabel pengacau terkendali……… . 17
4. Variabel pengacau tak terkendali……….. . 17
C. Definisi Operasional... 17
D. Bahan dan Alat Penelitian ... 18
xi
2. Alat penelitian ... 18
E. Tatacara Penelitian ... 19
1. Determinasi tanaman ... 19
2. Pengumpulan bahan ... 19
3. Preparasi buah apel beludru ... . 19
4. Pembuatan larutan pembanding dan uji ... 20
5. Uji pendahuluan ... 21
6. Optimasi metode penetapan kandungan fenolik total ... 22
7. Penetapan kandungan fenolik total ... 23
8. Optimasi metode uji aktivitas antioksidan ... 23
9. Uji aktivitas antioksidan ... 24
10. Analisis hasil ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
A. Hasil Determinasi Tanaman ... 26
B. Hasil Pengumpulan Bahan ... 26
C. Hasil Preparasi Sampel ... 28
1. Hasil pembuatan sari buah ... 28
2. Hasil fraksinasi sari buah ... 29
D. Hasil Uji Pendahuluan ... 31
1. Uji pendahuluan senyawa fenolik. .………..……..….….………… 31
2. Uji pendahuluan aktivitas antioksidan ……… 32
E. Hasil Optimasi Metode Uji Fenolik Total..…..……..……..……... 33
xii
2. Penentuan panjang gelombang maksimum………... 34
F. Hasil Estimasi Kandungan Fenolik Total…....…....…... 35
G. Hasil Optimasi Metode Uji Aktivitas Antioksidan…...…...…... 38
1. Penentuan panjang gelombang maksimum………...……... 38
2. Penentuan Operat Time………..…... 40
H. Estimasi Aktivitas Antioksidan dengan Radikal DPPH……… 41
BAB V KESIMPULAN DAN SARAN………. 51
A. Kesimpulan……… 51
B. Saran……….. 51
DAFTAR PUSTAKA……… 52
LAMPIRAN……… 57
xiii
DAFTAR TABEL
Halaman Tebel I. Hasil Scanning panjang gelombang maksimum asam galat
yang direaksikan dengan folin ciocalteu... 35
Tabel II. Hasil pengukuran absorbansi seri baku asam galat yang
direaksikan dengan folin-ciocalteu ... 36
Tabel III. Hasil penentuan jumlah fenolik total fraksi etil asetat sari buah apel beludru ... 37 Tabel IV. Hasil scanning panjang gelombang maksimum pada berbagai
konsentrasi ... 39 Tabel V. Hasil aktivitas antioksidan kuersetin dengan metode DPPH. 45
Tabel VI. Hasil aktivitas antioksidan fraksi etil asetat sari buah apel
beludru dengan metode DPPH ... 46
Tabel VII. Hasil perhitungan IC50 kuersetin dan fraksi etil asetat
sari buah apel beludru ... 47
Tabel XIV. Penggolongan tingkat kekuatan antioksidan kuersetin dan
xiv
DAFTAR GAMBAR
Halaman Gambar 1. Struktur kuersetin (Apak dkk., 2007) ……... 7
Gambar 2. Struktur kimia dari beberapa tipe flavonoid
(Shandar et al., 2011) ………. 8
Gambar 3. Struktur asam galat
(Kalita, Kar dan Handique)……… 9
Gambar 4. Senyawa fenolik dalam suasana basa
(Sambada, 2011)….…...…...…...….…...…..….….….…. 10
Gambar 5. Reaksi senyawa fenolik dengan pereaksi Folin-Ciocalteu
(Sambada, 2011)….…...…...…...….…...…..….….….…. 10
Gambar 6. 1,1-Diphenyl-2-picryl hydrazyl
(Molyneux, 2004)….…...…...…...….…...…..….….….…. 13
Gambar 7. Uji pendahuluan keberadaan senyawa
fenolik………... 32
Gambar 8. Uji pendahuluan aktivitas antioksidan...…... 33
Gambar 9. Grafik penentuan OT asam galat... 34
Gambar 10. Kurva kalibrasi asam galat dalam penetapan fenolik total... 37
Gambar 11. Grafik penentuan OT kuersetin...………... 40
Gambar 12. Grafik penentuan OT fraksi etil asetat... 41
Gambar 13. Reaksi antara radikal DPPH dengan senyawa
antioksidan(Nisizawa, 2005)... 43
Gambar 14. Konsentrasi kuersetin Vs % IC…... 46
xv
Gambar 16. Histogram rerata IC50 dari kuersetin dan fraksi etil asetat dengan
interval kepercayaan 95%... 49
xvi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat pengesahan determinasi tanaman apel beludru
(Diospyros blancoi A. DC.)... 57
Lampiran 2. Gambar tanaman apel beludru yang diambil di kompleks Universitas Sanata Dharma ... 58
Lampiran 3 Perhitungan rendemen ... 59
Lampiran 4. Data penimbangan untuk pengujian aktivitas Antioksidan ... 60
Lampiran 5. Data perhitungan konsentrasi DPPH, larutan pembanding, dan larutan uji ... 62
Lampiran 6. Scanning pengkoreksi ... 66
Lampiran 7. Optimasi metode uji aktivitas antioksidan ... 69
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH ... 75
Lampiran 9. Perhitungan nilai IC50 kuersetin dan fraksi etil asetat sari buah apel beludru ... 78
Lampiran 10. Penimbangan uji kandungan fenolik total ... 79
Lampiran 11. Scanning kontrol asam galat ... 80
Lampiran 12. Optimasi penentuan kandungan fenolik total ... 80
Lampiran 13. Penentuan kandungan fenolik total ... 85
xvii INTISARI
Antioksidan berperan dalam menghambat oksidasi dengan mengikat radikal bebas. Akibatnya kerusakan sel yang berujung pada penyakit degeneratif dapat dihambat. Penelitian ini dilakukan untuk menentukan aktivitas antioksidan serta kandungan fenolik total fraksi etil asetat sari buah apel beludru (Diospyros blancoi A. DC.). Sebelumnya telah diketahui tanaman lain yang bergenus
Diospyros memiliki kandungan senyawa fenolik berupa kuersetin.
Pengujian aktivitas antioksidan dilakukan secara kuantitatif maupun kualitatif menggunakan radikal 1,1 difenil-2-pikrilhidrazil (DPPH) dan dinyatakan dengan nilai Inhibition Concentration 50 (IC50). Keberadaan senyawa beraktivitas
antioksidan akan mengubah warna larutan DPPH dari ungu menjadi kuning. Penentuan fenolik total dengan metode Folin-Ciocalteu dinyatakan dengan nilai massa ekuivalen asam galat. Senyawa fenolik akan dioksidasi oleh Folin-Ciocalteu dalam suasana basa sehingga terbentuk larutan dengan warna biru.
Hasil penelitian menunjukkan bahwa fraksi etil asetat sari buah apel beludru mempunyai aktivitas antioksidan sangat kuat dengan nilai IC50 sebesar
(30.0 ± 0,09) µg/mL. Kandungan fenolik total sebesar (393.5 ± 0.35) mg ekivalen asam galat per g fraksi etil asetat.
Kata kunci: Antioksidan, buah apel beludru (Diospyros blancoi A. DC), fraksi etil asetat, DPPH, kandungan fenolik total
xviii ABSTRACT
Antioxidant plays a role in inhibiting oxidation by binding to free radicals. As a result, the cell damage that leads to degenerative diseases can be inhibited. This research was conducted to determine the antioxidant activity and total phenolic content of ethyl acetate fraction of velvet aple (Diospyros blancoi A. DC.) juice. Previously known that other plants from genus Diospyros contain phenolic compounds such as quercetin.
Antioxidant activity test performed quantitatively and qualitatively using radical 1,1-diphenyl-2 pikrilhidrazil (DPPH) and expressed as the value Inhibition Concentration 50 (IC50). The existence of active antioxidant compounds will change DPPH color from purple to yellow. Determination of total phenolic using Folin-Ciocalteu method expressed as equivalent mass of gallic acid. Phenolic compounds will be oxidized by the Folin-Ciocalteu under alkaline conditions, forming a blue solution.
The results showed that the ethyl acetate fraction of velvet apple juice has very strong antioxidant activity with IC50 of (30.0 ± 0.09) mg / mL. Total phenolic content of (393.5 ± 0.35) mg gallic acid equivalents per gram of ethyl acetate fraction.
Keywords: antioxidant, velvet apple (Diospyros blancoi A. DC), ethyl acetate fraction, DPPH, total phenolic content
1 BAB I
PENGANTAR
A. Latar Belakang
Radikal bebas adalah atom atau molekul yang mempunyai elektron tidak
berpasangan pada orbital terluarnya sehingga bersifat reaktif (Clarkson and
Thompson, 2000). Untuk mencapai kestabilan radikal bebas mencari pasangan
elektron dari molekul disekitarnya (Frei, 1994; Trevor, 1995; Prakash, 2001).
Berbagai kemungkinan dapat terjadi akibat radikal bebas seperti gangguan fungsi
sel, kerusakan struktur sel, molekul termodifikasi yang tidak dikenali sistem imun,
dan bahkan mutasi. Target utama radikal bebas adalah protein, asam lemak tak
jenuh dan lipoprotein, serta unsur DNA (Winarsi, 2007).
Menurut Suhartono (2002) antioksidan adalah senyawa kimia yang dapat
menyumbangkan elektron, sehingga suatu radikal bebas dapat diredam. Secara
alami tubuh memiliki antioksidan endogen seperti enzim SOD (scperoxyde
dismctase), glutation, dan katalase yang dapat menetralkan radikal bebas, namun
jumlahnya terbatas sehingga membutuhkan suplai antioksidan dari luar tubuh
(Frei, 1994; Trevor, 1995; Prakash, 2001).
Antioksidan dapat berasal dari bahan alam maupun sintetis. Efek samping
antioksidan sintetik yang belum diketahui menyebabkan antioksidan alami
menjadi alternatif yang dibutuhkan (Sunarni, 2005). Oleh sebab itu eksplorasi
sumber antioksidan alam yang berasal dari tumbuhan semakin berkembang.
Senyawa-senyawa polifenol mampu menghambat autooksidasi melalui
2
berpasangan pada radikal bebas (Pokorny, Yanishlieva, and Gordon, 2001).
Penelitian yang dilakukan oleh Lee, Jiang, Juan, Lin, and Hou (2006)
menunjukkan bahwa Diospyros blancoi A. DC. mengandung konstituen fenolik
lebih dari 30 mg ekivalen asam galat per gram ekstrak tanaman. Sehingga tujuan
penelitian ini adalah untuk mengetahui aktivitas antioksidan dari apel bludru
khususnya pada bagian buah (frcctcs).
Apel bludru umumnya digunakan penduduk Asia Tenggara untuk masalah
jantung, hipertensi, diabetes, gigitan ular dan serangga, serta digunakan untuk
diare (Das, Hamid, Bulubul, Sultana, and Islam, 2010). Kuersetin yang
merupakan salah satu anggota flavonoid ditemukan pada tanaman yang masih satu
genus dengan apel bludru (Diospyros blancoi) yaitu American Persimmon
(Diospyros virginiana L ) (Duke, 2001), sehingga diperkirakan apel bludru juga
memiliki kandungan flavonoid.
Digunakan pelarut air karena senyawa fenolik merupakan metabolit
sekunder yang mempunyai cincin aromatik yang terikat dengan satu atau lebih
substituen gugus hidroksil (-OH) sehingga pada umumnya larut dalam pelarut
polar (Markham, 1988). Fraksi etil asetat digunakan dalam penelitian karena
merupakan pelarutyang paling baik untuk aglikon flavonoid dan dianjurkan untuk
proses pemurnian (Robinson, 1995).
Penentuan aktivitas antioksidan dalam penelitian ini menggunakan metode
DPPH. Radikal DPPH memiliki kemampuan untuk direduksi atau distabilisasi
oleh antioksidan diukur dengan menentukan penurunan absorbansi pada panjang
digunakan untuk mengkaji kapasitas penangkapan radikal (Duh et al., 1999). Nilai
aktivitas antioksidan diketahui melalui nilai IC merupakan konsentrasi yang
menyebabkan penurunan 50% dari konsentrasi DPPH awal (Sunarni, 2005). Pada
penelitian ini juga dilakukan penentuan kandungan fenolik total dengan metode
Folin-Ciocalteau sebagai standar penentuan kandungan fenolik total setara massa
ekivalen asam galat pada uji aktivitas antioksidan (Aqil et al., 2006).
B. Permasalahan
1. Berapakah kandungan fenolik total fraksi etil asetat sari buah apel bludru yang
dinyatakan dengan massa ekivalen asam galat ?
2. Berapakah nilai aktivitas antioksidan fraksi etil asetat sari buah apel bludru
dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50 ?
C. Keaslian Penelitian
Uji aktivitas antioksidan tanaman apel bludru pernah dilakukan oleh Das,
et al. (2010) menggunakan daun, buah, dan kulit batang apel bludru yang
diperoleh dari Departemen Botani Universitas Dhaka. Kemudian dalam keadaan
kering diekstrak dengan metanol 97% selama 7 hari. Uji aktivitas antioksidan
dilakukan dengan metode DPPH serta ditetapkan kandungan fenolik totalnya
menggunakan spektrofotometri UV-VIS.
Perbedaan antara penelitian ini dengan penelitian sebelumnya adalah
bahwa dalam penelitian ini menggunakan fraksi etil asetat buah apel bludru dari
4
Paingan, Sleman, Yogakarta dan dalam keadaan segar diolah untuk mendapatkan
fraksi etil asetat dari sari buah apel bludru. Kemudian diuji aktivitas antioksidan
menggunakan radikal DPPH dan ditetapkan kandungan fenolik totalnya dengan
meggunakan metode Folin-Ciocalteu.
D. Manfaat penelitian
1. Manfaat teoritis: penelitian ini diharapkan dapat memberikan pengetahuan
tentang aktivitas antioksidan fraksi etil asetat sari buah apel bludru dengan
menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
2. Manfaat praktis: penelitian ini diharapkan dapat memberikan informasi tentang
aktivitas antioksidan buah apel bludru sehingga bisa dimanfaatkan untuk
pemeliharaan kesehatan manusia untuk menangkal radikal bebas.
E. Tujuan Penelitian
1. Tujuan umum: menetapkan kandungan fenolik total meggunakan metode
Folin-Ciocalteu dan menguji aktivitas antioksidan menggunakan metode DPPH fraksi
etil asetat sari buah apel beludru.
2. Tujuan khusus:
a. Mengetahui nilai kandungan fenolik total fraksi etil asetat sari buah apel
beludru yang dinyatakan dalam mg ekivalen asam galat.
b.Mengetahui nilai aktivitas antioksidan fraksi etil asetat sari buah apel bludru
dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
5 BAB II
PENELAAHAN PUSTAKA
A. Tanaman Apel Beludru
1. Klasifikasi tumbuhan
Tanaman apel beludru menurut USDA (United States of Department
Agriculture) diklasifikasikan sebagai berikut:
Kingdom : Plantae Subkingdom : Tracheobionta Superdivision : Spermatophyta Division : Magnoliophyta Class : Magnoliopsida Subclass : Dilleniidae Order : Ebenales Family : Ebenaceae Genus : Diospyros L.
Species : Diospyrosblancoi A. DC.
2. Nama lain
Sinonim : Diopyros discolor
Indonesia : Buah mentega, bisbul Inggris : Velvet apple, mabolo
Melayu : Bcah mentega
Filipina : Mabolo, kamagong (Morton, 1987).
3. Gambaran umum apel beludru
Menurut IPNI (International Plant Names Index) A. DC. merupakan
6
Tanaman buah mentega ini berbentuk pohon atau perdu. Tinggi tanaman
rata-rata 8-33 m, diameter batang 80 cm dan berakar tunggang. Daunnya tunggal,
berseling, bentuk lonjong, ujung daun runcing, tangkai pendek dan warna daun
hijau gelap. Panjang daun 15-22,8 cm dan lebar daun 5-9 cm dengan pinggir daun
rata. Daunnya berukuran besar, oleh karena itu tanaman ini dapat digunakan
sebagai pohon pelindung dan penahan angin. Bunga terletak di ketiak daun,
berkelamin tunggal atau hermafrodit, bunga jantan umumnya majemuk sedangkan
bunga betina soliter. Buah berbentuk oval antara 5-19 cm (Morton, 1987).
4. Penyebaran Tanaman
Apel beludru berasal dari Kepulauan Filipina yang umumnya terletak
dikawasan hutan ketinggian rendah dan menengah. Tanaman ini bisa ditemui dari
pulau Luzon hingga pulau paling selatan Filipina, yaitu pulau Sulu. Apel beludru
umumnya dibudidayakan untuk diambil buahnya, selebihnya hanya sebagai pohon
naungan dipinggir jalan. Selanjutnya, pada tahun 1881 tanaman ini juga
ditemukan didaerah Jawa dan Melaya, Kebun Raya Singapura, bahkan tanaman
ini banyak digunakan sebagai tanaman hias di India. Pada perkembangan
selanjutnya tanaman ini menyebar di berbagai daerah Amerika seperti Miami,
Karibia, Jamaika, dan Kuba (Morton, 1987).
5. Kandungan kimia apel bludru
Hasil penelitian yang dilakukan Howlader, Rahman, Khalipa, Ahmed,
and Rahman (2012) menunjukkan bahwa Diospyros blancoi memiliki konstituen
kimia seperti flavonoid, alkaloid, tanin, gula, dan gum. seperti Dalam penelitian yang
memiliki kandungan fenolik
ekstrak tanaman. Dalam penelitian yang dilakukan Duke (2011) ditemukan
adanya kandungan kuersetin pada tanaman yang masih bergenus sama
Diospyros virginiana
Gambar
Berdasarkan teori
bahwa spesies tumbuhan yang termasuk dalam genus yang sama dari suatu famili
tumbuhan tertentu akan mengandung senyawa
senyawa kimia dengan kerangk
berbeda tergantung dari ekosistem dan tantangan alam yang dihadapi oleh spesies.
Senyawa fenolik merupakan sumber antioksidan alami yang aman
digunakan dan merupakan golongan
antioksidan. Aktivitas antioksidan dari fenolik didapatkan dengan cara mereduksi
radikal bebas sehingga radikal menjadi stabil ( Marxen, Vanselow, Lippemeier,
Hitze, Ruser, and Hansen, 2007)
memiliki kandungan fenolik lebih dari 30 mg ekivalen asam galat per gram
Dalam penelitian yang dilakukan Duke (2011) ditemukan
adanya kandungan kuersetin pada tanaman yang masih bergenus sama
Diospyros virginiana L.
Gambar 1. Struktur kuersetin (Apak dkk., 2007)
Berdasarkan teori kemotaksonomi, Venkataraman (1976)
bahwa spesies tumbuhan yang termasuk dalam genus yang sama dari suatu famili
tumbuhan tertentu akan mengandung senyawa-senyawa kimia yang sama atau
senyawa kimia dengan kerangka struktur yang sama, hanya saja intensitasnya bisa
berbeda tergantung dari ekosistem dan tantangan alam yang dihadapi oleh spesies.
B. Senyawa Fenolik
Senyawa fenolik merupakan sumber antioksidan alami yang aman
digunakan dan merupakan golongan mayoritas senyawa yang bertindak sebagai
antioksidan. Aktivitas antioksidan dari fenolik didapatkan dengan cara mereduksi
radikal bebas sehingga radikal menjadi stabil ( Marxen, Vanselow, Lippemeier,
Hansen, 2007).
lebih dari 30 mg ekivalen asam galat per gram
Dalam penelitian yang dilakukan Duke (2011) ditemukan
adanya kandungan kuersetin pada tanaman yang masih bergenus sama, yaitu
, Venkataraman (1976) mengemukakan
bahwa spesies tumbuhan yang termasuk dalam genus yang sama dari suatu famili
senyawa kimia yang sama atau
hanya saja intensitasnya bisa
berbeda tergantung dari ekosistem dan tantangan alam yang dihadapi oleh spesies.
Senyawa fenolik merupakan sumber antioksidan alami yang aman
mayoritas senyawa yang bertindak sebagai
antioksidan. Aktivitas antioksidan dari fenolik didapatkan dengan cara mereduksi
8
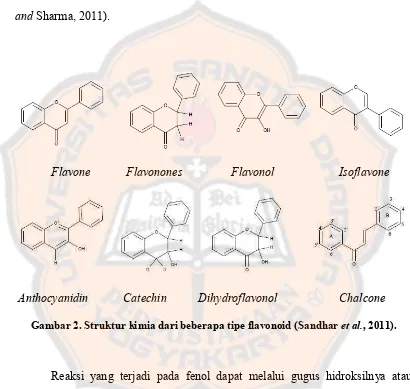
Flavonoid berbeda dalam penyusunan gugus hidroksil, metoksi dan bagian
gugus glikosida dan dalam konjugasi antara cincin A dan B. Variasi dalam cincin
C merupakan pembagian dalam subkelas. Dilihat dari struktur molekular mereka,
maka dapat dibagi dari delapan kelas (Sandhar, Kumar, Prasher, Tiwari, Shalhan,
and Sharma, 2011).
Flavone Flavonones Flavonol Isoflavone
Anthocyanidin Catechin Dihydroflavonol Chalcone
Gambar 2. Struktur kimia dari beberapa tipe flavonoid (Sandhar et al., 2011).
Reaksi yang terjadi pada fenol dapat melalui gugus hidroksilnya atau
dengan menggantikan atom hidrogen pada cincin aromatiknya. Sifat lainnya yang
menarik ia1ah fenol mampu mengkompleks protein sehingga beberapa enzim
dapat dihambat. Sifat ini menguntungkan proses ekstraksi, karena dapat
terhadap oksidasi dan ini bisa menyebabkan perubahan fenol se1arna ekstraksi
(Simpson, 1985).
Kandungan fenolik total dalam suatu sampel dapat
kolorometri dengan metode Folin
reduksi kimia reagen fenol yaitu campuran asam fosfomolibdat
adanya senyawa fenolik, sehingga dihasilkan produk berwarna biru yang memiliki
serapan kuat pada panjang gelombang 765 nm. Intensitas serapan pada panjang
gelombang tersebut proporsional dengan jumlah senyawa fenolik dalam sampel
(Waterhouse, 2002).
Metode Folin
dengan standar asam gala
Gambar 3. S
Metode kolorimetri yang biasa digunakan adalah
satu metode yang memiliki reaksi oksidasi yang cepat dengan fenol dengan
menggunakan alkali (biasanya sodium karbonat), dimana nilai yang didapat terhadap oksidasi dan ini bisa menyebabkan perubahan fenol se1arna ekstraksi
Kandungan fenolik total dalam suatu sampel dapat
kolorometri dengan metode Folin-Ciocalteu. Prinsip metode ini adalah adanya
reduksi kimia reagen fenol yaitu campuran asam fosfomolibdat-fosfotungstat oleh
adanya senyawa fenolik, sehingga dihasilkan produk berwarna biru yang memiliki
kuat pada panjang gelombang 765 nm. Intensitas serapan pada panjang
gelombang tersebut proporsional dengan jumlah senyawa fenolik dalam sampel
C. Metode Folin-Ciocalteu
in-Ciocalteu merupakan metode pengukuran kadar
dengan standar asam galat (Nely, 2007).
. Struktur asam galat (Kalita, Kar dan Handique, 2011)
Metode kolorimetri yang biasa digunakan adalah Folin
satu metode yang memiliki reaksi oksidasi yang cepat dengan fenol dengan
menggunakan alkali (biasanya sodium karbonat), dimana nilai yang didapat terhadap oksidasi dan ini bisa menyebabkan perubahan fenol se1arna ekstraksi
Kandungan fenolik total dalam suatu sampel dapat diukur secara
Ciocalteu. Prinsip metode ini adalah adanya
fosfotungstat oleh
adanya senyawa fenolik, sehingga dihasilkan produk berwarna biru yang memiliki
kuat pada panjang gelombang 765 nm. Intensitas serapan pada panjang
gelombang tersebut proporsional dengan jumlah senyawa fenolik dalam sampel
iocalteu merupakan metode pengukuran kadar polifenol
Handique, 2011).
olin Ciocalteu, salah
satu metode yang memiliki reaksi oksidasi yang cepat dengan fenol dengan
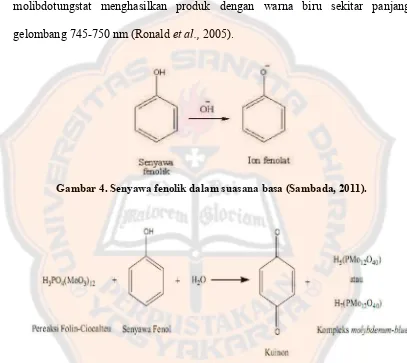
signifikan dengan konsentrasi ion fenolat (Cicco dan Latanzio, 2011).
kandungan fenolik total dilakukan dengan cara memberikan
Ciocalteu dan reaksi yang terjadi adalah oksidasi
pereaksi fenol
Folin-molibdotungstat menghasilkan
gelombang 745-750 nm (Ronald
Gambar 4. Senyawa fenolik dalam suasana basa (Sambada, 2011)
Gambar 5. Reaksi senyawa fenolik dengan pereaksi Folin
Radikal bebas adalah atom atau molekul yang mempunyai elektron tidak
berpasangan pada orbital terluarnya
memperoleh pasangan elektron senyawa ini sangat reaktif dan merusak jaringan. signifikan dengan konsentrasi ion fenolat (Cicco dan Latanzio, 2011).
ik total dilakukan dengan cara memberikan
yang terjadi adalah oksidasi dari ion fenolat senyawa uji
-Ciocalteu, dimana oksidasi dari senyawa fenol oleh reagen
menghasilkan produk dengan warna biru sekitar panjang
750 nm (Ronald et al., 2005).
. Senyawa fenolik dalam suasana basa (Sambada, 2011)
. Reaksi senyawa fenolik dengan pereaksi Folin-Ciocalteu (Sambada, 2011).
D. Radikal Bebas
Radikal bebas adalah atom atau molekul yang mempunyai elektron tidak
berpasangan pada orbital terluarnya (Clarkson and Thompson, 2000).
memperoleh pasangan elektron senyawa ini sangat reaktif dan merusak jaringan.
10
signifikan dengan konsentrasi ion fenolat (Cicco dan Latanzio, 2011). Estimasi
ik total dilakukan dengan cara memberikan reagen Folin
dari ion fenolat senyawa uji oleh
imana oksidasi dari senyawa fenol oleh reagen
warna biru sekitar panjang
. Senyawa fenolik dalam suasana basa (Sambada, 2011).
Ciocalteu
Radikal bebas adalah atom atau molekul yang mempunyai elektron tidak
(Clarkson and Thompson, 2000). Untuk
Radikal bebas yang terbentuk cenderung untuk mengadakan reaksi berantai yang
bila terjadi dalam tubuh dapat menimbulkan kerusakan-kerusakan yang serius
(Percival, 1998). Untuk mencapai kestabilan atom atau molekul, radikal bebas
akan bereaksi dengan molekul di sekitarnya untuk memperoleh pasangan elektron.
Reaksi seperti ini berlangsung terus menerus dalam tubuh dan bila tidak
dihentikan maka akan menimbulkan penyakit seperti kanker, jantung, katarak,
penuaan dini, serta penyakit degeneratif lainnya (Andayani, Lisawati, dan
Maemunah, 2008).
E. Antioksidan
Antioksidan dapat didefinisikan sebagai senyawa yang apabila dalam
konsentrasi rendah berada bersama substrat yang teroksidasi, dapat menunda atau
menghambat oksidasi senyawa tersebut (Halliwell, 1994). Antioksidan merupakan
suatu senyawa yang berperan dalam menghambat oksidasi yang diperantarai
oksigen. Senyawa antioksidan memegang peranan penting dalam pertahanan
tubuh terhadap penyakit. Hal tersebut disebabkan senyawa antioksidan dapat
mencegah pengaruh buruk yang disebabkan oleh senyawa radikal bebas (Percival,
1998).
Sistem antioksidan dibagi menjadi dua kelompok, yaitu kelompok
enzimatik dan non-enzimatik. Antioksidan enzimatik terdiri dari scperoxide
dismctase (SOD), katalase dan glctathione peroxidase. Antioksidan nonenzimatik
12
Antioksidan enzimatik secara alamiah dihasilkan oleh tubuh sedangkan
antioksidan non-enzimatik diperoleh dari luar tubuh (Fouad, 2005).
Pada saat ini penggunaan bahan pengawet dan antioksidan sintetis tidak
direkomendasikan oleh Badan Pengawas Obat dan Makanan (BPOM) karena
diduga dapat menimbulkan penyakit kanker (carcinogen agent). Seperti
penggunaan tBHQ pada dosis tinggi menyebabkan kanker otak, hal ini dikarekan
terbentuknya radikal semikuinon anion dan ROS yang menyerang sel otak. Begitu
pula dengan BHT dan BHA, dalam konsentrasi tinggi dapat menginduksi tumor
pada perut dan liver hewan uji. Karena itu, perlu dicari alternatif lain, yaitu bahan
pengawet dan antioksidan alami yang bersumber dari bahan alam. Bahan
pengawet dan antioksidan alami ini hampir terdapat pada semua
tumbuh-tumbuhan dan buah-buahan tersebar di seluruh tanah air Indonesia (Hernani,
2005).
F. Metode DPPH
Radikal bebas yang umumnya digunakan sebagai model dalam penelitian
antioksidan atau peredam radikal bebas adalah 1,1-difenil-2-pikrilhidrazil (DPPH)
(Windono et al., 2001).
DPPH merupakan radikal bebas yang stabil (dengan atom N di tengah)
serta dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen,
dapat berguna untuk pengujian aktivitas antioksidan komponen tertentu dalam
suatu ekstrak (Dinis et al., 1994).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh
keberadaan penangkap radikal bebas, maka basorbansinya menurun secara
stoikiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning
(Dehpour et al., 2009).
Salah satu parameter yang telah diketahui sebagai interpretasi hasil dari
metode DPPH yang dilakukan adalah “inhibit concentration 50” atau nilai IC50.
Nilai ini didefinisikan sebagai konsentrasi substrat yang menyebabkan 50%
hilangnya aktivitas DPPH. Nilai aktivitas antioksidan diketahui melalui nilai IC50
yang dihasilkan, bahwa semakin tinggi aktivitas antioksidan suatu senyawa, maka
semakin tinggi nilai IC50 yang dihasilkan (Molyneux, 2004).
Gambar 6. 1,1-Diphenyl-2-picryl hydrazyl (Molyneux, 2004)
G. Ekstraksi
Penyarian atau ekstraksi merupakan suatu peristiwa perpindahan massa
zat aktif yang semula berada di dalam sel kemudian ditarik oleh cairan penyari.
Pada umumnya penyarian akan bertambah baik jika permukaan simplisia yang
14
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan ( Dirjen POM,
1995). Untuk mendapatkan senyawa yang khas (zat aktif) dalam suatu tumbuhan,
diperlukan metode ekstraksi yang cepat dan teliti. Pemilihan metode ekstraksi
tergantung pada sumber bahan alami dan senyawa yang akan diisolasi tersebut
(Harborne, 1987).
Dalam memilih penyari, seseorang harus mampu mempertimbangkan banyak faktor. Menurut Depkes (1986) cairan penyari yang baik harus memiliki kriteria berikut ini.
(1) Murah dan mudah diperoleh, (2) Stabil secara fisika dan kimia,
(3) Tidak mudah menguap dan tidak mudah terbakar, (4) Selektif
(5) Tidak mempengaruhi zat berkhasiat, dan (6) Diperbolehkan oleh peraturan yang berlaku
Metode penyarian yang digunakan tergantung dari wujud dan kandungan
zat dari bahan yang disari. Cara penyarian dapat dibedakan menjadi: infundasi,
maserasi, perkolasi, dan penyarian yang berkesinambungan (Depkes, 1986).
H. Spekrofotometri Visibel
Spektrofotometri visibel adalah salah satu teknik analisis fisika-kimia yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik
pada panjang gelombang 380-780 nm (Mulja dan Suharman, 1995). Menurut
tampak (visible), oleh sebab itu digunakan spektrofotometri visibel untuk
pengukuran absorbansinya.
Interaksi antara senyawa yang mempunyai gugus kromofor dengan radiasi
elektromagnetik pada daerah UV-Vis (200-800 nm) akan menghasilkan transisi
elektromagnetik dan spektra absorbansi elektromagnetik. Jumlah radiasi
elektromagnetik yang diserap akan sebanding dengan jumlah molekul
penyerapnya, sehingga spektra absorbansi dapat digunakan untuk analisis
kuantitatif (Fessenden dan Fessenden, 1995).
Bila suatu molekul senyawa organik menyerap sinar UV atau tampak
maka di dalam molekul tersebut terjadi perpindahan (transisi elektron) dari
berbagai jenis tingkat energi orbital dari molekul tersebut (Sastromihardjojo,
2001). Absorbsi cahaya oleh suatu molekul merupakan suatu bentuk interaksi
antara gelombang cahaya (foton) dan atom atau molekul. Proses absorbsi cahaya
UV-Vis berkaitan dengan promosi elektron dari satu orbital molekul dengan
tingkat energi elektronik tertentu ke orbital lain dengan tingkat energi elektronik
yang lebih tinggi.
I. Landasan Teori
Radikal bebas tidak stabil sehingga secara reaktif menyerang molekul
alami tubuh maka menimbulkan penyakit degeneratif seperti kanker, jantung, dan
penuaan dini. Antioksidan sintetis seperti BHT dan BHA, dapat menginduksi
tumor dan kanker oleh karena itu tidak direkomendasikan oleh Badan Pengawas
16
Buah apel bludru mengandung senyawa fenolik yang mempunyai aktivitas
antioksidan dengan mereduksi radikal bebas untuk menghambat terjadinya reaksi
samping yang merugikan.
Metode DPPH (1,1-diphenyl-2-picryl-hydrazyl) memanfaatkan suatu
radikal bebas stabil dengan adanya delokalisasi elektron bebas pada molekul
tersebut. Delokalisasi ini menyebabkan munculnya absorpsi pada panjang
gelombang 517 nm. Keberadaan senyawa antioksidan dapat mengubah warna
larutan DPPH dari ungu menjadi kuning.
Metode Folin-Ciocalteu menggunakan reagen fenol asam
fosfomolibdat-fosfotungstat yang akan mengoksidasi gugus fenolik hidroksil. Selama reaksi
belangsung, gugus fenolik-hidroksil bereaksi dengan pereaksi Folin-Ciocalteu,
membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru. Warna biru
yang terbentuk akan semakin pekat setara dengan konsentrasi ion fenolat yang
terbentuk.
J. Hipotesis
1. Fraksi etil asetat sari buah apel beludru memiliki kandungan fenolik dinyatakan
dalam mg ekivalen asam galat.
2. Fraksi etil asetat sari buah apel beludru mempunyai nilai aktivitas antioksidan
dinyatakan dengan IC50.
17 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental rancangan acak
sederhana karena subjek uji diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi etil asetat sari buah apel bludru.
2. Variabel tergantung berupa % IC.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
pemanenan, umur buah yang dipanen, dan jumlah (g) buah segar yang
digunakan.
4. Variabel pengacau tak terkendali berupa, cuaca atau musim, curah hujan, dan
kelembaban ruangan.
C. Definisi Operasional
1. Buah apel bludru adalah daging buah yang sudah masak dari tanaman apel
bludru disekitar Universitas Sanata Dharma, Paingan, Sleman, Yogakarta.
2. Sari buah apel beludru adalah hasil dari proses filtrasi berulang buah apel
beludru yang telah diblender dengan aquades.
3. Fraksi etil asetat adalah hasil fraksinasi sari buah apel bludru dengan
menggunakan etil asetat, dimana sebelumnya sari buah tersebut telah
18
4.Persen inhibition concentration (%IC) adalah persen yang menyatakan
kemampuan fraksi etil asetat sari buah apel bludru untuk menangkap radikal
DPPH.
5. Inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil asetat sari
buah apel bludru yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian
1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini antara lain: buah apel bludru
yang berasal dari kawasan Kampus III Universitas Sanata Dharma Paingan,
Sleman, Yogakarta. Bahan kimia kualitas farmasetis berupa akuades (Farmasi
Sanata Dharma). Bahan kimia kualitas pro analitik (E.Merck) berupa methanol.
Bahan kualitas pro analitik Sigma Chem. Co., USA meliputi kuersetin, DPPH ,
reagen Folin-Ciocalteu, asam galat. Bahan kualitas teknis Brataco Chemica, yaitu:
washbensin dan etil asetat.
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa vortex (jcnke &
kcnkel), spektrofotometer UV-VIS (Shimadzu), blender, corong, Bcchner, oven,
mikropipet 10-1000 µL; 1-10 mL (Acura 825, Socorex), neraca analitik (Scaltec
SBC 22, BP 160P), vacccm rotary evaporator (Jcnke & Kcnkel), waterbath
(labo-tech, Heraceus), tabung reaksi bertutup, dan alat-alat gelas yang lazim
digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tatacara Penelitian
1. Determinasi tanaman
Determinasi tanaman apel bludru dilakukan di Laboratorium
Farmakognosi-Fitokimia, Fakultas farmasi Universitas Sanata Dharma menurut
Morton (1987) dan United States of Department Agriculture NRCS.
2. Pengumpulan bahan
Buah apel beludru diperoleh dari kawasan Kampus III Universitas Sanata
Dharma Paingan, Sleman, Yogakarta. Pada dasarnya apel beludru adalah tanaman
yang berbuah periodik sepanjang taun setiap 3-4 bulan. Pemanenan dilakukan
akhir bulan januari 2013 pada buah yang sudah masak dengan warna merah
kusam pada pagi hari. Untuk penelitian digunakan buah yang tidak berbiji.
3. Preparasi buah apel bludru
Buah segar apel beludru masak yang telah dikupas dan dibersihkan
dengan air mengalir kemudian dipotong sekecil dan setipis mungkin. Diambil 350
gram daging buah segar yang telah dipotong kemudian ditambahkan akuades
hingga terendam kemudian haluskan dengan blender. Sari buah merupakan filtrat
yang diperoleh melalui penyaringan berulang dengan bantuan pompa vakum.
Kemudian residu yang tersisa diperas menggunakan kain kasa. Lalu sari buah
yang didapat di ekstraksi cair-cair menggunakan washbensin dengan
perbandingan sari buah : washbensin (1:1 v/v), kemudian didiamkan sampai
terpisah sempurna. Fase air akan berada pada paling bawah, sedangkan fase
20
Dari hasil partisi diperoleh dua fase, yaitu fraksi washbensin dan sari buah.
Selanjutnya, sari buah diekstraksi cair-cair kembali menggunakan etil asetat
dengan perbandingan sari buah : etil asetat (1:1 v/v) sehingga didapatkan sari
buah dan fraksi etil asetat. Setelah dipisahkan, fraksi etil asetat diuapkan dengan
vaccm rotary evaporator hingga pelarut etil asetat tidak mengalir. Lalu hasil
fraksi tersebut digunakan analisis lebih lanjut.
4. Pembuatan larutan pembanding dan uji
a. Pembuatan larutan asam galat
Sebanyak 10 mg asam galat dilarutkan dan di ad aquades : metanol p.a
(1:1) hingga 10 mL. Diambil sebanyak 0,5; 0,75; 1,0; 1,25; dan 1,5 mL larutan
tersebut, kemudian ditambahkan akuades : metanol p.a (1:1) sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100;
125; dan 150 µg/mL.
b. Pembuatan larutan stok kuersetin
Sebanyak 10 mg kuersetin dilarutkan dengan metanol p.a sampai 10,0
mL.
c. Pembuatan larutan intermediet kuersetin
Diambil sebanyak 1 mL larutan stok kuersetin, kemudian ditambahkan
metanol p.a sampai 10,0 mL hingga didapatkan konsentrasi 100 μg/mL.
d. Pembuatan larutan pembanding
Diambil sebanyak 0,5; 0,75; 1; 1,25; 1,5 mL larutan intermediet
diperoleh konsentrasi larutan standar kuersetin sebesar 5; 7,5; 10; 12,5; dan 15
μg/mL.
e. Pembuatan larutan DPPH
DPPH sebanyak 15,7 mg dilarutkan menggunakan metanol p.a kedalam
labu ukur 100 mL sehingga diperoleh larutan DPPH dengan konsentrasi 0,4
mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat
baru.
f. Pembuatan larutan uji
i. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 10 mg fraksi etil asetat ditimbang, lalu ditambahkan 10
metanol p.a, kemudian diambil 3 mL dan ditambahkan metanol p.a sampai
diperoleh konsentrasi larutan uji sebesar 300,0 µg/mL.
ii. Larutan uji untuk aktivitas antioksidan
Larutan stok dibuat dengan 10,0 mg fraksi etil asetat yang dilarutkan
dengan metanol p.a dan ad sampai 10,0 mL. Larutan intermediet dibuat dengan
1 mL stok yang di ad sampai 10 mL. Kemudian Diambil sebanyak 1,5; 2,0;
2,5; 3,0; 3,5 mL, lalu ditambahkan metanol p.a sampai 10,0 mL, sehingga
diperoleh konsentrasi larutan uji sebesar 15; 20; 25; 30; 35 μg/mL.
5. Uji pendahuluan
a. Uji keberadaan senyawa fenolik
Sejumlah 0,5 mL larutan uji 300,0 µg/mL dan larutan pembanding
asam galat 150,0 µg/mL ditambah 2,5 mL pereaksi fenol Folin-Ciocalteu yang
22
selama 10 menit. Tambahkan 2 mL larutan natrium karbonat 1 M setelah itu
divortex 30 detik. Kemudian amati warna larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukan ke dalam masing-masing
tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL methanol p.a,
larutan pembanding kuersetin 37,5 μg/mL , dan larutan uji 200 μg/mL.
Selanjutnya larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan
tersebut kemudian divortex selamam 30 detik. Setelah 30 menit, amati warna
pada larutan tersebut.
6. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan
menggunakan metode spektrofotometri sesuai dengan penelitian Nusarini ( 2007).
a. Penentuan OT
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan
akuades (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium
karbonat 1 M. Setelah itu, dibaca absorbansinya dengan spektrofotometer visibel
pada panjang gelombang 750 nm selama 30 menit. Dilakukan demikian juga
untuk fraksi etil asetat dengan konsentrasi 300 μg/mL.
b. Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan
1 M. Diamkan selama OT, dilakukan scanning panjang gelombang maksimum
dengan spektrofotometer visibel pada 600-800 nm.
7. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 μg/mL
ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air
(1:10 v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M.
Setelah OT, absorbansinya dibaca pada λ maksimum terhadap blanko yang terdiri
atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium
karbonat 1M. Pengerjaan dilakukan 3 kali.
b. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 300 μg/mL, lalu dimasukan ke dalam labu
takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva
baku asam galat . Kandungan fenolik total dinyatakan sebagai gram ekivalen asam
galat (mg ekivalen asam galat per g fraksi etil asetat). Lakukan 3 kali replikasi.
8. Optimasi metode uji aktivitas antioksidan
a. Penentuan panjang gelombang serapan maksimum
Larutan DPPH sebanyak 0,5; 1,0; 1,5 mL dimasukkan kedalam 3 labu
ukur 10 mL. Kemudian ditambah dengan metanol p.a hingga tanda batas
sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,060 mM. Larutan
tersebut kemudian divortex selama 30 detik. Diamkan selama OT teoritis. Lalu
dilakukan scanning panjang gelombang serapan maksimum dengan
24
b. Penentuan operating time (OT)
Sebanyak 2 mL larutan DPPH dimasukan kedalam masing-masing
tiga labu ukur 10 mL, ditambahkan masing-masing dengan 2 mL larutan
pembanding kuersetin 5,0; 10,0 dan 15,0 μg/mL. Selanjutnya larutan tersebut
ditambahkan dengan metanol p.a hingga tanda batas. Larutan tersebut
kemudian divortex selama 30 detik. Setelah itu dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum yang didapat
selama 1 jam. Dilakukan demikian juga untuk larutan uji 15,0; 25,0; 35,0
μg/mL.
9. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode
spoktrofotometri sesuai dengan penelitian Nusarini (2007).
a. Pengukuran absorbansi larutan DPPH (kontrol)
Pada labu ukur 10 mL, dimasukan sebanyak 2 mL larutan DPPH.
Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas.
Kemudian larutan tersebut dibaca absorbansinya pada saat OT dan panjang
gelombang maksimum. Pengerjaan dilakukan sebanyak 3 kali. Larutan ini
digunakan sebagai kontrol untuk menguji larutan pembanding dan larutan uji.
b. Pengukuran absorbansi larutan pembanding dan larutan uji
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam labu ukur 10 mL
kemudian ditambah dengan 2 mL larutan pembanding dan uji pada berbagai
seri konsentrasi telah dibuat. Selanjutnya larutan tersebut ditambah dengan
detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi.
Pengujian dilakukan dengan 3 kali replikasi.
c. Estimasi aktivitas antioksidan
Hasil dari prosedur 9 a dan b, dihitung nilai % IC dan IC50 untuk kuersetin
dan fraksi etil asetat buah apel bludru.
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) IC dihitung dengan rumus :
( ) – ( )
x 100%
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
pembanding, sedangkan sumbu y adalah %IC. Lalu dianalisis secara statistik
untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan
pembanding dan larutan uji.
Uji kandungan fenolik total menghasilkan nilai mg ekivalen asam galat
dalam per g fraksi etil asetat. Nilai tersebut didapatkan dari analisis regresi linier
26 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Tujuan determinasi tanaman yaitu untuk memastikan kebenaran identitas
tanaman yang hendak digunakan dalam analisis fitokimia. Maka dari itu
determinasi tanaman merupakan langkah awal yang harus dilakukan dari suatu
penelitian dengan menggunakan sampel berupa tanaman. Determinasi tanaman
apel beludru telah dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma menurut Morton (1987) dan United States of
Department Agriculture NRCS.
Pembuktian dikuatkan dengan surat determinasi (lampiran 1) tanaman
yang dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta yang menyatakan kebenaran identitas
tanaman yang digunakan dalam penelitian.
B. Hasil Pengumpulan Bahan
Buah apel beludru diperoleh dari kawasan Kampus III Universitas Sanata
Dharma Paingan, Sleman, Yogakarta. Pada dasarnya apel bludru adalah tanaman
yang berbuah periodik sepanjang tahun setiap 3-4 bulan. Pemanenan dilakukan
akhir bulan januari 2013 dengan kriteria buah yang sudah masak dengan warna
merah kusam, dilakukan pada pagi hari, tidak berbiji dan segera dilakukan
preparasi lebih lanjut pada buah yang masih segar.
Pemanenan dilakukan pada pagi hari agar kandungan metabolit sekunder
yang berfungsi sebagai antioksidan tidak berkurang, hal ini dikarenakan senyawa
antioksidan digunakan tanaman untuk melawan radiasi sinar UV didalam
tanaman (Andayani, Lisawati dan Maimunah, 2008) serta menjaga metabolit
sekunder yang terdapat dalam tanaman tidak diolah menjadi metabolit sekunder
lainnya melalui fotosintesis (World Health Organization, 2003). Alasan lain
dilakukannya pemanenan buah pada pagi hari yaitu untuk menghindari kesalahan
pengambilan buah yang masak berdasarkan warna. Berdasarkan pengamatan
peneliti buah apel beludru diselimitu bulu-bulu halus berwarna putih keemasan
yang menjadi kemerahan jika terpapar sinar matahari dalam waktu yang lama.
Berdasarkan dekripsi tanaman sesuai Morton (1987) buah apel beludru
memiliki empat hingga delapan biji buah, walaupun sering kali didapati buah
sama sekali tanpa biji. Untuk menghindari ketidakseragaman tersebut dan sesuai
kondisi pengumpulan bahan dimana didapatkan buah yang tidak berbiji, maka
dikatakan penelitian ini menggunakan buah apel beludru yang tidak berbiji.
Hasil sari buah yang didapatkan dalam penelitian ini berasal dari buah
segar yang langsung diproses sesuai cara kerja yang telah ditetapkan. Hal ini
bertujuan untuk menghindari aktivitas polifenol oksidase dari fungi yang dapat
28
C. Hasil Preparasi Sampel
1. Hasil pembuatan sari buah
Tujuan dilakukan pembuatan sari buah yang bukan merupakan metode
ekstraksi secara kimiawi didasarkan pada aplikasi buah apel beludru dalam
masyarakat sebagai bahan konsumsi dan bukan ditujukan sebagai sumber senyawa
antioksidan. Sehingga penelitian ini berguna untuk melihat aktivitas antioksidan
buah apel beludru saat dikonsumsi sebagai sari buah.
Sari buah dibuat melalui proses penghalusan menggunakan blender dan
penyaringan yang dibantu pompa vakum. Rangkaian proses ini termasuk metode
ekstraksi secara fisis-mekanis karena bertujuan menarik cairan dari padatan
(Suyitno, 1989). Awalnya 350 g buah apel bludru segar yang telah dikupas dan
dicuci air mengalir dipotong sekecil dan setipis mungkin untuk memudahkan
proses penghalusan. Penghalusan dengan blender dilakukan sampai semua bahan
berubah menjadi seperti bubur skim dan tidak terdapat bagian yang masih kasar.
Ekstraksi fisis-mekanis bergantung pada kehalusan bahan (besar-kecilnya
hancuran) dimana semakin kecil ukuran maka luas permukaan untuk setiap satuan
berat semakin besar dan cairan yang terekstraksi akan optimal. Faktor lain yang
mempengaruhi hasil ekstraksi mekanis adalah kandungan cairan dimana semakin
tinggi kandungan cairan maka akan menghasilkan ekstrak yang lebih banyak
(Suyitno, 1989). Sehingga sebelum proses penghalusan tersebut, ditambahkan
akuades sebanyak 600 mL hingga semua potongan buah segar terendam dan
nantinya berguna untuk meningkatkan volume sari buah yang dihasilkan.
2 - 2,5 jam sampai ampas terlihat padat dan mengeras. Kemudian residu yang
tersisa diperas menggunakan kain kasa untuk mendapatkan sisa cairan yang
mungkin masih terkandung. Setelah didapat sari buah keruh, selanjutnya
dilakukan refiltrasi agar didapat sari buah jernih yang memudahkan proses partisi
pada proses selanjutnya. Total sari buah yang didapat dengan penambahan
akuades 600 mL adalah 470 mL.
Untuk mengekstraksi senyawa fenolik dalam bahan tumbuhan dapat
dilakukan dengan pelarut polar seperti etanol, metanol, n-butanol, aseton,
dimetilsulfoksida, dimetilformamida, dan air (Markham, 1988). Sari buah yang
didapat diharapkan mengandung senyawa fenolik yang hendak diuji karena
digunakan akuades yang juga berperan sebagai pelarut polar.
2. Hasil fraksinasi sari buah
Sari buah apel beludru yang didapat kemudian diekstraksi menggunakan
washbensin untuk menarik senyawa non polar. Indeks polaritas washbensin
adalah 3,8 yang bersifat sangat non polar, sehingga dapat digunakan untuk
mengekstraksi senyawa non polar seperti klorofil, vitamin, minyak dan lemak
(Snyder 1997).
Penggunaan washbensin untuk menarik senyawa nonpolar dari air sesuai
metode ekstraksi cair-cair dimana prinsip pemisahan senyawanya berdasarkan
kepolaran dengan dua pelarut yang kepolaranya berbeda. Sari buah yang didapat
diekstraksi menggunakan washbensin dengan perbandingan (1:1), sehingga
30
dari 100 mL sari buah dan 100 mL washbensin. Setelah itu akan terbentuk 2 fase
dalam corong pisah yang terdiri dari fase washbensin pada bagian atas dan fase air
pada bagian bawah. Berat jenis washbensin (0,730) lebih kecil dibanding air
(0,996) (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995), hal ini
yang menyebabkan washbensin berada pada bagian atas.
Langkah tersebut dilakukan sebanyak tiga kali. Dilakukan. Ekstraksi
cair-cair dilakukan berulang disesuaikan dengan hukum nerst yang prinsipnya
ektraksi cair-cair berulang akan lebih efektif dibanding ektraksi tunggal (Bassett,
et al., 1991).
Fase air yang didapat dari proses ekstraksi dengan washbensin kemudian
diekstraksi kembali menggunakan etil asetat (1:1) dan dilakukan sebanyak 3 kali.
Etil asetat yang berbobot jenis kecil dibandingkan dengan air (0,898 : 0,996)
(Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995) akan berada pada
bagian atas. Ekstraksi menggunakan etil asetat yang bersifat lebih non polar
dibanding air ditujukan untuk menarik senyawa aglikon yang hendak diuji.
Memang tidak diketahui secara pasti senyawa fenol apa yang terkandung dalam
tanaman apel beludru (Diospyros blancoi), sehingga pendakatan yang dilakukan
untuk memprediksi kandungan senyawa fenoliknya adalah dengan melihat
kandungan metabolit tanaman yang masih satu genus. Menurut Duke (2011)
Diospyros virginiana L mengandung senyawa fenolik kuersetin.
Kuersetin adalah salah satu golongan flavones yang merupakan senyawa
aglikon yang bersifat lebih non polar (Andersen and Markham, 2006). Maka dari
flavonoids dengan golongan isoflavones, flavanones, methylated flavones, and
flavonols (Andersen and Markham, 2006).
Fraksi etilasetat yang didapat kemudian diuapkan pelarutnya dengan
vacccm rotary evaporator supaya tidak merusak kestabilan senyawa fenolik. Hal
ini dikarenakan vaccum rotary evaporator dapat menguapakan suatu pelarut
dibawah titik didihnya melalui prinsip titik didih yang akan turun ketika tekanan
diturunkan (Dave, 2010). Bobot fraksi etil asetat yang didapat sebesar 140 mg dan
rendemen fraksi etil asetat yang didapat adalah 0,046%.
D. Hasil Uji Pendahuluan
1. Uji pendahuluan keberadaan senyawa fenolik
Uji kualitatif senyawa fenolik pada fraksi etil asetat ini memakai prinsip
reaksi oksidasi-reduksi pada suasana basa. Dalam suasana basa yang berasal
natrium karbonat, senyawa fenolik akan berubah menjadi ion fenolat. Ion fenolat
bersifat lebih reaktif terhadap adanya pereaksi fenol Folin- Ciocalteu. Asam
fosfomolibdat-fosfotungstat dalam pereaksi fenol Folin- Ciocalteu akan tereduksi
oleh ion fenolat tersebut sehingga akan terbentuk larutan dengan warna biru
(Singleton dan Rossi, 1965). Pengujian menunjukkan hasil positif dengan larutan
uji berwarna biru seperti kontrol positif (gambar 7). Hal ini menunjukkan bahwa
32
Gambar 7. Hasil uji pendahuluan keberadaan senyawa fenolik (A = kontrol negatif [Folin Ciocalteu dan Na2CO3], B = kontrol positif [Asam Galat + Folin Ciocalteu
dan Na2CO3 ], C= larutan uji [fraksi etil asetat sari buah apel beludru + Folin
Ciocalteu dan Na2CO3], D =Asam Galat, E =Fraksi etil asetat sari buah apel bludru)
2. Uji pendahuluan aktivitas antioksidan
Uji pendahulan ini bertujuan untuk megetahui secara kualitatif apakah
fraksi etil asetat sari buah apel beludru memiliki aktivitas antioksidan atau tidak.
Uji ini berdasarkan reaksi antara radikal DPPH dengan senyawa antioksidan.
Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu
menjadi kuning (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
DPPH merupakan radikal bebas yang stabil pada suhu ruangan dan
berwarna violet dalam metanol. Radikal yang bereaksi dengan antioksidan
tersebut dapat merusak rantai yang bertanggung jawab sebagai warna ungu dan
menjadi warna kuning (Badarinath et al., 2010)
Pengujian menunjukkan hasil positif dengan larutan uji berwarna kuning
seperti kontrol positif (gambar 8). Hal ini menunjukkan bahwa fraksi etil asetat
sari buah apel beludru memiliki aktivitas antioksidan. E D
A B C
Gambar 8. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif [blanko DPPH], B =kontrol positif [kuersetin + DPPH], C = larutan uji [fraksi etil asetat sari
buah + DPPH], D =kuersetin, E=Fraksi etil asetat sari buah apel beludru)
E. Hasil Optimasi Metode Uji Fenolik Total
1. Penentuan operating time (OT)
Penentuan operating time dilakukan dengan tujuan untuk mendapatkan
rentang waktu dimana reaksi antara baku pembanding (asam galat) dan larutan uji
(fraksi etil asetat sari buah) terhadap reagen (Folin Ciocalteu) yang diberikan telah
optimum. Penentuan operating time didasarkan dari waktu dimana absorbansi dari
baku pembanding dan larutan uji terhadap reagen mulai stabil atau selisih
absorbansi mulai kecil antara selang waktu yang diujikan. Estimasi waktu yang
dilihat adalah dalam waktu tiga puluh menit (asam galat) dan 60 menit (fraksi etil
asetat) dengan selang waktu lima menit. Panjang gelombang maksimum yang
dipakai adalah panjang gelombang yang telah didapatkan dalam penetapan lamda
maks teoritis, yaitu 750 nm.
E D
B C
34
Gambar 9. Grafik penentuan OT asam galat (Replikasi 3)
Dari hasil yang ditunjukan dengan grafik (gambar 5) OT yang didapatkan
untuk pengukuran asam galat adalah 20 menit. Serta hasil OT yang didapatkan
untuk pengukuran fraksi etil asetat adalah 40 – 50 menit (Lampiran, 12b).
2. Penentuan panjang gelombang serapan maksimum ( λ maks)
Panjang gelombang maksimum dimaksudkan untuk mendapatkan
serapan maksimum dari hasil reaksi antara asam galat dengan pereaksi
Folin-Ciocalteu. Pengukuran pada panjang gelombang maksimum akan menimbulkan
perbedaan respon yang besar untuk setiap beda konsentrasi. Dalam penentuan
panjang gelombang maksimum dilakukan pada 3 konsentrasi, yaitu pada
konsentrasi tinggi, tengah dan rendah, yaitu 50; 100; dan 150 µg/mL. Hal ini
bertujuan untuk merepresentasikan panjang gelombang maksimum dari setiap
konsentrasi.
Panjang gelombang yang didapatkan dari ketiga konsentrasi tersebut
adalah 751,0 nm.
Penentuan Operating time Asam Galat
50,50 µg/mL 101 µg/mL 151,50 µg/mL
Tabel I. Hasil scanning panjang gelombang maksimum asam galat yang direaksikan dengan Folin Ciocalteu
Konsentrasi larutan
Asam galat hasilλ maksimum scanning(nm) yang digunakan λ maksimum
λ maksimum teoritis
150 µg/mL 751,0
751,0 750
100 µg/mL 751,0
50 µg/mL 751,0
Untuk memastikan tidak adanya gangguan pembacaan absorban maka
dilakukan scanning pada larutan pembanding asam galat (Lampiran 11) dan
larutan uji fraksi etil asetat (Lampiran 6e) pada panjang gelombang maksimum
751 nm dan hasilnya menunjukkan tidak adanya serapan. Artinya tidak terdapat
kontaminan atau senyawa lain terukur pada panjang gelombang tersebut sehingga
dapat mengganggu pengukuran karena adanya interferensi atau overlapping.
F. Estimasi Kandungan Fenolik Total
Senyawa yang berperan utama dalam aktivitas antioksidan adalah
senyawa fenolik. Senyawa fenolik banyak terdistribusi dalam tanaman, maka
perlu dilakukan perhitungan kandungan fenolik total yang mungkin tedapat pada
fraksi etil asetat sari buah apel beludru tersebut. Prinsip metode kolorimetri Folin
Ciocalteu adalah reaksi oksidasi yang cepat dari fenol dengan menggunakan alkali
(biasanya sodium karbonat), dimana nilai yang didapat signifikan dengan
konsentrasi ion fenolat (Cicco dan Latanzio, 2011).
Kompleks biru yang terbentuk terjadi dengan reaksi oksidasi reduksi dari
36
dari senyawa fenol oleh reagen molibdotungstat dengan produk warna biru sekitar
panjang gelombang 745-750 nm (Ronald,et al., 2005).
Hasil molar warna biru yang terbentuk sebanding dengan jumlah ion
fenolik yang teroksidasi oleh kompleks fosfotungstat-fosfomolibdat, juga semakin
pekatnya warna biru yang terbentuk juga menandakan semakin banyak kompleks
fosfotungstat-fosfomolibdat yang tereduksi (Singleton and Rossi, 1985).
Pembuatan kurva kalibrasi asam galat dilakukan sebanyak tiga kali dan
untuk menentukan kandungan fenolik total digunakan persamaan dengan nilai r
terbaik.
Tabel II. Hasil pengukuran absorbansi seri baku asam galat yang direaksikan dengan folin-ciocalteu
Asam galat
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
(µg/mL) Absorbansi terukur Konsentrasi (µg/mL) Absorbansi terukur Konsentrasi (µg/mL) Absorbansi terukur
Gambar 10. Kurva kalibrasi asam galat dalam penetapan fenolik total
Tabel III. Hasil penentuan jumlah fenolik total fraksi etil asetat sari buah apel beludru
Dari ketiga persamaan yang telah didapatkan (Tabel II)dipilih persamaan
yang memiliki nilai r terbaik. Persamaan regresi linear yang paling baik diperoleh
dari replikasi III dengan y = 5,3782.10-3 x – 0,0564 dan R sebesar 0,9997. Nilai r
yang semakin baik menunjukkan koefisien korelasi yang baik dimana akan
membentuk garis lurus. Hal tersebut menunjukkan kesebandingan antara
penambahan konsentrasi asam galat dan penambahan absorbansi. Berdasarkan
perhitungan intrapolasi persamaan regresi linear y = 5,3782.10-3 x – 0,0564, maka
didapatkan kandungan fenolik total fraksi etil asetat sari buah apel beludru sebesar
(393,5 ± 0,35) mg ekivalen asam galat per g fraksi etil asetat.