i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Lina NIM: 058114093
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Lina NIM: 058114093
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
Jangan khawatirkan diri Anda sendiri dengan apa yang telah Anda coba tapi gagal, tapi dengan apa yang masih mungkin Anda lakukan (Paus Yohanes XXIII).
Karya ini kupersembahkan kepada: Tuhan Yesus Kristus, sumber segala kasih karunia sekarang dan selamanya!!
vii
sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Uji Aktivitas Penangkapan Radikal Hidroksil oleh Fraksi Etil Asetat Ekstrak Metanolik Alga Coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh dengan Metode Deoksiribosa”. Skripsi ini disusun guna memenuhi salah satu syarat untuk mendapatkan gelar Sarjana Farmasi (S. Farm.) pada Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Dalam penulisan skripsi ini, penulis banyak mendapatkan bantuan dari berbagai pihak berupa material, bimbingan, dorongan, nasehat maupun sarana dan prasarana. Pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Dra. Nora Iska H., M.Si., Apt. selaku dosen pengampu proyek atas segala bantuan material dan pengarahan yang telah diberikan.
3. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen pembimbing yang telah memberikan bimbingan dan saran dari awal hingga teselesaikannya skripsi.
viii
membimbing penulis saat mengalami kesulitan dalam penelitian.
7. Dr. Sabikis, Apt. sebagai guru yang memberikan banyak ilmu tentang reaksi-reaksi kimia khususnya reaksi redoks yang sangat rumit.
8. Semua dosen-dosen yang telah memberikan ilmu selama penulis menempuh pendidikan di Fakultas Farmasi Sanata Dharma, Yogyakarta. 9. Papa, mama, koko, tante dan semua keluarga yang telah memberikan
dukungan material maupun spiritual selama kehidupan penulis.
10.Felisia sebagai rekan kerja dalam penelitian, Siska, Alfa, dan Nia atas waktu, kesabaran, dan dukungan yang diberikan dalam suka dan duka. 11.Teman-teman kos “Zusi Arib”, Mbak Mitha, Mbak Ntrie, Mbak Cici,
Mbak Evi, Madum, Kasis, Thea, Ina, Mukti, Pipi, Iles, Dona dan Jela atas kebersamaan selama ini.
12.Teman-teman kelas B, khususnya Melda, Lise dan Lina Boy atas persahabatan yang terjalin saat perkuliahan.
ix
15.Rekan-rekan seperjuangan laboratorium, Ko Robby, Fian, Yoyok, David, Adryan, Happy atas keceriaan yang diberikan saat penelitian berlangsung. 16.Semua pihak dan teman-teman yang telah memberikan bantuan dan
dukungan yang tidak dapat disebutkan satu per satu.
Akhir kata, penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna. Atas keterbatasan dan kekurangan dalam penyusunannya, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi pembaca serta perkembangan ilmu pengetahuan.
Yogyakarta, November 2008
x
HALAMAN PERSETUJUAN PEMBIMBING………....……... iii
HALAMAN PENGESAHAN……….iv
HALAMAN PERSEMBAHAN………..….………...v
PRAKATA... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI... x
DAFTAR TABEL…... xiv
DAFTAR GAMBAR...………...………....xv
DAFTAR LAMPIRAN... xvi
INTISARI... xvii
ABSTRACT... xviii
BAB I PENGANTAR... 1
A. Latar Belakang ... 1
B. Perumusan Masalah... 3
C. Keaslian Karya... 3
D. Manfaat Penelitian ... 5
1. Manfaat teoritis ... 5
xi
2. Tujuan khusus ... 6
BAB II PENELAAHAN PUSTAKA... 7
A. Alga Coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh ... 7
B. Polifenol Florotannin ... 8
1. Struktur polifenol florotannin………8
2. Kelarutan florotannin……….9
3. Sifat antioksidan polifenol florotannin...11
C. Antioksidan. ... 13
1. Pengertian antioksidan……….13
2. Jenis antioksidan………...13
3. Mekanisme penangkapan radikal bebas………..14
4. Manfaat antioksidan……….15
D. Penyarian ... 15
E. Radikal Hidroksil ... 19
1. Pengertian radikal hidroksil……….19
2. Pembentukan radikal hidroksil………20
3. Metode untuk mendeteksi radikal hidroksil………21
xii
BAB III METODOLOGI PENELITIAN ...30
A. Jenis Rancangan Penelitian... 30
B. Variabel Penelitian ... 30
C. Definisi Operasional ... 31
D. Bahan-bahan Penelitian ... 32
E. Alat-alat Penelitian... 32
F. Tata Cara Penelitian ... 33
1. Preparasi Sampel Alga Coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh………..……….……….……….33
a. Pembuatan serbuk sampel alga coklat ……...………....………… 33
b. Penetapan kadar air dalam serbuk alga coklat ………... 33
2. Isolasi Crude Florotannin dari Serbuk Alga Coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh... 33
a. Pembuatan ekstrak metanol alga coklat …..………..…... 33
b. Fraksinasi ekstrak metanol alga coklat ……...…………...………….. 34
3. Uji Kualitatif Senyawa Fenolik... 34
xiii
BAB IV HASIL DAN PEMBAHASAN ... 41
A. Persiapan Sampel Alga Coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh... 41
B. Isolasi Crude Florotannin dari serbuk Alga Coklat Sargassum hystrix ……. 45
C. Uji Kualitatif Senyawa Fenolik ………...… 47
D. Penentuan Operating Time... 48
E. Penentuan Panjang Gelombang Maksimum (λmaks) ... 51
F . Uji Aktivitas Penangkapan Radikal Hidroksil oleh Fraksi Etil Asetat...53
BAB V KESIMPULAN DAN SARAN... 60
A. Kesimpulan ... 60
B. Saran... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN... 69
xiv
Tabel II. Hasil penetapan kadar air dalam serbuk alga coklat...44 Tabel III. Penurunan absorbansi kromogen MDA-TBA pada penambahan tanin... 53 Tabel IV. Persen scavenging dan ES50 senyawa standar tanin... 54 Tabel V. Absorbansi MDA-TBA pada berbagai penambahan konsentrasi fraksi etil
asetat……… 55 Tabel VI. Tabel hasil uji statistik perbandingan aktivitas fraksi dan kontrol
xv
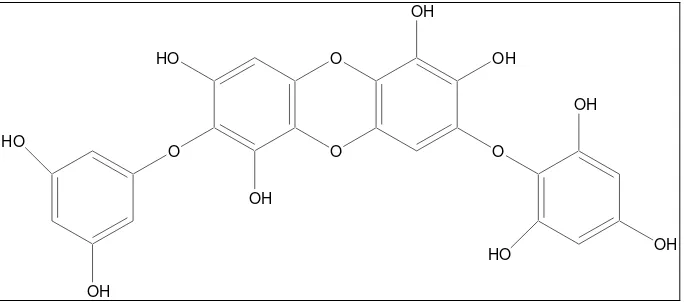
Gambar 1. Struktur floroglusinol dan florotannin……….……..……...……10
Gambar 2. Struktur kimia difloretohidroksikarmalol... 12
Gambar 3. Reaksi pembentukan radikal hidroksil... 20
Gambar 4. Struktur gula deoksiribosa ... 22
Gambar 5. Pembentukan MDA dari 2-deoksiribosa yang diserang radikal hidroksil dengan adanya O2……..………...…....23
Gambar 6. Struktur malonaldehid….…………...……..………... 23
Gambar 7. Diagram spektrofotometer visibel ... 27
Gambar 8. Reaksi oksidasi monofenol dan difenol oleh polifenol oksidase... 43
Gambar 9. Kurva penetapan operating time kromogen MDA-TBA... 49
Gambar 10. Reaksi pembentukan enol pada TBA.………….………..…….... 50
Gambar 11. Usulan reaksi pembentukan kromogen MDA-TBA...………….... 50
Gambar 12. Struktur kromogen MDA-TBA …..…….………...……….……. 51
Gambar 13. Kurva scanning panjang gelombang maksimum kromogen MDA-TBA……….. 52
Gambar 14. Grafik konsentrasi fraksi etil asetat (mg/ml) vs absorbansi rata-rata kromogen MDA-TBA ………...………... 55
xvi
Lampiran I. Data penetapan kadar air dengan Moisture Balance…..……... 69
Lampiran II. Data perhitungan konsentrasi reagen dan fraksi etil asetat…...……... 71
Lampiran III. Perhitungan konsentrasi deoksiribosa pada penetapan panjang gelombang maksimum………...…………...………….. 78
Lampiran IV. Uji penangkapan radikal hidroksil………..………... 79
Lampiran V. Foto fraksinasi ekstrak metanol alga coklat.…………... 91
Lampiran VI. Foto fraksi etil asetat... 91
xvii
antioksidan yang potensial mencegah kerusakan oksidatif melalui penangkapan radikal bebas.
Penelitian ini bertujuan untuk mengetahui adanya dan nilai aktivitas penangkapan radikal hidroksil fraksi etil asetat ekstrak metanolik alga coklat Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh dengan metode deoksiribosa. Aktivitas penangkapan radikal hidroksil dinyatakan dalam % penangkapan (% scavenging) dan effective scavenging 50 (ES50).
Metode deoksiribosa menggunakan reagen Fenton untuk menghasilkan radikal hidroksil, deoksiribosa sebagai makromolekul terdegradasi, asam trikloroasetat (TCA) dan asam tiobarbiturat (TBA) untuk membentuk suatu kromogen berwarna pink yang diukur absorbansinya pada panjang gelombang 532 nm. Analisis data digunakan regresi linier dengan sumbu x sebagai konsentrasi fraksi etil asetat dan sumbu y sebagai % scavenging. ES50 merupakan konsentrasi fraksi etil asetat yang memiliki % scavenging senilai 50%.
Hasil penelitian menunjukkan fraksi etil asetat tidak memiliki aktivitas penangkapan radikal hidroksil pada konsentrasi 0,02 mg/ml tetapi aktivitas prooksidan pada konsentrasi 0,03 mg/ml atau lebih. Hilangnya aktivitas antioksidan disebabkan polifenol florotanin telah teroksidasi selama masa penyimpanan sehingga pengendalian stabilitas senyawa harus diperhatikan.
xviii by free radicals scavenging activity.
The aim of this study is to recognize the existence and the value of radical hydroxyl scavenging activity of ethyl acetate fraction from methanolic extract of brown algae Sargassum hystrix v. Buxifolium (Chauvin) J. Agardh by deoxyribose method. The hydroxyl radicals scavenging activity is expressed in % scavenging and effective scavenging 50 (ES50).
The deoxyribose method uses Fenton’s reagent to produce hydroxyl radicals, deoxyribose sugar as the degraded macromolecules, trichloroacetic acid (TCA) and thiobarbituric acid (TBA) to form pink chromogen which absorbs at maximum wavelength at 532 nm. Data was analysed by linier regression with concentration of ethyl acetate fraction as x-axis and % scavenging as y-axis. ES50 is concentration of ethyl acetate fraction which has 50% scavenging activity.
Ethyl acetate fraction was found have no radical hydroxyl scavenging activity at concentration 0.02 mg/ml, but prooxidant activity at 0.03 mg/ml and more. Loss of activity was caused by polyphenol phlorotannin oxidated during storage, therefore stability control must be attented.
1
A. Latar Belakang
Reactive Oxygen Species (ROS) merupakan metabolit fisiologis yang terbentuk selama kehidupan aerobik sebagai hasil metabolisme oksigen. ROS
memiliki kategori yang luas, tidak hanya radikal oksigen seperti radikal anion
superoksida (O2·-), radikal hidroksil (OH·) atau nitro oksida (NO·), tetapi juga
beberapa derivat oksigen non radikal yang berbahaya seperti H2O2, dan anion
peroksinitrit (ONOO-) (Zusterzeel, 2001).
Diantara berbagai jenis ROS, radikal hidroksil merupakan radikal oksigen
yang paling reaktif, sangat potensial menimbulkan kerusakan oksidatif biologis dan
diketahui terlibat sebagai faktor patogenik dalam berbagai penyakit (Gutteridge dan
Halliwell, 1994). Kanker, arterosklerosis, dan arthritis merupakan penyakit-penyakit
yang disebabkan oleh kerusakan oksidatif (Gupta et al., 2007).
Antioksidan dapat mengatasi kerusakan oksidatif secara tidak langsung
dengan meningkatkan pertahanan alami sel (Aruoma, 1996; Schinella et al., 2002) dan secara langsung dengan menangkap spesies radikal bebas (Liu dan Ng, 2000).
Penggunaan antioksidan alami mempunyai keuntungan, yaitu aman sehingga mudah
untuk diterima konsumen terutama jika komponen tersebut telah memenuhi GRAS
Di tahun belakangan ini, beberapa spesies alga yang merupakan salah satu
material alami dilaporkan mampu mencegah kerusakan oksidatif sebagai scavanger
radikal bebas dan oksigen aktif, sehingga mencegah kemungkinan pembentukan sel
kanker. Polifenol dalam alga coklat yang disebut florotannin diketahui berperan
sebagai antioksidan yang potensial (Ragan dan Glombitza, 1986). Florotannin
merupakan senyawa polifenol yang tidak ditemukan pada tumbuhan terrestrial, tetapi
hanya pada tumbuhan alga khususnya alga coklat (Burtin, 2003). Luas laut Indonesia
yang besar, sebaran yang melimpah dan kemampuan reproduksi yang besar
menjadikan alga coklat sangat potensial untuk dimanfaatkan.
Mengacu pada penelitian Stephanie (2007), alga Sargassum hystrix v. buxifolium (Chauvin) J. Agardh diketahui mengandung polifenol florotannin dengan kadar 5,7 ± 0,54 mg PE/g fraksi. Oleh karena itu, perlu dilakukan uji lebih lanjut
mengenai potensi polifenol tersebut sebagai antioksidan. Penelitian ini telah
dilakukan secara in vitro dengan menggunakan metode deoksiribosa, yaitu pengukuran aktivitas antioksidan polifenol berdasarkan kemampuannya dalam
menangkap radikal hidroksil. Nilai kemampuan penangkapan radikal hidroksil oleh
fraksi dinyatakan sebagai persen scavenging dan juga effective scavenging 50 (ES50) yaitu kemampuan penangkapan radikal hidroksil senilai 50%.
Metode deoksiribosa merupakan metode yang sederhana (simple test-tube method) (Halliwel dan Gutteridge, 1988), memiliki sensitivitas tinggi, tidak memerlukan alat yang canggih dalam analisisnya (Halliwell dan Grootveld, 1988 cit
ini telah digunakan secara luas untuk pengujian radikal bebas. Prinsip metode ini
berdasarkan pemecahan oksidatif 2-deoksiribosa oleh senyawa radikal hidroksil
(Halliwell dan Grootveld, 1988 cit Conte, 1996) yang dihasilkan dari reagen Fenton.
B. Perumusan Masalah
Dari uraian di atas, maka rumusan masalah difokuskan sebagai berikut :
1. Apakah fraksi etil asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh memiliki aktivitas penangkapan radikal hidroksil dengan metode deoksiribosa yang dinyatakan dengan persen
scavenging ?
2. Berapakah nilai aktivitas penangkapan radikal hidroksil oleh fraksi etil asetat
ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh dengan metode deoksiribosa yang dinyatakan sebagai effective scavenging 50 (ES50) ?
C. Keaslian Karya
Sejauh pengamatan penulis, penelitian tentang uji penangkapan radikal
hidroksil dengan metode deoksiribosa pernah dilakukan oleh:
1. Purwantoko (2006) dengan judul “Validasi Metode Deoksiribosa sebagai Uji
2. Setyawati (2006) dengan judul “Uji Penangkapan Radikal Hidroksil oleh
Fraksi Etil Asetat dan Fraksi Air Ekstrak Teh Hitam dengan Metode
Deoksiribosa”
3. Kuntari (2007) dengan judul “ Uji Aktivitas Penangkapan Radikal Hidroksil
oleh Ekstrak Etanol Teh Hijau dan Teh Hitam dengan Metode Deoksiribosa.
Penelitian tentang potensi antioksidan alga coklat pernah dilakukan oleh:
1. Ahn et al. (2007) dengan judul “ Antioxidant Activities of Phlorotannins Purified from Ecklonia cava on Free Radical Scavenging Using ESR and H2O2-Mediated DNA Damage”. Penelitian menggunakan spesies alga coklat
yang berbeda yaitu Ecklonia cava dan metode Electron Spin Resonance untuk mendeteksi radikal hidroksil.
2. Heo et al. (2006) dengan judul “ Identification of Chemical Structure and Free Radical Scavenging Activity of Diphlorethohydroxycarmalol Isolated from a
Brown Alga, Ishige okamurae”. Penelitian menguji aktivitas isolat florotannin difloretohidroksikarmalol dari spesies alga coklat yang berbeda yaitu Ishige okamurae menggunakan metode Electron Spin Resonance untuk mendeteksi radikal hidroksil.
3. Patra et al. (2008) dengan judul “Evaluation of Antioxidant and Antimicrobial Activity of Seaweed (Sargassum sp) Extract: A Study on Inhibition of Glutathione-S-Transferase Activity”. Penelitian menggunakan ekstrak
Perbedaan dengan penelitian sebelumnya adalah bahwa pada penelitian ini
akan dilakukan uji penangkapan radikal hidroksil menggunakan metode deoksiribosa
pada fraksi etil asetat ekstrak metanolik spesies alga coklat yang berbeda, yaitu
Sargassum hystrix v. buxifolium (Chauvin) J. Agardh.
D. Manfaat Penelitian
1. Manfaat teoritis
Mengetahui aktivitas penangkapan radikal hidroksil oleh fraksi etil
asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium
(Chauvin) J. Agardh yang dinyatakan sebagai persen scavenging dan
effective scavenging 50 (ES50). 2. Manfaat metodologis
Penelitian ini dapat dijadikan acuan penggunaan metode
deoksiribosa pada uji daya antioksidan.
3. Manfaat praktis
Penelitian ini dapat memberi informasi tentang daya antioksidan alga
Sargassum hystrix v. buxifolium (Chauvin) J. Agardh, sehingga bisa dimanfaatkan sebagai salah satu alternatif pemeliharaan kesehatan
E. Tujuan Penelitian
1. Tujuan umum
Tujuan umum penelitian ini adalah menguji daya antioksidan fraksi
etil asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium
(Chauvin) J. Agardhdengan metode deoksiribosa.
2. Tujuan khusus
a. Mengetahui adanya aktivitas penangkapan radikal hidroksil oleh fraksi
etil asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh yang dinyatakan dengan persen
scavenging.
b. Mengetahui nilai aktivitas penangkapan radikal hidroksil oleh fraksi
7
A. Alga CoklatSargassum hystrix v. buxifolium (Chauvin) J. Agardh
Alga Sargassum merupakan salah satu marga Sargassum termasuk dalam kelas Phaeophyceae. Habitat alga Sargassum tumbuh diperairan pada kedalaman 0,5-10 m ada arus dan ombak. Alga Sargassum tumbuh berumpun dengan untaian cabang-cabang. Pertumbuhan alga ini sebagai makro alga melekat pada substrat dasar
perairan. Di daerah tubir tumbuh membentuk rumpun besar, panjang thalli utama mencapai 0,5-3 m dan tiap-tiap percabangan terdapat gelembung udara berbentuk
bulat yang disebut “bladder”, berguna untuk menopang cabang-cabang thalli
terapung ke arah permukaan air untuk mendapatkan intensitas cahaya matahari (Kadi,
2007).
Ciri-ciri Sargassum hystrix v. buxifolium (Chauvin) J. Agardh adalah ukuran tanaman sedang, tinggi sampai 5 dm, dengan beberapa cabang utama dan banyak
cabang lateral pendek tempat melekatnya daun, panjang daun mencapai 6 cm, lebar
1,5 cm, bentuk oval atau memanjang, tepi daun berbentuk serratus, mempunyai beberapa stomata yang kebanyakan terletak pada bagian distal daun dan biasanya
steril (Taylor, 1972).
dan vitamin C), mineral, karotenoid (fucoxantin, β-caroten, violaxantin) serta
polifenol (tertinggi pada alga coklat) (Burtin, 2003).
B. Polifenol Florotannin
1. Struktur polifenol florotannin
Polifenol dalam alga coklat disebut florotannin dan diketahui berpotensi
sebagai antioksidan. Florotannin terbentuk dari polimerasi monomer floroglusinol
(1,3,5-trihidroksibenzen) dan disintesis melalui jalur asetat malonat dalam alga laut
(Ragan dan Glombitza, 1986). Senyawa florotannin memiliki struktur unik yang tidak
ditemukan dalam tanaman terrestrial (Shibata et al., 2003). Senyawa dengan rangka dibenzo-1,4-dioksin ini memiliki bobot molekul rendah (300-800) dan struktur yang
rigid sehingga memungkinkan dalam berinteraksi kuat dengan berbagai molekul
biologis (Kang et al., 2003; Glombitza dan Gerstberger, 1985). Kandungan tertinggi florotannin ditemukan dalam alga coklat, berkisar dari 5-15 % berat kering (Ragan
dan Craigie, 1973; McInnes et al., 1984; Glombitza dan Keusgen, 1995).
Florotannin adalah dehidro-oligomer dan dehidropolimer floroglusinol yang
strukturnya sudah terelusidasi lebih dari 150 senyawa (Ragan dan Glombitza, 1986).
Unit-unit monomer terhubung melalui ikatan aril-aril dan ikatan diaril eter
membentuk berbagai kelompok florotannin yang berbeda (Glombitza dan Pauli,
2003). Ketika cincin aromatis terhubung hanya melalui ikatan aril-aril, terbentuklah
(Gambar 1, iii). Fuhalol terdiri dari unit floroglusinol yang dihubungkan dengan
ikatan eter pada posisi para dan orto serta satu tambahan gugus –OH di setiap cincin ketiga (Gambar 1, v). Ketika ada satu atau tiga cincin dengan komponen
dibenzodioksin yang tersubstitusi gugus fenoksil pada C-4, kelompok ini dinamakan
eckol (Gambar 1, vii). Endofucofloretol (Gambar 1, iv) and isofuhalol (Gambar 1, vi)
merupakan kelompok kecil, khusus dan jarang ditemukan (Koivikko, 2008).
2. Kelarutan polifenol
Senyawa fenolik umumnya paling larut dalam cairan penyari yang kurang
polar daripada air. Pemilihan pelarut yang disarankan adalah campuran air dan
metanol, etanol atau aseton (Waterman dan Mole, 1994). Menurut Koivikko et al. (2005), kelarutan florotannin paling besar adalah di larutan 70% aseton dalam air,
sedangkan pada penelitian yang dilakukan Nagayama et al. (2002), isolasi florotannin dari alga coklat diawali dengan ekstraksi 800 g alga coklat menggunakan metanol
2400 ml dan dilanjutkan dengan fraksinasi menggunakan metanol (240 ml),
kloroform (480 ml) dan akuades (180 ml). Fase metanol-akuades kemudian
diekstraksi dua kali menggunakan etil asetat (300 ml). Fraksi etil asetat inilah yang
(i) (v )
(ii) (vi)
(iii) (vii)
(iv)
3. Sifat antioksidan polifenol florotannin
Florotannin dalam alga coklat (Phaeophyta) tersimpan dalam vesikel dalam
sel (Ragan dan Glombitza 1986; Schoenwaelder dan Clayton, 2000). Florotannin
memiliki peran yang penting dalam konstruksi dinding sel alga coklat
(Schoenwaelder dan Clayton, 1998) dan seperti tanin dalam tanaman vaskular,
mereka mempunyai kemampuan dalam mempresipitasikan protein dan menyerap
radiasi UV. Terlebih lagi, senyawa ini merupakan polifenol yang memiliki sifat
antioksidan yang kuat (Shin et al., 2006). Kim et al. (2004) dan Kang et al. (2006) melaporkan bahwa beberapa florotannin pada penelitian aktivitas antioksidan alga
coklat memperlihatkan efek inhibisi terhadap lipid peroksidasi dan efek sitoprotektif
terhadap stress oksidatif yang menginduksi kerusakan sel.
Mekanisme aksi polifenol sebagai antioksidan adalah melalui kemampuan
gugus fenol untuk menangkap radikal bebas dengan memberikan atom hidrogennya
melalui proses transfer elektron, sehingga fenol berubah menjadi radikal fenoksil
(Janeiro dan Brett, 2004). Sifat antioksidan polifenol meningkat sesuai dengan
reaktivitasnya sebagai donor elektron atau hidrogen dan kemampuannya dalam
mengkelat ion logam transisi (Rice-Evans et al., 1997) serta kemampuan radikal derivat polifenol untuk menstabilkan dan mendelokalisasikan elektron tidak
berpasangan (fungsi pemutusan rangkaian reaksi).
Aktivitas antioksidan florotannin telah dilaporkan oleh Kang et al. (2003) dan Nakamura et al. (1996). Park et al. (2005) menemukan bahwa Sargassum thunbergii
melaporkan bahwa salah satu oligomer florotannin, dieckol yang diisolasi dari
Ecklonia cava memiliki aktivitas penangkapan radikal alkil sebesar 90% pada konsentrasi 50 μg/ml.
Pengujian aktivitas antioksidan alami dari alga laut juga dilakukan oleh Heo
et al. (2006) dengan menggunakan ekstrak metanolik alga coklat Ishige okamurae. Aktivitas penangkapan radikal bebas yang poten ditemukan dalam fraksi etil asetat.
Fraksi ini mengandung senyawa-senyawa polifenol, dan antioksidan yang poten
terelusidasi sebagai salah satu jenis florotannin, difloretohidroksikarmalol (gambar 2)
melalui data spektroskopi resonansi magnet inti dan massa.
Difloretohidroksikarmalol ditemukan memiliki IC50 sebesar 114,80 µM pada uji
penangkapan radikal hidroksil.
HO
OH
O O
O HO
OH
OH
OH
O
HO
OH
OH
C. Antioksidan
1. Pengertian antioksidan
Definisi antioksidan secara umum adalah senyawa yang melawan oksidasi
atau menghambat reaksi yang dipicu oleh oksigen atau peroksida. Kebanyakan
senyawa ini (misalnya tokoferol) digunakan sebagai pengawet dalam berbagai produk
(misalnya dalam lemak, minyak dan produk makanan untuk menunda ketengikan dan
perubahan-perubahan yang tidak diinginkan, dalam karet untuk menunda oksidasi).
Pengertian antioksidan yang lebih relevan secara biologis ialah senyawa alami atau
sintetik yang ditambahkan ke dalam produk untuk mencegah atau menunda
kerusakan yang disebabkan oleh oksigen udara (Huang et al., 2005).
Menurut Halliwell (1994), antioksidan dapat didefinisikan sebagai senyawa
yang apabila dalam konsentrasi rendah berada bersama substrat yang dapat
teroksidasi, dapat menunda atau menghambat oksidasi senyawa tersebut.
2. Jenis antioksidan
Menurut mekanismenya, antioksidan dapat digolongkan menjadi 2 macam
yaitu:
a. Preventive antioxidant
Antioksidan preventif merupakan antioksidan yang menghambat
oksidasi dengan mengurangi kecepatan inisiasi. Dalam kebanyakan
produk hidroperoksida, oksidasi ROOH merupakan penyebab proses
molekul yang tidak potensial sebagai radikal bebas (Burton et al., 1985). Beberapa enzim seperti glutation peroksidase dapat mengubah H2O2
menjadi H2O (Krishnaiah et al., 2007). b. Chain breaking antioxidant
Antioksidan ini kebanyakan merupakan fenol dan amin aromatis,
bekerja dengan cara menangkap radikal peroksil (Krishnaiah et al., 2007). Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam,
yaitu:
a. Antioksidan sintetik
Antioksidan sintetik merupakan antioksidan yang dibuat melalui
sintesis secara kimia, contohnya: BHA, BHT, PG dan TBHQ (Gulcin et al., 2004).
b. Antioksidan alami
Antioksidan alami merupakan antioksidan yang diproduksi langsung
oleh tanaman, contohnya: senyawa polifenol flavonoid dan tanin (Gulcin
et al., 2004).
3. Mekanisme penangkapan radikal bebas
Secara garis besar, mekanisme penangkapan radikal bebas dapat dibedakan
menjadi dua macam, yaitu secara enzimatik dan non-enzimatik. Enzim yang dapat
berperan sebagai antioksidan adalah superoksid dismutase (SOD), glutation
2005). Secara non-enzimatik, senyawa antioksidan bekerja melalui empat cara, yaitu
sebagai:
a. penangkap radikal bebas, misalnya vitamin C dan vitamin E.
b. pengkelat logam transisi, misalnya EDTA.
c. inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen.
d. kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
peroksidase (Huang et al., 2005).
4. Manfaat antioksidan
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang
disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam
penyakit seperti jantung koroner (Ames, 1983; Harman, 1993; Finkel dan Holbrook,
2000), kanker serta penuaan dini (Velavan et al., 2006). Penambahan antioksidan ke dalam formulasi makanan, juga efektif mengurangi oksidasi lemak yang
menyebabkan ketengikan, toksisitas dan destruksi biomolekul yang ada dalam
makanan (Decker, 1998).
D. Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan yang
adalah kecepatan difusi zat yang larut melalui lapisan-lapisan batas antara cairan
penyari dengan bahan yang mengandung zat tersebut.
1. Maserasi
Maserasi adalah ekstraksi suatu obat dengan pelarut melalui pengojogan dan
penggetaran selama berhari-hari pada temperatur ruangan (List dan Schmidt, 2000).
Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel sehingga
zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif
di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak ke luar
(Anonim, 1986). Keuntungan maserasi adalah dapat diaplikasikan dalam sampel
dalam jumlah sedikit, atau dengan batch tertentu (List dan Schmidt, 2000), cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan.
Kerugiannya adalah pengerjaannya lama dan penyariannya kurang sempurna
(Anonim, 1986).
2. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan
penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah serbuk
simplisia ditempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi
sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut,
cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai
keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya beratnya sendiri dan
Cara perkolasi lebih baik dibandingkan dengan cara maserasi karena:
a. Aliran cairan penyari menyebabkan adanya pergantian larutan yang
terjadi dengan larutan yang konsentrasinya lebih rendah, sehingga
meningkatkan derajat perbedaan konsentrasi.
b. Ruangan di antara butir-butir serbuk simplisia membentuk saluran
tempat mengalir cairan penyari. Karena kecilnya saluran kapiler
tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan
batas, sehingga dapat meningkatkan perbedaan konsentrasi (Anonim,
1986).
3. Sokhletasi
Sokhletasi merupakan salah satu penyarian berkesinambungan menghasilkan
ekstrak cair yang dilanjutkan dengan proses penguapan. Alat yang digunakan disebut
sokhlet. Prinsipnya uap cairan penyari naik ke atas melalui pipa samping, kemudian
diembunkan kembali oleh pendingin tegak. Cairan turun ke labu melalui tabung yang
berisi serbuk simplisia. Cairan penyari sambil turun melarutkan zat aktif serbuk
simplisia. Karena adanya sifon maka setelah cairan mencapai permukaan sifon,
seluruh cairan akan kembali ke labu. Keuntungan metode ini adalah cairan penyari
yang dibutuhkan lebih sedikit dan secara langsung hasil yang diperoleh lebih pekat,
serbuk simplisia disari oleh cairan penyari yang murni maka dapat menyari zat aktif
lebih banyak dan penyarian dapat diteruskan sesuai keperluan tanpa menambah
4. Infundasi
Infus adalah sediaan cair yang dibuat dengan dengan menyari simplisia
dengan air pada temperatur 900C selama 15 menit. Infundasi adalah proses penyarian
yang umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air
dari bahan-bahan nabati. Penyarian dengan cara ini menghasilkan sari yang tidak
stabil dan mudah tercemar oleh kuman dan kapang. Oleh sebab itu, sari yang
diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam. Cara ini sangat
sederhana dan sering digunakan oleh perusahaan obat tradisional (Anonim, 1986).
5. Ekstraksi dengan corong pisah
Ekstraksi pelarut merupakan metode yang baik dan populer. Prinsip metode
ini didasarkan pada distribusi zat terlarut dengan perbandingan tertentu antara dua
pelarut yang tidak saling campur, seperti benzen dan karbon tertraklorida atau
kloroform (Khopkar, 1990).
Menurut hukum distribusi Nernst: Jika [X1] adalah konsentrasi zat terlarut
dalam fase 1 dan [X2] adalah konsentrasi zat terlarut dalam fase 2, maka pada
kesetimbangan, X1, X2 didapat:
KD = [X2]
[X1]
dimana, KD = koefisien distribusi
Digunakan istilah perbandingan distribusi (D) dengan memperhitungkan
konsentrasi total zat di dalam kedua fase. Perbandingan distribusi dinyatakan sebagai
D = (Khopkar, 1990)
E. Radikal Hidroksil
1. Pengertian radikal hidroksil
Radikal bebas ialah spesies yang memiliki satu atau lebih elektron tidak
berpasangan pada orbitalnya. Contoh radikal bebas adalah superoksida (O2·-) dan
hidroksil (OH·) yang keduanya merupakan radikal oksigen, thiyl (RS·, radikal sulfur), triklorometil (CCl3·, radikal karbon yang terbentuk oleh metabolisme CCl4 di hati)
dan nitro oksida (NO·). Radikal hidroksil merupakan radikal oksigen sangat reaktif
yang menyerang kebanyakan molekul biologis dengan abstraksi atom hidrogen.
Berikut ini salah satu mekanisme radikal hidroksil dalam menimbulkan peroksidasi
lipid (L-H) menjadi radikal lipid (L·) :
L-H + OH· ÆH2O +L· (Halliwell dan Chirico, 1993)
Radikal hidroksil mampu mengoksidasi kebanyakan makromolekul termasuk
DNA, protein, lipid dan karbohidrat (Frank et al.,1989; Breen dan Murphy, 1995; Dean et al., 1997). Kerusakan oksidatif DNA karena ROS dihipotesiskan memainkan peranan penting dalam proses biologis seperti mutagenesis, penuaan, dan
2. Pembentukan radikal hidroksil
Pembentukan radikal hidroksil dapat melalui 2 mekanisme, yaitu reaksi ion
logam transisi dengan H2O2 yang disebut reaksi Fenton dan reaksi fisi homolitik air
karena terpapar radiasi ionisasi (Halliwell dan Chirico, 1993).
Reaksi Fenton merupakan reaksi yang penting untuk menghasilkan radikal
hidroksil. Reaksinya disebut reaksi Harber-Weiss (Kehrer, 2000), seperti berikut: Fe (II) + H2O2 →Fe (III) + ·OH + OH
-Besi merupakan katalis yang penting dalam reaksi redoks (Kanner et al., 1988). Kombinasi antara H2O2 dan garam besi merupakan mekanisme utama dalam
menghasilkan radikal hidroksil yang sangat reaktif (Gutteridge et al., 1981; Kanner
et al., 1988; Halliwell dan Gutteridge, 1999). Reaksi ini juga menggunakan EDTA. Pengkelatan Fe (II) oleh EDTA mencegah ion logam transisi untuk berikatan dengan
makromolekul yang dipelajari (Shcherbakova et al., 2006). Penambahan asam askorbat dalam sistem reaksi meningkatkan kecepatan pembentukan ·OH dengan
mereduksi Fe3+ menjadi Fe2+ sehingga memperbanyak jumlah radikal hidroksil.
Reaksi terlihat pada gambar 3, terjadi saat inkubasi pada temperatur 370C (sesuai
dengan temperatur tubuh manusia) dengan pH 7,4 selama 30 menit.
Fe3+-EDTA O
OH HO
HO
OH
O
Fe2+-EDTA O
O O
HO
OH
O
Fe2+ - EDTA + H2O2 Fe3+-EDTA + OH + OH +
+
3. Metode untuk mendeteksi radikal hidroksil
Ada beberapa metode yang digunakan untuk mendeteksi radikal hidroksil,
yaitu:
a. Metode pemerangkapan salisilat
Prinsipnya terjadi hidroksilasi salisilat oleh radikal hidroksil
membentuk produk 2,3- dan 2,5- DHBA (dihydroxybenzoic acid) yang dapat diukur menggunakan HPLC (Hashimoto et al., 2003).
b. Metode reaksi dengan dimetilsulfoksida (DMSO)
Metode ini melibatkan reaksi cepat antara radikal hidroksil dengan
DMSO menghasilkan radikal karbon (radikal metil), yang selanjutnya
bereaksi dengan fluorescamine yang terderivatisasi nitroksida untuk menghasilkan produk stabil o-metilhidroksilamin. Produk o -metilhidroksilamin dipisahkan dengan HPLC fase terbalik dan dikuantifikasi
secara fluorometri (Gutierrez, 2000).
c. Metode EPR (Electro Paramagnetic Resonance)\
Prinsipnya radikal hidroksil akan ditangkap oleh DMPO
(5,5s-dimetil-1-pirolina-1-oxida) menghasilkan produk radikal bebas lain yang
menyebabkan kenaikan garis kuartet pada EPR dengan rasio ketinggian
1:2:2:1 (Gutierrez, 2000).
Selain ketiga metode di atas, terdapat satu metode lagi yang bisa
F. Metode Deoksiribosa
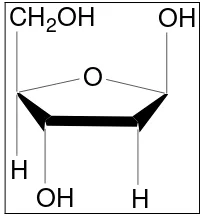
Metode deoksiribosa adalah metode yang sederhana, memiliki sensitivitas
tinggi dan tidak memerlukan alat yang canggih dalam analisisnya. Metode ini telah
digunakan secara luas untuk pengujian radikal bebas. Prinsip metode ini berdasarkan
pemecahan oksidatif 2-deoksiribosa (gambar 4) oleh senyawa radikal hidroksil
(Halliwell dan Grootveld, 1988 cit Conte, 1996).
O
CH2OH OH
H
OH H
Gambar 4. Struktur gula deoksiribosa (Murray et al., 1997)
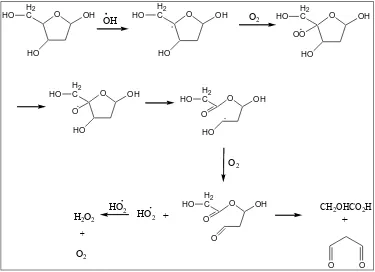
Radikal hidroksil yang terbentuk dari reaksi Fenton akan menyerang
deoksiribosa dan mendegradasinya menjadi fragmen-fragmen (Gupta et al., 2007). Proses reaksi degradasi ini dapat dijelaskan sebagai berikut: Radikal hidroksil akan
menyerang deoksiribosa dengan cara abstraksi (pemisahan) hidrogen pada atom C
dan membentuk suatu radikal deoksiribosa yang dengan adanya oksigen akan secara
O H2 C OH HO HO OH O H2 C OH HO HO O 2 O H2 C OH HO HO O O H2 C OH HO HO O O2 O H2 C OH O HO O HO2 HO2 H2O2
O2 O H2 C OH HO HO OO
CH2OHCO2H
O O
+ +
+
Gambar 5. Mekanisme pembentukan MDA dari atom karbon C-1, C-2,dan C-3 dari 2- deoksiribosa yang diserang radikal hidroksil dengan adanya O2 (Cheeseman
et al., 1988)
Selanjutnya, radikal gula peroksil ini akan mengalami serangkaian reaksi yang
meliputi disproporsionasi, penataan ulang, dan pemecahan ikatan C – C sehingga
menghasilkan suatu produk karbonil yang disebut malonaldehid (MDA) (Halliwell
dan Gutteridge, 1999). MDA (gambar 6) terbentuk dari atom karbon 1, 2, dan
C-3 pada molekul deoksiribosa (Cheeseman et al., 1988).
O O
Adanya pemanasan dengan asam tiobarbiturat (TBA) pada pH rendah, maka
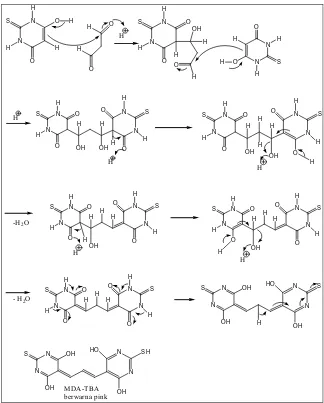
produk tersebut akan bereaksi membentuk kromogen berwarna pink yang dapat diukur absorbansinya pada 532 nm. Kromogen ini berasal dari reaksi kopling antara
asam tiobarbiturat dengan malonaldehid (TBA-MDA). Reaksi kopling ini terjadi
antara dua molekul TBA dengan satu molekul MDA. Hasil degradasi deoksiribosa
dapat diinhibisi oleh penambahan scavenger ·OH (Halliwell dan Gutteridge, 1988).
G. Spektrofotometri Visibel
Setiap molekul analit memiliki kemampuan untuk menyerap gelombang
tertentu dari radiasi elektromagnetik. Dalam proses ini, energi radiasi untuk
sementara dipindahkan ke molekul sehingga intensitas radiasi akan berkurang (Skoog
et al., 1994).
Panjang gelombang daerah ultraviolet dan tampak yang diserap oleh molekul
bergantung pada mudahnya promosi elektron. Senyawa yang menyerap cahaya pada
daerah tampak (yakni senyawa berwarna) memiliki elektron yang lebih mudah
dipromosikan daripada senyawa yang menyerap pada panjang gelombang ultraviolet
yang lebih pendek (Fessenden dan Fessenden, 1994).
Daerah visibel adalah sinar daerah panjang gelombang yang dapat dilihat oleh
mata manusia (cahaya tampak sebagai warna yang daerah spektrumnya terlihat pada
tabel 1), memanjang dari daerah UV dekat 380 nm sampai sekitar 780 nm (Christian,
Suatu senyawa organik mampu menyerap radiasi elektromagnetik karena
mereka memiliki elektron valensi yang dapat dieksitasikan ke tingkat energi yang
lebih tinggi. Absorpsi radiasi ultraviolet atau visibel oleh molekul atau atom M dapat
dijelaskan melalui dua tahap, yaitu eksitasi yang ditunjukkan dengan persamaan
berikut:
M + hv ÆM*
Produk reaksi antara M dan foton hv adalah partikel yang secara elektronik
tereksitasi dengan simbol M*. Waktu tinggal partikel yang tereksitasi hanya sebentar
(108- 10-9 s) kemudian diakhiri dengan proses relaksasi. Proses ini melibatkan
perubahan energi eksitasi menjadi panas, yaitu:
M* Æ M + panas (Skoog, 1985)
Tabel 1. Spektrum warna pada daerah visibel (Skoog et al., 1994)
Daerah panjang gelombang, nm
Warna yang diserap Warna komplementer (terlihat mata)
400-435 Ungu Kuning-hijau
435-480 Biru Kuning
480-490 Biru-hijau Orange
490-500 Hijau-biru Merah
500-560 Hijau Merah lembayung
560-580 Kuning-hijau Ungu
580-595 Kuning Biru
595-650 Orange Biru-hijau
650-750 Merah Hijau-biru
Kuantitas energi yang diserap oleh suatu senyawa berbanding terbalik dengan
panjang gelombang radiasi:
Dengan: ΔE = energi yang diabsorpsi, dalam erg
h = tetapan Planck, 6,6 x 10-27 erg det
v = frekuensi, dalam Hz
c = kecepatan cahaya, 3 x 1010 cm/det
λ = panjang gelombang, dalam cm (Fessenden dan Fessenden,
1994
Menurut hukum Beer’s, absorbansi mempunyai hubungan yang linier dengan
konsentrasi absorban (c) dan tebal kuvet (b) yang dirumuskan sebagai berikut:
Dengan : A = Absorbansi;
P0 = Kekuatan radiasi yang datang
P = Kekuatan radiasi setelah melewati kuvet yang
mengandung analit
b = Tebal larutan (cm)
c = Konsentrasi (mol.Lt-1)
ε = Absorptivitas molar (Lt.mol-1.cm-1) (Skoog et al.,
1994)
Untuk absorptivitas molar, hubungan ε dengan parameternya, dirumuskan
sebagai berikut:
A = log (P0/P) = ε b c
Dengan: P = probabilitas transisi elektron
A= luas daerah molekul target (cm2)
ε = Absorptivitas molar (Lt.mol-1.cm-1) (Skoog, 1985)
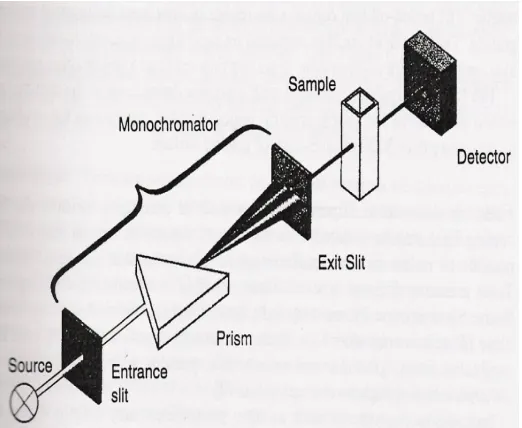
Instrumen yang digunakan untuk mempelajari absorpsi atau emisi radiasi
elektromagnetik sebagai fungsi panjang gelombang disebut spektrometer atau
spektrofotometer. Komponen yang esensial dalam spektrofotometer (gambar 7) yaitu:
(1) sumber radiasi energi, (2) sistem lensa, cermin dan celah yang memfokuskan
sinar, (3) monokromator yang mengubah radiasi menjadi beberapa panjang
gelombang, (4) wadah transparan untuk menampung sampel, (5) detektor radiasi
yang dihubungkan dengan recorder (Pescok et al., 1976).
H. Landasan Teori
Radikal hidroksil merupakan jenis radikal bebas paling reaktif. Di dalam
tubuh manusia, radikal hidroksil dalam tubuh akan menyerang DNA sehingga
menyebabkan kerusakan biologis. Polifenol dalam fraksi etil asetat alga coklat yang
disebut florotannin, diketahui berperan sebagai antioksidan yang potensial sehingga
mampu mencegah kerusakan oksidatif sebagai scavanger radikal bebas.
Aktivitas penangkapan radikal hidroksil oleh fraksi etil asetat ekstrak
metanolik alga coklat Sargassum hystrixv. buxifolium (Chauvin) J. Agardh dapat diuji dengan metode deoksiribosa. Radikal hidroksil yang terbentuk dari reaksi Fenton
akan menyerang deoksiribosa sehingga menghasilkan produk tertentu
(malondialdehid). Adanya pemanasan dengan asam tiobarbiturat (TBA) pada pH
rendah menyebabkan reaksi kopling antara TBA dengan malonaldehid (TBA-MDA)
membentuk kromogen berwarna pink yang dapat diukur absorbansinya pada 532 nm. Dengan penambahan senyawa yang berperan sebagai scavenger radikal hidroksil, hasil degradasi deoksiribosa akan terhambat. Semakin besar konsentrasi senyawa
antioksidan yang ditambahkan, radikal hidroksil yang ditangkap menjadi lebih
banyak sehingga jumlah kromogen MDA-TBA menjadi semakin berkurang dan
I. Hipotesis
Berdasarkan landasan teori, dapat dihipotesiskan bahwa fraksi etil asetat
30
A. Jenis Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena dalam
penelitian ini subjek uji diberi perlakuan yaitu penambahan berbagai konsentrasi
fraksi etil asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium
(Chauvin) J. Agardh yang diuji dengan metode deoksiribosa.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas dalam penelitian ini berupa konsentrasi fraksi etil asetat
ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh yang diuji dengan metode deoksiribosa.
2.Variabel tergantung
Variabel tergantung berupa aktivitas penangkapan radikal hidroksil fraksi etil
asetat ekstrak metanolik alga coklat Sargassum hystrix v. buxifolium (Chauvin) J.
3. Variabel pengacau
Variabel pengacau dalam penelitian ini ada dua jenis, yaitu:
a. Variabel pengacau terkendali, termasuk di dalamnya adalah temperatur dan waktu inkubasi yang digunakan dalam penelitian.
b. Variabel pengacau tak terkendali, termasuk di dalamnya adalah kestabilan bahan (vitamin C) dalam larutan.
C. Definisi Operasional
1. Ekstrak metanolik alga coklat adalah ekstrak hasil proses sokhletasi serbuk alga
coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh dengan penyari
metanol hingga larutan jernih.
2. Fraksi etil asetat adalah hasil fraksinasi ekstrak metanolik alga coklat dengan
menggunakan etil asetat.
3. Larutan kontrol merupakan larutan yang terdiri dari reagen Fenton, larutan
deoksiribosa, bufer fosfat, asam trikloroasetat, dan asam tiobarbiturat.
4. Larutan sampel merupakan larutan kontrol yang telah diberi fraksi etil asetat (butir
2)dengan berbagai konsentrasi.
5. Persen scavenging (% scavenging) adalah persen yang menyatakan kemampuan
suatu senyawa untuk menangkap suatu radikal bebas.
6. Effective Scavenging 50 (ES50) merupakan nilai konsentrasi fraksi etil asetat yang
D. Bahan-bahan Penelitian
Alga coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh (dari pantai
Drini, Gunung Kidul, Yogyakarta), akuades (Laboratorium Kimia Organik Fakultas
Farmasi Universitas Sanata Dharma), dan bahan-bahan kualitas p.a. E. Merck yaitu:
metanol, etil asetat, kalium hidroksida, natrium klorida, tanin, natrium karbonat,
dinatrium hidrogen fosfat, kalium dihidrogen fosfat, ferri klorida heksahidrat,
Natrium etilendiamin asam tetraasetat (Na EDTA), larutan hidrogen peroksida 30%,
L (+) asam askorbat (vitamin C), asam tiobarbiturat (TBA), dan asam trikloroasetat
(TCA). Sementara bahan yang lain: kloroform, gelatin croda (Brataco Chemica),
reagen Folin Ciocalteau dan 2-deoksi-D-ribosa (Sigma Chem. Co., USA).
E. Alat-alat Penelitian
Seperangkat spektrofotometer UV-Vis Perkin Elmer Lamda 20, pH-meter
Metrohm 632, Vacuum rotaevaporator (Janke & Kunkel), Timbangan elektrik BP
160 readability 0.01 mg, Waterbath (Emerson), Mikropipet 200-1000 µL (Acura 825,
Socorex), Tabung reaksi bertutup (Scott-Germany), Hot plate (Heidolph), Freezer (Toshiba), Alat-alat untuk sokhletasi, yaitu Sokhlet, Labu alas bulat (Schott Duran,
Germany), Heating mantle, Termometer, Corong pisah, Oven, Blender, Pengayak, dan alat-alat gelas yang lazim digunakan untuk penelitian di laboratorium analisis
F. Tata Cara Penelitian
1. Persiapan Sampel Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh
a. Pembuatan serbuk sampel alga coklat
Alga dikumpulkan pada tanggal 23 Maret 2007 di pantai Drini, Gunung
Kidul, Yogyakarta, kemudian dicuci dengan air mengalir. Alga diautoklaf
pada temperatur 1000C selama 30 menit dan dikeringkan dengan oven pada
temperatur 90 °C selama 6 hari. Setelah itu, alga diserbuk menggunakan
blender lalu diayak dengan ayakan nomor mesh 20/30. b. Penetapan kadar air dalam serbuk alga coklat
Serbuk alga ditimbang sebanyak 5 g, kemudian dimasukkan ke dalam
alat moisture balance yang sudah ditara terlebih dulu. Panaskan alat pada
temperatur 110 0C selama 15 menit. Catat persen sisa bobot zat setelah
pemanasan seperti yang tertera dalam alat.
2. Isolasi Crude Florotannin dari Serbuk Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh
a. Pembuatan ekstrak metanol alga coklat
Serbuk alga yang ditimbang sebanyak 80 g, dimasukan ke dalam kantong
kertas saring, kemudian dimasukkan ke labu sokhlet dan diberi pelarut
metanol sebanyak 2 kali sirkulasi. Proses sokhletasi dilakukan sampai tetesan
diuapkan pelarutnya dengan menggunakan vacuum rotary evaporator sampai
volume yang kecil (1/10 dari volume mula-mula).
b. Fraksinasi ekstrak metanol alga coklat
Ekstrak yang telah diuapkan ditambahkan 60 ml metanol, 120 ml
kloroform, dan 45 ml akuades. Kocok campuran beberapa kali, kemudian
diamkan hingga terbentuk dua lapisan. Pisahkan keduanya, selanjutnya
lapisan atas diekstraksi dengan etil asetat dua kali @75 ml. Kumpulkan fraksi
etil asetat, uapkan di waterbath dengan temperatur 80 0C sampai kering,
sehingga diperoleh fraksi yang merupakan crude phlorotannin. Fraksi
kemudian disimpan di dalam freezer.
3. Uji Kualitatif Senyawa Fenolik
a. Pembuatan larutan sampel fraksi etil asetat
Timbang 0,025 g fraksi etil asetat, masukkan ke dalam labu ukur 25 ml.
Tambahkan akuades hingga tanda, sehingga diperoleh konsentrasi sebesar 1
mg/ml.
b. Pembuatan larutan standar tanin
Timbang 0,025 g standar tanin, masukkan ke dalam labu ukur 25 ml.
Tambahkan akuades hingga tanda, sehingga diperoleh konsentrasi sebesar 1
mg/ml.
c. Uji pendahuluan
Sebanyak 1 ml larutan sampel pada butir a) ditambah 10 ml akuades,
kapas. Larutan berwarna kuning sampai merah menunjukkan adanya senyawa
yang mengandung kromofor dengan gugus hidrofilik. Jika ditambah larutan
KOH 6,5% b/v, warna larutan menjadi lebih intensif (Tejada, 2002).
d. Uji tanin (zat samak)
Sebanyak 1 ml larutan sampel pada butir a) dan 1 ml larutan tanin pada
butir b) (sebagai kontrol positif) ditambah 1 ml NaCl 2%. Bila terjadi suspensi
(endapan) disaring melalui kertas saring. Filtrat ditambah 5 ml larutan gelatin
1%. Terbentuknya endapan menunjukkan adanya tanin (Evans, 2002).
e. Uji polifenol
Sebanyak 1 ml larutan sampel pada butir a) dan 1 ml larutan tanin pada
butir b) ditambah 3 tetes besi (III) klorida 9% b/v. Jika terjadi warna biru
menunjukkan adanya senyawa fenolik (Farnsworth et al., 1970).
f. Uji dengan reagen Folin Ciocalteau
Pipet 5 ml larutan sampel pada butir a) dan 5 ml larutan tanin pada butir
b) dimasukkan ke dalam tabung reaksi yang mengandung 2,5 ml pereaksi
fenol Folin-Ciocalteau yang telah diencerkan dengan akuades 1:1. Diamkan
selama 2 menit. Tambahkan 7,5 ml Na2CO3 1,9 M. Terbentuknya warna biru
4. Uji Aktivitas Penangkapan Radikal Hidroksil dengan Metode Deoksiribosa a. Persiapan
Pembuatan reagen Fenton
1. Larutan FeCl
3 1 mM
Timbang seksama lebih kurang 13,52 mg FeCl3.6H2O, masukkan ke
dalam labu ukur 10 ml dan larutkan dengan akuades hingga tanda. Ambil
2,0 ml larutan tersebut, masukkan ke dalam labu ukur 10 ml. Kemudian
encerkan dengan akuades hingga tanda.
2. Larutan EDTA 1 mM
Timbang seksama lebih kurang 18,61 mg Na EDTA, masukkan ke
dalam labu ukur 10 ml dan larutkan dengan akuades hingga tanda. Ambil
2,0 ml tersebut dan masukkan ke dalam labu ukur 10 ml. Kemudian
encerkan dengan akuades hingga tanda.
3. Larutan vitamin C 1 mM
Timbang seksama lebih kurang 17,61 mg vitamin C, masukkan ke
dalam labu ukur 10 ml dan larutkan dengan akuades hingga tanda. Ambil
1,0 ml larutan tersebut masukkan ke dalam labu ukur 10 ml. Kemudian
encerkan dengan akuades hingga tanda.
4. Larutan H2O2 20 mM
Ambil sebanyak 0,091 ml larutan H2O2 30 %, masukkan ke dalam
tersebut, diambil sebanyak 2,5 ml dan dimasukkan ke dalam labu ukur 10
ml. Kemudian encerkan dengan akuades hingga tanda.
Pembuatan larutan Deoksiribosa 2,5 mM
Timbang seksama lebih kurang 20,95 mg deoksiribosa, masukkan ke
dalam labu ukur 10 ml dan larutkan dengan akuades hingga tanda. Dari
larutan ini, diambil sebanyak 4,0 ml dan dimasukkan ke dalam labu ukur 25
ml. Kemudian encerkan dengan akuades hingga tanda.
Pembuatan larutan TCA 5 %
Timbang seksama 2,5 g TCA, masukkan ke dalam beker glass 50 ml dan
tambahkan akuades secukupnya. Pindahkan larutan ke labu ukur 50 ml dan
tambahkan akuades hingga tanda.
Pembuatan larutan TBA 1 %
Timbang seksama 0,25 g TBA, masukkan ke dalam beker glass 100 ml
dan tambahkan akuades secukupnya, kemudian dipanaskan di atas hot plate
hingga seluruh TBA larut. Setelah itu, pindahkan larutan TBA tersebut ke
dalam labu ukur 25 ml dan tambahkan akuades hingga tanda.
Pembuatan larutan bufer fosfat
Timbang seksama sebanyak 1,4196 g Na2HPO4, masukkan ke dalam
labu ukur 500 ml dan larutkan dengan akuades hingga tanda. Kemudian
timbang seksama sebanyak 0,6805 g KH2PO4, masukkan ke dalam labu ukur
secukupnya ke dalam beker glass dan tambahkan larutan KH2PO4
bertetes-tetes hingga tercapai pH 7,4 dengan bantuan pH meter.
Preparasi larutan standar tanin
Timbang 0,025 g serbuk tanin, larutkan di gelas beker dengan akuades
lalu masukkan ke dalam labu ukur 25 ml. Tambahkan akuades hingga tanda,
sehingga diperoleh konsentrasi 1 mg/ml.
Preparasi Larutan Sampel fraksi etil asetat
Timbang 0,025 g fraksi etil asetat, larutkan di gelas beker dengan
akuades lalu masukkan ke dalam labu ukur 25 ml. Tambahkan akuades hingga
tanda, sehingga diperoleh konsentrasi 1 mg/ml.
b. Pengujian dengan Metode Deoksiribosa
Penentuan OT (Operating Time)
Pada tabung reaksi bertutup masukkan 300 µl larutan deoksiribosa 2,5
mM kemudian tambahkan 300 µl FeCl3 1 mM, 300 µl EDTA 1 mM, 300 µl
H2O2 20 mM, 4200 µl bufer fosfat pH 7,4 dan 300 µl asam askorbat 1 mM.
Inkubasikan pada temperatur 37 0C selama 30 menit, kemudian tambahkan 1
ml TCA 5% dan 1 ml TBA 1%. Campuran tersebut dipanaskan pada
waterbath temperatur 80 0C selama 30 menit. Dinginkan dengan bantuan air mengalir selama 5 menit dan dibaca absorbansinya pada panjang gelombang
Penentuan Panjang Gelombang Maksimum (λmaks)
Pada tabung reaksi bertutup, masukkan berturut-turut, 200, 300, dan 400
µl larutan deoksiribosa 2,5 mM, kemudian pada masing-masing tabung
tersebut tambahkan 300 µl FeCl3 1 mM, 300 µl EDTA 1 mM, 300 µl H2O2
20 mM, bufer fosfat pH 7,4 dan 300 µl asam askorbat 1 mM (penambahan
bufer fosfat disesuaikan dengan volume deoksiribosa sehingga volume akhir
campuran adalah 6 ml). Inkubasikan pada temperatur 37 0C selama 30 menit,
kemudian tambahkan 1 ml TCA 5% dan 1 ml TBA 1%. Campuran tersebut
dipanaskan pada waterbath temperatur 80 0C selama 30 menit. Dinginkan
dengan bantuan air mengalir selama 5 menit dan lakukan scanning absorbansi
pada panjang gelombang 400-600 nm.
Pengujian Aktivitas Penangkapan Radikal Hidroksil Standar dan Larutan
Sampel
Pada 14 tabung reaksi, dimasukkan 600 µl larutan deoksiribosa 2,5 mM
dan larutan uji alga sebanyak 0 (sebagai kontrol negatif), 100, 200, 300, 400,
500, 600, 700, 800, 900 dan 1000 µl. Sebagai kontrol positif, masukkan 200,
400, 600, dan 800 µl larutan standar tanin ke dalam 4 tabung lainnya.
Kemudian ke dalam masing-masing tabung tersebut di atas, tambahkan 300 µl
FeCl3 1 mM, 300 µl EDTA 1 mM, 300 µl H2O2 20 mM, bufer fosfat pH 7,4,
dan 300 µl asam askorbat 1 mM (penambahan bufer fosfat disesuaikan
dengan volume larutan uji yang ditambahkan sehingga volume akhir
kemudian tambahkan 1 ml TCA 5% dan 1 ml TBA 1%. Campuran tersebut
dipanaskan pada waterbath temperatur 80 0C selama 30 menit, dinginkan dan
dibaca absorbansinya pada daerah operating time dan panjang gelombang
maksimum hasil pengukuran. Dari hasil absorbansi yang diperoleh
selanjutnya dihitung % scavengingnya dan dibuat persamaan regresi linier
yang merupakan hubungan antara konsentrasi fraksi etil asetat vs %
scavenging untuk menentukan nilai ES50. Lakukan replikasi sebanyak 5 kali.
G. Analisis Data
Aktivitas penangkapan radikal hidroksil dari larutan uji dilaporkan sebagai %
inhibisi degradasi deoksiribosa yang dihitung sebagai :
% Scavenging = x 100%
A kontrol = Absorbansi campuran reaksi kontrol
A uji = Absorbansi campuran larutan uji
Nilai ES50 ditetapkan menggunakan persamaan regresi linier, dengan sumbu x
41
BAB IV
HASIL DAN PEMBAHASAN
A. Persiapan sampel Alga Coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh
Alga coklat Sargassum diambil dari Pantai Drini, Gunungkidul, Yogyakarta pada musim penghujan, tepatnya pada tanggal 23 Maret 2007. Pengambilan sampel
ini dilakukan saat air laut surut sekitar 300 m dari tepi pantai pada pukul 16.00-17.00
BBWI dan temperatur air laut mencapai 270C. Terdapat banyak karang pada daerah
pantai tempat diambilnya alga coklat Sargassum. Hal ini dikarenakan secara ekologis, alga coklat berperan dalam pembentukan ekosistem terumbu karang. Umur alga
coklat Sargassum yang dipanen tidak dapat diketahui secara pasti karena alga ini langsung diambil dari alam dan bukan merupakan jenis alga coklat Sargassum yang dibudidayakan (Stephanie, 2007).
Identifikasi spesies alga dilakukan di Laboratorium Taksonomi Tumbuhan
Fakultas Biologi Universitas Gadjah Mada Yogyakarta. Berdasarkan hasil
identifikasi, sampel alga coklat Sargassum termasuk dalam ordo Fucales, famili Sargassaceae, genus Sargassum, dan spesies Sargassum hystrix v. buxifolium
(Chauvin) J. Agardh (Stephanie, 2007) .
Sargassum hystrix v. buxifolium (Chauvin) J. Agardh. dari spesies alga coklat Sargassum lainnya. Pemisahan dilakukan dengan melihat ciri-ciri fisiknya yaitu daun panjang, lurus (tidak bergelombang), dan mempunyai banyak percabangan.
Pencucian alga utuh dilakukan dengan air mengalir untuk menghilangkan
kotoran-kotoran yang menempel pada permukaan alga berupa epifit, sedimen, pasir yang
mengandung silikat, zat kapur, dan bahan organik asing yang bukan berasal dari alga
coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh, yang dapat mengganggu
proses analisis kuantitatif polifenol menggunakan metode Folin-Ciocalteau
(Stephanie, 2007).
Setelah proses pencucian, alga coklat di autoklaf pada temperatur 1000C
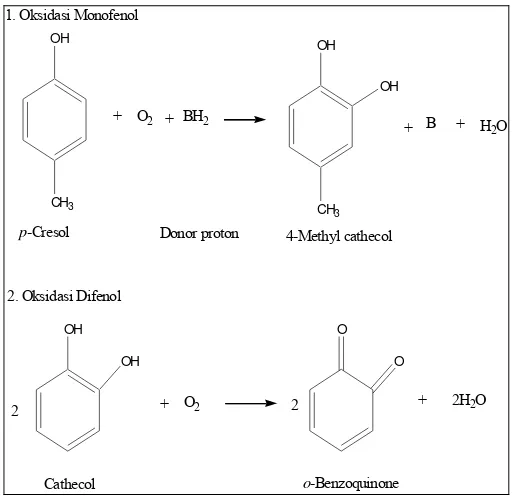
selama 30 menit untuk menginaktifasi enzim polifenol oksidase. Enzim ini dapat
mengkatalisis 2 reaksi oksidatif dengan kombinasi molekul oksigen, yaitu:
hidroksilasi monofenol menjadi o-difenol (oksidasi monofenol) dan oksidasi difenol
menjadi o-kuinon (oksidasi difenol) (Whitaker, 1996), seperti terlihat pada gambar 8.
Proses oksidasi polifenol ini menyebabkan polifenol kehilangan gugus –OH, gugus
yang bertanggung jawab atas aktivitas antioksidan.
Enzim polifenol oksidase bersifat termolabil. Menurut penelitian Gonzalez et
al. (1992), polifenol oksidase dalam ekstrak alpukat akan kehilangan aktivitasnya sebesar 98 % pada pemanasan temperatur 800C selama 30 menit, sedangkan pada
penelitian Chutintrasri dan Noomhorm (2003), polifenol oksidase yang terkandung
temperatur 900C selama 30 menit. Oleh karena itu, dibutuhkan temperatur yang lebih
besar dari 900C untuk menginaktifasi enzim tersebut.
OH CH3 OH OH O2 O2 BH2 OH CH3 OH O O B
2H2O
H2O
p-Cresol
+ +
Donor proton
+ +
4-Methyl cathecol 1. Oksidasi Monofenol
2. Oksidasi Difenol
2 + 2 +
Cathecol o-Benzoquinone
Gambar 8. Reaksi oksidasi monofenol dan difenol oleh polifenol oksidase
(Miyawaki, 2006)
Selanjutnya, sampel alga coklat Sargassum hystrix v. buxifolium (Chauvin) J.
Agardh. dikeringkan dalam oven dengan temperatur 900C hingga benar-benar kering
(simplisia mudah dihancurkan dengan kekuatan tangan). Ketebalan lapisan alga
coklat Sargassum hystrix v. buxifolium (Chauvin) J. Agardh di oven harus diperhatikan agar pengeringan dapat berjalan sempurna sehingga mencegah
tumbuhnya jamur dan mikroba lain yang dapat merusak senyawa-senyawa yang
terkandung dalam alga coklat. Tujuan pengeringan adalah mempermudah
Serbuk simplisia kemudian diayak dengan derajat halus 20/30. Serbuk yang terlalu
halus akan mempersulit penyaringan, karena butir-butir halus tadi membentuk
suspensi yang sulit dipisahkan dengan hasil penyaringan. Dengan demikian hasil
penyarian tidak murni lagi tetapi bercampur dengan partikel-partikel halus tadi.
Dengan penyerbukan yang terlalu halus juga menyebabkan banyak dinding sel yang
pecah sehingga zat yang tidak diinginkanpun ikut ke dalam hasil penyarian (Anonim,
1986).
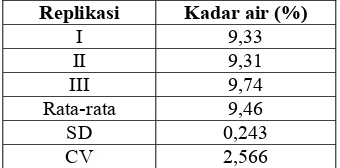
Penetapan kadar air dilakukan menggunakan moisture balance dimana serbuk
alga coklat dipanaskan selama 15 menit pada suhu 1100C dan dicatat persen bobot
sisa serbuk setelah pemanasan. Serbuk diambil dari wadah plastik yang disimpan
pada temperatur kamar. Tujuan penetapan kadar air adalah menjamin bahwa kadar air
dalam simplisia memenuhi standar yang ditetapkan, sehingga dapat menghindari
pertumbuhan mikroorganisme atau jamur yang menyebabkan rusaknya kandungan
kimia dalam serbuk. Selain itu, adanya lembab dalam simplisia juga mempermudah
terjadinya oksidasi polifenol. Standar yang dipergunakan adalah kadar air dalam
serbuk simplisia tidak boleh lebih dari 10% (Anonim, 1995).
Tabel 2. Hasil penetapan kadar air dalam serbuk alga
Replikasi Kadar air (%)
I 9,33 II 9,31 III 9,74 Rata-rata 9,46
Dari hasil yang ditunjukkan tabel 2, didapatkan bahwa kadar air dalam serbuk
simplisia kurang dari 10%, sehingga serbuk simplisia masih memenuhi persyaratan
yang ditetapkan.
B. Isolasi Crude Florotannin dari Serbuk Alga Sargassum hystrix
Serbuk alga Sargassum hystrix yang telah ditimbang, diekstraksi dengan cara
sokhletasi. Pemilihan cara ekstraksi ini didasarkan atas efisiensi dan efektivitas
sokhletasi, yaitu pelarut yang digunakan untuk menyari zat aktif selalu baru dan tidak
perlu diganti sehingga kapasitas dalam menyari zat aktif lebih besar. Proses
sokhletasi dilakukan pada temperatur 800C (temperatur di atas titik didih metanol,
64,51 0C) sampai cairan penyari menjadi jernih dengan total waktu 33 jam. Pada
penelitian ini tidak dilakukan optimasi waktu proses sokhletasi. Alasan penggunaan
metanol sebagai cairan penyari dibandingkan aseton 70% adalah karena sifat metanol
yang lebih polar, sehingga lebih selektif dalam mengekstraksi senyawa-senyawa
polar terutama florotannin. Penggunaan metanol sebagai cairan pengekstraksi
mengacu pada penelitian Nagayama et al. (2002).
Setelah proses sokhletasi selesai, ekstrak diuapkan menggunakan vacuum
rotary evaporator sampai volume kecil (sekitar 1/10 volume mula-mula). Tujuan penguapan ialah memekatkan ekstrak sehingga mempermudah proses fraksinasi.
Proses fraksinasi mengacu pada fraksinasi yang dilakukan oleh Nagayama et
fase bawah. Kloroform memiliki berat jenis yang lebih besar dari pada metanol-air,
sehingga fase kloroform berada di bawah dan fase metanol-air berada di atas. Fase
kloroform yang lebih non polar dibandingkan dengan metanol-air akan melarutkan
senyawa-senyawa yang non polar seperti pigmen, lipid dan vitamin E sedangkan fase
metanol-air akan menarik senyawa-senyawa yang lebih polar seperti polisakarida,
florotannin, iodin, vitamin C, mineral dan garam alginat. Fase metanol-air kemudian
diekstraksi sebanyak 2 kali menggunakan pelarut etil asetat dengan perbandingan 75:
75 ml. Ekstraksi dilakukan sebanyak dua kali karena hasil ekstraksi lebih baik jika
jumlah ekstraksi yang dilakukan berulang-ulang dengan jumlah pelarut sedikit-sedikit
(Khopkar, 1990). Pelarut etil asetat akan menarik zat-zat yang bersifat relatif lebih
non polar seperti florotannin sedangkan fase metanol akan menarik senyawa-senyawa
yang lebih polar seperti vitamin C, iodin, garam alginat, mineral dan polisakarida,
sehingga akan didapatkan fraksi yang lebih murni.
Fraksi etil asetat dikumpulkan dan diuapkan pada temperatur 80 0C
(temperatur di atas titik didih etil asetat; 77,11 oC) sampai kering sehingga diperoleh
crude florotannin yang akan diuji aktivitas antioksidannya. Untuk meminimalkan kerusakan polifenol florotannin, fraksi dibungkus dengan aluminium foil dan
disimpan di dalam freezer. Penyimpanan di dalam freezer mengacu pada penelitian
C. Uji Kualitatif Senyawa Fenolik
Florotannin merupakan senyawa polifenol oleh karena itu, dilakukan uji
tabung yang mampu mengidentifikasi adanya polifenol.
1. Uji pendahuluan
Adanya penambahan KOH (basa) akan menyebabkan polifenol dalam fraksi
mudah teroksidasi oleh udara menjadi bentuk kuinon sehingga hasil positif
ditunjukkan dengan warna larutan yang lebih gelap karena adanya perpanjangan
gugus kromofor. Pemanasan akan mempercepat proses oksidasi tersebut. Pada uji
tabung, larutan uji menunjukkan hasil negatif.
2. Uji tanin
Florotannin merupakan subkelompok dari tanin (Koivikko et al., 2005), oleh
karena itu dilakukan uji gelatin untuk mengidentifikasi florotannin. Tanin dapat
berikatan dengan protein gelatin (ikatan hidrogen atau interaksi hidrofobik) sehingga
menyebabkan presipitasi (Bruneton, 1999). Penambahan NaCl meningkatkan
sensitivitas reaksi melalui fenomena salting out pada kompleks tanin-protein. Apabila
presipitasi hanya terjadi saat penambahan garam, disebut reaksi positif palsu
(Fansworth et al., 1970). Pengujian menunjukkan hasil negatif karena tidak terbentuk
endapan sedangkan kontrol positif tanin menghasilkan suspensi (larutan menjadi
keruh).
3. Uji polifenol
Penambahan FeCl3 berfungsi membentuk kompleks warna biru dengan gugus
memberikan hasil negatif (tidak terdapat warna biru), sedangkan kontrol positif tanin
menunjukkan terbentuknya warna biru.
Ketiga uji tabung di atas memberikan hasil negatif dikarenakan konsentrasi
polifenol yang kecil sehingga uji tabung tidak cukup sensitif untuk mendeteksi
keberadaan polifenol.
4. Uji dengan reagen Folin-Ciocalteau
Uji ini didasarkan pada reaksi oksidasi reduksi yaitu pada suasana basa, ion
fenolat yang berasal dari senyawa fenolik mudah teroksidasi oleh asam fosfomolibdat
sementara juga mereduksinya membentuk produk berwarna biru (Waterman dan
Mole, 1994). Pengujian menunjukkan hasil positif larutan bewarna biru. Hal ini
menunjukkan bahwa fraksi etil asetat mengandung polifenol.
D. Penentuan Operating Time
Tujuan penetapan operating time ialah menentukan rentang waktu dimana
kromogen MDA-TBA menunjukkan absorbansi yang stabil, sehingga pengukuran
bisa reprodusibel dan kesalahan analisis diminimalkan. Penetapan operating time
dilakukan dengan mengukur absorbansi kromogen MDA-TBA pada panjang
gelombang teoritis 532 nm setiap 2 menit selama 60 menit. Hasilnya terlihat pada
gambar 9, yaitu pada menit ke-0 sampai ke-60, absorbansi memberikan nilai yang
stabil yang menunjukkan bahwa reaksi antara MDA dan TBA sudah sempurna dan
Pembentukan warna dilakukan dengan mereaksikan campuran reaksi yang
telah diinkubasi dengan asam trikloroasetat (TCA) dan asam tiobarbiturat (TBA).
Penambahan TCA berfungsi untuk menurunkan kecepatan reaksi degradasi
deoksiribosa oleh radikal hidroksil karena dalam suasana asam proses oksidasi
vitamin C akan terhambat. Dengan terhambatnya proses oksidasi vitamin C maka
proses reduksi dari Fe3+ menjadi Fe2+ akan terhambat pula sehingga pembentukan
radikal hidroksil juga akan terhambat. Reagen TCA juga memberikan suasana asam
sehingga mengkatalisis reaksi pembentukan kromogen MDA-TBA.
N N H O H H O H S N N H O H O H S H + H H
Gambar 10. Reaksi pembentukan enol pada TBA (Purwantoko, 2006)
N N H O H O H S H O H O H N N H O O H S H OH H H O N N H O H O H S H N N H O O H S N N OH OH H H H O S O H H H H N N H O O H S N N OH H H O S H O H H H
-H2O N
N H O O H S N N H H O S H O H H H N N OH OH S N N HO SH OH MDA-TBA berwarna pink OH H H OH H H N N H O O H S N N H H O S H O H H N N H O O H S N N H H O S H O H H OH H H
- H2O
N N OH OH S N N HO S OH H
![Gambar 1. Struktur floroglusinol (i) dan florotannin [tetrafucol A (ii), tetrafloretol B (iii), fucodiflorethol A (iv), tetrafuhalol A (v), tetraisofuhalol (vi), phlorofucofuroeckol (vii)] (Ragan dan Glombitza, 1986)](https://thumb-ap.123doks.com/thumbv2/123dok/1658465.2072221/28.612.149.515.126.592/floroglusinol-florotannin-tetrafloretol-fucodiflorethol-tetrafuhalol-tetraisofuhalol-phlorofucofuroeckol-glombitza.webp)