KONSERVASI DAN PROPAGASI Bulbophyllum echinolabium
J.J.SM. MELALUI KULTUR IN VITRO
CONSERVATION AND PROPAGATION OF Bulbophyllum
echinolabium J.J.SM. THROUGH IN-VITRO CULTURE
Tri Warseno, Ema Hendriyani, dan Arief Priyadi
UPT BKT Kebun Raya ‘Eka Karya” Bali – LIPI Candikuning, Baturiti, Tabanan, Bali 82191
E-mail: tri_06April@yahoo.co.id ABSTRAK
Salah satu jenis anggrek yang telah diperbanyak secara in vitro di Kebun Raya ‘Eka Karya’ Bali-LIPI adalah Bulbophyllum echinolabium J.J.Sm. Kegiatan konservasi dan propagasi Bulbophyllum echinolabium J.J.Sm. melalui kultur jaringan telah dilakukan di Laboratorium Kultur Jaringan Kebun Raya ‘Eka Karya’ Bali-LIPI. Tahapan yang dilakukan yaitu sterilisasi biji, penanaman biji pada media perkecambahan, pemeliharaan, dan subkultur serta aklimatisasi. Penelitian dilakukan dari bulan Oktober 2007–Oktober 2013. Penulisan makalah ini bertujuan untuk memberikan informasi kepada masyarakat mengenai metode konservasi dan propagasi Bulbophyllum echinolabium J.J.Sm. melalui kultur in vitro.
Kata kunci: Bulbophyllum echinolabium, in vitro, konservasi, perbanyakan.
ABSTRACT
Bali Botanic Garden has conducted various conservation of orchids species. Bulbophyllum echinolabium J.J.Sm. is one of the orchid species that has been propagated by in-vitro culture in Bali Botanic Garden. Conservation and propagation Bulbophyllum echinolabium J.J.Sm. through in-vitro culture has been carried out in the Tissue Culture Laboratory of Bali Botanic Garden. The steps being taken are : sterilization of seeds, planting seeds in the germination media, maintenance and sub-culture, and acclimatization. This study was conducted from October 2007 until October 2013. This paper aims to provide information to public regarding the conservation and propagation methods of Bulbophyllum echinolabium J.J.Sm. through in-vitro culture.
Keywords: conservation, propagation, in vitro, Bulbophyllum echinolabium. PENDAHULUAN
Orchidaceae merupakan suku terbesar dari tumbuhan berbunga dengan 20.000– 30.000 jenis yang berbeda (Chase et al. 2003). Kekayaan jenis anggrek yang dimiliki Indonesia merupakan potensi yang sangat berharga bagi keanekaragaman sumber daya
genetik anggrek di Indonesia. Namun, sangat disayangkan keanekaragaman anggrek tersebut terancam kelestariannya karena maraknya penebangan hutan dan konversi hutan. Menurut Kull et al. (2006), di antara suku tumbuhan lainnya, Orchidaceae merupakan tanaman yang paling terancam mengalami kepunahan. Kultur in vitro merupakan salah satu metode yang berguna untuk memperbanyak jenis tanaman endemis atau yang terancam punah untuk tujuan konservasi (Arditti dan Krikorian 1996). Metode ini sangat berguna untuk anggrek karena bijinya sulit berkecambah dengan persemaian biasa. Hal ini disebabkan biji anggrek tidak memiliki endosperm; oleh sebab itu, dalam perkecambahannya membutuhkan fungi simbiotik. Selain itu, kebanyakan anggrek memiliki rata-rata pertumbuhan yang sangat lambat (Arditti 1992). Perbanyakan anggrek dalam jumlah banyak dan waktu yang relatif singkat dapat dilakukan dengan teknik kultur in vitro. Anggrek yang dihasilkan memiliki sifat sama dengan induknya dan pertumbuhannya relatif seragam serta dapat melakukan berbagai hal yang berkaitan dengan pelestarian anggrek yang tidak dapat dilakukan secara konvensional (Sandra 2003).
Kebun Raya Indonesia telah melakukan upaya konservasi anggrek yang semakin langka di alam melalui perbanyakan anggrek dengan teknik kultur in vitro untuk memperoleh bibit anggrek dalam skala relatif besar. Beberapa jenis anggrek alam telah diperbanyak di Kebun Raya Bogor, Kebun Raya Purwodadi, dan Kebun Raya Bali. Salah satu jenis anggrek yang telah diperbanyak secara in vitro di Kebun Raya Bali adalah Bulbophyllum echinolabium J.J.Sm. (Isnaini dkk. 2011). Anggrek jenis ini terdaftar dalam lampiran II CITES sehingga walaupun belum terancam punah, tetapi bisa mengarah kesana apabila perdagangannya tidak diatur dengan peraturan yang melindungi keberlangsungannya di alam liar (UNEP-WCMC 2011).
Bulbophyllum merupakan kelompok genus terbesar dalam famili Orchidaceae
dengan lebih dari 2.000 jenis. Nama Bulbophyllum sendiri berasal dari bahasa latin
bulbus (seperti bulb) dan bahasa yunani phyllon (daun), yang menunjukkan struktur pseudobulb tempat tumbuhnya daun (Arditti 1992). Bulbophyllum merupakan
anggrek epifit, simpodial dengan pseudobulb mendukung satu daun yang tebal. Perbungaan hanya mendukung satu bunga. B. echinolabium J.J.Sm. memiliki bunga yang paling besar diantara genus Bulbophyllum hingga mencapai 40 cm (Comber 1990). Anggrek ini memiliki potensi sebagai tanaman hias karena memiliki bunga yang indah dengan karakter unik. Bunganya berwarna merah marun dengan sepal lateral yang tumbuh lebih panjang dibandingkan petal. Jenis ini sangat disukai sebagai tanaman hias baik indoor maupun outdoor. Oleh karena potensi inilah, B.
echinolabium J.J.Sm. sangat diminati oleh para peminat dan kolektor anggrek. Jika
tidak dilakukan upaya perbanyakan untuk memenuhi kebutuhan pasar, mungkin untuk beberapa tahun kedepan jenis ini akan mengalami kepunahan di habitat aslinya. Untuk meningkatkan tingkat keberhasilan perbanyakan B. echinolabium J.J.Sm. melalui kultur in vitro diperlukan usaha untuk mengkaji faktor-faktor penyebab belum berhasilnya planlet yang telah melalui tahap aklimatisasi.Penulisan makalah
ini bertujuan untuk memberikan informasi kepada masyarakat mengenai metode konservasi dan propagasi B. echinolabium J.J.Sm. melalui Kultur In vitro.
METODE PENELITIAN
Material Tanaman
Material yang digunakan dalam penelitian ini adalah biji anggrek B. echinolabium J.J.Sm. koleksi Kebun Raya ‘Eka Karya’ Bali-LIPI (No kolektor : GT.1051/ No akses : E198007205) yang berasal dari Sulawesi Selatan. Penelitian ini dilakukan di Laboratorium Konservasi Tumbuhan dan Rumah Kaca UPT Balai Konservasi Tumbuhan Kebun Raya ‘Eka Karya’ Bali – LIPI. Penelitian dilakukan mulai dari Oktober 2007–Oktober 2013.
Sterilisasi Biji, Perkecambahan, dan Pemeliharaan
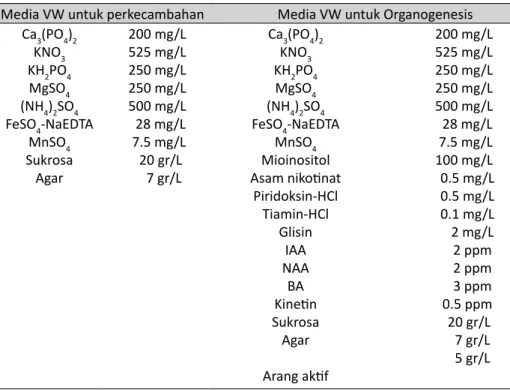
Biji anggrek B. echinolabium J.J.Sm. yang digunakan dalam penelitian ini berasal dari buah yang dipetik matang dari pohon. Hal ini ditandai dengan kulit buah yang berwarna kuning. Buah anggrek B. echinolabium J.J.Sm. dibiarkan pecah secara alami di suhu ruang dan dipisahkan dari buahnya. Sebelum disemai dalam media kultur, biji disterilisasi dalam larutan NaClO komersial (merk Bayclin, kadar NaClO 5,25%) yang diencerkan hingga 20% selama 10 menit di dalam laminar. Proses penyemaian dalam media kultur dibantu dengan ose untuk meratakan biji diatas permukaan media. Media yang digunakan untuk perkecambahan B. echinolabium J.J.Sm. adalah media dasar Vacin and Went (VW) tanpa pemberian zat pengatur tumbuh. Dalam penelitian ini, biji disemai dalam 7 botol media kultur, sedangkan media yang dipergunakan untuk pemeliharaan dan subkultur (organogenesis) adalah media dasar VW yang telah dimodifikasi dan diberi zat pengatur tumbuh. Komposisi media yang digunakan dalam penelitian ini dapat dilihat pada Tabel 1 (Lampiran). Kultur biji diinkubasikan dalam ruang kultur dengan pencahayaan 12 jam terang. Pemeliharaan dan subkultur biji B. echinolabium J.J.Sm. yang telah berkecambah ke media baru dilakukan setelah terbentuknya struktur protocorm like bodies dengan setidaknya satu calon daun.
Aklimatisasi Planlet
Planlet B. echinolabium yang telah siap diaklimatisasi, dikeluarkan dari botol kultur. Kegiatan ini dimulai pada akhir April 2013 s.d. Oktober 2013. Akar dicuci dengan air yang dicampur dengan sabun cair (Sunlight®), kemudian dilanjutkan dengan air mengalir untuk menghilangkan sisa media agar yang menempel. Selanjutnya, planlet dicelupkan dalam larutan vitamin B1 (Liquinox Start®) 2,5 mL/liter air dan fungisida Benlate® 2g/ liter air secara berurutan. Setelah itu, planlet diletakkan di hamparan kertas koran di tempat teduh selama beberapa jam untuk menghilangkan air yang menempel. Tahap berikutnya, planlet ditanam secara single pot pada media
cacahan akar pakis dan arang dengan perbandingan volume 3:1. Single pot disungkup dengan plastik transparan dan diletakkan di tempat terlindung dari sinar matahari langsung di dalam rumah kaca. Perawatan planlet pada masa aklimatisasi mencakup penyemprotan air dengan frekuensi 2–3 hari sekali dan pupuk NPK Growmore® 30:10:10 dengan dosis 2 g/liter 1–2 kali dalam seminggu. Setelah sebulan, mulai dilakukan buka tutup sungkup sekaligus penempatan planlet di lokasi dengan intensitas cahaya langsung secara bertahap hingga planlet mampu tumbuh tanpa sungkup dan intensitas cahaya yang lebih tinggi. Pengamatan untuk mengetahui pertumbuhan planlet dilakukan pada awal penanaman sampai 150 hari setelah penanaman. Parameter yang diamati meliputi jumlah dan dan luas daun.
HASIL DAN PEMBAHASAN
Kegiatan konservasi dan propagasi B. echinolabium J.J. Sm. melalui kultur in vitro telah dilakukan oleh UPT BKT Kebun Raya ‘Eka Karya’ Bali – LIPI. Upaya konservasi
B. echinolabium J.J. Sm. dilakukan dengan memperbanyak koleksi B. echinolabium J.J.
Sm. tidak hanya dilakukan di alam terbuka, tetapi juga di laboratorium. Konservasi tumbuhan melalui in vitro tidak memerlukan lahan yang luas dan perawatan yang berlebihan.
Sterilisasi dan Perkecambahan Biji
Perkecambahan biji B. echinolabium J.J.Sm. dalam penelitian ini terjadi 1 tahun setelah inisiasi dengan persentase perkecambahan sebesar 86% atau sebanyak 6 dari 7 kultur biji yang berkecambah. Waktu perkecambahan yang memakan waktu lama mungkin disebabkan embrio yang belum cukup matang atau terjadi dormansi terhadap bijinya. Perkecambahan B. echinolabium J.J.Sm. membutuhkan kondisi lingkungan dan nutrisi tertentu, terutama jika biji anggrek masih muda. Lingkungan yang mendukung, seperti suhu dan cahaya tertentu untuk mematahkan dormansi dan memicu perkecambahan. Nutrisi yang dibutuhkan perlu didukung dengan pemberian nutrisi secara lengkap karena biji anggrek tidak mengandung endosperm atau cadangan makanan untuk membantu pertumbuhan dalam tahap awal sebelum mencapai tahap autotrof. Pertumbuhan biji anggrek dimulai dengan pembentukan
protocorm like bodies (plb), pembentukan primordial daun, pendewasaan daun,
pembentukan daun kedua, dan pembentukan akar (Santosa dan Fatimah 2004).
Pemeliharaan dan SubKultur
Media VW diberi penambahan zat pengatur tumbuh auksin, sitokinin, dan vitamin. Tujuannya adalah untuk memacu morfogenesis dan diferensiasi organ lebih lanjut sehingga dapat membentuk planlet B. echinolabium J.J. Sm. yang siap untuk diaklimatisasi (Machakova et al. 2008). Auksin yang digunakan dalam kegiatan ini adalah Indole Acetic Acid (IAA) 2 ppm dan Napthalene Acetic Acid (NAA) 3
Gambar 1. A. Morfologi Tanaman B. echinolabium J.J. Sm.; B. Morfologi Bunga B echinolabium J.J. Sm yang Telah Mekar; C. Kultur B. echinolabium J.J.Sm. yang Telah Berakar; D. Kultur B. echinolabium J.J.S. yang Telah Diaklimatisasi
A
C
B
D
ppm. Sedangkan Sitokinin yang digunakan adalah BA (3 ppm) dan Kinetin (0.5 ppm). NAA merupakan zat pengatur tumbuh golongan auksin yang merangsang pembentukan akar. Pengaruh auksin terhadap perkembangan sel menunjukkan adanya indikasi dalam meningkatkan sintesa protein. Kenaikan sintesa protein dapat digunakan sebagai sumber tenaga dalam pertumbuhan (Sriyanti dan Wijayani 1994). Penggunaan sitokinin yang dikombinasikan dengan auksin akan memberikan jumlah tunas lebih baik dibandingkan dengan sitokinin tunggal. Rasio pemberian auksin sitokinin untuk memacu morfogenesis dan diferensiasi akan berbeda tiap jenis tanaman, sedangkan vitamin merupakan senyawa yang diperlukan oleh tumbuhan dalam jumlah sedikit sebagai senyawa intermediate esensial atau katalisis dalam proses metabolisme. Oleh karena itu, pemberian vitamin dalam media kultur dapat meningkatkan pertumbuhan dan kesintasan tanaman kultur (Thorpe et al. 2008).
Pada kegiatan ini, pertumbuhan eksplan dari biji B. echinolabium J.J. Sm. melalui kultur biji hingga menjadi planlet yang siap untuk diaklimatisasi masih lambat. Menurut Monnier (1990), keberhasilan perbanyakan secara in vitro, baik melalui penggandaan tunas, organogenesis, maupun organogenesis embriosomatik, sangat dipengaruhi oleh genotype dan eksplan, jenis media dasar, dan jenis serta konsentrasi zat pengatur tumbuh yang digunakan.
Planlet hasil dari tahapan subkultur ini kemudian diseleksi untuk menentukan planlet yang siap untuk diaklimatisasi. Kriteria planlet B. echinolabium J.J.Sm. yang siap untuk diaklimatisasi adalah akar, daun, dan warna pucuk batang hijau mantap (tidak tembus pandang) serta pertumbuhannya kekar dan akar memenuhi media (pertumbuhan akar bagus).
Aklimatisasi
Aklimatisasi dilakukan untuk mengadaptasikan tanaman B. echinolabium J.J. Sm. hasil kultur biji terhadap lingkungan baru sebelum ditanam dalam lingkungan tum-buh yang kurang aseptik. Proses aklimatisasi dilakukan dengan cara bertahap supaya tanaman hasil kultur jaringan dapat beradaptasi dengan perubahan lingkungan. Baik suhu, kelembapan, cahaya maupun faktor lainnya akan berbeda dan tanaman hasil kultur jaringan juga memiliki kekurangan dibanding tanaman yang ditanam di lingkungan alami.
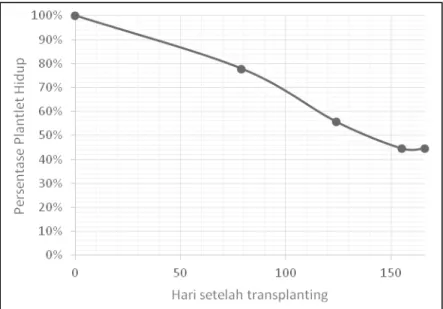
Pada penelitian ini persentase keberhasilan tahap aklimatisasi sebesar 44,4% (Gambar 2). Nilai yang relatif kecil tersebut menambah informasi bahwa tahap ak-limatisasi sering menjadi penyebab kemacetan (bottleneck) dalam usaha perbanyakan tanaman dengan kultur biji.
Hal pertama yang perlu dicermati adalah pencucian akar untuk membersihkan sisa-sisa media agar sebelum ditanam di media pakis. Apabila masih ada media agar yang tersisa, akan tumbuh jamur dalam waktu 2–3 hari setelah transplanting. Hal ini tentunya sangat berdampak buruk bagi planlet yang baru saja dipindahtanamkan. Selama proses aklimatisasi B. echinolabium dalam kurun waktu 6 bulan tidak ditemukan gangguan ini. Hal ini selain dipengaruhi oleh pencucian akar dari sisa media agar secara tuntas, sesaat sebelum ditanam dilakukan pencelupan planlet ke dalam larutan fungisida.
Faktor kedua yang memengaruhi keberhasilan pertumbuhan planlet secara single
pot ini adalah ukuran planlet ketika dikeluarkan dari botol. Planlet dengan ukuran
lebih besar tampaknya lebih besar peluangnya untuk berhasil tumbuh apabila dibandingkan dengan planlet yang berukuran lebih kecil (Gambar 3A dan 3B). Hal ini tampaknya terkait dengan kondisi organ vegetatif planlet (akar, pseudo bulb, dan daun) pada saat dipindahkan ke media baru. Secara visual, terlihat bahwa planlet dengan ukuran besar mempunyai organ vegetatif yang lebih kuat dan segar dibandingkan dengan planlet kecil. Terkait dengan kondisi planlet, Hazarika (2003) menjelaskan
Gambar 2. Persentase Planlet Hidup
Gambar 3. Tahapan Aklimatisasi: A. Awal Aklimatisasi; B. Akhir Tahap Aklimatisasi; C-D. Tanaman B. echinolabium J.J. Sm Hasil Aklimatisasi; E-F. Tunas Baru yang Muncul pada Tana-man Hasil Aklimatisasi
A D B E C F
bahwa kondisi lingkungan in-vitro yang terkontrol dan ketersediaan nutrisi yang berlimpah menyebabkan karakter fenotipe, fisiologis, dan anatomis planlet yang menyebabkannya sulit bertahan ketika ditanam di lingkungan luar. Selain kedua faktor yang telah disebutkan sebelumnya, pengondisian terhadap keadaan lingkungan
di rumah kaca secara bertahap inilah yang menjadi penentu keberhasilannya. Lebih lanjut Hazarika (2003) menjelaskan bahwa planlet dalam botol kultur dengan kondisi kelembapan udara tinggi umumnya memiliki karakter-karakter khusus seperti ren-dahnya pembentukan lapisan lilin daun, abnormalitas stomata, dan lapisan kutikula yang tidak kontinu. Karakter-karakter tersebut tentunya sangat terkait dengan kadar air dalam jaringan tanaman, yang berpengaruh terhadap berlangsungnya keseluruhan proses fisiologis, baik itu anabolisme maupun katabolisme.
Hubungan antara air dalam media tanam, tanaman, dan atmosfer menjadi faktor penting dalam keberhasilan awal aklimatisasi. Hal ini diketahui dari kondisi plantet yang tidak berhasil tumbuh yang pada umumnya diawali dari kondisi layu kemudian lama-kelamaan menjadi kering dan pada akhirnya mati. Dalam kondisi normal, air yang ada dalam media tanam diserap oleh tanaman melalu akar, diangkut dalam jaringan tanaman melalui pembuluh xylem, dan pada akhirnya ditranpirasikan oleh daun melalui lubang-lubang stomata atau lebih dikenal dengan konsep
soil-plant-atmosphere continuum-SPAC (Kirkham 2005). Layu dan keringnya tanaman
menunjukkan adanya gangguan dari kontinyuitas pergerakan air dari media sampai ke atmosfer ini.
Penyungkupan dengan plastik transparan dilanjutkan dengan buka-tutup secara bertahap merupakan aplikasi konsep SPAC tersebut. Perlakuan ini dimaksudkan untuk mengaklimatisasi planlet dengan kondisi kelembapan udara di lingkungan baru yang berbeda dengan kondisi in-vitro. Beberapa waktu setelah tersungkup rapat, kelembapan udara di lingkungan dalam sungkup akan menjadi jenuh oleh uap air yang dihasilkan melalui proses transpirasi dan evaporasi. Hal ini ditandai dengan terbentuknya titik-titik embun di permukaan dalam sungkup. Kondisi ini akan menghambat hilangnya air dari jaringan tanaman sehingga sel-sel tanaman dalam kondisi turgid dan tanaman terlihat segar. Hal yang sebaliknya akan terjadi pada saat sungkup dibuka, dimana sel-sel menjadi flaccid dan tanaman terlihat layu. Buka tutup sungkup dilakukan secara bertahap dan berulang-ulang hingga planlet tetap segar walaupun sungkup telah dibuka. Dalam aklimatisasi B. echinolabium J.J. Sm. di rumah kaca Kebun Raya Bali ini, planlet bisa bertahan tanpa sungkup setelah 1 bulan buka-tutup secara bertahap.
Setelah itu, pemberian pupuk cair terlihat memberikan manfaat untuk memacu pertumbuhannya. Dalam hal ini, dalam kurun waktu 2–3 hari setelah disemprot pupuk, warna daun-daun planlet menjadi lebih hijau dari sebelumnya. Planlet B.
echinolabium J.J. Sm.yang telah diaklimatisasi mengalami penambahan tunas dan
daun baru (Gambar 3 D). Dengan demikian, aklimatisasi secara bertahap terhadap kondisi lingkungan di rumah kaca atau lapangan diperlukan untuk meningkatkan keberhasilan perbanyakan tanaman.
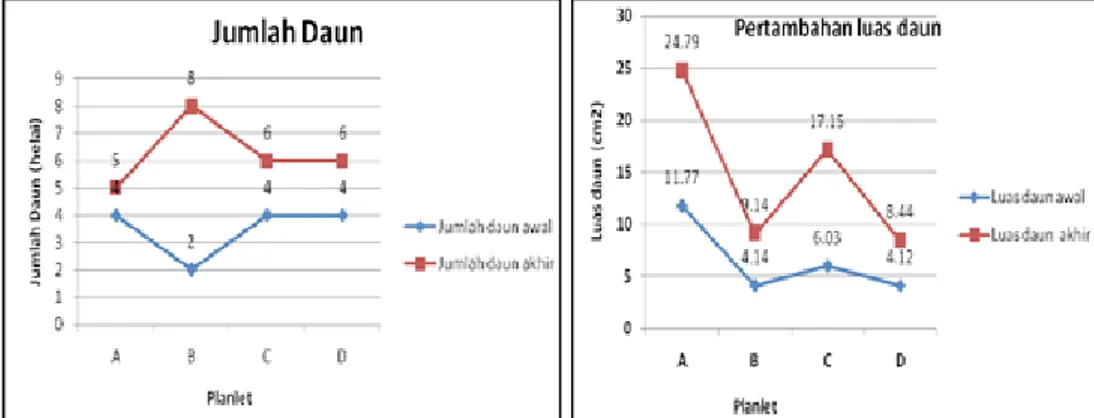
Gambar 4 menunjukkan bahwa masing-masing planlet yang berhasil bertahan mengalami pertumbuhan dengan ditandainya pertambahan jumlah dan luas daun. Pertambahan jumlah daun tertinggi terdapat pada eksplan B (bertambah 6 helai
Gambar 4. Grafik Pertumbuhan Planlet pada Tahap Aklimatisasi
setelah 150 hari penanaman) sedangkan pertambahan luas daun paling besar terdapat pada planlet A (luas daun bertambah 13,02 cm2).
Kegiatan ini masih memerlukan penelitian yang lebih mendalam lagi dengan jumlah sampel yang lebih banyak dan faktor perlakuan yang lebih kompleks untuk mengetahui teknik aklimatisasi yang lebih tepat, untuk mendapatkan media yang sesuai untuk pertumbuhan planlet, serta untuk mengetahui pengaruh media aklimatisasi terhadap pertumbuhan dan keberhasilan aklimatisasi dalam kultur in
vitro B. echinolabium J.J. Sm.
Penelitian tentang pengembangan B. echinolabium J.J. Sm. dan anggrek alam lainnya melalui teknik kultur in vitro dan aklimatisasinya juga perlu terus diupayakan untuk optimalisasi perbanyakan anggrek alam untuk tujuan konservasi secara ex situ maupun untuk memperoleh bibit anggrek alam yang tumbuh subur dan sehat dalam skala besar untuk tujuan komersil. Dengan adanya ketersediaan bibit hasil kultur jaringan diharapkan eksploitasi B. echinolabium J.J. Sm dan anggrek alam lain yang dari habitat aslinya dapat dicegah.
KESIMPULAN DAN SARAN
Pada kegiatan ini, pertumbuhan eksplan dari biji B. echinolabium J.J. Sm. melalui kultur biji hingga menjadi planlet yang siap untuk diaklimatisasi masih lambat. Persentase keberhasilan tahap aklimatisasi sebesar 44,4%. Aklimatisasi secara bertahap terhadap kondisi lingkungan di rumah kaca atau lapangan diperlukan untuk meningkatkan keberhasilan perbanyakan tanaman B. echinolabium J.J.Sm. dengan kultur jaringan. Penelitian mengenai Konservasi dan Propagasi B. echinolabium J.J. Sm. melalui kultur biji telah dilakukan di UPT BKT Kebun Raya ‘ Eka Karya’ Bali, namun hasilnya belum optimal. Penelitian ini masih membutuhkan pengembangan yang lebih lanjut sehingga akan diperoleh metode konservasi dan propagasi yang lebih tepat dan cepat dalam rangka pelestarian B. echinolabium J.J. Sm secara ex situ, pengembangan dan pemanfaatannya.
DAFTAR PUSTAKA
Arditti J. 1992. Fundamentals of Orchid Biology. New York: Wiley.
Arditti, J. & A.D. Krikorian. 1996. “Orchid Micropropagation: The Path From Laboratory to Commercialization and An Account of Several Unappreciated Investigations.” Bot J Linn Soc. 122, 183–241.
Chase, M.W., K.M. Cameron, R.L. Barrett & J.V. Freudenstein. 2003. “DNA Data and Orchidaceae Systematic: A New Phylogenetic Classification.” Orchid Conservation, 69–89. Natural History Publications. Dixon, K.W., S.P. Kell, R.L. Barrett and P.J. Cribb (Eds.). Borneo, Kota Kinabalu, Sabah.
Comber, J.B. 1990. Orchids of Java, 255. Bentham-Moxon Trust. Kew: Royal Botanic Gardens. Hawkes, A. D. 1965. Encyclopaedia of Cultivated Orchids. London: Faber and Faber Limited. Hazarika, B.N. 2003. “Acclimatization of Tissue-cultured Plants.” Current Sci. 85(12), 1704–1712. Isnaini, Y., E. Hendriyani, & S. Nurfadilah. (2011). “Konservasi In Vitro dan Perbanyakan
Anggrek Alam di Kebun Raya Indonesia.” Prosiding Seminar Nasional HUT Kebun Raya Cibodas Ke-159, 539–543. Konservasi Tumbuhan Tropis: Kondisi Terkini dan Tantangan ke Depan. UPT Balai Konservasi Tumbuhan Kebun Raya Cibodas – LIPI.
Kirkham, M. B. 2005. Principles of Soil and Plant Water Relations. Singapur: Elsevier.
Kull, T., P. Kindlmann, Branisovska, M.J. Hutchings & R.B. Primack. 2006. “Conservation Biology of Orchids : Introduction to the Special Issue.” Biological Conservation 129, 1–3. Machakova, I., E. Zazimalova & E.F. George. 2008. “Plant Growth Regulators I: Introduction;
Auxin, their Analogues and Inhibitors.” Plant Propagation by Tissue Culture. 3rd Edition, 175. George, E.F., M.A. Hall and G.J. de Klerk (Eds.). Springer. Netherland.
Monnier, M. 1990. “Induction Embryogenesis in Suspension Culture. Metode in Molecular Biology.” Plant Cell Tiss. Org. Cult. 6, 149–157. Springer. Netherlands.
Sandra, E. 2003. Kultur Jaringan Anggrek Skala Rumah Tangga. Jakarta: AgroMedia Pustaka. Santosa, U. & Fatimah, N. 2004. Kultur Jaringan Tanaman. Malang: UMM Press.
Sriyanti, D.P. & A. Wijayani. 1994. Teknik Kultur Jaringan. Yogyakarta: Yayasan Kanisius. Thorpe, T., C. Stasolla, E.C. Yeung, G.J. de Klerk, A. Roberts & E.F. George. 2008. “The
Component of Plant Tissue Culture Media II : Organic Additions, Osmotic and pH Effects, and Supports Systems.” Plant Propagation by Tissue Culture. 3rd Edition, 115. George, E.F.,
M.A. Hall and G.J. de Klerk (Eds.). Springer. Netherland.
UNEP-WCMC. 2011. Checklist of CITES Species (CD-ROM). CITES Secretariat, Geneva, Switzerland, and UNEP-WCMC, Cambridge, United Kingdom.
LAMPIRAN
Tabel 1. Komposisi Media
Media VW untuk perkecambahan Media VW untuk Organogenesis Ca3(PO4)2 KNO3 KH2PO4 MgSO4 (NH4)2SO4 FeSO4-NaEDTA MnSO4 Sukrosa Agar 200 mg/L 525 mg/L 250 mg/L 250 mg/L 500 mg/L 28 mg/L 7.5 mg/L 20 gr/L 7 gr/L Ca3(PO4)2 KNO3 KH2PO4 MgSO4 (NH4)2SO4 FeSO4-NaEDTA MnSO4 Mioinositol Asam nikotinat Piridoksin-HCl Tiamin-HCl Glisin IAA NAA BA Kinetin Sukrosa Agar Arang aktif 200 mg/L 525 mg/L 250 mg/L 250 mg/L 500 mg/L 28 mg/L 7.5 mg/L 100 mg/L 0.5 mg/L 0.5 mg/L 0.1 mg/L 2 mg/L 2 ppm 2 ppm 3 ppm 0.5 ppm 20 gr/L 7 gr/L 5 gr/L