MODUL KIMIA XII IPA
BAB II
REDOKS DAN
REAKSI REDOKS
Standar Kompetensi :Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari
Kompetensi Dasar:
Menerapkan konsep reaksi oksidasi-reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri
Indikator:
Menyetarakan reaksi redoks dengan cara setengah reaksi (ion elektron)
Menyetarakan reaksi redoks dengan cara perubahan bilangan oksidasi (PBO)
Tujuan Pembelajaran:
1. Siswa dapat menyetarakan persamaan reaksi redoks
2. Siswa dapat menyelesaikan latihan soal penentuan bilangan oksidasi
3. Siswa dapatmenyetarakan persamaan reaksi redoks dengan cara bilangan Oksidasi (PBO) pada suasana asam
dan basa
4. Siswa dapat menyelesaikan latihan soal penyetaraan persamaan reaksi redoks dengan cara setengah reaksi pada
suasana asam dan basa 5. Aktif dalam kerja kelompok
6. Menggunakan bahasa Indonesia yang baik dan benar 7. Melaporkan data atau informasi dengan benar
8. Melakukan tugas yang diberikan dengan penuh tanggung jawab 9. Berani berpendapat, bertanya, atau menjawab pertanyaan tanpa
ragu ragu
10. Kerjasama dengan semua orang tanpa membeda-bedakan 11. Mengutamakan kepentingan umum di atas kepentingan pribadi 12. Memberi perhatian kepada orang lain yang sakit/lemah
1. Konsep Reduksi – Oksidasi (Redoks) N
o Reaksi Oksidasi Reaksi Reduksi
1 reaksi penambahan oksigen reaksi pengurangan oksigen 2 peristiwa pelepasan elektron
Contoh : Cu → Cu2+ + 2e- peristiwaelektron penangkapan
contoh: Cu2+ + 2e- → Cu
oksidasi 4 Zat memberikan elektron kepada
zat lain Zat menerima elektron darizat lain Senyawa yang mengalami oksidasi disebut reduktor, senyawa yang mengalami reduksi disebut oksidator.
1.1. Bilangan Oksidasi
Muatan dari suatu spesi dikatakan sebagai bilangan oksidasi (biloks). Biloks digunakan untuk menentukan apakah terjadi reaksi redoks atau tidak. Bila terjadi reaksi redoks, maka spesi yang teroksidasi akan mengalami kenaikan biloks dan yang tereduksi akan mengalami penurunan biloks.
Aturan penentuan bilangan oksidasi adalah :
a. Unsur murni atau senyawa beratom sejenis memiliki biloks = nol b. Atom H biloksnya = +1, kecuali pada senyawa hidrida seperti BaH2,
CaH2, NaH, biloks atom H = -1
c. Atom O biloksnya = -2, kecuali pada senyawa
o F2O → biloks O = +2
o Senyawa peroksida (H2O2, Na2O2, CaO2) → biloks O = -1
d. Atom logam memiliki biloks positif (+) sesuai dengan valensi logam tersebut
e. Jumlah total biloks seluruh atom dalam senyawa netral = nol f. Jumlah total biloks seluruh atom dalam ion = muatan ion
g. Jika dua jenis atom bersenyawa, atom yang memiliki keelektronegatifan lebih besar selalu mempunyai bilangan oksidasi negatif
2. Penyetaraan Reaksi Redoks
Reaksi redoks dapat disetarakan dengan cara bilangan oksidasi atau cara setengah reaksi.
2.1. Cara Langsung (Perubahan Bilangan Oksidasi/PBO) - Tentukan reaksi reduksi dan oksidasi
- Tuliskan perubahan biloks yang terjadi
- Samakan jumlah elektron yang dilepas dan diterima dengan menambahkan koefisien
- Hitung jumlah muatan kiri dan kanan
Jika muatan kiri > kanan → tambahkan OH- pada ruas kiri
Jika muatan kiri < kanan → tambahkan H+pada ruas kiri
- Samakan jumlah H dengan menambahkan H2O pada ruas kanan
Contoh : Fe+2 + MnO
5Fe+2 + MnO
4- → 5Fe3+ + Mn2+
Jumlah muatan kiri = +9, Jumlah muatan kanan = +17 Selisih muatan= +8 di ruas kiri(kiri < kanan)
5Fe+2 + MnO
4- + 8 H+ → 5Fe3+ + Mn2+
Jumlah H dan O di ruas kanan dan kiri tidak sama 5Fe+2 + MnO
4 + 8 H- → 5Fe+ 3+ + Mn2+ + 4H2O (reaksi
total)
2. Cara Setengah Reaksi
Untuk menyelesaikan persamaan redoks dengan cara setengah reaksi, maka langkah – langkah yang dilakukan adalah :
Tabel 1. Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi
Reaksi Suasana Asam Reaksi Suasana Basa
Tulis masing – masing reaksi reduksi
dan oksidasi Tulis masing – masing reaksi reduksidan oksidasi Setarakan jumlah elektron yang
terlibat Setarakan jumlah elektron yangterlibat Tambahkan satu molekul H2O pada
ruas yang kekurangan satu atom O Tambahkan dua molekul OH
- pada
ruas yang kekurangan satu atom O Tambahkan satu molekul H+ pada
ruas yang kekurangan satu atom H Tambahkan molekul yang kekurangan atom HH2O pada ruas Tulis reaksi yang sudah setara Tulis reaksi yang sudah setara
Contoh: Setarakan reaksi berikut ini H+
+2 +3
1. ClO3- + S2O32- → Cl- + S4O62- (Suasana asam)
Jawab :
ClO3- + S2O32- → Cl- + S4O62-
ClO3- + 6e- → Cl
-{2(S2O32-) → S4O62- + 2e-} x3
ClO3- + 6S2O32- → Cl- + 3S4O6
2-Ruas kanan kekurangan 3 atom O
ClO3- + 6S2O32- → Cl- + 3S4O62- + 3H2O
Ruas kiri kekurangan 6 atom H
ClO3- + 6S2O32- + 6H+ → Cl + 3S- 4O62- + 3H2O (reaksi total)
2. Cl2 + IO3- → IO4- + Cl-(Suasana basa)
Jawab :
Cl2 + IO3- → IO4- + Cl-
Cl2 + 2e- → 2Cl
-IO3- → IO4- + 2e
-Ruas kiri kekurangan satu atom O Cl2 + IO3- + 2OH- → IO4- + Cl-
Jumlah atom H dan O di ruas kiri dan kanan tidak sama Cl2 + IO3- + 2OH- → IO 4 + Cl- - + H2O (reaksi total)
Latihan Soal Penyetaraan Reaksi Redoks:
Selesaikan persamaan reaksi ini dengan cara perubahan bilangan oksidasi!
1. Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
2. KClO3(aq) + H2SO4(l) → KHSO4(s) + O2(g) + ClO2(g) + H2O(g)
3. KMnO4(aq)+ K2C2O4(aq)+H2SO4(aq) → K2SO4(aq) +MnSO4(aq)+ CO2(g)+ H2O(l)
4. ZnS + HNO3 → ZnSO4 + NO + H2O
5. KMnO4 + SnF2 + HF → MnF2 + SnF4 + KF + H2O
6. K2Cr2O7 aq + SnCl2 aq + HClaq → CrCl3 aq + SnCl4 aq + KClaq+ H2Ol
7. Cr2O3 + Na2CO3 + KNO3 → Na2CrO4 + CO2 + KNO2
8. Cl2 + SO2 + H2O → HCl + H2SO4
9. KOH + Cl2 → KCl + KClO3 + H2O
10. CH3OH(l) + Na2Cr2O7(aq) + H2SO4(aq) → Cr2(SO4)3 (aq)+ HCOOH(aq)+
Na2SO4(aq) + H2O(l)
11. Al + H2SO4 → Al2(SO4)3 + H2O + SO2
12. H2S + HNO3 → H2O + S + NO
13. ZnS + HCl + HNO3 → ZnCl2 + S + H2O + NO
14. KMnO4 + KI + H2O → MnO2 + I2 + KOH
Selesaikan persamaan reaksi redoks berikut dengan cara Perubahan Bilangan oksidasi dan Setengah reaksi!
A. Reaksi redoks dalam suasana asam
1) ClO3¯ + SO2 → SO42¯ + Cl¯ 2) H2S + NO3¯ → S8 + NO 3) MnO4¯ + H2S → Mn2+ + S8 4) Cu + SO42¯ → Cu2+ + SO2
5) MnO4¯ + CH3OH → CH3COOH + Mn2+ 6) Cr2O72¯ + Fe2+ → Cr3+ + Fe3+
7) HNO2 → NO + NO2
8) H2C2O4 + MnO4¯ → CO2 + Mn2+ 9) O2 + As → HAsO2 + H2O
10) NO2 → NO3¯ + NO
11) ClO4¯ + Cl¯ → ClO¯ + Cl2 12) H5IO6 + Cr → IO3¯ + Cr3+ 13) Fe + HCl → HFeCl4 + H2 14) NO3¯ + H2O2 → NO + O2 15) BrO3¯ + Fe2+ → Br¯ + Fe3+
16) Cr2O72¯ + C2H4O → CH3COOH + Cr3+ 17) MnO4¯ +C2H4O → CH3COOH + MnO2 18) Zn + NO3¯ → NH4+ + Zn2+
19) HBr + SO42¯ → SO2 + Br2 20) NO3¯ + I2 → IO3¯ + NO2
21) CuS + NO3¯ → NO + Cu2++ HSO4¯ B. Reaksi redoks dalam suasana basa
7) Fe + NiO2 → Fe(OH)2 +Ni(OH)2 8) MnO4¯ + H2O2 → MnO2 + O2
9) Zn + BrO4¯ → [Zn(OH)4]2¯+Br¯ 10) MnO4¯ + S2¯ → MnO2 + S8 11) Pb(OH)42¯+ ClO¯ → PbO2+Cl¯ 12) Tl2O3 + NH2OH → TlOH + N2
13) Fe(OH)2+CrO42¯ → Fe2O3 + Cr(OH)4¯ 14) Br2 → Br¯ + BrO3¯
SOAL PILIHAN GANDA
1. Manakah dari reaksi-reaksi berikut yang merupakan reaksi redoks? A. H+ + OH-
→
H2O
B. BaCl2 + H2SO4
→
BaSO4 + 2HCl C. SO2 + OH-→
HSO2-D. I2 + 2S2O32-
→
2I- + S4O6 2-E. MnCO3→
MnO + CO22. Pada reaksi: Cl2 + 2KOH
→
KCl + KClO + H2O bilangan oksidasi klor berubah dari...A. -1 menjadi +1 dan 0 B. +1 menjadi -1 dan 0 C. 0 menjadi -1 dan -2 D. -2 menjadi 0 dan +1 E. 0 menjadi -1 dan +1 3. Reaksi redoks berikut:
Cr2O72- + a Fe2+ + 14H+
→
b Cr3+ + c Fe3+ + 7H2O setelah disetarakan maka koefisien a, b, c masing-masing adalahA. 3, 2, 3 D. 6, 2, 6
B. 3, 4, 3 E. 6, 3, 6
C. 4, 3, 5
4. Perhatikan reaksi redoks berikut:
Cr2O72- + SO32-
→
Cr3+ + SO42- . Setelah reaksi disetarakan, perbandingan banyak mol ion Cr2O72- dengan SO42- dalam reaksi tersebut adalah ….A. 1 : 3 D. 3 : 2
B. 3 : 1 E. 1 : 6
C. 2 : 3
5. Bilangan oksida Cl dari -1 sampai dengan +7. Ion atau molekul manakah di bawah ini yang tidak dapat mengalami reaksi disproporsionasi adalah..
A. Cl2 dan HClO4 D. HCl dan HClO2
C. Cl- dan NaClO 4
6. Pada reaksi H2SO4 + HI H2S + I2 + H2O
1,5 mol asam sulfat dapat mengoksidasi hidrogen Iodida sebanyak ...
A. 12 mol B. 9 mol C. 6 mol
D. 3 mol E. 1,5 mol 7. Pada reaksi redoks berikut :
4Fe(s) + NO3-(aq) + 10H+(aq) 4Fe2+(aq) + NH4+(aq) + 3H2O(l) maka…
A. ion H+ mengalami reduksi
B. ion NO3- mengalami oksidasi
C. Fe sebagai reduktor
D. 1 mol NO3- = 4 mol ekuivalen
E. ion NH4+ sebagai oksidator
8. Logam Fe (Ar Fe = 56) jika dilarutkan di dalam asam dan
direaksikan dengan KMnO4 akan terjadi reaksi sebagai berikut: Fe2+ (aq) + MnO4-(aq) → Mn2+(aq) + Fe3+(aq)
Jika berat Fe yang dilarutkan 11,2 gram, maka volume KMnO4 0,1 M
yang dibutuhkan untuk reaksi tersebut adalah
A. 120 ml B. 160 ml C. 250 ml
D. 320 ml E. 400 ml
9. Pada reaksi redoks :aCr2O7-2(aq) + 14 H+(aq) + b Fe2+(aq) cCr3+(aq) +
7H2O(l) + d Fe3+(aq)
Nilai a, b, c, dan d berturut-turut dalam reaksi adalah ...
A. 1, 4, 2, 4 B. 1, 6, 2, 6 C. 2, 8, 2, 8 D. 2, 8, 4, 8 E. 3, 8, 6, 8
10.Bilangan oksidasi nitrogen tertinggi terdapat dalam senyawa ….
A.
NH4Cl B. N2H4 C. NaNO3D. Li3N E. Ca(NO2)2
11. Diantara reaksi berikut : 1. CH4 + 2O2 CO2 + 2H2O
2. CaCO3 + 2HCl CaCl2 + H2O + CO2
3. 2K2CrO4 + H2SO4 K2Cr2O7 + H2O + K2SO4
4. 3Fe2O3 + CO Fe3O4+CO2 yang
tergolong reaksi redoks adalah ….
A
Semua B. 1, 2, dan 3C. 1, 3, dan 4
D. 1 dan 4 E. 3 dan 4
12. Dalam reaksi:
CuS(s) + HNO3(aq) + HCI(aq) CuCl2(aq) + NO(g) + H2O(l) + S(s)
Yang merupakan oksidator dan hasil oksidasi adalah ….
D. CuS dan NO E. HNO3 dan S
13.KMnO4 dalam lingkungan basa dapat mengoksidasi Fe(OH)2
menurut persamaan; MnO
4-(aq) + aF(OH)2(s) + bH2O(l) MnO2(s) + cFe(OH)3(s) + dOH-(aq)
harga a, b, c dan d yang membuat reaksi di atas setara berturut-turut adalah …..
A
3, 1, 2 dan 2B
2, 2, 2 dan 2C
3, 2, 3 dan 1D
3, 2, 3 dan 2E
1, 1, 1 dan 114. Pada reaksi berikut: 6I
-(aq) + 2MnO4-(aq) + 4H2O(l)→ 3I2(s)+ 2MnO2(s)+
8OH
-(aq) Pernyataan yang benar adalah....
A. unsur I menerima 6 elektron B. unsur Mn melepaskan 14 elektron C. biloks Mn berubah dari -1 menjadi +4 D. biloks I berubah dari -1 menjadi 0 E. biloks H berubah dari +1 menjadi -1
15. Diantara reaksi berikut yang merupakan reaksi disproporsionasi adalah...
A. 2 Na2S2O3 + I2 → 2 NaI + Na2S4O6
B. 2 K2CrO4 + H2SO4 → K2SO4 + K2Cr2O7 + H2O
C. 6 KOH + 3 Cl2 → 5 KCl + KClO3 + 3 H2O
D. NH4Cl + NaOH → NaCl + NH3 + 3 H2O
E. 2 H2S + SO2 → 2 H2O + 3 S
16. Persamaan reaksi : a Cu(s) + b HNO3(aq) → cCu(NO3)2(aq) + dNO(g)+
H2O(l)Koefisien reaksi a, b, c, dan d adalah....
A. 1, 8, 1, 6 B. 3, 8, 3, 2 C. 2, 8, 2, 4 D. 1, 8, 1, 4 E. 3, 8, 3, 4
17. Reaksi redoks :KMnO4(aq)+ K2C2O4(aq)+H2SO4(aq)→ K2SO4(aq)+MnSO4(aq)
+ CO2(g)+ H2O(l)
Setengah reaksi oksidasi di atas adalah.... A. MnO4- (aq) + 8 H+ + 5 e → Mn2+(aq) + 4 H2O(l)
B. Mn2+
(aq) → Mn7+(aq) + 5 e
C. C2O42-(aq) → 2 CO2(g) + 2 e
D. 4 H+ + O
2(g0 + 4 e → 2 H2O(l)
E. H2C2O4(aq) + 2 H+ + 2 e → 2 CO2(g) + 2 H2O(l)
18. Pada reaksi :2 Cr(OH)3 + 3 ClO-(aq) + 4 OH-(aq) → 2 CrO42-(aq) + 3 Cl -(aq0 + 5 H2O Perubahan bilagan oksidasi chrom
B. 0 menjadi +4 C. +3 menjadi +6 D. +6 menjadi +3 E. +6 menjadi _4
19. Yang bukan merupakan reaksi redoks adalah … A. (NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
B. CuCO3 + H2SO4 → CuSO4 + H2O + CO2
C. H2S + 2H2O + 3Cl2 → SO2 + 6HCl
D. Mg + CuSO4 → MgSO4 + Cu
E. 3CH3CHOHCH3 + 2CrO3 → 3CH3COCH3 + 2Cr(OH)3
20. Reaksi berikut yang merupakan reaksi oksidasi reduksi adalah … A. Al3+ + 3OH- → Al(OH)
3 D. H+ + SO42- → H2SO4
B. Pb2+ + 2Br - → PbBr
2 E. H2 + Cl2 → 2HCl
C. HF + NH3 → NH4F
DAFTAR PUSTAKA
Achmad, H., Penuntun Belajar Kimia TPB II; Elektro Kimia, Departemen Kimia FMIPA – ITB, Bandung, 1982
Brady, J.E., General Chemistry : Principles and Structure, 5th
SEL ELEKTROKIMIA
I. Standar kompetensi
2. Memahami reaksi oksidasi reduksi dan sel elektrokimia serta penerapannya
dalam teknologi dan kehidupan sehari-hari II. Kompetensi Dasar
2.1 Menerapkan konsep reaksi redoks dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam industri.
2.2 Mengamati reaksi redoks dalam sel elektrolisis dan menerapkan hukum Faraday.
2.3Menerapkan konsep reaksi redoks pada korosi dan cara mencegahnya
2.4Menghitung banyaknya pereaksi dan hasilreaksi dalam larutan elektrolit dari hasil titrasi redoks
III. Tujuan Pembelajaran
Mengembangkan sikap dan perilaku yang mandiri dalam menyetarakan reaksi
redoks dengan cara setengah reaksi (ion elektron)
Mengembangkan sikap dan perilaku mau bekerja keras, dan berdaya juang tinggi
menyetarakan reaksi redoks dengan cara perubahan bilangan oksidasi (PBO)
Mengembangkan sikap dan perilaku yang mandiri, mau bekerja keras, dan berdaya juang tinggi dalam menyimpulkan ciri-ciri reaksi redoks yang berlangsung secara spontan melalui percobaan Mengutamakan musyawarah, menghormati dalam menggambarkan susunan
sel Volta atau sel Galvani dan menjelaskan fungsi tiap bagiannya Mengutamakan musyawarah dalam menjelaskan bagaimana energi listrik
dihasilkan dari reaksi redoks dalam sel Volta
Mengembangkan sikap dan perilaku mau bekerja keras dalam menuliskan
Mengembangkan keterbukaan, kelembutan hati dalam menghitung potensial sel
berdasarkan data potensial standar
Menjelaskan prinsip kerja sel Volta yang banyak digunakan dalam kehidupan
(baterai, aki dll)
Mengamati reaksi yang terjadi di anoda dan katoda pada reaksi elektrolisis melalui
percobaan
Mengembangkan sikap dan perilaku mau bekerja keras dalam menuliskan reaksi yang terjadi di anoda dan katoda pada larutan atau cairan dengan elektroda aktif ataupun elektroda inert Mengembangkan sikap dan perilaku yang berdaya juang tinggi saat menjelaskan
faktor-faktor yang mempengaruhi terjadinya korosi melalui percobaan
Mengembangkan sikap dan perilaku yang berdaya juang tinggi saat menjelaskan
beberapa cara untuk mencegah terjadinya korosi
Mengembangkan sikap dan perilaku mau bekerja keras dalam menerapkan konsep
hukum Faraday dalam perhitungan sel elektrolisis
Mengembangkan sikap dan perilaku yang berdaya juang tinggi saat menuliskan
reaksi elektrolisis pada penyepuhan dan pemurnian suatu logam Mengembangkan sikap dan perilaku mau bekerja keras
dalam menentukan
konsentrasi suatu zat dengan titrasi redoks
Mengembangkan sikap dan perilaku mau bekerja keras dalam menentukan
1. SEL VOLTA 2.SEL ELEKTROLISA
Sel yang menghasilkan energi listrik Sel yang menggunakan energi listrik dari perubahan kimia/reaksi kimia untuk suatu perubahan kimia
KAPAN KNAP
Kutub + 1. KATODA ( tempat reduksi ) kutub Kutub - 2. ANODA ( tempat oksidasi ) kutub +
Setiap zat/ logam memiliki harga potensial elektroda standart ( E0 )
tertentu Potensial Elektroda adalah suatu ukuran untuk menyatakan mudah tidaknya suatu zat/ unsur mengalami reduksi( itu sebabnya potensial elektroda disebut juga potensial reduksi ) yang diukur pada keadaan standart yaitu suhu 250C, konsentrasi ion 1 M dan tekanan gas 1 atm. Data E0dilihat
dalam tabel ini:
Jika E0 besar (bertanda +) : berarti mudah direduksi
Jika E0 kecil (bertanda -) : berarti mudah dioksidasi
Suatu sel menggunakan 2 elektroda dengan harga E0 yang berbeda,
Sel Volta menghasilkan listrik karena ada beda potensial dari elektroda yang digunakan. Beda potensial dihitung Dengan rumus :
E0
sel = E0 reduksi
-E0 oksidasi
E sel (potensial suatu sel) dapat dihitung dengan rumus:
E sel = E0sel -
0,0592
n
log Qc
n : jumlah elektron yang terlibat
Qc : kuosien reaksi (perbandingan konsentrasi Produk dengan Pereaksi)
Sel Volta dapat dinyatakan dengan suatu diagram yang disebut
diagram (notasi) sel Volta. Anode selalu dinyatakan di sebelah kiri, sedangkan katode di sebelah kanan.
Anode(-) / Elektrolit pd Anode // Elektrolit pd Katode / Aktode(+)
Dua garis sejajar (||) yang memisahkan anode dan katode menyatakan jembatan garam. Beda potensial pada jembatan garam berharga nol.
Kegunaan jembatan garam adalah sebagai berikut.
1. Melengkapi rangkaian listrik (sirkuit). Dengan adanya jembatan garam ion dapat bergerak dari sel yang satu ke sel yang lain.
Harga potensial mutlak suatu elektrode tidak dapat diukur, maka diperlukan suatu elektrode yang dipakai sebagai standar, yaitu elektrode hidrogen, mempunyai potensial = 0,00 volt.
Berdasarkan eksperimen sebagai berikut: 1. Elektrode yang lebih mudah mengadakan reaksi reduksi dibandingkan dengan elektrode
H2, diberi harga potensial reduksi positif.
2. Mengganti kation dan anion yang kekurangan dalam masing - masing sel
E° sel > 0 atau E° sel (+), reaksi berlangsung spontan.
E° sel < 0 atau E° sel (–), reaksi tidak
berlangsung.
Notasi sel Volta menyatakan bahwa di anode (kutub –) terjadi oksidasi Zn menjadi Zn2+, sedangkan di katode
(kutub +) terjadi reduksi ion Cu2+
menjadi Cu.
Diagram sel Voltanya:
Zn(s) | ZnSO4(aq) || CuSO4(aq) | Cu(s)
atau
Zn(s) | Zn(aq) || Cu (aq) | Cu(s)
Elektrode Zn dihubungkan dengan elektrode H2, besarnya potensial yang
Contoh soal:
1. Hitunglah E°sel untuk reaksi: Zn / Zn2+ (a = 1) // Pb2+ (a = 1) / Pb Jawab: E°sel = E° Zn/Zn2+ + E° Pb2+/Pb
= – (– 0,76 V) + (– 0,13 V) = + 0,63 V
3. Beberapa Sel Volta dalam Kehidupan Sehari – hari: a. Baterai Kering (Sel Leclanche)
Sel Baterai ini terdiri dari anode Zn, katode batang grafit (C). Katode grafit bersifat inert dan diletakkan dalam elektrolit berbentuk pasta berisi
campuran batu kawi (MnO2) dan Salmiak (NH4Cl).
Reaksi redoks yang terjadi:
Anode : Zn(s) → Zn2+(aq) + 2 e
Katode:2MnO2(s)+ 2NH4+(aq)+2e →Mn2O3(s)+2NH3(g)+H2O(l)
_______________________________________________+
2MnO2(s)+NH4+(aq)+Zn(s)→Mn2O3(s)+2NH3(g)+H2O(l)+Zn2+(aq)
NH3 akan bergabung dengan Zn2+(aq)
reaksinya: Zn2+
(aq) + 4NH3(g)→ Zn(NH3)42+(aq)
Potensial sel Leclanche sebesar 1,5 volt, umur baterai ini cenderung pendek disebabkan produk ion dari reaksi redoks tidak dapat berdifusi dengan cepat meninggalkan elektrode. Jika pemakaian dihentikan, ion – ion ini akan
mempunyai kesempatan untuk meninggalkan elektrode, maka umur baterai naik.
b. Baterai Alkalin
Baterai ini bersifat basa karena menggunakan KOH menggantikan NH4Cl
dalam pasta. Potensial selnya sebesar 1,5 volt, baterai ini dapat bertahan lebih lama dan dapat menyuplai arus yang lebih besar
dibandingkan baterai kering seng – karbon.
Reaksi redoks yang terjadi:
Anode: Zn(s) + 2 OH-(aq) → ZnO(s)+ H2O(l) +2 e
Katode:2 MnO2(s) + H2O(l) + 2 e → Mn2O3(s)+2 OH-(aq)
____________________________________________+ Sel: Zn(s) + 2 MnO2(s) → ZnO(s) + Mn2O3(s)
Reaksi redoks pada sel tidak melibatkan ion
yang dapat berkumpul di permukaan elektrode sehingga
potensialnya konstan. Anode seng yang berpori memperluas permukaan anode sehingga memperbesar arus. Baterai ini digunakan pada peralatan yang memerlukan arus besar, misalnya: kamera, tape recorder, main
c. Baterai Merkuri
dan Karbon, elektrolit KOH.
Reaksi redoks yang terjadi:
Anode: Zn(s) + 2OH-(aq) → ZnO(s) + H2O(l) +2e
Katode: HgO(s) + H2O(l) + 2 e → Hg(l) + 2 OH-(aq)
_________________________________________+ Sel: Zn(s) + HgO(s) → ZnO(s) + Hg(l)
Reaksi yang terjadi tidak melibatkan ion sehingga potensialnya konstan. Potensial sel yang dihasilkan 1,34 volt. Baterai ini digunakan pada jam tangan, kalkulator.
d. Baterai Perak Oksida
Sel dari baterai perak oksida terdiri dari anode Zn, katode Ag2O dengan elektrolit KOH.
Reaksi redoks yang terjadi:
Anode: Zn(s) + 2 OH-(aq) → Zn(OH)2(s)+ 2 e
Katode:Ag2O(s) + H2O(l)+ 2 e → 2 Ag(s) + 2 OH-(aq)
________________________________________+
Sel: Zn(s)+ Ag2O(s) + H2O(l) +2e → 2 Ag(s)+ Zn(OH)2(s)
Potensial sel baterai ini sekitar 1,5 volt dan dapat bertahan konstan
selama pemakaian, banyak digunakan untuk jam tangan, kamera, kalkulator.
e. Baterai Lithium-Tionil Klorida (Li/SOCl2)
Sel baterai ini terdiri dari anode Li, katode karbon, dimana tionil klorida tereduksi. Elektrolitnya adalah lithium aluminium tetraklorida (LiAlCl4) dalam
tionil klorida.
Reaksi redoks yang terjadi:
Anode: 4 Li(s) → 4 Li+(aq) + 4 e
Katode: 2 SOCl2(aq) + 4 e → SO2(g) + S(s) + 4 Cl-(aq)
______________________________________________+
Sel: 2 SOCl2(aq) + 4 Li(s) → SO2(g) + S(s) + 4 LiCl(aq)
f. Aki atau baterai Pb
Sel aki terdiri dari anode Pb, katode PbO2 dengan elektrolit H2SO4.
Anode dan katode yang berbentuk pelat menambah luas permukaan elektrode sehingga dapat memperbesar arus
Anode: Pb(s) + SO2-4(aq) → PbSO4 (s) + 2e
Kat: PbO2(s) + 4H+(aq)+ SO2-4(aq)+2e → PbSO4 (s)+ 2H2O(l)
____________________________________________+
Sel: Pb(s) + PbO2(s) + 4H+(aq)+2SO2-4(aq)→ 2PbSO4 (s)+2H2O(l)
R. redoks pada aki mengakibatkan penurunan konsentrasi H2SO4
dan penumpukan produk PbSO4 pada permukaan pelat, karenanya potensial
aki menurun dan aki harus diisi ulang.Pengisian ulang aki dilakukan dengan melewatkan arus dengan arah berlawanan, artinya arus elektron dimasukkan melalui katode. Dengan demikian, reaksi dapat dibalik dan PbSO4 melarut
kembali menjadi Pb dan PbO2, proses ini disebut elektrolisis.
Reaksi redoks yang terjadi:
2PbSO4 (s) + 2 H2O(l) → Pb(s) + PbO2(s) + 4 H+(aq) + 2 SO2-4(aq)
Aki model baru menggunakan anode Pb – Ca, sehingga hanya sedikit air yang terelektrolisis dan tidak perlu menambah air aki.
g. Baterai Ni – Cd
Sel baterai ini terdiri dari anode Cd, katode logam NiO2 dengan elektrolit KOH.
Reaksi redoks yang terjadi:
Anode: Cd(s) + 2 OH-(aq) → Cd(OH)2(s) + 2 e
Katode: NiO2(s) + 2 H2O(l) → Ni(OH)2(s) + 2 OH-(aq)
______________________________________________+
Sel: NiO2(s) + 2 H2O(l) + Cd(s) → Ni(OH)2(s) + Cd(OH)2(s)
Baterai ini dilengkapi alat isi ulang, mempunyai potensial 1,4 volt. Sering digunakan pada kalkulator, fash fotografi, kamera digital, laptop.
h. Baterai NiMH (Nikel Metal Hidrida)
Sel dari baterai ini terdiri dari anode Ni(OH)2, katode paduan logam yang
menyerap hidrogen, Elektrolitnya KOH.
Reaksi redoks yang terjadi:
Anode: Ni(OH)2 + OH-(aq) → NiOOH + H2O +e
Katode: M(aq) + H2O(l)+ e → MH + OH-(aq)
_____________________________________+ Sel: Ni(OH)2 + M → NiOOH + MH
Baterai ini digunakan pada laptop,telepon seluler, kamera digital. Potensial yang dihasilkan 1,4 volt, dapat menyimpan 50% energi lebih banyak dari baterai Ni-Cd.
Pada sel bahan bakar menggunakan bahan bakar biasa, campuran hidrogen dan oksigen atau campuran gas alam dengan oksigen. Di katode dialirkan gas oksigen melalui bahan berpori yang mengkatalisis reaksi, anode dialirkan gas hidrogen. Sel terdiri tabung kosong terbuat dari
karbon padat dan diisi katalis, elektrolit KOH.
Reaksi redoks yang terjadi:
Anode: 2 H2(g) + 4 OH-(aq) → 4H2O(l) + 4e
Katode: O2(g) + 2 H2O(l) + 4 e → 4OH-(aq)
__________________________________+ Sel: 2 H2(g) + O2(g) → 2 H2O(l)
Sel ini dapat beroperasi terus menerus, terus disuplai pereaksi. Sel ini mengubah
energi bahan bakar langsung menjadi energi listrik.
LATIHAN SOAL SEL VOLTA
1. Gambarkan sel volta sesuai dengan reaksi berikut :
Ni(s) + Cu(NO3)2(aq) → NiNO3(aq) + Cu(s) , Tulislah reaksi pada
katoda, anoda serta E0 sel dan diagram selnya.
2. Diketahui reaksi ½ sel berikut :Al3+
(aq) + 3e → Al(s) E0 = - 1,67 v
Cu2+
(aq) + 2e → Cu(s) E0 = +0,34 v
Tulislah notasi sel/ diagram sel dan harga potensial sel 3. Diketahui dua reaksi berikut :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu (s) E0 = 1,10 v
2Al(s) + 3 Cu2+(aq) → 2Al3+(aq) + 3 Cu (s) E0 = 2,0 v
a. Urutkan ketiga logam berdasarkan makin kuatnya daya pereduksi ? b. Harga potensial sel yang menggunakan elektroda Zn dan Al
c. Harga E sel bila reaksi redok Zn dan Al dengan konsentrasi tertentu seperti berikut : 2 Al(s) + 3 Zn2+(aq) (0,2 M) →2 Al3+(aq) (2 M) + 3 Zn(s)
4. Perhatikan tabel berikut :
ka toda
anoda Cu
2+/ Cu Pb
2+/ Pb Fe
2+/ Fe
Fe / Fe2+ 0,78 v 0,31
Pb / Pb 2+ 0,47 v -
Zn / Zn2+
- 0,63v 0,32 v
a. Urutkan logam berdasarkan oksidator makin kuat b. Harga E0 untuk Zn
(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
c. Logam yang paling mudah teroksidasi.
5. Seorang siswa mengukur tegangan elektroda logam diperoleh hasil sbb : Tegangan yang diperoleh pada rangkaian Al/Al3+ // Ni2+ / Ni, Eo = 1,41
volt dan tegangan yang diperoleh dari rangkaian Ni / Ni2+ // Br
2 / Br- Eo
= 1,32 volt. Tentukan tegangan yang diperoleh pada rangkaian Al/Al3+ //
Br2 / Br-.
6. Perhatikan rangkaian gambar berikut :
a. Reaksi redok pada elektroda Zn ... > > Reaksi redok pada elektroda X ... Bila E0 Zn = - 0,76 v , hitung E0 X ...
Zn X Diagram sel ... Reaksi total sel ...
8.
9. Perhatikan data E0 berikut :
Uns
ur Cu2+/Cu Pb2+/Pb Mg
2+/
Mg Zn2+/Zn Fe
2+/
Fe I2 / I
-E0 + 0,34 - 0,13 - 2,37 - 0,76 - 0,44
-0,54 a. Selidikilah reaksi manakah dibawah ini yang dapat berlangsung ? (1) Mg2+
(aq) + Pb(s) → Mg(s) + Pb2+(aq)
(2) 2I
-(aq) + Fe2+(aq) → I2(s) + Fe(s)
(3) Cu2+
(aq) + Fe(s) → Cu (s) + Fe2+(aq)
b. Tentukan manakah yang dapat melindungi logam besi dari korosi secara proteksi katodik ?
10. Diketahui potensial standart beberapa sel sebagai berikut : Li/Li+ // Zn2+ / Zn E0 = 2,24 volt
Mg/Mg2+ // Zn2+ / Zn E0 = 1,61 volt 1, 1 Zn(NO3 )2 XSO4
Diisi dengan Fe2(SO4)3(aq)
Sebuah gelas piala terbuat dari logam aluminium Data : Fe3+ + 3e → Fe2+ E0 = 0,77 v
Fe/Fe2+ // Cu2+ / Cu E0 = 0,78 volt
Zn/Zn2+ // Cu2+ / Cu E0 = 1,10 volt,
Tentukan potensial standar sel berikut a. Li/Li+ // Cu2+ / Cu
b. Mg/Mg2+ // Fe2+ / Fe
c. Mg/ Mg2+ // Cu2+ / Cu
11. Bila harga potensial elektroda standart unsur sbb : Unsu
r
Cu2+/
Cu
Al3+/
Al
Mg2+/
Mg
Zn2+/
Zn
Sn4+/
Sn2+
Ag+/
Ag E0 0,34
-1,66 - 2,37 - 0,76 0,15 0,80
Hitunglah potensial sel volta berikut :
a. Zn(s) + 2 Ag+(aq) ( 2M ) Zn2+(aq) ( 1 M ) + 2Ag (s)
b. Mg(s) + Cu2+(aq) (0,1 M ) Mg2+(aq) (0,01 M) + Cu(s)
c. 2Al (s) + 3 Sn4+(aq) (0,08 M) 2 Al3+(aq) (0, 36 M) + 3 Sn2+(aq) (0,54 M)
12. Diketahui harga potensial standart sel berikut : A/A+ // C2+ / C E0 = 3,55 volt
B/B2+ // C2+ / C E0 = 0,98 volt
A/A+ // D2+ / D E0 = 2,47 volt
a. Susunlah A,B,C,D berdasarkan daya pereduksinya dimulai dari pereduksi paling kuat
b. Tentukan potensial standar sel dari D/D2+ // B2+ / B
KOROSI / PERKARATAN
Proses teroksidasinya logam oleh oksigen diudara (logam yang mudah
logam seperti besi, cenderung mengalami kerusakan di alam. Hal itu ditandai dengan adanya bercak-bercak besi yang berwarna merah cokelat, yang umumnya disebut karat besi. Proses perusakan pada permukaan logam yang disebabkan oleh reaksi kimia disebut korosi. Korosi logam ada yang berlangsung cepat ada yang berlangsung lambat. Ada logam yang tidak mengalami korosi sama sekali. Hal ini dapat dilihat pada kemampuan bereaksi (kereaktifan) logam tersebut dengan asam.
Daftar deret logam yang mengurutkan kereaktifan logam terhadap asam dinamakan deret Volta. Dalam deret volta, dari kiri ke kanan kereaktifan logam terhadap asam akan berkurang (semakin kecil),
Adanya debu karbon (C), hasil pembakaran batu bara dan kayu berpeluang besar menyebabkan terjadinya korosi. Baja yang merupakan campuran homogen besi – karbon (Fe + C) sangat rentan terhadap terjadinya korosi secara cepat.
Apabila karbon menempel pada besi atau baja besi maka yang terjadi sebagai berikut.
1. Logam besi akan berfungsi sebagai anode/-sebagai anode (–).
2. Karbon akan berfungsi sebagai katode /+ sebagai katode (+).
3. Gas oksigen yang terlarut dalam air akan berfungsi sebagai elektrolit O2 yang terlarut dalam air akan berfungsi sebagai elektrolit.
4. Pada proses korosi besi berlangsung sel elektrokimia seperti pada sel volta
Volta.
Korosi besi pada kondisi netral/basa:
Elektron yang dihasilkan mengalir ke bagian besi lainnya yang bertindak sebagai katode. Oksigen yang larut dalam air, akan tereduksi menjadi OH
-Reaksi yang terjadi:
Anode: Fe(s) → Fe2+(aq) + 2e Eo = + 0,44 volt
____________________________________________________________+
Sel: ½ O2(g) + H2O(l) + Fe(s) → 2 OH-(aq) + Fe2+(aq) EoSel = + 0,841 volt
Ion Fe2+ dan OH- selanjutnya membentuk endapan Fe(OH)
2. Di udara , Fe(OH)2
tidak stabil dan membentuk Fe2O3. xH2O yang disebut dengan karat
Fe(OH)2 (s)
⃗
O2, H2O Fe2O3. x H2O(s)Korosi besi pada kondisi asam
Pada kondisi asam, reaksi yang terjadi pada anode sama dengan pada kondisi netral/basa, yakni reaksi oksidasi Fe menjadi ion Fe2+. Akan tetapi
oksigen tereduksi di katode menjadi H2O.
Anode: Fe(s) → Fe2+(aq) + 2 e Eo = + 0,44 volt
Katode: O2(g) + 4H+(aq) + 4 e → 2 H2O(l) Eo = + 1,23 volt
Terdapat banyak ion H+ maka ada reaksi reduksi lain yang juga berlangsung,
yaitu pembentukan hidrogen.
Katode: 2 H+
(aq) + 2 e → H2 (g)
Pada katode terjadi 2 reaksi menyebabkan logam Fe banyak teroksidasi, maka korosi Fe pada kondisi asam lebih besar
Logam lain yang lebih reaktif akan menempatkan logam tersebut sebagai penyuplai elektron atau bertindak sebagai anode dalam sel elektrokimia korosi. Contoh: logam Mg (Eo = - 2,37 volt) untuk perlindungan logam Fe (Eo =
- 0,44 volt). Mg akan sebagai anode, Fe sebagai katode.
Reaksi yang terjadi:
Anode: Mg(s) → Mg2+(aq) + 2 e
Katode: ½ O2(g) + H2O(l) + 2 e → 2 OH-(aq) (kondisi netral/basa)
b. Menggunakan lapisan pelindung untuk mencegah kontak langsung dengan H2O dan O2
1. Pengecatan: Cat yang mengandung timbale dan Zink akan lebih baik, karena keduanya melindungi besi terhadap korosi.
Pencegahan Korosi:
a. Menggunakan perlindungan katode:
Reaksi korosi di anode: M → Mx++ x e
2. Melumuri dengan oli/gemuk: diterapkan berbagai perkakas dan mesin.
3. Disalut dengan plastik: Plastik mencegah kontak dengan udara dan air.
4. Pelapisan dengan Timah: Lapisan timah hanya melindungi besi selama lapisan utuh, jika rusak maka timah mendorong/mempercepat korosi besi. Hal itu terjadi karena Eo Fe = - 0,44 v dan Eo Sn = - 0,14v, besi
yang dilapisi dengan timah akan membentuk sel elektrokimia dengan besi sebagai anode.
5. Pelapisan dengan Zink:
Zink dapat melindungi besi sekalipun lapisannya tidak utuh. Potensial elektrode besi lebih negatif daripada Zink, maka besi yang kontak dengan zink akan membentuk sel elektrokimia dengan besi sebagai katode, sehingga besi terlindungi dan zink mengalami oksidasi.
6. Pelapisan dengan Krom:
Besi atau baja dapat dilapisi dengan kromium untuk memberi lapisan pelindung yang mengkilap
SEL ELEKTROLISA
KNAP
(Sel yang menggunakan energi listrik untuk suatu perubahan kimia)
Gunanya : - mendapatkan logam murni - memurnikan logam
- menyepuh logam
KATODA ( - ) ANODA ( + )
( mereduksi ion +) ( mengoksidasi ion -)
2H+ + 2e → H
2 * Lihat elektrodanya dulu, bila
non inert
Ion logam selain alkali/alkali tanah (selain Pt , C , Au) Ion logam itu yang tereduksi : elektroda itu yang teroksidasi Ln+ + n e → L
(s)
Ion logam alkali/alkali tanah , sulit * Bila elektrodanya inert (Pt , C , Au)
(Bila ada air, maka air yang tereduksi) lihat ion negatifnya
Logam itulah yang direduksi molekulnya : Ln+ + n e → L
(s) 2Cl - → Cl2 + 2e
Bila anionnya memiliki oksigen, Sulit dioksidasi,air yang teroksidasi :
2 H2O → 4H+ + O2 + 4 e
* Bila anionnya ion OH
4OH- → 2H
2O + O2 + 4e Perhatikan contoh berikut :
Tulislah persamaan reaksi yang terjadi pada elektrolisa berikut :
a. elektrolisis larutan NaCl dengan elektroda C
Jawab:
NaCl(aq) ---H2O→ Na+(aq) + Cl-(aq)
Anoda : 2Cl- → Cl 2 + 2e
Katoda:2H2O+2e→H2+2OH
-_________________ -_________________-____________________
Reaksi sel : 2H2O + 2Cl- → H2 + 2OH- +
Cl2
Contoh reaksi elektrolisis:
b. Elektrolisis larutan HCl dengan elektroda Pt, reaksinya: 2HCl (aq) → 2H+ (aq) + 2Cl  ̄(aq)
Anoda: 2Cl  ̄(aq) → Cl2 (g) + 2e  ̄(Oksidasi) Katoda: 2H+ (aq) + 2e → ̄ H2 (g) (Reduksi)
—————————————————————————————— + R. Total: 2HCl (aq) → H2 (g) + Cl2 (g) (Redoks)
c. Elektrolisis larutan NaOH dengan elektroda Pt, reaksinya: 4NaOH (aq) → 4Na+ (aq) + 4OH  ̄(aq)
A: 4OH  ̄(aq) → 2H2O (l ) + O2 (g) + 4e  ̄ (Oksidasi) K: 4H2O (l ) + 4e →  ̄ 2H2 (g) + 4OH  ̄(aq) (Reduksi)
————————————————————————————————— +
R. Total: 4NaOH (aq) + 2H2O (l ) → 4Na+ (aq) + 4OH  ̄ (aq) + 2H2 (g) + O2 (g)
NaCl (aq)
_
d. Elektrolisa larutan NaCl dengan elektroda Zn
NaCl(aq) ---H2O → Na+ + Cl
Anoda : ...
Katoda : ...
___________________________________ Reaksi sel:
NaCl (aq)
_ e.Elektrolisis lelehan NaCl dengan elektroda C
NaCl(aq) → Na+ + Cl
Anoda: ...
Katoda: ...
___________________________________ Reaksi sel :
NaCl (l)
LATIHAN SOAL
Tuliskan reaksi sel pada elektrolisis senyawa berikut!
1. Elektrolisa larutan kalium nitrat dengan elektroda carbon 2. Elektrolisa barium hidroksida dengan elektroda platina 3. Elektrolisa larutan asam klorida dengan elektroda zeng
4. Elektrolisa lelehan natrium bromida dengan elektroda carbon
5. Elektrolisa larutan perak nitrat dengan katoda perak dan anoda tembaga. 6. Elektrolisa lelehan Al2O3 dengan elektroda grafit
7. Elektrolisa leburan MgCl2 dengan elektroda platina
8. elektrolisa larutan kalium yodida dengan elektroda carbon
9. Rancanglah suatu proses penyepuhan logam besi dengan logam tenbaga. 10. Elektrolisa larutan perak nitrat dengan katoda besi dan anoda perak.
Na+
HUKUM FARADAY
Michael Faraday adalah tokoh yang mengamati hubungan banyaknya arus yang mengalir pada Sel dengan jumlah zat yang dihasilkan
Bunyi Hukum faraday I :
Banyaknya zat yang dihasilkan sebanding dengan jumlah arus yang mengalir
Arus 1F dialirkan akan dihasilkan 1grek zat (grek =gr eqivalen = mol x Ar/pbo) 1 F = 1 mol e = massa e x bil avogadro
= 1,6. 10-19 x 6,02. 1023
= 96500 coulomb satuan arus merupakan perkalian kuat arus dengan waktu
1 mol e = 96500 C C = i x t
1 C =
1
96500
mol
Bila arus sebesar i x t coulomb mengalir dihasilkan:
ixt
96500
mol
e =
ixt
96500
mol
massa = mol x ME gram (ME = massa eqivalen = Ar/PBO)
W =
i x t
96500
x
PBO
Ar
gram1. Berapa gram Ni yang diendapkan pada elektrolisis larutan NiSO4 dengan arus listrik
24 125 C ? Jawab:
2. Bila arus 20 A dialirkan melalui leburan kriolit yang mengandung Al2O3 selama 50
menit, berapa gram Al yang terbentuk dan berapa liter gas O2 yang timbul jika
diukur pada keadaan standar (STP) ? Jawab:
HUKUM FARADAY II digunakan untuk rangkaian seri (lebih dari 1 sel)
Bunyi:
massa yang dihasilkan pada setiap sel sebanding dengan massa eqivalennya
W Ag =
i xt
96500
x
Ar Ag
PBO
; W Ni =96500
i xt
x
Ar Ni
PBO
; W Cr =i x t
96500
x
Ar Cr
PBO
Maka: W Ag : WNi : WCr =
ArAg
pbo
:
Ar Ni
pbo
:
Ar Cr
pbo
ME Ag MENi ME Cr
WAg : W Ni : W Cr = ME Ag : ME Ni :
ME Cr
Contoh Soal:
Jika arus 1 F dialirkan ke dalam tiga larutan, yaitu CuSO4, AuCl3 dan AgNO3, maka
perbandingan massa Cu : Au : Ag sesuai dengan perbandingan massa ekivalennya,
Jawab:
Penerapan sel elektrolisis dalam industri dan lingkungan sekitar kita
1. Logam alkali tanah Magnesium paling banyak diproduksi dengan elektrolisisi lelehan garam kloridanya. Dalam industri , Mg dibuat dari air laut menurut proses Down.Reaksi kimia yang terjadi:
MgCl2(l) → Mg2+(l) + 2Cl-.(l)
Katode /- : Mg2+
(l) + 2 e → Mg.(l)
Anode/+ : 2 Cl
-(l) → Cl2(g) + 2 e
Reaksi Sel: Mg2+
(l) + 2 Cl-(l) → Mg(l) +Cl2(g)
3. Sel terdiri dari anode dan katode karbon. Al2O3 dilarutkan ke dalam lelehan kriolit
Na3AlF6 di mana Al2O3 terionisasi menjadi
Al3+ dan O2- disebut proses Hall – Heroult.
Katode : Al3+
(l) + 3 e → Al(l)
Anode : 2 O
2-(l) → O2(g) + 4 e
________________________________+ Reaksi Sel: 4 Al3+
(l) + 6 O2-(l)→ 4 Al(l) + 3O2(g)
Proses ini anode karbon bereaksi dengan oksigen membentuk CO2. Reaksi
keseluruhan: 4Al3+
(l) + 6O2-(l) + 3C(s) → 4 Al(l) +
3CO2(g)
4. Logam Na dapat diperoleh dari elektrolisis lelehan NaCl.
Proses Down dengan hasil samping gas klor.
Katode: 2Na+
(l) + 2 e → 2 Na(s)
Anode: 2 Cl
-(l) → Cl2(g) + 2 e
_____________________________+ Reaksi Sel: 2 Na+
(l) + 2Cl- (l) → 2Na (l) + Cl2 (g)
Pemisahan produk Na dan Cl2 penting sekali
karena keduanya dapat bereaksi secara 5. Pada proses pemurnian tembaga, tembaga kotor dijadikan anode, katode digunakan tembaga murni. Larutan elektrolit yang digunakan adalah larutan CuSO4. Selama elektrolisis, tembaga dari anode terus menerus dilarutkan kemudian diendapkan pada katode.
CuSO4(aq) → Cu2+ (aq) + SO4
2-(aq)
Katode: Cu2+(aq) + 2e → Cu(s)
Anode: Cu(s) → Cu2+(aq) + 2e
Perak, emas, platina, besi dan seng merupakan pengotor pada tembaga. Perak, platina dan emas mempunyai potensial lebih positif daripada tembaga. Dengan mengatur tegangan selama elektrolisis, ketiga logam itu tidak ikut larut. Ketiga logam tersebut akan terdapat pada lumpur anode. Besi dan seng, mempunyai potensial elektrode lebih negatif daripada tembaga, akan ikut larut. Akan tetapi ion-ionnya (Fe2+ dan Zn2+) lebih sukar diendapkan, tidak
ikut mengendap di katode.
LATIHAN SOAL SEL ELEKTROLISA
1. Gambarkan bagan sel elektrolisa untuk menyepuh besi dengan perak.Bila batang besi seluas 200 cm2 dialiri dengan arus 10 A, berapa lama waktu
yang diperlukan untuk mendapatkan lapisan setebal 0,5cm (massa jenis perak 7,86 g/ml)
2. Perhatikan gambar :
Elektrolisis NiCl2(aq)dengan
elektroda Pt
a. Tulis reaksi pada anoda
b. Jika NiCl2(aq) dielektrolisis dengan arus
sejumlah 8,8F (Ar Ni=59) Hitung pertambahan massa katoda.
3. Pada elektrolisis CuSO4(aq) dihasilkan 25,4 gr endapan Cu pada katoda,
Hitung volume gas H2 pada STP yang dibebaskan pada elektrolisis H2SO4(aq)
encer dengan jumlah arus yang sama. 4. Perhatikan gambar :
pada elektroda 3 terbentuk 336 ml gas Fe C 3 4C(-) a. Pada STP, berapa pertambahan
massa pada elektroda nomor 2 b. volume gas pada elektroda no 4
5. I II
CuSO4 (aq)
H2SO4( aq)
6. Penyepuhan sendok/garpu yang terbuat dari besi (baja) dengan perak. Sendok/garpu digunakan sebagai katode, sedangkan anode adalah perak murni. Larutan elektrolitnya adalah larutan perak nitrat. Pada katode akan terjadi pengendapan perak, sedangkan anode perak terus menerus larut. Konsentrasi ion Ag+ dalam larutan tidak
berubah.
Katode (Fe): Ag+
(aq) + e → Ag(s)
Anode (Ag): Ag(s) → Ag+(aq) +
e
(+) (-)
NiCl2(a
a. Reaksi pada kutub negatif
(-) (+) b. arus masuk 19300 coulomb, katoda
pada sel I massanya bertambah ...gr
c. Berapa buah elektron masuk pada se
d. massa katoda sel II bertambah 4,8 g
Tentukan massa relatif L
(+) (-) ││
6. Pt Pt a. Volume gas yang dihasilkan selama 1 jam
Kutub negatif pada suhu 270C,1
atm dengan Arus 0,5 F
100 ml b. Berapa % H2SO4 selama itu dapat
diubah
menjadi gas hidrogen dikatoda
(+) (-) 7.a. Tulis persamaan reaksi pada setiap elektroda ││ b. Pada elektroda 3 dihasilkan 112 ml gas (STP)
1 2 3 4 berapa mol elektron yang masuk pada selCu Cu C C
c. Hitung volume gas pada elektroda 4
8. Perhatikan gambar :
a. bila arus yang mengalir 0,01 F, tentukan pH larutan di ruang katoda (-) ││ (+)
b. Volume gas klor jika pada PT, 1 mol gas nitrogen bervolume 20 liter.
Pt Pt 500 ml
SOAL PENGAYAAN
1. Tuliskan reaksi elektrolisis dari senyawa berikut:
CuSO4 NaCl (aq) H2SO4
5M
a. larutan NaOH dengan elektrode Pt b. larutan CuSO4 dengan elektrode C
c. larutan NiSO4 dengan elektrode Cu
d. larutan AgNO3 dengan katode Fe dan Anode Ag
e. lelehan MnCl2 dengan elektrode Au
f. lelehan Al2O3 dengan elektrode grafit
2. Pada elektrolisis NiCl2(aq) dengan elektrode Pt, jika NiCl2(aq) dielektrolisis
dengan arus listrik sejumlah 8,8 Faraday (Ni = 59). Hitung massa zat yang terjadi di katode.
3. Gambar bagan sel elektrolisis untuk menyepuh besi dengan perak.Tuliskan reaksi yang terjadi pada masing-masing elektrode. Berapa waktu diperlukan untuk mengendapkan 100 mg perak, jika digunakan arus 1000 Ampere? (Ag = 108)
4. Jika listrik sebanyak 0,4 F dialirkan ke dalam larutan tembaga II sulfat dengan elektrode Pt,tentukan massa tembaga di katode dan volum gas yang terbentuk di anode (STP) Cu = 63,5
5. Satu liter larutan KI dielektrolisis sampai pH = 13, tentukan: a. Berapa faraday arus listrik yang digunakan?
b. Berapa gram yodin yang terbentuk di anode? I = 127 c. Berapa liter gas yang dihasilkan di katode (STP)
6. Hitung massa logam nikel yang mengandung di katode, jika elektrolisis NiSO4(aq) dengan arus 5 F
7. Pada elektrolisis CuSO4(aq) dihasilkan 25,4 gram endapan Cu pada katoda,
Hitung volum gas H2 pada STP yang dibebaskan pada elektrolisis
H2SO4(aq) encer dengan jumlah arus yang sama.
8. Berapa gram Ni yang diendapkan pada elektrolisis NiSO4(aq) jika
digunakan arus listrik 20000 C ?
9. Berapa waktu yang diperlukan untuk elektrolisis AgNO3(aq) menggunakan
arus listrik 0,1A agar diperoleh 0,1gram endapan Ag ?
10.Berapa waktu yang diperlukan untuk elektrolisis 10 mL AgNO3(aq) 0,01 M
menggunakan
arus listrik 0,1 A sampai elektrolisis terhenti karena semua perak telah mengendap ?
11. Jika campuran CuSO4(aq) dan NiSO4(aq) dielektrolisis sehingga dihasilkan 1 gr
endapan,
maka berapa gram Cu dan berapa gr Ni yang telah diendapkan dari larutan tersebut ?
12.CuSO4(aq), AuCl3(aq), AgNO3(aq) yang terpisah masing-masing dielektrolisis
dengan arus
listrik 0,1A dalam waktu yang sama. Jika Cu yang diendapkan sebanyak 0,1 gr, maka
masing-masing berapa gr Au dan Ag yang diendapkan ?
13.masing pasangan reaksi berikut aktivitasnya satu (a = 1). Masing-masing tentukan
dihasilkan !
a. (i). Cu/Cu2+//Ag+/Ag atau (ii). Ag/Ag+//Cu2+ /Cu
b. (i). Cu/Cu2+//Pb2+/Pb atau (ii). Pb/Pb2+//Cu2+/Cu
c. (i). Pb/Pb2+//Ag+/Ag atau (ii). Ag/Ag+//Pb2+/Pb
d. (i). Zn/Zn2+//Ag+/Ag atau (ii). Ag/Ag+//Zn2+/Zn
14. Sel elektrokimia dengan jembatan garam K2SO4 menggunakan elektroda
Fe dalam
larutan FeSO4
dan elektroda Zn dalam larutan ZnSO4.
a. Tentukan manakah elektroda positip dan negatifnya? b. Tuliskan reaksi yang terjadi!
c. Berapakah potensial sel yang dihasilkan?
Soal Pilihan Ganda
1. Pada reaksi redoks :
aCr2O7-2(aq) + 14 H+(aq) + b Fe2+(aq) cCr3+(aq) + 7H2O(l) + d Fe3+(aq)
Nilai a, b, c, dan d berturut-turut dalam reaksi adalah ... A. 1, 4, 2, 4 B. 1, 6, 2, 6 C. 2, 8, 2, 8 D. 2, 8, 4, 8 E. 3, 8, 6, 8
2. Logam Fe (Ar Fe = 56) jika dilarutkan di dalam asam dan direaksikan dengan KMnO4 akan terjadi reaksi sebagai berikut:
Fe2+
(aq)+MnO-4(aq)→Mn2+(aq)+Fe3+(aq) Jika berat Fe yang dilarutkan 11,2
gram, maka volume KMnO4 0,1 M yang dibutuhkan untuk reaksi tersebut
adalah ...
A. 120 ml B. 160 ml C. 250 ml D. 320 ml E. 400 ml
3. Logam Cu dan Zn dimasukkan ke dalam larutan yang mengandung ion- ion Cu2+
dan Zn2+ dengan konsentrasi 1,0 M. Dari data E° Cu2+/Cu = +0,34 Volt dan
E°
Zn2+/Zn = -0,76 Volt, maka akan terjadi reaksi yang menghasilkan ...
A. Cu2+ dan Zn2+ B. Cu2+ dan Zn C. Zn2+ dan Cu
D. Cu2+ dan H
2 E. Zn dan Cu
4. Diketahui potensial reduksi standar unsur halogen sebagai berikut:
F2 + 2e
→
2F- E0 = 2,87 volt Cl2 + 2e→
2Cl- E0 = 1,36 voltBr2 + 2e
→
2Br- E0 = 1,06 volt I2 + 2e→
2I- E0 = 0,54 voltBerdasarkan harga E0, reaksi berikut ini yang tidak berlangsung adalah
A. F2 + NaCl B. Br2 + NaF C. Cl2 + KBr
D. Cl2 + KI E. Br2 + KI
5. Diketahui:
Ag+ + e
→
Ag E0 = +0,80 voltMg2+ + 2e
→
Mg E0 = -2,34 voltFe2+ + 2e
→
Fe E0 = -0,44 volt Dua set setengah sel yang beda potensialnyaterbesar adalah ….
A. Ag/Ag+// Mg2+/Mg B. Zn / Zn2+//Ag+/Ag C.Mg/Mg2+//Fe2+/ Fe
D. Fe / Fe2+ // Ag+/ Ag E. Mg / Mg2+// Ag+/ Ag
6. Dari data: E0 Cu2+/Cu = +0,34 volt
E0 Zn2+/Zn=-0,76 volt Pernyataan yang sesuai dalam keadaan standar....
A. Cu lebih mudah teroksidasi
B. Logam Zn lebih mudah mengendap dari pada logam Cu C. Dalam deret volta logam Zn terletak di sebelah kanan logam Cu
D. Logam Zn lebih mudah larut menjadi ion Zn2+
E. Bagan sel voltanya dapat ditulis dengan Cu/Cu2+//Zn2+/Zn
7. Bila dua buah logam tembaga dan seng dicelupkan ke dalam larutan asam sulfat 1 M, maka
….
A. Zn akan larut menghasilkan gas H2
B. Cu akan larut menghasilkan gas H2
C. Zn dan Cu tidak larut D. Zn dan Cu akan larut
E. Bila kedua logam dihubungkan dengan kawat, Cu akan larut
8. Serbuk Fe dan serbuk Pb dimasukkan ke dalam suatu larutan yang mengandung ion-ion Fe2+
dan Pb2+ dengan konsentrasi masing-masing 1 M. Dari data E0
Fe = -0,44 volt dan E0Pb = -0,13
volt, maka akan terjadi reaksi.... A. yang menghasilkan Fe2+ dan Pb2+
B. yang menghasilkan Fe2+ dan Pb
C. yang menghasilkan Fe dan Pb
D. yang menghasilkan Fe dan Pb2+
E. pengendapan Fe dan Pb
9. Diketahui: Al3+/Al E0 = -1,66 volt
Cu2+/Cu E0 = +0,34 volt Besarnya potensial elektroda yang timbul untuk reaksi: Al + CuSO 4
→
Al2(SO4)3 + Cu adalah ….A. 0,68 volt B. 2,64 volt C. 1,32 volt
D. 4,00 volt E. 2,00 volt
10. Elektrolisis larutan KCl menggunakan elektroda karbon akan menghasilkan A. logam K di katoda D. gas H2 di katoda
B. gas O2 di anoda E. gas Cl2 di katoda
C. larutan basa di anoda
11. Pada reaksi elektrolisis larutan NiSO4 dengan elektroda Ag, reaksi yang terjadi pada anoda
adalah ….
A. Ni2+ + 2e
→
Ni B. Ag→
Ag+ + e C. Ni→
Ni2+ + 2eD. 2H2O + 2e
→
2 OH- + H2 E. 2H2O→
4H+ + O2 + 4e12. Diketahui data potensial elektroda standar Ag+
(aq) + e- Ag(s) E° = +0,80 volt
Zn2+
(aq) + 2e Zn(s) E° = -0,76 volt
In3+
(aq) + 3e- In(s) E° = -0,34 volt
Mn2+
(aq) + 2e- Mn(s) E° = -1,20 volt
Reaksi redoks yang tidak berlangsung spontan adalah ... A. Zn2+
B. 3Mn(s) +2In3+(aq) 2 In(s +3Mn2+(aq) E.2 I3+(aq) + 3Zn(s) 2 In(s) + 3Zn2+ (aq)
C. Mn2+
(aq) + 2 Ag(s) Mn(s) + 2 Ag+(aq)
13. Untuk menetralkan larutan yang terbentuk di Katode pada elektrolisis larutan Na2SO4 diperlukan 50 ml larutan HCl 0,2 M. Jumlah muatan listrik
yang
digunakan adalah ...
A. 0,01 F B. 0,02 F C. 0,05 F D. 0,10 F E. 0,20 F 14. Elektrolisis zat yang menghasilkan gas hydrogen pada anoda ialah
A. NH3 (l) B. KHSO4 (aq) C. Na2SO4(aq)
D. NaH(l) E. HCl(aq)
15. Arus listrik sebesar 10 ampere dialirkan selama 16 menit ke dalam larutan CuSO4 (Ar Cu =
63,5; S = 32; O = 16) dengan elektroda karbon. Massa tembaga yang dapat diendapkan di katoda adalah..
A. 1,58 gr B. 6,32 gr C. 2,39 gr D. 8,23 gr E. 3,16 gr
16. Arus listrik 10 ampere dialirkan ke dalam larutan CuSO4 selama 965 detik. Volume gas yang
dihasilkan di anoda (0 0C, 1 atm) adalah ….(Ar Cu = 63,5; O = 16; S = 32; 1 F = 96500
C/mol)
A. 0,56 liter B. 11,20 liter C. 1,12 liter
D. 22,40 liter E. 6,72 liter
17. Elektrolisis tembaga (II) klorida dengan arus listrik 0,5 F menghasilkan endapan Cu sebanyak …. (Ar Cu = 63,5)
A. 0,1587 gram B. 158,7 gram C. 1,587 gram
D. 1587 gram E. 15,87 gram
18. Larutan Zn(NO3)2 dielektrolisis dengan elektroda Pt dan diperoleh seng 13 gram. Volume
oksigen yang dihasilkan pada anoda (STP) adalah ….
A. 5,6 liter B. 2,24 liter C. 4,48 liter D.1,12liter E. 3,36 liter
19. Larutan NiSO4 dielektrolisis dengan elektroda karbon dan terbentuk endapan Ni sebanyak
1,475 gram (Ar Ni = 59) pada katoda. Volume gas yang dihasilkan di anoda jika diukur pada (P, T) di mana 30 gram gas NO volumenya 20 liter adalah …. (Ar N = 14; O = 16)
A. 75 mL B. 500 mL C. 125 mL D. 1000 mL E. 250 mL
20. Tindakan berikut dapat memperlambat korosi, kecuali …. A. mengecat permukaan logam
B. meminyaki permukaan logam C. melakukan galvanisasi pada logam
D. menghubungkan logam itu dengan logam lain yang sifat reduktornya lebih kuat E. meletakkan logam dalam larutan asam
21. Diketahui potensial elektroda standar (E0) unsure-unsur:
P2+ + 2e
→
P ; E0 = -2,37 volt Q2+ + 2e→
Q ; E0 = -1,66 voltR2+ + 2e
→
R ; E0 = -0,28 volt Fe2+ + 2e→
Fe ; E0 = -0,44 voltS2+ + 2e
→
S ; E0 = -0,13 volt T2+ + 2e→
T ; E0 = +0,34 voltUnsur logam yang memberikan perlindungan katodik paling baik terhadap besi A. P B. S C. Q D. T E. R
A. (96500 x 20) gram D. (96500 x 108 x 20) gram B. (96500 x 108 x 200) gram E. (108/96500) x 20] gram C. (108/96500) x 1200] gram
23. Reaksi yang terjadi di anoda pada reaksi elektrolisis larutan NaCl dengan elektroda
platina adalah ...
A. 2H2O O2 +4H+ + 4e D. Na+ + e Na
B. H2O + 2e H2 + 2 OH- E. 2Cl- Cl2 + 2e
C. Pt Pt2+ + 2e
24. Seorang siswa melakukan percobaan : 1. Paku dimasukkan ke dalam larutan garam 2. Paku dimasukkan ke dalam minyak pelumas
3. Paku dililiti logam tembaga kemudian dimasukkan ke dalam air 4. Paku dililiti logam magnesium kemudian dimasukkan ke dalam air 5. Paku diletakkan sebagai anoda dan tembaga sebagai katoda dimasukkan ke dalam larutan tembaga sulfat kemudian dialiri arus listrik. Dari 5
percobaan yang dilakukan siswa, paku akan terlindungi dari perkaratan yaitu
pada percobaan ... (paku terbuat dari besi)
A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 5
25. Gas Fluorin (Ar = 19) diperoleh dari elektrolisa leburan KHF2 sesuai
dengan
persamaan : 2HF2- 2HF + F2 + 2e Bila pada proses tersebut dialirkan
arus listrik sebesar 10 ampere selama 30 menit, maka volume gas F2
yang
dihasilkan pada STP adalah ...
A. 2,09 liter B. 4,17 liter C. 5,6 liter D. 7,8 liter E. 11,2 liter
26.
A. Al Al3+ + 3e D. Al3+ + 3e Al
B. 2H2O O2 + 4H+ + 4e E. 2H+ +2e H2
C. 2H2O + 2e H2 + OH
-V. Glossary
ISTILAH KETERANGAN
Pada proses elektrolisis larutan Al2(SO4)3 seperti
Sel Volta Sel yang menghasilkan energi listrik dariperubahan kimia/reaksi kimia Sel Elektrolisis Sel yang menggunakan energi listrik untuk suatuperubahan kimia Katoda Terjadi reaksi reduksi
Anoda Terjadi reaksi oksidasi Potensial
Elektroda
suatu ukuran untuk menyatakan mudah tidaknya suatu zat/ unsur mengalami reduksi
Korosi Proses perusakan pada permukaan logam yang disebabkan oleh reaksi kimia
Michael Faraday tokoh yang mengamati hubungan banyaknya arus yang mengalir pada Sel dengan jumlah zat yang dihasilkan
VI. DAFTAR PUSTAKA
1. Petrucci, R.H.alih bahasa Suminar Achmadi(1999) Kimia dasar, prinsip dan Terapan Modrn. Edisi keempat. Jilid 2.
Jakarta:Erlangga
2. Achmad, H., Penuntun Belajar Kimia TPB II; Elektro Kimia, Departemen Kimia FMIPA – ITB, Bandung, 1982
3. Brady, J.E., General Chemistry : Principles and Structure, 5th edition, John Wiley and Sons, New York, 1990
4. Internet (www.e-dukasi.com), ( www.chem-is-try.net ), (www.google.co.id), dll
5. Forum Pendidikan Telkom, Internet (www.plasa.com/ksi), (www.brawijaya.ac.id
Pada kegiatan ini akan dipelajari perubahan-perubahan yang terjadi pada elektrolisa larutan garam Natrium Sulfat dan Kalium Iodida 1. Alat dan Bahan:
a. Pipa U
b. Elektroda karbon c. Batu baterei dan kabel d. Standart dan klem e. Gelas ukur
f. Pipet tetes
g. Larutan Na2SO4 0,5 M
h. Larutan KI 0,5 M
i. Kertas lakmus merah dan biru
j. Indikator penolptalein, amilum dan universal 2. Langkah Kerja:
a. Elektrolisa larutan Na2SO4
1. Isi pipa U atau alat elektrolisis dengan 80 ml larutan Na2SO4 0,5
M yang telah ditambahkan 5 tetes indikator universil, sampai ¾ tinggi tabung. Masukkan setiap elektroda ke dalam pipa U/alat elektrolisis sehingga tercelup dan sambungkan kedua elektroda dengan baterei. Tentukan katode dan anodenya.
2. Biarkan reaksi elektrolisa berlangsung selama 5 menit, catat setiap perubahan yang terjadi. Setelah itu angkat kedua elektroda tersebut.
3. Ambil setiap larutan di katode dan anode dan masing-masing kedalam 2 buah tabung reaksi kira-kira sebanyak 2 mL dan beri label larutan dari Katoda K1 serta larutan dari Anoda A1 . Selanjutnya Larutan di katode dan anode tambahkan 2 tetes indikator penolptalein. Catat perubahan warna yang terjadi. b. Elektrolisa larutan KI
1. Isi pipa U atau alat elektrolisis dengan 80 ml larutan KI 0,5 M sampai ¾ tinggi tabung. Kemudian lakukan elektrolisa selama 10 menit.
2. Ambil larutan di katode sebanyak 2 ml kemudian tambahkan 1 tetes indikator phenolftalen, sedangkan 2 ml larutan di anode tambahkan indikator amilum. Catat perubahan yang terjadi. 3. Pertanyaan:
2. Zat apakah yang terjadi di anode dan katode sebagai hasil elektrolisa
Sumber arus sumber arus
││ ││
Anoda : .. ... Anoda : .. ...
Katoda : ... Katoda : ... ...
Reaksi Sel: ... ... Reaksi Sel:...
(- ) sumber arus (+)
a. Elektroda mana yang menghasilkan gas ? b. Elektroda mana yang massanya bertambah ?
c. Elektroda mana yang massanya berkurang ?
Na+
SO42- Zn2+
SO42-u
Ag2SO4(
aq) (aq)H2SO4
NaCl(l)
-C + +Ag
-C Ag
PRAKTIKUM - REAKSI REDOKS Cara Kerja:
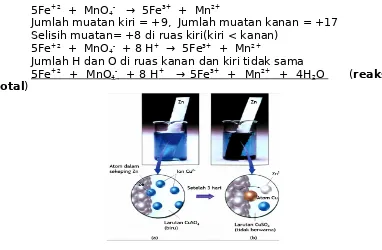
A. Masukkan logam Zn, serbuk Fe sebanyak ½ spatula ke dalam 2 buah tabung reaksi yang kering dan bersih. Masing-masing tambahkan 10 mL larutan CuSO4 0,1M, kocok tabung 3 menit.
Amati dan catat perubahan yang terjadi ! 1. Tuliskan persamaan reaksi dari percobaan! 2. Identifikasi mana oksidator - reduktornya ! 3. Buatlah kesimpulan dari percobaan dan Informasikan hasilnya pada kelompok
B. Masukkan serbuk Fe, serbuk Cu sebanyak ½ spatula ke dalam 2 buah tabung reaksi yang kering dan bersih. Masing-masing tambahkan 10 mL larutan ZnSO4 0,1M, kocok tabung 3 menit.
C. Masukkan serbuk Fe sebanyak 1/2 sendok spatula, satu logam Zn, serbuk Cu sebanyak 1/2 sendok spatula secukupnya ke dalam 3 buah tabung reaksi yang kering dan bersih. Masing-masing tambahkan 10 mL larutan NiSO4 0,1M, kocok tabung 3 menit.
D. Masukkan logam Cu, sebanyak ½ spatula ke dalam 1 buah tabung reaksi yang
kering dan bersih. Masing-masing tambahkan 10 mL larutan AgNO3 0,1M, kocok
E. Dengan menggunakan pinset, ambil logam Na yang telah tersedia, simpan di atas kaca arloji, lalu masukkan ke dalam gelas kimia 250 mL yang berisi 100 mL air. Tambahkan 2 tetes larutan fenolftalein. Amati dan catat perubahan yang terjadi! Ulangi percobaan tersebut dengan menggunakan larutan HCl 0,1 M 100 mL sebagai pengganti air. Perhatian : Hati-hati Na jangan sampai terkena kulit.
1. Setarakan persamaan reaksi dari percobaan ini ! 2. Identifikasi mana oksidator - reduktornya !
3. Buatlah kesimpulan dari percobaan ini ! 4. Informasikan hasilnya pada kelompok
F. Masukkan 5 mL etanol 70 % ke dalam cawan porselin, lalu di bakar. Periksa gas CO2 yang terjadi dengan menggunakan
pengaduk yang telah dicelupkan ke dalam larutan Ca(OH)2. Amati
dan catat perubahan yang terjadi !
1. Setarakan persamaan reaksi dari percobaan yang dilakukan ! 2. Identifikasi mana oksidator dan reduktornya !
3. Buatlah kesimpulan dari percobaan ini ! 4.Informasikan hasilnya pada kelompok
G. Masukkan 1 spatula Ca(OCl)2 ke dalam gelas kimia 100 mL yang
berisi 50 mL air emudian di aduk, lalu teteskan beberapa tetes larutan HCl 0,1 M. Amati dan catat apa yang terjadi !
3. Buatlah kesimpulan dari percobaan ini ! 4. Informasikan hasilnya pada kelompok
H. Masukkan 1 spatula (NH4)2Cr2O7 ke dalam cawan porselin kemudian
panaskan di
atas pembakar. Periksa uap yang terjadi dengan kertas lakmus merah yang sudah
dibasahi air dan dengan bara lidi ! Perhatian : Gunakan api kecil. 1. Tuliskan persamaan reaksi dari percobaan
2. Identifikasi mana oksidator - reduktornya ! 3. Buatlah kesimpulan dari percobaan ini ! 4. Informasikan hasilnya pada kelompok
I. Masukkan serbuk KClO3 sebanyak 2 spatula ke dalam tabung berpipa
samping, tambahkan 1/8 spatula MnO2, tutup mulut tabung dengan
sumbat gabus. Panaskan tabung tersebut hingga KClO3 dalam
tabung meleleh. Dekatkan lidi yang membara pada mulut tabung, amati dan catat perubahan yang terjadi !
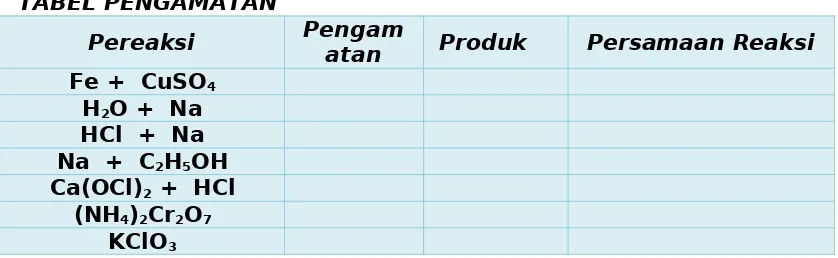
TABEL PENGAMATAN
Pereaksi Pengamatan Produk Persamaan Reaksi
Fe + CuSO4
H2O + Na
HCl + Na Na + C2H5OH
Ca(OCl)2 + HCl
(NH4)2Cr2O7
PRAKTIKUM - SEL VOLTA 1. Tujuan Percobaan:
Mengukur beda potensial larutan dalam sel volta 2. Alat dan Bahan:
Gelas kimia, Ampermeter, Jembatan garam, kabel, jepit buaya Logam Cu, Zn, Fe, Mg, larutan CuSO4 1 M, larutan ZnSO4 1 M,
larutan FeSO4 1 M, larutan MgSO4 1 M
3. Cara Kerja:
1. Masukkan 10 ml larutan ZnSO4 1 M ke dalam suatu gelas kimia
dan celupkan sepotong logam seng dalam gelas tersebut.
2. Masukkan 10 ml larutan CuSO4 1 M ke dalam suatu gelas kimia
dan celupkan sepotong logam tembaga dalam gelas tersebut 3. hubungkan kedua larutan tersebut dengan jembatan garam
4. Rakitlah rangkaian sel volta seperti gambar diatas dengan menghubungkan kedua lempeng logam melalui ampermeter 5. Kemudian amati potensial sel yang terjadi pada ampermeter
apakah jarum menunjukkan arah positif atau negatif, catatlah hasil harga potensial yang kalian peroleh sebagai data pengamatan
6. Larutan dan elektrode diganti-gati seperti pada data hasil pengamatan.
4. Data Hasil Pengamatan: N
o
Katod e
Laruta
n Anode
Laruta n
Potensial Sel 1. Cu CuSO4 Zn ZnSO4 ...
2. Zn ZnSO4 Cu CuSO4 ...
3. Fe FeSO4 Cu CuSO4 ...
4. Cu CuSO4 Fe FeSO4 ...
5. Zn ZnSO4 Fe FeSO4 ...
6. Fe FeSO4 Zn ZnSO4 ...
7. Mg MgSO4 Fe FeSO4 ...
8. Fe FeSO4 Mg MgSO4 ...
9. Zn ZnSO4 Mg MgSO4 ...
10
5. Pertanyaan:
1. Tulislah semua persamaan reaksi sel dari semua hasil pengamatan 2. Bandingkan data hasil hitungan tersebut dengan potensial sel menurut data.
PRAKTIKUM TITRASI YODOMETRI
Tujuan: menentukan kadar oksidator/reduktor dalam larutan Dasar Teori:
Seperti halnya penentuan kadar asam/basa dalam larutan, kadar suatu