I. JUDUL PRAKTIKUM : Voltametri
II. TANGGAL PRAKTIKUM : Rabu, 15 Mei 2013 dan Rabu, 22 Mei 2013
III. TUJUAN :
1. Membuat elektroda kerja sendiri (elektroda amalgam Cu-Hg, elektroda pasta carbon, elektroda Cu)
2. Menentukan keefektifan dari elektroda secara voltametri differential pulse
IV. KAJIAN PUSTAKA:
Voltametri adalah suatu elektrolisis dimana arus direkam sebagai suatu fungsi potensial elektroda kerja. Voltametri merupakan elektrolisis dalam ukuran mikroskala dengan menggunakan mikro elektroda kerja, disebut juga teknik arus voltase. Potensial dari mikro elektroda kerja divariasikan dan arus yang dihasilkan dicetak sebagai fungsi dari potensial. Hasil cetakan ini disebut voltamograf. Voltametri berkembang pesat dibanding metode analisis lain, hal ini dikarenakan kelebihan dalam sensitifitas, selektifitas, kesederhanaan dan kemudahan penganalisisan. Pesatnya perkembangan voltametri setelah penemuan polarografi oleh Jaroslav Heyrovsky pada tahun 1920.
Voltametri didasarkan pengukuran arus sebagai fungsi dari potensial aplikasi (applied potential) pada saat terjadi polarisasi pada indicator elektroda atau elektroda kerja. Voltametri mempelajari hubungan voltase arus-waktu selama elektrolisis dilakukan dalam suatu sel, di mana suatu elektroda mempunyai luas permukaan yang relative besar, dan elektroda yang lain (elektroda kerja) mempunyai luas permukaan yang sangat kecil dan seringkali dirujuk sebagai mikroelektroda: lazimnya teknik ini mencakup pengkajian pengaruh perubahan voltase pada arus yang mengalir di dalam sel. Mikroelektroda ini biasanya dibuat dari bahan tak reaktif yang menghantar listrik seperti emas, platinum atau karbon, dan dalam beberapa keadaan dapat digunakan suatu elektroda merkurium tetes (D.M.E); untuk kasus istimewa ini teknik itu dirujuk sebagai polarografi. Voltametri merupakan metoda elektrokimia yang mengamati perubahan arus dan potensial. Potensial divariasikan secara sistematis sehingga zat
kimia tersebut, mengalami oksidasi dan reduksi dipermukaan elektroda. Dalam voltametri, salah satu elektroda pada sel elektrolitnya terpolarisasi. Penelahan pada sistem tersebut diikuti dengan kurva arus tegangan. Metode ini umum digunakan untuk menentukan komposisi dan analisis kuantitatif larutan.
Dalam sistem voltametri ada yang disebut dengan siklik voltametri. Voltametri ini merupakan tehnik voltametri dimana arus diukur selama penyapuan potensial dari potensial awal ke potensial akhir dan kembali lagi potensial awal atau disebut juga penyapuan (scanning) dapat dibalik kembali setelah reduksi berlangsung. Dengan demikian arus katodik maupun anodik dapat terukur. Arus katodik adalah arus yang digunakan pada saat penyapuan dari arus yang paling besar menuju arus yang paling kecil dan arus anodik adalah sebaliknya.
Sel voltametri, terdiri dari 3 elektroda yaitu elektroda pembanding, elektroda kerja, dan elektroda pembantu. Elektroda kerja pada voltametri tidak bereaksi, akan tetapi merespon elektroda aktif apa saja yang ada dalam sampel. Pemilihan elektroda bergantung pada besarnya range potensial yang diinginkan untuk menguji sampel. Adapun jenis dan teknik yang termasuk kedalam voltametri adalah sebagai berikut:
a). Polarografi
Polarografi adalah suatu bentuk elektrolisis dalam mana elektroda kerja berupa suatu elektroda merkuri tetes, dan direkam suatu kurva arus voltase (voltammogram). Polarogarfi digunakan secara luas untuk analisis ion –ion logam dan anion –anion anorganik, seperti IO dan NO . Gugus fungsi senyawa organik yang mudah teroksidasi atau tereduksi juga dipelajari dalam polarogarfi. Gugus fungsi yang digunakan meliputi karbonil, asam karboksilat, dan senyawa karbon yang memiliki ikatan rangkap.
b). Hydrodynamic Voltametri
Hydrodynamic voltametri bermanfaat untuk analisis reduksi atau oksidasi pada potensial yang lebih positif karena hydrodynamic voltametri tidak dibatasi untuk elektroda Hg. Arus pada hydrodynamic voltametri diukur sebagai fungsi dari aplikasi potensial pada elektroda kerja.
c). Stripping Voltametri
Stripping Voltametri terdiri atas tiga teknik yaitu : anoda, katoda, dan adsorpsi stripping voltametri. Anodic stripping voltametri terdiri dari dua tahap Pertama pengontrolan potensial elektrolisis yang mana elektroda kerja, biasanya tetes merkuri atau lapis tipis merkuri, pada potensial katoda yang cukup untuk melapisi ion logam pada elektroda. Tahap kedua, potensial anoda di scan kearah potensial yang lebih positif. Ketika potensial pada elektroda kerja cukup positif analit dilepaskan dari elektroda, larutan dikembalikan dalam bentuk oksidasi. Arus selama tahap stripping dimonitor sebagai fungsi dari potensial, memberikan bentuk kenaikan pada puncak voltammogram yang sama Puncak arus yang proporsional pada konsentrasi analit dalam larutan. Anodic stripping voltametri sangat sensitif pada percobaan, yang mana harus dikontrol dengan hati–hati jika hasilnya ingin akurat dan tepat.
d). Amperometri
Amperometri merupakan salah satu teknik voltametri yang mana potensial konstan diaplikasikan pada elektroda kerja, dan arus diukur sebagai fungsi waktu Karena potensial tidak discan, amperometri tidak mendorong kearah voltammogram.
Potensial yang diterapkan pada elektroda dalam teknik voltametri ini bisa bermacam-macam, yang menghasilkan beberapa varian teknik voltametri diantaranya adalah : LSV (linear sweep voltammetry), CV (cyclic voltammetry), DPV (differensian pulse voltammetry) dan SWV (square wave voltammetry).
1. LSV (linear sweep voltammetry)
Linear sweep voltammetry adalah istilah umum untuk suatu teknik voltametri dimana potensial yang diberikan pada elektroda kerja dengan variasi waktu linier. Metode ini juga mencakup polarography, siklik voltametri rotating disc
voltametri. Slope yang dihasilkan dari metode ini memiliki unit potensial (volt) per satuan waktu, dan biasanya disebut scan rate percobaan. Voltammogram dari LSV yaitu :
Nilai dari scan rate percobaan dapat divariasi dari tingkat rendah mV/sec (khusus untuk polarography) sampai tingkat tinggi 1.000.000 V/sec (tercapai bila digunakan ultra mikroelektrode sebagai electrode kerja). Dengan jalur linier potensial, arus Faraday ditemukan untuk menaikkan scan rates yang lebih tinggi. 2. CV (cyclic voltammetry)
Cyclic voltammetry adalah yang paling umum digunakan dalam teknik elektrokimia, dan berdasarkan pada kelinieran potensial dari kurva. Sehingga perubahan potensial sebagai fungsi linier dari waktu. Tingkat perubahan potensial dengan waktu mengarah pada scan rate. Voltamogram dari CV yaitu :
Differensian pulse voltammetry diperoleh dengan menambahkan secara periodic pulse potensial (meningkatkan potensial sementara) untuk menjalankan voltase yang digunakan pada LSV. Arus diukur hanya khusus untuk pulse dan diakhiri pada penerapan pulse. Perbedaan antara kedua arus diplotkan sebagai fungsi jalur potensial pada LSV. Voltammogram dari DPV yaitu :
4. SWV (square wave voltammetry)
Square wave voltammetry dan differential pulse voltammetry keduanya digunakan untuk analisis kualitatif dan kuantitatif. Metode ini mengambil keuntungan dari timing sampel ke computer berulang kali pada dua titik relative terhadap waktu penerapan tegangan square wave untuk electroda. Perbedaan antara dua nilai arus diplotkan sebagai fungsi dari aplikasi potensial DC. Hasil yang diperoleh adalah puncak dari voltammetryc wave , sesuai dengan aktivitas elektro dari spesies pada sel elektrokimia. Voltamogram dari SWV yaitu :
V. ALAT DAN BAHAN: Tabel 1.Alat
No Nama alat Jumlah
1 Kawat tembaga 12 cm 3 buah
2 Gelas kimia 100 mL 2 buah
3 Labu ukur 100 mL 1 buah
4 Rol film 5 buah
5 Pipet ukur 10 mL 1 buah
6 Kain beludru 1 lembar
7 Cutter 1 buah
8 Instrumen voltametri 1 unit
9 Penjepit buaya 1 buah
Tabel 2. Bahan No Nama bahan 1 Larutan K4Fe (CN)6 0,01 M 2 Larutan HgNO3 3 Karbon aktif 4 Parafin 5 Aquades
VII. ANALISIS DAN PEMBAHASAN: Elektroda amalgam Cu-Hg
Dipotong sepanjang 15 cm
Selubung kawat tembaga di kelupas 2mm pangkal yang di potong di amplas hingga ujungnya rata
Digosok dengan kain bludru di celupkan dalam larutan Hg pekat Kawat tembaga
Elektroda tembaga
Dipotong sepanjang 15 cm
pangkal yang di potong di amplas hingga ujungnya rata dengan selubung dari kawat tembaga
digosokkan pada kain bludru Kawat tembaga
Dipotong sepanjang 15 cm
pangkal yang di potong di amplas hingga ujungnya rata dengan selubung dari kawat tembaga
digosokkan pada kain bludru
ujung kawat yang sudah rata dengan selubungnya ditaruk kedalam selubung sedalam 2mm
pasta carbon(carbon: parafin= 2:1)
dimasukkan kedalam ruang yang terdapat didalam selubung hingga padat
direndam dalam aquades Kawat tembaga
Elektroda pasta carbon Elektroda yang telah di buat
Data hasil uji voltametri
Dipasang pada instrument voltametri Diukur voltase menggunakan uji DP dan CV
Percobaan kali ini bertujuan untuk membuat elektroda kerja dengan sendirinya dan mampu menentukan keefektifan dari masing-masing elektroda tersebut.
Untuk pembuatan elektroda sendiri dibagi menjadi 3 yaitu pembuatan elektroda Cu-Hg, pembuatan elektroda Cu, dan pembuatan elektroda pasta carbon. Untuk cara pembuatan elektroda Cu-Hg, elektrodaCu dan elektroda pasta carbon adalah sebagai berikut: Kawat tembaga dipotong sepanjang 15 cm. untuk salah satu ujungnya dikelupas semua sepanjang 2 cm untuk dihubungkan dengan alat voltametri dengan penjepit buaya. Untuk salah satu ujungnya yang lain tidak perlu dikelupas karena untuk masing-masing elektroda memiliki perlakuan yang berbeda-beda.
1. Untuk elektroda Cu-Hg ujung yang tidak dihubungkan dengan alat voltametrinya diamplas hingga permukaanya rata. Setelah itu pelindung kawat tembaganya dikelupas sepanjang 2 mm Kemudian diamplas dan digosokkan kekain bludru. Lalu dicelupkan kedalam larutan Hg yang jenuh. Larutan Hg jenuh ini dibuat dengan melarutkan Hg padat secukupnya dalam air. Dimana dalam larutan Hg jenuh ini sendiri terjadi kesetimbangan antara fasa cair dan fasa padatan. Setelah di celupkan kedalam larutan Hg jenuh ini kawat tembaga yang sebelumnya berwarna merah kekuningan berubah menjadi putih(silver) mengkilap. Hal ini terbentuknya amalgam dari Cu-Hg. Elektroda ini merupakan elektroda yang lebih ramah lingkungan daripada metode tetes Hg(polarografi) karena lebih menghemat pembuangan Hg yang tidak ramah lingkungan. 2. Untuk elektroda Cu ujung yang tidak disambungkan ke alat voltametri
cukup diamplas hingga rata kemudian digosokkan pada kain bludru untuk menghilangkan sisa-sisa serbik hasil amplasan Cu tadi.
3. Untuk elektroda pasta carbon juga sama dengan cara di atas yaitu ujung yang tidak disambungkan ke alat voltametri cukup diamplas hingga rata
kemudian digosokkan pada kain bludru untuk menghilangkan sisa-sisa serbik hasil amplasan Cu tadi. Kemudian kawat tembaga yang telah di amplas tadi sedikit dimasukkan sedalam 2mm kedalam pelindungnya sehingga ada sedikit ruang untuk meletakkan pasta carbon. Pasta carbonnya sendiri dibuat dengan cara mencampurkan carbon aktif dengan minyak parafin dengan perbandingan 2:1.
Fungsi dari minyak paraffin ini sendiri adalah sebagai perekat agar carbon aktif tidak berhamburan ke larutan yang akan di analisis. Carbon aktif digunakan karena carbon aktif memiliki sifat mengadsorbsi sehingga mampu mengikat zat yang akan di analisis.
Dari ketiga elektroda tersebut kemudian disambungkan ke alat voltametri dan diujikan kedalam larutan K4Fe(CN)6 dengan variasi konsentrasi 0,5 ppm; 1ppm; 2,5ppm; 5ppm; 10ppm.
. Dari analisis akan diperolek grafik sebagai berikut:
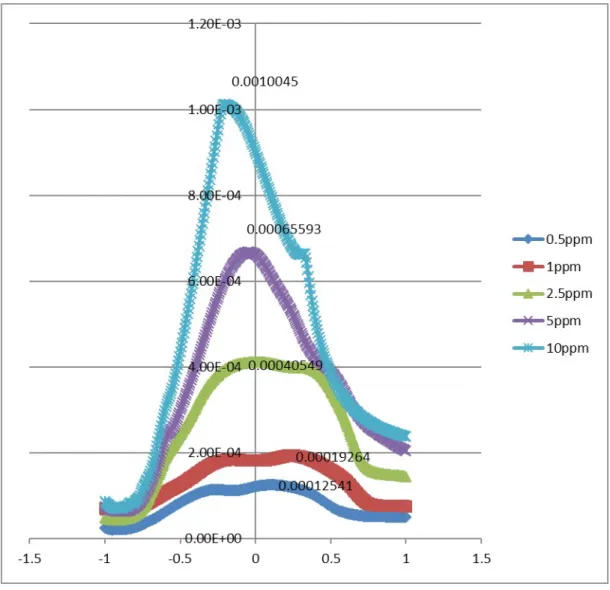
Dari grafik tersebut dapat terlihat bahwa dengan elektroda Cu-Hg pada rentang potensial -1 volt hingga 1 volt, semakin besar konsentrasi K4Fe(CN)6 semakin
besar pula arus yang diberikanhal ini dapat telihat dengan semakin tingginya puncak seiring dengan meningkatnya konsentrasi larutan.
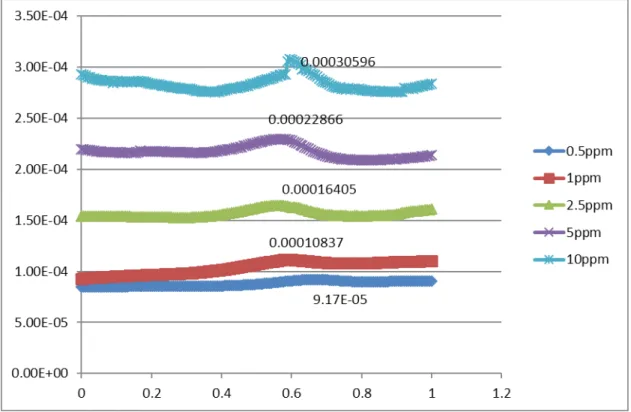
Dari grafik tersebut dapat terlihat bahwa dengan elektroda pasta carbon pada rentang potensial 0 volt hingga 1 volt, semakin besar konsentrasi K4Fe(CN)6 semakin besar pula arus yang diberikanhal ini dapat telihat dengan semakin tingginya puncak seiring dengan meningkatnya konsentrasi larutan.
Dari grafik tersebut dapat terlihat bahwa dengan elektroda Cu pada rentang potensial 0 volt hingga 1 volt, arus yang dihasilkan tidak konsisten. Hal ini dapat dilihat dari grafik bahwa pada konsentrasi 0,5 ppm;1ppm; dan 2,5ppm puncak grafik semakin tinggi dengan meningkatnya konsentrasi. Namun, pada konsentrasi 5 ppm dan 10 ppm terjadi penurunan puncak arus. Bahkan pada konsentrasi 5 ppm dan 10 ppm puncaknya lebih rendah daripada puncak pada konsentrasi 0,5 ppm. Hal ini kemungkinan disebabkan oleh beberapa hal, diantaranya:
1. Pada saat pengamplasan permukaan elektrodanya tidak rata atupun hasil amplasnya miring sehingga permukaan yang kontak dengan larutan .
2. Larutan yang 5ppm dan 10 ppm digunakan telah mengalami oksidasi dan karena penyimpanan yang terlalu lama.
Untuk menentukan keefektifan elektroda yang telah dibuat dapat ditentukan dengan cara membuat kurva atau grafik antara konsentrasi dengan arus tertinggi yang
di hasilkan pada saat analisis. Elektroda yang mampu menghantarkan arus paling besar pada setiap konsentrasilah yang memiliki keefektifan paling besar. Jika di lihat dari grafik elektroda amalagam Cu-Hg maka di dapat puncak kuat arus pada setiap konsentrasi sebagai berikut:
Jika di lihat dari grafik elektroda pasta carbon maka di dapat puncak kuat arus pada setiap konsentrasi sebagai berikut:
Konsentrasi (ppm) Voltase 0.5 9.17E-05 1 0.000108 2.5 0.000164 5 0.000229 10 0.000306
Jika di lihat dari grafik elektroda pasta carbon maka di dapat puncak kuat arus pada setiap konsentrasi sebagai berikut:
Konsentrasi (ppm) Voltase 0.5 2.38E-06 1 4.52E-06 2.5 6.06E-06 5 2.14E-06 Konsentrasi (ppm) Voltase 0.5 0.000125 1 0.000193 2.5 0.000405 5 0.000656 10 0.001005
10 2.02E-06
sehingga jika dari table tersebut digambarkan dalam bentuk grafik akan menghasilkan kurva seperti berikut:
dapat disimpulkan bahwa elektroda Cu-Hg memiliki keefektifan paling besar karena pada setiap konsentrasi, elektroda amalgam Cu-Hg mampu menghasilkan arus yang paling besar diantara elektroda lainnya(elektroda pasta carbon dan elektroda Cu).
VIII. KESIMPULAN:
Berdasarkan pembahasan, maka dapat disimpulkan bahwa:
IX. DAFTAR PUSTAKA:
Coolkhas-chemistry., 2009. Voltametri, http://coolkhas-chemistry.blogspot.comDiakses pada 15 Mei 2013
Febliza, Asyiti.S.Pd, M.Pd.2011.Metode Amperometri(Voltametri) dalam analisis.Unic of Chemistry.Diakses pada 15 Mei 2013.
Khopkar,S.M., 1990. Konsep Dasar Kimia Analitik, Jakarta : UI-Press.
X. LAMPIRAN: a. Lampiran foto
Gambar 1. Kristal HgNO3, karbon aktif dan parafin
Gambar 2. Karbon aktif Gambar 3. Larutan K4Fe(CN)6
b. Lampiran grafik
Grafik Voltase Elektroda Cu-Amalgam
Gambar 5. Perendaman elektroda pasta carbon