26
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian yang digunakan dalam penelitian ini adalah deskriptif. Penelitian deskriptif adalah metode penelitian yang bertujuan untuk membuat gambaran secara sistematis, faktual dan akurat mengenai fakta, sifat serta hubungan antar fenomena yang diselidiki, sehingga metode ini berkehendak untuk mengadakan akumulasi data dasar semata (Nazir, 1988).
B. Objek Penelitian
Objek Penelitian yang digunakan merupakan potongan DNA ikan gurame (Osphronemus gouramy Lac.) hasil hibridisasi yang kaya akan motif mikrosatelit, hasil dari penelitian Kusumawaty et al (2005).
C. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Pendidikan
Biologi, Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam. Universitas Pendidikan Indonesia.
D. Cara Kerja
Penelitian diawali dengan perbanyakan DNA elusi motif mikrosatelit dengan metode “PCR” dari DNA sisik gurame yang telah dipotong oleh enzim restriksi rsaI dan telah dipasang adapter dari penelitian sebelumnya (Kusumawaty
27
et.al., 2005) yang dapat dilihat pada Gambar 3.2 pada alur penelitian 1.5-1.6. Setelah itu dilanjutkan proses ligasi (1.6), proses penyisipan sel kompeten E. Coli dh5 alpha (1.7), transformasi (1.8), isolasi plasmid (1.9), sikuensing (1.10) hingga perancangan primer.(1.11).
1. Polymerase Chain Reaction
PCR (polymerase chain reaction) adalah metode perbanyakan DNA yang bersifat spesifik secara in vitro. Program PCR terdiri dari tahap jumlah sikus,volume reaksi suhu dan waktu untuk setiap siklus sesuai keperluan. Amplifikasi DNA menggunakan PCR terdiri dari tahapan denaturasi awal, denaturasi, penempelan primer (annealling), pemanjangan primer (elongation) dan pemanjangan akhir. Suhu annealling bergantung pada Tm (suhu leleh) primer
yang digunakan biasanya suhu annealing adalah Tm(suhu leleh)-50C. Komposisi PCR
untuk memperbanyak DNA hasil elusi dapat dilihat pada Tabel 3.1.
Tabel 3.1.Komposisi reaksi PCR untuk memperbanyak potongan DNA hasil elusi
Pereaksi Volume reaksi
50µL 25µL DNA elusi 10µL 5µL Primer 21mer 3µL 1,5µL MgCl2(25mM) 2µL 1µL Taq polymerase (2 unit) 2µL 1µL DNTPs (200µM) 0,4µL 0,2µL Buffer PCR 10X 5 µL 2,5µL Deion Water 27,6 µL 13,8 µL Total Reaksi 50µL 25µL
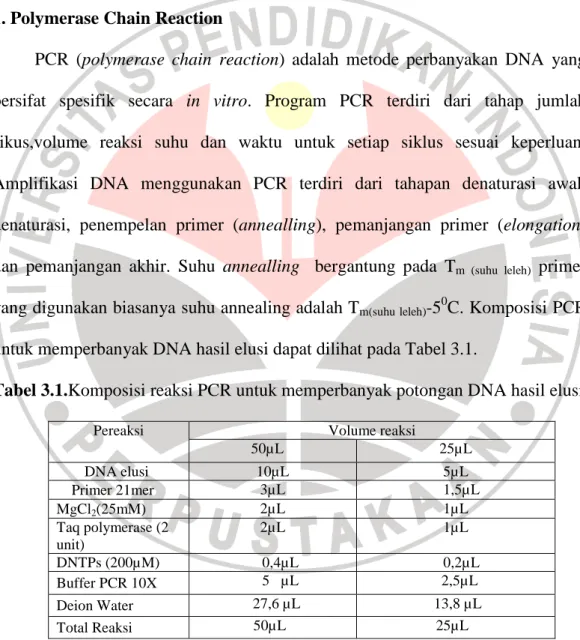
Setelah mengatur program, mesin PCR dijalankan dan proses amplifikasi ditunggu hingga selesai. Gambar 3.1 berikut adalah program PCR secara umum
28
Gambar 3.1. Program PCR secara umum
Keterangan : Denaturasi awal pada 940C selama 5 menit; 2. Denaturasi pada 940C selama 40 detik; 3. Penempelan primer pada 600C selama 60 detik; 4. Pemanjangan primer pada 750C selama 2 menit; 5. Pemanjangan akhir pada 720C selama 5menit; 6. Penyimpanan 40C secukupmya.
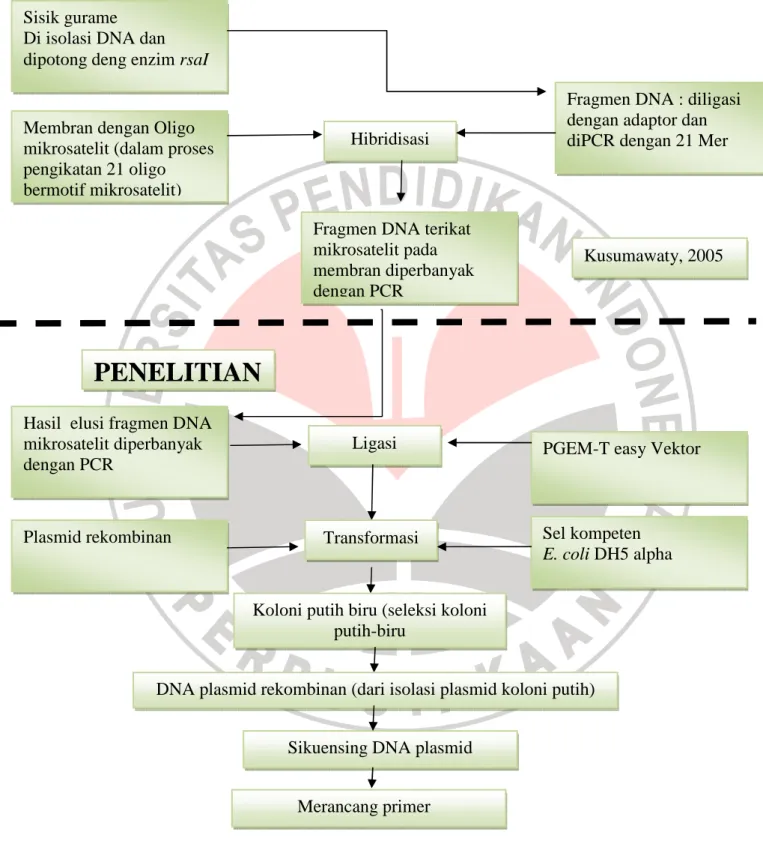
Berikut adalah bagan kerja penelitian (Gambar 3.2), penelitian lanjutan ini dimulai dari alur kerja amplifikasi DNA motif mikrosatelit yang telah dihibridisasi hingga proses perancangan primer yang diberi tanda garis putus-putus.
29
Gambar 3.2 Bagan kerja pencarian motif mikrosatelit
Sisik gurame Di isolasi DNA dan dipotong deng enzim rsaI
Fragmen DNA : diligasi dengan adaptor dan diPCR dengan 21 Mer Membran dengan Oligo
mikrosatelit (dalam proses pengikatan 21 oligo bermotif mikrosatelit)
Hibridisasi
Fragmen DNA terikat mikrosatelit pada membran diperbanyak dengan PCR
Kusumawaty, 2005
PENELITIAN
PGEM-T easy Vektor Hasil elusi fragmen DNA
mikrosatelit diperbanyak dengan PCR
Ligasi
Transformasi
Plasmid rekombinan Sel kompeten
E. coli DH5 alpha
Koloni putih biru (seleksi koloni putih-biru
DNA plasmid rekombinan (dari isolasi plasmid koloni putih)
Sikuensing DNA plasmid
30
2. Elektroforesis
Elektroforesis adalah teknik pemisahan molekul tersuspensi berdasarkan kemampuan migrasi yang dipengaruhi oleh medan listrik (Snustad & Simmons, 2003). DNA dapat dipisahkan menggunakan elektoforesis gel agarosa atau gel poliakrilamida. Serbuk agarosa dilarutkan dengan larutan TAE 1X hingga larut benar dan terlihat bening. Setelah agak dingin larutan agarosa dituang ke cetakan gel yang telah dipasangi sisir pencetak sumur. Larutan agarosa dibiarkan hingga mengeras dan menjadi gel kemudian gel beserta cetakannya diletakan dalam wadah elektroforesis yang telah diisi larutan TAE 1X sebagai buffer.
DNA yang akan dielektroforesis dicampur dengan loading dye buffer yang telah diberi pewarna dengan perbandingan 5:1 kemudian dipipet kedalam sumur gel. Alat elektoforesis ditutup dan dirangkaikan dengan sumber arus. Tegangan diatur sesuai keperluan (misal 50V atau 100V) lalu sumber arus dinyalakan, pergerakan sampel yang telah dicampur dengan loading dye buffer yang diberi perwarna dipantau hingga jarak migrasi tertentu kemudian sumber arus dimatikan. Gel agarosa kemudian diangkat dan direndam dalam larutan Etidium Bromida (EtBr) selama kurang lebih 15 menit. Gel kemudian dibilas dalam akuades lalu diamati dibawah sinar UV.
31
3. Ligasi hasil PCR DNA elusi dengan “pGEM®-T easy vector system I (Promega, 1999)
Hasil PCR DNA elusi kemudian diligasi dengan “pGEM®-T easy vector system I” dengan mengikuti prosedur yang disarankan oleh produsen kit ligasi (Promega). Jumlah vektor dan DNA insert (hasil PCR) yang digunakan diambil setengah dari prosedur yang ada dalam kit. Reaksi dilakukan dalam tabung mikrosentrifuga 0,2 ml dengan mencampurkan 1 µl “buffer” ligasi 10×, 5 ng/0,5 µl vektor “pGEM®-T easy”, T4 DNA ligase 1U dan DNA sisipan. Campuran reaksi tersebut digenapkan dengan air deion steril hingga 5 µl. Selanjutnya campuran tersebut diaduk secara perlahan dengan menggunakan batang pengaduk pipa kaca kapiler ujung tumpul kemudian campuran diinkubasi dengan alat PCR pada suhu 40C selama semalam. Jumlah DNA hasil PCR yang diperlukan dapat dihitung dengan rumus (sesuai dengan protokol pada kit):
panjang sisipan (kb) ukuran vektor (kb)
4. Transformasi ke dalam bakteri Escherichia coli strain dh5 alpha (Promega, 1990)
Transformasi plasmid ke dalam sel kompeten mengikuti prosedur dari produsen kit sel kompeten Escherichia coli strain dh5 alpha (Promega). Sebanyak 2 µl dari setiap hasil ligasi di atas dimasukkan secara hati-hati ke dalam tabung polipropilen 50 ml dingin dan ke dalam setiap tabung dimasukan bakteri yang telah kompeten sebanyak 50 µl. Sebagai kontrol 100 µl sel kompeten ditambah dengan 0,1 ng plasmid yang belum dipotong.
32
Tabung berisi bakteri kompeten dan plasmid selanjutnya disimpan dalam es selama 20 menit. Setelah itu tabung dimasukan ke dalam “waterbath” untuk di “heat-shock” atau diberi kejutan panas pada suhu 420C selama 50 detik. Selanjutnya tabung tersebut segera didinginkan dalam es selama 2 menit. Sebanyak 950 µl medium SOC cair (2% bacto tryptone; 0,5% yeast ekstrak; 1% [v/v] 1 M NaCl; 0,25% [v/v] 1 M KCl; 1% [v/v] 1 M MgCl2; 1% [v/v] 2 M
glukosa) ditambahkan ke dalam tabung kemudian suspensi sel diinkubasi pada suhu 370C pada 175 rpm selama 2 jam.
Pada tabung yang berisi kontrol dimasukan medium SOC sebanyak 900 µl. Setelah diinkubasi kultur sampel tranformasi lalu dituang sebanyak 100 µl untuk setiap cawan Petri yang berisi medium LB padat. Medium LB padat tersebut berisi 1% bacto tryptone; 0,5% bacto yeast ekstrak; 1% NaCl dan 1,5% bacto agar yang mengandung 100 µg/ml ampisilin dan telah dioleskan 20 µl X-gal (50 mg/ml) + 100 µl 0,1 M IPTG secara merata di atas permukaan medium LB padat dengan menggunakan batang pengaduk kaca berbentuk L. Sebanyak 100 µg/ml kultur control transformasi hasil pengenceran 1:10 dituang ke dalam cawan petri yang berisi medium LB padat seperti di atas.
Kultur bakteri diratakan di atas medium LB padat dengan bantuan bola-bola kaca steril berdiameter 3 mm. Kultur bakteri tersebut selanjutnya diinkubasi pada suhu 370C selama semalam (16-18 jam). Untuk menegaskan warna biru pada koloni, hasil inkubasi tersebut disimpan semalam pada suhu 40C.
33
1. Isolasi Plasmid (Xiang et al., 1998)
Koloni tunggal sel hasil transformasi yang berwarna putih dipilih secara acak. Masing-masing koloni dimasukkan dalam sebuah tabung reaksi yang berisi 4 ml medium TB cair (Terrific Broth; 1,2% bacto tryptone; 2,4% yeast ekstrak; 0,4% gliserol; 0,17 M KH2PO4; 0,72 M K2HPO4) yang mengandung 100 µg/ml
ampisilin. Tabung tersebut lalu diinkubasi semalam pada suhu 370C pada kecepatan 250 rpm.
Kultur sel selanjutnya dimasukan ke dalam tabung mikrosentrifuga sebanyak 1,5 ml dan disentrifugasi pada kecepatan 13.000 rpm selama 20 detik. Supernatan dibuang, kemudian endapan bakteri ditambah dengan 100 µl GTE (50 mM glukosa; 25 mM tris-HCl pH 8; 10 mM EDTA pH 8). Setelah itu endapan bakteri tersebut dihomogenkan dengan alat vorteks. Setelah homogen, suspensi bakteri tersebut ditambah “buffer” lisis sebanyak 200 µl (0,2 M NaOH; 1% SDS). Sebelum ditambah 150 µl 5 M potassium asetat, tabung terlebih dahulu dibolak-balik. Campuran dibolak-balik kembali agar homogen. Tabung lalu disentrifugasi pada kecepatan 13.000 rpm selama satu menit. Endapan yang diperoleh dibuang, lalu tabung sekali lagi disentrifugasi pada kecepatan yang sama.
Supernatan dipindah ke dalam tabung mikrosentrifuga 1,5 ml yang baru dan ditambah 2 kali volume 100% etanol dingin (-200C). Setelah itu tabung disentrifugasi pada kecepatan 13.000 rpm selama satu menit. Setelah supernatan dibuang, pelet dikeringkan dengan desikator vakum hingga kering. Pelet kering kemudian disuspensikan dalam 200 µl TE (10 mM Tris-Cl; 1 mM EDTA pH 8) yang mengandung 20 µg/ml RNAse dan disimpan pada suhu -200C. Sebanyak 1-2
34
µl sampel dianalisis di gel agarosa untuk melihat ada atau tidaknya plasmid. Sebelum plasmid rekombinan hasil isolasi disikuens, untuk meyakinkan bahwa potongan DNA yang disikuensing adalah sisipan yang diharapkan, sebanyak 1-2 µl plasmid dipotong dengan enzim EcoRI.
2. Sikuensing
Sikuensing dilakukan di Macrogen Seoul. Korea. Plasmid hasil isolasi berisi DNA sisipan dipilih secara acak untuk dianalisis urutan DNA sisipannya. Sikuensing DNA dilakukan satu arah dimulai dari daerah yang dikenal oleh primer T7 dengan menggunakan mesin otomatik sikuensing ABI 377A dan pewarnaan dengan menggunakan kit ABI PRISMTM Dye terminator (Perkin Elmer).
3. Merancang Primer
Primer yang mengapit lokus mikrosatelit dirancang dengan menggunakan program komputer Primer3.cgi v 0.2c (Rozen & Skaletsky, 1998). Analisis primer untuk melihat ada atau tidaknya “hairpin” dan “primer dimmer” dengan menggunakan program komputer Primer Premier4 (Biosoft international, 1996), dengan cara “online” pada situs http://frodo.wi.mit.edu/primer3/ akan terlihat pada Gambar 3.3. Beberapa syarat-syarat umum adalah: (1). primer panjamg minimal adalah 15 pasang basa nitrogen. (2). Memiliki Kandungan G/C minimal 50%. (3). Suhu “anealling” biasanya dalam kisaran 50-65 oC (4). Suhu ánealling yang lebih tinggi biasanya didapat target yang lebih spesifik. (5). Ujung 3’ harus G/C
35
Pick left primer, or use left primer below:
Pick hybridization probe (internal oligo), or use oligo below:
Pick right primer, or use right primer below (5' to 3' on opposite strand):
Pick Primers Reset Form
Sequence
Id: A string to identify your output.
Targets:
E.g. 50,2 requires primers to surround the 2 bases at positions 50 and 51. Or mark the source sequence with [ and ]: e.g.
...ATCT[CCCC]TCAT.. means that primers must flank the central CCCC.
Excluded Regions:
E.g. 401,7 68,3 forbids selection of primers in the 7 bases starting at 401 and the 3 bases at 68. Or mark the source sequence with < and >: e.g. ...ATCT<CCCC>TCAT.. forbids primers in the central CCCC.
Product Size Ranges 150-250 ¶100-300 301-400 401-500 501-600 601-700 701-850 851-1000
Number To Return 5 Max 3' Stability 9.0
Max Repeat Mispriming 12.00 Pair Max Repeat Mispriming 24.00
Max Template Mispriming 12.00Pair Max Template Mispriming 24.00
Pick Primers Reset Form Pick Primers Reset Form
Gambar 3.3. Tampilan program Primer3.cgi v 0.2c (Rozen & Skaletsky, 1998)
TCGATTCTCTTGCTTACGCGTGGACTAGACGCTGTGGCACCT GATAAAATTTCCTGCTGCTGCTGCTGCTGCTGCTGCTGCTGC TACTGTGGCCACTGAATTGGCAGCGTTTGCCGCTGCTGACAT CGTGTCT[GGTTGTTGTTGTTGTTGTTGTTGTTGTTGTT]GC TGCAGTTGCTGCTGTATTTGCAGCACTGGCTGATGTTAATGC TGATGCTGCTATGTGTGCTGCTTGGAGTGCTGCTGATGCTGG
36
Setelah dimasukan data-data berupa urutan basa nitrogen hasil dari sikuensing serta memberi target dari urutan basa nitrogen yang berulang akan terlihat tampilan pada Gambar 3.4.
OLIGO start len tm gc% any 3' seq LEFT PRIMER 23 20 60.48 60.00 5.00 1.00 GACTAGACGCTGTGGCACCT
RIGHT PRIMER 199 20 60.02 50.00 5.00 0.00 TCAGCCAGTGCTGCAAATAC
SEQUENCE SIZE: 397
INCLUDED REGION SIZE: 397
PRODUCT SIZE: 177, PAIR ANY COMPL: 4.00, PAIR 3' COMPL: 0.00 TARGETS (start, len)*: 134,31
1 TCGATTCTCTTGCTTACGCGTGGACTAGACGCTGTGGCACCTGATAAAATTTCCTGCTGC >>>>>>>>>>>>>>>>>>>> \ 61 TGCTGCTGCTGCTGCTGCTGCTGCTACTGTGGCCACTGAATTGGCAGCGTTTGCCGCTGC 121 TGACATCGTGTCTGGTTGTTGTTGTTGTTGTTGTTGTTGTTGTTGCTGCAGTTGCTGCTG ******************************* < 181 TATTTGCAGCACTGGCTGATGTTAATGCTGATGCTGCTATGTGTGCTGCTTGGAGTGCTG <<<<<<<<<<<<<<<<<<< 241 CTGATGCTGGTGACACTGTTGATGCTTGTTGTACTGCTGCTGCTGCTGCTGCTGCTGCTG 301 CTGCTTCAGATGCTTGATTTGCTGCATTTACTGCCAGTTCCACTGGTGCTGCACCGGCTG 361 CGACTAAAGTGGCAGTAGTCCACGCGTAAGCAAGAGA
KEYS (in order of precedence): ****** target
>>>>>> left primer <<<<<< right primer
Gambar 3.4. Tampilan primer hasil dari sikuen DNA dari elusi E1.1 dengan
program Primer3.cgi v 0.2c (Rozen & Skaletsky, 1998)

![Gambar 3.3. Tampilan program Primer3.cgi v 0.2c (Rozen & Skaletsky, 1998) TCGATTCTCTTGCTTACGCGTGGACTAGACGCTGTGGCACCTGATAAAATTTCCTGCTGCTGCTGCTGCTGCTGCTGCTGCTGCTACTGTGGCCACTGAATTGGCAGCGTTTGCCGCTGCTGACATCGTGTCT[GGTTGTTGTTGTTGTTGTTGTTGTTGTTGTT]GCTGCAGTTGC](https://thumb-ap.123doks.com/thumbv2/123dok/4310304.3158934/10.892.97.802.206.940/gambar-tampilan-program-primer-skaletsky-tcgattctcttgcttacgcgtggactagacgctgtggcacctgataaaatttcctgctgctgctgctgctgctgctgctgctgctactgtggccactgaattggcagcgtttgccgctgctgacatcgtgtct-ggttgttgttgttgttgttgttgttgttgtt-gctgcagttgc.webp)
